Вопросы ихтиологии, 2019, T. 59, № 6, стр. 681-692
Особенности раннего онтогенеза эндемичной озёрной формы Salvelinus malma сomplex (Salmonidae) − малоротого гольца Кроноцкого озера (Восточная Камчатка)
М. Ю. Пичугин *
Московский государственный университет
Москва, Россия
* E-mail: mp_icht@mail.ru
Поступила в редакцию 07.07.2018
После доработки 21.09.2018
Принята к публикации 12.10.2018
Аннотация
Исследованы рост, последовательность закладки и особенности транзитивных состояний элементов скелета (костей черепа и сериальных структур – зубов, жаберных тычинок, плавниковых лучей и птеригиофоров, тел позвонков, предорзалий, чешуй) у предличинок, личинок и мальков эндемичной озёрной формы северной мальмы Salvelinus malma сomplex оз. Кроноцкое – малоротого гольца, выращенных в лаборатории при постоянной температуре. Отмечена высокая индивидуальная изменчивость темпа роста и остеогенеза, профиля головы личинок малоротого гольца, демонстрирующая недавнее относительно других эндемичных кроноцких форм гольцов становление этого глубоководного озёрного морфотипа. Сравнительный анализ раннего развития симпатрических малоротого и белого гольцов Кроноцкого озера свидетельствует в пользу происхождения более тепловодного малоротого гольца от холодноводного белого.
Малоротый голец – одна из семи морфологически различных симпатрических форм северной мальмы Salvelinus malma сomplex, обитающих в Кроноцком озере (Сенчукова и др., 2012; Павлов и др., 2013; Маркевич и др., 2014, 2017а, 2017б; Салтыкова, 2016; Бусарова и др., 2017; Есин, Маркевич, 2017). Взрослые особи малоротого гольца по пропорциям тела и окраске весьма напоминают белого гольца Кроноцкого озера, но отличаются коротким рылом (заглазничное расстояние более чем вдвое превышает предглазничное), бóльшим диаметром глаза, небольшим конечным ртом с короткой верхнечелюстной костью. Длина по Смитту (FL) половозрелых особей составляет 168−330 мм, чаще не превышает 210 мм (Салтыкова, 2016; Есин, Маркевич, 2017; Маркевич и др., 2017б). В морфологии головы и тела прослеживаются педоморфные черты; у части особей, а в брачном наряде у всех производителей на боках тела хорошо видны овальные мальковые пятна (Есин, Маркевич, 2017). Малоротый голец является эврифагом со значительным преобладанием в питании бентосных организмов (хирономид, олигохет и моллюсков) и встречается только в озере на глубине 20–50 м, единично – до 100 м (Есин, Маркевич, 2017; Маркевич и др., 2017б).
На нерестилище малоротого гольца в 2014 г. впервые собрали живую икру и изучили рост, морфо- и остеогенез личинок при постоянной температуре. Первые результаты эксперимента показали, что личинки малоротого гольца хорошо отличаются от таковых длинноголового, белого и одной из форм носатых (N1) кроноцких гольцов по окраске и размерно-возрастным характеристикам (Pichugin, Markevich, 2015).
Цель настоящей работы − описать особенности роста и остеогенеза малоротого гольца в интервале онтогенеза от вылупления до окончания личиночного периода.
МАТЕРИАЛ И МЕТОДИКА
Половые продукты получили от нескольких текучих самцов и самок на озёрном нерестилище 08.11.2014 г. Икру осеменили “сухим” способом и транспортировали в Москву в течение 2 сут. в изотермическом контейнере с талым льдом. Инкубацию и подращивание молоди проводили при температуре 5−7 (6)°С. Икру и свободных эмбрионов после вылупления содержали в плавучих сетчатых садках в аквариумах объёмом 20 л с аэрацией, помещённых в холодильную установку. Еженедельно заменяли 1/4−1/3 объёма воды. Через 1 мес. после вылупления предличинок одного возраста пересадили в аквариумы объёмом 10 и 20 л с плотностью 2.5−3.0 экз/л. Молодь развивалась при естественном фотопериоде. Часть личинок подращивали в непрозрачном аэрируемом контейнере объёмом 10 л при низкой освещённости. Кормили живыми личинками хирономид. Подращивание с периодическим отбором проб продолжали в течение 2.5 лет. Температуру воды на нерестилище малоротого гольца в озере регистрировали 06.09.2014−26.09.2015 г. при помощи температурного самописца Star-oddi Starmon mini с точностью ±0.01°С.
Изготовление ализариновых препаратов и оценку степени дифференцировки костей черепа, осевого скелета и скелета плавников у молоди малоротого гольца проводили по ранее описанным методикам (Пичугин, 2009, 2015). В полученных размерных группах просчитали коэффициент вариации (CV) (Вуколов, 2004). Изучены рост 220 экз. и развитие скелета 123 экз., выращенных в эксперименте. Динамика развития некоторых элементов скелета в зависимости от возраста и длины тела (FL) представлена графически, кривые построены методом наименьших квадратов. Для сравнительного анализа использовали ализариновые препараты молоди белого гольца (Пичугин, Маркевич, 2018).
РЕЗУЛЬТАТЫ
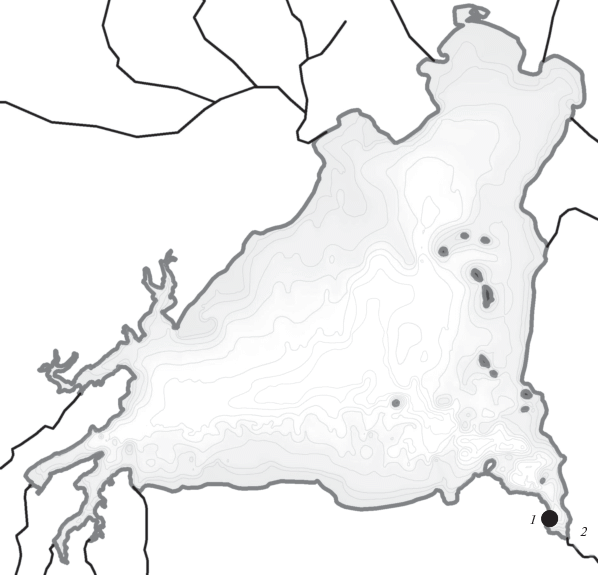
Особенности размножения. Нерест малоротого гольца в 2014 г. проходил с конца октября (массовый − со II декады ноября) до середины декабря на глубине 25–35 м примерно в 1 км от истока р. Кроноцкая (рис. 1) при придонной температуре ~4.5°С. Гнёзда производители не строили, так как дно на нерестилище составляют слабозаиленные каменные блоки, галечный или песчаный субстрат отсутствует (Маркевич и др., 2017б). В период нереста вследствие ветрового перемешивания среднемесячная температура на озёрном нерестилище (на глубине 35 м) снижалась с 4.58 в ноябре до 1.80°С в декабре, а после ледостава с января по апрель установилась гомотермия 2.43–2.48°С. В мае–октябре наблюдался постоянный постепенный рост температуры: V – 2.59, VI – 4.10, VII – 4.94, VIII – 5.93, IX – 6.31, X − 7.27°С.
Рис. 1.
Локализация в Кроноцком озере нерестилища малоротого гольца Salvelinus malma сomplex (1) в 1 км от истока р. Кроноцкая (2).
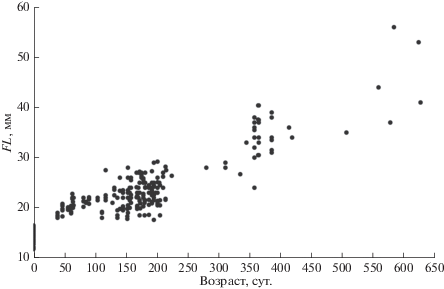
Развитие молоди. Диаметр оплодотворённой икры варьирует в пределах 4.1–5.3 (4.80) мм, её окраска бледно-жёлтая (Пичугин, Маркевич, 2015). Вылупление эмбрионов наблюдали с 21 января до 14 марта 2015 г. Оно начиналось с образования длинной экваториальной трещины в оболочке икринки и высвобождения хвоста. Значительная часть эмбрионов долго не могли самостоятельно высвободить голову из относительно прочной оболочки. Длина свободных эмбрионов после вылупления составила 11.8−16.5 (14.7) мм (Пичугин, Маркевич, 2015). В течение 35−40 сут. наблюдали соматический рост большей части малоподвижных свободных эмбрионов до FL 18−19 мм без закладки окрашиваемых ализарином костных зачатков. В возрасте 47 сут. предличинки достигли FL 19.5–20.8 мм, 64 сут. – 20.0–22.1 мм, 90 сут. – 20.8–22.8 мм (рис. 2). Начало экзогенного питания у особей раннего вылупления (21.01–05.02) отмечено в возрасте 62–65 сут., а у особей массового вылупления (06–14.03) – в возрасте 29−36 сут. Ускорение роста не наблюдали, и более 190 сут. сохранялся желток. Воздух в плавательном пузыре у всех особей появился через 2.0–2.5 мес. после начала питания, т.е. у особей раннего вылупления – в возрасте 4–5 мес., а у особей массового вылупления – в возрасте 3.0–3.5 мес. Последние не перешедшие к экзогенному питанию предличинки погибли при FL 18.0–19.2 мм в возрасте 111–115 сут.
Рис. 2.
Рост молоди малоротого гольца Salvelinus malma сomplex в условиях постоянной температуры 6°С.
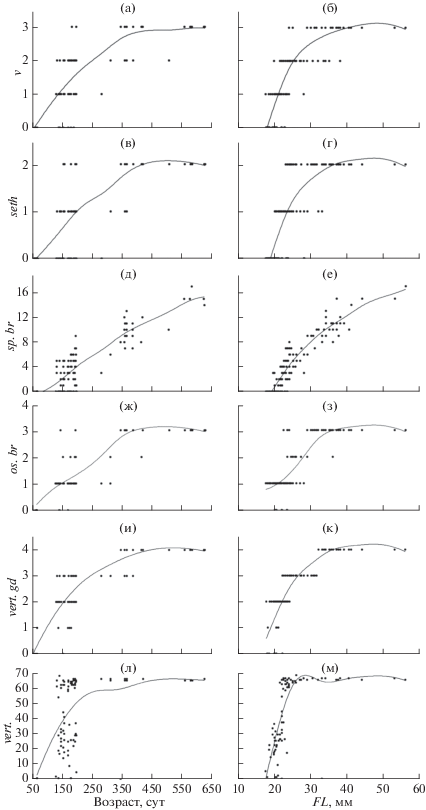
В течение 40–90 сут. предличинки по темпу роста и остеогенеза разделились на три группы. В одной продолжался соматический рост с очень медленным остеогенезом, во 2-й наблюдалась более интенсивная закладка элементов скелета с торможением соматического роста, а в 3-й, наиболее многочисленной, – самый медленный темп роста и остеогенеза. Результатом стало появление в пробах относительно крупных и мелких особей со слабым развитием костей и промежуточных по длине тела личинок на более продвинутых стадиях остеогенеза. Степень развития элементов скелета в зависимости от возраста и длины тела демонстрируют данные табл. 1, 2 и рис. 3. Так, в возрасте 195 сут. длина личинок варьировала в пределах 17.6−29.0 мм (CV 14%), они имели от одного до четырёх−пяти члеников в лучах плавников (CV 47−53%), от одного до трёх костных элементов в жаберных дугах (CV 56%), от нуля до девяти окостеневших жаберных тычинок на 1-й жаберной дужке (CV 63%), от отсутствия зачатка до сформированной костной пластинки супраэтмоида (CV 57%), praeoperculum (CV 36%), frontale (CV 34%), vomer (CV 46%), птеригиофоров спинного и анального плавников (CV 42%) (табл. 1, рис. 3а, 3в, 3д, 3ж). А в размерном диапазоне 18.0–19.0 мм у большей части особей (предполагаемых представителей 1-й и 3-й групп) отсутствовали лучи в анальном и брюшных плавниках, зачатки сошника, супраэтмоида, frontale и тел позвонков, птеригиофоры D и A, в то время как у находящихся на продвинутых стадиях остеогенеза особей 2-й группы имелись все перечисленные элементы, а также более дифференцированные parasphenoideum, dentale, anguloarticulare, praemaxillare, maxillare, operculum, interoperculum и suboperculum, единая пластинка glossohyale с тремя парами зубов и девять пар жаберных лучей, ceratobranchiale в нисходящей ветви жаберной дуги, до 29 тел позвонков, включая последний уростилярный (табл. 2). Широкая изменчивость уровня остеогенеза наблюдается во всех размерных диапазонах (табл. 2, рис. 3б, 3г, 3е, 3з, 3к, 3м). Так, закладка тел позвонков наблюдалась в возрастном интервале 67–210 сут. (рис. 3л) и в размерном интервале FL 17.8–27.0 мм (рис. 3м). Зачатки прободённых чешуй боковой линии впервые отмечены у относительно быстрорастущей особи FL 40.4 мм в возрасте 364 сут. В возрасте 386 сут. первый зачаток прободённой чешуи обнаружен у личинки FL 33.5 мм. У мальков возраста 2+ чешуя покрывала бока тела, но отсутствовала на брюхе и спине.
Таблица 1.
Оценки роста и транзитивных фенетических состояний элементов скелета у особей разного возраста малоротого гольца Salvelinus malma сomplex Кроноцкого озера (Восточная Камчатка) в экспериментальных условиях (6°С)
| Признак | Возраст, сут. после вылупления (число особей, экз.) | |||||||
|---|---|---|---|---|---|---|---|---|
| 61 (3) | 131 (3) | 170 (4) | 195 (8) | 358 (10) | 386 (6) | 570 (3) | 625 (2) | |
| FL, мм | 20.0−20.4 (20.1) | 22.5−24.0 (23.4) | 22.0−27.0 (24.0) | 17.6−29.0 (23.3) | 24.0−38.0 (32.7) | 31.0−39.0 (34.5) | 37.0−56.0 (45.7) | 41.0−53.0 (47.0) |
| P | 5−10 (8.3) | 7−11 (9.3) | 12−14 (13.0) | 12−14 (13.1) | 12−14 (13.3) | 13−15 (13.8) | 13−14 (13.3) | 13 |
| D | 0−11 (3.7) | 15−16 (15.3) | 15−17 (16.0) | 14−17 (15.0) | 13−17 (15.4) | 13−16 (14.8) | 16−18 (16.7) | 16 |
| A | 0−9 (3.0) | 9−12 (10.7) | 12−14 (13.0) | 7−14 (12.0) | 10−15 (13.6) | 13−14 (13.2) | 13 | 13 |
| V | 0−6 (0.3) | 8−9 (8.7) | 9 | 7−9 | 9 | 9 | 9 | 9 |
| Dn | 0−1 | 1−2 (1.3) | 1−3 (2.5) | 1−5 (2.6) | 2−4 (3.0) | 4−6 (4.8) | 5−8 (7.0) | 5−8 (6.5) |
| Pn | 1 | 1 | 2) | 1−4 (1.9) | 2−4 (2.6) | 3−4 (3.5) | 4−7 (5.7) | 5−7 |
| An | 0−1 (0.3) | 1 | 3−4 (3.5) | 1−5 (2.9) | 3−5 (4.0) | 4−6 (5.0) | 4−9 (7.0) | 5−8 |
| Vn | 0−1 (0.3) | 1 | 2−3 (2.3) | 1−4 (2.1) | 2−4 (2.8) | 3−5 (3.8) | 4−9 (6.7) | 4−8 (6.0) |
| Cn | 1 | 3−4 (3.3) | 5−6 (5.3) | 3−6 (4.5) | 3−7 (5.3) | 6−9 (7) | 7−12 (10.0) | 8−12 (10.0) |
| sp.br. | 0 | 3−5 (4.0) | 2−5 (3.5) | 0−9 (4.8) | 7−12 (9.9) | 7−11 (9.7) | 15−17 (15.7) | 14−15 (14.5) |
| os.br. | 0 | 1 | 1 | 1−3 (1.6) | 3 | 3 | 3 | 3 |
| r.br. | 6 | 9 | 10 | 7−12 (9.6) | 10−11 (10.3) | 11−13 (11.7) | 10−11 (10.7) | 10−13 (11.5) |
| mx | 7−9 (8.0) | 9−12 (11.0) | 11−12 (11.3) | 9−16 (12.9) | 6−12 (9.6) | 7−11 (8.5) | 10−15 (13.0) | 16 |
| pmx | 4−5 (4.3) | 9−10 (9.7) | 7−10 (8.8) | 6−9 (7.9) | 6−9 (6.8) | 6−8 (6.3) | 7−13 (9.0) | 11 |
| dent | 3 | 4 | 4−5 (4.5) | 4−5 (4.1) | 5−6 (5.3) | 5−6 (5.3) | 6 | 5−6 (5.5) |
| ang | 1 | 1 | 2−3 (2.3) | 2−4 (2.6) | 3−4 (3.6) | 3−4 (3.5) | 4 | 4 |
| op | 1 | 1 | 2 | 2 | 3 | 3 | 3 | 3 |
| pop | 0−1 (0.3) | 1 | 1−2 (1.3) | 1−2 (1.5) | 3 | 2−3 (2.8) | 3 | 3 |
| psph | 2 | 3 | 3−4 (3.3) | 2−5 (3.1) | 5 | 4−5 (4.3) | 5 | 5 |
| v | 0 | 2 | 1−2 (1.8) | 1−3 (1.6) | 2−3 (2.9) | 2−3 (2.5) | 3 | 3 |
| seth | 0 | 0−1 (0.7) | 1 | 0−2 (1.3) | 1−2 (1.8) | 2 | 2 | 2 |
| fr | 0 | 2 | 1−3 (2.0) | 1−3 (1.9) | 3−4 (3.5) | 3−4 (3.8) | 4 | 4 |
| gl | 0 | 5−8 (7.0) | 6−9 (7.5) | 3−9 (7.0) | 7−12 (9.1) | 7−10 (8.7) | 7−10 (8.7) | 7−10 (8.5) |
| vert.gd | 0 | 2−3 (2.3) | 2−3 (2.8) | 2−3 (2.5) | 3−4 (3.7) | 3−4 (3.7) | 4 | 4 |
| pred | 0 | 0 | 0 | 0 | 0−14 (7.3) | 9−15 (10.8) | 15−18 (16.7) | 16 |
| Dpt | 0 | 12−13 (12.7) | 9−12 (11.3) | 0−14 (10.5) | 11−13 (12.6) | 11−13 (12.0) | 13−14 (13.3) | 13 |
| Apt | 0 | 7−9 (8.0) | 7−10 (9.0) | 0−11 (8.6) | 9−11 (10.5) | 9−11 (10.0) | 10−12 (11.0) | 10 |
Примечание. Здесь и в табл. 2: за скобками – пределы варьирования показателя, в скобках – среднее значение. FL − длина по Смитту; P, D, V, A – число заложившихся лучей соответственно в грудных, спинном, брюшных, анальном плавниках; Dn, Pn, Vn, An – максимальное число члеников в одном луче плавника; Cn − максимальное число члеников в луче верхней лопасти хвостового плавника; sp.br. – число окостеневших жаберных тычинок; os.br. – число окостеневших элементов на 1-й жаберной дуге; r.br. – число пар жаберных лучей; mx, pmx – maxillare и praemaxillare (n + 1 – пластинка с n приросших зубов); dent – dentale (3 – есть приросшие зубы, 4 – замкнулись отверстия вдоль нижнего края кости, 5 – есть стенки гиомандибулярного канала боковой линии, 6 – канал замкнут в трубку); ang – anguloarticulare (1 – зачаток, 2 – есть нижний отросток, 3 – есть верхний отросток, 4 – есть канал сейсмосенсорной системы боковой линии, замкнутый в трубку); op – operculum (1 – треугольный зачаток с верхней выемкой, 2 – округлая форма с верхней выемкой, 3 – выемки нет); pop – praeoperculum (0 – здесь и далее отсутствие костной закладки; 1 – зачаток без отверстий, 2 – есть отверстия сейсмосенсорного канала боковой линии, 3 – есть парные стенки защиты канала); psph – parasphenoideum (1 – игловидный зачаток, 2 – есть тонкие боковые отростки, 3 – булавовидная форма боковых отростков, 4 – замкнулись задние отверстия, 5 – замкнулись передние отверстия); v – vomer (1 – парный зачаток, 2 – единая пластинка, 3 – головка и рукоятка кости разделены); th.v – число зачатков зубов на сошнике; seth – supraethmoideum (1 – есть головка кости, 2 – есть задний отросток); fr – frontale (1 – зачаток орбитального отдела, 2 – есть жёлоб сейсмосенсорного канала боковой линии с отверстиями, 3 – есть боковые выступы защиты канала, 4 – канал заключён в трубку); gl – glossohyale (1 – парная закладка, 2 – единая пластинка, >2 – n + 1 – пластинка с n приросших зубов); vert.gd – степень дифференцировки осевого скелета (1 – есть 1-й зачаток тела позвонка, 2 – есть закладки тел позвонков в передней части туловища, 3 – закладка всех тел позвонков, 4 – замыкание всех закладок тел позвонков в кольца); pred – predorsalia (общее число костей); Dpt и Apt – число окостеневших птеригиофоров спинного и анального плавников.
Таблица 2.
Оценки транзитивных фенетических состояний элементов скелета у особей разной длины (FL) малоротого гольца Salvelinus malma сomplex Кроноцкого озера (Восточная Камчатка) в экспериментальных условиях (6°С)
| Признак | FL, мм (число особей, экз.) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 18.0–19.0 (5) |
19.1–20.0 (16) |
20.1–21.0 (12) |
21.1–22.0 (16) |
22.1–23.0 (11) |
23.1–24.0 (15) |
24.1–25.0 (7) |
25.1–26.0 (3) |
33.0–34.1 (5) |
35.0–36.1 (4) |
|
| P | 10–13 (11.6) | 0–13 (9.2) | 6–13 (11.1) | 9–14 (12.6) | 11–14 (13.1) | 7–14 (11.8) | 13–14 (13.3) | 12–14 (13.3) | 13–14 (13.4) | 13–14 (13.8) |
| D | 13–15 (14.2) | 0–16 (8.7) | 9–15 (13.3) | 10–16 (14.3) | 14–17 (15.4) | 12–17 (15.1) | 15–17 (16.0) | 15–16 (15.3) | 15–16 (15.8) | 15–17 (15.8) |
| A | 0–12 (9.0) | 0–12 (6.1) | 9–12 (10.6) | 9–13 (11.9) | 11–13 (12.3) | 8–14 (11.9) | 12–13 (12.4) | 12–14 (13.0) | 13–15 (13.8) | 14–15 (14.5) |
| V | 0–8 (5.8) | 0–9 (4.6) | 5–8 (7.3) | 7–10 (8.6) | 8–9 (8.7) | 5–9 (8.5) | 9 | 9 | 9 | 9 |
| Dn | 1–3 (2.2) | 0–2 (1.1) | 1–3 (1.8) | 1–3 (2.4) | 1–3 (2.5) | 1–4 (2.3) | 1–3 (2.6) | 1–4 (2.7) | 2–6 (4.0) | 3 |
| Pn | 1 | 0–2 (1.0) | 1 | 1–2 (1.3) | 1–2 (1.5) | 1–2 (1.6) | 1–2 (1.9) | 1–2 (1.7) | 1–4 (2.6) | 2–4 (3.0) |
| An | 0–2 (1.6) | 0–3 (1.1) | 1–2 (1.8) | 1–3 (2.3) | 1–4 (2.6) | 1–4 (2.7) | 3–4 (3.3) | 1–4 (2.7) | 3–5 (4.4) | 3–5 (4.0) |
| Vn | 0–1 (0.8) | 0–2 (0.8) | 1–2 (1.3) | 1–2 (1.7) | 1–3 (1.7) | 1–3 (1.7) | 1–3 (2.4) | 1–3 (2.0) | 2–4 (3.4) | 2–4 (3.0) |
| Cn | 2–4 (3.2) | 1–4 (2.5) | 1–4 (3.2) | 2–5 (4.0) | 3–5 (4.3) | 2–5 (4.2) | 5 | 3–5 (4.3) | 4–7 (5.8) | 4–7 (5.5) |
| sp.br. | 0 | 0–3 (0.4) | 0–2 (0.3) | 0–4 (2.0) | 0–7 (3.7) | 0–8 (4.5) | 3–7 (5.3) | 4–6 (5.0) | 9–13 (11.0) | 8–11 (10.0) |
| os.br. | 0–1 (0.6) | 0–1 (0.6) | 0–1 (0.8) | 0–1 (0.9) | 1–3 (1.2) | 0–3 (1.4) | 1–2 (1.3) | 1–2 (1.7) | 3 | 2–3 (2.8) |
| r.br. | 5–9 (7.2) | 0–11 (6.4) | 6–10 (8.1) | 4–11 (9.3) | 8–10 (9.5) | 9–11 (9.9) | 10–11 (10.4) | 10 | 10–12 (11.2) | 10–11 (10.3) |
| mx | 6–11 (8.6) | 5–15 (9.4) | 7–13 (10.2) | 7–13 (10.9) | 6–15 (11.8) | 9–14 (11.3) | 8–15 (12.1) | 10–15 (12.0) | 6–11 (8.8) | 7–11 (9.0) |
| pmx | 4–7 (6.0) | 2–8 (5.3) | 5–10 (7.3) | 5–12 (7.6) | 7–10 (8.0) | 6–10 (7.5) | 6–9 (7.6) | 5–9 (7.3) | 6–9 (6.6) | 5–8 (6.8) |
| dent | 3–4 (3.4) | 3–4 (3.4) | 3–4 (3.8) | 3–5 (4.2) | 4–5 (4.4) | 3–5 (4.4) | 4–5 (4.4) | 5 | 5–6 (5.4) | 5–6 (5.5) |
| ang | 1–2 (1.4) | 1–2 (1.5) | 1–2 (1.6) | 1–3 (2.0) | 1–3 (1.9) | 1–4 (2.1) | 2–3 (2.7) | 2–3 (2.7) | 3–4 (3.6) | 3–4 (3.8) |
| pop | 1 | 0–1 (0.6) | 1–2 (1.1) | 0–2 (1.4) | 1–2 (1.5) | 0–3 (1.7) | 2 | 2 | 3 | 2–3 (2.8) |
| psph | 1–3 (2.0) | 2–3 (2.4) | 1–3 (2.3) | 1–3 (2.9) | 3 | 2–5 (3.4) | 3–4 (3.1) | 3–4 (3.7) | 4–5 (4.8) | 5 |
| v | 0–1 (0.4) | 0–2 (0.4) | 0–1 (0.6) | 0–2 (1.3) | 0–2 (1.5) | 1–3 (1.8) | 2–3 (2.1) | 2 | 2–3 (2.6) | 3 |
| th.v | 0 | 0 | 0 | 0–1 (0.1) | 0–2 (0.4) | 0–1 (0.3) | 0–2 (0.3) | 0–2 (0.7) | 0–2 (0.8)– | 0–1 (0.3) |
| seth | 0 | 0–1 (0.1) | 0–1 (0.3) | 0–1 (0.8) | 1–2 (1.1) | 0–2 (0.9) | 1–2 (1.4) | 1–2 (1.7) | 2 | 2 |
| fr | 0–1 (0.6) | 0–2 (0.8) | 0–2 (1.0) | 0–3 (1.6) | 1–3 (2.2) | 1–3 (2.1) | 2–3 (2.3) | 3 | 4 | 3–4 (3.8) |
| gl | 3–8 (6.0) | 0–7 (3.6) | 0–8 (5.8) | 1–9 (6.6) | 7–11 (7.9) | 5–15 (8.5) | 5–10 (7.7) | 8–11 (9.3) | 8–9 (8.8) | 8–9 (8.8) |
| vert.gd | 0–2 (1.2) | 0–2 (1.0) | 0–2 (1.5) | 0–3 (1.9) | 2–3 (2.5) | 2–3 (2.4) | 3 | 3 | 4 | 4 |
| pred | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 9–14 (10.8) | 9–14 (11.5) |
| Dpt | 0–10 (5.4) | 0–12 (3.9) | 0–12 (7.7) | 0–12 (10.4) | 9–13 (11.9) | 0–13 (11.0) | 12–14 (12.4) | 9–12 (11.0) | 12–13 (12.6) | 12–13 (12.8) |
| Apt | 0–6 (2.8) | 0–7 (2.8) | 0–9 (4.2) | 0–10 (7.9) | 0–11 (8.7) | 0–11 (8.9) | 10 | 7–10 (9.0) | 10–11 (10.6) | 10–11 (10.8) |
Рис. 3.
Закладка и развитие элементов скелета у малоротого гольца Salvelinus malma сomplex в зависимости от возраста и длины (FL): а, б – vomer (v); в, г –supraethmoideum (seth); д, е – число окостеневших жаберных тычинок на 1-й жаберной дуге слева (sp.br.); ж, з – число окостенений в 1-й жаберной дуге (os.br.); и, к – степень дифференцировки осевого скелета (vert.gd); л, м – число заложившихся тел позвонков (vert.).
Высокая смертность личинок отмечена в возрасте 120−210 сут., в период активного остеогенеза, в частности, из-за аномалий в развитии элементов скелета. Наибольшее число выявленных аномалий приходится на недоразвитие отдельных лучей спинного и анального плавников и/или срастание зачатков лучей хвостового плавника. У части особей отметили нерасхождение зачатков жаберных лучей, подобное выявленному ранее у озёрных гольцов S. alpinus complex оз. Даватчан (Забайкалье) (Пичугин, 2009).
Постоянно наблюдали отмеченную ранее (Пичугин, Маркевич, 2015) высокую агрессивность быстро растущих особей по отношению к отстающим в росте и каннибализм – пожирание мягких тканей у погибших.
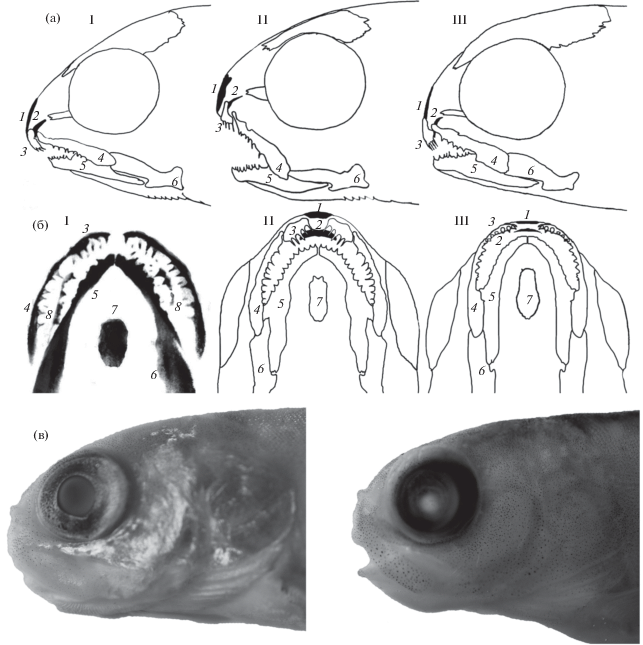
Профиль головы и развитие этмоидного отдела черепа (рис. 4). При достижении личинками FL 20 мм в остеогенезе головы выявлена гетерохрония: замедленные относительно роста крыши хрящевого черепа рост и развитие висцерального скелета (зачаток glossohyale отсутствует в возрасте >2 мес.) и дна хрящевого черепа с малым приращением вдоль оси парасфеноида, особенно в нижней части этмоидного отдела, и по этой причине в разной степени выраженное закругление и укорочение рыла (рис. 4а, 4в). В результате место закладки супраэтмоида смещено вперёд и вниз, головка кости закладывается вертикально, у части особей даже загибается в сторону пасти, накрывая рыло спереди. Предчелюстные кости также смещены вниз, озубленная пластинка этих костей изогнута внутрь пасти (рис. 4б, II), реже направлена вертикально (рис. 4б, III). Нижняя челюсть короткая и не смыкается с верхней даже у особей FL > 34 мм (рис. 4б). Сошник закладывается у части особей при FL 20−21 мм, но его дифференцировка замедлена, часто он сохраняется в виде парной закладки или изогнутой сердцевидной пластинки до достижения FL 32−35 мм, рукоятка кости не формируется. Функции сошника по удержанию пищи в пасти оказываются ограничены, так как он прикрыт расположенными в два ряда зубами предчелюстных костей (рис. 4а, I−III). Очевидно, поэтому у большинства просмотренных личинок зубы на сошнике не заложились либо (у наиболее крупных) имеются один–три слабых зачатка. Профиль головы личинок значительно варьирует (рис. 4а). В результате такой согласованной трансформации морфогенеза у мальков (рис. 4в) сохраняется своеобразное короткое закруглённое рыло и нижнее положение рта. Процесс выравнивания длины челюстей за счёт координированного гетерохронного ускорения роста dentale и anguloarticulare, в результате которого формируется характерный для взрослых рыб профиль (Есин, Маркевич, 2017), происходит, по-видимому, после достижения мальками FL 70–100 мм.
Рис. 4.
Профили головы личинок и мальков и расположение зачатков костей черепа личинок малоротого гольца Salvelinus malma сomplex: а − варианты (I–III) профиля головы у личинок FL 34 мм; б – то же, вентродорсальная проекция (I – FL 20 мм, возраст 140 сут.; II–III – FL 34 мм, 386 сут.); в – профили головы мальков. 1 – супраэтмоид, 2 – vomer, 3 – praemaxillare, 4 – maxillare, 5 – dentale, 6 – anguloarticulare, 7 – glossohyale, 8 – palatinum.
Окраска. Пигментация предличинок меланином начинается примерно через 1 мес. после вылупления. Зёрна меланина покрывают тело и голову, заходят на спинной плавник, особенно вдоль его первых лучей, и концентрируются в основании лучей хвостового плавника. К возрасту 2 мес. после вылупления на боках тела предличинок формируются 6–7 овальных пятен, а желточный мешок с боков и снизу становится серебристым (рис. 5а) (Пичугин, Маркевич, 2015). С ростом личинок число округлых пятен parr, тёмных, почти чёрных, увеличивается до 8–9 (рис. 5б–5г), такое их число сохраняется до взрослого состояния. К возрасту 330–350 сут. пятна на боках тела светлеют и становятся менее контрастными, они сохраняются и в мальковый период. Особи, выросшие при низкой освещённости, приобрели серебристую окраску (рис. 5д). Однако при пересадке в условия естественной освещённости бледно-пятнистая окраска восстанавливалась в течение 1.5−2.0 мес. Окраска мелких тугорослых (рис. 5е) и крупных мальков (рис. 5ж) различалась по интенсивности пигментации.
Рис. 5.
Окраска личинок и мальков малоротого гольца Salvelinus malma сomplex, выращенных в экспериментальных условиях: а – возраст 59 сут., FL 20.6 мм; б – 90 сут., FL 22.0 мм; в, г – 165 сут. (в − FL 25.4 мм, мелкая личинка; г − FL 30.8 мм, крупная личинка); д – 365 сут., FL 37.5 мм, низкая освещённость; е, ж – 2+ (е − FL 67 мм, тугорослый малёк; ж − FL 78 мм, крупный малёк).

Сравнительный анализ развития выращенной в одинаковых условиях молоди малоротого и белого гольцов Кроноцкого озера. Личинки малоротого гольца сходны с таковыми белого гольца (Пичугин, Маркевич, 2018) по низкому темпу роста и поздней кальцификации костей скелета, относительно ранней закладке супраэтмоида и тел позвонков. Малоротые гольцы отличаются от белых меньшими диаметром икры (4.1–5.3 (4.80) против 5.3–6.0 (5.64) мм) и длиной свободных эмбрионов (11.8–16.5 (14.7) против 18.2–20.3 (19.57) мм), окраской личинок (5–7 против 10–13 овальных чёрных пятен на боках тела и хвостовом стебле), поздним появлением воздуха в плавательном пузыре и поздней закладкой glossohyale, frontale, praeoperculum и жаберных тычинок, но ранней закладкой чешуй, которые формируются при меньшей длине (табл. 4 ). В черепе белого гольца не выявлены задержки развития нижней челюсти и укорочение рыла, описанные у малоротого гольца.
Таблица 3.
Возраст и длина (FL) выращенных при одинаковых условиях особей малоротого и белого гольцов Salvelinus malma complex Кроноцкого озера при наступлении сходных онтогенетических стадий и закладке некоторых окостенений
| Стадия | Малоротый голец, (мои данные) | Белый голец (Пичугин, Маркевич, 2018) | ||
|---|---|---|---|---|
| Возраст, сут. | FL, мм | Возраст, сут. | FL, мм | |
| Вылупление | 0 | 11.8−16.5 | 0 | 18.2−20.3 |
| Появление воздуха в плавательном пузыре | 90−105* 120−155 | 20.0−21.0* 19.0−21.0 |
62−64* 80−90 |
25.0−26.0* 24.0−25.0 |
| Начало этапа смешанного питания | 62–65 | 20.2−22.3 | 62−64* 80−90 |
25.0−26.0* 24.0−25.0 |
| Закладка: | ||||
| – первых жаберных тычинок | 131−145 | 20.0−22.0 | 121 | 24.5−25.0 |
| – всех тел позвонков | 140−153* 187−192 |
23.5−26.0* 23.0−24.0 |
206* 360 |
29.5* 28.0–31.0 |
| – сошника | 128−131 | 21.0−24.0 | 121 | 24.5−25.0 |
| – супраэтмоида | 131* 140−145 |
20.3−26.0* | 206* | 29.5* |
| – чешуи | 364* 386 |
40.4* 33.5 |
490* | 46.0−47.0* |
ОБСУЖДЕНИЕ
Малоротый голец Кроноцкого озера – карликовая форма северной мальмы с редкой для данного вида при наличии разнообразных потенциальных речных и ручьевых нерестилищ специализацией к озёрному глубоководному нересту (Пичугин, 2012). Отличие данного озёрного нерестилища от типичных для северной мальмы в иной температурной динамике с относительно высокой и стабильной температурой в период протекания эмбриогенеза (Пичугин, 2015). По-видимому, именно высокая температура привела к смещению сроков нереста малоротого гольца с сентября, как у всех форм кроноцких гольцов с речным нерестом (Есин, Маркевич, 2017), на ноябрь. К особенностям эмбрионального развития данной формы можно отнести высокую вариабельность скорости органогенеза и, как следствие, растянутые почти на 2 мес. сроки вылупления. В процессе специализации малоротого гольца к озёрному развитию происходило уменьшение диаметра икринок и утолщение и упрочнение оболочки яиц. Последнее привело к усложнению вылупления и повышенной смертности эмбрионов. По-видимому, такие преобразования обусловлены переходом от закрытых речных кладок икры к открытым озёрным и защите от выедания бокоплавами Gammarus lacustris (Gammaridae). Можно предположить, что более прочные оболочки икринок устойчивее к внешним повреждениям, а выход эмбрионов обеспечивается более интенсивной работой желёз вылупления. Растянутый срок перехода на этап смешанного питания обусловлен разной степенью морфологической сформированности свободных эмбрионов при вылуплении. Вылупившиеся позже эмбрионы более сформированы и быстрее переходят к этапу смешанного питания. Изменчивость морфологического состояния свободных эмбрионов, разная скорость остеогенеза и частные гетерохронии закладок и дифференцировок отдельных костей, отражаемые высокими значениями коэффициента вариации, демонстрируют продолжающийся поиск “своей” траектории развития. Высокие значения CV были выявлены при описании степени дифференцировки отдельных костей скелета диких личинок проходной формы северной мальмы, выросших при разных температурных режимах, обусловленных растянутым на 4 мес. (конец августа−начало января) нерестовым сезоном, и объяснялись регулируемыми гетерохрониями по Матвееву (1968) (Пичугин, 2015). Однако личинки малоротого гольца на нативном нерестилище развиваются в очень стабильном температурном режиме, исключающем подобные регулируемые гетерохронии.
К морфологическим особенностям малоротого гольца относится укорочение передней части головы, которое, судя по результатам данного анализа, происходит в два этапа. Вначале согласованно замедляются рост и развитие висцерального скелета и элементов дна черепа, а закладки супраэтмоида и предчелюстных костей смещаются вниз. Позднее, в мальковый период, происходит небольшое ускорение роста нижней челюсти и выравнивание длины челюстей. Сходным образом, по-видимому, проходит личиночное развитие симпатрических с малоротым гольцом трёх форм носатых гольцов, однако без последующего у N2 и N3 выравнивания длины челюстей. Форма головы взрослых носатых гольцов в вентродорсальной проекции (Есин, Маркевич, 2017. Рис. 22 ) весьма сходна с вариантами формы головы личинок малоротых гольцов (рис. 4б, II−III). Очевидно, микроэволюционные преобразования морфогенеза малоротого и носатых гольцов происходили по сходной параллельной траектории. Эмбрионально-личиночный период развития малоротого гольца по поздней кальцификации элементов скелета весьма сходен с таковым белого гольца Кроноцкого озера (Пичугин, Маркевич, 2018), которая, по предположению авторов, стала следствием крайне низкой температуры на нерестилище в р. Узон и часто встречается у форм гольцов Salvelinus при сходных условиях (Balon, 1980). Весьма вероятно, что малоротый голец образован из группировки наиболее тугорослых белых гольцов, которые не смогли накопить энергетических запасов для анадромной миграции в быстрые воды горных притоков и перешли к озёрному нересту, а смещение нерестилища малоротых гольцов на глубину предотвратило тотальное выедание икры многочисленной молодью гольцов, скатывающихся на литораль из притоков озера. Примечательно, что значительно более тёплый температурный режим озёрного нерестилища не привёл к ускорению роста и остеогенеза, т.е. тугорослость приобрела наследственную природу. Высокая изменчивость морфотипа личинок малоротого гольца, прежде всего по форме головы, отражает поиск новой адаптивной нормы (Медников, 1987), а пóзднее появление воздуха в плавательном пузыре, по-видимому, объясняется необходимостью предварительной закладки осевого скелета для подъёма к поверхности для заглатывания воздуха. Не исключено, что проявление такой широкой изменчивости профиля головы молоди малоротых гольцов объясняется отличными от нативных условиями выращивания в эксперименте. Однако высокая изменчивость формы головы отмечена и у взрослых диких особей (Маркевич и др., 2017б). Можно предположить, что в условиях Кроноцкого озера с высокой конкуренцией специализирующихся форм северной мальмы за пищевые ресурсы особи, имеющие отличный от оптимального взрослого морфотип, хуже приспособлены и элиминируются.
Исследователи, впервые описавшие малоротого гольца, констатировали, что первичная дивергенция озёрных и озёрно-речных форм Кроноцкого озера произошла по ресурсным осям пелагиаль–бенталь с дальнейшим разделением озёрных форм (большеротого и малоротого гольцов) в тех же ресурсных осях пелагиаль–бенталь (гиполимнион–профундаль) (Есин, Маркевич, 2017). Однако, признавая универсальность симпатрической дивергенции у гольцов Salvelinus именно по питанию (Adams et al., 2003), эта констатация не объясняет механизм трансформации онтогенеза северной мальмы в эту форму. По моему мнению, наличие наследственно закреплённых элементов холодноводного развития и поздняя закладка чешуи у малоротого гольца убедительно свидетельствуют в пользу происхождения его не от генерализованной северной мальмы, а от её специализированной производной формы – белого гольца Кроноцкого озера.
БЛАГОДАРНОСТИ
Автор признателен Г.Н. Маркевичу, Е.В. Есину (Кроноцкий государственный биосферный заповедник) и Л.А. Анисимовой (ВНИРО) за сбор и доставку в МГУ живой икры малоротого гольца, предоставление данных температуры на нерестилище и сведений о нересте; Т.И. Шпиленку и Д.М. Паничевой (Кроноцкий государственный биосферный заповедник) – за техническую поддержку при организации работ на территории Кроноцкого заповедника; А.Н. Строганову (МГУ) – за предоставленное холодильное оборудование; С.С. Алексееву (ИБР РАН) – за обсуждение рукописи.
Список литературы
Бусарова О.Ю., Маркевич Г.Н., Кнудсен Р., Есин Е.В. 2017. Трофическая дифференциация носатого гольца Salvelinus schmidti Viktorovsky, 1978 озера Кроноцкое (Камчатка) // Биология моря. Т. 43. № 1. С. 47−53.
Вуколов Э.А. 2004. Основы статистического анализа. М.: Форум, 464 с.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus азиатской части северной Пацифики: происхождение, эволюция, современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Маркевич Г.Н., Анисимова Л.А., Салтыкова Е.А и др., 2014. Разнообразие и особенности биологии эндемичных форм гольца Salvelinus malma из бассейна оз. Кроноцкое // Матер. XV Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 325–330.
Маркевич Г.Н., Есин Е.В., Бусарова О.Ю. и др. 2017а. Разнообразие носатых гольцов Salvelinus malma (Salmonidae) Кроноцкого озера (Камчатка) // Вопр. ихтиологии. Т. 57. № 5. С. 521−533. https://doi.org/10.7868/S0042875217050125
Маркевич Г.Н., Есин Е.В., Салтыкова Е.А. и др. 2017б. Новые эндемичные формы глубоководных гольцов рода Salvelinus (Salmoniformes: Salmonidae) озера Кроноцкое (Камчатка) // Биология моря. Т. 43. № 3. С. 188−194.
Матвеев Б.С. 1968. Сравнительный метод исследования и его значение в изучении причин изменения темпов развития в эволюции онтогенезов // Темп индивидуального развития животных и его изменения в ходе эволюции. М.: Наука. С. 22−37.
Медников Б.М. 1987. Проблема видообразования и адаптивные нормы // Журн. общ. биологии. Т. 48. № 1. С. 15−26.
Павлов С.Д., Кузищин К.В., Груздева М.А. и др. 2013. Фенетическое разнообразие и пространственная структура гольцов (Salvelinus) озерно-речной системы Кроноцкая (восточная Камчатка) // Вопр. ихтиологии. Т. 53. № 6. С. 645−670.
Пичугин М.Ю. 2009. Развитие элементов скелета в эмбрионально-личиночный период у карликовой и мелкой симпатрических форм Salvelinus alpinus complex из оз. Даватчан (Забайкалье) // Там же. Т. 49. № 6. С. 763−780.
Пичугин М.Ю. 2012. Особенности развития скелета у личинок Salvelinus malma complex с речных и озёрного нерестилищ озера Кроноцкое (восточная Камчатка) // Матер. XIII Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 272−275.
Пичугин М.Ю. 2015. Особенности роста и развития скелета ранней молоди северной мальмы Salvelinus malma malma из рек западной Камчатки в связи с температурным режимом нерестилищ // Вопр. ихтиологии. Т. 55. № 4. С. 435–452.
Пичугин М.Ю., Маркевич Г.Н. 2015. Исследование ранних стадий онтогенеза симпатрических форм гольцов Salvelinus Кроноцкого озера, выращенных в эксперименте // Матер. XVI Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 328−331.
Пичугин М.Ю., Маркевич Г.Н. 2018. Особенности раннего онтогенеза белого гольца Salvelinus malma complex (Salmonidae) Кроноцкого озера (восточная Камчатка) // Вопр. ихтиологии. Т. 58. № 5. С. 589–598.
Салтыкова Е.А. 2016. Морфологическое разнообразие и дивергенция гольцов рода Salvelinus озера Кроноцкое (Восточная Камчатка): Автореф. дис. … канд. биол. наук. М.: МГУ, 25 с.
Сенчукова А.Л., Павлов С.Д., Мельникова М.Н., Мюге Н.С. 2012. Генетическая дифференциация гольцов (род Salvelinus) из озера Кроноцкое на основе анализа митохондриальной ДНК // Вопр. ихтиологии. Т. 52. № 4. С. 489−499.
Adams C.E., Woltering C., Alexander G. 2003. Epigenetic regulation of trophic morphology through feeding behaviour in Arctic charr, Salvelinus alpinus // Biol. J. Lin. Soc. V. 78. № 1. P. 43−49.
Balon E.K. 1980. Comparative ontogeny of charrs // Charrs: salmonid fishes of the genus Salvelinus. Perspectives in vertebrate science 1. The Hague: Dr. W. Junk Publ. P. 703−720.
Pichugin M.Yu., Markevich G.N. 2015. Some features of morphology diversification of Dolly Varden morphs from Lake Kronotskoe in early development // Book Abstr. 8-th Int. Charr symp. P. 113.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


