Вопросы ихтиологии, 2019, T. 59, № 6, стр. 733-736
Симпатрическая диверсификация камчатской мальмы Salvelinus malma (Salmonidae) в экосистеме предельно малого размера
Е. В. Есин 1, 2, *, Н. О. Мельник 1, Д. В. Зленко 3, Ф. Н. Шкиль 1, Г. Н. Маркевич 2
1 Институт проблем экологии и эволюции РАН − ИПЭЭ
Москва, Россия
2 Кроноцкий государственный природный биосферный заповедник
Камчатский край, г. Елизово, Россия
3 Московский государственный университет
Москва, Россия
* E-mail: esinevgeniy@ya.ru
Поступила в редакцию 29.01.2019
После доработки 12.03.2019
Принята к публикации 14.03.2019
Аннотация
Впервые для северо-востока Азии в изолированном водоёме площадью 0.23 км2 обнаружена планктоядная форма Salvelinus malma с зимним озёрным нерестом. Эта форма обитает совместно с мальмой-бентофагом, размножающейся осенью в притоке. С учётом размера водоёма и отсутствия других видов рыб данный пример экологической диверсификации можно признать самым простым из известных в мире. Представлены данные по скорости роста, морфологии и питанию двух симпатрических форм.
Гольцы рода Salvelinus известны своей эволюционной пластичностью и способностью образовывать репродуктивно изолированные симпатрические формы в озёрах разного размера. За исключением небольшого числа сложных “пучков” гольцы разделяются по универсальному механизму на две формы, осваивающие ресурсы пелагиали и бентали или мелководья и глубоководной зоны (Jonsson, Jonsson, 2001; Klemetsen, 2010). Диверсификацию в экосистемах холодноводных северных озёр провоцирует устойчивая годовая динамика параметров среды (Smith, Skúlason, 1996; McPhee et al., 2012; Boughman, Svanbäck, 2017). Можно предположить, что стабильные градиенты экологических факторов и разнообразие потенциально пригодных для освоения ниш возникают лишь в экосистемах определённого объёма. На данный момент самые маленькие из известных систем с репродуктивно изолированными симпатрическими формами гольцов имеют объём ~0.01 км3. Пелагические и демерсальные гольцы с контрастной адаптивной морфологией описаны из исландского оз. Галтабол площадью 1.2 км2 и глубиной до 10 м (Bolnick, Fitzpatrick, 2007). Не на много больше ряд других исландских и забайкальских озёр с генетически обособленными парами форм гольцов (Wilson et al., 2004; Gordeeva et al., 2015).
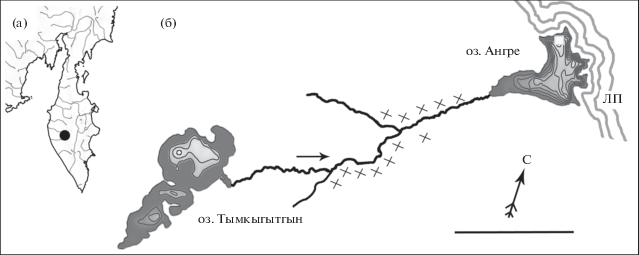
В 2016 г. мы обнаружили пару симпатрических форм мальмы S. malma в изолированной водной системе объёмом в три раза меньше оз. Галтабол − в оз. Ангре (Камчатка, подножье вулкана Ича, 55°31′ с.ш., 157°41′ в.д.) площадью 0.23 км2 (рис. 1а). Озеро запружено лавовым потоком, вытекшим из конуса Северный Черпук 6.5 тыс. лет назад (Певзнер, 2015). Вода из озера фильтруется через лавовую плотину. В водоём впадает постоянный ручей, который берёт начало из мелководного (средняя глубина 3 м) ледникового оз. Тымкыгытгын. Кроме мальмы других видов рыб в экосистеме нет.
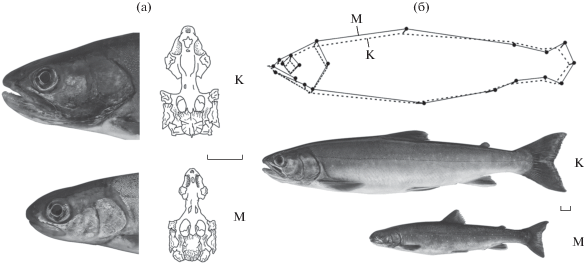
Рис. 1.
Бассейн оз. Ангре: а − положение на п-ове Камчатка (⚫); б − схема водной системы, изобаты на схемах озёр проведены через 3 м; (→) – направление течения в ручье, (×) − места нереста крупной формы мальмы Salvelinus malma в ручье, (◻) – нерестилище мелкой формы в озере, ЛП − лавовая плотина. Масштаб: 1 км.
МАТЕРИАЛ И МЕТОДИКА
В 2018 г. начат годовой цикл гидробиологических работ, включающий ежемесячные обловы озера и притока. В период работ с июля по февраль было поймано 430 взрослых рыб и 200 экз. молоди. У всех гольцов определили длину по Смитту (FL), массу, качественное содержимое желудка, пол и стадию зрелости. Для 135 экз. определён возраст по структуре отолитов (сагитта). У 140 рыб, отловленных в июле, оценили соотношение компонентов пищи по массе и интенсивность заражения паразитами. Анализ изменчивости формы тела выполнили по цифровым изображениям тела, полученным стандартным методом (Markevich et al., 2018) для 62 самок с гонадами IV стадии зрелости, в программе MorphoJ v1.06. Для визуализации различий между анализируемыми группами использовали опцию канонического анализа, сгенерировав функцию изменения формы в Прокрустовом пространстве (Zelditch et al., 2004). У этих же самок оценили пропорции черепа и посчитали число жаберных тычинок на 1-й левой дужке.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Озеро Ангре (рис. 1б) − димиктическое; осеннее перемешивание произошло в конце сентября, ледовый покров сформировался в октябре. Озеро отличается значительными перепадами уровня: в июне в момент максимального наполнения глубина достигает 27 (в среднем 12) м; к февралю за счёт фильтрации через лавовую плотину глубина упала на 3 м, озеро потеряло до 1/4 объёма. Средняя биомасса Cyclops scutifer и Daphnia longispina (95% планктонных ракообразных) в июле составила 0.2 г/м3, что является средним для камчатских озёр показателем (Куренков, 2005). Падение уровня способствовало значительной концентрации рачков, в сентябре их биомасса увеличилась до 5.5 г/м3.
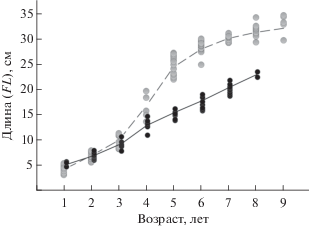
В озёрных уловах созревающие гольцы (IV стадия зрелости гонад) разделяются на две неперекрывающиеся размерные группы: крупные особи FL 25−35 (в среднем 29.5) см массой 140−342 (222.2) г в возрасте 5−9 (6.5) лет; мелкие − соответственно 13−22 (16.6) см, 18−124 (46.6) г, 4−8 (5.8) лет. По темпу роста группы достоверно различаются (t-тест: р < 0.05) начиная с возраста 4 года (рис. 2). По-видимому, ускорение роста крупных рыб происходило на 4−5-й год жизни после ската из притока в озеро. В уловах донных сетей доля крупных рыб составляла 90%, в пелагических сетях – 60%. Относительная численность, а также размеры крупных самцов и самок были близки, в то время как среди мелких рыб численно доминировали самки, которые в среднем крупнее и старше самцов.
Рис. 2.
Темп линейного роста мелкой (⚫) и крупной ( ) форм мальмы Salvelinus malma из бассейна оз. Ангре. Рыбы первых трёх возрастных групп взяты с озёрного мелководья
(⚫) и из ручья (
) форм мальмы Salvelinus malma из бассейна оз. Ангре. Рыбы первых трёх возрастных групп взяты с озёрного мелководья
(⚫) и из ручья ( ).
).
Между двумя размерными группами гольцов выявлены морфологические и анатомические различия. Голова крупных рыб коническая, диаметр глаза в среднем составляет 21.1% длины головы (с); у мелких рыб голова скруглённая, средний диаметр глаза 26.3% с (рис. 3а). Характерная особенность мелких рыб – укороченное рыло с горбинкой (21.4 против 22.5% с у крупных). Этмоидный отдел хрящевого черепа мелких рыб скошен вниз, его длина составляет 34−40 (37.1)% длины хондрокрания; супраэтмоидная кость с широкой головкой и узкой задней частью. У крупных рыб профиль черепа прямой, этмоидная часть составляет 38−48 (43.4)% длины хондрокрания; задняя часть супраэтмоида шире головки. По форме тела созревающие самки двух групп в наибольшей степени различаются (прокрустовая ANOVA: F28.72 = 3.95, p = 0.0310) шириной основания хвостового плавника и диаметром глаза, а также высотой передней части тела (рис. 3б). Две группы также достоверно различаются (U-тест: р = 0.001) по числу жаберных тычинок: у крупных рыб их 19−24 (21.1), у мелких – 19−25 (22.5).
Рис. 3.
Особенности морфологии мелкой (М) и крупной (К) форм мальмы Salvelinus malma из бассейна оз. Ангре: а − головы и хондрокрании половозрелых особей; б − соотношение консенсусной формы тела половозрелых самок по положению 21 метки в Прокрустовом пространстве (длина векторов отклонения меток пропорциальна статистической значимости нагрузок на метки) и самки двух форм. Масштаб: 1 см.
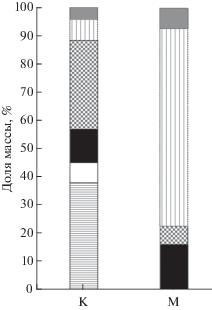
Пищевая специализация двух морф не строгая. Крупные рыбы в течение всего года предпочитали моллюсков, амфипод и личинок амфибиотических насекомых; зимой переходили к факультативному каннибализму. Мелкие рыбы активно питались планктонными C. scutifer и D. longispina (особенно в сентябре−октябре), в холодный период в питании возрастало значение личинок хирономид и амфипод. Соотношение массы основных объектов питания в желудках рыб в июле (период низкой концентрации зоопланктона) приведено на рис. 4. Морфы также различаются по заражённости нематодой Cystidicola farionis, промежуточным хозяином которой являются амфиподы (Black, Lankester, 1980), и цестодой Eubothrium salvelini, передающейся через планктонных ракообразных (Vik, 1963). Нематоды встречались в плавательном пузыре крупных рыб в июле со средней частотой 152.6 (до 690) экз/рыбу, у мелких – с частотой 3.4 (до 16) экз/рыбу, а цестоды были отмечены в кишечнике крупных и мелких рыб со средней частотой соответственно 15.9 (до 36) и 12.8 (до 38) экз/рыбу.
Рис. 4.
Соотношение по массе объектов питания мелкой (М) и крупной (К) форм мальмы Salvelinus malma из бассейна оз. Ангре в июле: ( ) – моллюски Pisidium sp., (◻) − личинки ручейников (Trichoptera), (◼) – личинки хирономид (Chironomidae),
(
) – моллюски Pisidium sp., (◻) − личинки ручейников (Trichoptera), (◼) – личинки хирономид (Chironomidae),
( ) – амфиподы Gammarus sp., (
) – амфиподы Gammarus sp., ( ) − планктонные ракообразные Cyclops scutifer и Daphnia longispina, (
) − планктонные ракообразные Cyclops scutifer и Daphnia longispina, ( ) − имаго.
) − имаго.
Все три года наблюдений крупные рыбы размножались во второй половине сентября–начале октября в ручье. Гольцы строили гравийно-галечные гнёзда. Оседлые ручьевые самцы (так называемые карлики) не обнаружены. Не менее половины крупных особей пропускали нерест, оставаясь в озере (их гонады в августе−сентябре были на III стадии зрелости). Мелкие рыбы нерестились в январе на покрытом валунами свале дна в северной части озера под лавовым потоком, вероятно, на выходах грунтовых вод (в этом месте всю зиму сохранялась незамерзающая полынья). Зрелые крупные гольцы в озере с октября не ловились, мелкие зрелые рыбы никогда не ловились в притоке. Икра на ручьевых и озёрных нерестилищах развивалась при разной температуре: в притоке температура воды в грунте бугров с ноября по апрель была близка к 1.0°С, на дне озера в зоне нереста мелкой формы температура в это же время не опускалась ниже 2.5°С.
Таким образом, обнаруженная система демонстрирует типовой пример симпатрической диверсификации гольцов в ресурсных осях пелагиали−бентали. Две формы разобщены по местам и срокам нереста, различаются особенностями морфологии в соответствии с типом питания и образом жизни. Специфический рацион предопределяет различия в возрасте созревания и дефинитивных размерах. Данный пример диверсификации можно признать одним из простейших в мире; симпатрическое формообразование проходит в условиях отсутствия конкуренции с другими видами рыб. Редкий случай возникновения специализированной формы-планктофага у мальмы, по-видимому, связан с особым уровенным режимом озера, приводящим к концентрации зоопланктона к концу лета, когда у формы начинается активная фаза созревания. В таких условиях адаптация оказалась возможной даже в экосистеме минимального объёма. Многие другие популяции мальмы из сходных по размеру озёр Камчатки не дивергируют на устойчивые симпатрические формы (Esin, Markevich, 2019).
Гольцов оз. Ангре можно признать важным модельным объектом для микроэволюционных исследований − возраст системы на несколько тысяч лет меньше большинства известных симпатрических комплексов из постледниковых озёр. В настоящее время начаты работы по анализу молекулярных механизмов регуляции морфогенеза форм. Принимая во внимание важность популяционной системы, гольцы оз. Ангре включены в Красную книгу Камчатского края (2018).
Список литературы
Красная книга Камчатского края. 2018. Т. 1. Животные / Под ред. Токранова А.М. Петропавловск-Камчатский: Камчатпресс, 196 с.
Куренков И.И. 2005. Зоопланктон озер Камчатки. Петропавловск-Камчатский: Изд-во КамчатНИРО, 162 с.
Певзнер М.М. 2015. Голоценовый вулканизм Срединного хребта Камчатки. М.: ГЕОС, 252 с.
Black G.A., Lankester M.W. 1980. Migration and development of swim-bladder nematodes, Cystidicola spp. (Habronematoidea), in their definitive hosts // Can. J. Zool. V. 58. № 11. P. 1997–2005. https://doi.org/10.1139/z80-275
Bolnick D.I., Fitzpatrick D.M. 2007. Sympatric speciation: models and empirical evidence // Ann. Rev. Ecol. Evol. V. 38. P. 459–87. https://doi.org/10.1146/annurev.ecolsys.38.091206.095804
Boughman J.W., Svanbäck R. 2017. Synergistic selection between ecological niche and mate preference primes diversification // Evolution. V. 71. №. 1. P. 6–22. https://doi.org/10.1111/evo.13089
Esin E.V., Markevich G.N. 2019. Parallel late ontogeny transformations in contrasting landlocked phenotypes of Salvelinus malma (Salmonidae) from small volcanic lakes // Ecol. Freshwat. Fish. V. 28. № 3. P. 624−638. https://doi.org/10.1111/eff.12480
Gordeeva N.V., Alekseyev S.S., Matveev A.N., Samusenok V.P. 2015. Parallel evolutionary divergence in Arctic char Salvelinus alpinus complex from Transbaikalia: variation in differentiation degree and segregation of genetic diversity among sympatric forms // Can. J. Fish. Aquat. Sci. V. 72. P. 96–115. https://doi.org/10.1139/cjfas-2014-0014
Jonsson B., Jonsson N. 2001. Polymorphism and speciation in Arctic charr // J. Fish Biol. V. 58. P. 605–638. https://doi.org/10.1111/j.1095-8649.2001.tb00518.x
Klemetsen A. 2010. The charr problem revisited: Exceptional phenotypic plasticity promotes ecological speciation in postglacial lakes // Freshwat. Rev. V. 3. P. 49–74. https://doi.org/10.1608/FRJ-3.1.3
Markevich G.N., Esin E.V., Anisimova L.A. 2018. Basic description and some notes on the evolution of seven sympatric morphs of Dolly Varden Salvelinus malma from the Lake Kronotskoe Basin // Ecol. Evol. V. 8. № 5. P. 2554–2567. https://doi.org/10.1002/ece3.3806
McPhee M.V., Noakes D.L.G., Allendorf F.W. 2012. Developmental rate: a unifying mechanism for sympatric divergence in postglacial fishes? // Current Zool. V. 58. P. 21–34. https://doi.org/10.1093/czoolo/58.1.21
Smith T.B., Skúlason S. 1996. Evolutionary significance of resource polymorphisms in fishes, amphibians, and birds // Ann. Rev. Ecol. Syst. V. 27. P. 111–133. https://doi.org/10.1146/annurev.ecolsys.27.1.111
Vik R. 1963. Studies of the helminth fauna of Norway. IV. Occurrence and distribution of Eubothrium crassum (Bloch, 1779) and E. salvelini (Schrank, 1790) (Cestoda) in Norway with notes of their life cycles // Nytt. Mag. Zool. V. 11. P. 47–73.
Wilson A.J., Gislason D., Skulason S., Snorrason S.S., Adams C.E., Alexander G., Danzmann R.G., Ferguson M.M. 2004. Population genetic structure of Arctic charr, Salvelinus alpinus from northwest Europe on large and small spatial scales // Mol. Ecol. V. 13. P. 1129–1142. https://doi.org/10.1111/j.1365-294X.2004.02149.x
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L. 2004. Geometric morphometrics for biologists: a primer. N.Y.: Elsevier, 455 p.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


