Вопросы ихтиологии, 2019, T. 59, № 6, стр. 693-714
Детали строения и функционирования аппарата глоточных челюстей рубиново-пепельной рыбы-попугая Scarus rubroviolaceus (Scaridae)
Е. С. Громова 1, В. В. Махотин 1, *
1 Московский государственный университет
Москва, Россия
* E-mail: vmakhotin@mail.ru
Поступила в редакцию 12.11.2018
После доработки 13.12.2018
Принята к публикации 18.12.2018
Аннотация
В работе рассмотрены детали строения некоторых мускулов, связок, апоневротических конструкций и остеологических признаков аппарата глоточных челюстей рубиново-пепельной рыбы-попугая Scarus rubroviolaceus. В процессе препарирования обнаружены свидетельства присутствия у данного вида нёбного органа, конвергентно сходного с таковым у донных карповых (Cyprinidae) и чукучановых (Catostomidae) рыб. Обсуждается опосредованное влияние сокращения m. geniohyoideus и m. sternohyoideus на работу глоточных челюстей. На основании результатов анатомирования и анализа литературы корректируется интерпретация полученных ранее морфофункциональных данных, характеризующих аппарат глоточных челюстей попугаевых (Scaridae), на примере S. rubroviolaceus.
Растительноядные рыбы играют значительную роль в поддержании благоприятного баланса структуры тропических коралловых рифов – одной из самых разнообразных и продуктивных морских экосистем. Среди данной группы Teleostei особенно важны рыбы-попугаи (Scaridae), питание и жизнедеятельность которых способствует доминированию на рифе живых кораллов над бентосными водорослями (Lokrantz et al., 2008; Dromard et al., 2013). Строение и функционирование висцерального аппарата рыб-попугаев взаимосвязано со значительным содержанием в потребляемой ими пище карбоната кальция, который они приобретают, используя разные способы изъятия кормового материала. Виды попугаевых пасутся, соскребая маты эпилитических водорослей с твёрдого субстрата; ощипывают слоевища таких макроскопических водорослей, как бурые (Phaeophyceae) и известковые красные кораллиновые (Corallinales), а также побеги покрытосеменных морских трав; поедают живые коралловые полипы. Представители Scaridae включаются в процесс наружной биоэрозии своего местообитания, осуществляя продукцию, переработку и транспорт осадочной породы (известняк) рифа (Randall, 1965; Brock, 1979; Bellwood, 1996; Bonaldo, Bellwood, 2008; Francini-Filho et al., 2008; Alwany et al., 2009; Green, Bellwood, 2009; Bonaldo et al., 2011, 2014; Cernohorsky et al., 2015). Захват пищи попугаевые выполняют при помощи мощно развитых передних челюстей, включающих praemaxillare сверху и dentale снизу; последние с возрастом рыбы неподвижно скрепляются при помощи шва. У представителей рода Scarus зубы на передних челюстях сливаются между собой и с несущими их костями, образуя монолитные зубные пластинки, покрытые слоем цемента (Bellwood, 1994). Механическая твёрдость эмали зубов попугаевых превышает таковую у многих рыб, чьи зубы подвергаются во время кормодобывания высоким нагрузкам, например большой белой акулы Carcharodon carcharias и пираньи Serrasalmus manueli (Chen et al., 2012). Благодаря такому строению аппарата питания представители Scaridae способны совершать силовые укусы, удаляющие вместе со съедобным материалом кусочки рифового субстрата, на котором он располагался. Необходимость комплексной обработки корма в ротовой полости рыбы способствовала изменению конструкции и функционирования элементов жаберных дуг попугаевых. Это привело к формированию специализированного механизма глоточных челюстей (pharyngeal jaw apparatus, PJA) (Vandewalle et al., 1992, 2000), обладание которым данная группа окунеобразных (Perciformes) разделяет наряду с остальными представителями губановидных (Labroidei) (Liem, Greenwood, 1981; Liem, 1986; Liem, Sanderson, 1986; Нельсон, 2009).
Скелет PJA рубиново-пепельной рыбы-попугая Scarus rubroviolaceus и у других видов Scaridae представлен консолидированными укрупнёнными верхней и нижней глоточными челюстями (Monod, 1951; Nelson, 1967; Yamaoka, 1980; Liem, Greenwood, 1981; Price et al., 2010; Mikami, 2013). Верхняя глоточная челюсть (upper pharyngeal jaw, UPJ) составлена из левого и правого pharyngobranchialia 3, вентральные зубные ряды которых плотно вставляются один в другой во избежание возможных сдвигов левой половинки UPJ относительно правой (Clements, Bellwood, 1988). Озубленная нижняя глоточная челюсть (lower pharyngeal jaw, LPJ) образована единым элементом, сформированным из сросшихся ceratobranchialia 5 обеих сторон головы. UPJ образует плоский сустав с вентральной поверхностью нейрокраниума, а LPJ – сустав c сleithrum (Bellwood, 1986). Мускулы, обеспечивающие специфическую работу глоточных челюстей, претерпели значительные модификации относительно исходного варианта их строения у менее специализированных окунеобразных (Elshoud-Oldenhave, 1979; Lauder, 1983a, 1983b), которые включают: 1) изменение их количества, 2) гипертрофию некоторых из них, 3) смещение мест крепления как на нейрокраниуме, так и на жаберных дугах; 4) увеличение перистости. Существует небольшое число работ, характеризующих морфологию PJA попугаевых, и рубиново-пепельной рыбы-попугая в частности (Clements, Bellwood, 1988), однако лишь в немногих из них сделаны попытки описать функционирование PJA в целом, поскольку их авторы, на наш взгляд, упускали, неточно описывали или неверно истолковывали существенные детали его строения (Board, 1956; Gobalet, 1989). Кроме того, в литературе можно обнаружить записи электромиографии сокращения мускулов, управляющих лишь движениями суспензориума (Liem, 1978; Дзержинский, 2005) попугаевых, но не их PJA (Alfaro, Westneat, 1999; Alfaro et al., 2001).
Цель работы – провести детальный анализ строения мускулов, соединительнотканных структур и связок PJA, а также переднего отдела пищевода рубиново-пепельной рыбы-попугая. Уточнено устройство и места крепления мускулов sternohyoideus и geniohyoideus, сокращение которых оказывает влияние на работу PJA. Предложены ранее не описанные варианты взаимодействия различных образований, входящих в состав PJA, таких как нёбный орган (по: Doosey, Bart, 2011), и компоненты сфинктера пищевода − глоточный клапан (valvula pharyngealis) и глоточные мешки (saccus pharyngealis) (по: Board, 1956).
МАТЕРИАЛ И МЕТОДИКА
Исследовали строение мускульных, костных и соединительнотканных элементов, входящих в состав и окружающих PJA рубиново-пепельной рыбы-попугая. Изготовили три спиртовых и два сухих препарата голов по традиционной методике (Ромейс, 1953). Для определения видовой принадлежности особей использовали работы по систематике представителей попугаевых (Schultz, 1958, 1969; Liao et al., 2004). В исследовании использованы как самки, так и самцы, имеющие рубиново-пепельный окрас туловища и находящиеся на начальной стадии онтогенеза (Bruggemann et al., 1996; Howard et al., 2013; Pereira et al., 2016). Препараты исследовали при помощи стереомикроскопа МБС-1. Рисунки создавали на основе цифровых цветных фотографий анатомированных голов рыб при помощи камеры Panasonic DMC-FZ8. Фотографии обрабатывали в программе Adobe Photoshop CS2, формируя по ним точные контурные изображения препаратов, которые затем корректировали, сравнивая с исходным объектом.
Для описания скелетных элементов жаберных дуг, гиоида, нижней челюсти и плечевого пояса взяты термины, которые используются в литературе при описании остеологии губановидных (Delsman, 1925; Rognes, 1973; Goedel, 1974; Barel et al., 1976; Tedman, 1980; Gobalet, 1989; Bellwood, 1994; Carr et al., 2006; Mikami, 2013), а также миологии (Anker, 1978; Yamaoka, 1978; Liem, Greenwood, 1981; Stiassny, 1981, 1982; Kaufman, Liem, 1982; Liem, 1975, 1986; Bellwood, 1986; Liem, Sanderson, 1986; Drucker, Jensen, 1991), соединительнотканных образований и мягких структур разного происхождения, располагающихся при входе в пищевод (Board, 1956; Stiassny, Jensen, 1987; Gobalet, 1989; Kobelkowsky, 2013) у рыб данной группы. В работе также употребляются обозначения из исследований ветвления головных нервов разных представителей Teleostei (Cole, 1898; Herrick, 1899; Handrick, 1901; Gierse, 1904; Nicol, 1952; Mithel, 1964; Maheshwari, 1965; Saxena, 1969; Springer, Freihofer, 1976; Harrison, 1981; Nilsson, 1984; Graaf, 1990; Nakae, Sasaki, 2006, 2007, 2008). Кроме того, вводятся некоторые термины для указания деталей структур мышечной и соединительнотканной систем висцерального аппарата рубиново-пепельной рыбы-попугая.
В тексте использованы следующие сокращения: m. – мускул (musculus), lig. – связка (ligamentum), t. – сухожилие (tendo), pr. – отросток (processus), cr. – гребень (crista), tub. − бугристость кости (tuberositas), n. – нерв (nervus), r. – ветвь нерва (ramus).
РЕЗУЛЬТАТЫ
Особенности строения epibranchiale 4, UPJ и LPJ (рис. 1, 2)
Рис. 1.
Строение некоторых костных элементов аппарата глоточных челюстей рубиново-пепельной рыбы-попугая Scarus rubroviolaceus: а−в – верхняя глоточная челюсть (UPJ) в сочленении с epibranchiale 4 (вид cоответственно снизу, сверху и сбоку); г – нижняя глоточная челюсть (LPJ), вид сбоку; al − ala lateralis, apu − planum articularis pars principalis UPJ, c – carina (киль LPJ), ca − сrista alae, cce − crista collum epibranchiale 4, cle − collum epibranchiale 4, cpu − crista pars principalis UPJ, cra − сrista alveolaris, de – dens, ma − margo alae (ободок латерального крыла), pac − pr. anterior collum, pae − pars articularis epibranchiale 4, pal − portio alveolaris LPJ, pau − pr. alveolaris UPJ, pc − pr. cleithralis, pla − planum articularis transversus, pll − pr. lateralis LPJ, pm − pr. muscularis, ppa − pr. pars articularis, sa − sulcus alveolaris, tau − tuberositas alveolaris UPJ, tuc − tuberositas carinae. Масштаб здесь и далее: 1 см.
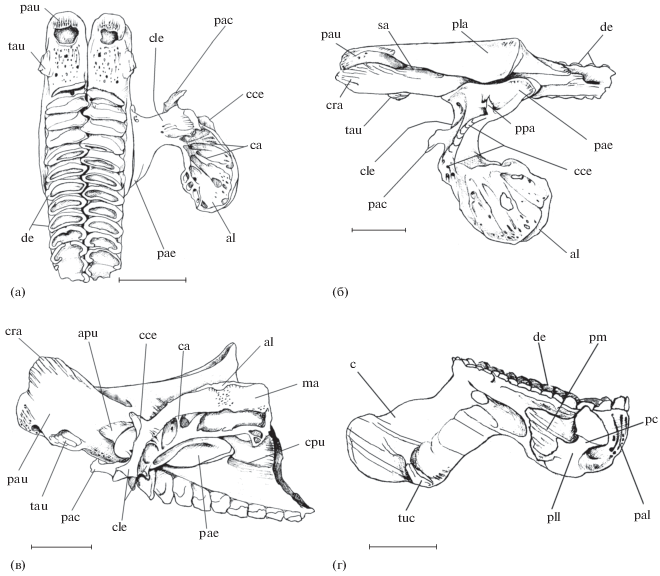
Рис. 2.
Некоторые мускулы, соединительнотканные структуры и нервы глоточного отдела висцерального
аппарата рубиново-пепельной рыбы-попугая Scarus rubroviolaceus, вид сбоку: а − после снятия суспензориума и жаберной крышки, а также частичного
удаления латерально расположенных элементов жаберных дуг; б – epibranchiale 4 частично
удаленo, обнажена область сфинктера пищевода, видны хорошо обособленные мускулы нёбного
органа; в – сфинктер пищевода и глоточный мешок (saccus pharyngealis) вскрыты; IX
– n. glossopharyngeus (IX); X1, 2 – r. branchialis vagus (Х1, X2), aap – m. adductor
arcus palatini, acu − pr. aculeus prooticum (иглообразный отросток prooticum), ad4,
5 – m. adductor 4, 5, ahy3 − pr. autogenous hypobranchiale 3, aJa − anastomosis Jacobson,
alp − aponeurosis m. levator posterior pars lateralis, ao − aorta ventralis, ceh –
ceratohyale, cl – cleithrum, co – cor, dhh − hypohyale dorsale, hm4 – hemibranchia
4 dextra, hmVII – r. hyomandibularis (VII), jVII − r. opercularis profundus facialis
junctum (VII), jin − v. jugularis inferior, laX − r. lateralis vagus (X), lh − lig.
hyale, lh3 – lig. hypobranchiale 3, li1,2 – m. levator internus 1,2, li4 − lig. epi-ceratobranchiale
4, lp − m. levator pectoralis, LPJ – mandibula pharyngeus inferior, lpm − m. levator
posterior pars medialis, mbs – membrana sagittalis, mcl − m. corpus lateralis magnum,
mpr − pr. muscularis LPJ, oc − n. occipitalis, od1−2, 4 − m. obliquus dorsalis 1−2,
4; oc+sp − nn. occipitalis + cerebrospinalis, opt − textus organum palatinum (ткань
нёбного органа), pIX − r. pretrematicus et posttrematicus glossopharyngeus (IX), pce
− m. pharyngocleithralis externus, pci − m. pharyngocleithralis internus, pch − planum
articularis cleithralis, ph − mm. рharyngealia, ph2 − pharyngobranchiale 2, phX2,
X3 – r. pharyngeus vagus (X2, X3), por − pulvinar organum palatinum (подушка нёбного
органа), ppVII − r. posterior palatinus (VII), psVII+IX − r. pseudobranchialis VII+IX,
psa − plica saccus pharyngealis, pstX3 − r. posttrematicus vagus (X3), rc – m. rectus
communis, rd – m. rectractor dorsalis, riX − r. intestinalis vagus (X), rsh − r. sternohyoideus,
rv4 – m. rectus ventralis 4, sac – saccus pharyngealis, so − sphincter oesophagii
(собственно сфинктер пищевода), sph − m. saccus pharyngealis, sym − truncus sympaticus,
tcm − t. corpus muscularis, tdp − m. transversus dorsalis posterior, tp2 − m. transversus
pharyngobranchiale 2, tre4 − m. transversus epibranchiale 4, tru − m. transversus
UPJ, tsh – t. sternohyoideus, tv1, 2 – m. transversus ventralis 1, 2, vo − villi organum
palatinum (ворсинки нёбного органа), uh – urohyale, ( ) − мускулатура, (
) − мускулатура, ( ) − регулярная соединительная ткань, (
) − регулярная соединительная ткань, ( ) − нерегулярная соединительная ткань; ост. обозначения см. на рис. 1.
) − нерегулярная соединительная ткань; ост. обозначения см. на рис. 1.
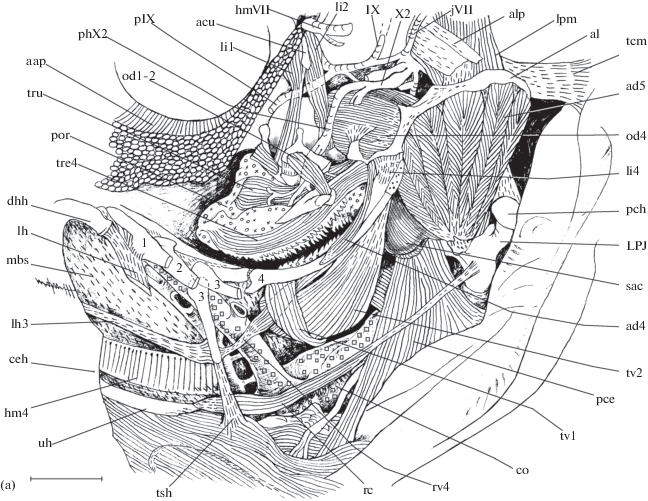
Рис. 2.
Окончание.
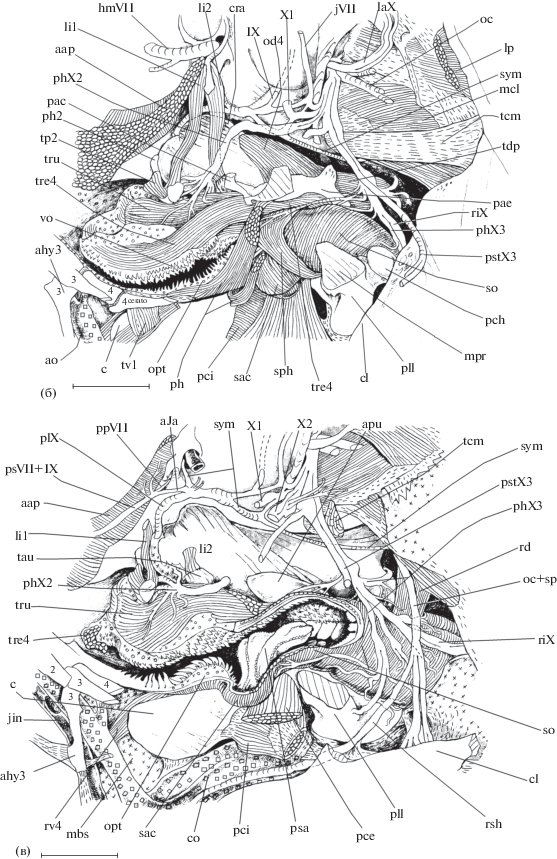
Epibranchiale 4 (рис. 1а–1в, 2а, 2б) имеет сустав с UPJ, а также при помощи lig. epiceratobranchiale 4 (см. ниже) скрепляется с ceratobranchiale 4. Epibranchiale 4 включает в себя сочленовную часть и латеральное крыло, соединённые изогнутой вперёд костной шейкой (collum). Сочленовная часть кости овальной формы, медиально формирует плоский сустав с UPJ; суставная поверхность, имеющаяся для этого на еpibranchiale 4, слегка вогнутая. Срединная область сочленовной части еpibranchiale 4 формирует ориентированный вверх треугольный pr. pars articularis с острой вершиной. Дорсальная доля шейки несёт мощный cr. collum epibranchiale 4, тянущийся от pr. pars articularis и оканчивающийся в месте перехода шейки в латеральное крыло. Этот гребень служит границей раздела между передней и задней поверхностями шейки. Передняя поверхность вогнута и формирует направленный вперёд pr. anterior. Латеральное крыло имеет форму веера и уплощено дорсовентрально. Оно слегка выпукло вверх, вогнуто снизу и ориентировано вбок. Край крыла по периметру увеличен и формирует заметный широкий костный ободок. Кость, образующая крыло, перфорирована, а по её вентральной поверхности следуют несколько гребней, которые ориентированы медиолатерально.
Широкая в дорсовентральном направлении, уплощённая с боков пластинка каждой из UPJ (рис. 1а–1в, 2б, 2в) включает в себя основную часть и ориентированный вперёд альвеолярный отросток (pr. alveolaris), внутри которого формируются зубы. По мере своего развития они смещаются назад. Булавовидный альвеолярный отросток имеет расширенный рострально передний конец, латеральная часть которого образует мощный вертикально ориентированный костный cr. alveolaris. Наружная и внутренняя стороны сr. alveolaris покрыты гребешками более маленького размера. Сr. alveolaris возвышается относительно альвеолярного отростка. Мягкая костная ткань вентральной и передней поверхностей альвеолярного отростка, а также медиальной стороны сr. alveolaris перфорирована и не служит для крепления мускулов. На границе описываемой мягкой ткани и основания более твёрдого cr. alveolaris на наружной поверхности UPJ формируется заметная tub. alveolaris. Узкий глубокий желобок отделяет заднюю часть сr. alveolaris и начальную долю сочленовной поверхности UPJ для нейрокраниума. Срединные области гладкой медиальной стороны альвеолярных отростков каждой стороны головы рыбы формируют между собой плотный контакт. Имеющаяся в месте перехода альвеолярного отростка в основную часть UPJ овальная суставная площадка для причленения epibranchiale 4 слегка выпуклая и превышает по площади располагающуюся напротив неё сочленовную поверхность на epibranchiale 4. На уровне передней границы этого сустава на вентральной стороне UPJ расположены наиболее ростральные зубы.
Дорсальная часть основной доли UPJ несёт сочленовную поверхность для формирования плоского сустава с вентральной областью нейрокраниума. Порция передней половины этой сочленовной поверхности располагается на медиальной стороне UPJ и, следовательно, ориентирована в сагиттальной плоскости, контактируя с cr. ventralis parasphenoideum. Таким образом, UPJ обоих сторон головы образуют для cr. ventralis своеобразные “ножны”. Другая, латеральная, порция передней половины, а также вся задняя половина описываемой сочленовной поверхности UPJ находятся в поперечной плоскости, формируя “салазки”, за счёт которых пара UPJ способна осуществлять переднезадние смещения. Ширина поперечно ориентированной сочленовной поверхности увеличивается в направлении назад.
Узкий задний край основной части UPJ в области крепления m. retractor dorsalis покрыт небольшими костными рёбрами. От каудального края суставной площадки для причленения epibranchiale 4 назад по поверхности UPJ тянется невысокий cr. pars principalis UPJ. Сверху и снизу относительно этого гребня и задней половины суставной площадки поверхность основной части UPJ вогнута.
Тело LPJ (рис. 1г, 2) состоит из уплощённой дорсовентрально передней доли и утолщённой задней альвеолярной доли, каудальная поверхность которой перфорирована. Между передней и задней долями не имеется заметного перехода. Дорсальная сторона LPJ озублена: первыми стачиваются передние, т.е. наиболее отдалённые от герминативной зоны, зубы. Тело LPJ с каждой своей стороны формирует мощный pr. lateralis, дорсальная поверхность которого сильно вогнута и покрыта продольными костными рёбрышками. Боковая часть pr. lateralis в свою очередь образует два отростка: один – pr. muscularis для крепления некоторых глоточных мускулов, а другой – pr. cleithralis, несущий слабо выпуклую фасетку для формирования плоского сустава с передней областью cleithrum. Наружная поверхность треугольного по форме pr. muscularis покрыта хорошо заметными костными рёбрами.
Вентральная сторона тела LPJ непосредственно впереди pr. lateralis вогнута; немного ростральнее тело формирует широкий, уплощённый в сагиттальной плоскости киль, ориентированный передневентрально. Основание киля прободено округлым небольшим отверстием. Поверхность киля покрыта костными рёбрышками, направление которых совпадает с направлением продольной оси, проведённой через тело LPJ. На нижнем крае киля имеется заметная tub. сarinae, имеющая ту же ориентацию, что и его костные рёбрышки.
Описание нёбного органа, hemibranchia 4, pseudobranchia и некоторых связок PJA
Нёбный орган (рис. 2–4) − сильное разрастание ткани на нижней стороне черепа в области ротовой и жаберной полостей рыбы. В меньшей степени наблюдается гипертрофия ткани участков вентральной поверхности ротовой и жаберной полостей. Наибольшего размера нёбный орган рубиново-пепельной рыбы-попугая достигает в районе ростральных частей дорсальных элементов жаберных дуг, которые погружены в него. Меньшая толщина ткани органа сопровождает всю верхнюю стенку ротовой полости, начиная с зубов передних челюстей. Так, нёбный орган целиком заполняет внутренний объём “ковшей” слившихся praemaxillare и dentale, которые располагаются напротив друг друга на уровне ротовых клапанов. M. adductor arcus palatini обеих сторон головы покрыт толстым слоем описываемой ткани. Снизу ткань органа также присутствует на участке в области верхнего края киля LPJ, ceratobranchiale 4, mm. рharyngealia и маленькой хрящевой basibranchiale 4, формируя фрагменты так называемого заднеязычного органа, имеющегося у карпа Cyprinus carpio (postlingual organ – по: Sibbing, Uribe, 1985).
Рис. 3.
Мускулы гиоида, жаберных лучей и нижней челюсти рубиново-пепельной рыбы-попугая Scarus rubroviolaceus после частичного удаления “ковша” dentale, вид снизу: age − pars anterior m. geniohyoideus, d – dentale, hys − m. hyohyoideus superior, ifs − septa inferior, imb − m. intermandibularis, iop – interoperculum, lge − pars lateralis m. geniohyoideus, lio − lig. interoperculare, mbV − r. mandibularis (V), myl − myosepta longitudinalis (продольная миосепта), pge − pars posterior m. geniohyoideus, rbr1−4 − radii branchiostegii 1−4, sh – m. sternohyoideus, shy − septa hyohyoideus superior, ssa − septa sagittalis, tge − t. geniohyoideus, ttg − locus tendinosus terminalis m. geniohyoideus, vhh – hypohyale ventrale; ост. обозначения см. на рис. 2.
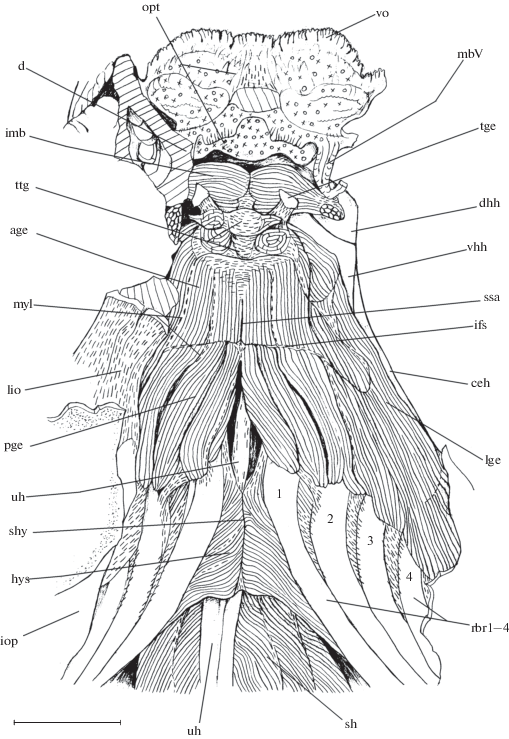
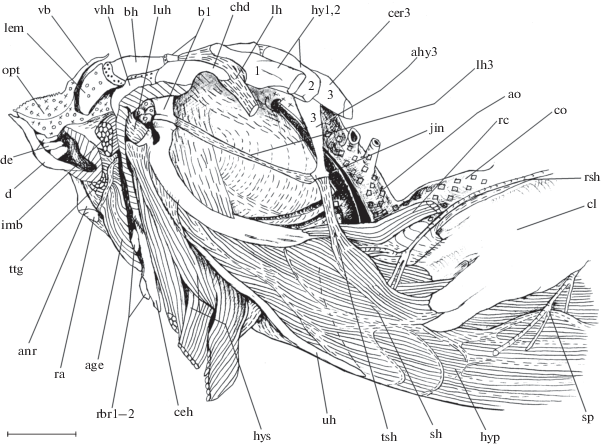
Рис. 4.
Извлечённый нижний отдел жаберной решётки рубиново-пепельной рыбы-попугая Scarus rubroviolaceus, гиоид левой стороны головы удалён, открыты urohyale, передняя область нижней ветви
cleithrum и m. sternohyoideus, располагающийся между ними, вид сбоку: anr – anguloarticulare,
b1 − basibranchiale 1, bh − basihyale, cer3 − ceratobranchiale 3, chd − pr. caudalis
hypohyale dorsale, hy1, 2 − hypobranchiale 1, 2, hyp − m. hypaxialis, lem − lingua
extremum mollis (мягкий конец языка), luh − lig. urohypohyale, ra – retroarticulare,
sp – n. cerebrospinalis, vb − valvula buccalis, ( ) − хрящ, (
) − хрящ, (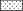 )− жир; ост. обозначения см. на рис. 1−3.
)− жир; ост. обозначения см. на рис. 1−3.
Большая доля поверхности нёбного органа покрыта небольшими ворсинками, а в его составе можно различить жир и рыхлую соединительную ткань. Однако в области передних участков дорсальных элементов жаберных дуг, где гипертрофия органа формирует “подушку”, характер его покрытия меняется: обнаруживаемые на нём ворсинки увеличиваются в размере и начинают напоминать жаберные тычинки, располагающиеся на ceratobranchialia 3 и 4, но обладающие большей мягкостью. Ворсинки, усеивающие поверхность органа, которая находится медиальнее m. transversus UPJ, ориентированы вентрально и вентрокаудально. Снизу, в области киля LPJ, ворсинки, покрывающие небольшой сгусток ткани нёбного органа, направлены вверх и дорсорострально.
В глубинной области нёбного органа, непосредственно под альвеолярным отростком UPJ, обнаруживаются нерегулярные тёмно окрашенные мускульные волокна. Помимо них ткань органа скрепляется с хорошо обособленными мускулами m. transversus epibranchiale 4, m. transversus UPJ и m. transversus pharyngobranchiale 2.
Лепестки hemibranchia 4 (рис. 2а) не связаны с костными элементами жаберной дуги 4. Последняя жаберная щель расположена между ceratobranchialia 3 и 4, исчезая между жаберными дугами 4 и 5. Несущая лепестки полоска hemibranchia 4 крепится к соединительнотканной плёнке, выстилающей медиальную стенку оперкулярной полости. Под этой плёнкой располагаются мускулы, обслуживающие PJA; сзади и внизу эта мембрана присоединяется к cleithrum, а каудодорсально связана с тимусом и оперкулярной железой. Точных границ оперкулярной железы в вентральном направлении провести нельзя: тонкий слой её ткани характерной ячеистой структуры распространяется вниз по поверхности описываемой плёнки, гранича с hemibranchia 4. Полоска hemibranchia 4 пролегает косо, дорсально накладываясь на m. adductor 5, затем перекидывается на глоточный мешок и mm. transversus ventralis 1 и 2. По пути дальнейшего следования она пересекает aorta ventralis, аутогенный отросток hypobranchiale 3, t. sternohyoideus и постепенно сходит на нет в области lig. hypobranchiale 3.
Pseudobranchia крупного размера, имеет хорошо развитые жаберные лепестки, весьма напоминающие те, что расположены на жаберных дугах. Pseudobranchia расположена под острым углом по отношению к продольной оси нейрокраниума. Вентрокаудально она отходит от полоски внутренней поверхности срединного отдела hyomandibulare, которая выстлана плёнкой, затем переходит на нижнюю сторону m. adductor arcus palatini и, наконец, прикрепляется к участку parasphenoideum в месте перехода его cr. ventralis в pr. anterior. Таким образом, лепестки pseudobranchia обращены вверх и назад. Иннервацию осуществляет r. pseudobranchialis VII + IX.
Широкое lig. epiceratobranchiale 4 (рис. 2а) соединяет передний край шейки epibranchiale 4 латеральнее его pr. anterior с верхним расширенным участком ceratobranchiale 4. Дорсально передний край связки граничит с m. adductor 4.
Lig. hypobranchiale 3 (рис. 2а, 4, 5) – длинная узкая связка, тянущаяся в ростродорсальном направлении от кончика аутогенного отростка hypobranchiale 3 к заднему краю вентрально ориентированного отростка basibranchiale 1, который сочленяется с обращённым вверх отростком urohyale.
Область прикрепления lig. hyale (рис. 2а, 4, 5) в районе продольной оси жаберной решётки включает верхнезадний участок hypohyale dorsale, который формирует для отхождения этой связки pr. caudalis, а также передний край hypobranchiale 1, прилегающий сзади к этому отростку. Определённая доля волокон lig. hyale крепится к боковым сторонам basibranchiale 1. В вентральном отделе головы рыбы связка оканчивается на pr. dorsalis hyoideum, чья передняя часть сформирована ceratohyale, а задняя – epihyale, которые граничат друг с другом посредством хорошо заметного шва. Площадь верхней области крепления lig. hyale превышает таковую нижней.
Толстое и блестящее парное lig. urohypohyale (рис. 4) соединяет переднюю поверхность двураздельной головки urohyale с вентральной поверхностью hypohyale ventrale каждой стороны головы.
Lig. baudeloti отсутствует.
Особенности строения некоторых мускулов PJA, m. sternohyoideus, m. geniohyoideus
Имеется три mm. levatores externi 1–3, начала которых слегка сухожильны, и два mm. levatores interni 1–2, составленные только из мускульных волокон. M. levator externus 1 представляет собой мускульный тяж, который начинается с кончика направленного вниз иглообразного отростка prooticum (pr. aculeus prooticum), располагающегося вентральнее передней сочленовной фасетки для hyomandibulare. Волокна тянутся передневентрально и оканчиваются на верхней поверхности epibranchiale 1, непосредственно впереди участка раздвоения этого элемента. M. levator externus 2 начинается рядом с m. levator externus 1, ориентирован дорсовентрально, оканчивается коротким слабо дифференцированным сухожилием на направленном каудально отростке epibranchiale 2. M. levator externus 3 берёт начало с каудальной поверхности pr. aculeus prooticum, следует задневентрально и прикрепляется при помощи сухожилия (более протяжённого, чем у m. levator externus 2) к длинному вертикально ориентированному отростку epibranchiale 3.
Mm. levator externus 4, levator posterior и adductor 5 демонстрируют значительную степень слияния волокон на разных участках своего следования. M. levator externus 4 – мощный перистый мускул, начинающийся с нейрокраниума двумя головками: переднелатеральной и заднемедиальной, которые соединены между собой сухожильными промежутками. M. levator externus 4 caput rostrolaterale крепится к внутренней поверхности fossa subtemporalis lateralis и имеет хорошо развитый апоневротический каркас. Часть мускульных волокон берёт начало с медиальной стороны hyomandibulare, непосредственно ниже его заднего сочленовного мыщелка. Caput rostrolaterale содержит в себе чашевидные “конусы” апоневрозов, которые вложены друг в друга, наподобие миосепт миомеров туловища рыбы. Между ними под острым углом уложены короткие мускульные волокна. M. levator externus 4 caput caudomediale отходит из приблизительно 2/3 глубокого пространства fossa subtemporalis medialis. Её мускульные волокна для прикрепления частично используют каудальные поверхности апоневротических конусов caput rostrolaterale и, кроме того, формируют собственные подобные конусы. Вершины конусов обеих головок m. levator externus 4 направлены вниз и незадолго перед достижением epibranchiale 4 сливаются друг с другом, постепенно формируя сначала вытянутые пластины апоневрозов, а затем и толстое конечное многочленистое сухожилие, состоящее из группы отдельных блестящих соединительнотканных “ремней”. Часть описываемых пластин апоневрозов оканчивается на участке задней поверхности шейки epibranchiale 4. Составное конечное сухожилие, ориентированное задневентрально, проходит позади изгиба шейки и медиальнее латерального крыла epibranchiale 4 для прикрепления на латеральной стороне pr. muscularis LPJ. Внушительного размера перистый m. levator posterior состоит из двух порций – латеральной и медиальной.
M. levator posterior pars lateralis (рис. 2а) представляет собой огромный мускульный конус, который берёт своё начало из задней 1/3 пространства глубокой fossa subtemporalis medialis, а также с находящейся позади неё костной планки, сформированной exoccipitale и parasphenoideum, ниже области начала m. adductor operculi. Порция оканчивается на дорсальной поверхности латерального крыла и небольшом участке задней стороны шейки epibranchiale 4. Внутренний объём мускулатуры m. levator posterior pars lateralis структурирован несколькими соединительнотканными конусами, вложенными друг в друга таким же образом, как и в случае m. levator externus 4. Однако вершины этих конусов направлены вверх, а основания – в сторону латерального крыла epibranchiale 4. Каудальная поверхность пластины апоневроза, который является задней стенкой одного из наружных конусов m. levator externus 4 caput caudomediale, служит местом крепления самых передних волокон m. levator posterior pars lateralis. Этот апоневроз оканчивается на задней поверхности шейки epibranchiale 4 (см. выше). Таким образом, в области своего начала m. levator posterior pars lateralis спереди непрерывен с m. levator externus 4.
M. levator posterior pars medialis (рис. 2а) имеет значительную протяжённость в дорсовентральном направлении. Его мускульные волокна заключены между несколькими вытянутыми пластинами апоневрозов, которые в области отхождения порции от нейрокраниума формируют трубки. Рострально передние из этих пластин служат местом прикрепления каудальных волокон m. levator posterior pars lateralis. Дорсально m. levator posterior pars medialis проходит медиальнее сухожильного места начала m. levator pectoralis и порции m. epaxialis, устремляющейся вперёд на дорсальную поверхность нейрокраниума. Эта начальная доля m. levator posterior pars medialis заключает внутри своей массы pr. ventralis posttemporale, обходя его изнутри и снаружи. Волокна начинаются с поверхности fossa occipitalis lateralis. Порция оканчивается, минуя латеральное крыло epibranchiale 4, крупным многочленным сухожилием на дорсальной стороне pr. lateralis и pr. muscularis LPJ, которое впереди сливается с конечным сухожилием m. levator externus 4 подобной структуры, а латерально – с множественными конечными узкими рёбрами апоневрозов m. adductor 5 (рис. 2а, 6). Таким образом формируется единое сухожильное конечное образование колоссального размера, источником которого служат три разных глоточных мускула − m. levator externus 4, m. levator posterior и m. adductor 5.
M. levator internus 1 (рис. 2) широко начинается c переднего края prooticum ростральнее его pr. aculeus: область начала этого мускула граничит с таковой у верхнекаудальной части m. adductor arcus palatini (последний формирует ложе для глазного яблока). M. levator internus 1 нисходит сверху вниз медиальнее pharyngobranchiale 2, латеральнее pr. alveolaris UPJ и проникает в ткань нёбного органа. В самой глубинной части нёбного органа мускул веерообразно расширяется, и его волокна становится сложно отделить от окружающей их ткани органа. Мускульные волокна m. levator internus 1 дотягиваются почти до самой вентральной поверхности подушки нёбного органа, усеянной ковром ворсинок.
М. levator internus 2 (рис. 2) полностью скрыт под латерально расположенными mm. levatores externi 1–3 и становится виден только после их удаления. Мускул начинается с кадульной стороны pr. aculeus prooticum и ориентирован слегка задневентрально. Оканчивается на ребристой поверхности крупной tub. alveolaris UPJ. Место окончания m. levator internus 2 находится непосредственно у переднего края области прикрепления к UPJ m. obliquus dorsalis 4.
Толстый слой волокон m. obliquus dorsalis 4 (рис. 2а, 2б, 6) берёт начало с поверхности сr. alveolaris и наружной срединной поверхности pr. alveolaris UPJ, а также с верхней области основной части UPJ сразу же ниже сустава с нейрокраниумом и срединного участка UPJ непосредственно выше суставной площадки для причленения epibranchiale 4. Местом окончания волокон служат верхнепередняя сторона сочленовной части epibranchiale 4 и передняя поверхность шейки, располагающаяся впереди принадлежащего ей дорсального гребня, а также pr. anterior. С pr. anterior m. obliquus dorsalis 4 cвязан коротким блестящим сухожилием. Следует отметить, что область прикрепления также включает передний и медиальный участки pr. pars articularis. Перистый m. obliquus dorsalis 4 содержит крупные продольно ориентированные пластины апоневрозов. В передней области мускула его волокна следуют вперёд–назад. На уровне pr. pars articularis epibranchiale 4 волокна m. obliquus dorsalis 4 постепенно меняют свою ориентацию на медиолатеральную, таким образом веерообразно расходясь по поверхности UPJ, и без заметной границы становятся частью m. transversus dorsalis posterior.
Сфинктер пищевода является комплексной структурой, в составе которой (с каждой стороны головы рыбы) помимо собственно сфинктера можно выделить несколько обособленных мускульных образований: 1) mm. transversii (4 шт.), 2) глоточный мешок (saccus pharyngealis), 3) обслуживающий его m. saccus pharyngealis, 4) mm. pharyngealia, связывающие киль LPJ с жаберной дугой 4. Структуры 2−4 обслуживаются r. pharyngeus X3 и частично r. posttrematicus X3.
Область крепления мускульных волокон собственно сфинктера пищевода (sphincter oesophagii) (рис. 2а, 2б) включает: сверху − узкую полоску поверхности основной части UPJ, окаймляющую зубной ряд под областью отхождения m. transversus dorsalis posterior; вентрально – аналогичную полоску поверхности LPJ, окаймляющую снизу его зубы и тянущуюся каудально от уровня pr. lateralis вплоть до заднего края альвеолярной доли LPJ. Мускульные волокна нисходят сверху вниз; у крупных экземпляров наблюдается их сегментарность. Пространство, заключённое в пределах сфинктера пищевода, формирует небольшую полость, внутренняя поверхность которой покрыта некрупными мягкими ворсинками, направленными назад и напоминающими по своему строению ворсинки подушки нёбного органа.
M. transversus dorsalis posterior (рис. 2б, 6) соединяет вогнутую заднюю область основной части UPJ выше проходящего по ней cr. pars principalis (см. выше) с заднедорсальной поверхностью сочленовной части epibranchiale 4, включая каудальную сторону его pr. pars articularis. Мускул не содержит апоневрозов; волокна его основной части ориентированы в переднезаднем направлении. Область крепления на UPJ расположена непосредственно впереди области окончания m. retractor dorsalis (рис. 2в). Ниже гребня основной части UPJ мускульные волокна m. transversus dorsalis posterior без заметной границы включаются в состав m. transversus epibranchiale 4.
M. transversus epibranchiale 4 (рис. 2) представляет собой продольно ориентированный контрлатеральный тяж длинных мускульных волокон, устремляющийся вперёд начиная с задних 2/3 вентральной поверхности сочленовной части epibranchiale 4, а также с соседнего участка его шейки каждой стороны головы. Иннервируется r. pharyngeus X1. Рострально обе половинки мускула связаны посредством сагиттальной миосепты. Передняя граница мускула находится на уровне расположения pseudobranchia сверху и hypobranchiale 3 снизу. M. transversus epibranchiale 4 служит основой глоточного клапана (valvula pharyngealis) (по: Board, 1956); малая часть мускульных волокон связана с epibranchiale 1. Верхняя часть мускула посредством небольшого сгустка ткани нёбного органа скреплена с основной массой последнего. Если этот сгусток удалить, m. transversus epibranchiale 4 способен легко скользить дорсовентрально относительно латеральной поверхности нёбного органа. Медиальная сторона мускула покрыта небольшим слоем ткани органа. Более тонкий слой этой ткани, сопровождающий нижнюю поверхность мускула, служит основанием для многочисленных крупных ворсинок, расположенных в несколько рядов и ориентированных вентрокаудально. M. transversus epibranchiale 4 проходит под острым углом по отношению к m. transversus UPJ.
М. transversus UPJ (рис. 2) является самым крупным мускулом нёбного органа. Он представляет собой мощный широкий мускульный пояс, охватывающий латерально и снизу основную массу ткани подушки нёбного органа. Иннервируется r. pharyngeus X2. Если мы будем двигаться в направлении медиально от внутренней поверхности мускула в глубь органа, то постепенно волокна m. transversus UPJ теряют свою упорядоченность и перемешиваются с окружающей их тканью. Мускул проходит латеральнее веерообразного окончания m. levator internus 1. М. transversus UPJ берёт начало с передней 1/3 вентральной стороны сочленовной части epibranchiale 4, с небольшого соседнего участка шейки epibranchiale 4, а также с узкой полоски поверхности UPJ, которая находится между рядом его зубов и суставной площадкой для причленения epibranchiale 4. На уровне задней половины сочленовной доли epibranchiale 4 основная доля волокон m. transversus UPJ без заметной границы включается в состав sphincter oesophagii. Рострально половинки мускула контрлатеральных сторон головы рыбы сходятся на миосепте. Таким образом, область начала m. transversus UPJ расположена немного впереди и медиальнее места крепления m. transversus epibranchiale 4.
М. transversus pharyngobranchiale 2 (рис. 2б) – маленький мускул, который состоит из двух контрлатеральных половинок, сходящихся на миосепте. Он прикрепляется к дорсальной поверхности срединного участка pharyngobranchiale 2 каждой стороны головы рыбы и следует вперёд, располагаясь немного ниже и впереди рострального конца альвеолярного отростка UPJ. Иннервация осуществляется r. pharyngeus X2.
В области прикрепления к передней доле LPJ m. pharyngocleithralis externus (рис. 2а, 2в) от сфинктера пищевода обособляется крупный полый карман − глоточный мешок (saccus pharyngealis) (рис. 2). Сзади его волокна включаются в состав sphincter oesophagii, а впереди, где пространство мешка резко сужается, крепятся к верхнему краю киля LPJ и служат основой для вентрального сгустка ткани нёбного органа (см. выше). Глоточный мешок накладывается латерально на m. pharyngocleithralis externus. Внутри мешка обнаружено небольшое количество осадка. Внутренняя поверхность мешка лишена крупных ворсинок: её покрытие составляют многочисленные мельчайшие сосочки. У некоторых рассмотренных экземпляров мешок был надут и расправлен, а у других (рис. 2) − втянут с образованием складки.
М. saccus pharyngealis (рис. 2б) представляет собой дифференцированный мускульный поясок сфинктера пищевода, располагающийся на уровне впадения устья глоточного мешка в полость sphincter oesophagii. Направление волокон мускула отличается от такового и у мешка, и у sphincter oesophagii. Вентрально m. saccus pharyngealis прикрепляется к переднему краю pr. lateralis LPJ по соседству с рядом зубов. Его волокна следуют переднедорсально и ниже суставной площадки UPJ для причленения epibranchiale 4 включаются в состав волокон sphincter oesophagii в месте перехода последних в состав m. transversus UPJ.
Мm. рharyngealia (рис. 2б) – пучки мускульных волокон, связывающие LPJ с 4-й жаберной дугой. У изученных особей имеются один–три пучка. Сверху областью прикрепления являются медиальная поверхность дорсального отдела ceratobranchiale 4, рядом с участком крепления m. transversus ventralis 2 (рис. 2а), а также вентральная сторона шейки epibranchiale 4 в месте перехода последней в латеральное крыло. Снизу mm. рharyngealia получают крепление на верхнем крае киля LPJ ростральнее зоны отхождения m. pharyngocleithralis internus (рис. 2б, 2в). Вентрально, таким образом, волокна mm. рharyngealia частично переходят в состав тех волокон сфинктера пищевода, которые располагаются ростральнее глоточного мешка (см. выше). Медиальная поверхность передних из пучков mm. рharyngealia несёт слой ткани нёбного органа, который служит основанием для многочисленных крупных ворсинок.
M. rectus communis (рис. 2а, 4) – длинный тонкий мускульный тяж, соединяющий передний край pr. lateralis LPJ вентральнее отхождения его pr. muscularis с каудальным кончиком дорсального отростка urohyale. Мускул тянется вентрорострально, проходя латеральнее m. pharyngocleithralis externus и сердца рыбы, а затем медиальнее t. sternohyoideus. M. rectus communis имеет длинное конечное сухожилие, протяжённость которого достигает почти 1/2 длины целого мускула. Небольшого размера m. rectus ventralis 4 (рис. 2а) представляет собой вытянутый пучок, который тянется передневентрально от нижней поверхности срединной области ceratobranchiale 4. Его конечное сухожилие прикрепляется к заднему краю свободного конца аутогенного отростка hypobranchiale 3 (по: Konow, Sanford, 2008). По пути следования m. rectus ventralis 4 проходит в щели между m. transversus ventralis 2 и m. transversus ventralis 1, а затем латеральнее aorta ventralis. Уплощённый m. transversus ventralis 1 (рис. 2а) широко начинается с вентральной поверхности переднего участка ceratobranchiale 4 вблизи места сочленения с basibranchiale 4. Мускул тянется латеральнее m. transversus ventralis 2 и m. rectus ventralis 4. Вентрально m. transversus ventralis 1 крепится к tub. сarinae. Волокна мускула, таким образом, ориентированы переднедорсально.
От небольшого выступа наружной поверхности parasphenoideum, находящегося сразу же ниже костного гребня этой кости, вдоль которого тянется пучок ветвей n. vagus (X), в каудальном направлении тянется мощное, толстое и блестящее сухожилие туловищной мускулатуры − t. corpus muscularis (рис. 2). Оно проходит в непосредственной близости от верхнего края основной части UPJ, сочленяющейся с parasphenoideum. Позади t. corpus muscularis несколько расширяется и оканчивается на вытянутом дорсовентрально участке передней поверхности верхнего отдела cleithrum. Место прикрепления в небольшой степени снаружи прикрыто нижней долей supracleithrum.
M. geniohyoideus (рис. 3–5) начинается с наружной поверхности epihyale сразу же перед tub. epihyalis для прикрепления lig. interoperculo-epihyale. Также область отхождения включает заднюю половину боковой стороны ceratohyale и верхушки radii brachiostegii, причленяющиеся к гиоиду. Мускул содержит продольные миосепты, которые сильнее дифференцированы в нижней части m. geniohyoideus, придавая ей некоторую степень подразделённости на пучки. Среди этих миосепт ничем не выделяется сагиттальная миосепта − septa sagittalis. При взгляде снизу заметно, что m. geniohyoideus при помощи поперечной septa inferior формирует переднюю и заднюю части (pars anterior et posterior m. geniohyoideus). Однако septa inferior не имеет большой протяжённости и быстро исчезает, в связи с чем деление мускула в боковых отделах на переднюю и заднюю части не просматривается. M. geniohyoideus оканчивается на нижнем крае “ковша” dentale в области симфиза посредством короткого сухожильного участка. Это место прикрепления расположено сразу же под вентральным краем m. intermandibularis (рис. 3, 4) и связано с последним узким соединительнотканным промежутком. После удаления нижней челюсти становится заметно, что волокна этого конечного сухожильного участка m. geniohyoideus на dentale имеют поперечное размещение, противоположное ориентации позади расположенной части мускула. Кроме того, m. geniohyoideus формирует пару очень коротких, направленных продольно сухожилий (t. geniohyoideus), которые проходят непосредственно под m. intermandibularis. Т. geniohyoideus прикрепляются к задненижнему участку dentale по обе стороны от шва симфиза.
Рис. 5.
Схема расположения m. geniohyoideus ( ) и гиоида (
) и гиоида ( ) по отношению к другим составляющим нижнего отдела висцерального аппарата и плечевому
поясу рубиново-пепельной рыбы-попугая Scarus rubroviolaceus: gh − m. geniohyoideus, (···) – граница гиоида (ceratohyale), (←) – вектор сокращения
m. geniohyoideus; (→) − вектор сокращения m. sternohyoideus; (
) по отношению к другим составляющим нижнего отдела висцерального аппарата и плечевому
поясу рубиново-пепельной рыбы-попугая Scarus rubroviolaceus: gh − m. geniohyoideus, (···) – граница гиоида (ceratohyale), (←) – вектор сокращения
m. geniohyoideus; (→) − вектор сокращения m. sternohyoideus; (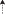 ) − суммарный вектор сокращения m. geniohyoideus + m. sternohyoideus; ост. обозначения
см. на рис. 2−4.
) − суммарный вектор сокращения m. geniohyoideus + m. sternohyoideus; ост. обозначения
см. на рис. 2−4.
M. sternohyoideus (рис. 2а, 3–5) начинается с передней поверхности нижней ветви cleitrum с каждой стороны головы рыбы. Мускул содержит несколько поперечных миосепт, число которых варьирует у разных особей. Область прикрепления на плечевом поясе у некоторых экземпляров вступает в контакт с местом окончания m. pharyngocleithralis externus. Нижний отдел m. sternohyoideus каудальнее одной из задних миосепт переходит в m. hypaxialis (рис. 4). Мускул включает две контрлатеральные половинки, которые впереди оканчиваются на обеих наружных сторонах серповидно изогнутого urohyale, находящегося в сагиттальной плоскости. Часть дорсомедиальных волокон m. sternohyoideus при помощи длинного t. sternohyoideus оканчивается на вентральном конце аутогенного отростка hypobranchiale 3. Источником данного сухожилия является одна из миосепт мускула.
ОБСУЖДЕНИЕ
На коралловых рифах основным кормом рубиново-пепельной рыбы-попугая служат маты эпилитических водорослей (~ 60% массы пищи) и известковые кораллиновые и некораллиновые водоросли (39%); на долю живых коралловых полипов приходится < 1% рациона (Ong, Holland, 2010). Таким образом, пища данного вида содержит значительное количество трудно усвояемого известкового осадка, который особи в ходе питания необходимо подвергать обширной обработке. Для осуществления этого процесса PJA рубиново-пепельной рыбы-попугая обладает комплексом анатомических адаптаций, свидетельствующих о глубокой специализации его конструкции в сравнении с другими представителями Labroidei. Трансформация висцерального аппарата также распространяется и на составляющие его вентрального отдела в области ротовой полости, что влечёт за собой изменения в механизме функционирования последней, подстраивая её под нужды работы PJA.
Особенности строения ротовой полости, работы m. geniohyoideus и m. sternohyoideus
В ротовой полости рубиново-пепельной рыбы-попугая имеется вертикально ориентированный костный киль, сформированный поднятием вверх срединных элементов жаберных дуг и языка рыбы. Киль подразделяет ротовую полость на левую и правую половины и несёт важные функции (см. ниже). Поскольку рубиново-пепельная рыба-попугай использует в качестве основного способа захвата пищи кусание, а не всасывание, она не нуждается в быстром и значительном расширении ротовой полости (Alfaro et al., 2001). Поэтому у неё исчезает lig. mandibulohyoideum, обеспечивающая прямую связь между нижней челюстью и гиоидом (Громова, Махотин, 2016). Следовательно, у данного вида потерян механизм высокоамплитудного открывания рта путём сокращения m. sternohyoideus. Неозубленный маленький язык рыбы – basihyale − специфическом образом потерял способность к протракции в процессе дыхания и питания, выполняет лишь ретракцию и поднятие вверх, не выходя при этом из углубления в ткани нёбного органа, которая заполняет “ковш” dentale и всегда пребывает под покровом нижнего ротового клапана. Для рубиново-пепельной рыбы-попугая достаточна небольшая степень расширения ротовой полости в её вентральном отделе, создаваемая посредством работы m. geniohyoideus и m. sternohyoideus.
При сокращении m. geniohyoideus смещение гиоида в переднем направлении относительно dentale практически сведено на нет маленьким interhyale, специфической дорсовентральной ориентацией гиоида относительно нижней челюсти и крайне коротким расстоянием между местом прикрепления m. geniohyoideus на dentale и передним краем гиоида (рис. 3–5). У более примитивных Teleostei при открывании рта гиоид оказывается в вентральном положении по отношению к нижней челюсти (Camp et al., 2009), тогда как у рубиново-пепельной рыбы-попугая его дорсальный конец сохраняет свою верхнюю позицию относительно dentale. Поэтому сокращение m. geniohyoideus будет лишь в небольшой степени поворачивать верхний конец гиоида назад и вверх, по часовой стрелке приподнимая киль жаберной решётки; ограничителем протяжённости этого движения служит lig. hyale11. После того, как lig. hyale натягивается, сокращение m. geniohyoideus начинает отводить половинки гиоидной дуги в стороны, осуществляя абдукцию суспензориумов рыбы. Степень отведения в латеральном направлении также контролируется lig. hyale (рис. 5). Кроме того, сокращение m. geniohyoideus может способствовать отведению нижней челюсти путём прижатия задненижнего края “ковша” dentale к anguloarticulare (Lauder, 1983с) при одновременной активности m. levator operculi.
Формирование обособленного t. sternohyoideus свидетельствует об увеличении степени дифференцировки апоневротического каркаса m. sternohyoideus, что может быть связано с возникновением нескольких очагов активности в пределах всей массы мускула, а также неоднородности силы сокращения в этих областях (Herring et al., 1979). Если активность проявляет мускул целиком, то в качестве итога происходит ретракция urohyale. Силовое сокращение m. sternohyoideus будет побуждать m. geniohyoideus играть роль пассивной связки, посредством которой m. sternohyoideus производит отведение половинок гиоидной дуги в стороны, расширяя ротовую полость (рис. 5). Мера этой абдукции вследствие ориентации гиоида относительно нижней челюсти не велика и контролируется натяжением lig. hyale. В ходе данного процесса происходит прижатие задненижнего края “ковша” dentale к anguloarticulare обеих сторон головы, которое опосредованно может вкладываться в небольшую степень опускания вниз нижней челюсти. Итогом одновременного сокращения m. geniohyoideus и m. sternohyoideus является смещение языка рыбы вверх и назад, что создаёт характерную форму дорсального киля жаберной решётки рубиново-пепельной рыбы-попугая. Подобное совместное сокращение m. geniohyoideus и m. sternohyoideus конвергентно использует в процессе питания и серебряная аравана Osteoglossum bicirrhosum − значительно более примитивный вид Teleostei (Нельсон, 2009), однако оно имеет иное назначение – осуществление внутриротовой обработки добычи языком рыбы, выполняя её укус зубами, сидящими на basihyale напротив зубов ectopterygoideum, entopterygoideu и dermopalatinum (Громова и др., 2017).
Роль нёбного органа и сфинктера пищевода в функционировании PJA
На основании исследованного морфологического материала мы можем заключить, что рубиново-пепельная рыба-попугай обладает подушкой хорошо развитого нёбного органа, участвующего в формировании переднего отдела PJA (рис. 2). В пользу этого свидетельствует иннервация этого образования r. pharyngeus Х1 и Х2. Наличие описываемой структуры у рубиново-пепельной рыбы-попугая конвергентно сходно с таковой у донных представителей карповых (Cyprinidae) и чукучановых (Catostomidae) (Doosey, Bart, 2011), а также у белого толстолобика Hypophthalmichthys molitrix (Gromova, Makhotin, 2018). Стоит отметить, что у некоторых видов ушастых окуней (Centrarchidae) между m. obliquus dorsalis 2 и m. transversus dorsalis anterior обнаружено небольшое уплотнение из фиброзной ткани (Lauder, 1983b), однако несравнимо менее развитое, чем нёбный орган у исследуемого нами вида. У рубиново-пепельной рыбы-попугая находящийся позади нёбного органа разросшийся сфинктер пищевода формирует уникально дифференцированные разнообразные мышечные структуры, играющие важную роль в работе PJA. В их числе m. transversus epibranchiale 4, m. transversus UPJ и m. transversus pharyngobranchiale 2 внедряются в ткань нёбного органа, создавая его мускульный каркас и способствуя осуществлению его движений. Среди этих трёх мышц самое обширное вторичное изменение своего места прикрепления относительно исходного состояния, которое присуще неспециализированным окунеобразным (Lauder, 1983a, 1983b), демонстрирует m. transversus epibranchiale 4, связанный с epibranchiale 4, но иннервируемый r. pharyngeus Х1.
Функционирование нёбного органа у рубиново-пепельной рыбы попугая включает в себя перистальтику его вентральной поверхности, а также сжатие и расслабление всего органа. За движения перистальтики в основном ответственна огромная масса волокон m. transversus UPJ. Поджимание целиком всего органа вверх выполняет m. levator internus 1. Потребность во вкусовом анализе и сегрегации съедобного и несъедобного материала, поступающего в перемалывающий механизм зубов PJA, обусловливает необходимость плотного прилегания нижней поверхности подушки нёбного органа к верхней поверхности фрагментов заднеязычного органа (Sibbing, Uribe, 1985), а также к сомкнутым рядам жаберных тычинок прилегающих элементов жаберных дуг, на которых задерживается корм. Поэтому дно ротовой полости в районе перехода её в глоточную часть приподнимается навстречу нёбному органу путём сокращения сильно развитых mm. adductores 1−4, выполняющих приведение ceratobranchialia 1−4 соответственно к epibranchialia 1−4. Эти мускулы не имеют отношения к опусканию нёбного органа, что противоречит мнению Гобалета (Gobalet, 1989). Кроме того, эффективной работе нёбного органа способствует повышение концентрации фрагментов корма в области устья пищевода. Такое направленное скопление пищи в заднем отделе ротовой полости становится возможным благодаря особому строению висцерального черепа рубиново-пепельной рыбы-попугая, конструкция которого обладает морфологическими приспособлениями, отвечающими потребностям взаимосвязанных процессов дыхания и питания, несущих признаки специализации. Раскроем вышесказанное более подробно.
Как у многих Teleostei, использующих кусание в качестве основного способа кормодобывания, голова рубиново-пепельной рыбы-попугая сжата с боков для достижения максимальной нагрузки, прикладываемой к небольшой поверхности субстрата в ходе укуса (Grubich et al., 2012). В связи с этим пространства ротовой и жаберной полостей узки и обладают ограниченным объёмом. Кроме того, сокращение пространства жаберной полости происходит вследствие гипертрофии мускулов PJA, что также является причиной исчезновения жаберной щели между жаберными дугами 4 и 5, присутствия двойного набора жаберных лепестков только на первых трёх жаберных дугах и специфического расположения hemibranchia 4. Поэтому мы предполагаем, что рубиново-пепельная рыба-попугай может испытывать некоторые трудности в исполнении процесса газообмена должным образом, необходимым для обеспечения нормального функционирования организма животного, в сравнении с более генерализованными представителями окунеобразных. Преодолению этой проблемы способствует поведение рыб данного вида. Если многие донные представители карповых и сомовых (Siluridae), поедающие бентос, демонстрируют незначительную скорость плавания (Schulz, Berg, 1987; Hoogenboezem et al., 1992), то рубиново-пепельная рыба-попугай является довольно подвижным видом (Korsmeyer et al., 2002; Kendall et al., 2007). Процесс её питания включает в себя серии коротких укусов кормового субстрата, которые перемежаются с периодами быстрого передвижения рыбы с открытым ртом в поисках другого источника пищи (Clements, Bellwood, 1988; Alfaro et al., 2001). По-видимому, поддержание ротовой полости в распахнутом положении способствует более активному омыванию жаберных лепестков за счёт создания эффекта таранной вентиляции жабр (Brown, Muir, 1970). Задняя половина operculum, а также suboperculum и interoperculum – мягкие и тонкие кости, поэтому жаберная крышка в процессе дыхания у данного вида не может создавать такие значительные перепады давления между ротовой и оперкулярной полостями, какие присущи хищным рыбам, захватывающим добычу путём всасывания, например обыкновенному окуню Perca fluviatilis (Osse, 1969). Позади киля дно жаберной решётки специфическим образом сильно опущено вниз и вогнуто дорсально, образуя ложе, которое заполняет подушка нёбного органа. Киль способствует формированию позади себя в ротовой полости гидроциклонических эффектов в быстрых водных потоках, устремляющихся через рот животного. Узкое пространство ротовой полости помогает поддерживать движение таким способом создаваемого турбулентного потока в каудальном направлении, что обеспечивает перенос и накопление захваченных передними челюстями фрагментов корма под нёбный орган, к устью пищевода, во время периодов поиска корма животным. Описанная конструкция внутреннего пространства ротовой полости способствует тому, что основной вклад в процесс газообмена привносят жаберные лепестки, сидящие на ceratobranchialia 1−3, которые находятся по обе стороны от киля, и вентральная часть hemibranchia 4. Помимо этого у рубиново-пепельной рыбы-попугая имеется сильно развитая pseudobranchia, у которой, по-видимому, процесс усвоения кислорода преобладает над cекреторной функцией. Можно заключить, что аппараты питания белого толстолобика и рубиново-пепельной рыбы-попугая имеют анатомические приспособления, формируемые за счёт разных структур висцерального черепа, но дающие сходный функциональный результат – создание в ротовой полости животного зон турбулентности водного потока, необходимых для скопления корма в определённых её областях. Наибольшего расцвета этот механизм достигает у рыб, питающихся путём фильтрации перекрёстным потоком (Махотин, Громова, 2019).
Для эффективной обработки насыщенной карбонатом кальция пищи строение переднего отдела пищевода рубиново-пепельной рыбы-попугая уникальным образом изменилось относительно его устройства, характерного для неспециализированных окунеобразных (Lauder, 1983a, 1983b): сформировалась система взаимосвязанных друг с другом мускульных камер переменного объёма, впереди сообщающаяся с ротовой полостью. Вследствие этого процесс измельчения корма до консистенции, подходящей для отправки в кишечник рыбы, напоминает способ механической обработки еды в многокамерном желудке жвачных травоядных животных (Hofmann, 1989), который включает в себя попеременное заглатывание и отрыгивание съеденной пищи посредством ротовой полости. Развитие подобного механизма питания привело к исчезновению у рубиново-пепельной рыбы-попугая настоящего желудка, чьи функции перешли к сфинктеру пищевода, работающего в тесном взаимодействии с остальными составляющими PJA (Chao, 1973). Зубы UPJ и LPJ у исследованного нами вида также конвергентно напоминают те, что присущи жвачным травоядным, в упрощённом варианте (Lister, 1996; Ungar, 2015).
Перед тем как кусочки кормового субстрата из ротовой полости попадают в щель между озубленными поверхностями UPJ и LPJ, они оказываются под подушкой нёбного органа путём расслабления глоточного клапана, расположенного на переднем крае PJA. Основой глоточного клапана служит m. transversus epibranchiale 4, сокращение которого в случае необходимости обеспечивает перекрывание и таким образом обособление пространства, находящегося под нёбным органом, в случае одновременного сжатия мускульных волокон передней части sphincter oesophagii. Однако “соскребать” проглоченный рыбой корм в каудальном направлении m. transversus epibranchiale 4, как указывают некоторые авторы (Board, 1956; Clements et al., 2016), не способен. Борд (Board, 1956) сообщает, что в основе предполагаемых им соскребательных движений нёбного органа лежат перемещения несущей его UPJ относительно нижних отделов жаберной решётки. Однако в процессе перетирания пищи UPJ изменение своего местоположения вперёд−назад осуществляет вместе со связанными с ним epibranchialia 1–4 и ceratobranchialia 1−4. Борд (Board, 1956) же для процесса “соскребания” предполагает неподвижность ceratobranchialia 1−4 относительно epibranchialia 1–4, что в реальности привело бы к деформации и поломке конструкции жаберного аппарата. Проникновение корма на зубы PJA обеспечивается иным способом: происходит расширение сжатой до этого полости sphincter oesophagii и пища с током воды устремляется из-под пространства под нёбным органом в каудальном направлении в область пониженного давления. Данному процессу помогает также и расширение глоточных мешков, которые могут работать в качестве насоса. При этом они способны накапливать в себе порции ещё не перемолотой зубами PJA пищи или же перетёртую кормовую смесь на разных стадиях обработки. Такое становится возможным благодаря сокращению m. saccus pharyngealis, которое отделяет полость мешка от полости sphincter oesophagii, а также mm. рharyngealia, отделяющих полость мешка от камеры под подушкой нёбного органа. Если m. saccus pharyngealis и mm. рharyngealia сократятся одновременно, это приведёт к обособлению глоточного мешка и от полости sphincter oesophagii, и от полости под нёбным органом. Глоточный мешок одной стороны головы может сократиться, тогда как мешок другой стороны головы оставаться растянутым. В результате этого обеспечивается равномерное распределение обрабатываемой смеси по всей поверхности между зубами LPJ и UPJ без образования нежелательных сгустков на её левом или правом участке относительно контрлатерального22. В процессе перетирания корма зубами PJA рубиново-пепельная рыба-попугай время от времени подсасывает вперёд (т.е. отрыгивает) под нёбный орган выработанную смесь съедобных и несъедобных компонентов для анализа на предмет достаточности степени их обработки. Для этого под нёбным органом формируется область пониженного давления следующим образом. Сначала происходит плотное прижатие дна жаберной решётки к вентральной поверхности подушки органа и сокращение m. transversus epibranchiale 4, перекрывающее связь с ротовой полостью. После этого рыба быстро опускает вниз вентральную часть аппарата жаберных дуг, располагающуюся под нёбным органом, за счёт сокращения волокон задней области m. sternohyoideus (но не всего мускула), подтягивающих вниз центральную ось жаберной решётки за аутогенный отросток hypobranchiale 3; это действие происходит одновременно с сокращением m. pharyngocleithralis externus et internus. Тонкие аспекты приложения силы к описываемому отделу жаберной решётки помогает контролировать также работа m. rectus ventralis 4, который передаёт своё влияние через аутогенный отросток hypobranchiale 3. В ходе данного процесса наличие lig. hypobranchiale 3 способствует поддержанию специализированной формы киля.
Описываемые события, т.е. переход обрабатываемой кормовой смеси из-под зубов PJA в sphincter oesophagii, в глоточный мешок или под нёбный орган и обратно, могут выполняться рыбой многократно. Когда она, наконец, примет решение об окончании процесса пережёвывания пищи, просвет пищевода позади сфинктера расширится и корм с током воды покинет PJA. Таким образом, подобный автономный круговорот обрабатываемой пищи в пределах взаимосвязанных камер PJA за счёт наличия глоточного клапана может происходить без какого-либо контакта с ротовой полостью рыбы. При необходимости, однако, корм может проникнуть из PJA и обратно в ротовую полость, например, при случайном проглатывании нежелательного трудно пережёвываемого объекта. Для выполнения этой процедуры животное сначала с закрытым ртом с силой приводит в действие суспензориумы при помощи мощных m. adductor arcus palatini каждой стороны головы, изгоняя воду из ротовой и жаберной полостей. Затем происходит прижатие жаберных крышек m. adductor operculi и отведение суспензориумов силовым сокращением m. geniohyoideus, m. sternohyoideus и частично m. levator arcus palatini. После этих действий давление в ротовой полости рыбы становится меньше, чем в камере под нёбным органом, создавая ток воды из неё в ростральном направлении. Рот открывается, а вновь сокращающиеся m. adductor arcus palatini отправляют нежелательный объект во внешнюю среду (Махотин, Громова, 2019).
Регулирование перемещений LPJ в процессе обработки корма PJA
В то время как у большинства групп Euteleostei PJA вовлечён только в процесс глотания добычи, виды попугаевых обнаруживают уникальные структурные и функциональные инновации PJA, которые дают им возможность пережёвывать трудно обрабатываемую пищу (Claes, Vree, 1991). У рубиново-пепельной рыбы-попугая перемещения сравнительно подвижной LPJ относительно UPJ динамически контролируются многочисленными мускулами, осуществляющими связь LPJ с нейрокраниумом, остальными отделами жаберной решётки и плечевым поясом. В противоположность данной ситуации у более генерализованных окунеобразных ведущие движения в пределах PJA исходят со стороны UPJ, тогда как LPJ более ограничена в своих перемещениях (Wainwright, 2005). Мускульная поддержка UPJ рубиново-пепельной рыбы-попугая значительно беднее таковой LPJ: она обеспечивает небольшие переднезадние сдвиги UPJ по гладкой вентральной стороне parasphenoideum, конвергентно напоминающие те, что совершает в ходе протракции верхняя челюсть осетровых рыб (Acipenseridae) (Цессарский, 1993). Специфическое строение нижней сочленовной области нейрокраниума, которая включает в себя сагиттальный cr. ventralis parasphenoideum, переходящий в поперечно ориентированную сочленовную поверхность, одновременно служит увеличению площади плотного устойчивого прилегания к ней передней мягкой альвеолярной части UPJ, а также способствует поддержанию стабильной направленности движений заднего отдела кости. Киль LPJ рубиново-пепельной рыбы-попугая служит механически эффективным плечом рычага данного элемента, выгодным местом крепления нескольких мускулов, регулирующих его перемещения. Для осуществления упомянутого выше контроля движений LPJ мышцы PJA видоизменяют такие свои характеристики, как внутреннее строение, масса и место прикрепления. Кроме того, управление перемещениями LPJ напрямую выполняют костные структуры, не относящиеся к висцеральному черепу − плечевой пояс рыбы. Рассмотрим вышесказанное более подробно.
1. Среди набора разнообразных мышц, регулирующих перемещения LPJ, своим внушительным размером и сложностью апоневротического каркаса выделяется комплекс, включающий взаимосвязанные друг с другом m. levator externus 4, m. levator posterior и m. adductor 5, которые таким образом играют роль трёх порций единого cложноперистого “сверхмускула”. Подобное вторичное слияние ранее обособленных у менее специализированных окунеобразных мышц направлено на увеличение эффективности работы PJA: путём повышения силы укуса LPJ относительно UPJ, а также посредством создания условий более тонкого контроля движений LPJ, поскольку разные области “сверхмускула” сокращаются независимо друг от друга, в сумме давая новые результаты, ранее недоступные его отдельным составляющим (Herring et al., 1979; Luca, Merletti, 1988; Koh, Grabiner, 1992). Об использовании такой дифференцированной регулировки приложения силы к LPJ со стороны этого мускульного комплекса свидетельствует скопление на поверхности LPJ наборов многочисленных одиночных конечных сухожилий, формирующих более крупные многочленные образования с трудно различимыми границами. Стоит отметить, что у менее специализированных окунеобразных, таких как морские ворчуны (Haemulidae), сокращение m. levator externus 3−4 и m. levator posterior будет приводить не к поднятию, а к опусканию элементов UPJ, которые давят сверху на LPJ (Wainwright, 1989).
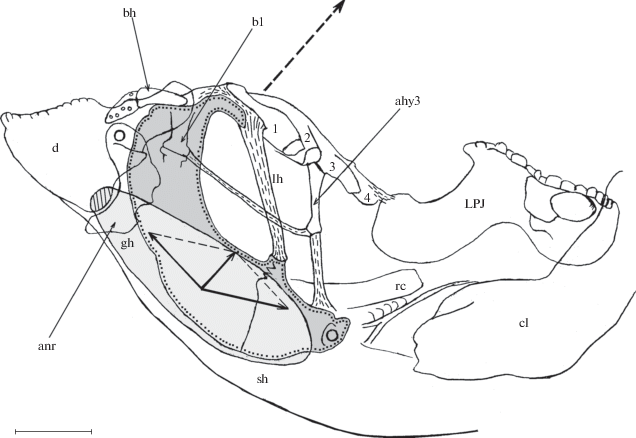
2. Epibranchiale 4 рубиново-пепельной рыбы-попугая является ключевым элементом, осуществляющим передачу силы на LPJ не только со стороны нейрокраниума, но и при участии UPJ (Bellwood, 1986). Плоский сустав не ограничивает смещения сочленовной части epibranchiale 4 в переднезаднем направлении и в малой степени медиально, относительно UPJ. Широкая свобода движений костного элемента, которую предоставляет сустав этой категории, в условиях прикрепления к нему таких силовых мускулов, как m. levator posterior pars lateralis, m. adductor 5 и часть m. levator externus 4, казалось бы, должна способствовать поломке механизма PJA; однако же этого не происходит благодаря наличию вышеупомянутой дифференцированной мускульной регулировки движений, составляющих PJA, в том числе и еpibranchiale 4. В частности, при взаимодействии m. levator posterior pars lateralis и m. adductor 5 epibranchiale 4 играет функцию механического блока, позволяющего регулировать силу, которую LPJ прикладывает к UPJ (рис. 6). Два антагониста небольшого размера − m. obliquus dorsalis 4 и m. transversus dorsalis posterior – благодаря своей специфической ориентации посредством epibranchiale 4 в значительной степени влияют на направление оказываемой силы LPJ по отношению к UPJ, что важно для осуществления процесса перетирания корма. При совместном сокращении m. adductor 5 и m. obliquus dorsalis 4 суммарный вектор давления, который LPJ прикладывает к UPJ, будет иметь больший рострально направленный компонент, нежели при сокращении m. levator externus 4. Подобное можно констатировать и для суммарного заднедорсального вектора сокращения m. adductor 5 и m. transversus dorsalis posterior: он эффективнее будет прижимать LPJ к UPJ в каудальном направлении в сравнении с m. levator posterior. О таких результатах совместного сокращения m. adductor 5 и m. obliquus dorsalis 4/m. transversus dorsalis posterior свидетельствует характерное веерообразное устройство его внутренней апоневротической конструкции. Значение этих двух итоговых векторов заключается также и в том, что их присутствие наряду с сокращением других мускулов, связанных с LPJ, которые осуществляют его протракцию (например, m. rectus communis) или ретракцию (например, m. pharyngocleithralis internus), в сумме даст более выгодное приложение вектора тяги к LPJ в нужном направлении (соответственно вперёд или назад) и значительно повысит её эффективность. Протракция LPJ будет способствовать увеличению высоты киля жаберной решётки.
Рис. 6.
Схема приложения сил нижней глоточной челюсти (LPJ) к верхней (UPJ) при совместном сокращении пары m. adductor 5 и m. obliquus dorsalis 4 и пары m. adductor 5 и m. transversus dorsalis posterior рубиново-пепельной рыбы-попугая Scarus rubroviolaceus, полученная в результате суммации векторов мускулов по правилу паралеллограмма; UPJ и LPJ находятся в воспроизведённом “рабочем” положении; UPJ представлено в сочленении с нейрокраниумом рыбы. 1 – суммарный вектор сокращения m. adductor 5 и m. obliquus dorsalis 4; 2 − суммарный вектор сокращения m. adductor 5 и m. transversus dorsalis posterior, epi4 – epibranchiale 4; ост. обозначения см. на рис. 2.
3. Формирование плоского сустава LPJ с cleithrum является одним из вспомогательных средств, способствующих осуществлению многократно повторяемых силовых однотипных движений LPJ в ходе обработки корма. В этих условиях плечевой пояс выступает в качестве опоры (Liem, Greenwood, 1981); подобное сочленение с той же ролью имеется в PJA у растительноядного тупорылого полурыла Arrhamphus sclerolepis (Tibbetts, Carseldine, 2003). Характер сустава свидетельствует, что в процессе пережёвывания пищи LPJ рубиново-пепельной рыбы-попугая не производит высоко амплитудных перемещений относительно cleithrum, которые необходимы ceratobranchiale 5 хищных, менее специализированных окунеобразных, таких как обыкновенный окунь (Osse, 1969) или судак Stizostedion lucioperca (Elshoud-Oldenhave, 1979), поскольку размер подвижной вырывающейся из ротовой полости добычи таких охотников может сильно варьировать. В этом случае сустав был бы укреплён, однако у рубиново-пепельной рыбы-попугая он не поддержан связками и не имеет синовиальной сумки. Смещение LPJ вверх и вперёд происходит во время приведения половинок cleithrum друг к другу в том же направлении, в сторону затылочного отдела черепа, путём сокращения m. levator pectoralis и порций туловищной мускулатуры, тянущихся от нейрокраниума к cleithrum и supracleithrum. О значительной силе аддукции плечевого пояса, развиваемой в ходе этого движения, свидетельствует наличие мощного t. corpus muscularis. Обратное перемещение cleithrum вниз и назад обусловлено сокращением мышц живота, крепящихся к области симфиза двух половинок плечевого пояса, а также m. hypaxialis, устремляющейся в каудальном направлении от нижней ветви cleithrum. В этих условиях прилеганию сочленовных поверхностей сустава LPJ и cleitrum друг к другу способствует активность m. pharyngocleithralis externus и internus. Степень отведения плечевого пояса у менее специализированных окунеобразных контролируется lig. baudeloti (Osse, 1969), а у рубиново-пепельной рыбы попугая эту функцию берёт на себя t. corpus muscularis.
ЗАКЛЮЧЕНИЕ
Изучение строения и механизма функционирования PJA рубиново-пепельной рыбы-попугая вносит вклад в понимание особенностей экологии и поведения данного вида семейства Scaridae. PJA рубиново-пепельной рыбы-попугая демонстрирует высокую степень автономности своей активности относительно работы аппарата передних челюстей. Увеличение степени участия PJA в обработке корма привело к вторичному упрощению строения пищеварительного тракта у данного вида – отсутствию желудка. PJA у рубиново-пепельной рыбы-попугая является комплексной системой, функционирование которой обеспечивают специализированные костные элементы жаберных дуг и нёбный орган, обслуживаемые видоизменёнными мускульными структурами, среди которых своим сложным устройством выделяется сфинктер пищевода. Последний формирует сложную систему камер переменного объёма, взаимосвязь которых способствует тщательному перетиранию пищи глоточными зубами; циклы такой обработки могут многократно повторяться. Ротовая полость рыбы демонстрирует адаптацию к сопряжению процессов дыхания и питания. Наличие нёбного органа, которым также конвергентно обладают представители карпообразных (Сypriniformes), связано с характером потребляемого корма рубиново-пепельной рыбой-попугаем, насыщенного карбонатом кальция, и функциональными особенностями способа обработки корма во рту изучаемого вида. Исследованы и проиллюстрированы оригинальными рисунками детали крепления мускулов, обслуживающих нёбный орган, а также уточнена их иннервация. В процессе питания язык рубиново-пепельной рыбы-попугая конвергетно осуществляет перемещения, используемые также для внутриротовой обработки добычи гораздо более примитивным видом − серебряной араваной.
Список литературы
Громова Е.С., Махотин В.В. 2016. Функциональная морфология висцерального аппарата семги Salmo salar (Salmonidae) // Вопр. ихтиологии. Т. 56. № 4. С. 410–426.
Громова Е.С., Дзержинский Ф.Я., Махотин В.В. 2017. Морфофункциональные особенности висцерального аппарата серебряной араваны Osteoglossum bicirrhosum (Osteoglossidae) // Там же. Т. 57. № 4. С. 379–392.
Дзержинский Ф.Я. 2005. Сравнительная анатомия позвоночных животных. М.: Аспект Пресс, 303 с.
Махотин В.В., Громова Е.С. 2019. Детали строения скелета, мышц и соединительнотканных элементов головы белого толстолобика Hypophthalmichthys molitrix (Cyprinidae) в связи с особенностями функционирования его висцерального аппарата // Вопр. ихтиологии. Т. 59. № 1. С. 3−27.
Нельсон Д.С. 2009. Рыбы мировой фауны. М.: Либроком, 880 с.
Ромейс Б. 1953. Микроскопическая техника. М.: Изд-во иностр. лит-ры, 718 с.
Цессарский А.А. 1993. Морфология и эволюция черепа осетрообразных: Автореф. дис. … канд. биол. наук. М.: ИЭМЭЖ РАН, 28 с.
Alfaro M., Westneat M.W. 1999. Motor patterns of herbivorous feeding: electromyographic analysis of biting in the parrotfishes Cetoscarus bicolor and Scarus iseri // Brain Behav. Evol. V. 54. P. 205−222.
Alfaro M., Janovetz J., Westneat M.W. 2001. Motor control across trophic strategies: muscle activity of biting and suction feeding fishes // Amer. Zool. V. 41. P. 1266−1279.
Alwany M.A., Thaler E., Stachowitsch M. 2009. Parrotfish bioerosion on Egyptian Red Sea reefs // J. Exp. Mar. Biol. Ecol. V. 371. P. 170–176.
Anker G.Ch. 1978. The morphology of the head-muscles of a generalized Haplochromis species: H. elegans Trewavas 1933 (Pisces, Cichlidae) // Netherl. J. Zool. V. 28. № 2. P. 234–271.
Barel C.D.N., Witte F., Van Oijen M.J.P. 1976. The shape of the skeletal elements in the head of a generalized Haplochromis species: H. elegans Trewavas 1933 (Pisces, Cichlidae) // Ibid. V. 26. № 2. P. 163–265.
Bellwood D.R. 1986. The functional morphology, systematics and behavioural ecology of parrotfihes (family Scaridae): Ph. D.Thesis. N. Queensland, Townsville: James Cook Univ., 489 p.
Bellwood D.R. 1994. A phylogenetic study of the parrotfishes family Scaridae (Pisces: Labroidei), with a revision of genera. Sydney: Austral. Mus., 86 p.
Bellwood D.R. 1996. Production and reworking of sediment by parrotfishes (family Scaridae) on the Great Barrier Reef, Australia // Mar. Biol. V. 125. P. 795–800.
Board P.A. 1956. The feeding mechanism of the fish Sparisoma cretense // Proc. Zool. Soc. London. V. 127. № 1. P. 59−77.
Bonaldo R.M., Bellwood D.R. 2008. Size-dependent variation in the functional role of the parrotfish Scarus rivulatus on the Great Barrier Reef, Australia // Mar. Ecol. Progr. Ser. V. 360. P. 237–244.
Bonaldo R.M., Krajewski J.P., Bellwood D.R. 2011. Relative impact of parrotfish grazing scars on massive Porites corals at Lizard island, Great Barrier Reef // Ibid. V. 423. P. 223–233.
Bonaldo R.M., Hoey A.S., Bellwood D.R. 2014. The ecosystem roles of parrotfishes on tropical reefs // Ocean. Mar. Biol. Ann. Rev. V. 52. P. 81–132.
Brock R.E. 1979. An experimental study on the effects of grazing by parrotfishes and role of refuges in benthic community structure // Mar. Biol. V. 51. P. 381–388.
Brown E., Muir B.S. 1970. Analysis of ram ventilation of fish gills with application to skipjack tuna (Katsuwonus pelamis) // J. Fish. Res. Board Can. V. 27. № 9. P. 1637–1652.
Bruggemann J.H., Van Kessel A.M., Van Rooij J.M., Breeman A.M. 1996. Bioerosion and sediment ingestion by the Caribbean parrotfish Scarus vetula and Sparisoma viride: implications of fish size, feeding mode and habitat use // Mar. Ecol. Progr. Ser. V. 134. P. 59 –71.
Camp A.L., Konow N., Sanford C.J. 2009. Functional morphology and biomechanics of the tongue-bite apparatus in salmonid and osteoglossomorph fishes // J. Anat. V. 214. P. 717−728.
Carr A., Tibbetts I.R., Kemp A., Truss R., Drennan J. 2006. Inferring parrotfish (Teleostei: Scaridae) pharyngeal mill function from dental morphology, wear, and microstructure // J. Morphol. V. 267. P. 1147–1156.
Cernohorsky N.H., McClanahan T.R., Babu I., Horsak M. 2015. Small herbivores suppress algal accumulation on Agatti atoll, Indian Ocean // Coral Reefs. V. 34. № 4. P. 1023–1035. https://doi.org/10.1007/s00338-015-1331-x
Chao L.N. 1973. Digestive system and feeding habits of the cunner, Tautogolabrus adspersus, a stomachless fish // Fish. Bull. V. 71. № 2. P. 565–586.
Chen Po-Yu, Schirer J., Simpson A. et al. 2012. Predation versus protection: fish teeth and scales evaluated by nanoindentation // J. Mater. Res. V. 27. № 1. P. 100–112.
Claes G., Vree F. 1991. Kinematics of the pharyngeal jaws during feeding in Oreochromis niloticus (Pisces, Perciformes) // J. Morphol. V. 208. P. 227−245.
Clements K.D., Bellwood D.R. 1988. A comparison of the feeding mechanisms of two herbivorous labroid fishes, the temperate Odax pullus and the tropical Scarus rubroviolaceus // Austal. J. Mar. Freshw. Res. V. 39. P. 87–107.
Clements K.D., German D.P., Piche J. et al. 2016. Integrating ecological roles and trophic diversification on coral reefs: multiple lines of evidence identify parrotfishes as microphages // Biol. J. Linn. Soc. V. 120. № 4. P. 729–751.
Cole F.J. 1898. Observations on the structure and morphology of the cranial nerves and lateral sense organs of fishes; with special reference to the genus Gadus // Trans. Linn. Soc. Zool. Ser. 2. V. 7. № 5. P. 17–221.
Delsman H.C. 1925. Fishes with protrusile mouths // Treubia. V. 6. № 2. P. 98–106.
Doosey M.H., Bart H.L. Jr. 2011. Morphological variation of the palatal organ and chewing pad of catostomidae (Teleostei: Cypriniformes) // J. Morphol. V. 272. P. 1092–1108.
Dromard C., Bouchon-Navaro Y., Harmelin-Vivien M., Bouchon C. 2013. Diversity of trophic niches among Scaridae (Guadeloupe, Lesser Antilles) // Proc. Gulf Caribb. Fish. Inst. V. 66. P. 259–265.
Drucker E.G., Jensen J.S. 1991. Functional analysis of a specialized prey processing behavior: winnowing by surfperches (Teleostei: Embiotocidae) // J. Morphol. V. 210. P. 267–287.
Elshoud-Oldenhave M.J.W. 1979. Prey capture in the pike-perch, Stizostedion lucioperca (Teleostei, Percidae): a structural and functional analysis // Zoomorphol. V. 93. P. 1−32.
Francini-Filho R.B., Moura R.L., Ferreira C.M., Coni E.O.C. 2008. Live coral predation by parrotfishes (Perciformes: Scaridae) in the Abrolhos Bank, eastern Brazil, with comments on the classification of species into functional groups // Neotrop. Ichthyol. V. 6. № 2. P. 191–200.
Gierse V.A. 1904. Untersuchungen über das Gehirn und die Kopfnerven von Cyclothone acclinidens // J. Morphol. V. 32. P. 602–686.
Gobalet K.W. 1989. Morphology of the parrotfish pharyngeal jaw apparatus // Amer. Zool. V. 29. P. 319−331.
Goedel W. 1974. A contribution to the comparative and functional anatomy of the head of Tilapia (Cichlidae, Teleostei) // Zool. Jb. Anat. V. 92. P. 220–274.
Graaf P.J.F. 1990. Innervation pattern of the gill arches and gills of the carp (Cyprinus carpio) // J. Morphol. V. 206. P. 71–78.
Green A.L., Bellwood D.R. 2009. Monitoring functional groups of herbivorous reef fishes as indicators of coral reef resilience. A practical guide for coral reef managers in the Asia Pacific region. Gland, Switzerland: IUCN, 70 p.
Gromova E.S., Makhotin V.V. 2018. Maxillary apparatus in feeding of the silver carp Hypophthalmichthys molitrix (Cyprinidae) // J. Ichthyol. V. 58. № 6. P. 857−877.
Grubich J.R., Huskey S., Crofts S. et al. 2012. Mega-bites: extreme jaw forces of living and extinct piranhas (Serrasalmidae) // Sci. Rept. V. 2. № 1009. P. 1–9.
Handrick V.K. 1901. Zur Kenntnis des Nervensystems und der Leuchtorgane des Argyropelecus hemigymnus // Zoologica. № 32. P. 1–68.
Harrison G. 1981. The cranial nerves of the teleost Trichiurus lepturus // J. Morphol. V. 167. P. 119–134.
Herrick C.J. 1899. The cranial and first spinal nerves of Menidia; a contribution upon the nerve components of the bony fishes // J. Comp. Neurol. V. 9. № 1. P. 419–455.
Herring S.W., Grimm A.F., Grimm B.R. 1979. Functional heterogeneity in a multipinnate muscle // Amer. J. Anat. V. 154. № 4. P. 563−576.
Hofmann R.R. 1989. Evolutionary steps of ecophysiological adaptation and diversification of ruminants: a comparative view of their digestive system // Oecologia. V. 78. P. 443–457.
Hoogenboezem W., Lammens E.H.R., Vugt Y., Osse J.W.M. 1992. A model for switching between particulate-feeding and filter-feeding in the common bream, Abramis brama // Environ. Biol. Fish. V. 33. P. 13–21.
Howard K.G., Claisse J.T., Clark T.B. et al. 2013. Home range and movement patterns of the Redlip Parrotfish (Scarus rubroviolaceus) in Hawaii // Mar. Biol. V. 160. P. 1583–1595.
Kaufman L.S., Liem K.F. 1982. Fishes of the suborder Labroidei (Pisces: Perciformes): phylogeny, ecology, and evolutionary significance // Breviora. Mus. Comp. Zool. № 472. P. 1–19.
Kendall J.L., Lucey K.S., Jones E.A. et al. 2007. Mechanical and energetic factors underlying gait transitions in bluegill sunfish (Lepomis macrochirus) // J. Exp. Biol. V. 210. P. 4265–4271.
Kobelkowsky A. 2013. Morphology and dissection technique of the kidney of the grey snapper Lutjanus griseus (Teleostei: Lutjanidae) // Int. J. Morphol. V. 31. № 2. P. 553−561.
Koh T.J., Grabiner M.D. 1992. Cross talk in surface electromyograms of human hamstring muscles // J. Orthop. Res. V. 10. P. 701–709.
Konow N., Sanford C.P.J., 2008. Biomechanics of a convergently derived prey-processing mechanism in fishes: evidence from comparative tongue bite apparatus morphology and raking kinematics // J. Exp. Biol. V. 211. P. 3378−3391.
Korsmeyer K.E., Steffensen J.F., Herskin J. 2002. Energetics of median and paired fin swimming, body and caudal fin swimming, and gait transition in parrotfish (Scarus schlegeli) and triggerfish (Rhinecanthus aculeatus) // Ibid. V. 205. P. 1253–1263.
Lauder G.V. 1983a. Functional design and evolution of the pharyngeal jaw apparatus in euteleostean fishes // Zool. J. Linn. Soc. V. 77. P. 1−38.
Lauder G.V. 1983b. Functional and morphological bases of trophic specialization in sunfishes (Teleostei, Centrarchidae) // J. Morphol. V. 178. P. 1−21.
Lauder G.V. 1983c. Food capture // Fish biomechanics / Eds. Webb P.W., Weihs D. N.Y.: Praeger. P. 280−311.
Liao Y.-C., Chen L.-S., Shao K.-T., Chen I.-Sh. 2004. A review of parrotfishes (Perciformes: Scaridae) of Taiwan with descriptions of four new records and one doubtful species // Zool. Stud. V. 43. № 3. P. 519–536.
Liem K.F. 1975. Biological versatility, evolution, and food resource exploitation in African cichlid fishes // Amer. Zool. V. 15. P. 427–454.
Liem K.F. 1978. Modulatory multiplicity in the functional repertoire of the feeding mechanism in cichlid fishes I. Piscivores // J. Morphol. V. 158. P. 323–360.
Liem K.F. 1986. The pharyngeal jaw apparatus of the Embiotocidae (Teleostei): a functional and evolutionary perspective // Copeia. № 2. P. 311–323.
Liem K.F., Greenwood P.H. 1981. A functional approach to the phylogeny of the pharyngognath Teleosts // Amer. Zool. V. 21. P. 83−101.
Liem K.F., Sanderson S.L. 1986. The pharyngeal jaw apparatus of labrid fishes: a functional morphological perspective // J. Morphol. V. 187. P. 143−158.
Lister A.M. 1996. The morphological distinction between bones and teeth of fallow deer (Dama dama) and red deer (Cervus elaphus) // Int. J. Osteoarch. V. 6. P. 119–143.
Lokrantz J., Nyström M., Thyresson M., Johansson C. 2008. The non-linear relationship between body size and function in parrotfishes // Coral Reefs. V. 27. P. 967–974.
Luca C.J., Merletti R. 1988. Surface myoelectric signal cross-talk among muscles of the leg // Electroencephalogr. Clin. Neurophysiol. V. 69. P. 568–575.
Maheshwari S.C. 1965. The cranial nerves of Mastacembelus armatus (Lacepede) // Jpn. J. Ichthyol. V. 12. № 3−6. P. 89–98.
Mikami Y. 2013. Phylogenic relationship of Labridae species deduced from comparative dissection // Anat. Rec. V. 296. P. 788–797.
Mithel M. 1964. The cranial nerves of the sisorid catfish Bagarius bagarius // Copeia. № 4. P. 673–678.
Monod Th. 1951. Notes sur le squelette visceral des Scaridae // Bull. Soc. Hist. Nat. Toul. V. 86. P. 191–194.
Nakae M., Sasaki K. 2006. Peripheral nervous system of the ocean sunfish Mola mola (Tetraodontiformes: Molidae) // Ichthyol. Res. V. 53. P. 233–246.
Nakae M., Sasaki K. 2007. Review of spino-occipital and spinal nerves in Tetraodontiformes, with special reference to pectoral and pelvic fin muscle innervation // Ibid. V. 54. P. 333–349.
Nakae M., Sasaki K. 2008. Branchial arch muscle innervation by the glossopharyngeal (IX) and vagal (X) nerves in Tetraodontiformes, with special reference to muscle homologies // J. Morphol. V. 269. P. 674–690.
Nelson G.J. 1967. Gill arches of some teleostean fishes of the families Girellidae, Pomacentridae, Embiotocidae, Labridae and Scaridae // J. Nat. Hist. V. 1. P. 289–293.
Nicol J.A.C. 1952. Autonomic nervous systems in lower chordates // Biol. Rev. V. 27. № 1. P. 1–48.
Nilsson S. 1984. Innervation and pharmacology of the gills // Fish Physiol. V. 10. P. 185–227.
Ong L., Holland K.N. 2010. Bioerosion of coral reefs by two Hawaiian parrotfishes: species, size differences and fishery implications // Mar. Biol. V. 157. № 6. P. 1313–1323.
Osse J.W.M. 1969. Functional morphology of the head of the perch (Perca fluviatilis L.): an electromyographic study // Netherl. J. Zool. V. 19. № 3. P. 289–392.
Pereira P.H.C., Santos M., Lippi D.L., Silva P. 2016. Ontogenetic foraging activity and feeding selectivity of the Brazilian endemic parrotfish Scarus zelindae // PeerJ. 4:e2536. 15 p. https://doi.org/10.7717/peerj.2536
Price S.A., Wainwright P.C., Bellwood D.R. et al. 2010. Functional innovations and morphological diversification in parrotfish // Evolution. V. 64. № 10. P. 3057–3068.
Randall J.E. 1965. Grazing effect on sea grasses by herbivorous reef fishes in the West Indies // Ecology. V. 46. № 3. P. 255–260.
Rognes K. 1973. Head skeleton and jaw mechanism in Labrinae (Teleostei: Labridae) from Norwegian waters // Acta Univ. Berg. Ser. Math. Rer. Nat. № 4. P. 1–151.
Saxena P.K. 1969. The cranial nerves in Hilsa ilisha (Ham.) and Cirrhina mrigala (Ham.) // Acta Anat. V. 74. P. 197–213.
Schultz L.P. 1958. Review of the parrotfishes family Scaridae // Bull. Unit. St. Nat. Mus. V. 214. P. 1–133.
Schultz L.P. 1969. The taxonomic status of the controversial genera and species of parrotfishes with a descriptive list (family Scaridae) // Smith. Contr. Zool. № 17. P. 1−50.
Schulz U., Berg R. 1987. The migration of ultrasonic-tagged bream, Abramis brama (L.), in Lake Constance (Bodensee-Untersee) // J. Fish Biol. V. 31. P. 409–414.
Sibbing F.A., Uribe R. 1985. Regional specializations in the oro-pharyngeal wall and food processing in the carp (Cyprinus carpio L.) // Netherl. J. Zool. V. 35. № 3. P. 377–422.
Springer V.G., Freihofer W.C. 1976. Study of the monotypic fish family Pholidichthyidae (Perciformes) // Smith. Contr. Zool. № 216. P. 1–41.
Stiassny M.L.J. 1981. Phylogenetic versus convergent relationship between piscivorous cichlid fishes from lakes Malawi and Tanganyika // Bull. Brit. Mus. Nat. Hist. Zool. V. 40. № 3. P. 67– 101.
Stiassny M.L.J. 1982. The relationships of the neotropical genus Cichla (Perciformes, Cichlidae): a phyletic analysis including some functional considerations // J. Zool. London. V. 197. P. 427–453.
Stiassny M.L.J., Jensen J.S. 1987. Labroid intrarelationships revisited: morphological complexity, key innovations, and the study of comparative diversity // Bull. Mus. Comp. Zool. V. 151. № 5. P. 269–319.
Tedman R.A. 1980. Comparative study of the cranial morphology of the labrids Choerodon venustus and Labroides dimidiatus and the scarid Scarus fasciatus (Pisces: Perciformes). I. Head skeleton // Austral. J. Mar. Freshw. Res. V. 31. P. 337–349.
Tibbetts I.R., Carseldine L. 2003. Anatomy of a hemiramphid pharyngeal mill with reference to Arrhamphus sclerolepis krefftii (Steindachner) (Teleostei: Hemiramphidae) // J. Morphol. V. 255. P. 228–243.
Ungar P.S. 2015. Mammalian dental function and wear: a review // Biosur. Biotrib. V. 1. № 1. P. 25–41.
Vandewalle P., Havard M., Claes G., Vree F. 1992. Mouvements des machoires pharyngiennes pendant la prise de nourriture chez le Serranus scriba (Linnk, 1758) (Pisces, Serranidae) // Can. J. Zool. V. 70. P. 145−160.
Vandewalle P., Parmentier E., Chardon M. 2000. The branchial basket in teleost feeding // Cybium. V. 24. № 4. P. 319–342.
Wainwright P.C. 1989. Functional morphology of the pharyngeal jaw apparatus in perciform fishes: an experimental analysis of the Haemulidae // J. Morphol. V. 200. P. 231−245.
Wainwright P.C. 2005. Functional morphology of the pharyngeal jaw apparatus // Fish biomechanics / Eds. Shadwick R., Lauder G.V. Chicago: Elsevier Press. P. 77−101.
Yamaoka K. 1978. Pharyngeal jaw structure in labrid fish // Publ. Seto Mar. Biol. Lab. V. 24. № 4−6. P. 409–426.
Yamaoka K. 1980. Some pharyngeal jaw muscles of Calotomus japonicus (Scaridae, Pisces) // Contr. Seto Mar. Bio. Lab. № 661. P. 315−322.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


