Вопросы ихтиологии, 2019, T. 59, № 6, стр. 640-650
О морфологической и генетической гетерогенности нерки Oncorhynchus nerka (Salmonidae) крупных озёрно-речных систем Восточной и Западной Камчатки
А. М. Хрусталева 1, *, Н. В. Кловач 1
1 Всероссийский научно-исследовательский институт рыбного хозяйства
и океанографии – ВНИРО
Москва, Россия
* E-mail: mailfed@mail.ru
Поступила в редакцию 04.12.2018
После доработки 30.01.2019
Принята к публикации 05.03.2019
Аннотация
Исследована морфологическая и генетическая гетерогенность выборок нерки Oncorhynchus nerka (как смешанных, так и собранных в разные периоды её массового хода) из устьев рек Западной (Озeрная, Большая, Палана) и Восточной Камчатки (р. Камчатка), в бассейнах которых (в притоках и озёрах) воспроизводятся её крупнейшие в Азии стада. Периодичность в течение массового нерестового хода нерки в реках западного побережья Камчатки по оценкам биологических показателей и частот аллелей 45 локусов однонуклеотидного полиморфизма ДНК не выявлена. Анализ смешанных выборок нерки из устьев западнокамчатских рек позволил выделить в выборке из р. Большая группу особей, предположительно отнесённую нами к озёрной форме, в выборках же из рек Озерная и Палана фенотипическая и генетическая неоднородность не отмечена. Выявленная гетерогенность выборки из устья р. Камчатка отражает сложную пространственно-генетическую структуру нерки в бассейне данной озёрно-речной системы, а различия между выборками, собранными в течение массового хода в основном русле, свидетельствуют о последовательном подходе к устью нерестовых группировок, воспроизводящихся в разных частях речного бассейна.
Нерка Oncorhynchus nerka является третьим по численности видом тихоокеанских лососей, ценным как в экономическом, так и в научном плане. Ей, как и другим представителям рода Oncorhynchus, свойственны ярко выраженная филопатрия (привязанность к местам рождения), анадромность (заход в реки на нерест) и моноцикличность (100%-ная гибель после нереста). Популяционная структура нерки чрезвычайно сложна и имеет свойства древовидной иерархически организованной системы. Изолированные локальные (географические) популяции отдельных рек чаще всего подразделены на сезонные расы, те в свою очередь − на субпопуляции и/или группы субпопуляций разных участков бассейна. Структура ветвится вплоть до малых панмиктических группировок, воспроизводящихся на отдельных нерестилищах (демы или элементарные популяции). Кроме темпоральных и географических внутривидовых единиц у нерки выделяют экологические группы − экологические (генеративные) формы и экотипы (Смирнов, 1975; Иванков, 1985; Иванков, Иванкова, 2013). Первые в зависимости от степени привязанности нереста и пресноводного нагула молоди к бассейнам озёр подразделяются на озёрную (лимнофильную) и речную (реофильную) формы, те в свою очередь вследствие биотопической специализации делятся на экотипы. Речная форма может размножаться как на ключевых нерестилищах (ключи, “чаши”, лимнокрены), так и на русловых (соответственно ручьевой и речной экотипы). Озёрная нерка, как правило, представлена двумя экотипами − озёрным (нерестится на литорали) и ручьевым (ключевые нерестилища в ручьях, впадающих в озеро); причём, несмотря на то что условия инкубации икры на литорали и в притоках озёр могут существенно различаться, нагул молоди обоих экотипов происходит совместно в озере. В водоёмах, где сезонные расы у нерки хорошо выражены, они различаются не только сроками хода, но и местами нереста (эколого-темпоральные расы: ранняя нерка нерестится, как правило, в реках и ручьях, поздняя − на литорали озёр).
Существенные отличия в условиях эмбрионально-личиночного и нерестового периодов жизни экологических форм и экотипов тихоокеанских лососей приводят к возникновению морфологических различий между ними (Иванков, Иванкова, 2013). Прежде всего это касается меристических признаков (число позвонков, лучей в плавниках, чешуй в боковой линии и пр.), значения которых находятся в обратной зависимости от температуры на ранних этапах развития эмбриона; а также размерных характеристик, в большей степени обусловленных успешностью размножения на нерестилищах разных типов (в мелких реках преимущество получают более мелкие и низкотелые особи – молодые и/или тугорослые, на глубоководных нерестилищах, наоборот, крупные и высокотелые) (Иванков, 1985; Иванков, Иванкова, 2013). Помимо морфологических особенностей разным эколого-темпоральным расам, а также отдельным экотипам свойственны устойчивые генетические различия, возникающие вследствие локальных адаптаций и их относительно высокой изоляции, так как стреинг преимущественно наблюдается в пределах сходных экологических групп.
Изучению популяционной структуры данного вида посвящено большое число работ (Коновалов, 1980; Бугаев, 1995, 2011; Глубоковский, 1995; Wood, 1995), основанных на различных методологических подходах, среди которых на сегодняшний день лидирующую позицию занимают генетические исследования (Пустовойт, 1994; Varnavskaya et al., 1994; Алтухов и др. 1997; Beacham et al., 2006a, 2006b; Варнавская, 2006; Habicht et al., 2010). Очевидно, что для изучения экологической дифференциации у нерки лучше подойдут генетические маркеры, выявляющие не только нейтральную, но и адаптивную изменчивость в группировках, приуроченных к разным биотопам. Такими подходящими маркерами являются локусы однонуклеотидного полиморфизма ДНК (ОНП или SNP), отличительными чертами которых являются высокая воспроизводимость результатов, точность генотипирования, простота аналитических подходов. Однако в популяционной и экологической генетике для корректной интерпретации данных необходимо соблюдать ряд требований методического характера, в том числе к проведению полевых работ и сбору материала (Животовский, 2013). К примеру, о разнокачественности выборок, взятых не единовременно, а в течение нескольких дней нерестовой миграции тихоокеанских лососей в нижних участках рек, сообщалось в ряде публикаций (Пустовойт, 1994, 2014; Пильганчук и др., 2012). В то же время не вызывает сомнений тот факт, что даже однократные выборки, собранные в устье крупной озёрно-речной системы, могут быть смесью особей из разных субпопуляций (элементарных популяций) и экологических группировок, в той или иной степени отличающихся друг от друга, а могут, напротив, содержать особей только одной из этих субпопуляций. В первом случае в выборке, являющейся совокупностью представителей нескольких панмиктических групп, будет наблюдаться эффект Валунда, который проявляется как дефицит гетерозигот в подразделённой популяции по локусам, в которых имеется вариация аллельных частот между субпопуляциями.
Цель нашей работы − изучить морфологическую и генетическую гетерогенность выборок (как смешанных, так и собранных в разные периоды массового хода) нерки из устьевых участков рек Западной и Восточной Камчатки, в бассейнах которых (в притоках и озёрах) воспроизводятся её крупнейшие в Азии стада. Интерпретация результатов классификации смешанных выборок с привлечением данных о пространственно-генетической структуре рассматриваемых популяций позволит нам сделать важные обобщения, касающиеся стратегии дальнейших исследований сложных популяционных систем, свойственных данному виду.
МАТЕРИАЛ И МЕТОДИКА
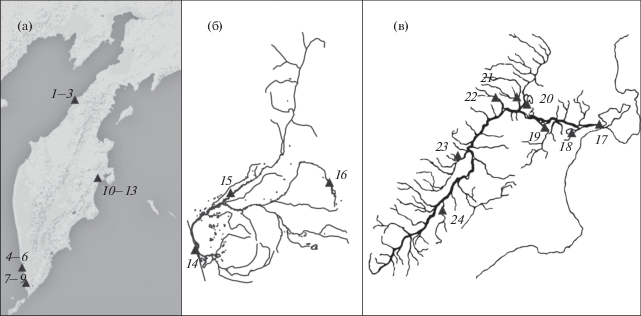
Материал собирали во время массового нерестового хода нерки в нижнем течении рек Западной (Палана, Большая, Озерная) и Восточной (р. Камчатка) Камчатки (рис. 1а, таблица). У пойманных рыб определяли возраст, измеряли стандартную длину (SL) и длину по Смитту (FL), а также массу тела (общую и без внутренностей) и гонад. Возраст определяли, руководствуясь рекомендациями Правдина (1966) и Бугаева (1995). Пробы ткани нерки фиксировали 96%-ным этанолом. Тотальную ДНК выделяли из фрагментов печени и плавника стандартными методами (Маниатис и др., 1984). Исследовали полиморфизм 45 описанных ранее локусов SNP, три из которых (One_CO1, One_Cytb_17, One_Cytb_26) локализованы в митохондриальном геноме, остальные – преимущественно в интронах и экзонах ядерных генов, диспергированных повторах и различных EST-последовательностях (Smith et al., 2005; Elfstrom et al., 2006; Habicht et al., 2010). Три митохондриальных локуса для последующего анализа были объединены в один Cytb_CO1.
Рис. 1.
Карта-схема районов сбора материала: а – п-ов Камчатка, наши данные; б − бассейн р. Большая (Хрусталева и др., 2014); в – бассейн р. Камчатка (Habicht et al., 2010; Хрусталева и др., 2015). Выборки: 1−3 − р. Палана, 4−6 – р. Большая, 7−9 – р. Озерная, 10−13 – р. Камчатка, 14 − р. Большая (устье) 2004 г., 15 – р. Быстрая, 16 – р. Плотникова, 17 − р. Камчатка (устье) 2005 г., 18 − оз. Азабачье, р. Бушуева, 19 − р. Хапица, 20 − р. Еловка, 21 − р. Двуюрточная, 22 − р. Белая, 23 − р. Козыревка, 24 − р. Китильгина.
Объём собранного материала и биологические характеристики (M ± m) нерки Oncorhynchus nerka в выборках из рек Озерная, Большая, Палана и Камчатка
| № | Река (место вылова) |
Дата вылова | Выборка | Доля самок, % | Длина, см | Масса, г | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Описание | Обозначение* | Объём**, экз. | SL | FL | тела без внутренностей | гонад | ||||
| 1 | Палана (нижнее течение) |
10.07.2003, 11.07.2003, 12.07.2003 |
Массовый ход | KP1 | 93 (30) | 51 | 61.8 ± 1.1 | 57.8 ± 1.0 | 2600.5 ± 143.9 | 131.4 ± 16.3 |
| 2 | 17.07.2003, 18.07.2003 |
То же | KP2 | 62 (44) | 61 | 62.5 ± 1.1 | 58.4 ± 1.0 | 2568.5 ± 140.3 | 142.4 ± 16.5 | |
| 3 | 20.07.2003, 21.07.2003 |
» | KP3 | 46 (20) | 54 | 62.4 ± 1.0 | 58.6 ± 1.0 | 2554.3 ± 132.8 | 135.0 ± 16.3 | |
| 4 | Большая (нижнее течение) |
23.07.2003 | Начало хода летней нерки | KB1 | 16 (16) | 47 | 60.9 ± 1.2 | 57.2 ± 1.2 | 2665.7 ± 191.6 | 181.7 ± 29.7 |
| 5 | 29.07.2003 | Поздняя (летняя) нерка, рунный ход | KB2 | 53 (50) | 42 | 63.8 ± 1.3 | 59.9 ± 1.2 | 2997.0 ± 183.6 | 166.8 ± 23.7 | |
| 6 | 30.07.2003 | То же | KB3 | 54 (35) | 57 | 64.1 ± 1.0 | 59.9 ± 0.9 | 2903.9 ± 163.3 | 190.0 ± 27.3 | |
| 7 | Озерная (устье) | 04.08.2003 | Рунный ход | KO1 | 50 (45) | 68 | 60.8 ± 1.3 | 57.2 ± 1.3 | 2464.8 ± 165.7 | 138.0 ± 14.5 |
| 8 | 05.08.2003 | То же | KO2 | 49 (21) | 53 | 62.0 ± 1.1 | 58.0 ± 1.0 | 2686.9 ± 152.2 | 112.2 ± 16.9 | |
| 9 | 07.08.2003 | » | KO3 | 50 (24) | 80 | 59.2 ± 1.0 | 55.6 ± 0.9 | 2352.4 ± 121.0 | 124.4 ± 13.7 | |
| 10 | Камчатка (нижнее течение) | 29.06.2004, 30.06.2004 | Поздняя (летняя) нерка, массовый ход | KK1 | 0 (20) | − | − | − | − | − |
| 11 | 01.07.2004, 02.07.2004 | То же | KK2 | 49 (28) | 51 | 57.3 ± 1.4 | 53.3 ± 1.3 | 2266.1 ± 187.0 | 118.9 ± 19.6 | |
| 12 | 05.07.2004, 06.07.2004, 07.07.2004 | » | KK3 | 71 (33) | 55 | 63.0 ± 1.2 | 59.1 ± 1.1 | 2685.6 ± 150.2 | 153.8 ± 15.7 | |
| 13 | 09.07.2004 | » | KK4 | 20 (20) | 47 | 61.9 ± 2.4 | 57.8 ± 2.2 | 2570.0 ± 332.9 | 131.1 ± 42.2 | |
В работе представлены оригинальные данные по изменчивости 45 локусов SNP нерки Западной и Восточной Камчатки, полученные методом TaqMan-ПЦР. Молекулярно-генетический анализ проводили в лаборатории экологической геномики факультета гидробиологии и рыболовства Университета штата Вашингтон. Методика генотипирования детально изложена ранее (Seeb et al., 2009; Хрусталева и др., 2013). Обозначения локусов приведены в сокращённом варианте: префикс One_, принятый для обозначения SNP-локусов нерки, опущен для краткости изложения.
Кроме того, в работе проанализированы опубликованные ранее данные анализа полиморфизма 45 локусов SNP в следующих выборках: молодь нерки из двух основных притоков р. Большая – р. Быстрая, район пос. Карымай (n = 33), р. Плотникова, в 10 км от оз. Начикинское (n = 39); производители из устья р. Большая, 11 и 8 августа 2004 г. (n = 90) (рис. 1б) (Хрусталева и др., 2014); а также наши опубликованные ранее данные по нерке оз. Азабачье (n = 39) и ранней нерке из устья р. Камчатка в 2005 г. (n = 20) (Хрусталева и др., 2015) и открытые данные Хабичта с соавторами (Habicht et al., 2010) по частотам аллелей тех же локусов в выборках из притоков среднего и верхнего течения р. Камчатка − рек Хапица (n = = 146), Белая (n = 81), Двуюрточная (n = 88), Еловка (n = 109), Козыревка (n = 40) и Китильгина (n = 28) (рис. 1в).
Для сравнения выборок по биологическим показателям применяли t-критерий Стьюдента. Расчёт оценок коэффициента инбридинга индивидов относительно субпопуляции (FIS) и вероятностные тесты на соответствие равновесию по Харди−Вайнбергу (по методу полного перебора), генную дифференциацию и проверку неравновесия по сцеплению (с применением цепей Маркова) осуществляли в программе GENEPOP 3.4 (Raymond, Rousset, 1995). Уровень значимости для множественных тестов корректировали с помощью FDR-поправки Бенджамини−Хохберга (Benjamini, Hochberg, 1995). Для выявления подразделённости выборок генотипы были проанализированы в программе STRUCTURE 2.3.4 (Pritchard et al., 2000), в которой методами численного моделирования (метод цепей Маркова − 1 млн итераций, период burn-in − 500 тыс. итераций) выявляли наличие устойчивых потенциальных компонент (кластеров) в анализируемой совокупности данных (admixture model, допускающая гибридное происхождение особей при условии независимости аллельных частот среди кластеров), определяли наиболее вероятный вариант разделения выборки на заданное число групп K (K = 1−5), затем выполняли байесовскую классификацию особей. По результатам кластеризации оценивали ln Pr(X|K) для K = 1−5, где X – вектор наблюдаемых генотипов. Апостериорную вероятность разбиения на K групп − Pr(K|X) − оценивали по формуле Байеса. Многомерное шкалирование (MDS) и расчёт Евклидовых дистанций по частотам аллелей в выборках осуществляли в программе SPSS 19.0.01.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Размерно-массовые характеристики производителей нерки Западной Камчатки существенно не различались по выделенным периодам массового хода. Так, в р. Палана различий по биологическим характеристикам особей разных сроков массового нерестового хода не выявлено. Производители летней нерки из первых партий хода в р. Большая были заметно мельче выловленных в течение массового хода 29 и 30 июля. При этом достоверные различия выявлены лишь по длине рыб (p = 0.03), по массе значимых различий не наблюдалось. В р. Озерная производители, выловленные 4 и 5 августа (выборки КО1 и КО2), были крупнее выловленных двумя днями позже (КО3). При сравнении двух первых выборок были выявлены достоверные различия по массе гонад (p = 0.022), которые наиболее вероятно объясняются разным соотношением самцов и самок в улове. По остальным показателям выборки не различались. Пойманные 5 августа особи были значимо крупнее выловленных 7 августа, различия обнаружены по всем исследуемым биологическим показателям (p < 0.001). Причина выявленных различий также, скорее всего, кроется в разном соотношении полов в выборках, так как самцы западнокамчатской нерки существенно крупнее самок (Бугаев, 1995): в выборке KO2 доля самцов была гораздо выше, чем в KO3. Производители из первой и третьей выборок не отличались ни по одному из рассмотренных признаков.
В р. Камчатка (Восточная Камчатка), напротив, размерно-массовые характеристики производителей, выловленных 1−2 июля, были значимо ниже (p < 0.05), чем в выборках более поздних сроков хода. Последние же не различались между собой ни по длине, ни по массе.
Для оценки генетической гетерогенности нерестового хода нерки были проанализированы выборки, собранные из уловов речных неводов в устьях рек Западной и Восточной Камчатки. Из 43 исследованных локусов SNP в выборках из р. Камчатка были полиморфны 34 локуса, р. Палана – 31, р. Большая – 36, р. Озерная – 37. По результатам тестов на генную и генотипическую дифференциацию частоты аллелей анализируемых локусов в выборках, собранных в разные дни массового хода в нижних участках рек Западной Камчатки (Озерная, Большая, Палана), значимо не различались.
Гетерогенность аллельных частот 34 полиморфных локусов SNP выявлена по периодам массового хода нерки в устье р. Камчатка: выборки первой (конец июня−первые числа июля) и второй (середина−конец I декады июля) половины массового хода летней нерки достоверно различались. Однако эти различия были обусловлены преимущественно изменчивостью двух локусов: RF-295 (по которому выборка третьей четверти хода отличалась от первых двух) и MHC2_251v2 (по которому чётко разделялись выборки первой и второй половины хода). Выявленная генетическая и морфологическая неоднородность выборок вполне может объясняться последовательным подходом к устью нерестовых группировок, воспроизводящихся в разных частях речного бассейна. Обнаруженные различия между этими группировками могут быть следствием локальных адаптаций к конкретным условиям обитания субпопуляций нерки данной озёрно-речной системы, а могут быть следствием их относительной изоляции и случайных (дрейф генов, мутации), исторических (эффект основателя) и демографических (волны численности, бутылочное горлышко) процессов, приводящих к смещению аллельных частот по данным локусам. Однако последние факторы должны воздействовать в той или иной степени одинаково на все локусы при более или менее равных скоростях эволюции в них. Поэтому гипотеза о селективной природе выявленных различий кажется вполне состоятельной. Тем более что первый из этих локусов расположен в экзоне гена 12-RF амидпептида гипоталамуса, отвечающего за регуляцию различных физиологических и поведенческих процессов у животных, в том числе гормональную регуляцию, регуляцию потребления пищи, терморегуляцию и болевую рецепцию, а второй – в интроне гена Onne-DAB, транслирующегося в антигенсвязывающие области молекулы главного комплекса гистосовместимости класса II (MCHII) и отвечающего за формирование иммунитета к экстрацеллюлярным патогенам. О различиях между группировками нерки бассейна р. Камчатка, воспроизводящимися в притоках верхнего, среднего и нижнего течения, по однонуклеотидным заменам в гене Onne-DAB, обусловленных действием различных форм отбора в отдельных локальностях данной озёрно-речной системы, сообщалось в наших предыдущих работах (Хрусталева, 2018; Хрусталева и др., 2018).
В популяционной генетике признаками гетерогенности выборки являются в первую очередь отклонения от равновесия Харди−Вайнберга по некоторым локусам, проявляющиеся в дефиците гетерозигот (эффект Валунда), а также положительные тесты на неравновесие по сцеплению между физически несцепленными генами (Nei, Li, 1973). Анализ генотипических распределений в объединённых выборках нерки из устьев рек Западной и Восточной Камчатки показал, что значимое несоответствие наблюдаемых и ожидаемых при равновесии Харди−Вайнберга частот генотипов по наибольшему числу локусов (по 7 из 34) наблюдалось в выборке из р. Камчатка; тогда как в выборках из рек Большая, Озeрная и Палана – соответственно по трём, двум и одному локусу. Все отмеченные отклонения, как и ожидалось, были связаны с дефицитом гетерозигот. В выборках из нижнего течения рек Камчатка и Большая статистически значимый дефицит гетерозигот отмечался и после введения поправки на множественные сравнения: в первом случае по локусам MHC2_190v2 (p = 0.0003, FIS = 0.652) и MHC2_251v2 (p = 0, FIS = 0.955), во втором – по ZNF-61 (p = 0.0004, FIS = 0.386). Столь высокие значения коэффициента инбридинга в локусах группы MHC наиболее вероятно объясняются эффектом Валунда в смешанной выборке из устья крупной озёрно-речной системы, в разных локальностях которой по данным локусам действует разнонаправленный отбор.
Нам доподлинно известно о физическом сцеплении лишь двух пар используемых в работе SNP: это локусы в составе гена глицерол-3-фосфат дегидрогеназы (GPDH и GPDH2) и главного комплекса гистосовместимости (MHC2_190v2 и MHC2_251v2). Однако незначимых тестов на независимое наследование (p < 0.05) было значительно больше: в р. Камчатка – 31 тест из 561, в р. Палана − 28 из 465, в р. Большая − 36 из 630, в р. Озерная − 23 из 666. После FDR-коррекции корреляция между генотипами двух пар локусов, GPDH–GPDH2 (p = 0.000024) и GPH-414−MHC2_251v2 (p = 0.000004), отмечена в выборке из бассейна р. Камчатка, а также в выборке из р. Большая для zP3b − MARCKS-2 (p = = 0.000002). Таким образом, мы имеем все основания предполагать реальную генетическую гетерогенность лишь для выборок из устьев рек Большая и Камчатка. Обоим речным бассейнам свойственны большая протяжённость основного русла, развитая система притоков и наличие изолированных озёр, подходящих для размножения нерки. В реках Палана и Озерная воспроизводство нерки сосредоточено в бассейне одного крупного озера, следовательно, условия существования популяций в них более однородны, а изоляция между ними преимущественно симпатрическая. Кроме того, нерка обоих озёр представлена главным образом одной сезонной (эколого-темпоральной) расой: в бассейне р. Палана 99%, а в р. Озерная 98% всей нерки приходится на позднюю форму (Бугаев, Дубынин, 2002; Бугаев и др., 2002а).
Частоты аллелей полиморфных локусов в объединённых выборках из устьев рек Западной Камчатки были проанализированы с помощью программы STRUCTURE для выявления в смешанных выборках относительно генетически однородных групп особей. Так, в выборке из устья р. Большая были выделены три группы: наиболее многочисленная первая, меньшая по объёму вторая и самая малочисленная третья (рис. 2а, 2б). При этом морфологически особи из этих групп не различались. Однако доля рыб, проживших в пресной воде один год, в первых двух группах была не менее 80%, в то время как в третьей не превышала 40%. При анализе распределений аллельных частот 36 полиморфных локусов SNP в данных группах оказалось, что первые две различаются лишь по частотам гаплотипов объединённого митохондриального локуса CytB_CO1, в то время как третья группа отличалась от первых двух по большинству локусов. Для выяснения происхождения выделенных групп были проанализированы выборки молоди нерки из основных притоков р. Большая – рек Быстрая и Плотникова, а также выборка производителей, собранная в 2004 г. в устье. В объединённых данных по всем четырём выборкам также были идентифицированы три группы особей, совпадающие с выделенными ранее в выборке из устья реки 2003 г. (рис. 2в, 2г). Примечательно, что в выборках из устья реки встречались особи всех трёх групп, в выборке молоди из низовий р. Быстрая особи, отнесённые к группе 3, отсутствовали, а в выборке молоди из верховий р. Плотникова лишь 2 экз. идентифицированы как представители третьей группы (рис. 2в). Как и в предыдущем случае, установлено, что за дифференциацию первых двух групп отвечает лишь локус CytB_CO1. Исключение данного локуса привело к существенному ослаблению кластеризации на первые две группы (фактически их выделение стало неправомерным), в то время как группа 3 сохранилась в неизменном виде (рис. 2д, 2е).
Рис. 2.
Классификация смешанных выборок нерки Oncorhynchus nerka бассейна р. Большая на основе алгоритма программы STRUCTURE 2.3.4: a, в, д – особи отсортированы по датам и местам вылова; б, г, е – особи ранжированы по вероятности отнесения их к группам. Разные оттенки серого соответствуют трём кластерам (K = 3) и отображают вероятность принадлежности к ним особей, пояснения в тексте. Обозначения см. на рис. 1.

В бассейне р. Большая поздняя нерка представлена двумя экологическими формами − озёрной (главным образом, популяциями оз. Начикинское и в значительно меньшей степени − оз. Сокоч; оба озера расположены в верхнем течении р. Плотникова) и речной, отдельные субпопуляции которой воспроизводятся в крупных притоках – в реках Быстрая, Плотникова, Карымчина, Банная и других (Крохин, Крогиус, 1937; Семко, 1954; Бугаев и др., 2002б; Запорожец и др., 2013). Молодь речных локальных группировок нерки р. Большая скатывается преимущественно в возрасте одного года, а нередко − сеголетками. Случаи задержки молоди нерки в реке до двух лет единичны (Wood et al., 1987). Молоди озёрных стад нерки, т.е. нерестующих в бассейне озера (на литорали и в притоках) и нагуливающихся в нём в течение всего пресноводного периода жизни, свойственно более продолжительное время пресноводного нагула: озерная нерка совершает катадромную миграцию преимущественно в возрасте 2 лет, хотя в зависимости от конкретных условий молодь из озера может скатываться и в более раннем возрасте (Burgner, 1991; Wood, 1995). Анализируя полученные нами результаты, можно предположить, что группа 3 главным образом представлена озёрной неркой, наиболее вероятно, из оз. Начикинское. В пользу данного предположения свидетельствует тот факт, что в бассейне р. Быстрая особи, отнесённые к данной группе, отсутствовали, а среди сеголеток верховья р. Плотникова встречались единично. Обнаружение сеголеток начикинской нерки в реке не является артефактом, так как незначительная часть особей озёрной формы всё же скатывается из озера, не достигнув среднего возраста катадромной миграции, по случайным причинам. Кроме того группа 3 была относительно немногочисленной и в основном представлена возрастным классом 2.3. Первые же две группы, скорее всего, можно интерпретировать как смешанные выборки речной нерки разных притоков данного бассейна. Дифференциация их на две группы происходит главным образом вследствие существования двух филогенетических линий мтДНК нерки на азиатской части ареала в связи с особенностями её палеорасселения (Брыков и др., 2005; Хрусталева, 2016). Причём на Западной Камчатке центральные гаплотипы обеих линий более или менее равномерно распределены в бассейнах р. Большая и оз. Курильское (р. Озерная), в отличие от р. Камчатка, где в притоках среднего течения доминирует один из двух массовых на азиатском побережье гаплотипов мтДНК.
Аналогичным образом была проведена кластеризация объединённых выборок из устьев рек Палана и Озерная. Обе выборки разделились на две группы (рис. 3), но, как и в предыдущем случае, за их дифференциацию отвечал лишь один локус CytB_CO1, исключение которого привело к неудовлетворительным вариантам кластеризации: Pr(K = 1|X) > Pr(K = 2|X) > Pr(K = 3|X) и т.д. В обеих выборках также не наблюдалось генетической подразделённости по периодам нерестового хода. Таким образом обе выборки в первом приближении можно считать однородными.
Рис. 3.
Классификация смешанных выборок нерки Oncorhynchus nerka рек Озерная (а) и Палана (б) на основе алгоритма программы STRUCTURE 2.3.4. (K = 2).

По итогам анализа в программе STRUCTURE в смешанной выборке из устья р. Камчатка 2004 г. были выделены две группы особей − 1 и 2 (рис. 4). Причём выборки первой половины хода в основном представлены более многочисленной группой 2, а в выборках второй половины хода особи, отнесённые к группе 1, встречались гораздо чаще (рис. 4а). Группы значимо дифференцируются по большинству локусов (20 из 34), при этом наиболее весомый вклад вносят MHC2_251v2 и GPH-414, последний расположен в интроне гена, кодирующего α-субъединицу гликопротеиновых гормонов гипофиза. Анализ фенотипических признаков производителей нерки из обеих групп показал, что группа 2 представлена преимущественно мелкими и более молодыми особями за счёт менее продолжительного периода морского нагула (2−3 года). В группе 1 рыбы были в среднем старше и крупнее за счёт значительной доли (45%) производителей, проживших в море 4 года. Кроме того, доля особей, нагуливающихся в пресной воде 2 года, была существенно выше в группе 1. В этом контексте можно предположить, что различия между выделенными группами обусловлены их принадлежностью к разным группировкам локальных стад второго порядка летней нерки в бассейне р. Камчатка (Бугаев, 1995): группу 1 в первом приближении можно отнести к группировке Е, воспроизводящейся на нерестилищах среднего и нижнего течения реки, часть особей которой нагуливаются до ската в море в оз. Азабачье, группу 2 – преимущественно к группировке В, занимающей притоки верхнего течения, молодь которой зимует на нерестилищах и скатывается в возрасте 1+ (Хрусталева и др., 2015). Наши выводы подкрепляются результатами MDS- шкалирования по матрице Евклидовых расстояний, вычисленных по аллельным частотам локусов SNP в выборках нерки из разных частей бассейна р. Камчатка (рис. 5). По первой координате на диаграмме выделяются три чётко обособленные группы популяций: группировка притоков среднего течения, куда также попали выделенная нами группа 1 и выборка ранней нерки из устья 2005 г.; нерка из притоков верхнего течения, представленная одной выборкой из р. Китильгина и формирующая общий кластер с группой 2; совокупность выборок из притоков нижнего течения и из р. Козыревка. Эти результаты хорошо согласуются с общей картиной генетической дифференциации нерки р. Камчатка по однонуклеотидным заменам в гене Onne-DAB (Хрусталева, 2018; Хрусталева и др., 2018), а также с особенностями пространственного распределения частот гаплотипов мтДНК в бассейне р. Камчатка.
Рис. 4.
Классификация объединённой выборки нерки Oncorhynchus nerka, собранной 2004 г. в устье р. Камчатка, на основе алгоритма программы STRUCTURE 2.3.4. (K = 2): a – особи отсортированы по датам вылова, б – особи ранжированы по вероятности отнесения к группам.

Рис. 5.
Диаграмма многомерного шкалирования (MDS), построенная по Евклидовым дистанциям, для выборок нерки Oncorhynchus nerka из бассейна р. Камчатка; обозначения выборок см. на рис. 1.

Судя по присутствию особей, проживших в пресной воде 2 года (две речные зоны роста на чешуе), в обеих группах, можно предположить, что наиболее многочисленная в бассейне р. Камчатка нерка оз. Азабачье также может быть единично представлена в них. Наиболее вероятно, она мигрирует несколько позднее, и наши выборки не охватили её в полной мере. Так, по визуальным наблюдениям, проведённым нами на литорали оз. Азабачье 13.07.2004 г., особи летней нерки, имеющие серебристую окраску, были немногочисленны и встречались в скоплениях ранней нерки с нерестовыми изменениями спорадически. Таким образом, можно сделать предварительный вывод о темпоральной подразделённости нерестового хода нерки данной озёрно-речной системы: несмотря на значительное перекрывание сроков миграции каждой группировки, в начале хода преобладают особи, воспроизводящиеся на нерестилищах среднего течения реки, затем преимущественно мигрируют группировки верхнего течения и, вероятно, несколько позднее в массе заходит азабачинская нерка. Несмотря на практическую важность полученных результатов, заметим, что наши выводы пока не окончательны и требуют дальнейших экспериментальных подтверждений.
В контексте стратегии исследований сложных популяционных систем данного вида, таких как популяции рек Большая и Камчатка, необходимо отметить, что выделяемые на основе численного моделирования компоненты смешанных выборок из устьев могут быть корректно интерпретированы лишь в случае наличия данных по внутрипопуляционным группировкам в конкретном речном бассейне. Как правило, невозможно отнести генетически различающиеся группы из смеси к реальным группировкам, воспроизводящимся в разных участках речного бассейна без какой-либо дополнительной информации (о географической, возрастной и размерной структуре популяции, наличии темпоральных и/или экологических форм, о времени и месте сбора материала, данных биоанализа и пр.). Однако уже на этапе оценки популяционно-генетических параметров и характера наследования локусов можно судить о неоднородности выборок, что должно стать сигналом о необходимости более обстоятельных исследований пространственно-генетической структуры данной популяции. Наши соображения о необходимой и достаточной степени детализации изучения подразделённых популяций/популяционных систем нерки изложены ранее (Хрусталева и др., 2017). Тем не менее не всегда возможно собрать более или менее представительный материал по всем локальным субпопуляциям (тем более по отдельным нерестилищам), в этом случае наиболее оптимальным решением будет использование численного моделирования, результаты которого, как показано в нашей работе, вполне адекватно отражают реальную ситуацию.
В заключение следует подчеркнуть, что у нас нет достаточных оснований для выделения каких-либо периодов в массовом нерестовом ходе нерки в нижнем течении рек Озерная, Большая и Палана, а выборки, собранные в пик хода в устье, можно объединять для дальнейшего анализа. Смешанные выборки из нижних участков русла рек Палана и Озерная, воспроизводство нерки в которых сосредоточено в бассейне крупных озёр Паланское и Курильское, можно считать гомогенными. Очевидно, что такие выборки представляют собой смесь экотипов (озёрного, речного и ручьевого), между которыми должны наблюдаться различия по селективным маркерам. Однако генетическая дифференциация в бассейнах этих молодых по палеонтологическим меркам озёр не выявляется с использованием относительно медленно эволюционирующих нейтральных и/или находящихся под слабым давлением отбора SNP. Отсутствие различий между группировками, воспроизводящимися на речных и озёрных нерестилищах, может объясняться также действием балансирующего отбора по некоторым локусам (например, локусам в составе генов MHC класса II) в силу общности условий раннего пресноводного нагула молоди (Хрусталева и др., 2018). Возможно, различия между экотипами в данных водоёмах удастся обнаружить, расширяя охват исследований (выборки из конкретных нерестилищ, ручьевых и литоральных) и привлекая больше селективных или же нейтральных, но более изменчивых, маркеров (к примеру, микросателлитов).
Список литературы
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. 1997. Популяционная генетика лососевых рыб. М.: Наука, 288 с.
Брыков Вл.А., Полякова Н.Е., Подлесных А.В. и др. 2005. Влияние биотопов размножения на генетическую дифференциацию популяций нерки (Oncorhynchus nerka) // Генетика. Т. 41. № 5. С. 635−645.
Бугаев В.Ф. 1995. Азиатская нерка (пресноводный период жизни, структура локальных стад, динамика численности). М.: Колос, 464 с.
Бугаев В.Ф. 2011. Азиатская нерка−2 (биологическая структура и динамика численности локальных стад в конце ХХ−начале ХХI вв.). Петропавловск-Камчатский: Камчатпресс, 380 с.
Бугаев В.Ф., Дубынин В.А. 2002. Факторы, влияющие на биологические показатели и динамику численности нерки Oncorhynchus nerka рек Озерной и Камчатка // Изв. ТНИРО. Т. 130. С. 679–757.
Бугаев В.Ф., Миловская Л.В., Лепская Е.В. и др. 2002а. Исследования нерки Oncorhynchus nerka оз. Паланского в 1990–2001 гг. (северо-западная Камчатка) // Там же. Т. 130. С. 777–791.
Бугаев В.Ф., Остроумов А.Г., Непомнящий К.Ю., Маслов А.В. 2002б. Некоторые особенности биологии нерки Oncorhynchus nerka р. Большой (Западная Камчатка) и факторы, влияющие на ее биологические показатели // Там же. Т. 130. С. 758−776.
Варнавская Н.В. 2006. Генетическая дифференциация популяций тихоокеанских лососей. Петропавловск-Камчатский: Изд-во КамчатНИРО, 488 с.
Глубоковский М.К. 1995. Эволюционная биология лососевых рыб. М.: Наука, 343 с.
Животовский Л.А. 2013. О методологии исследования популяционной организации вида по генетическим маркерам (на примере горбуши Oncorhynchus gorbuscha) // Вопр. ихтиологии. Т. 53. № 3. С. 371−376. https://doi.org/10.7868/S0042875213030144
Запорожец О.М., Запорожец, Г.В., Зорбиди Ж.Х. 2013. Динамика численности и биологические характеристики тихоокеанских лососей реки Большой (западная Камчатка) // Изв. ТНИРО. Т. 174. С. 38−68.
Иванков В.Н. 1985. Экотипы лососевых рыб // Морфология и систематика лососевых рыб. Л.: Изд-во ЗИН АН СССР. С. 47–54.
Иванков В.Н., Иванкова Е.В. 2013. Внутривидовые репродуктивные стратегии у тихоокеанских лососей рода Oncorhynchus (фундаментальные сходства и видовые различия) // Изв. ТИНРО. Т. 173. С. 103–118.
Коновалов С.М. 1980. Популяционная биология тихоокеанских лососей. М.: Наука, 237 с.
Крохин Е.М., Крогиус Ф.В. 1937. Очерк бассейна р. Большой и нерестилищ лососевых, расположенных в нем // Изв. ТИНРО. Т. 9. С. 3−156.
Маниатис Т., Фрич Э., Сэмбрук Д. 1984. Молекулярное клонирование. М.: Мир, 480 с.
Пильганчук О.А., Шпигальская Н.Ю., Дубынин В.А. и др. 2012. Предварительные результаты оценки генетической гетерогенности нерестового хода нерки р. Озерная // Матер. Всерос. науч. конф. “Водные биологические ресурсы северной части Тихого океана: состояние, мониторинг, управление”. Петропавловск-Камчатский: Изд-во КамчатНИРО. С. 431–438.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Пустовойт С.П. 1994. Внутрипопуляционная генетическая изменчивость и межпопуляционная дифференциация азиатской нерки Oncorhynchus nerka (Walbaum) // Генетика. Т. 30. № 1. С. 101−106.
Пустовойт С.П. 2014. Морфометрическое изучение нерки Oncorhynchus nerka (Walbaum) р. Палана (западное побережье п-ова Камчатка) // Вестн. СВГУ. № 21. С. 67−72.
Семко Р.С. 1954. Запасы западнокамчатских лососей и их промысловое значение // Изв. ТИНРО. Т. 41. С. 3–109.
Смирнов А.И. 1975. Биология, размножение и развитие тихоокеанских лососей. М.: Изд-во МГУ, 335 с.
Хрусталева А.М. 2016. Филогеография азиатской нерки Oncorhynchus nerka по данным изменчивости митохондриальных локусов ОНП: анализ сценариев послеледникового расселения вида на азиатском побережье Тихого океана // Изв. ТИНРО. Т. 186. С. 93−106. https://doi.org/10.26428/1606-9919-2016-186-93-106
Хрусталева А.М. 2018. Исследование приспособительного характера полиморфизма главного комплекса гистосовместимости (MHC) по однонуклеотидным заменам в популяциях азиатской нерки: II. Факторы, определяющие изменчивость гена Onne-DAB в бассейне р. Камчатка // Генетика. Т. 54. № 11. С. 1298−1308. https://doi.org/10.1134/S0016675818110085
Хрусталева А.М., Гриценко О.Ф., Кловач Н.В. 2013. Полиморфизм по однонуклеотидным заменам (SNP) в популяциях нерки Oncorhynchus nerka п-ова Камчатка // Там же. Т. 49. № 11. С. 1322–1336. https://doi.org/10.7868/S001667581311009X
Хрусталева А.М., Кловач Н.В, Гриценко О.Ф., Сиб Дж.Е. 2014. Внутри- и межпопуляционная изменчивость нерки Oncorhynchus nerka юго-западного побережья Камчатки на основе анализа локусов однонуклеотидного полиморфизма // Там же. Т. 50. № 7. С. 840−853. https://doi.org/10.7868/S0016675814070091
Хрусталева А.М., Кловач Н.В., Ведищева Е.В., Сиб Дж.Е. 2015. Генетическая дифференциация нерки Oncorhynchus nerka бассейна р. Камчатка и озерно-речных систем западного побережья Берингова моря по данным анализа локусов однонуклеотидного полиморфизма // Там же. Т. 51. № 10. С. 1141−1153. https://doi.org/10.7868/S0016675815090052
Хрусталева А.М., Пономарева Е.В., Пономарева М.В., Кловач Н.В. 2017. Исследование однонуклеотидного полиморфизма ДНК в популяциях нерки Камчатки, северо-западного Побережья Охотского моря и Чукотки // Изв. ТИНРО. Т. 190. С. 18−32. https://doi.org/10.26428/1606-9919-2017-190-82-89
Хрусталева А.М., Пономарева Е.В., Пономарева М.В. и др. 2018. Исследование приспособительного характера полиморфизма главного комплекса гистосовместимости (MHC) по однонуклеотидным заменам в популяциях азиатской нерки: I. В популяциях нерки рек Озерная и Камчатка действуют разные формы отбора // Генетика. Т. 54. № 10. С. 1177−1187. https://doi.org/10.1134/S0016675818100077
Beacham T.D., Varnavskaya N.V., McIntosh B., MacConnachie C. 2006a. Population structure of sockeye salmon from Russia determined with microsatellite DNA variation // Trans. Amer. Fish. Soc. V. 135. P. 97−109. https://doi.org/10.1577/T05-118.1
Beacham T.D., McIntosh B., MacConnachie C. et al. 2006б. Pacific Rim population structure of sockeye salmon as determined from microsatellite analysis // Ibid. V. 135. P. 174−187. https://doi.org/10.1577/T05-149.1
Benjamini Y., Hochberg Y. 1995. Controlling the false discovery rate: a powerful and practical approach to multiple testing // J. Roy. Stat. Soc. Ser. B. V. 57. № 1. P. 289–300.
Burgner R.L. 1991. Life history of Sockeye Salmon (Oncorhynchus nerka) // Pacific Salmon Life Histories / Eds. Groot C., Margolis L. Vancouver: UBC Press. P. 3–117.
Elfstrom C.M., Smith C.T., Seeb J.E. 2006. Thirty-two single nucleotide polymorphism markers for high-throughput genotyping of sockeye salmon // Mol. Ecol. Notes. V. 6. № 4. P. 1255−1259. https://doi.org/10.1111/j.1471-8286.2006.01507.x
Habicht C., Seeb L.W., Myers K.W. et al. 2010. Summer–fall distribution of stocks of immature sockeye salmon in the Bering Sea as revealed by single-nucleotide polymorphisms // Trans. Amer. Fish. Soc. V. 139. № 4. P. 1171−1191 (http://www.tandfonline.com/doi/suppl/https://doi.org/10.1577/T09-149.1?scroll=top). 10.1577/T09-149.1
Nei M., Li W.H. 1973. Linkage disequilibrium in subdivided populations // Genetics. V. 75. № 1. P. 213−219.
Pritchard J.K., Stephens M., Donnelly P. 2000. Inference of population structure using multilocus genotype data // Ibid. V. 155. № 2. P. 945–959. https://doi.org/10.1111/j.1471-8286.2007.01758.x
Raymond M., Rousset F. 1995. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism // J. Heredity. V. 86. P. 248−249.
Seeb J.E., Pascal C.E., Ramakrishnan R., Seeb L.W. 2009. SNP genotyping by the 5'-nuclease reaction: advances in high throughput genotyping with non-model organisms // Methods in molecular biology, single nucleotide polymorphisms / Ed. Komar A. N.Y.: Humana Press. P. 277−292. https://doi.org/10.1007/978-1-60327-411-1_18
Smith C.T., Elfstrom C.M., Seeb J.E., Seeb L.W. 2005. Use of sequence data from rainbow trout and Atlantic salmon for SNP detection in Pacific salmon // Mol. Ecol. V. 14. P. 4193−4203. https://doi.org/10.1111/j.1365-294X.2005.02731.x
Varnavskaya N.V., Wood C.C., Everett R. 1994. Genetic variation in sockeye salmon (Oncorhynchus nerka) populations of Asia and North America // Can. J. Fish. Aquat. Sci. V. 51. Suppl. 1. P. 132−146.
Wood C.C. 1995. Life history variation and population structure in sockeye salmon // Amer. Fish. Soc. Symp. V. 17. P. 195−216.
Wood C.C., Riddell B.E., Rutherford D.T. 1987: Alternative juvenile life histories of sock-eye salmon (Oncorhynchus nerka) and their contribution to production in the Stikine River, Northern British Columbia // Sockeye salmon (Oncorhynchus nerka) population biology and future management / Eds. Smith H.D. et al. Can. Fish. Aquat. Sci. Spec. Publ. V. 96. P. 12−24.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


