Вопросы ихтиологии, 2019, T. 59, № 6, стр. 737-740
Половое созревание и соотношение полов у тихоокеанской трески Gadus macrocephalus (Gadidae) в водах Приморья (Японское море)
А. Н. Вдовин *
Тихоокеанский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии − ТИНРО
Владивосток, Россия
* E-mail: vdovinan1955@mail.ru
Поступила в редакцию 30.01.2019
После доработки 23.04.2019
Принята к публикации 16.05.2019
Аннотация
Половое созревание 50% самцов тихоокеанской трески Gadus macrocephalus в водах Приморья происходит в возрасте 2+, самок − 4+; 100% − соответственно 6+ и 7+. По среднемноголетним данным в целом в популяции самцов больше, чем самок, в 1.2 раза, среди половозрелых особей − в 1.7 раза, что необходимо для успешного нереста.
Соотношение полов и темп полового созревания имеют функциональную связь с интенсивностью репродукции и гомеостазом популяции. Половая структура динамична и в своей динамике тесно связана как с возрастной структурой популяции, так и с уровнем её численности (Коновалов, 1980; Шилов, 2001; Вдовин, Черноиванова, 2006). Согласно концепции репродуктивной изменчивости (Малкин, 1995), по возрасту массового полового созревания самок определяется доля изъятия промыслового запаса.
Тихоокеанская треска Gadus macrocephalus – важный объект промысла в российских водах Дальнего Востока. Первым фундаментальным трудом по её биологии является монография Моисеева (1953). Информация о соотношении полов и темпу полового созревания тихоокеанской трески в этом регионе представлена во множестве публикаций (Борец, 1997; Ким Сен Ток, 1998; Фадеев, 2005; Винников, 2008; Полтев, 2008). Специализированных исследований по половому составу и половому созреванию трески в водах Приморья не проводили.
Цель работы – изучить динамику соотношения полов и полового созревания в течение жизненного цикла приморской трески.
МАТЕРИАЛ И МЕТОДИКА
Для определения соотношения полов и доли половозрелых рыб в возрастных группах трески использована база данных по биологическим анализам за 2004−2016 гг. Вызывающие сомнение данные по стадиям зрелости отфильтровывали. Весьма полезной при оценке качества данных по стадиям зрелости оказалась статья Сергеевой и Варкентина (2016). Объём генеральной выборки составил 756 экз.
Оценки численности возрастных групп трески за этот же период взяты из работы Вдовина с соавторами (2017). При расчёте этих оценок использованы данные контрольных уловов траловых съёмок, проведённых на акватории, прилегающей к материковому побережью российских вод Японского моря (Приморский край). В 13 съёмках было выполнено 3049 тралений в диапазоне глубин 20−700 м. Треска встречалась в 953 тралениях. Данные по численности и возрастному составу трески рассчитаны разными способами: с использованием коэффициента уловистости 1 (k = 1) и дифференцированных коэффициентов уловистости по длине и плотности скоплений (k(l)). В двух съёмках (2007 и 2014 гг.) использовали значения k(l) для средней плотности скоплений <100 экз/км2, в остальных – >100 экз/км2. Численность с k = 1 и k(l) обозначается соответственно N и Nd (Вдовин и др., 2017).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во многих работах, посвящённых биологии трески дальневосточных морей России, указывается, что соотношение полов у этого вида близко 1 : 1, либо отмечается небольшое преобладание самцов (Моисеев, 1953; Борец, 1997; Полтев, 2008). В этих и подобных работах говорится также о том, что в младших возрастных группах преобладают самцы, а в старших – самки. В отдельных публикациях приводятся примеры высокой изменчивости соотношения полов в зависимости от сезона и места обитания (Каика и др., 2013) вплоть до преобладания самок в нерестовом стаде (Ким Сен Ток, 2013). О резком различии соотношения полов в популяции камчатской трески в целом и в её нерестовой части утверждает Винников (2008). Его данные оказались весьма близки к данным японских исследований, которым посвящена работа Дерюгина (1928): в целом соотношение полов близко к 1 : 1, а в нерестовой части на одну самку приходится 2−3 самца.
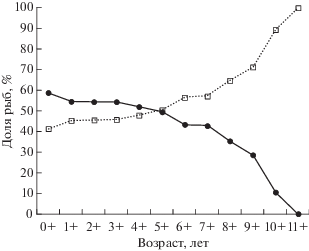
По нашим данным, как и по данным других авторов (Борец, 1997; Фадеев, 2005; Полтев, 2008), в младших возрастных группах преобладают самцы, а в старших – самки (рис. 1). Следует отметить, что со 2-го по 5-й год жизни преобладание самцов над самками невелико, а на 6-м году соотношение полов становится близким к 1 : 1. С 7-го года доля самцов начинает резко падать. Последнее определённо связано с пониженной выживаемостью самцов по сравнению с самками. О меньшей продолжительности жизни самцов говорится в публикациях известных нам авторов. Представленные данные различаются весьма значительно. По данным Овсянникова с соавторами (2013), в разных районах северо-западной части Охотского моря самцы перестают встречаться с возраста 6−8 лет. По Винникову (2008), предельный возраст самцов 10−11 лет, а самок – 12 лет. Наши данные совпадают с данными этого автора: предельный возраст самцов достигает 11 лет, самок – 12 (при максимальной длине 118 см). Отдельные самки, видимо, могут жить и дольше. Есть сведения о поимке трески в российских водах Японского моря длиной 140 см (Панченко и др., 2016). Такое явление следует отнести к феноменальному, поскольку подобная особь отмечена единственный раз за 33 года исследований.
Рис. 1.
Возрастная динамика доли самцов (⚫) и самок (◻) тихоокеанской трески Gadus macrocephalus в водах Приморья, по данным биологических анализов за 2004−2016 гг.
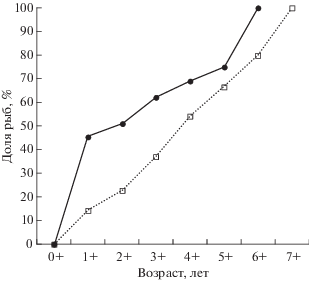
У приморской трески половое созревание начинается на 2-м году жизни (рис. 2). Доля половозрелых самцов в этом возрасте в 3.2 раза выше, чем половозрелых самок. С увеличением возраста подобная кратность между долями уменьшается. Все самцы созревают на 7-м году жизни, самки на год позже. По данным литературы, начало полового созревания трески в разных районах происходит в разном возрасте. По обобщённой Фадеевым (2005) информации в большинстве районов ареала самцы тихоокеанской трески созревают на 3−8-м году жизни, самки – на 4−9-м; но на юге ареала (к примеру, в Британской Колумбии) созревание начинается раньше − на 2−3-м годах жизни. На 2−3-м годах жизни также начинается созревание северокурильской трески (Полтев, 2008), хотя воды Северных Курил уместнее отнести к центру ареала.
Рис. 2.
Доля половозрелых самцов и самок в разных возрастных группах тихоокеанской трески Gadus macrocephalus в водах Приморья, по данным биологических анализов за 2014−2016 гг.; обозначения см. на рис. 1.
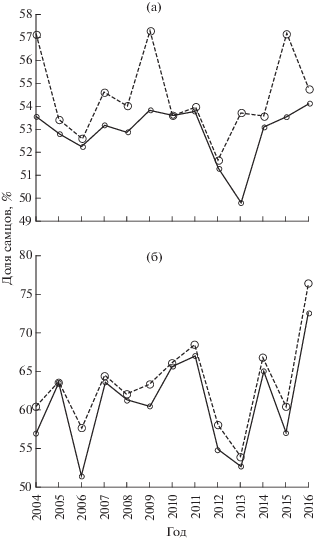
Соотношение полов в популяции в целом и в её нерестовой части характеризуется высокой межгодовой изменчивостью (рис. 3). Межгодовая динамика зависит, прежде всего, от динамики численности: из-за значительных различий в урожайности поколений возрастной состав популяции не может быть стабильным (Вдовин и др., 2017). Если уменьшение доли самцов с возрастом носит поступательный характер, то численность старшей возрастной группы, представляющей урожайное поколение, может быть выше численности предыдущего возраста, относящегося к неурожайному поколению. При разных способах расчёта ход динамики соотношения полов подобен, но доля самцов при использовании Nd всегда выше. Подчеркнём, что в популяции в целом она всегда выше половины. Данное обстоятельство определяется недоучётом молоди (среди которой значительно больше самцов) при использовании стандартного коэффициента уловистости (Вдовин и др., 2017). Различия в цифрах по соотношению полов в целом для популяции по N и Nd невелики (рис. 3а): в среднем соотношение между самками и самцами для N составляет 1.00 : 1.12, а для Nd – 1.00 : 1.19. В половозрелой части популяции самцов также всегда больше, чем самок (рис. 3б): при расчётах с использованием N в среднем в 1.57 (1.06−2.65) раза, Nd − 1.73 (1.17−3.25) раза. Межгодовая динамика соотношения полов у половозрелых особей выражена заметно отчётливее, чем в популяции в целом: интервал между минимальными и максимальными значениями доли самцов (по Nd) − 22.4 против 6.0%.
Рис. 3.
Динамика доли самцов в приморском стаде тихоокеанской трески Gadus macrocephalus в целом (а) и в его нерестовой части (б) в 2004−2016 гг., по данным расчёта численности с использованием коэффициента уловистости 1 (—) и дифференцированных по длине коэффициентов (- -).
В работах Ким Сен Тока (1998) и Полтева (2008) приводятся данные о межгодовой изменчивости соотношения полов в отдельных возрастных и размерных группах, однако какие-либо кардинальные отличия не прослеживаются. Таким образом, подобные изменения не способны в значительной степени сгладить межгодовую динамику полов. Важным является то обстоятельство, что в половозрелой части популяции самцов всегда больше самок. Поэтому представления о близком соотношении полов среди половозрелых особей нам представляются весьма сомнительными. Преобладание самцов в нерестовой части популяции, видимо, необходимо для успешного проведения нереста. В серии экспериментов по размножению тихоокеанской трески японские учёные установили, что одну самку оплодотворяет от одного до трёх самцов, чаще больше одного (Sakurai, Hattori, 1996). У дальневосточной наваги Eleginus gracilis эти же авторы наблюдали такое же нерестовое поведение. В экспериментах по размножению минтая Theragra chalcogramma на одну самку приходилось два−три самца (Sakurai, 1983; Baird, Olla, 1991). Примерно такое соотношение полов наблюдается у особей приморского минтая во время нереста в естественных условиях (Вдовин и др., 2015). В экспериментах по размножению пикши Melanogrammus aeglefinus нерестящиеся особи до образования пар сбиваются в группы по четыре рыбы − три самца и одна самка (Hawkins et al., 1967). Таким образом, у четырёх массовых тресковых видов рыб в нерестовом стаде преобладают самцы.
ВЫВОДЫ
1. Приморская треска начинает созревать на 2-м году жизни; 50% самцов достигают половой зрелости в возрасте 2+, самок – в возрасте 4+. Все самцы и самки являются половозрелыми в возрасте соответственно 6+ и 7+.
2. По среднемноголетним данным в популяции приморской трески самцов больше, чем самок, в 1.2 раза, в нерестовом стаде – в 1.7 раза.
3. Более достоверными количественными оценками по соотношению полов следует считать результаты расчётов по Nd, в которых нивелируется негативный фактор недоучёта молоди.
Список литературы
Борец Л.А. 1997. Донные ихтиоцены российского шельфа дальневосточных морей: состав, структура, элементы функционирования и промысловое значение. Владивосток: Изд-во ТИНРО, 217 с.
Вдовин А.Н., Черноиванова Л.А. 2006. Многолетняя динамика некоторых параметров популяции тихоокеанской сельди Clupea pallasii (Clupeidae) залива Петра Великого // Вопр. ихтиологии. Т. 46. № 1. С. 54–61.
Вдовин А.Н., Нуждин В.А., Бойко М.И. 2015. Возрастная динамика полового состава приморского минтая Theragra chalcogramma (Японское море) // Вопр. рыболовства. Т. 16. № 3. С. 351–358.
Вдовин А.Н., Четырбоцкий А.Н., Нуждин В.А. 2017. Оценка репрезентативности выборки донных траловых съемок на примере тихоокеанской трески Японского моря // Тр. ВНИРО. Т. 165. С. 45−60.
Винников А.В. 2008. Тихоокеанская треска западной Камчатки: биология, динамика численности, промысел: Автореф. дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 24 с.
Дерюгин К.М. 1928. Некоторые результаты научно-промысловых исследований в Охотском море, осуществленные в 1915−1918 гг. под руководством проф. Марукава // Изв. Тихоокеан. науч.-промысл. станции. Т. 1. Вып. 1. С. 325−328.
Каика А.И., Юсупов Р.Р., Орлов А.М., Смирнов А.А. 2013. Биологическая характеристика и распределение тихоокеанской трески Gadus macrocephalus (Gadidae) в северной части Охотского моря // Тихоокеанская треска дальневосточных вод России. М.: Изд-во ВНИРО. С. 117−133.
Ким Сен Ток. 1998. Особенности биологии и численность тихоокеанской трески в водах западного побережья Сахалина и южных Курильских островов // Изв. ТИНРО. Т. 124. С. 212–235.
Ким Сен Ток. 2013. Отличительные черты биологии и ресурсы тихоокеанской трески северо-восточной части Японского моря (западное побережье о. Сахалин // Тихоокеанская треска дальневосточных вод России. М.: Изд-во ВНИРО. С. 81–106.
Коновалов С.М. 1980. Популяционная биология тихоокеанских лососей. Л.: Наука, 238 с.
Малкин Е.М. 1995. Принцип регулирования промысла на основе концепции репродуктивной изменчивости популяций // Вопр. ихтиологии. Т. 35. № 4. С. 537−540.
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Изв. ТИНРО. Т. 40. 288 с.
Овсянников В.П., Немченко А.Ю., Сидяков Ю.В. 2013. Новые данные об экологии и промысле тихоокеанской трески прибрежных вод северо-западной части Охотского моря // Тихоокеанская треска дальневосточных вод России. М.: Изд-во ВНИРО. С. 106–117.
Панченко В.В., Калчугин П.В., Соломатов С.Ф. 2016. Уточнение глубин обитания и максимальных размеров донных и придонных видов рыб в российских водах Японского моря // Вопр. ихтиологии. Т. 56. № 3. С. 264−283. https://doi.org/10.7868/S0042875216030152
Полтев Ю.Н. 2008. Некоторые вопросы, связанные с размножением тихоокеанской трески Gadus macrocephalus в водах восточного побережья северных Курильских островов и южной оконечности Камчатки // Там же. Т. 48. № 3. С. 393−403.
Сергеева Н.П., Варкентин А.И. 2016. Закономерности полового созревания, половой цикл и шкала стадий зрелости гонад тихоокеанской трески (Gadus macrocephalus) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 42. С. 5−31.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Шилов И. А. 2001. Экология. М.: Высш. шк., 512 с.
Baird T.A., Olla B.L. 1991. Social and reproductive behavior of a captive group of walleye Pollock Theragra chalcogramma // Environ. Biol. Fish. V. 30. P. 295–301.
Hawkins A.D., Chapman K.J., Symonds D.J. 1967. Spawning of haddock in captivity // Nature. V. 215. № 5104. P. 923–925.
Sakurai Y. 1983. Reproductive behavior of walleye pollock in captivity // Aquabiology. V. 5. P. 1−7.
Sakurai Y., Hattori T. 1996. Reproductive behavior of Pacific cod in captivity // Fish. Sci. V. 62. № 2. P. 222−228.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


