Вопросы ихтиологии, 2020, T. 60, № 1, стр. 74-81
Морфология сперматозоидов рыб семейства Mullidae: Upeneus sulphureus
Н. Г. Емельянова 1, *, Д. А. Павлов 1
1 Московский государственный университет
Москва, Россия
* E-mail: enata744@mail.ru
Поступила в редакцию 07.03.2019
После доработки 07.03.2019
Принята к публикации 20.04.2019
Аннотация
Методами сканирующей и трансмиссионной электронной микроскопии исследована морфология сперматозоидов Upeneus sulphureus и проведено сравнение формы головок сперматозоидов у U. sulphureus, U. tragula, U. margarethae и Parupeneus multifasciatus. Сперматозоид U. sulphureus имеет овальную головку, уплощённую с одной стороны, ядро с глубоким U-образным вырезом, коаксиально расположенные центриоли и два сечения митохондрий в средней части. Со стороны уплощения головки её апикальный конец слегка изогнут и заострён. По форме головки U. tragula и U. margarethae отличаются от всех представителей семейства Mullidae, морфология сперматозоидов которых описана до настоящего времени, наличием сильно изогнутого и заострённого апикального конца головки и одного сечения митохондрии в средней части. Данные по сравнительной морфологии сперматозоидов обсуждаются в связи с существующими филогенетическими схемами.
Морфология сперматозоидов рыб отражает их эволюционную историю, может использоваться в качестве дополнительных таксономических признаков и для анализа особенностей биологии размножения (Jamieson, 1991; Mattei, 1991). Ультраструктура сперматозоидов в сравнительном плане описана у относительно небольшого числа морских рыб, включая, например, представителей семейств Apogonidae (Lahnsteiner, 2003), Sparidae (Maricchiolo et al., 2004; Mahmoud, 2010), Scorpaenidae, Synanceiidae (Sàbat et al., 2009; Павлов, Емельянова, 2018) и Sebastidae (Vila et al., 2010). Эти работы показали, что в пределах крупных таксономических групп (подотряды и семейства) сперматозоиды характеризуются общим планом строения, но существует значительная межвидовая изменчивость.
Данные по ультраструктуре сперматозоидов рыб семейства Mullidae приведены для западноафриканской барабули Pseudupeneus prayensis (= Upeneus prayensis) (Boisson et al., 1969), европейской барабули Mullus barbatus (Lahnsteiner, Patzner, 1995), чернопятнистой барабули Parupeneus spilurus (= Paraupeneus spilurus) (Gwo et al., 2004), полосатой зубатой барабули P. multifasciatus, двуцветной барабули P. barberinoides (Емельянова, Павлов, 2012), чернополосой козобородки Upeneus tragula и U. margarethae (Емельянова, Павлов, 2014). Сперматозоиды двух последних видов имеют необычную для костистых рыб форму с сильно изогнутым и заострённым апикальным концом головки. Род Upeneus включает виды, характеризующиеся значительным разнообразием. В последнее время описано несколько новых видов, общее число которых составляет 42 (Uiblein, Gouws, 2015; Uiblein et al., 2017, 2019). Имеется ли специфическая форма сперматозоида у других представителей рода Upeneus, пока остаётся неясным. Анализ морфологии сперматозоидов может быть полезным для выяснения филогенетических взаимоотношений видов в пределах рода и в целом в семействе Mullidae.
Жёлтая козобородка U. sulphureus распространена в следующих регионах: Красное море, Персидский залив, Мадагаскар, Сейшельские острова, Реюньо́н, Пакистан, Индия, Шри Ланка, Андаманское море, Индонезия, Новая Гвинея, Фиджи, Новая Каледония, Филиппины, Южная Япония (Uiblein, Heemstra, 2010). Обитает в прибрежных водах и эстуариях на глубине от 10 до 90 м, достигает полной длины (TL) 23 см, является объектом промысла (Randall, Kulbicki, 2006; Froese, Pauly, 2019).
Цель работы − описать особенности морфологии сперматозоидов U. sulphureus. Биология жёлтой козобородки остаётся слабо исследованной. В связи с этим мы приводим некоторые биологические характеристики особей из прибрежной зоны Центрального Вьетнама.
МАТЕРИАЛ И МЕТОДИКА
Особи U. sulphureus были приобретены на рыбных рынках г. Нячанг (южная часть Центрального Вьетнама) и Дананг (Центральный Вьетнам) в 2013−2017 гг.. Биологический анализ и фиксацию материала проводили на базе Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра (Нячанг), а также в г. Дананг. Для электронной сканирующей микроскопии (СЭМ) и трансмиссионной микроскопии (ТЭМ) использовали фрагменты семяпроводов самцов, отловленных в зал. Нячанг в 2017 г. Фиксатором служила смесь 2.5%-ного раствора глутарового альдегида и 2%-ного параформальдегида на фосфатном буфере pH 7.4 с добавлением хлористого натрия (2.5%) и сахарозы (1.5%). Постфиксацию осуществляли в 1%-ном растворе четырёхокиси осмия. Дальнейшую обработку для СЭМ и ТЭМ проводили общепринятыми методами (Уикли, 1975). Объекты для СЭМ напыляли сплавом золота с палладием и исследовали в растровом электронном микроскопе CamScan S-4 (“Cambridge Instruments”, Великобритания) при ускоряющем напряжении 20 кВ. Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1011 Jeol (“Jeol”, Япония) при ускоряющем напряжении 80 кВ. Для получения изображений использовали цифровую камеру ES-500W (“Gatan”, СШA) и компьютерную программу Digital Micrograph. Измерения объектов проведены посредством компьютерной программы ImageJ.
Для сравнения морфологии сперматозоидов U. sulphureus с другими видами использовали полученные нами ранее (Емельянова, Павлов, 2012, 2014) изображения сперматозоидов U. tragula, U. margarethae и P. multifasciatus. Самцы трёх последних видов также отловлены в зал. Нячанг11. Форму головок сперматозоидов сравнивали, выбирая изображения (СЭМ) сбоку и “в профиль” с заметным на одной стороне головки уплощением (при его наличии) или с изгибом её апикальной части. Контрастное изображение головки сперматозоида (без части жгутика, которую удаляли посредством программы Photoshop) обрабатывали в программе ImageJ (Image–Adjust–Threshold). Используя инструмент Wand (tracing) tool, получали изображение белой головки сперматозоида на чёрном фоне, которое конвертировали в RGB (24-bit) bmp-файл для последующего анализа. Изображения головок сперматозоидов ориентировали уплощением или вогнутой частью головки вверх (Photoshop) и обрабатывали посредством эллиптического анализа Фурье и пакета SHAPE 1.3 (Iwata, Ukai, 2002). Этот анализ предусматривает описание контура, которое не зависит от его ориентации, размера и начальной точки отсчёта. Контур головки сперматозоида описывается несколькими гармониками, каждая из которых характеризуется четырьмя коэффициентами (дескрипторами Фурье). Чем больше число гармоник, тем более точно описывается контур (Kuhl, Giardina, 1982). Первоначальное число гармоник составило 20. Три первых коэффициента первой гармоники не использованы для анализа, поскольку они являются константами и применяются для нормализации остальных гармоник, но четвёртый коэффициент включён в модель. Для определения необходимого и достаточного числа гармоник в программе PAST 2.17 (Hammer et al., 2001) последовательно удаляли коэффициенты последних гармоник, вносящих наименьший вклад в дискриминацию, и анализировали распределение точек в пространстве главных компонент. Это распределение практически не менялось при удалении коэффициентов 16 гармоник. Таким образом, число дескрипторов Фурье, описывающих контур каждой головки сперматозоида, составило 13.
РЕЗУЛЬТАТЫ
Биологические показатели U. sulphureus. Среди особей FL 98–104 мм из зал. Нячанг пол удалось определить лишь у трёх самок с яичниками II стадии зрелости (таблица). Особи FL 109–165 мм, отловленные в районе Дананга в январе, не участвовали в размножении, что подтверждается низкими значениями гонадосоматического индекса (ГСИ) самок и самцов. Большинство самок имели яичники II стадии зрелости. В гонадах заметны единичные, чуть более крупные ооциты, возможно, являющиеся клетками, вступившими в период вителлогенеза. У двух наиболее крупных особей массой 95.7 и 71.0 г. в яичниках обнаружены атретические тела – остатки резорбировавшихся желтковых ооцитов. У всех самцов среди половых клеток присутствовали сперматозоиды, более многочисленные в семяпроводах, чем в семенниках. В зал. Нячанг в апреле все особи FL 134–165 мм участвовали в размножении. Яичники самок находились на IV стадии зрелости (старшая генерация ооцитов представлена заполненными желтком клетками); семенники самцов − на IV и IV–V стадии.
Биологические показатели Upeneus sulphureus
| Показатель | Район, месяц и год сбора | |||||
|---|---|---|---|---|---|---|
| Дананг, 01.2013 | Нячанг | |||||
| 02.2016 | 04.2017 | |||||
| Cамки | Cамцы | juv. | Cамки | Cамки | Cамцы | |
| Длина по Смитту (FL), мм | $\frac{{120{\kern 1pt} --{\kern 1pt} 165}}{{138{\text{ }}\left( {17} \right)}}$ | $\frac{{109{\kern 1pt} --{\kern 1pt} 146}}{{121\,\,\left( {10} \right)}}$ | $\frac{{98{\kern 1pt} --{\kern 1pt} 104}}{{101{\text{ }}(3)}}$ | $\frac{{100{\kern 1pt} --{\kern 1pt} 104}}{{102{\text{ }}\left( 2 \right)}}$ | $\frac{{151{\kern 1pt} --{\kern 1pt} 165}}{{158{\text{ }}\left( 7 \right)}}$ | $\frac{{134{\kern 1pt} --{\kern 1pt} 157}}{{145{\text{ }}\left( 7 \right)}}$ |
| Масса, г | $\frac{{34.8{\kern 1pt} --{\kern 1pt} 95.7}}{{54.3{\text{ }}\left( {21.7} \right)}}$ | $\frac{{25.3{\kern 1pt} --{\kern 1pt} 55.2}}{{35.9{\text{ }}\left( {9.0} \right)}}$ | $\frac{{17.6{\kern 1pt} --{\kern 1pt} 20.7}}{{18.6{\text{ }}\left( {1.4} \right)}}$ | $\frac{{19.8{\kern 1pt} --{\kern 1pt} 20.9}}{{20.5{\text{ }}\left( {0.5} \right)}}$ | $\frac{{68.5{\kern 1pt} --{\kern 1pt} 97.3}}{{80.4{\text{ }}\left( {15.0} \right)}}$ | $\frac{{46.1{\kern 1pt} --{\kern 1pt} 73.8}}{{57.2{\text{ }}\left( {8.4} \right)}}$ |
| ГСИ, % | $\frac{{0.6{\kern 1pt} --{\kern 1pt} 1.0}}{{0.8{\text{ }}\left( {0.1} \right)}}$ | $\frac{{0.3{\kern 1pt} --{\kern 1pt} 1.1}}{{0.6{\text{ }}\left( {0.3} \right)}}$ | − | $\frac{{0.25{\kern 1pt} --{\kern 1pt} 0.42}}{{0.35{\text{ }}\left( {0.09} \right)}}$ | $\frac{{4.6{\kern 1pt} --{\kern 1pt} 6.6}}{{5.5{\text{ }}\left( {1.0} \right)}}$ | $\frac{{1.5{\kern 1pt} --{\kern 1pt} 3.1}}{{2.4{\text{ }}\left( {0.4} \right)}}$ |
| Число рыб, экз. | 7 | 15 | 5 | 3 | 3 | 18 |
Особенности морфологии сперматозоидов. Сперматозоиды U. sulphureus имеют головку овальной формы, незначительную по размеру среднюю часть и жгутик. При изучении с помощью СЭМ средняя часть сперматозоида не выражена (рис. 1а). Головка несколько более широкая в базальной части по сравнению с апикальной и на одной стороне уплощена. Со стороны уплощения головки её апикальный конец слегка изогнут и заострён (рис. 1б). По данным СЭМ, длина головки составляет 1.5–1.8 (в среднем 1.7) мкм, наибольшая ширина в базальной части – 1.4–1.0 (1.2) мкм (n = 15), длина жгутика – 44–57 (50) мкм (n = 9). Головка сперматозоида окружена ядерной мембраной, не содержащей пор, и плазмалеммой. Хроматиновый материал головки плотно упакован. Углубление в основании ядра, в цитоплазме которого находится центриолярный комплекс и базальная часть жгутика, сильно развито, имеет форму перевёрнутой буквы U и составляет около 90% длины ядра. Оно расположено в центре основания ядра, реже – слегка эксцентрично. Проксимальная центриоль расположена над дистальной и обычно слегка смещена относительно последней. Она видна в виде округлого веретеноподобного образования или полукольца высокой электронной плотности. На продольных срезах в цитоплазме средней части обычно имеются два сечения митохондрий, на поперечных – три или четыре. Аксонема жгутика построена по классической схеме и состоит из девяти дуплетов периферических микротрубочек и двух центральных – (9 × 2) + 2. Микротрубочки аксонемы электронопрозрачны. Аксонема окружена цитоплазматическим чехлом, имеющим неодинаковую ширину в разных участках жгутика и образующим латеральные гребни.
Рис. 1.
Морфология сперматозоидов видов семейства Mullidae: а, б – Upeneus sulphureus; в, г – U. tragula; д, е – U. margarethae; ж, з – Parupeneus multifasciatus; а, в, д, ж – сканирующая электронная микроскопия (СЭМ), б, г, е, з – трансмиссионная электронная микроскопия (ТЭМ). 1 – слегка изогнутый и заострённый апикальный конец головки, 2 – проксимальная центриоль, 3 – дистальная центриоль, 4 – митохондрия. Масштаб: 1 мкм.
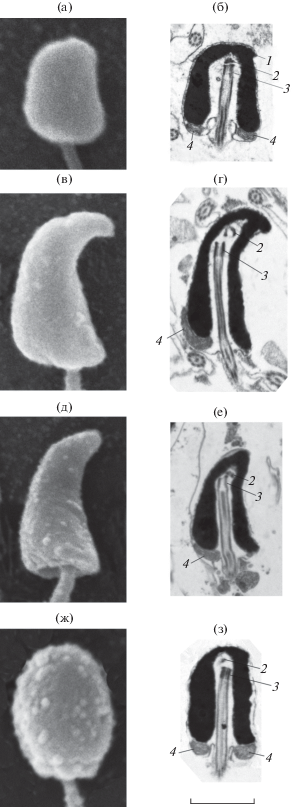
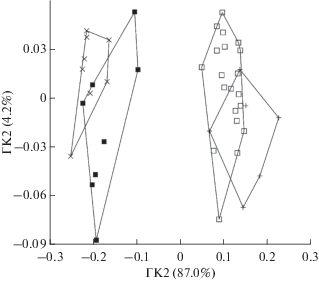
По форме головки и ультраструктуре сперматозоидов U. sulphureus отличается от U. tragula и U. margarethae (рис. 1в–1е) и сближается с P. multifasciatus (рис. 1ж, 1з). Очевидно, в связи с сильно изогнутым апикальным концом головки у U. tragula и U. margarethae проксимальные центриоли в большей степени, чем у других видов, смещены по отношению к дистальным. В средней части сперматозоидов U. tragula и U. margarethae заметно лишь одно сечение митохондрии.
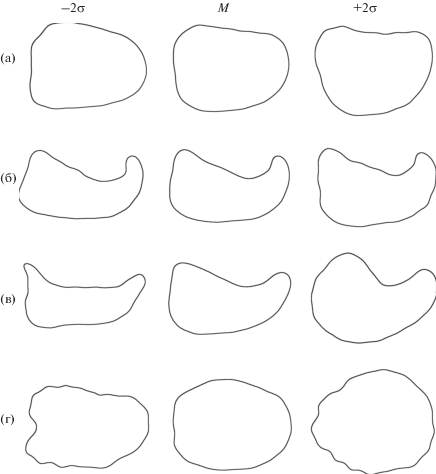
Сравнение формы головки сперматозоида у четырёх видов с помощью эллиптического анализа Фурье показало, что в целом она специфична для вида (рис. 2, рис. 3). Уплощение головки сперматозоида P. multifasciatus (рис. 2г) проявляется в небольшой степени и заметно не у всех клеток, в то время как аналогичное уплощение у U. sulphureus (рис. 2а) более выражено. Апикальный конец головки слегка более изогнут у U. tragula, чем у U. margarethae (рис. 2б, 2в). В пространстве главных компонент U. sulphureus + P. multifasciatus и U. tragula + + U. margarethae чётко обособлены друг от друга, а дискриминация почти полностью определяется первой главной компонентой (рис. 3).
Рис. 2.
Реконструированные контуры головки сперматозоида (СЭМ) видов семейства Mullidae по результатам анализа коэффициентов Фурье методом главных компонент: а – Upeneus sulphureus, б – U. tragula, в – U. margarethae, г – Parupeneus multifasciatus. Приведены контуры, описываемые первой главной компонентой; 2σ – два средних квадратических отклонения, M – усреднённый контур.
ОБСУЖДЕНИЕ
В статьях, посвящённых биологии U. sulphureus из разных регионов, затрагиваются преимущественно вопросы промышленного рыболовства, структуры популяций, роста и питания рыб; многие из этих статей цитируются в работе, посвящённой состоянию популяций этого вида в северо-западной части Персидского залива (Mohamed, Resen, 2010). Данные по репродуктивным характеристикам U. sulphureus в литературе практически отсутствуют. Сообщается, что в прибрежной зоне штатов Андхра и Орисса (Индия) размножение U. sulphureus наблюдается, главным образом, с января по май, причём 50% особей созревают по достижении TL 131 мм (Reuben et al., 1994). Эта длина соответствует ≈ 116 мм FL. По нашим данным, все рыбы FL < 104 мм не достигли половой зрелости. Отсутствие размножающихся рыб в январе может свидетельствовать о том, что, как и в прибрежной зоне Индии, нерест является сезонным и, по-видимому, происходит весной, по крайней мере в районе Дананга. Во время размножения ГСИ самок U. sulphureus, достигающий 6.6%, близок к ГСИ самок других видов рода Upeneus. Например, ГСИ U. tragula достигает 8.5% (Pavlov et al., 2014), U. margarethae – 7.9% (Павлов, Емельянова, 2016), Upeneus pori – 7.5% (Ramadan, El-Halfawy, 2014). В то же время ГСИ самцов U. sulphureus, достигающий 3.1%, оказался необычно высок. Близкое максимальное значение ГСИ самцов (2.8%) зарегистрировано лишь у Mullus barbatus из Тунисского залива (Cherif еt al., 2007). У остальных видов семейства Mullidae максимальные значения ГСИ самцов значительно меньше: U. tragula – 0.8% (Pavlov et al., 2014), U. margarethae – 0.7% (Павлов, Емельянова, 2016), P. multifasciatus – 1.1% (Павлов и др., 2011), P. barherinus – 1.1% (Wahbeh, Ajiad, 1985), Mulloides flavilineatus и M. vanicolensis – 0.7% (Wahbeh, 1992), Pseudupeneus grandisquamis – 1.1% (Lucano-Ramírez et al., 2006).
На основе имеющихся сведений по ультраструктуре сперматозоидов видов семейства Mullidae можно выделить следующие плезиоморфные признаки. Головка умеренно удлинённая с U-образным ядром. Глубокое проникновение центриолярного комплекса и основания жгутика в углубление в ядре, по-видимому, способствует надёжной фиксации жгутика (Gwo et al., 2004). Средняя часть слабо выражена и включает несколько митохондрий, расположенных в один ряд. Другой характерный признак – наличие более или менее коаксиально расположенных центриолей, хотя проксимальные и дистальные центриоли могут быть слегка смещены друг относительно друга, что наблюдается у M. barbatus (Lahnsteiner, Patzner, 1995), P. spilurus (Gwo et al., 2004), P. multifasciatus, P. barberinoides (Емельянова, Павлов, 2012), U. sulphureus (наша статья) и в наибольшей степени у U. tragula и U. margarethae (Емельянова, Павлов, 2014).
Средняя часть сперматозоидов M. barbatus и P. spilurus на продольном срезе имеет два сечения митохондрий, митохондрии плотно прилегают друг к другу, а их число на поперечных срезах равно соответственно пяти (Lahnsteiner, Patzner, 1995, 1998) и шести (Gwo et al., 2004). Такое же расположение митохондрий, очевидно, свойственно P. multifasciatus и P. barberinoides (Емельянова, Павлов, 2012), в то время как у U. sulphureus число митохондрий варьирует от трёх до четырёх. На продольных срезах сперматозоидов U. tragula и U. margarethae имеется лишь одно сечение митохондрии, в некоторых случаях заметна незначительная по размеру часть 2-го сечения, а клетки без сечений отсутствуют. Такая особенность продольных срезов позволяет предположить наличие не более трёх митохондрий.
В головках сперматозоидов рода Upeneus хроматин плотно упакован, тогда как у P. multifasciatus и P. barberinoides отдельные глыбки хроматина всё же различимы; и это более отчётливо выражено в сперматозоидах последнего вида (Емельянова, Павлов, 2012). Известно, что компактная локализация хроматина связана с отсутствием синтетических процессов в ядре до момента оплодотворения (Данилова, 1978).
Наличие латеральных гребней жгутика (формирующихся в связи с разной толщиной цитоплазматического чехла, окружающего жгутик) отмечено у M. barbatus (Lahnsteiner, Patzner, 1995, 1998), P. multifasciatus, P. barberinoides (Емельянова, Павлов, 2012), U. tragula, U. margarethae (Емельянова, Павлов, 2014) и U. sulphureus (наша статья), но эти структуры не обнаружены у P. spilurus (Gwo et al., 2004).
Виды семейства Mullidae значительно различаются по форме головки сперматозоида. Головка, уплощённая с одной стороны, впервые отмечена у P. spilurus (Gwo et al., 2004). Позднее такая же форма головки описана у P. multifasciatus, P. barberinoides (Емельянова, Павлов, 2012) и U. sulphureus (наша статья). Форма головки сперматозоида может быть достаточно точно описана с помощью эллиптического анализа Фурье, который подтверждает отмеченную ранее (Емельянова, Павлов, 2014) уникальную форму головки сперматозоида U. tragula и U. margarethae со значительно изогнутой и заострённой апикальной частью. Функциональное значение такой формы головки, очевидно, состоит в обеспечении надёжной фиксации сперматозоида в воронке микропиле ооцита в условиях микротурбулентности. Принцип фиксации может быть подобен действию рога якоря. Как отмечено выше, тенденция к формированию асимметрии головки сперматозоида проявляется у ряда видов рода Parupeneus, а также у U. sulphureus. Морфология сперматозоидов U. sulphureus со слегка изогнутым и заострённым апикальным концом головки, по-видимому, является переходной к необычной форме сперматозоидов U. tragula и U. margarethae.
Характеристики подвижности сперматозоидов рыб после активации определяются такими морфологическими параметрами, как форма головки, влияющая на гидродинамические свойства гамет, число митохондрий, определяющих энергетические запасы, и наличие латеральных гребней жгутика, увеличивающих силу его биения (Lahnsteiner, Patzner, 1998). Вместе с тем связь морфологии сперматозоидов M. barbatus и U. tragula с их подвижностью оказалась достаточно сложной. Несмотря на большее число митохондрий в средней части сперматозоида у первого вида, продолжительность подвижности гамет после активации составляет соответственно 1 мин 30 с (Lahnsteiner, Patzner, 1998) и 5 мин (Емельянова и др., 2015). Не исключено, что меньшая продолжительность подвижности сперматозоидов у M. barbatus компенсируется их значительной концентрацией в связи с высокими значениями ГСИ (см. выше). Следует отметить, что среди представителей семейства Mullidae нерест описан, по-видимому, лишь у черноморской султанки M. barbatus ponticus по наблюдениям в аквариуме (Овен, 2004). Икрометание и осеменение ооцитов осуществлялись у дна, после чего яйца сразу всплывали, что предполагает непродолжительный контакт между гаметами.
Таким образом, имеющиеся сведения по морфологии сперматозоидов рыб семейства Mullidae не позволяют выделить признаки, характерные для отдельных родов, но подтверждают филогенетическую близость U. tragula и U. margarethae, отмеченную на основе морфологического анализа (Uiblein, Heemstra, 2010), оценки формы отолитов (Павлов, 2016) и молекулярного анализа (Bos, 2014; Uiblein et al., 2016). В пределах рода Upeneus виды объединены первоначально в четыре группы (Uiblein, Heemstra, 2010), а впоследствии в шесть групп (Uiblein et al., 2019), причём U. sulphureus, U. tragula и U. margarethae входят в состав групп видов “mollucensis”, “tragula” и “margarethae” соответственно. По молекулярным данным (анализ последовательности нуклеотидов в фрагменте субъединицы I цитохром C-оксидазы (COI)), при использовании видов рода Mulloidichthys и Parupeneus в качестве аутгрупп, U. sulphureus, с одной стороны, и U. tragula + U. margarethae, с другой, входят в состав двух крупных сестринских клад, причём монофилия выделенной по морфологическим признакам группы “tragula” (включающей U. margarethae) не подтверждается (Bos, 2014; Uiblein et al., 2016). Из исследованных видов во вторую кладу вместе с U. tragula + U. margarethae в одном случае входят U. japonicus и U. pori (Bos, 2014), а в другом – U. heemstra, U. guttatus и U. parva (Uiblein et al., 2016). Уникальная форма головки сперматозоидов U. tragula и U. margarethae, очевидно, является синапоморфным признаком. Наличие этого признака у других видов позволит уточнить филогенетические отношения в пределах рода Upeneus.
Генетический анализ нескольких представителей семейства Mullidae из Красного и Средиземного морей показал, что виды родов Mullus, Parupeneus и Mulloides являются сестринской группой по отношению к видам рода Upeneus (Golani, Ritte, 1999). Эти результаты подтверждены секвенированием полного митохондриального генома ряда видов костистых рыб, включая шесть видов семейства Mullidae: U. japonicus и U. tragula являются сестринской группой по отношению к трём видам рода Parupeneus и Mulloidichthys vanicolensis (Song et al., 2017). По остеологическим и миологическим признакам виды родов Parupeneus и Pseudupeneus в наибольшей степени отличаются от остальных барабулевых рыб и рассматриваются как наиболее специализированные. Специализация связана главным образом с относительным удлинением рыла, а значительная степень развития зубов в ротовом аппарате представителей рода Upeneus является генерализованным признаком (Gosline, 1984). В филогенетической схеме, построенной по ряду анатомических признаков, виды рода Upeneus и Parupeneus также рассматриваются как соответственно наиболее генерализованные и специализированные (Kim, 2002. Fig. 100 ). На основе морфологии сперматозоидов можно предположить противоположную ситуацию. Округлая и сравнительно симметричная головка может рассматриваться как плезиоморфный признак семейства, в то время как асимметричная головка с сильно изогнутой апикальной частью, по крайней мере у некоторых видов рода Upeneus, является филогенетически продвинутым признаком.
Список литературы
Данилова Л.В. 1978. Ультраструктурное исследование сперматогенеза. М.: Наука, 208 с.
Емельянова Н.Г., Павлов Д.А. 2012. Ультраструктура гамет некоторых видов семейства Mullidae Южно-Китайского моря // Вопр. ихтиологии. Т. 52. № 6. С. 701–707.
Емельянова Н.Г., Павлов Д.А. 2014. Ультраструктура гамет двух видов рода Upeneus (Mullidae) Южно-Китайского моря // Там же. Т. 54. № 3. С. 352–358. https://doi.org/10.7868/S0042875214030023
Емельянова Н.Г., Павлов Д.А., Лыонг Тхи Бик Тхуан, Во Тхи Ха. 2015. Состояние гонад, подвижность сперматозоидов и начальные стадии эмбрионального развития Upeneus tragula (Mullidae) // Там же. Т. 55. № 2. С. 196–206. https://doi.org/10.7868/S0042875215020071
Овен Л.С. 2004. Специфика развития половых клеток морских рыб в период размножения, как показатель типа нереста и реакции на условия среды обитания. М.: Изд-во ВНИРО, 186 с.
Павлов Д.А. 2016. Дифференциация трёх видов рода Upeneus (Mullidae) по форме отолитов // Вопр. ихтиологии. Т. 56. № 1. С. 41–55. https://doi.org/10.7868/S0042875216010112
Павлов Д.А., Емельянова Н.Г. 2016. Особенности размножения Upeneus margarethae (Mullidae) – вида, впервые обнаруженного в прибрежной зоне Вьетнама // Там же. Т. 56. № 4. С. 474–486. https://doi.org/10.7868/S0042875216040135
Павлов Д.А., Емельянова Н.Г. 2018. Сравнительный анализ морфологии сперматозоидов у трёх видов рыб подотряда Scorpaenoidei // Там же. Т. 58. № 2. С. 201–214. https://doi.org/10.7868/S0042875218020091
Павлов Д.А., Емельянова Н.Г., Лыонг Тхи Бик Тхуан, Во Тхи Ха. 2011. Размножение и начальное развитие полосатой зубатой барабули Parupeneus multifasciatus (Mullidae) // Там же. Т. 51. № 5. С. 628–641.
Уикли Б. 1975. Электронная микроскопия для начинающих. М.: Мир, 324 с.
Boisson C., Mattei X., Mattei C. 1969. Mise en place et evolution du complexe centriolaire au cours de la spermiogenese d’Upeneus prayensis C.V. (Poisson Mullidae) // J. Microscopie (Paris). V. 8. P. 103–112.
Bos A.R. 2014. Upeneus nigromarginatus, a new species of goatfish (Perciformes: Mullidae) from the Philippines // Raffles Bull. Zool. V. 62. P. 745–753.
Cherif M., Zarrad R., Gharbi H. et al. 2007. Some biological parameters of the red mullet, Mullus barbatus L., 1758, from the Gulf of Tunis // Acta Adriat. V. 48. № 2. P. 131–144.
Froese R., Pauly D. (eds.). 2019. FishBase. World Wide Web electronic publication. (http://www.fishbase.org. Version 08/2019)
Golani D., Ritte U. 1999. Genetic relationships in goatfishes (Mullidae: Perciformes) of the Red Sea and the Mediterranean, with remarks on Suez Canal migrants // Sci. Mar. V. 63. № 2. P. 129–135.
Gosline W.A. 1984. Structure, function, and ecology in the goatfishes (family Mullidae) // Pac. Sci. V. 38. № 4. P. 312–323.
Gwo J.C., Yang W.T., Kuo M.C. et al. 2004. Spermatozoal ultrastructures of two marine perciform teleost fishes, the goatfish, Paraupeneus spilurus (Mullidae) and the rabbitfish, Siganus fuscescens (Siganidae) from Taiwan // Tiss. Cell. V. 36. P. 63–69.
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: paleontological statistics software package for education and data analysis // Palaeont. Electr. V. 4. № 1. P. 1–9.
Iwata H., Ukai Y. 2002. Shape: a computer program package for quantitative evaluation of biological shapes based on elliptic Fourier descriptors // J. Hered. V. 93. P. 384–385.
Jamieson B.G.M. 1991. Fish evolution and systematics: evidence from spermatozoa. Cambridge: Cambridge Univ. Press, 319 p.
Kim B.-J. 2002. Comparative anatomy and phylogeny of the family Mullidae (Teleostei: Perciformes) // Mem. Grad. Sch. Fish. Sci. Hokkaido Univ. V. 49. № 1. P. 1–74.
Kuhl F.P., Giardina C.R. 1982. Elliptic Fourier features of a closed contour // Comput. Graph. Image Process. V. 18. P. 236–258.
Lahnsteiner F. 2003. The spermatozoa and eggs of the cardinal fish // J. Fish Biol. V. 62. P. 115–128.
Lahnsteiner F., Patzner R.A. 1995. Fine structure of spermatozoa of two marine teleost fishes, the red mullet, Mullus barbatus (Mullidae) and the white sea bream, Diplodus sargus (Sparidae) // J. Submicroscopic Cytol. Pathol. V. 27. P. 259–266.
Lahnsteiner F., Patzner R.A. 1998. Sperm motility of the marine teleosts Boops boops, Diplodus sargus, Mullus barbatus and Trachurus mediterraneus // J. Fish Biol. V. 52. P. 726–742.
Lucano-Ramírez G., Ruiz-Ramírez S., Rojo-Vázquez J.A. 2006. Composición por tallas y ciclo reproductivo de Pseudupeneus grandisquamis (Pisces: Mullidae) en el Pacífico central Mexicano // Rev. Biol. Trop. V. 54. № 1. P. 195–207.
Mahmoud H.H. 2010. Ultrastructure features of spermiogenesis and spermatozoa in Diplodus vulgaris (Geoffroy saint-hilaire, 1817) “Egypt” // Egypt. J. Aquat. Res. V. 36. № 4. P. 669–679.
Maricchiolo G., Genovese L., Laurà R. et al. 2004. Fine structure of spermatozoa in the common pandora (Pagellus erythrinus Linnaeus, 1758) (Perciformes, Sparidae) // Histol. Histopathol. V. 19. P. 1237–1240.
Mattei X. 1991. Spermatozoon ultrastructure and its systematic implication in fishes // Can. J. Zool. V. 69. P. 3038–3055.
Mohamed A.R.M., Resen A.K. 2010. The population status of sulphur goatfish Upeneus sulphureus in the Iraqi marine waters, northwest Arabian Gulf // Mesopot. J. Mar. Sci. V. 25. № 1. P. 31–40.
Pavlov D.A., Emel’yanova N.G., Luong Thi Bich Thuan, Vo Thi Ha. 2014. Reproduction of freckled goatfish Upeneus tragula (Mullidae) in the coastal zone of Vietnam // J. Ichthyol. V. 54. № 10. P. 893–904. https://doi.org/10.1134/S0032945214100129
Ramadan A.M., El-Halfawy M.M. 2014. Ovarian maturation and spawning season of Por’s goatfish Upeneus pori, (Mullidae) from Mediterranean Sea, Egypt // Ibid. V. 54. № 10. P. 905–912. https://doi.org/10.1134/S0032945214100154
Randall J.E., Kulbicki M. 2006. A review of the goatfishes of the genus Upeneus (Perciformes: Mullidae) from New Caledonia and the Chesterfield Bank, with a new species and four new records // Zool. Stud. V. 45. P. 298–307.
Reuben S., Vijayakumaran K., Chittibabu K. 1994. Growth, maturity and mortality of Upeneus sulphureus from Andhra–Orissa coast // Ind. J. Fish. V. 4. № 2. P. 87–91.
Sàbat M., Lo Nostro F., Casadevall M., Muñoz M. 2009. A light and electron microscopic study on the organization of the testis and the semicystic spermatogenesis of the genus Scorpaena (Teleostei, Scorpaenidae) // J. Morphol. V. 270. P. 662–672.
Song H.Y., Hyun Y.S., Jo S. et al. 2017. Complete mitochondrial genome of Parupeneus barberinus (Perciformes, Mullidae): mitogenome characterization and phylogenetic analysis // Mitochondrial DNA. Part B: Resources. V. 2. № 2. P. 785–786.
Uiblein F., Gouws G. 2015. Distinction and relatedness – taxonomic and genetic studies reveal a new species group of goatfishes (Upeneus; Mullidae) // Mar. Biol. Res. V. 11. № 10. P. 1021–1042.
Uiblein F., Heemstra P.C. 2010. A taxonomic review of the Western Indian goatfishes of the genus Upeneus (Family Mullidae) with descriptions of four new species // Smith. Bull. V. 11. P. 35–71.
Uiblein F., Gouws G., Gledhill D.C., Stone K. 2016. Just off the beach: intrageneric distinctiveness of the bandtail goatfish Upeneus taeniopterus (Mullidae) based on a comprehensive alpha-taxonomy and barcoding approach // Mar. Biol. Res. V. 12. № 7. P. 675–694.
Uiblein F., Gledhill D.C., Peristiwady T. 2017. Two new goatfishes of the genus Upeneus (Mullidae) from Australia and Indonesia // Zootaxa. V. 4318. № 2. P. 295–311.
Uiblein F., Gledhill D.C., Pavlov D.A., Tuan Anh Hoang, Shaheen S. 2019. Three new goatfishes of the genus Upeneus (Mullidae) from the Indo-Pacific, with a redescription of colour patterns in U. margarethae // Zootaxa. V. 4683. № 2. P. 151–196.
Vila S., Sàbat M., Muñoz M., Casadevall M. 2010. Spermiogenesis particularities of a sperm storage species: Helicolenus dactylopterus (Teleostei: Scorpaenidae) // Sci. Mar. V. 74. № 4. P. 687–704.
Wahbeh M.I. 1992. Aspects of the reproduction biology and growth of two species (Mullidae) from Aquaba, Red Sea // Senckenberg. Mar. V. 22. № 3/6. P. 255–264.
Wahbeh M.I., Ajiad A. 1985. Reproductive biology and growth of the goatfish, Parupeneus barberinus (Lacepede), in Aqaba, Jordan // J. Fish Biol. V. 26. P. 583–590.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии