Вопросы ихтиологии, 2020, T. 60, № 1, стр. 16-25
Новые нахождения редкого вида Rondeletia bicolor (Stephanoberycoidei) над Срединно-Атлантическим хребтом и некоторые вопросы филогении семейства Rondeletiidae
С. Г. Кобылянский 1, *, Н. В. Гордеева 2, А. Н. Котляр 1
1 Институт океанологии РАН – ИО РАН
Москва, Россия
2 Институт общей генетики РАН – ИОГен РАН
Москва, Россия
* E-mail: kobylianskysg@gmail.com
Поступила в редакцию 27.03.2019
После доработки 20.06.2019
Принята к публикации 10.07.2019
Аннотация
Приведены новые морфометрические данные редкого мезобатипелагического вида Rondeletia bicolor (Rondeletiidae), пойманного над центральной частью Срединно-Атлантического хребта в диапазоне глубин 2500−0 м. Обобщены известные сведения о внешней морфологической изменчивости и распространении вида в Мировом океане. На основании новых генетических данных проведён анализ филогенетических связей Rondeletia bicolor, показана монофилия рода Rondeletia, а также его место в системе подотряда Stephanoberycoidei.
Род стефанобериксовидных рыб Rondeletiа (Rondeletiidae) в настоящее время включает в себя два валидных вида: R. bicolor Goode et Bean, 1895 и R. loricata Abe et Hotta, 1963. Это некрупные мезобатипелагические рыбы, длина которых обычно не превышает 10 см. Виды Rondeletia редко встречаются в уловах, нигде, судя по всему, не достигая заметной численности. Хотя первоописание R. bicolor составлено уже более 100 лет назад, опубликованные с тех пор данные о пластических и счётных признаках представителей этого вида носят весьма фрагментарный характер. Число пойманных экземпляров R. bicolor за всё время изучения данного вида едва превышает 50 (Fishnet2, 2019), поэтому каждая новая находка R. bicolor позволяет получить дополнительную информацию о его географическом распространении и батиметрическом распределении.
Настоящая статья посвящена подробному сравнительному описанию внешней морфологии 3 экз. R. bicolor, пойманных над центральной частью Срединно-Атлантического хребта. В работе также представлены первые данные о генетической изменчивости данного вида; на основании новых и уже известных генетических данных подтверждена монофилия рода Rondeletia, показано общее положение R. bicolor в системе стефанобериксовидных рыб.
МАТЕРИАЛ И МЕТОДИКА
В 39-м рейсе НИС “Профессор Логачев” (2018 г.) были пойманы 3 экз. R. bicolor над центральной тропической частью Срединно-Атлантического хребта (САХ). Рыбы пойманы незамыкающимся разноглубинным тралом Айзекса−Кида в модификации Самышева−Асеева (РТАКСА) во время двух ночных тралений в пелагиали над ложем и восточным склоном рифтовой долины САХ в олиготрофных периферических водах Северо-Атлантического антициклонического круговорота. Материал хранится в коллекции Института океанологии РАН. При обработке материала за основу принята схема измерений и подсчётов пластических и меристических признаков, ранее применявшаяся для R. loricata (Котляр, 1996). В работе приняты следующие обозначения морфометрических признаков: SL – стандартная длина рыбы, с – длина головы, ао – длина рыла, о – горизонтальный диаметр глаза, ро – заглазничное расстояние; ch – высота головы, io – ширина межглазничного промежутка, lmx – длина верхней челюсти, lmd – длина нижней челюсти, H – наибольшая высота тела, h – высота хвостового стебля, lpc – длина хвостового стебля; aD, aP, aV, aA – антедорсальное, антепекторальное, антевентральное, антеанальное расстояния; PV, VA – пектовентральное и вентроанальное расстояния; lD, lA – длина оснований спинного и анального плавников; lP, lV – длина грудного и брюшного плавников; pD1, pA1 – постдорсальное и постанальное расстояния от начала оснований D и A до начала хвостового плавника; pD2, pA2 – постдорсальное и постанальное расстояния от конца оснований D и A до начала хвостового плавника, l sp.br. – длина угловой тычинки на 1-й жаберной дуге, l fil.p. – длина наиболее длинного лепестка ложножабры; D, A, P, V – число лучей в спинном, анальном, грудном и брюшном плавниках; C – суммарное число сегментированных и несегментированных лучей в хвостовом плавнике; Cd, Cv – число сегментированных лучей в дорсальной и вентральной лопастях хвостового плавника; Сd.p.r., Сv.p.r. – число дорсальных и вентральных несегментированных дополнительных лучей хвостового плавника, sp.br. – общее число жаберных тычинок на 1-й жаберной дуге; ll – число вертикальных рядов невромастов вдоль медиальной линии тела, fil.p. – число лепестков ложножабры, vert. – суммарное число туловищных и хвостовых позвонков, включая уростиль; pc – число пилорических придатков.
Фрагмент гена первой субъединицы цитохромоксидазы с (cox 1) митохондриальной (мт) ДНК размером около 655 пар нуклеотидов (п.н.) амплифицировали с помощью пары универсальных праймеров (Ward et al., 2005). Полученная последовательность cox 1 мтДНК R. bicolor депонирована в базе данных NCBI под номером MK583016. Фрагмент сox 1 мтДНК выбран как для получения уникального ДНК-баркода R. bicolor, так и для реконструкции филогенетических связей из-за наибольшего таксономического представительства близких родов и семейств бериксообразных рыб в базах данных. Правомерность оценки топологии и дивергенции отдельных видов и групп на основе единичного митохондриального гена поддерживается в целом сходной картиной филогенетической классификации на основе комплекса молекулярных маркеров (Betancur-R et al., 2017). Для филогенетического анализа из актуальных публичных баз данных GenBank/NCBI (2019) и BOLDSystem (2019) позаимствованы данные генотипов cox 1 представителей родственных видов и семейств Rondeletiidae (Rondeletia loricata: AP00293, EU148303-305, JQ354324, JQ354325, KY033745 и полученная нами ранее последовательность DSSAF700-1), Barbourisiidae (Barbourisia rufa: GBMTG1513-16, JQ354000), Cetomimidae (Procetichthys kreffti: GBMTG1512-16, AP010880; Cetostoma regani: AP010882; Danacetichthys galathenus: GBMTG230-16; Ditropichthys storeri: FNZ198-06; Cetomimus sp.: GBMTG1511-16; Gyrinomimus myersi: GBMTG1509-16 и G. grahami: Fj164637), Gibberichthyidae (Gibberichthys pumilus: MFLE034-12) и Stephanoberycidae (Acanthochaenus luetkenii: EU148067, EU148068). В качестве внешних таксонов, выбор которых оказывает определённый эффект на структуризацию филогении внутренней группы (Sanderson, Shaffer, 2002), привлекли представителей максимально близкого семейства Melamphaidae (Poromitra megalops: DSSAF233-11), близкого и более отдалённого отрядов − соответственно Polymixiiformes (Polymixia lowei: AP002927) и Scombriformes (Scomber scombrus: KX782979).
Для выравнивания последовательностей, общая длина которых составила 612 п.н., использован алгоритм ClustalW в программе MEGA, версия 6.0 (Tamura et al., 2013). Наиболее подходящая модель нуклеотидных замен (GTR + I) (Tavaré, 1986) выбрана с помощью информационного критерия Акайк (AIC) (Akaike, 1974) в программе MODELGENERATOR (Keane et al., 2006). На основе выбранной модели выполнен анализ филогении с помощью Байесова алгоритма (Bayesian inference, BI) в программе MrBayes 3.2.6 (Ronquist et al., 2012) и метода максимального правдоподобия (maximum likelihood, ML) в программе RAxML 8.0 (Stamatakis, 2014). Для Байесова анализа выполнено 4 млн генераций, из двух повторов и четырёх MCMCцепей каждая; первые 400 тыс. генераций были отброшены. Дополнительно топологию оценивали с помощью метода «ближайшего соседа» (neighbor-joining, NJ) в рамках субмодели TrN (Tamura, Nei, 1993) в программе MEGA 6 (Tamura et al., 2013). Постериорные вероятности, ML- и NJ-бутстреп-индексы (полученные в каждом случае с помощью 1000 реплик) приведены в качестве показателей надёжности топологии на консенсусном BI-древе. В качестве меры генетических различий между видами в программе MEGA рассчитаны нескорректированные p-дистанции, представляющие долю различающихся нуклеотидных сайтов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Материал. ИО РАН б/№ – 2 экз. SL 33.0 (рис. 1) и 37.5 мм, НИС “Профессор Логачёв”, 39-й рейс, ст. 39L196RT, 03−04.03.2018 г., 14°35′−14°43′ c.ш. 44°57′−44°59′ з.д., РТАКСА, глубина до дна 3312 м, горизонт лова 2500−0 м, время лова 22:08−01:44; 1 экз. SL 28.0 мм, НИС “Профессор Логачёв”, 39-й рейс, ст. 39L201RT, 05.03.2018 г., 14°47′−14°49′ c.ш. 44°54′ з.д., РТАКСА, глубина до дна 2732 м, горизонт лова 700−0 м, время лова 00:32−01:48.
Рис. 1.
Rondeletia bicolor SL 33.0 мм: НИС “Профессор Логачёв”, 39-й рейс, ст. 39L196RT, 14°35′−14°43′ c.ш. 44°57′−44°59′ з.д., РТАКСА, горизонт лова 2500−0 м.

Описание. Тело относительно высокое, заметно сжатое с боков, слабо суживающееся от головы к хвосту; достигает наибольшей высоты примерно на вертикали начала основания грудных плавников; наибольшая высота тела содержится 2.2−2.8 раза в SL. Грудные плавники слабые, короткие, их основания заметно смещены ближе к вентральному краю тела. Основание 1-го луча грудного плавника расположено значительно ниже горизонтали нижнего края орбиты; все лучи соединены между собой плавниковой мембраной. Брюшные плавники короткие, их основания расположены значительно ближе к концу хвостового стебля, чем к началу рыла; антевентральное расстояние содержится 1.7 раза в SL. Хвостовой стебель короткий, относительно высокий; высота хвостового стебля укладывается 0.9−1.1 раза в его длине. Хвостовой плавник выемчатый. Основания спинного и анального плавников сильно смещены назад в каудальном направлении и расположены практически супротивно. Длина основания анального плавника равна длине основания спинного или в 1.1−1.2 раза превосходит его. Все парные и непарные плавники лишены шипов. Чешуя на теле и голове отсутствует. Кожа очень мягкая, легко собирается в складки. Замкнутый сейсмосенсорный канал боковой линии на теле отсутствует; вместо этого из кожи выступают несколько невромастов в виде конусообразных папилл, формирующих приблизительно над каждым миомером один вертикальный ряд (рис. 2а). Свободно сидящие невромасты имеются также и на дорсальной поверхности спины непосредственно перед началом основания спинного плавника, образуя здесь фигуру в виде узкого вытянутого эллипса (рис. 2б).
Рис. 2.
Невромасты (nm) боковой линии (а) и при начале основания спинного плавника (б) Rondeletia bicolor: nm – невромасты, 1 – 1-й луч спинного плавника. Масштаб: а − 2, б – 1 мм.

Голова довольно большая, её дорсальный профиль заметно выгнут; длина головы содержится в SL 2.4−2.6 раза. Глаз маленький, полностью сформирован, 4.4−5.4 раза в с; зрачок круглый, хрусталик хорошо развит. Над верхнезадним краем орбиты имеется небольшой костный шип, направленный своей вершиной вперёд и вверх и являющийся выростом sphenoticum (Parr, 1929). У хорошо сохранившихся экземпляров он закрыт сверху кожей. Межглазничный промежуток в 2.2−2.4 раза превышает горизонтальный диаметр глаза. Рыло относительно длинное, содержится 3.0−3.2 раза в с. Обонятельная капсула открывается наружу двумя приблизительно одинаковыми по величине ноздрями, расположенными в переднебоковой части рыла; на переднем крае задней ноздри имеется лепестковидный клапан. Рот большой, конечный. Заднее окончание верхней челюсти сильно расширено, далеко заходит за вертикаль переднего края орбиты. Длина верхней челюсти содержится 2.2−2.5 раза в с, нижней – 1.7−2.2 раза в с. Зубы на челюстях очень мелкие, щетинковидные; на верхней челюсти они расположены в два−четыре ряда (два−три ряда у более мелких экземпляров), на нижней челюсти – два−пять рядов (у экземпляра SL 28.6 мм − два, SL 33.0 мм − два−три, SL 37.5 мм – пять рядов). Все каналы сейсмосенсорной системы головы замкнутые, сверху покрыты кожей и открываются наружу немногочисленными крупными порами. На внутреннем крае жаберных тычинок имеются редкие, примерно одинаковые по размеру острые шипики, расположенные в один ряд. Длина угловой тычинки на 1-й жаберной дуге укладывается 6.4−7.3 раза в с. Пилорические придатки короткие и толстые.
Измерения (3 экз. SL 28.0, 33.0 и 37.5 мм). В % SL: c 38.5, 40.9, 38.7; ao 12.2, 13.6, 12.3; o 8.4, 7.6, 8.8; po 17.5, 19.7, 20.0; ch 31.5, 32.4, 29.3; io 18.5, 18.2, 19.2; lmx 18.8, 15.7, 16.8; lmd 17.8, 22.7, 18.7; H 36.4, 45.5, 36.0; h 9.8, 9.7, 9.6; lpc 10.5, 9.1, 11.2; aD 73.4, 74.2, 79.5; aP 46.5, 41.5, 45.9; aV 59.4, 60.6, 58.7; aA 76.9, 75.8, 76.0; PV 16.1, 19.1, 16.0; VA 11.5, 12.1, 13.3; lD 18.1, 18.2, 15.2; lP 12.6, 12.1, 8.3; lV 11.2, 12.4, 10.7; lA 21.0, 18.5, 16.0; pD1 29.0, 30.3, 30.7; pD2 9.0, 12.1, 14.7; pA1 29.7, 29.7, 26.8; pA2 8.7, 10.6, 14.7; l sp.br. 5.2, 6.1, 6.0; l fil.p. 1.7, 1.8, 2.0. В % c: ao 31.8, 33.3, 31.7; o 21.8, 18.5, 22.8; po 45.5, 48.1, 51.7; ch 81.8, 79.3, 75.9; io 48.2, 44.4, 49.7; lmx 43.6, 45.9, 40.7; lmd 46.3, 55.6, 48.2; l sp.br. 13.6, 14.8, 15.5; l fil.p. 4.5, 4.4, 5.1.
Данные о меристических признаках исследованных рыб приведены в таблице.
Окраска. У фиксированных 70%-ным этанолом рыб тело однотонное, тёмно-коричневое, все плавники светлые, основные лучи хвостового плавника коричневые примерно на половину их длины. Жаберно-ротовая полость тёмно-коричневая. Перитонеум чёрный. Пилорические придатки не окрашены.
Сравнительные замечания. Сравнение наших измерений пластических и подсчётов меристических признаков у экземпляров R. bicolor из Центральной Атлантики и их значений у немногочисленных экземпляров этого вида из Северо-Западной и Юго-Западной Атлантики, включая Мексиканский залив и Карибское море (Goode, Bean, 1895; Paxton, 1974; Tolley et al., 1989; Paxton et al., 2001; Mincarone et al., 2014), указывает на их конспецифичность (таблица). Данные измерений 3 экз., пойманных над САХ, хорошо согласуются с имеющимися описаниями вида и подтверждают наличие аллометрической изменчивости некоторых пластических признаков у ювенильных и половозрелых особей, о которой упоминалось ранее (Paxton, 1974). Действительно, у R. bicolor, судя по нашим и литературным данным (Goode, Bean, 1895; Mincarone et al., 2014), по мере роста увеличиваются относительные значения (% SL) с, ао, lmx и lpc, но уменьшаются io и h. Относительно длины головы (% с) по мере роста также заметно увеличиваются ао и lmx и, напротив, уменьшаются о и io. Различия в счётных признаках между нашими экземплярами, пойманными над САХ, и рыбами из Западной Атлантики практически отсутствуют. Исключение составляет лишь суммарное число лучей (сегментированных и несегментированных) хвостового плавника. У рыб, пойманных над САХ и в Юго-Западной Атлантике, оно равно 25−26, тогда как в Северо-Западной Атлантике, Мексиканском заливе и Карибском море – 28−29 (таблица). Мы не склонны преувеличивать значение этих различий, имея в виду малое число изученных экземпляров, а также возможную погрешность в подсчётах.
Таблица 1.
Меристические признаки Rondeletia bicolor из разных частей Атлантического океана (по нашим и литературным данным)
| Приз-нак | Центральная тропическая часть САХ (n = 3) |
ЮЗА (n = 1) |
СЗА и Карибское море (n = 15) |
СЗА (n = 6) и центральная часть САХ (n = 1) | Мексиканский залив (n = 5) | СЗА (голотип) |
||
|---|---|---|---|---|---|---|---|---|
| Наши данные | Mincarone et al., 2014 | Paxton, 1974 | Paxton et al., 2001 | Tolley et al., 1989 | Goode, Bean, 1895 | |||
| SL, мм | 33.0 | 37.5 | 28.0 | 101.0 | 19.5−97.0 | 7.2−21.7 | 30.0−77.0 | 97.0 |
| D | 13 | 14 | 14 | 14 | 14−15 | 15 (14)* | 13−15 | 14 |
| A | 13 | 13 | 14 | 13 | 13−15 | 14−15 (14)* | 12−14 | 14 |
| P | 9 | 9 | 9 | 9 | 9−10 (15?) | 10 (10)* | 8−9 | 9 |
| V | 6 | 6 | 5 | 5 | 5−6 | 6 (6)* | 6 | 5 |
| C | 26 | 26 | 25 | 25 | 29 | 28−29 | – | – |
| Cd | 10 | 10 | 9 | 11 | – | 10 | – | – |
| Cv | 9 | 9 | 9 | 10 | – | 9 | – | – |
| Сd.p.r. | 4 | 4 | 4 | 2 | 4 | 5 | – | – |
| Сv.p.r. | 3 | 3 | 3 | 2 | 3 | 4−5 | – | – |
| sp.br. | 7 + 1 + 19 = 27 | 7 + 1 + 17 = 25 | 7 + 1 + 17 = 25 | 7 + 1 + 17 = 25 | 6−7 + 1 + 15−18 = = 24−26 | – | 6−7 + 1 + 16−18 | – |
| fil.p. | 3 | 4 | 3 | – | – | – | – | – |
| ll | 26 | 26 | 26 | – | 24−26 | 24−25 | 24 | – |
| vert. | 10 + 17 = 27 | 10 + 17 = 27 | 10 + 17 = 27 | – | 26−27 | 27 | – | – |
| pc | – | – | 5 | – | – | – | – | – |
Примечание. САХ – Срединно-Атлантический хребет, ЮЗА – юго-западная часть Атлантического океана, СЗА – северо-западная часть Атлантического океана; n – число исследованных рыб, *в скобках данные 1 экз. SL 14,4 мм из центральной части САХ; обозначения признаков см. в разделе “Материал и методика”, “−” − данные отсутствуют.
В литературе также имеются упоминания о поимках 3 экз. R. bicolor в Тихом океане (Paxton, 1974, 1999; Paxton et al., 2001), но какие-либо сведения об их внешней морфологии отсутствуют.
R. bicolor хорошо отличается от R. loricata бóльшим числом вертикальных рядов папилл в боковой линии (ll 24−26 против 15−19), а также наличием у R. bicolor крючковидного выроста sphenoticum, расположенного в районе задневерхней части орбиты и часто проступающего здесь через кожу (Parr, 1929; Paxton, 1974; Paxton, Trnski, 2016). Заметные отличия между видами также наблюдаются в форме и строении окостенений инфраорбитальной серии, жаберной крышки (praeoperculum, operculum и interoperculum), пояса грудных и брюшных плавников, скелета хвостового плавника (Parr, 1929; Котляр, 1996; Paxton et al., 2001).
Филогенетическое положение R. bicolor. Анализ морфологических признаков Rondeletiidae, приведённый в работах ряда авторов, не позволяет сделать окончательный вывод о положении данного семейства среди других групп стефаноберикообразных рыб. Парр (Parr, 1929) впервые поместил Rondeletiidae в Xenoberyces (= Stephanoberyciformes). Позднее одни авторы сближали данное семейство с Cetomimidae и Barbourisiidae в составе общего под- или надотряда (Harry, 1952; Rosen, Patterson, 1969; Paxton, 1989; Paxton et al., 2001; Nelson et al., 2016), тогда как другие объединяли его в одном отряде или подотряде вместе с семействами Mirapinnidae, Megalomycteridae11, Stephanoberycidae, Hispidoberycidae, Gibberichthyidae и Melamphaidae (Rosen, 1973; Johnson, Patterson, 1993; Moore, 1993). Наиболее полная гипотеза о филогенетических взаимоотношениях между Rondeletiidae и перечисленными выше семействами, основанная на изучении морфологических признаков, содержится в работе Мура (Moore, 1993). По наличию единственного общего морфологического признака (Y-образного рисунка гребней лобных костей) семейство Gibberichthyidae было помещено в качестве сестринской группы вместе с семействами Stephanoberycidae и Hispidoberycidae в одну филетическую линию. При этом филетическая последовательность семейств Rondeletiidae, Barbourisiidae, Megalomycteridae и Cetomimidae была отнесена автором ко второй эволюционной линии, которую он рассматривал в качестве сестринской по отношению к первой. Помещение Rondeletiidae в последнюю линию также же было основано на единственном признаке (отсутствие плавниковых шипов). При этом ни в коей мере не было оценено эволюционное значение таких общих для Gibberichthyidae и Rondeletiidae морфологических признаков, как наличие боковой линии, состоящей из вертикальных рядов свободносидящих невромастов, общего строения челюстной мускулатуры и верхних фарингеальных элементов жаберных дуг (Rosen, 1973). В ряде работ было отмечено и поразительное сходство общей формы и относительных пропорций тела у Rondeletia и Gibberichthys, а также наличие у личинок первого и у взрослых особей второго рода циклоидных чешуй, полностью покрытых сверху эпидермисом и не налегающих друг на друга (Parr, 1934; Paxton et al., 2001). Показано, что представителей Rondeletiа и Gibberichthys объединяет и наличие “органа Томинаги” − уникальной структуры, топологически тесно связанной с обонятельной капсулой и, видимо, обладающей секреторной функцией (Tominaga, 1970; Paxton et al., 2001). Таким образом, изучение дополнительных морфологических признаков, не рассмотренных в работе Мура (Moore, 1993), заставило большинство исследователей согласиться с предположением Розена (Rosen, 1973) о том, что Rondeletiidae и Gibberichthyidae являются сестринскими таксонами.
Филогенетические связи R. bicolor и R. loricata (рис. 3) также подтверждают тесное родство Rondeletiidae и Gibberichthyidae: p-дистанции между R. loricata, R. bicolor и Gibberichthys pumilus относительно небольшие (0.126 ± 0.013 и 0.137 ± 0.013). При этом в пределах рода Rondeletia генетическое расстояние между видами довольно заметное (р-дистанция 0.084 ± 0.011). Наблюдаемое генетическое расхождение подтверждается и заметными различиями между видами по ряду морфологических признаков, о чём было указано выше. Тем не менее оба вида составляют единую кладу с существенным уровнем BI- и NJ-поддержки, что свидетельствует в пользу монофилии семейства Rondeletiidae. Нам кажется наиболее адекватной последняя филогенетическая классификация костистых рыб (Betancur-R et al., 2017), согласно которой все изученные в данной работе представители бериксообразных рыб должны быть отнесены к подотряду Stephanoberycoidei. При этом мы не разделяем мнение Нельсона с соавторами (Nelson et al., 2016) о необходимости выделения семейств Rondeletiidae, Barbourisiidae и Cetomimidae в отдельное надсемейство Cetomimoidea. Согласно результатам филогенетического анализа, все изученные нами семейства стефанобериксовидных рыб можно подразделить на три основные ветви (рис. 3). Топология двух верхних ветвей, к которым относятся семейства Rondeletiidae, Gibberichthyidae, Cetomimidae (включая Procetichthys) и Barbourisiidae, хорошо поддерживается бутстреп-статистикой. При этом положение семейства Stephanoberycidae по результатам всех филогенетических реконструкций оказалось неустойчивым (ввиду малого числа изученных таксонов), но приближающимся к основанию общего древа. К сожалению, ввиду полного отсутствия генетических данных для семейства Hispidoberycidae в настоящей работе оказалось также невозможным оценить и его родственные связи. Данные филогенетического анализа стефнобериксообразных рыб, приведённые на кладограммах в работе Колгана с соавторами (Colgan et al., 2000), в части положения представителей семейств Rondeletiidae, Cetomimidae и Barbourisiidae в целом показывают картину, схожую с нашей. Однако имеется и ряд различий, обусловленных, на наш взгляд, тем, что авторы оперировали в своём анализе меньшим числом таксоновов (родов и видов), а материалы по представителям семейств Gibberichthyidae и Stephanoberycidae у них и вовсе отсутствовали.
Рис. 3.
Филогенетические связи двух видов Rondeletia и представителей Stephanoberycoidei для cox 1 мтДНК, представленные в виде консенсусного BI- дерева. Конспецифические последовательности cox 1 для удобства объединены. Возле узлов ветвления приведены значения постериорной вероятности BI/индексы бутстреп-поддержки ML-дерева/индексы бутстреп-поддержки NJ-дерева; в последних случаях показаны величины >50%. Схематические изображения представителей разных таксонов взяты из: Paxton, 1989; Moore, 2016; Paxton, Trnski, 2016.
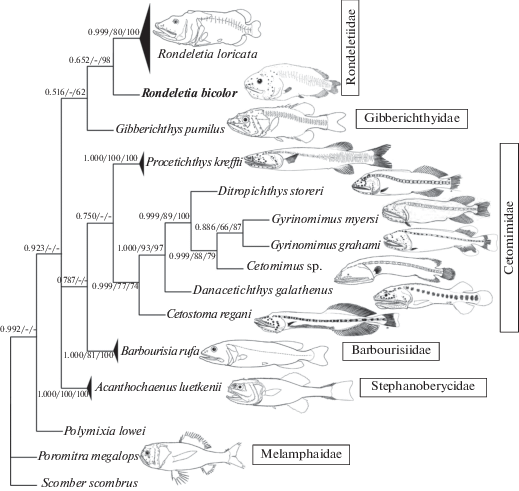
Исходя из всего выше изложенного, можно сделать вывод о том, что оба вида рода Rondeletia могут быть отнесены к сравнительно высокоспециализированной группе глубоководных стефанобериксовидных рыб, обитающих в мезо- и батипелагиали. Демонстрируя некоторое внешнее сходство с представителями семейств Cetomimidae и Barbourisiidae, данная группа, на наш взгляд, не может быть сближена с Barbourisia rufa и/или предковой формой родов Cetomimidae, как это предлагает Пакстон (Paxton, 1989).
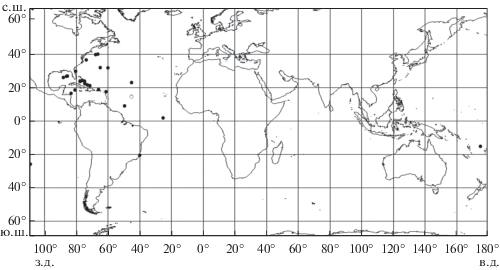
Распространение. Среди видов рода Rondeletia наибольшее число поимок приходится на R. loricata; в Атлантическом, Тихом и Индийском океанах вид отмечен в основном между 50° с.ш. и 50° ю.ш. (Abe, Hotta, 1963; Paxton, 1974; Котляр, 1996; Paxton et al., 2001; Paxton, Trnski, 2002, 2016; Moore et al., 2003; Mincarone et al., 2014), а в Северной Атлантике − до 66° с.ш. (Okamura et al., 1995; Møller et al., 2010). За всё время исследований R. loricata был пойман в диапазоне глубин 100−2350 м (Котляр, 1996). R. bicolor, несмотря на более раннее первоописание, встречается в коллекционных сборах значительно реже. Большинство находок этого вида приурочено к западной части Атлантического океана, где он обнаружен в Мексиканском заливе и Карибском море, в водах Суринама и Французской Гвианы и далее на север вдоль побережья Северной Америки примерно до 40° с.ш. (Goode, Bean, 1895; Parr, 1928, 1929, 1933; Paxton, 1974; Uyeno, Sato, 1983; Котляр, 1996; Moore et al., 2003). В других частях Северной Атлантики вид известен лишь по поимке личинки (14.4 мм) в центральной части океана над САХ, в районе с координатами 23°13′ с.ш. 44°56′ з.д. (Paxton et al., 2001), а также по экземпляру, отмеченному чуть севернее экватора (примерно под 2° с.ш. 25° з.д.) (Paxton, Trnski, 2016). В южном полушарии единственный экземпляр R. bicolor отмечен в водах Бразилии, в районе с координатами 20°24′−20°27′ ю.ш. 39°46′−39°44′ з.д. (Mincarone et al., 2014). В публикации по материалам, собранным экспедицией 11-го рейса НИС “Академик Курчатов” в Южной Атлантике, также была указана поимка R. bicolor на четырёх станциях в районе, ограниченном координатами 24°34′−25°44′ ю.ш. 26°26′−26°38′ з.д. (Парин и др., 1974). Однако при повторном исследовании этот материал был переопределён в качестве R. loricata (Bast, Klinkhardt, 1990). В Тихом океане R. bicolor отмечен лишь в двух верифицированных точках − 25°48′ ю.ш. 108°46′ з.д. и 15° ю.ш. 175° з.д. (Paxton, 1974; Paxton et al., 2001). Ещё в одной публикации (Paxton, 1999) сообщалось о третьей поимке этого вида в Тихом океане без указания точных координат лова. Сообщения о нахождении R. bicolor в Индийском океане (Rofen, 1959) не нашли впоследствии своего подтверждения (Paxton, 1974). В целом R. bicolor известен в диапазоне глубин 182−3003 м (Goode, Bean, 1895; Harry, 1952; Котляр, 1996). На рис. 4 показаны все известные места ловов R. bicolor в Мировом океане, установленные по литературным источникам (Goode, Bean, 1895; Parr, 1928, 1929, 1933; Harry, 1952; Paxton, 1974; Беккер и др., 1975; Paxton et al., 2001; Paxton, Trnski, 2002, 2016; Moore et al., 2003; Mincarone et al., 2014) и нашим данным. Ареал R. bicolor, по-видимому, примерно сходен с таковым R. loricata (Котляр, 1996), но из-за редкости вида он представлен лишь единичными далеко отстоящими друг от друга точками ловов, что не позволяет чётко очертить его границы. В целом же, судя по имеющимся данным, в Атлантике вид, видимо, не заходит на север далее 40° с.ш., а в Тихом океане не отмечен южнее 26° ю.ш.
Список литературы
Беккер В.Э., Щербачёв Ю.Н., Чувасов В.М. 1975. Глубоководные пелагические рыбы Карибского моря // Тр. ИО АН СССР. Т. 100. С. 208−336.
Котляр А.Н. 1996. Остеология, внутривидовая структура и распространение Rondeletia loricata (Rondeletiidae) // Вопр. ихтиологии. Т. 36. № 2. С. 154−168.
Парин Н.В., Андрияшев А.П., Бородулина О.Д., Чувасов В.М. 1974. Пелагические глубоководные рыбы юго-западной части Атлантического океана// Труды ИО АН СССР. Т. 98. С. 76−140.
Abe T., Hotta H. 1963. Description of a new deep-sea fish of the genus Rondeletia from Japan // Jpn. J. Ichthyol. V. 10. № 2–3. P. 43–48.
Akaike H. 1974. A new look at the statistical model identification // IEEE Trans. Autom. Control V. 19. P. 716–723.
Bast H.-D., Klinkhardt M.B. 1990. Records of the redmouth whalefish, Rondeletia loricata Abe & Hotta, 1963 (Osteichthyes: Cetomimiformes: Rondeletiidae) from the Northeast and Southwest Atlantic // Arch. Fish. Wiss. V. 40. № 3. P. 249−263.
Betancur-R R., Wiley E. O., Arratia G. et al. 2017. Phylogenetic classification of bony fishes // BMC Evol. Biol. V. 17. № 1. P. 162. https://doi.org/10.1186/s12862-017-0958-3
BOLDSystem. 2019. Barcode of Life Data Systems. (http://www.boldsystems.org. Version 03/2019)
Colgan D.J., Zhang C.-G., Paxton J.R. 2000. Phylogenetic investigations of the Stephanoberyciformes and Beryciformes, particularly whalefishes (Euteleostei: Cetomimidae), based on partial 12S rDNA and 16S rDNA sequences // Mol. Phylogen. Evol. V. 17. №. 1. P. 15–25. https://doi.org/10.1006/mpev.2000.0811
Fishnet2. 2019. Portal data use statement. (www.fishnet2.net. Version 03/2019)
GenBank. 2019. (http://www.ncbi.nlm.nih.gov/genbank. Version 03/2019)
Goode G.B., Bean T. H. 1895. On Cetomimidae and Rondeletiidae, two new families of bathyal fishes from the north-western Atlantic // Proc. US Nat. Mus. V. 17. № 1012. P. 451−454.
Harry R.R. 1952. Deep-sea fishes of the Bermuda oceanographic expeditions families Cetomimidae and Rondeletiidae // Zoologica (NY). V. 37. № 1. P. 55−72.
Johnson G.D., Patterson C. 1993. Percomorph phylogeny: a survey of acanthomorphs and a new proposal // Bull. Mar. Sci. V. 52. № 1. P. 554–626.
Johnson G.D., Paxton J.R., Sutton T.T. et al. 2009. Deep-sea mystery solved: astonishing larval transformations and extreme sexual dimorphism unite three fish families // Biol. Lett. V. 5. № 2. P. 235−239. https://doi.org/10.1098/rsbl.2008.0722
Keane T.M., Creevey C.J., Pentony M.M. et al. 2006. Assessment of methods for amino acid matrix selection and their use on empirical data shows that ad hoc assumptions for choice of matrix are not justified // BMC Evol. Biol. V. 6. P. 29.
Mincarone M.M., Di Dario F., Costa P.A.S. 2014. Deep-sea bigscales, pricklefishes, gibberfishes and whalefishes (Teleostei: Stephanoberycoidei) off Brazil: new records, range extensions for the south-western Atlantic Ocean and remarks on the taxonomy of Poromitra // J. Fish Biol. V. 85. P. 1546−1570.
Moore J.A. 1993. The phylogeny of the Trachichthyiformes (Teleostei: Percomorpha) // Bull. Mar. Sci. V. 52. № 1. P. 114–136.
Moore J.A. 2016. Melamphaidae // The living marine resources of the Eastern Central Atlantic. V. 3. Pt. 1 / Eds. Carpenter K.E., De Angelis N.P. Rome: FAO. P. 2164–2166.
Moore J.A., Hartel K.E., Craddock J.E., Galbraith J.R. 2003. An annotated list of deepwater fishes from off the New England region, with new area records // Northeast. Naturalist. V. 10. № 2. P. 159−248.
Møller P.R., Nielsen J.G., Knuden S.W et al. 2010. A checklist of the fish fauna of Greenland waters // Zootaxa. № 2378. P. 1–84.
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken, New Jersey: John Wiley and Sons, 752 p.
Okamura O., Amaoka K., Takeda M. (eds.). 1995. Fishes collected by the R/V Shinkai Maru around Greenland. Tokyo: Jpn. Mar. Fish. Resour. Res. Center, 304 p.
Parr A.E. 1928. Deep-sea fishes of the order Iniomi from the waters around the Bahama and Bermuda Islands with annotated key to Sudidae, Myctophidae, Scopelarchidae, Evermannelidae, Omosudidae, Cetomimidae and Rondeletidae of the world // Bull. Bingham Oceanogr. Coll. V. 3. № 3. P. 1−193.
Parr A.E. 1929. A contribution to the osteology and classification of the orders Iniomi and Xenoberyces // Occas. Pap. Bingham Oceanogr. Coll. № 2. P. 1−45.
Parr A.E. 1933. Deepsea Berycomorphi and Percomorphi from the waters around the Bahama and Bermuda Islands // Bull. Bingham Oceanogr. Coll. V. 3. № 6. P. 1−51.
Parr A.E. 1934. Report on experimental use of a triangular trawl for bathypelagic collecting // Ibid. V. 4. № 6. P. 1–59.
Paxton J.R. 1974. Morphology and distribution patterns of the whalefishes of the family Rondeletiidae // J. Mar. Biol. Ass. India. V. 15. № 1. P. 178–188.
Paxton J.R. 1989. Synopsis of the whalefishes (family Cetomimidae) with descriptions of four new genera // Rec. Austral. Mus. V. 41. № 2. P.135–206.
Paxton J.R. 1999. Rondeletiidae // The living marine resources of the Western Central Pacific. V. 4. Pt. 2 / Eds. Carpenter K.E., Niem V.H. Rome: FAO. P. 2204.
Paxton J.R, Trnski T. 2002. Rondeletiidae // The living marine resources of the Western Central Atlantic. V. 2. Pt. 1 / Ed. Carpenter K.E. Rome: FAO. P. 1168−1169.
Paxton J.R., Trnski T. 2016. Rondeletiidae // The living marine resources of the Eastern Central Atlantic. V. 3. Pt. 1 / Eds. Carpenter K.E., De Angelis N. Rome: FAO. P. 2169–2170.
Paxton J.R., Johnson G.D., Trnski T. 2001. Larvae and juveniles of the deepsea “whalefishes” Barbourisia and Rondeletia (Stephanoberyciformes: Barbourisidae, Rondeletiidae), with comments of family relationships // Rec. Austral. Mus. V. 53. № 3. P. 407−429.
Rofen R.R. 1959. The whale-fishes: families Cetomimidae, Barbourisidae and Rondeletiidae (order Cetunculi) // Galathea Rept. V. I. P. 255−260.
Ronquist F., Teslenko M., Van Der Mark P. et al. 2012. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space // Syst. Biol. V. 61. № 3. P. 539−542. https://doi.org/10.1093/sysbio/sys029
Rosen D.E. 1973. Interrelationships of higher euteleostean fishes // Zool. J. Linn. Soc. London. V. 53. Suppl. 1. Interrelationships of fishes. P. 397–513.
Rosen D.E., Patterson C. 1969. The structure and relationships of the paracanthopterygian fishes // Bull. Amer. Mus. Natur. Hist. V. 141. Art. 3. P. 359−474.
Sanderson M.J., Shaffer H.B. 2002. Troubleshooting molecular phylogenetic analyses // Ann. Rev. Ecol. Syst. V. 33. P. 49–72.
Stamatakis A. 2014. RAxML version 8: a tool for phylogenetic analysis and post-analysis of large phylogenies // Bioinformatics. V. 30. № 9. P. 1312–1313.
Tamura K., Nei M. 1993. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees // Mol. Biol. Evol. V. 10. P. 512−526.
Tamura K., Stecher G., Peterson D. et al. 2013. MEGA6: Molecular evolutionary genetics analysis version 6.0 // Ibid. V. 30. P. 2725−2729.
Tavaré S. 1986. Some probabilistic and statistical problems in the analysis of DNA sequences // Some mathematical questions in biology − DNA sequence analysis / Ed. Miura R.M. Providence, R.I.: Amer. Math. Soc. P. 57−86.
Tolley S.G., Gartner J.V., Lancraft T.M. 1989. Whalefishes (Beryciformes: Cetomimoidei) of the Gulf of Mexico // Bull. Mar. Sci. V. 45. № 3. P. 671−677.
Tominaga Y. 1970. On the glandular organs before the eyes of the red-coated whalefish, Rondeletia loricata // Zool. Mag. Tokyo. V. 79. № 11–12. P. 368.
Uyeno T., Sato Y. 1983. Rondeletiidae // Fishes trawled off Suriname and French Guiana. Tokyo: Jpn. Mar. Fish. Resour. Res. Center. P. 280−281.
Ward R.D., Zemlak T.S., Innes B.H. et al. 2005. DNA barcoding Australia’s fish species // Phil. Trans. Roy. Soc. V. 360 B. P. 1847–1857.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии