Вопросы ихтиологии, 2020, T. 60, № 2, стр. 192-201
Паразиты и темп полового созревания как индикаторы популяционной структуры окуня-клювача Sebastes mentella (Sebastidae)
Ю. И. Бакай *
Полярный филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии − ПИНРО
Мурманск, Россия
* E-mail: bakay@pinro.ru
Поступила в редакцию 14.03.2019
После доработки 13.06.2019
Принята к публикации 25.09.2019
Аннотация
На основании сравнительного анализа фауны паразитов и темпа полового созревания особей окуня-клювача Sebastes mentella в пелагических и придонных группировках североатлантической и норвежско-баренцевоморской популяций рассматривается направление филогенеза этого вида. Особям окуня-клювача в пелагиали и батиали северной части Норвежского моря свойственны значительно более высокая степень сходства фауны паразитов и меньшие различия длины и возраста полового созревания, чем в пелагиали и батиали морей Северной Атлантики. Это может свидетельствовать о том, что пелагическая группировка окуня-клювача в Норвежском море находится на более ранней стадии формирования, чем его пелагическая группировка в морях Ирмингера и Лабрадор, а норвежско-баренцевоморская популяция является филогенетически более молодой, чем североатлантическая. Возникновение массовых миграций особей окуня-клювача из пелагиали моря Ирмингера в Норвежское море указывает на вероятный источник происхождения его норвежско-баренцевоморской популяции.
Морские окуни рода Sebastes впервые были использованы Барсуковым (1981а, 1981б) как модельная группа для исследования эволюционного процесса. Согласно его гипотезе о расселении и эволюции подсемейства Sebastinae, дополненной Литвиненко (1985) и Снытко (2001), окуни рода Sebastes, обитающие в морях Северной Атлантики (СА) и сопредельного сектора Северного Ледовитого океана (СЛО) и называемые североатлантическими, произошли от северотихоокеанских предков. Итоги сравнительного анализа фауны паразитов окуней рода Sebastes этих регионов Мирового океана (Бакай, 2013) и молекулярно-генетических исследований (Рольский и др., 2017) подтверждают гипотезу о филогенетической молодости и тихоокеанском происхождении североатлантических Sebastes. Наличие естественной межвидовой гибридизации у Sebastes в морях СА (Roques et al., 2001; Artamonova et al., 2011, 2013; Saha et al., 2017), наиболее часто встречающейся, по мнению Гарднера (Gardner, 1997), у молодых или не завершивших процесс видообразования видов, также соответствует гипотезе о филогенетической молодости североатлантических Sebastes.
Симпатрическое видообразование североатлантических Sebastes выражено в биотопической неполной пространственной изоляции, связанной с различиями в распределении рыб по глубине (Барсуков 1981а; Литвиненко, 1985). Оно происходило при смещении от берегов на бόльшую глубину шельфа, в батиаль и мезопелагиаль, окуней в ряду видов: малый S. viviparus → золотистый S. norvegicus → окунь-клювач (клювач) S. mentella в морях СЛО и восточной части СА, а также в ряду видов: американский S. fasciatus → золотистый → → клювач в западной части СА. Палеоклиматические события в период плейстоцена, по мнению некоторых авторов (Литвиненко, 1985; Roques et al., 2001; Рольский и др., 2017), могли обусловить и аллопатрическое видообразование североатлантических Sebastes.
Результаты изучения последовательностей контрольного региона мтДНК подтвердили такое направление видообразования североатлантических Sebastes, указав на максимальную среди них филогенетическую молодость окуня-клювача (Artamonova et al., 2013; Рольский и др., 2017). Этот вид является одним из наиболее распространённых и массовых видов рыб в морях СА и смежного района СЛО, а также важным объектом международного промысла. Сложная популяционная организация этого филогенетически молодого и экологически пластичного вида, симпатрически распределяющегося с другими видами Sebastes во многих районах и слабо дифференцируемого от них в западных районах ареала, обусловили дискуссии о видовой структуре окуня-клювача в СА (Бакай, Мельников, 2008; Cadrin et al., 2010; Makhrov et al., 2011; Planque et al., 2013; Melnikov, 2016). Некоторые авторы по результатам генетических исследований высказали предположение о продолжении процесса видообразования у рода Sebastes в Атлантическом и Тихом океанах (Hyde, Vetter, 2007; Shum et al., 2015).
Существуют противоречивые данные о популяционном статусе окуня-клювача, обитающего в пелагиали Норвежского моря. Согласно одним, не найдено достоверных различий в составе и характере распределения аллелей ферментных локусов в его пробах из мезопелагиали морей Ирмингера и северной части Норвежского (Строганов и др., 2009). По другим, напротив, установлено значительное различие в распределении MEP генотипов клювача этих районов (Johansen et al., 2000). По данным микросателлитного анализа структуры мтДНК, высказано мнение о генетической близости клювача в пелагиали морей Ирмингера и Норвежского, а также придонного окуня батиали Фарерских о-вов и Норвегии (Stefansson et al., 2009), на основании этого предположена их принадлежность к единой метапопуляции, населяющей моря СА и СЛО (Cadrin et al., 2010; Planque et al., 2013).
Исходя из высокой меры сходства фауны паразитов окуня-клювача, установлены тесная связь и единство происхождения его скоплений в пелагиали и батиали северной части Норвежского моря, указывающие на принадлежность пелагических скоплений окуня к норвежско-баренцевоморской популяции (Бакай, 2011), которая значительно обособлена от североатлантической популяции клювача (Bakay, 2000, 2001; Бакай, 2014; Бакай, Попов, 2017).
Североатлантическую популяцию окуня-клювача формируют особи, обитающие в мезопелагиали СА (моря Ирмингера и Лабрадор) на акватории более 450 тыс. кв. миль и глубине 70–1000 м, служащей репродуктивной областью, а также в смежных районах шельфа и батиали Гренландии и Канады, являющихся выростным ареалом, и Исландии. Ареал норвежско-баренцевоморской популяции клювача охватывает западную акваторию шельфа Баренцева моря и прибрежье архипелага Шпицберген, служащие выростной областью, а также батиали и пелагиали Норвежского моря, где происходит воспроизводство. В этих популяциях существуют репродуктивно пока не изолированные пелагическая и придонная группировки окуня-клювача, формируемые соответственно его рано- и поздносозревающими особями (Захаров и др., 1977; Saborido-Rey et al., 2004; Мельников, Бакай, 2006, 2009б; Drevetnyak et al., 2011; Planque et al., 2013; Melnikov, 2016; Бакай, Попов, 2017). У представителей первой из них выработана повышенная миграционная активность.
Результаты применения паразитологических данных в комплексе с выявленными популяционными характеристиками окуня-клювача, одной из которых является темп полового созревания, позволили обосновать пространственное и батиметрическое единство пелагической группировки и её значительную обособленность от придонной группировки североатлантической популяции этого вида (Мельников, Бакай, 2006, 2009а; Бакай, Мельников, 2008; Бакай, 2014, 2015). Они подтверждают, что паразиты служат естественными метками для выделения локальных стад, изучения структуры скоплений и популяционной биологии, миграций и филогенетики рыб (Williams et al., 1992; MacKenzie, Hemmingsen, 2015). Выбор темпа полового созревания в качестве эколого-популяционного индикатора определён мнением о том, что рост его отличий имеет прямую зависимость от степени обособленности сравниваемых групп рыб, принадлежащих одной популяции (Hall et al., 2015).
Цель работы – выявить различия в формировании фауны паразитов и темпа полового созревания особей окуня-клювача в пелагических и придонных группировках его североатлантической и норвежско-баренцевоморской популяций. Предполагается, что величина этих различий, характеризующая степень обособленности придонных и пелагических экологических групп клювача в морях СА и СЛО, отражает направление филогенеза этого вида.
МАТЕРИАЛ И МЕТОДИКА
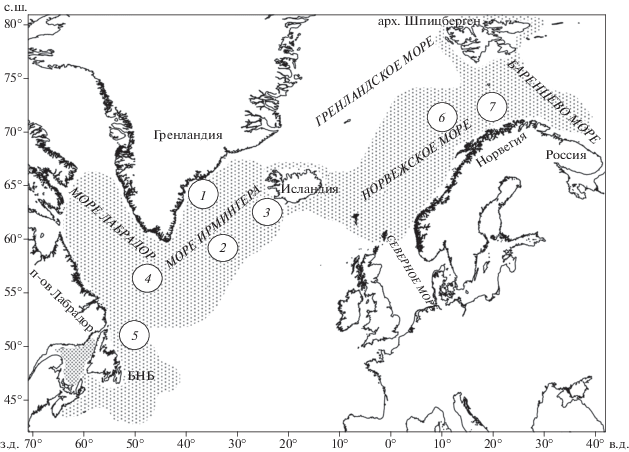
Для проведения сравнительного анализа использованы собственные опубликованные материалы по фауне паразитов и темпу полового созревания окуня-клювача (Bakay, 2000, 2001; Мельников, Бакай, 2006, 2009а, 2009б; Бакай, Мельников, 2008; Бакай, 2011; Бакай, Попов, 2017), а также данные литературы по темпу его созревания (Захаров и др., 1977) в разных районах СА и Норвежского моря. Паразитологические данные получены по результатам полного паразитологического вскрытия (Донец, Шульман, 1973; Быховская-Павловская, 1985) 1728 экз. окуня-клювача общей длиной (TL) 27–48 см в возрасте 7–25 лет и видовой идентификации их паразитов. Паразитов крови не исследовали. Пробы рыб взяты из траловых уловов, полученных на глубине 100–1000 м в мезопелагиали морей Ирмингера, Лабрадор и Норвежского и на сопредельных акваториях батиали Гренландии, Исландии, Канады и Норвегии в апреле–августе 1995–2009 гг. (рис. 1).
Рис. 1.
Ареал и районы исследований окуня-клювача Sebastes mentella: 1 – батиаль Гренландии, 2 – пелагиаль моря Ирмингера, 3 – батиаль Исландии, 4 – пелагиаль моря Лабрадор, 5 – батиаль Северной Ньюфаундлендской банки (СНБ), 6 – пелагиаль Норвежского моря, 7 – батиаль Норвежского моря; БНБ – Большая Ньюфаундлендская банка.
Для выявления отличий фауны паразитов окуня-клювача сравниваемых районов использованы данные по её качественному составу, а также количественные показатели заражённости паразитом каждого вида: экстенсивность инвазии (ЭИ) – доля рыб, заражённых паразитом данного вида (% числа исследованных рыб), и индекс обилия (ИО) – число паразитов данного вида, приходящихся на одну исследованную рыбу (Bush et al., 1997). Для проведения сравнительного анализа паразитофауны клювача в парах сравниваемых смежных районов пелагиали и батиали СА и Норвежского моря оценивали значимость различий в ЭИ паразитом каждого вида по тесту критерия значимости (χ2) при р < 0.05 (Бреев, 1976). При анализе степени обособленности сравниваемых групп рыб исходили из её обратной зависимости от меры сходства (L0) фауны их паразитов (Андреев, Решетников, 1977, 1978), определяемой по коэффициенту Сёренсена–Чекановского (Бейли, 1970), а также прямой зависимости от разницы длины и возраста наступления половой зрелости рыб (Hall et al., 2015). Таксономический состав фауны паразитов указан согласно современным данным (WoRMS, 2018).
Представлены основные результаты проводимого автором на акватории пелагиали и батиали морей Ирмингера и Норвежского многолетнего (1981–2019) мониторинга степени заражённости окуня-клювача единственным специфичным ему паразитом – копеподой Sphyrion lumpi, поселяющейся на окуне в мезопелагиали (Bakay, 1989). При этом регистрировали как живых особей паразита, так и следы его инвазии (остатки цефалоторакса), сохраняющиеся в рыбе после отмирания копеподы долгое время (возможно, до конца жизни хозяина) и являющиеся поэтому надёжной естественной меткой (Бакай, Карасев, 1995).
Идентификация особей окуня-клювача выполнена согласно “Методическим указаниям …” (1984). Возраст рыб установлен по чешуе. Темп полового созревания определён у 37056 самцов и 30743 самок. Сравнительный анализ темпа полового созревания выполнен по общей длине при массовом (50%) созревании (TL50). Районирование акватории основано на общепринятых данных (Границы …, 2000).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У окуня-клювача в районах пелагиали и батиали морей СА и Норвежского обнаружены паразиты 30 видов (по 15–19 видов в районе), относящихся к семи классам (Bakay, 2000, 2001; Мельников, Бакай, 2006, 2009а, 2009б; Бакай, Мельников, 2008; Бакай, 2011). Степень заражённости паразитами клювача в четырёх парах смежных районов (пелагиаль моря Ирмингера – батиаль Гренландии, пелагиаль моря Ирмингера – батиаль Исландии, пелагиаль моря Лабрадор – батиаль СНБ, пелагиаль и батиаль северной части Норвежского моря) с указанием значимости различий в ЭИ по каждой паре сравниваемых районов представлены в табл. 1. Значимые различия (p < 0.05) в ЭИ паразитами клювача в трёх парах сравниваемых районов морей СА установлены по 42.9–59.1% видов паразитов при малой мере парного сходства (L0 = 70.3–74.3%) состава их паразитофауны (табл. 2). Между пелагиалью и батиалью северной части Норвежского моря значимые различия в ЭИ отмечены лишь для 21.0% обнаруженных видов паразитов при высокой мере сходства состава паразитофауны окуня (L0 = 91.4%).
Таблица 1.
Встречаемость паразитов у окуня-клювача Sebastes mentella в сопредельных районах пелагиали и батиали морей Северной Атлантики и Норвежского моря
| Паразит и другие показатели | Пелагиаль моря Ирмингера |
Батиаль Восточной Гренландии |
Батиаль Исландии | Пелагиаль моря Лабрадор |
Батиаль СНБ | Пелагиаль Норвежского моря | Батиаль Норвежского моря |
|---|---|---|---|---|---|---|---|
| Myxozoa | |||||||
| Myxidium incurvatum | 5.2/+ | 15.11/+ | 22.21/+ | 6.5/+ | 7.4/+ | 4.4/+ | 8.7/+ |
| M. obliquelineolatum | 4.8/+ | 10.21/+ | 8.2/+ | 9.5/+ | 11.1/+ | 3.9/+ | 8.7/+ |
| Leptotheca adeli | 1.2/+ | 25.11/+ | 7.01/+ | 9.0/+ | – | 3.9/+ | 5.7/+ |
| L. kovaljovae | – | – | – | – | – | 4.5/+ | 5.7/+ |
| L. macroformis | – | – | – | – | – | 1.1/+ | 2.9/+ |
| Pseudоalataspora sebastei | 2.6/+ | 21.81/+ | 10.11/+ | 5.0/+ | 51.82/+ | 6.1/+ | 18.63/+ |
| Monogenea | |||||||
| Microcotyle caudatа | – | – | 17.11/0.48 | – | – | – | – |
| Cestoda | |||||||
| Bothriocephalus scorpii | 9.6/0.19 | –1 | 6.3/0.06 | 12.3/0.19 | 18.52/0.19 | 20.8/0.27 | 27.1/0.40 |
| Diphyllobothrium sp. pl. | 0.4/0.01 | – | – | 0.5/0.01 | – | – | – |
| Grillotia erinaceus pl. | 0.9/0.01 | – | – | 1.1/0.01 | – | 0.5/0.01 | – |
| Hepatoxylon trichiuri pl. | 1.1/0.01 | – | – | 0.5/0.01 | – | – | – |
| Phyllobothrium sp. pl. | 1.5/0.03 | – | 0.6/0.01 | 1.6/0.02 | 3.7/0.04 | – | – |
| Scolex pleuronectis pl. | 12.1/0.31 | 2.21/0.03 | –1 | 8.9/0.25 | 3.7/0.04 | 25.7/2.44 | 14.3/0.72 |
| Trematoda | |||||||
| Anomalotrema koiae | 1.6/0.01 | 7.21/0.17 | 3.8/0.04 | 2.2/0.05 | 3.7/0.04 | 5.6/0.06 | 11.4/0.20 |
| Derogenes varicus | 0.7/0.01 | 2.1/0.08 | – | 1.1/0.01 | 7.42/0.07 | 3.3/0.06 | 2.9/0.33 |
| Hemiurus levinseni | – | – | – | – | 3.72/0.04 | – | – |
| Lecithophyllum botryophoron | 1.1/0.02 | 2.2/0.02 | 1.9/0.03 | 2.2/0.02 | – | 2.8/0.06 | 5.7/0.10 |
| Podocotyle reflexa | 1.7/0.02 | 24.51/0.32 | 5.71/0.06 | 2.8/0.03 | 3.7/0.04 | 11.2/0.15 | 12.9/0.48 |
| Rhabditida | |||||||
| Anisakis simplex l. | 88.8/7.86 | 56.81/2.01 | 72.81/4.68 | 78.8/6.18 | 33.32/1.00 | 94.4/13.35 | 88.7/10.33 |
| Hysterothylacium aduncum l. | 6.8/0.10 | 15.11/0.213 | 13.31/0.29 | 7.7/0.09 | 18.52/0.30 | 28.2/0.55 | 41.43/1.20 |
| Pseudoterranova decipiens l. | – | 0.7/0.01 | – | – | – | 1.1/0.01 | 4.3/0.06 |
| Spinitectus oviflagellis | – | 0.7/0.01 | 3.21/0.11 | – | – | – | – |
| Rhabditida gen. sp. | – | – | 1.91/0.03 | – | – | – | – |
| Palaeacanthocephala | |||||||
| Corynosoma strumosum l. | 0.3/0.01 | 3.61/0.05 | 1.3/0.02 | 0.5/0.01 | – | – | 2.93/0.03 |
| Echinorhynchus gadi | – | 1.41/0.06 | 1.31/0.02 | – | – | – | – |
| Palaeacanthocephala sp. l. | – | – | 1.91/0.03 | – | – | – | – |
| Hexanauplia | – | ||||||
| Chondracanthus nodosus | – | – | 0.71/0.01 | – | 3.72/0.04 | – | 1.4/0.01 |
| Peniculus clavatus | – | – | – | – | 3.72/0.04 | – | – |
| Pennella sp. | – | 0.7/0.01 | – | – | – | – | – |
| Sphyrion lumpi | 45.0/1.102 | 13.21/0.21 | 15.61/0.24 | 41.7/0.92 | 12.52/0.17 | 53.4/1.23 | 26.43/0.46 |
| Средняя длина рыб (TL), см | 35.5 | 31.6 | 38.5 | 34.6 | 36.7 | 36.0 | 34.2 |
| Число исследованных рыб, экз. | 957 (1340) | 139 (11511) | 158 (1077) | 199 (991) | 27 | 178 (6392) | 70 (3349) |
Примечание. СНБ − Северная Ньюфаундлендская банка; перед чертой – экстенсивность инвазии (ЭИ), %, после черты – индекс обилия (“+” − не определяли у Myxozoa); число исследованных рыб: за скобками – все виды паразитов, за исключением S. lumpi, в скобках − только S. lumpi; отличия значений ЭИ достоверны при р < 0.05: 1от пелагиали моря Ирмингера, 2от пелагиали моря Лабрадор, 3от пелагиали Норвежского моря.
Таблица 2.
Особенности фауны паразитов окуня-клювача Sebastes mentella в сравниваемых районах пелагиали и батиали морей Северной Атлантики и Норвежского моря
| Показатель | Сравниваемые районы | |||
|---|---|---|---|---|
| пМИ−бГ | пМИ−бИ | МЛ−бСНБ | пНМ−бНМ | |
| Число обнаруженных видов паразитов | 22 | 24 | 21 | 19 |
| Доля видов паразитов со значимыми различиями (р < 0.05) в экстенсивности инвазии, % | 59.1 | 58.3 | 42.9 | 21.0 |
| Мера парного сходства состава фауны паразитов (L0), % | 74.3 | 70.3 | 72.7 | 91.4 |
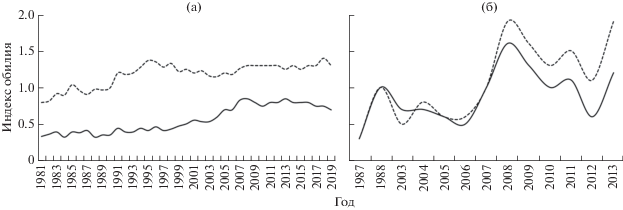
Итоги многолетнего мониторинга свидетельствуют о значимых межгодовых колебаниях степени инвазии окуня-клювача мезопелагической копеподой S. lumpi (Бакай, 2011, 2014; Бакай, Попов, 2017) и синхронности этих колебаний в пелагиали и батиали северной части Норвежского моря (рис. 2). Североатлантическую популяцию клювача отличают отсутствие значимых колебаний заражённости копеподой S. lumpi в пелагиали в 1981–2019 гг., пространственное и батиметрическое постоянство значимо более высокой инвазии паразитом самок окуня (рис. 3), стабильно высокий (у 42–53% рыб при ИО 0.9–1.2) уровень инвазии копеподой в мезопелагиали и наличие лишь единичных следов её инвазии (у 12.5–15.6% рыб, ИО 0.2) на смежных акваториях батиали Гренландии, Исландии и Канады (табл. 1). Эти неизменные особенности инвазии копеподой S. lumpi обоснованы в качестве фена (в понимании Яблокова, 1982) пелагической группировки североатлантической популяции окуня-клювача (Бакай, 2011, 2014; Бакай, Попов, 2017), указывая на присутствие в ареале хозяина двух центров заражения этим паразитом – мезопелагиаль морей Ирмингера и Норвежского.
Рис. 2.
Межгодовая динамика экстенсивности инвазии окуня-клювача Sebastes mentella копеподой Sphyrion lumpi (с учётом следов её инвазии) в батиали (—) и пелагиали (- -) северной части Норвежского моря в феврале−мае 1982–2002 гг. и ноябре 2003−2016 гг.; (I) – пределы варьирования показателя, (− ∙ −) − линия тренда для батиали (R2 = 0.0026).
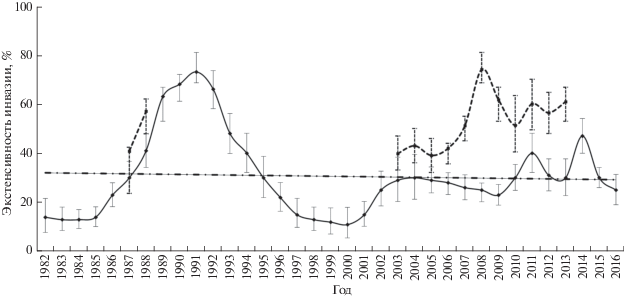
Рис. 3.
Межгодовая динамика заражённости самцов (—) и самок (- -) окуня-клювача Sebastes mentella копеподой Sphyrion lumpi (с учётом следов её инвазии) в апреле–июле 1981–2019 гг.: а − пелагиаль моря Ирмингера, б − северная часть Норвежского моря.
Темп линейного роста окуня-клювача в морях СА и в Норвежском море сходен (Захаров и др., 1977; Мельников, Бакай, 2006, 2009а, 2009б; Бакай, Мельников, 2008; Melnikov, 2016). Ежегодный абсолютный прирост длины его особей в возрасте наступления массового (50%) полового созревания (8–18 лет) варьирует в пределах 1–2 (в среднем 1.5) см. Это подтверждают результаты расчётов огив полового созревания окуня (рис. 4) и сравнительного анализа темпа его роста в пелагиали и батиали СА и Норвежского моря (Мельников, Бакай, 2006, 2009а, 2009б; Бакай, Попов, 2017).
Рис. 4.
Огивы полового созревания окуня-клювача Sebastes mentella в батиали и пелагиали Норвежского моря: а – длина (батиаль – 42526 экз., пелагиаль – 16959 экз.), б − возраст (16215 и 3205 экз.); обозначения см. на рис. 2.
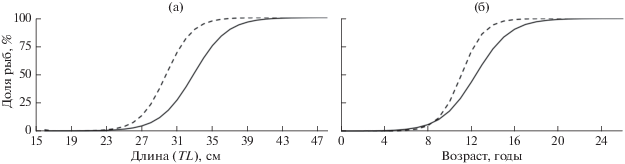
Особи окуня-клювача, обитающие в пелагиали как СА, так и Норвежского моря, достигают половой зрелости при меньшей длине и в более раннем возрасте, чем на сопредельных акваториях батиали (Rikhter, 1996; Мельников, Бакай, 2006, 2009а, 2009б; Бакай, Мельников, 2008; Melnikov, 2016; Бакай, Попов, 2017). Так, массовое половое созревание рыб в пелагиали всех районов наступает при TL 29–31 см в возрасте 8–11 лет, а в батиали – при TL 32–43 см в возрасте 13–19 лет (табл. 3). При этом в морях Ирмингера и Лабрадор разница длины массового созревания (TL50) и возраста особей окуня-клювача в пелагиали и батиали составляет 6.6–9.9 (в среднем 7.9) см и 5.3 года, а в Норвежском море – лишь 3.1 см и 2.0 года. Более высокий темп полового созревания особей клювача приводит и к более раннему полному созреванию рыб в пелагиали (TL100 = 36–44 см, возраст 15–19 лет), чем в батиали, – при максимальной для этого вида длине (44–50 см) и возрасте (22–26 лет). Поэтому доля зрелых особей клювача в пелагиали выше, чем в батиали (88.6–96.7 против 13.0–60.6%).
Таблица 3.
Длина особей, достигших полового созревания, и доля половозрелых самцов и самок окуня-клювача Sebastes mentella в пелагиали и батиали морей Северной Атлантики и Норвежского моря
| Море, биотоп | Число рыб, экз. | Длина (TL), см | Доля половозрелых рыб, % | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Самцы | Самки | Самцы | Самки | Оба пола | Самцы | Самки | Оба пола | |||
| TL50 | TL100 | TL50 | TL100 | TL50 | ||||||
| Море Ирмингера: | ||||||||||
| – пелагиаль | 2263 | 1612 | 30.3 | 40.0 | 31.2 | 40.8 | 30.7 | 91.2 | 94.6 | 92.9 |
| – батиаль Гренландии | 415 | 328 | 35.1 | 44.0 | 39.6 | 45.4 | 37.4 | 32.1 | 14.3 | 23.2 |
| – батиаль Исландии | 648 | 552 | 35.8 | 45.0 | 40.3 | 47.0 | 38.0 | 42.0 | 36.5 | 39.2 |
| Море Лабрадор: | ||||||||||
| – пелагиаль | 6739 | 5047 | 29.1 | 36.0 | 30.2 | 39.0 | 30.5 | 88.1 | 89.0 | 88.6 |
| – батиаль СНБ | 953 | 825 | 36.4 | 48.0 | 42.6 | 50.0 | 39.5 | 19.0 | 7.0 | 13.0 |
| Норвежское море (север): | ||||||||||
| – пелагиаль | 9142 | 5722 | 29.1 | 43.7 | 30.3 | 44.2 | 29.7 | 96.0 | 97.6 | 96.7 |
| – батиаль | 16 896 | 16 657 | 32.1 | 47.0 | 33.5 | 43.0 | 32.8 | 56.2 | 63.8 | 60.6 |
Высокая мера сходства (L0 = 91.4%) состава фауны паразитов при малой доле (21.0%) видов со значимыми различиями в степени заражённости окуня-клювача пелагической и придонной группировок в северной части Норвежского моря (Бакай, 2011) по сравнению с этими показателями в морях СА (соответственно L0 = 70.3–74.3 и 42.9–59.1%) (Bakay, 2000, 2001; Мельников, Бакай, 2006, 2009б) свидетельствуют о меньшей обособленности между собой таких группировок в Норвежском море. Помимо этого, значимые и синхронные межгодовые колебания уровня инвазии клювача копеподой S. lumpi в батиали и пелагиали северной части Норвежского моря (рис. 2) подтверждают предположение некоторых авторов (Drevetnyak et al., 2011) о наличии массового возврата особей окуня из пелагиали в батиаль Норвежского моря после спаривания. По имеющимся данным, пелагическая группировка клювача в морях СА обитает круглогодично (Мельников, Бакай, 2009б; Melnikov, 2016), значительно обособившись от придонной группировки его североатлантической популяции. Отсутствие массового обмена особями окуня-клювача между этими группировками в районе Исландии подтверждено результатами его подводного мечения (Sigurðsson et al., 2006).
Формирование в СА и Норвежском море пелагических и придонных группировок окуня-клювача, являющегося наиболее филогенетически молодым среди видов североатлантических Sebastes (Artamonova et al., 2013; Рольский и др., 2017), свидетельствует о продолжении процесса его видообразования. Данный процесс обусловлен стратегией этого экологически пластичного вида на расширение ареала путём освоения мезопелагиали СА и Норвежского моря. Заселение клювачем мезопелагиали в большом диапазоне глубин (100−1000 м) способствует снятию напряжённости пищевой конкуренции не только в придонных слоях батиали Гренландии, Канады, Исландии и Норвегии, но и в мезопелагиали. Формирование пелагических группировок клювача сопровождается увеличением темпа его полового созревания и миграционной активности, расширением спектра кормовых ресурсов, приводящим к развитию у окуня эврифагии (Бакай, Мельников, 2008; Мельников, Бакай, 2009б; Долгов, 2016). Такое усложнение экологической структуры вида согласуется с гипотезой темпа жизни, согласно которой быстрый темп жизни подразумевает более быстрый рост и раннее созревание, бóльшую активность и скорость метаболизма (Hall et al., 2015). Кроме того, у окуня-клювача в мезопелагиали морей СА произошли и морфологические изменения, способствующие росту его миграционной активности: уменьшение размеров толщины тела, длины головы и шипов на ней (Garabana, 2005).
Успешному освоению окунем-клювачем обширной (от Исландии до Канады) акватории мезопелагиали морей СА способствует отсутствие значительной конкуренции со стороны наиболее массовых видов рыб (северная путассу Micromesistius poutassou, атлантические сельдь Clupea harengus и скумбрия Scomber scombrus) пелагиали Северо-Восточной Атлантики, откармливающихся преимущественно в Норвежском море. Особи первых двух из этих видов способны быть прямыми пищевыми конкурентами окуню, а скумбрии, кроме этого, могут потреблять в пищу его пелагических личинок, поднимающихся после вымета в эпипелагиаль.
Продолжающийся процесс видообразования у окуня-клювача сопровождается усилением обособленности особей его пелагической и придонной группировок при росте различий темпа их полового созревания. Результатом такой обособленности может стать и репродуктивная изоляция, предпосылки которой отмечены у клювача в Норвежском море. Так, не только вымет предличинок самками в апреле−мае, но и спаривание в августе–октябре происходят как на акватории батиали, так и в пелагиали Норвежского моря (Drevetnyak et al., 2011; Бакай, Попов, 2017). Поэтому меньшая, чем в морях СА, обособленность пелагической и придонной группировок окуня-клювача в Норвежском море, обусловленная массовым возвратом его особей в батиаль после спаривания в пелагиали, при меньших различиях длины и возраста их массового полового созревания свидетельствуют о том, что пелагическая группировка в Норвежском море находится на более ранней стадии формирования. Это может являться следствием относительной филогенетической молодости норвежско-баренцевоморской популяции окуня-клювача по сравнению с североатлантической.
Итоги исследования географической структуры фауны паразитов и пространственно-временнóго изменения двух обоснованных фенов окуня-клювача пелагической группировки его североатлантической популяции (Bakay, 2001; Бакай, Мельников, 2008; Бакай, 2011, 2014, 2015; Бакай, Попов, 2017) подтверждают самостоятельность его норвежско-баренцевоморской популяции. Они же указывают на возникновение в начале 2000-х гг. массовых миграций особей этого вида из пелагиали моря Ирмингера за пределы ареала североатлантической популяции в пелагиаль юго-западной части, а с 2008 г. и северной части Норвежского моря, где возникли смешанные скопления клювача двух популяции (рис. 3б). Это свидетельствует о наличии донорства североатлантической популяции окуня-клювача в отношении его норвежско-баренцевоморской популяции и вероятном источнике происхождения второй из них, очевидно, в результате завершения Последнего ледникового максимума.
Возникновение таких миграций клювача объясняет отсутствие достоверных различий в составе и характере распределения аллелей ферментных локусов в его пробах из моря Ирмингера и северной части Норвежского моря (Строганов и др., 2009). Результатом этих массовых и невозвратных миграций окуня-клювача, возможно, могло стать значительное необъясненное снижение индексов его численности в пелагиали морей Ирмингера и Лабрадор в 2007–2013 гг., выявленное по итогам проведения четырёх международных тралово-акустических съёмок по оценке его запаса (ICES, 2013a). К сожалению, достоверные оценки индексов численности и динамики запаса окуня-клювача в Норвежском море отсутствуют (ICES, 2013b).
Список литературы
Андреев В.Л., Решетников Ю.С. 1977. Исследование внутривидовой и морфологической изменчивости сига Coregonus lavaretus (L.) методами многомерного статистического анализа // Вопр. ихтиологии. Т. 18. Вып. 5. С. 862–878.
Андреев В.Л., Решетников Ю.С. 1978. Анализ состава пресноводной ихтиофауны северо-восточной части СССР на основе методов теории множеств // Зоол. журн. Т. 57. Вып. 2. С. 165–174.
Бакай Ю.И. 2011. Эколого-паразитологическая характеристика окуня-клювача Sebastes mentella (Sebastidae) Норвежского моря и смежных вод // Вопр. ихтиологии. Т. 51. № 1. С. 97–104.
Бакай Ю.И. 2013. К вопросу о происхождении североатлантических Sebastes (Scorpaenidae) на основе анализа их паразитофауны // Биология моря. Т. 39. № 3. С. 227–229.
Бакай Ю.И. 2014. Экологические особенности паразитирования Sphyrion lumpi (Copepoda) у окуня-клювача Sebastes mentella // Тр. Центра паразитологии ИПЭЭ РАН. Т. XLVIII. Систематика и экология паразитов. М.: Тов. науч. изд. КМК. С. 24–26.
Бакай Ю.И. 2015. Кожные пигментные образования как фен североатлантической популяции окуня-клювача Sebastes mentella Travin, 1951 (Scorpaenidae) // Биология моря. Т. 41. № 2. С. 145–148.
Бакай Ю.И., Карасев А.Б. 1995. Диагностика и регистрация эктопоражений морских окуней (методическое руководство). Мурманск: Изд-во ПИНРО, 22 с.
Бакай Ю.И., Мельников С.П. 2008. Биолого-экологическая характеристика окуня-клювача Sebastes mentella (Scorpaenidae) на разных глубинах в пелагиали моря Ирмингера // Вопр. ихтиологии. Т. 48. № 1. С. 73–85.
Бакай Ю.И., Попов В.И. 2017. Эколого-популяционные особенности окуня-клювача Sebastes mentella (Scorpaenidae) Норвежского моря на основе анализа его паразитофауны // Вестн. МГТУ. Т. 20. № 2. С. 412–421. https://doi.org/10.21443/1560-9278-2017-20-2-412-421
Барсуков В.В. 1981а. Морские окуни (Sebastinae) Мирового океана – их морфология, экология, распространение, расселение и эволюция: Автореф. дис. … докт. биол. наук. Л.: ЗИН АН СССР, 50 с.
Барсуков В.В. 1981б. Краткий обзор системы подсемейства морских окуней (Sebastinae) // Вопр. ихтиологии. Т. 21. Вып. 1. С. 3–27.
Бейли Н. 1970. Математика в биологии и медицине. М.: Мир, 326 с.
Бреев К.А. 1976. Применение математических методов в паразитологии // Изв. ГосНИОРХ. Т. 105. С. 109–126.
Быховская-Павловская И.Е. 1985. Паразиты рыб. Руководство по изучению. Л.: Наука, 120 с.
Границы океанов и морей. 2000. СПб.: Изд-во ГУНиО МО РФ, 206 с.
Долгов А.В. 2016. Состав, формирование и трофическая структура ихтиоценов Баренцева моря. Мурманск: Изд-во ПИНРО, 336 с.
Донец З.С., Шульман С.С. 1973. О методах исследований Myxosporidia (Protozoa, Cnidosporidia) // Паразитология. Т. 7. Вып. 2. С. 191–192.
Захаров Г.П., Никольская Т.Л., Сорокин В.П. и др. 1977. Морской окунь клюворылый (клювач) Sebastes mentella // Промысловые биологические ресурсы Северной Атлантики и прилегающих морей Северного Ледовитого океана. Ч. 2. М.: Пищ. пром-сть. С. 72–87.
Литвиненко Н.И. 1985. Морские окуни (род Sebastes) Северной Атлантики – их морфология, экология, распространение, расселение и эволюция: Автореф. дис. … канд. биол. наук. Л.: ЛГУ, 22 с.
Мельников С.П., Бакай Ю.И. 2006. Биолого-экологическое обоснование мер регулирования промысла окуня-клювача в районе Исландии // Рыб. хоз-во. № 1. С. 48–50.
Мельников С.П., Бакай Ю.И. 2009а. Структура скоплений и основные популяционные характеристики окуня-клювача Sebastes mentella (Scorpaeniformes: Scorpaenidae) в пелагиали моря Ирмингера и смежных вод // Вопр. ихтиологии. Т. 49. № 2. С. 200–213.
Мельников С.П., Бакай Ю.И. 2009б. Пополнение запаса окуня-клювача Sebastes mentella (Scorpaeniformes: Scorpaenidae) в пелагиали моря Ирмингера и смежных вод // Там же. Т. 49. № 5. С. 669–680.
Методические указания по определению видов морских окуней северной части Атлантического океана и прилежащих морей. 1984. Калининград: Изд-во АтлантНИРО, 28 с.
Рольский А.Ю., Махров А.А., Артамонова В.С. 2017. Процессы видообразования морских окуней рода Sebastes Атлантического и Северного Ледовитого океанов // Матер. III Междунар. конф. “Современные проблемы биологической эволюции”. М.: ГДМ. С. 101–104.
Снытко В.А. 2001. Морские окуни северной части Тихого океана. Владивосток: Изд-во ТИНРО-центра, 468 с.
Строганов А.Н., Лепесевич Ю.М., Мельников С.П. 2009. Биолого-генетическая характеристика окуня-клювача Sebastes mentella (Scorpaenidae) открытой части Норвежского моря // Вопр. ихтиологии. Т. 49. № 3. С. 333–340.
Яблоков А.В. 1982. Состояние исследований и некоторые проблемы фенетики популяций // Фенетика популяций. М.: Наука. С. 3–14.
Artamonova V.S., Karabanov D.P., Makhrov A.A. et al. 2011. Hybridization of redfish (genus Sebastes) in the Irminger Sea and its significance for studies of population structure of beaked redfish, S. mentella // ICES CM/A:06. 3 p.
Artamonova V.S., Makhrov A.A., Karabanov D.P. et al. 2013. Hybridization of beaked redfish (Sebastes mentella) with small redfish (S. viviparus) and diversification of redfishes (Scorpaeniformes) in the Irminger Sea // J. Natur. Hist. V. 1. № 47. P. 1791–1801. https://doi.org/10.1080/00222933.2012.752539
Bakay Yu.I. 1989. On infestation of marine redfishes (Sebastes genus) of the North Atlantic by the copepod Sphyrion lumpi (Krøyer, 1845) // Proc. Int. Workshop Sphyrion lumpi. Güstrow. GDR. P. 29–36.
Bakay Yu.I. 2000. Parasites and pigmented patches as indicators of intraspecific structure of Sebastes mentella in the Irminger Sea // ICES CM 2000/Z:06. 16 p.
Bakay Yu.I. 2001. Results from the analysis of geographical variability in parasite fauna of redfish Sebastes mentella from the North Atlantic // Deep-Sea Fisheries Symposium. NAFO SCR Doc. 01/153. Ser. № 4503. 11 p.
Bush A., Lafferty K., Lotz J., Shostak A. 1997. Parasitology meets ecology on its own terms: Margolis et al. Revisited // J. Parasitol. V. 83. № 4. P. 575–583.
Cadrin S., Bernreuther M., Daníelsdóttir A. et al. 2010. Population structure of beaked redfish, Sebastes mentella: evidence of divergence associated with different habitats // ICES J. Mar. Sci. V. 67. № 8. P. 1617–1630. https://doi.org/10.1093/icesjms/fsq046
Drevetnyak K., Nedreaas K., Planque B. 2011. Redfish // The Barents Sea: ecosystem, resources, management. Half a century of Russian-Norwegian cooperation / IMR, PINRO. Trondheim: Tapir. P. 292–307.
Garabana D. 2005. The genus Sebastes Cuvier, 1829 (Pisces, Scorpaenidae) in the North Atlantic: species and stock discrimination using traditional and geometric morphometrics: Ph. D. Thesis. Vigo: Univ. Vigo, Spain, 306 p.
Gardner J.P. 1997. Hybridization in the sea // Adv. Mar. Biol. V. 31. P. 1–78. https://doi.org/10.1016/S0065-2881(08)60221-7
Hall M., Asten T., Katsis A. et al. 2015. Animal personality and pace-of-life syndromes: do fast-exploring fairy-wrens die young? // Front. Ecol. Evol. V. 3. Article 28. 14 p. https://doi.org/10.3389/fevo.2015.00028
Hyde J., Vetter R. 2007. The origin, evolution, and diversification of rockfishes of the genus Sebastes (Cuvier) // Mol. Phylogen. Evol. V. 44. P. 780–811.
ICES. 2013a. Report of the Working Group on Redfish Surveys (WGRS). ICES CM 2013/SSGESST:14. Copenhagen: ICES Headquarters, 56 p.
ICES. 2013b. Report of the Arctic Fisheries Working Group (AFWG). ICES CM 2013/ACOM:05. Copenhagen: ICES Headquarters, 726 p.
Johansen T., Danielsdottir A., Meland K., Nævdal G. 2000. Studies of the genetic relationship between deep-sea and oceanic Sebastes mentella in the Irminger Sea // Fish. Res. V. 49. № 2. P. 179–192.
MacKenzie K., Hemmingsen W. 2015. Parasites as biological tags in marine fisheries research: European Atlantic waters // Parasitology. V. 142. № 1. P. 54–67. https://doi.org/10.1017/S0031182014000341
Makhrov A., Artamonova V., Popov V. et al. 2011. Comment on: Cadrin et al. (2010) ”Population structure of beaked redfish, Sebastes mentella: evidence of divergence associated with different habitats. ICES Journal Marine Science, 67: 1617–1630” // ICES J. Mar. Sci. V. 68. № 10. P. 2013–2015. https://doi.org/10.1093/icesjms/fsr132
Melnikov S. 2016. Intraspecies structure of beaked redfish Sebastes mentella of the Atlantic and Arctic Oceans // J. Ichthyol. V. 56. № 1. P. 52–71. https://doi.org/10.7868/S0042875216010094
Planque B., Astakhov A., Kristinsson K. et al. 2013. Monitoring beaked redfish (Sebastes mentella) in the North Atlantic, current challenges and future prospects // Aquat. Liv. Resour. V. 26. P. 293–306. https://doi.org/10.1051/alr/2013062
Rikhter V.A. 1996. On population structure of beaked redfish (Sebastes mentella Travin) in the Irminger Sea as related to larval drift // NAFO Sci. Coun. Stud. Doc. 27. P. 49–56.
Roques S., Sevigny J-M., Bernatchez L. 2001. Evidence for broadscale introgressive hybridization between two redfish (genus Sebastes) in the North-west Atlantic: a rare marine example // Mol. Ecol. V. 10. P. 149–165. https://doi.org/10.1046/j.1365-294x.2001.01195.x
Saborido-Rey F., Garabana D., Stransky K. et al. 2004. Review of the population structure and ecology of S. mentella in the Irminger Sea and adjacent waters // Rev. Fish Biol. Fish. V. 14. P. 455–479. https://doi.org/10.10007/s11160-005-3585-9
Saha A., Johansen T., Hedeholm R. et al. 2017. Geographic extent of introgression in Sebastes mentella and its effect on genetic population structure // Evol. Appl. V. 10. P. 77–90.https://doi.org/10.1111/eva.12429
Shum P., Pampoulie P., Kristinsson K., Mariani S. 2015. Three-dimensional post-glacial expansion and diversification of an exploited oceanic fish // Mol. Ecol. V. 24. № 14. P. 3652–3667. https://doi.org/10.1111/mec.13262
Sigurðsson T., Thorsteinsson V., Gustafsson L. 2006. In situ tagging of deep-sea redfish: application of an underwater, fish-tagging system // ICES J. Mar. Sci. V. 63. P. 523–531. https://doi.org/10.1016/j.icesjms.2005.05.023
Stefansson M., Reinert J., Sigurðsson P. et al. 2009. Depth as a potential driver of genetic structure of Sebastes mentella across the North Atlantic Ocean // Ibid. V. 66. P. 680–690.
Williams H., MacKenzie K., McCarthy A. 1992. Parasites as biological indicators of the population biology, migrations, diet and phylogenetics of fish // Rev. Fish Biol. Fish. V. 2. P. 144–176.
WoRMS. 2018. World register of marine species (http://www.marinespecies.org at VLIZ. Version 12/2018). https://doi.org/10.14284/170
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


