Вопросы ихтиологии, 2020, T. 60, № 2, стр. 174-182
Сезонное распределение нитчатого шлемоносца Gymnocanthus pistilliger (Cottidae) в российских водах Японского моря
В. В. Панченко 1, 2, *, А. А. Матвеев 3, Л. Л. Панченко 4
1 Тихоокеанский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии – ТИНРО
Владивосток, Россия
2 Национальный научный центр морской биологии Дальневосточного отделения РАН – ННЦМБ ДВО РАН
Владивосток, Россия
3 Камчатский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии – КамчатНИРО
Петропавловск-Камчатский, Россия
4 Владивостокский государственный университет экономики и сервиса
Владивосток, Россия
* E-mail: vlad-panch@yandex.ru
Поступила в редакцию 11.03.2019
После доработки 09.04.2019
Принята к публикации 11.04.2019
Аннотация
В российских водах Японского моря нитчатый шлемоносец Gymnocanthus pistilliger в весенне-осенний период обитает на глубинах от 5 до 217 м при температуре придонного слоя воды от –1.4 до +18.7°С. Весной мигрирует от внешней границы шельфа в его прогреваемую среднюю и верхнюю части, где летом образует нагульные, а осенью преднерестовые концентрации. Наибольшие скопления наблюдаются в зал. Петра Великого, наименьшие – в северной части Татарского пролива. В летний период молодь придерживается прогреваемой мелководной зоны, которую взрослые рыбы избегают. С началом осеннего охлаждения мелкоразмерные рыбы смещаются глубже, а на мелководье проникают производители. Максимальные глубины обитания во все сезоны характерны только для взрослых рыб. В водах Японского моря G. pistilliger достигает большей длины (33 см), чем на севере ареала. В популяции преобладают самки, достигающие бóльших размеров, чем самцы. В летний период соотношение полов на относительно небольших глубинах близко, с увеличением глубины доля самок постепенно возрастает.
Нитчатый шлемоносец Gymnocanthus pistilliger – преимущественно бореальный вид; в Арктике обитает лишь в южной части Чукотского моря, в Азии – повсеместно в Охотском и Беринговом морях, в Японском море вдоль материкового побережья до Пусана, у Хоккайдо, Курильских о-вов, Юго-Восточной Камчатки, в зал. Аляска (Chyung, Kim, 1959; Неелов, 1979; Сон Ён Хо, 1986; Линдберг, Красюкова, 1987; Kim, Yoon, 1992; Amaoka et al., 1995; Борец, 2000; Шейко, Федоров, 2000; Mecklenburg et al., 2002; Федоров и др., 2003; Фадеев, 2005; Парин и др., 2014; Fricke et al., 2019; Froese, Pauly, 2019). Во многих районах, в том числе и в российских водах Японского моря, является обычным видом (Соколовский и др., 2007), между тем, хотя и относится к объектам рыболовства, промыслом осваивается слабо.
Несмотря на обширный ареал нитчатого шлемоносца, этот вид остаётся недостаточно изученным. По северной области ареала имеются ограниченные данные о его распределении, возрастном составе и некоторых чертах биологии из прикамчатских вод (Николотова, 1977; Токранов, 1981, 1985, 1987, 1988, 1993; Токранов, Полутов, 1984; Чучукало, 2006; Баланов, Матвеев, 2018) и восточной части Берингова моря (Hoff, 2000). На юге целенаправленные исследования G. pistilliger велись в основном в зал. Петра Великого, граничащим с водами Корейского п-ова, где изучалось его распределение в тёплый период года и в начале осеннего похолодания (Вдовин и др., 1994), динамика численности (Панченко, 2013), а также здесь и в прилегающих водах Приморья – возраст и рост (Шелехов, Панченко, 2007; Панченко, 2012). В других публикациях по Японскому морю содержатся лишь отрывочные сведения о его распределении и питании (Вдовин, Зуенко, 1997; Калчугин, 1998; Ким Сен Ток, 2001; Пущина, 2005; Чучукало, 2006; Соломатов, 2008; Панченко, Зуенко, 2009; Панченко и др., 2016; Пущина и др., 2016).
Цель работы – выявить закономерности сезонного батиметрического и пространственного распределения, а также проследить тенденции распределения разных размерных групп нитчатого шлемоносца в российских водах Японского моря.
МАТЕРИАЛ И МЕТОДИКА
В основу работы положены данные донных траловых съёмок и контрольных тралений акватории российских вод Японского моря, проведённых ТИНРО в разные сезоны 1983–2017 гг.11 Использованы данные 9486 тралений на шельфе и материковом склоне российской зоны Японского моря на глубинах от 2 до 935 м, из них 4689 сопровождались измерением придонной температуры воды. Основная масса тралений ниже 5-метровой изобаты выполнена донными тралами с мягким грунтропом, длиной верхней подборы от 20 до 69 м (горизонтальное раскрытие от 13 до 38 м) и ячеёй в кутце от 10 до 30 мм со скоростью 1.5–4.5 (в среднем 2.6) узлов. На меньших глубинах основным орудием лова являлся модифицированый в ТИНРО бим-трал (Вдовин и др., 2009) с ячеёй в кутце 10 мм и горизонтальным раскрытием 3 м; скорость траления 1.3–3.4 (2.4) узлов. Для получения сравнимых результатов при использовании тралов разных конструкций уловы рыб пересчитывали на плотность по формуле: P = B/S, где P – плотность, кг/км2; B – улов, кг; S – площадь траления, км2. Так как вопрос о коэффициентах уловистости рыб остаётся дискуссионным, коэффициент уловистости при пересчёте на плотность не вводили.
Деление на гидрологические сезоны проводили по классификации Зуенко (1994): весенний – март–апрель, летний – июнь–сентябрь, осенний – ноябрь–декабрь: май является переходным месяцем между весенним и летним сезонами, октябрь – между летним и осенним. Поскольку характер распределения донных рыб в мае ближе к таковому весной (Соломатов, 2008), май мы относим к весеннему сезону. Первая же половина октября проанализирована совместно с летними месяцами, вторая – с осенними.
Анализ пространственного распределения нитчатого шлемоносца выполнен с помощью программного пакета CHARTMASTER методом сплайн-аппроксимации. Всего измерили абсолютную длину (TL) 53 663 особей, из них 20 322 с определением пола; индивидуально взвесили 1374 экз.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пространственное распределение нитчатого шлемоносца в российских водах Японского моря во все исследованные сезоны отличалось неоднородностью (рис. 1). Наибольшие концентрации в весенне-осенний период формировались на широком шельфе юга района, в зал. Петра Великого, с пиковыми значениями в летний нагульный период (рис. 1б). В этот сезон здесь прослеживались два центра плотности: один локализовался в западной части залива, другой – в восточной. Такую же закономерность отметили ранее Вдовин с соавторами (1994) при изучении распределения нитчатого шлемоносца в зал. Петра Великого в июле–октябре. На основании проведённого анализа эти авторы высказали предположение о существовании в заливе двух внутривидовых группировок, граница между которыми проходит в зоне раздела циркуляции вод, располагающейся в центральной части залива. А наблюдавшееся в октябре увеличение концентраций бычка без перераспределения скоплений они связали с преднерестовой миграцией, идущей в западную часть из северокорейских вод, а в восточную – из североприморских. Таким образом, отмеченную нами высокую плотность шлемоносца в зал. Петра Великого в осенний период (рис. 1в) можно объяснить концентрацией рыб на нерестилищах. Весной же плотность рыб заметно ниже, основные концентрации в заливе смещены восточнее (рис. 1а). Если верно предположение о подходе в осенний период на нерест в западную часть зал. Петра Великого группировки производителей из северокорейских вод, отсутствие высоких концентраций здесь весной можно связать с обратной их миграцией после нереста. Новиков с соавторами (2002) считают, что в целом для вод Приморья нерест нитчатого шлемоносца происходит в зимний период на глубинах 60–110 м. Вдовин с соавторами (1994), со ссылкой на неопубликованные данные М.С. Стрельцова, сообщают, что на юге Приморья, в зал. Петра Великого, этот вид нерестится на несколько меньших глубинах – 30–50 м. Мы в этом районе в первой половине декабря обнаружили преднерестовых и нерестовых особей на ещё меньших глубинах – 6–14 м: в двух тралениях были пойманы семь самок и один самец G. pistilliger. Самец и четыре самки имели гонады IV–V стадии зрелости (Сакун, Буцкая, 1968), а три самки – текучие половые продукты.
Рис. 1.
Пространственное распределение нитчатого шлемоносца Gymnocanthus pistilliger в российских водах Японского моря по сезонам: а – весна, б – лето, в – осень.
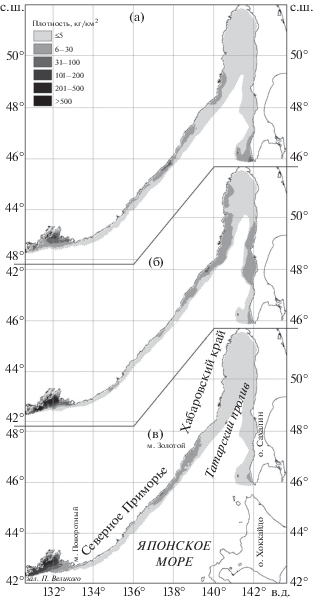
Широкий шельф, подобный существующему в зал. Петра Великого, имеется в Татарском проливе, однако значительных концентраций шлемоносца здесь ни в один из сезонов не наблюдалось (рис. 1), минимальные же уловы приурочены к осеннему периоду, максимальные – к летнему. Судя по резкому снижению (особенно в кутовой части) плотности рыб в осенний период (рис. 1в), в это время происходит откочёвка G. pistilliger из вод пролива, из чего можно сделать вывод об отсутствии в его северной и центральной частях нерестовых участков. Вероятно, и после нереста зимовальных миграций в направлении вод Татарского пролива не происходит. Для этой области Японского моря характерен субарктический тип вертикальной структуры вод с пониженными значениями температуры и солёности (Яричин, 1980; Зуенко, 2008), неблагоприятными (особенно в зимний период) для обитания многих видов гидробионтов, в том числе для представителей семейства рогатковых (Cottidae), в частности пёстрого получешуйника Hemilepidotus gilberti и двурогого бычка Enophrys diceraus (Панченко, Пущина, 2018, 2019). Лишь юг островного побережья находится под воздействием тёплого Цусимского течения, где во все исследованные сезоны и сохраняется относительно высокая плотность рыб. Часть рыбного населения на зимовку смещается южнее, к побережью о-ва Хоккайдо (Ким Сен Ток, 2004). С весенним прогревом вод концентрации нитчатого шлемоносца в водах Татарского пролива со стороны как материка, так и о-ва Сахалин начинают перемещаться на север и в летний период в островной части достигают центральной области, а в материковой – и кутовой части.
Рассматривая оставшуюся область материковой акватории российских вод Японского моря, можно во все сезоны отметить отсутствие на прилегающем к зал. Петра Великого с северо-востока шельфе значительных концентраций нитчатого шлемоносца (рис. 1). Формирование скоплений в южной области Северного Приморья и разрыв с центральной можно объяснить системой вергенций вод, из которых наиболее важной является зона дивергенции. Она находится в центральной части моря и вытянута на северо-восток, но в районе 44° с. ш. имеет почти широтное направление и вплотную примыкает к материковому шельфу (Яричин, Покудов, 1982). Зона дивергенции характеризуется квазистационарным положением, значительной мощностью по вертикали и выклинивается на шельф, разрывая идущее с севера на юг Приморское течение. Разрыв в распределении рыб в этом районе, в том числе представителей Cottidae, отмечали и ранее (Калчугин, 1998; Соломатов, 2008). Выше, в центральной части материковой акватории, наименьшая область повышенных уловов наблюдалась летом (рис. 1б), что можно связать с предпочтением основной частью рыб в нагульный период широких шельфовых зон, ближайшая из которых здесь располагается на севере района. Осенью концентрация рыб в центральной части материковой акватории повышается, что, видимо, объясняется нерестовым подходом рыб с севера, из вод Татарского пролива; весной же, при растекании по шельфу в северном направлении, понижается.
В северо-западной части Японского моря нитчатый шлемоносец относится к сублиторально-элиторальной группировке рыб, обитающих в тёплый период года преимущественно на глубинах <50 м, а на зиму откочёвывающих к внешнему краю шельфа (Соломатов, 2008). Вполне закономерно, что самый узкий его батиметрический диапазон приурочен к лету: в целом по району наименьшая глубина поимки составила 5 м, наибольшая – 135 м (рис. 2). Следует отметить, что на глубине 135 м был выловлен всего 1 экз. шлемоносца, причём в конце гидрологического лета (конец сентября). Следующая по степени глубоководности поимка в летний сезон зарегистрирована на глубине 107 м. Скопления G. pistilliger в летний период формировались в основном в диапазонах глубин 40–60, 60–80 и в меньшей степени 20–40 м. Средняя температура на указанных глубинах составила соответственно 4.8, 2.8 и 9.2°C. В целом температурный диапазон обнаружения нитчатого шлемоносца летом варьировал от отрицательных значений (–0.6…–0.1°С), отмеченных в самом конце летнего сезона в северной части Татарского пролива, до +18.7°С. Следует отметить, что, по имеющимся в литературе сведениям, на севере ареала нитчатый шлемоносец в летний период придерживается меньших глубин. Так, на западнокамчатском шельфе летом он предпочитает диапазон глубин 20–40 м, а также глубины <20 м; эпизодически встречается на 40–60 и 60–80 м, термопатия составляет 2–12°С (Токранов, 1981; Баланов, Матвеев, 2018). В восточной части Берингова моря в тёплый период года обитает в прибрежных водах до глубин <50 м (Hoff, 2000).
Рис. 2.
Средние плотности нитчатого шлемоносца Gymnocanthus pistilliger (◼) и температурный режим (ж) в разных диапазонах глубин в российских водах Японского моря по сезонам: а – весна, б – лето, в – осень.
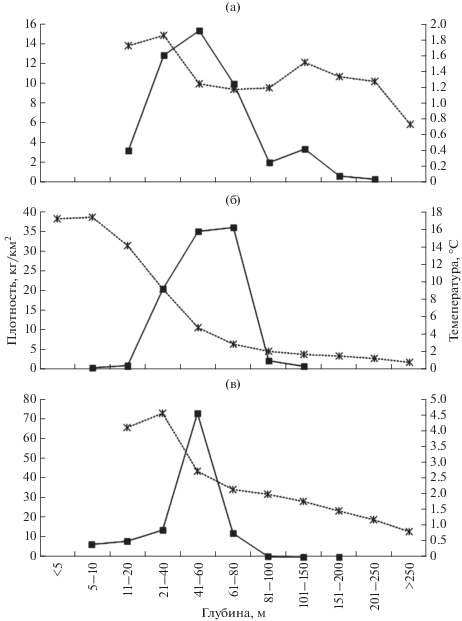
Осенью глубины обитания нитчатого шлемоносца в исследуемой северо-западной части Японского моря расширились за счёт глубоководья, составив 6–200 м (рис. 2в). Однако основные скопления были сосредоточены в верхней части шельфа, что можно объяснить начинающимся здесь, видимо, с декабря, нерестом. В лидерах остались те же три диапазона, что и в летний период, однако если на 40–60 м плотность рыб двукратно возросла, то на 60–80 и 20–40 м столь же заметно понизилась. Описанные изменения происходили на фоне снижения температуры воды, значимость которой возрастала с уменьшением глубины. Осенью G. pistilliger встречался в диапазоне температуры 0.1–7.2°C. Вероятно, за счёт снижения температуры воды до более комфортных для вида значений произошло некоторое повышение плотности рыб в мелководной зоне – на глубинах 5–10 и 10–20 м.
В весенний сезон нитчатый шлемоносец встречался на глубинах 15–217 м; как и осенью, основная масса рыб отмечалась на глубинах 20–80 м с пиковыми значениями в диапазоне 40–60 м (рис. 2а), однако лидерство последнего проявлялось в меньшей степени. Стоит отметить некоторое повышение плотности рыб на глубинах 100–150 м по сравнению со смежными диапазонами, обусловленное, видимо, нахождением здесь особей, ещё не совершивших отход с мест зимовки. Средняя температура на глубинах обитания нитчатого шлемоносца варьировала незначительно – от 1.2 до 1.8°C, однако в целом температурный диапазон его встречаемости был значительно шире: от –1.4°С в относительно мелководной зоне в начале весеннего периода до +7.6°C здесь же в его конце.
Исходя из распределения G. pistilliger в осенний и весенний сезоны, а также из имеющихся литературных сведений, можно сделать предположения о его батиметрических предпочтениях во время зимовки. По данным литературы (Новиков и др., 2002; Соломатов и др., 2008), в водах Приморья на зимовку нитчатый шлемоносец отходит за 100-метровую изобату до глубин 200–300 м. Следовательно, можно предположить, что максимальные глубины обитания, отмеченные нами в период осенних миграций к местам зимовки (200 м) и в период весенних перемещений к местам нагула (217 м) близки таковым в зимний период. Хотя Ким Сен Ток (2001), а вслед за ним и Соколовский с соавторами (2007) считают, что в зимний период у Юго-Западного Сахалина G. pistilliger проникает по материковому склону до глубины 442 м, нам это представляется сомнительным. Мы также располагаем сведениями о присутствии его в нескольких тралениях, поднятых с глубины свыше 217 м, однако при критическом анализе глубин обитания рыб в российской зоне Японского моря (Панченко и др., 2016) было выявлено, что всем им предшествовали ловы на меньших глубинах, где представители вида объективно присутствовали. Так как некоторые особи могли застрять в трале и проявиться только в следующем улове, такие данные были исключены из анализа.
Литературные сведения по зимовальному периоду мы можем дополнить имеющимися у нас в ограниченном количестве достоверными данными. В начале зимовального периода (в I декаде января) в зал. Петра Великого было проведено пять тралений на глубинах 55–70 м; при четырёх ловах температура имела отрицательные значения (–0.3…–0.7°С) и лишь при одном, самом глубоководном, – слабоположительное (0.1°С). Во всех тралениях отмечались особи нитчатого шлемоносца, при этом наибольшая его плотность (65 кг/км2) была приурочена к положительному температурному фону, однако лишь немногим меньшая удельная биомасса (48 кг/км2) зарегистрирована при наиболее низкой температуре. Нахождение зимой G. pistilliger на указанных глубинах может быть обусловлено проходящим в холодный период нерестом или же перемещением после него на зимовку в сторону внешней границы шельфа, в воды со стабильной слабоположительной температурой. Возможно, однако, что часть рыб зимуют и при отрицательной температуре воды в средней и верхней частях шельфа.
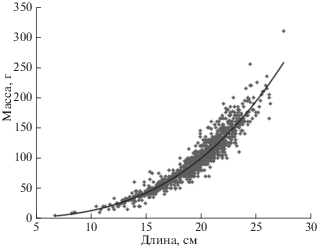
По нашим данным, в Японском море, в южной части ареала, G. pistilliger достигает бóльших размеров, чем в северной: в уловах встречались особи длиной до 33 см, преобладали рыбы TL 17–23 см. Тогда как в водах Камчатки не отмечается особей TL > 27 см (Токранов, 1987), а в восточной части Берингова моря – 20.1 см (Hoff, 2000). Индивидуальное взвешивание в Японском море было проведено среди особей G. pistilliger TL 7.0–27.5 см и массой 5–310 г в основном в тёплый период года. К сожалению, особи большего размера в выборку не попали из-за крайне малой встречаемости в уловах рыб крупного размера (Панченко, 2013). Связь между длиной (TL, см) и массой (W, г) нитчатого шлемоносца в исследуемом районе описывается степенной зависимостью W = 0.0113TL3.027 (R2 = 0.9406) (рис. 3), согласно которой масса рыб предельного размера (33 см) составляет ~450 г.
Рис. 3.
Зависимость между длиной (TL) и массой нитчатого шлемоносца Gymnocanthus pistilliger в российских водах Японского моря.
У представителей семейства Cottidae наблюдаются различия в батиметрическом распределении особей разного размера. В тёплое время года молодь предпочитает прогретое мелководье, а взрослые рыбы – большие глубины (Панченко, Зуенко, 2009). В определённой степени это характерно и для нитчатого шлемоносца. Судя по размерному составу, летом на глубины >80 м заходили только его взрослые особи (рис. 4), так как в исследуемом районе самцы и самки нитчатого шлемоносца достигают половой зрелости в возрасте 2–3 года при длине соответственно 11.6–16.3 и 13.1–17.5 см (Панченко, 2012). Средние размеры в летний период с глубиной увеличивались, хотя наиболее крупные особи предпочитали нагуливаться на глубинах образования скоплений – 40–60 м – и в прилегающих диапазонах. Сеголетки (минимальная TL 3.5 см) придерживались мелководной зоны.
Рис. 4.
Размерный состав нитчатого шлемоносца Gymnocanthus pistilliger в уловах донного трала разных диапазонах глубин в российских водах Японского моря по сезонам: а – весна, б – лето, в – осень; (-) – среднее значение, (│) – пределы варьирования показателя.
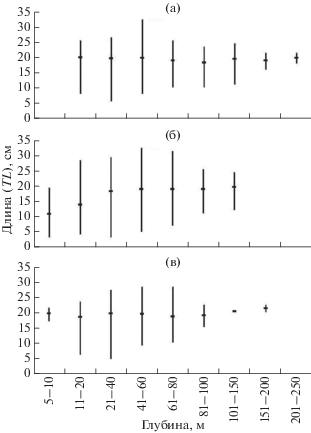
Осенью молодь покинула интенсивно охлаждаемое мелководье. До 17-метровой изобаты размер пойманных рыб составлял не менее 17 см, глубже начали отмечаться мелкие особи, в том числе подросшие сеголетки длиной от 5 см (рис. 4в). За исключением изменения размерного состава нитчатого шлемоносца в сублиторальной зоне и проникновения взрослых рыб в осенний период к нижней границе шельфа размерный состав в остальных батиметрических диапазонах летом и осенью значительно не различался.
При пяти описанных выше январских ловах на глубинах 55–70 м минимальный размер G. pistilliger составил 11 см. Самые мелкие особи были встречены при слабоположительной температуре воды в самом глубоководном из тралений. В остальных ловах, проведённых при отрицательном температурном фоне, минимальный размер рыб варьировал от 14 до 24 см, т.е. соответствовал в основном взрослым особям.
Весной годовики TL ≥ 6 см встречались на глубине 15–43 м (рис. 4а) при температуре –0.6…+5.3°С. Наиболее крупные особи отмечались в диапазоне 40–60 м, в котором наблюдалась максимальная концентрация рыб. Минимальные размеры с глубиной повышались, за исключением мелководной зоны.
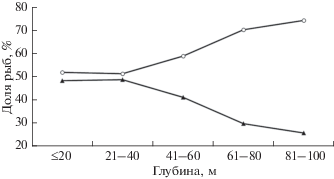
У всех обитающих в водах Приморья бычков рода Gymnocanthus, в том числе и у нитчатого шлемоносца, соотношение полов с ростом меняется, однако в целом в популяции преобладают самки (Панченко, 2012). Обусловлено это половым диморфизмом, одним из проявлений которого является достижение самцами меньших размеров и меньшей продолжительности жизни. В связи с этим среди взрослых рыб с увеличением размеров доля самок неуклонно возрастает. Мы проследили изменения в соотношении полов в летний период в зал. Петра Великого (где была выполнена основная масса промеров с дифференцировкой по половому составу) в соответствии с глубинами обитания. В относительно глубоководной зоне доля самок почти в три раза превысила долю самцов, с уменьшением же глубины разница постепенно уменьшалась, и на глубинах <40 м различия оказались минимальными (рис. 5). Конечно же, тенденцию повышения доли самок с возрастанием глубины частично можно связать с возрастанием с глубиной размеров рыб в летний период. Однако, хотя в выполненных нами с определением пола промерах длина самцов естественно была меньшей (до 26 см), в массе размеры рыб в каждом из диапазонов варьировали в пределах, достигаемых особями обоего пола. Ранее уже обращали внимание на тенденцию к повышению в летний период доли самок с возрастанием глубины у другого представителя рода – широколобого шлемоносца G. detrisus, у которого эта тенденция выражена даже в большей степени – вплоть до полного отсутствия самцов в глубоководной зоне (Панченко, 2009).
ВЫВОДЫ
1. Нитчатый шлемоносец обитает во всех районах акватории российских вод Японского моря, однако распределение на разных участках существенно различается. Наибольшие концентрации наблюдаются на широком шельфе юга района – в зал. Петра Великого. Подобная шельфовая зона на севере, в Татарском проливе, используется в гораздо меньшей степени, в особенности с материковой стороны, что связано со спецификой гидрологического режима.
2. G. pistilliger встречается на глубине 5–217 м при температуре придонного слоя воды –1.4…+18.7°С. Наименьший его батиметрический диапазон (5–135 м) характерен для летнего сезона, но как летом, так и весной и осенью он концентрируется на сходных глубинах: в основном в верхней и средней части шельфа. Весной это связано с миграциями в прогреваемую шельфовую зону к местам летнего нагула, летом – образованием нагульных скоплений, осенью – подходом на нерестилища, располагающиеся в верхней части шельфа.
3. В летний период молодь придерживается мелководной зоны, прогреваемой наиболее интенсивно, которую взрослые рыбы избегают. С началом осеннего охлаждения мелкие рыбы смещаются глубже, а на мелководье проникают производители. Максимальные глубины обитания во все сезоны характерны только для взрослых рыб.
4. В водах Японского моря нитчатый шлемоносец достигает TL 33 см, что значительно больше, чем на севере ареала. В летний период соотношение самцов и самок нитчатого шлемоносца на относительно небольших глубинах близко к равному, глубже доля самок постепенно возрастает. В целом в популяции преобладают самки, достигающие бóльших размеров и имеющие бóльшую продолжительность жизни, чем самцы.
Список литературы
Баланов А.А., Матвеев А.А. 2018. Диагностика Gymnocanthus pistilliger Pallas, 1814 и G. galeatus Bean, 1881 (Scorpaeniformes: Cottidae) в районах их совместного обитания // Биология моря. Т. 44. № 5. С. 365–368.
Борец Л.А. 2000. Аннотированный список рыб дальневосточных морей. Владивосток: Изд-во ТИНРО-центра, 192 с.
Вдовин А.Н., Зуенко Ю.И. 1997. Вертикальная зональность и экологические группировки рыб залива Петра Великого // Изв. ТИНРО. Т. 122. С. 152–176.
Вдовин А.Н., Швыдкий Г.В., Афанасьева Н.И. и др. 1994. Пространственно-временная изменчивость распределения нитчатого шлемоносца в заливе Петра Великого // Экология. № 4. С. 53–59.
Вдовин А.Н., Мизюркин М.А., Пак А. 2009. Возможности использования бим-трала для прямых учетов гидробионтов // Вопр. рыболовства. Т. 10. № 1(37). С. 150–160.
Зуенко Ю.И. 1994. Типы термической стратификации вод на шельфе Приморья // Комплексные исследования морских гидробионтов и условий их обитания. Владивосток: Изд-во ТИНРО. С. 20–39.
Зуенко Ю.И. 2008. Промысловая океанография Японского моря. Владивосток: Изд-во ТИНРО-центра, 227 с.
Калчугин П.В. 1998. Распределение рогатковых (Cottidae) у северного Приморья // Изв. ТИНРО. Т. 123. С. 82–88.
Ким Сен Ток. 2001. Зимние миграции шельфовых рыб в зону материкового склона юго-западного Сахалина // Вопр. ихтиологии. Т. 41. № 5. С. 593–604.
Ким Сен Ток. 2004. Сезонные особенности вертикальной структуры ихтиоценов западносахалинского шельфа и островного склона // Там же. Т. 44. № 1. С. 77–88.
Линдберг Г.У., Красюкова З.В. 1987. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 5. Л.: Наука, 526 с.
Неелов А.В. 1979. Сейсмосенсорная система и классификация керчаковых рыб. Л.: Наука, 208 с.
Николотова Л.А. 1977. Питание и пищевые взаимоотношения донных рыб западнокамчатского шельфа: Автореф. дис. … канд. биол. наук. Владивосток: ДВНЦ АН СССР, 21 с.
Новиков Н.П., Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2002. Рыбы Приморья. Владивосток: Изд-во Дальрыбвтуз, 552 с.
Панченко В.В. 2009. Распределение широколобого шлемоносца Gymnocanthus detrisus (Cottidae) в водах Приморья (Японское море) в летний период // Биология моря. Т. 35. № 1. С. 3–8.
Панченко В.В. 2012. Возраст и рост шлемоносных бычков рода Gymnocanthus (Cottidae) в заливе Петра Великого и прилегающих районах Приморья // Вопр. ихтиологии. Т. 52. № 2. С. 234–247.
Панченко В.В. 2013. Размерно-возрастной состав и динамика численности нитчатого шлемоносца Gymnocanthus pistilliger (Cottidae) в заливе Петра Великого (Японское море) // Вопр. рыболовства. Т. 14. № 2 (54). С. 208–218.
Панченко В.В., Зуенко Ю.И. 2009. Распределение бычков семейства Cottidae в заливе Петра Великого Японского моря в летний период // Там же. Т. 10. № 4 (40). С. 750–763.
Панченко В.В., Пущина О.И. 2018. Распределение и некоторые черты биологии пёстрого получешуйника Hemilepidotus gilberti (Cottidae) в российских водах Японского моря // Вопр. ихтиологии. Т. 58. № 4. С. 439–449. https://doi.org/10.1134/S0042875218040148
Панченко В.В., Пущина О.И. 2019. Распределение и некоторые черты биологии двурогого бычка Enophrys diceraus (Cottidae) в российских водах Японского моря // Там же. Т. 59. № 2. С. 163–173. https://doi.org/10.1134/S0042875219020176
Панченко В.В., Калчугин П.В., Соломатов С.Ф. 2016. Уточнение глубин обитания и максимальных размеров донных и придонных видов рыб в российских водах Японского моря // Там же. Т. 56. № 3. С. 264–283. https://doi.org/10.7868/S0042875216030152
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Пущина О.И. 2005. Питание и пищевые взаимоотношения массовых видов донных рыб в водах Приморья в весенний период // Изв. ТИНРО. Т. 142. С. 246–269.
Пущина О.И., Соломатов С.Ф., Калчугин П.В., Будникова Л.Л. 2016. Питание и пищевые отношения массовых видов рогатковых (Cottidae, Pisces) зал. Петра Великого (Японское море) в летний период // Там же. Т. 184. С. 186–203. https://doi.org/10.26428/1606-9919-2016-184-186-203
Сакун О.Ф., Буцкая Н.А. 1968. Определение стадий зрелости и изучение половых циклов рыб. Мурманск: Изд-во ПИНРО, 46 с.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. 2007. Рыбы российских вод Японского моря: аннотированный и иллюстрированный каталог. Владивосток: Дальнаука, 200 с.
Соломатов С.Ф. 2008. Состав и многолетняя динамика донных ихтиоценов северного Приморья: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр, 24 с.
Сон Ён Хо. 1986. О распределении рыб в прибрежных водах Восточного моря // Тр. Вонсан. ин-та рыб. хоз-ва Восточного моря. № 1. С. 132–150.
Токранов А.М. 1981. Распределение керчаковых (Cottidae, Pisces) на западнокамчатском шельфе в летний период // Зоол. журн. Т. 60. Вып. 2. С. 229–237.
Токранов А.М. 1985. Питание рогатковых рода Gymnacanthus Swainson (Cottidae) прикамчатских вод // Вопр. ихтиологии. Т. 25. Вып. 3. С. 433–437.
Токранов А.М. 1987. О размножении рогатковых рыб рода Gymnacanthus (Cottidae) в прибрежных водах Камчатки // Там же. Т. 27. Вып. 6. С. 1026–1030.
Токранов А.М. 1988. Видовой состав и биомасса рогатковых (Pisces: Cottidae) в прибрежных водах Камчатки // Бюл. МОИП. Отд. биол. Т. 93. Вып. 4. С. 61–69.
Токранов А.М. 1993. О половом диморфизме массовых видов рогатковых (Cottidae) прикамчатских вод // Там же. Т. 98. Вып. 6. С. 19–26.
Токранов А.М., Полутов В.И. 1984. Распределение рыб в Кроноцком заливе и факторы, его определяющие // Зоол. журн. Т. 63. Вып. 9. С. 1363–1373.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северо-западной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. 2003. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука, 204 с.
Чучукало В.И. 2006. Питание и пищевые отношения нектона и нектобентоса в дальневосточных морях. Владивосток: Изд-во ТИНРО-центр, 484 с.
Шейко Б.А., Федоров В.В. 2000. Глава 1. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных Камчатки и сопредельных морских акваторий / Под ред. Моисеева Р.С., Токранова А.М. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Шелехов В.А., Панченко В.В. 2007. Возраст и рост нитчатого шлемоносца Gymnocanthus pistilliger (Cottidae) в водах южного Приморья (Японское море) // Вопр. ихтиологии. Т. 47. № 2. С. 228–237.
Яричин В.Г. 1980. Состояние изученности циркуляции вод Японского моря // Тр. ДВНИГМИ. Вып. 80. С. 46–61.
Яричин В.Г., Покудов В.В. 1982. Формирование структурных особенностей гидрофизических полей и течений в северной глубоководной части Японского моря // Там же. Вып. 96. С. 86–95.
Amaoka K., Nakaya K., Yabe M. 1995. The fishes of Northern Japan. Sapporo: Kita-Nihon Kaiyo Center Co. Ltd, 391 p.
Chyung M.K., Kim K.H. 1959. Thirteen unrecorded species of fish from Korean waters // Kor. J. Zool. V. 2. № 1. P. 2–10.
Fricke R., Eschmeyer W.N., Van der Laan R. (eds.). 2019. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive. calacademy.org/research/ Ichthyology/ catalog/fishcatmain.asp. Version 02/2019)
Froese R., Pauly D. (eds.). 2019. Fishbase. World Wide Web electronic publication. (www.fishbase.org. Version 02/2019)
Hoff G.R. 2000. Biology and ecology of threaded sculpin, Gymnocanthus pistilliger, in the eastern Bering Sea // Fish. Bull. V. 98. № 4. P. 711–722.
Kim I.-S., Yoon C.-H. 1992. Synopsis of the family Cottidae (Pisces: Scorpaeniformes) from Korea // Kor. J. Ichthyol. V. 4. № 1. P. 54–79.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. 2002. Fishes of Alaska. Bethesda, Maryland: Amer. Fish. Soc., 1037 p.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии