Вопросы ихтиологии, 2020, T. 60, № 2, стр. 127-133
Новый вид мурен рода Strophidon (Muraenidae) из Вьетнама
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН – ИПЭЭ РАН
Москва, Россия
2 Институт океанологии им. П.П. Ширшова РАН – ИО РАН
Москва, Россия
* E-mail: prokartster@gmail.com
Поступила в редакцию 27.08.2019
После доработки 11.10.2019
Принята к публикации 18.10.2019
Аннотация
Описан новый вид Strophidon dawydoffi sp. n. из залива Нячанг (Южно-Китайское море, Вьетнам). От совместно встречающегося вида S. sathete новый вид хорошо отличается более тонким и удлинённым телом, лопастевидно расширенным на конце хвостом, внешним отсутствием вертикальных плавников, гораздо меньшим числом преанальных позвонков, удлинёнными телами позвонков в средней части хвостового отдела позвоночного столба, строением невральных дуг и парапофизов, пёстрой окраской тела и ротовой полости, бóльшим числом зубов во внутренних рядах на maxillare и dentale и двумя–тремя рядами папилл на губах. Различия в числе инфраорбитальных пор и в форме рыла между экземплярами S. sathete связываются с индивидуальной изменчивостью.
Мурены рода Strophidon McClelland, 1844 характеризуются сильно удлинённым телом, хвостовая часть которого, по меньшей мере, вдвое превышает суммарную длину головы и туловища; глазами, расположенными ближе к вершине рыла, чем к концу ротовой щели, и двурядными челюстными зубами (Böhlke, 1995). По современным представлениям (Smith, 2012) этот род является монотипическим. Однако в ходе траловой съемки в заливе Нячанг (Южно-Китайское море, Вьетнам) в 2007 г. мною был добыт экземпляр мурены, хотя и удовлетворяющий приведенному выше диагнозу, но резко отличающийся по многим признакам от ранее известного вида S. sathete (Hamilton, 1822), весьма обычного в заливе Нячанг. В настоящем сообщении этот экземпляр описывается в качестве голотипа нового вида. Неудача в попытках собрать дополнительный материал по данному виду, возможно, объясняется тем, что его, вероятно, роющий образ жизни делает этот вид труднодоступным для имеющихся орудий лова, несмотря на то что рыба обитает на мягких грунтах и малых глубинах.
МАТЕРИАЛ И МЕТОДИКА
Методика изучения и терминология соответствуют общепринятым (Böhlke, 1989). Строение позвонков изучалось по рентгенограммам. Голотип нового вида хранится в коллекции Института океанологии РАН, Москва (ИО РАН). Координаты точки вылова даются так, как они указаны на этикетке. Для сравнения использовано 20 экз. S. sathete из той же коллекции (TL 280–1070 мм), собранных автором в заливах Нячанг и Ванфонг (Вьетнам) в 2005–2009 гг. В тексте использованы следующие сокращения признаков: TL – полная длина, VF – позвонковая формула (число предорсальных – преанальных – полное число позвонков). Отличающиеся значения одних и тех же счётных признаков на разных сторонах тела одной рыбы разделены знаком “/”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
(рис. 1–3)
Рис. 1.
Strophidon dawydoffi sp. n., голотип ИО РАН № 3598, TL 650 мм, общий вид, (►) – положение ануса.

Рис. 2.
Strophidon dawydoffi sp. n., голотип: а – голова, б – губные папиллы, в – хвостовой конец тела. N1, N2 – передняя и задняя ноздри; io2, io3 – вторая и третья инфраорбитальные поры. Масштаб: а – 1, б – 0.5 , в – 5 мм.
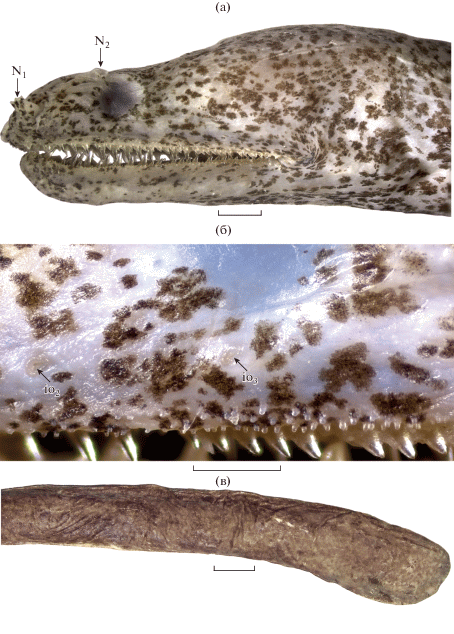
Рис. 3.
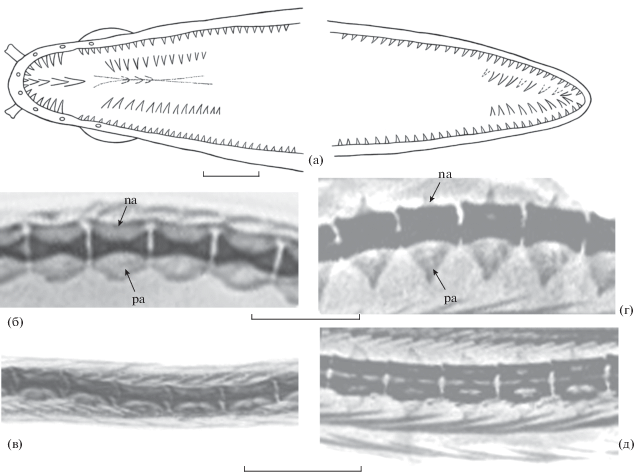
Strophidon dawydoffi sp. n., голотип (а–в) и S. sathete TL 720 мм, Вьетнам (зал. Нячанг) (г, д): а – схема озубления; б, г – 25-й–29-й позвонки; в – 100-й–104-й позвонки; д – 102-й–105-й позвонки; na – невральная дуга, pa – парапофиз. Масштаб: а – 1, б–д – 6 мм (линейка общая для б и г и для в и д).
Материал. Голотип ИО РАН № 3598, зрелая самка TL 650 мм (рис. 1), Вьетнам, зал. Нячанг, 12°10′060–12°12′480 с.ш., 109°16′126–109°13′879 в.д., глубина 15.8–19.2 м, трал № 2, 10.05.2007 г., время лова 09.42–11.22, сборщик А.М. Прокофьев.
Диагноз. Вид рода Strophidon с пёстрой окраской тела и ротовой полости, 12–14 и 9 зубами во внутренних рядах на maxillare и dentale, низким телом (около 81.3 раза в TL), лопастевидно расширенным концом хвоста, внешне не различимыми плавниками, короткими широко закруглёнными парапофизами, удлинёнными телами позвонков в средней части хвостового отдела, VF 9–59–178.
Описание. Тело очень длинное, тонкое, цилиндрическое, его высота на уровне ануса 81.25 раза содержится в TL, у хвостового конца более сжатое с боков и несколько более высокое (высота хвостовой лопасти в 1.25 раза больше высоты тела на уровне ануса) (рис. 1). Рыло в профиль тупо закруглённое; верхняя челюсть длиннее нижней; дорсальный контур головы резко повышается на участке между вертикалями заднего края глаза и заднего конца ротовой щели; глаз мал (2.5 раза в длине рыла), расположен гораздо ближе к вершине рыла, чем к заднему концу ротовой щели (расстояние от заднего края глаза до конца ротовой щели в 2.4 раза больше длины рыла); ширина межглазничного промежутка в 1.4 раза больше длины рыла; длина неврокрания в 2.6 раза меньше длины головы. Передняя ноздря открывается длинной трубочкой (в 1.5 раза короче горизонтального диаметра глаза) на вершине рыла, задняя – округлым отверстием с отчётливо приподнятыми краями над передней третью глаза (рис. 2а). Супраорбитальных пор три, первая расположена над верхней губой, вторая – у основания трубочки передней ноздри, третья – позади передней ноздри, вдвое ближе к ней, чем к переднему краю глаза. Инфраорбитальных пор три, они расположены за основанием трубочки передней ноздри, между ней и передним краем глаза и под передней половиной глаза. Нижнечелюстных пор шесть, передние четыре сближены, пятая расположена впереди вертикали заднего конца ротовой щели. Бранхиальных пор две, расположены они вдвое ближе к жаберному отверстию, чем к концу рта; расстояние между порами вдвое меньше промежутка между задней бранхиальной порой и задним краем жаберного отверстия. Отверстия сейсмосенсорных пор мелкие. Край верхней губы перед и под глазом несёт три ряда мелких бугорковидных папилл (рис. 2б), далее назад переходящих в два ряда; край нижней губы с двумя рядами таких папилл на всем протяжении. Жаберные отверстия овальные, вытянуты продольно, их длина лишь в 1.1 раза меньше длины рыла. Начало спинного плавника расположено над жаберным отверстием. Анус расположен у начала анального плавника, в 2.5 раза ближе к вершине рыла, чем к концу хвоста; преанальная длина 3.5 раза укладывается в TL. Плавниковые лучи полностью сокрыты в коже, плавниковая складка слабо развита лишь близ хвостового конца тела; спинной плавник на большем протяжении у фиксированного экземпляра снаружи неразличим, а анальный угадывается лишь в виде слабо выраженного килеватого утолщения по срединно-брюшной линии тела. Хвостовой конец тела высокий, широко и несколько асимметрично закругленный (рис. 2в). Яичники голотипа содержат зрелые икринки до 1 мм в диаметре.
Озубление (рис. 3а). Наружные интермаксиллярные зубы мелкие, наиболее задние из них несколько крупнее присимфизных, их общее число 14. Срединных интермаксиллярных зубов четыре, их длина прогрессивно увеличивается от первого к последнему. Максиллярные и нижнечелюстные зубы в два чётко разделённых ряда, зубы внутреннего ряда заметно крупнее наружных. Наружных максиллярных зубов 28/33, внутренних – 12/14. В наружном ряду на нижней челюсти с каждой стороны по 30 зубов, во внутреннем – по 9 (с левой стороны часть зубов утрачена). Все зубы с узкими островершинными коронками с гладкими краями. Сошник с тремя зубами, имеющими более широкие коронки, чем челюстные зубы, и полностью сокрытыми в складке ткани мягкого неба.
Некоторые измерения, в % TL: длина головы 6.08, длина неврокрания 2.31, длина рыла 0.39, горизонтальный диаметр глаза 0.15, ширина межглазничного промежутка 0.54, длина ротовой щели 1.65, расстояние от заднего края глаза до конца ротовой щели 0.92, длина жаберного отверстия 0.35, преанальная длина 28.46, постанальная длина 71.54, высота тела на уровне ануса 1.23, высота хвостового конца тела 1.54. В % длины головы: длина неврокрания 38.0, длина рыла 6.3, горизонтальный диаметр глаза 2.5, ширина межглазничного промежутка 8.9, длина ротовой щели 27.2, расстояние от заднего края глаза до конца ротовой щели 15.2, длина жаберного отверстия 5.8, высота тела на уровне ануса 20.3.
Окраска. Основной фон светлый, почти белый, густо испещрён мелкими, неправильной формы, частично сливающимися коричневыми пятнышками, в передней половине тела не скрывающими основной фон, а в задней – сливающимися в почти однотонную коричневую окраску (светлый основной фон вновь прослеживается на отдельных участках лишь на расширенном хвостовом конце). На голове и вентральной поверхности туловища пятнышки расположены реже, чем на дорсальной и латеральной поверхности. Кожа вокруг ануса затемнена. Ротовая полость белая с тёмными пестринами, такими же, как на коже головы. Брюшина светлая. Прижизненная окраска не имела отличий от описанной выше окраски фиксированного экземпляра.
Рентгенограмма. VF 9–59–178. Парапофизы развиты с третьего по 75-й позвонки (на самых передних и самых задних из них малы); наиболее развитые парапофизы короткие и широкие, дистально широко закруглённые (рис. 3б), в 1.5 раза меньше суммарной высоты тела и невральной дуги соответствующего позвонка. Невральные дуги низкие, протяжённые, одинаковой длины с телами позвонков. Тела позвонков средней части хвостового отдела сильно удлинённые (рис. 3в). Межмышечные косточки тонкие.
Этимология. Вид назван в память о русском зоологе Константине Николаевиче Давыдове (1877–1960), в 1929–1934 гг. работавшем в Институте океанографии в Нячанге и внёсшем огромный вклад в познание различных групп морских беспозвоночных.
Сравнительные замечания. Многими авторами (Böhlke, 1995; Прокофьев, 2010; Smith, 2012) род Strophidon считается монотипическим, однако японские исследователи (Masuda et al., 1985; Hatooka, 2002) склонны выделять в нём два вида, которые, к тому же, приводятся ими под разными родовыми названиями11: Evenchelys macrura и Strophidon ui. Хатоока (Hatooka, 2002) различает эти виды по форме рыла (более высокое у E. macrura и заострённое у S. ui) и числу инфраорбитальных пор (соответственно четыре и три; у S. ui отсутствует пора под задней половиной глаза). В изученном мною материале из вод Вьетнама встречаются как экземпляры с тремя, так и с четырьмя инфраорбитальными порами, причём первые преобладают, среди них отмечены рыбы как с высоким, тупо обрубленным, так и с приострённым рылом. В связи с этим я склонен считать, что разница в числе инфраорбитальных пор отражает лишь индивидуальную изменчивость и не коррелирует со слабыми и, по-видимому, в определённой мере субъективными различиями в форме рыла, поэтому выделение двух видов на основании признаков, описанных Хатоокой (Hatooka, 2002), не оправданно. Вместе с тем единственный признаваемый вид S. sathete характеризуется очень широким ареалом в Индо-Вест-Пацифике (от Южной Африки до Японии) (Castle, McCosker, 1986; Böhlke, McCosker, 2001; Loh et al. 2015), и его популяции из разных районов никогда подробно не сравнивались между собой. По литературным данным, отмечается некоторая географическая изменчивость в числе позвонков: для южноафриканских рыб указывается их около 210 (Castle, McCosker, 1986), для рыб из вод Малайзии – 188–200 (в среднем 194) (Loh et al., 2015), а для японских – только 183–196 (Hatooka, 2002). Описано пять номинальных видов (в скобках указаны их типовые местонахождения), ныне сводимых в синонимию S. sathete (Böhlke, 1995; Smith, 2012): Muraenophis sathete Hamilton, 1822 (Индия), Lycodontis longicaudata McClelland, 1844 (Индия), Muraena macrurus Bleeker, 1854 (Макассар, Индонезия), Thyrsoidea longissima Kaup, 1856 (Индия) и Strophidon ui Tanaka, 1918 (Япония). Первоописания этих видов недостаточно информативны (Hamilton, 1822; McClelland, 1844; Bleeker, 1854; Kaup, 1856; Tanaka, 1918), а типы сохранились только для двух из них (M. macrurus и T. longissima) (Smith, 2012). Тем не менее все перечисленные номинальные виды характеризуются однотонно-тёмной окраской, хорошо развитыми плавниковыми складками по всей длине спинного и анального плавников и сужающимся к концу хвостом, и на этом основании ни одно из ранее опубликованных названий не может быть применено к описываемому мною виду. Нижеследующее сравнение основано на непосредственном изучении экземпляров S. sathete из вод Вьетнама с привлечением литературных данных по изменчивости отдельных признаков у этого вида.
Внешние отличия S. dawydoffi от S. sathete заключаются в следующем. Тело у нового вида гораздо более тонкое и удлинённое, его высота у ануса содержится в TL около 81.3 раза против 38–50 у S. sathete (Böhlke, 1995; Loh et al., 2015; собственные данные). Хвост S. sathete не расширяется к концу в лопасть, как у нового вида, а имеет типичное для угреобразных рыб строение. Спинной, анальный и хвостовой плавники у S. sathete хорошо выражены, их лучи чётко видны сквозь кожу, плавниковая складка хорошо отграничена от тела, тогда как у нового вида наблюдается кажущееся отсутствие спинного и анального плавников, лучи которых полностью скрыты в коже и не определяются без её подрезки; плавниковая складка едва намечена только в терминальном расширенном участке хвостового отдела. При этом конец хвоста также заключён в толстую кожу, и лучи хвостового плавника снаружи не видны (рис. 2в). Окраска у S. sathete, как правило, монотонно-коричневая (от светлой до очень тёмной, впрочем, нередко светлеющая к брюху, а у некоторых рыб вдоль срединной линии боков проходит слабо выраженная черноватая полоса), но плавники всегда более тёмные, чем тело, черноватые. У S. dawydoffi окраска тела пёстрая, хотя в задней половине тела пестрины сливаются практически в сплошной фон, и плавники никак не обозначены отличиями в окраске. Ротовая полость у S. sathete светлая, тогда как у нового вида она покрыта столь же густыми тёмными пестринами, как и кожа головы снаружи. У нового вида гораздо больше зубов во внутренних рядах на maxillare и dentale: соответственно 12–14 и 9 против 5–10 (обычно 7 или 8) и 3–5 у S. sathete (собственные данные; Ло с соавторами (Loh et al., 2015) указывают для экземпляров из вод Малайзии (Сабах) и Тайваня соответственно 4–9 и 3–4 зубов). Нужно ещё отметить, что зубы на сошнике у нового вида одинаковой величины и целиком сокрыты в продольной складке мягкого нёба (разноразмерные, полностью выступают у S. sathete). По сравнению с изученными мною экземплярами S. sathete из вод Вьетнама у голотипа нового вида их число несколько меньше (три против пяти–восьми), однако Ло с соавторами (Loh et al., 2015) приводят для экземпляров S. sathete из вод Малайзии (Сабах) и Тайваня от трёх до восьми сошниковых зубов. Дополнительным отличием нового вида от S. sathete являются гораздо лучше выраженные папиллы на губах, расположенные в несколько рядов (у S. sathete губы гладкие или несут по краю один ряд очень мелких папилл).
Весьма существенные различия между S. dawydoffi и S. sathete наблюдаются в строении позвонков (рис. 3б–3д). Невральные дуги у нового вида пластинчатые, одинаковой длины с телами позвонков, тогда как у S. sathete – торчащие, треугольные (рис. 3б, 3г). Парапофизы у нового вида развиты гораздо слабее, чем у S. sathete, их дистальный край широко закруглён (у S. sathete парапофизы треугольной формы, их высота равна или несколько превышает суммарную высоту тел и невральных дуг несущих их позвонков) (рис. 3б, 3г). Кроме того, парапофизы предорсальных позвонков у нового вида малы и слабо заметны на рентгенограмме, тогда как у S. sathete они столь же развиты, как и последующие. Тела позвонков в средней части хвостового отдела у нового вида заметно удлинены (рис. 3в), тогда как у S. sathete они не отличаются по форме от других позвонков (рис. 3д). За счёт этого (а также за счёт меньшей высоты) хвостовой отдел и тело в целом у нового вида выглядят более удлинёнными, чем у S. sathete, хотя общее число позвонков у него меньше известного предела изменчивости у S. sathete (178 против 183–210). Число преанальных позвонков у нового вида существенно меньше, чем у S. sathete (59 против 76–83), и в целом суммарная длина головы и туловища меньше, чем у сравниваемого вида (3.5 раза в TL против 2.4–3.3 (как правило, менее 3.0) раза у S. sathete).
В целом отличия между двумя видами Strophidon представляются мне не меньшими, чем между этим родом и другими внешне сходными длиннотелыми муренами (Pseudechidna brummeri (Bleeker, 1858), виды Gymnothorax из группы “prolatus” sensu Smith et al. (2018)), так что нельзя исключать возможности выделения S. dawydoffi в особый род. Однако индопацифические Muraenidae по сей день остаются анатомически весьма слабо изученными, а границы между их родами – недостаточно чётко охарактеризованными, поэтому до проведения более детального исследования я предпочитаю следовать наиболее консервативной точке зрения и рассматривать описываемый здесь новый вид в одном роде с S. sathete, к которому он представляется наиболее близким.
Список литературы
Прокофьев А.М. 2010. Дополнения к видовому составу мурен залива Нячанг (Южно-Китайское море, центральный Вьетнам) (Anguilliformes: Muraenidae) // Вопр. иxтиoлoгии. T. 50. № 1. C. 42–47.
Bleeker P. 1854. Ichthyologische waarnemingen, gedaan op verschillende reizen in de residentie Banten // Natuurkd. Tijdschr. Neder. Indië. V. 7. P. 309–326.
Böhlke E.B. 1989. Methods and terminology // Fishes of the western North Atlantic. Sears Found. Mar. Res. Mem. 1. Pt. 9. V. 1. Anguilliformes and Saccopharyngiformes / Ed. Böhlke E.B. New Haven: Sears Found. P. 1–7.
Böhlke E.B. 1995. Notes on the muraenid genera Strophidon, Lycodontis, Siderea, Thyrsoidea, and Pseudechidna, with a redescription of Muraena thyrsoidea Richardson, 1845 // Proc. Acad. Nat. Sci. Phila. V. 146. P. 459–466.
Böhlke E.B., McCosker J.E. 2001. The moray eels of Australia and New Zealand, with the description of two new species (Anguilliformes: Muraenidae) // Rec. Aust. Mus. V. 53. № 1. P. 71–102.
Castle P.H.J., McCosker J.E. 1986. Family No. 41: Muraenidae // Smith’s Sea Fishes / Eds. Smith M.M., Heemstra P.C. Johannesburg: Macmillan S. Africa. P. 165–176.
Hamilton F. 1822. An account of the fishes found in the river Ganges and its branches. Edinburgh: Constable, i–vii + 405 p.
Hatooka K. 2002. 59. Muraenidae moray eels // Fishes of Japan with pictorial keys to the species. V. 1 / Ed. Nakabo T. Tokyo: Tokai Univ. Press. P. 196–211.
Kaup J.J. 1856. Catalogue of the apodal fish in the collection of the British Museum. London: British Museum, 163 p.
Loh K.-H., Chong V.C., Hussein M.A.S., Sasekumar A. 2015. Notes on the moray eels (Anguilliformes: Muraenidae) of Malaysia with two new records // Sains Malaysiana. V. 44. № 1. P. 41–47.
Masuda H., Amaoka K., Araga C. et al. 1985. The fishes of the Japanese Archipelago. V. 1. Tokyo: Tokai Univ. Press, i–xxii + 437 p.
McClelland J. 1844. Apodal fishes of Bengal // J. Nat. Hist. Calcutta. V. 5. № 18. P. 151–226.
Smith D.G. 2012. A checklist of the moray eels of the world (Teleostei: Anguilliformes: Muraenidae) // Zootaxa. V. 3474. № 1. P. 1–64.
Smith D.G., Hibino Y., Ho H.-C. 2018. Two new elongate unpatterned moray eels from Taiwan and Vietnam, with notes on two congeners (Anguilliformes: Muraenidae) // Ibid. V. 4454. № 1. P. 33–42.
Tanaka S. 1918. Two new species of Japanese fishes // Zool. Mag. Tokyo. V. 30. № 352. P. 51–52.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


