Вопросы ихтиологии, 2020, T. 60, № 2, стр. 219-228
Влияние температуры на двигательную активность и плавательную способность молоди плотвы Rutilus rutilus (Cyprinidae)
А. К. Смирнов 1, *, Е. С. Смирнова 1
1 Институт биологии внутренних вод РАН – ИБВВ РАН
Ярославская область, Борок, Россия
* E-mail: smirnov@ibiw.yaroslavl.ru
Поступила в редакцию 05.03.2019
После доработки 29.04.2019
Принята к публикации 30.05.2019
Аннотация
Представлены результаты изучения двигательной активности и плавательной способности молоди плотвы Rutilus rutilus при значениях температуры (7, 16, 25, 28 и 31°С), охватывающих большую часть диапазона температурной толерантности данного вида. Максимальные значения пройденного пути и скорости плавания особей в “открытом поле”, критической скорости течения и времени до сноса рыб в гидродинамической установке зарегистрированы при близкой к оптимальной для жизнедеятельности молоди плотвы температуре (25°С). Выявлена бóльшая температурная зависимость целенаправленной двигательной активности молоди плотвы по сравнению со спонтанной. Высокие показатели плавательной способности сеголеток в очень широком диапазоне температуры отражают хорошую приспособленность к жизни в температурно-неоднородном прибрежье.
Самопроизвольное перемещение организмов в пространстве в ответ на внешние воздействия является их простейшей реакцией (Ивлев, 1966). Сама способность к активному движению может рассматриваться как основополагающая адаптация животных, определяющая их успешное существование в постоянно меняющейся среде обитания (Павлов, 1979). В большинстве водоёмов водная толща не статична, а находится в постоянном движении, образуя течения разной интенсивности. Вследствие этого гидробионты должны обладать навыками ориентации по отношению к потокам воды (реореакция), а также определённой плавательной способностью для сохранения желательной для них пространственной позиции. У рыб реореакция возникает уже на самых ранних этапах личиночного развития и сохраняется в онтогенезе (Павлов, 1966, 1979). Исследования, затрагивающие вопросы перемещения рыб в пространстве, можно условно разделить на два основных направления: изучение двигательной активности, ориентированной на определённые цели (терморегуляция, питание, защита и др.), либо спонтанной и определение плавательной способности. Под последней понимается продолжительность движения рыб с той или иной скоростью (Павлов, 1979; Павлов, Черноусов, 1981).
Из всего разнообразия абиотических факторов, оказывающих воздействие на двигательные реакции рыб, особенно значимы освещённость и температура (Павлов, 1979). Причём последняя, определяя биоэнергетику организма, напрямую воздействует на большинство жизненных процессов, в том числе и на способность к передвижению (Beamish, 1978; Linløkken et al., 2010). Изучению влияния температуры на двигательную активность и плавательную способность рыб посвящено много работ (Brett, 1964; Павлов и др., 1972; Beamish, 1978; Павлов, 1979; Koumoundouros et al., 2002; Lee et al., 2003; O’Steen, Bennett, 2003; Kent, Ojanguren, 2015). Плотва Rutilus rutilus как вид с широким ареалом, хорошо приспособленный для жизни в стоячих и текучих водоёмах, также не раз становилась объектом подобных исследований (Павлов и др., 1972; Павлов, 1979; Persson, 1986; Скоробогатов и др., 1987; Forstner, Wieser, 1990; Linløkken et al., 2010). Плотва характеризуется широким диапазоном температурной устойчивости – 0–37°С (Голованов, 2013) – и населяет озёра и реки от Скандинавии до Средней Азии и Ближнего Востока. Температурный оптимум для жизнедеятельности неполовозрелых особей плотвы, установленный по реакции термопрефферендума, приходится на зону относительно высоких значений – 23–26°С (Dijk et al., van, 2002; Голованов, 2013; Смирнов, Смирнова, 2015). Однако ранее влияние температуры на особенности плавания особей данного вида чаще всего оценивали при более низких значениях (4–21°С). В связи с этим вопросы, связанные с двигательной активностью плотвы при близких к оптимуму для жизнедеятельности значениях температуры, а также выше его, представляются весьма важными. Последнее особенно актуально на фоне продолжающейся в последние десятилетия тенденции роста средних значений температуры воды в водоёмах умеренного климата (Литвинов, Законнова, 2012).
Цель работы – изучить особенности двигательной активности и плавательной способности молоди плотвы в широком температурном диапазоне.
МАТЕРИАЛ И МЕТОДИКА
Исследования выполнены в сентябре–ноябре 2018 г. на сеголетках плотвы стандартной длиной (SL) 47.2 ± 0.8 мм и массой 1.7 ± 0.1 г, которых отлавливали мальковым неводом в прибрежье канала, расположенного в пос. Борок и сообщающегося с Рыбинским водохранилищем. После вылова в течение двух недель рыб содержали в аквариуме объёмом 340 л для адаптации к лабораторным условиям. Затем по 45 особей разместили в пяти отдельных аквариумах (80 л) для акклимации к температуре соответственно 7, 16, 25, 28 и 31°С, продолжавшейся минимум 14 сут. Температуру поддерживали на заданном уровне (±0.5°С) посредством электронного терморегулирующего устройства (BM8036) с цифровыми датчиками (SN18B20). На всём протяжении адаптационного периода один раз в сутки рыб кормили ad libitum сухим хлопьевидным кормом Sera Vipan (Германия) и ежедневно заменяли 30–50% общего объёма воды.
Опыты по определению двигательной активности и плавательной способности плотвы при разной температуре проводили в первой половине дня при естественной освещённости. Всего исследовано 200 особей (по 40 экз. из каждой группы).
Двигательную активность молоди плотвы оценивали методом “открытого поля”. Опыты выполняли в широком плоском аквариуме размерами 1.3 × 0.9 × 0.1 м с расчерченным на квадраты (10 × 10 см) дном. По его периметру располагалась непрозрачная ширма белого цвета высотой 50 см. Рыб из экспериментальных групп отбирали случайным образом для снижения вероятности воздействия каких-либо дополнительных неучтённых факторов (срок адаптации, атмосферное давление и др.). Наблюдение и съёмку поведения рыб делали с помощью цифровой IP-камеры DCS-2210 (“D-Link”, Taйвань), закреплённой над аквариумом. Записи эксперимента обрабатывали на компьютере в программе D-ViewCam NVR. В начале каждого опыта одну особь помещали в аквариум, после чего начинали отсчёт времени до момента её самопроизвольного движения (латентный период). Далее в течение 5 мин фиксировали число секторов, пересечённых рыбой во время перемещения по аквариуму. Пройденный путь рассчитывали путём перемножения числа пересечённых секторов на их размер. Полученная таким образом приблизительная величина представлена за 5 мин наблюдений в целом и для каждой минуты отдельно. На основании этих данных вычисляли среднюю скорость плавания всех особей за те же временны́е отрезки.
После испытаний в “открытом поле” рыбу помещали в гидродинамическую установку для исследования её плавательной способности. Рабочая камера установки представляет собой прозрачную трубу (длиной 80 см и диаметром 15.5 см) с ограничительными решётками по краям (Смирнова, 2010). Методика определения критической скорости течения заключается в постепенном (ступенчатом) усилении потока воды до момента сноса особи. Рыб по одной сажали в установку, после чего запускали двигатель на малых оборотах, формируя минимально возможную скорость потока воды ~0.3 м/с. Наблюдения продолжали в течение 1 мин, после чего скорость увеличивали до 0.6 м/с. Далее таким же образом скорость повышали до ~1.0 и максимума ~1.2 м/с. Опыты длились до момента сноса рыбы к ограничительной решётке рабочей камеры, но не более 10 мин. Для каждой особи фиксировали достигнутую максимальную скорость течения и общее время сопротивления потоку воды. Исходя из этих данных, рассчитывали приблизительный путь, проплываемый рыбой до момента сноса. После опытов плотву измеряли и взвешивали.
Статистическую обработку экспериментальных данных выполняли в программном пакете STATISTICA. Для сравнения межгрупповых и внутригрупповых показателей двигательной активности и плавательной способности применяли непараметрический критерий Манна–Уитни. Для оценки температурной зависимости двигательной активности и плавательной способности использовали линейную регрессию и дисперсионный анализ Фишера.
РЕЗУЛЬТАТЫ
Двигательная активность. Большинство рыб при помещении в установку «открытое поле» какое-то время сохраняли неподвижность, оставаясь в одном из расчерченных секторов, что определялось как латентный период (Тl). Его продолжительность достоверно зависела (F = 9.41, p < 0.05, df = 4) от температуры (рис. 1). В холодной воде (7°С) рыбы были малоактивны (Тl в среднем ~2 мин), а также демонстрировали максимальные индивидуальные различия в продолжительности латентного периода – от 0 до 10 мин (дольше наблюдения не выполняли). При температуре воды 16°С среднее значение Тl было ниже в 4 раза (p < 0.05); минимальный латентный период (в среднем 11 с) отмечен у рыб при 25°С. Вследствие того что при 16 и 25°С момент начала движения молоди наступал существенно раньше, относительное число особей, сохранявших неподвижность >5 мин (3%), было минимальным (табл. 1).
Рис. 1.
Латентный период (∙∙∙◻∙∙∙) и двигательная активность (–⚫–) молоди плотвы Rutilus rutilus за 5 мин наблюдений в установке “открытое поле” при разной температуре воды; здесь и на рис. 2, 3: (|) – среднее значение и его ошибка.
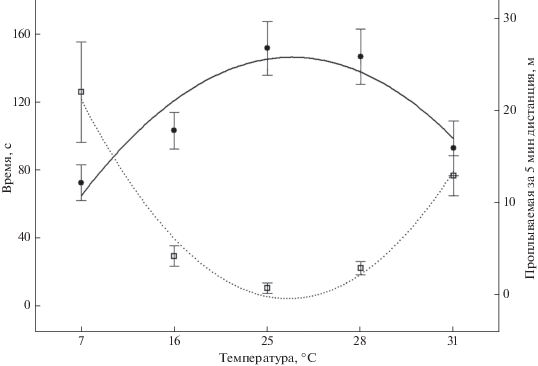
Таблица 1.
Некоторые показатели двигательной активности молоди плотвы Rutilus rutilus при разной температуре среды
| Показатель | Температура, °С | ||||
|---|---|---|---|---|---|
| 7 | 16 | 25 | 28 | 31 | |
| Скорость движения, см/с: | |||||
| за 5 мин наблюдения | 4.1 ± 0.6 | 6.0 ± 0.7* | 8.9 ± 1.0* | 8.6 ± 1.0 | 5.3 ± 1.0* |
| за 1-ю мин наблюдения | 4.5 ± 0.6 | 7.3 ± 0.9* | 14.8 ± 1.3* | 10.5 ± 1.3* | 5.8 ± 1.3* |
| за 5-ю мин наблюдения | 3.7 ± 0.6 | 4.8 ± 0.8 | 4.7 ± 0.9 | 8.7 ± 1.2* | 5.4 ± 1.0* |
| Доля особей, проплывших дистанцию %: | |||||
| <1 м | 31 | 8 | 10 | 10 | 24 |
| 1–30 м | 62 | 73 | 37 | 50 | 46 |
| >30 м | 7 | 19 | 53 | 40 | 30 |
| Доля особей с Тl > 5 мин, % | 19 | 3 | 3 | 8 | 15 |
Примечание. Тl – латентный период; здесь и в табл. 2: *различия с показателями предшествующей температурной группы достоверны при p < 0.05.
Двигательная активность плотвы в установке “открытое поле” в значительной мере (F = 6.37, p < 0.05, df = 4) определялась температурой среды (рис. 1). Анализ полученных данных выявил фактически линейный рост среднего пути, проплываемого рыбами за пять минут наблюдений, в диапазоне температуры от 7 до 25°С. Однако вследствие высокой степени индивидуальных различий показатели регрессии были низкими (r = 0.4, R2 = 0.2, p < 0.05). При температуре 28 и 31°С по сравнению с 25°С (p < 0.05) двигательная активность рыб снижалась.
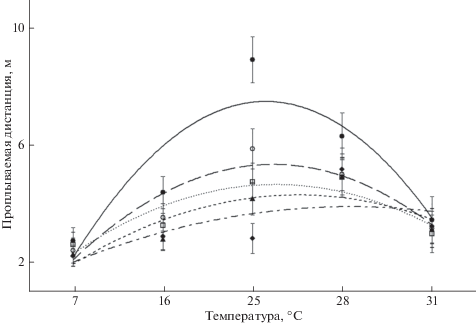
При рассмотрении перемещения особей в поминутной хронологической последовательности наблюдается более сложный характер зависимости пройденной дистанции от температуры (рис. 2, табл. 1). При 25°С рыбы в три раза активнее перемещались в начале опытов по сравнению с их окончанием (F = 11.55, p < 0.05, df = 4). При крайних значениях исследованного диапазона температуры эти различия были минимальны и недостоверны (F = 0.15, F = 0.07, p > 0.05, df = 4). При 28°С особи активно перемещались в течение всех 5 мин наблюдений (F = 0.70, p > 0.05, df = 4). Кроме того, при температуре 7, 16 и 25°С показатели двигательной активности плотвы в течение 5-й мин наблюдений фактически совпадали.
Рис. 2.
Двигательная активность молоди плотвы Rutilus rutilus в установке “открытое поле” при разной температуре воды: (–⚫–) – 1-я, (–⚪–) – 2-я, (∙∙∙◻∙∙∙) – 3-я, (–▲–) – 4-я, (–◆–) – 5-я минуты.
Наблюдаемая в эксперименте двигательная активность молоди плотвы имела значительную индивидуальную изменчивость. В каждой группе встречались как особи, находившиеся в течение всего опыта фактически без движений, так и активно перемещавшиеся. Вследствие этого преодолеваемая рыбами дистанция за весь период наблюдений варьировала в широком диапазоне – 0–63 м. Причём в разных группах существовали определённые особенности распределения особей по двигательной активности (табл. 1). При 7 и 31°С число рыб, проплывших дистанцию <1 м, было в два–три раза больше в сравнении с остальными группами; а при 25°С число особей, активно перемещающихся в экспериментальном пространстве, было максимальным.
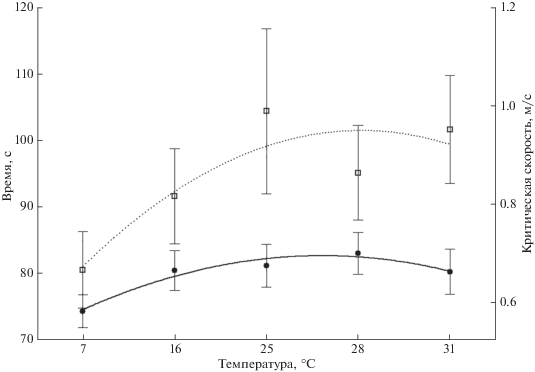
Плавательная способность. По сравнению с двигательной активностью плавательная способность молоди плотвы в меньшей степени зависела от температуры среды (рис. 3). При увеличении температуры воды от 7 до 28°С повышение значения критической для рыб скорости течения составило всего ~0.1 м/с (r = 0.16, R2 = 0.03, p < 0.05), а при 31°С отмечено некоторое снижение показателей плавательной способности рыб.
Рис. 3.
Критическая скорость течения (–⚫–) и общее время до сноса (∙∙∙◻∙∙∙) молоди плотвы Rutilus rutilus в гидродинамической установке при разной температуре воды.
Как и в случае с показателями двигательной активности, у исследованных рыб наблюдалась высокая индивидуальная изменчивость в способности сопротивляться потоку воды. Часть особей скатывалась уже в течение 1-й мин при самой низкой из предоставленных скоростей течения (~0.3 м/с); число таких рыб в исследованных группах несколько разнилось (табл. 2). Примечательно, что при каждом значении температуры около половины особей скатывались в течение 2-й мин опыта при скорости потока воды ~0.6 м/с. Максимально возможной скорости течения (~1.2 м/с) достигли лишь рыбы, адаптированные к температуре воды 25 и 28°С, соответственно 10 и 3% особей. В каждой группе отмечались рыбы, первичная реакция которых на начало движения воды была нехарактерной: она заключалась в быстром сносе головой вперёд по направлению и со скоростью течения. Однако доля таких особей была невелика (<5%), и при повторном тестировании они, как правило, проявляли стандартную реореакцию.
Таблица 2.
Некоторые показатели плавательной способности молоди плотвы Rutilus rutilus при разной температуре
| Показатель | Температура, °С | ||||
|---|---|---|---|---|---|
| 7 | 16 | 25 | 28 | 31 | |
| Критическая скорость плавания, SL/c | 12.8 ± 0.7 | 14.1 ± 0.8 | 14.3 ± 0.9 | 15.9 ± 1.0* | 13.3 ± 0.9* |
| Пройденная до момента сноса дистанция, м | 33.8 ± 3.6 | 45.5 ± 5.2 | 57.6 ± 12.6 | 43.4 ± 4.6 | 48.6 ± 5.8 |
| Доля особей, %: | |||||
| скатившихся на 1-й минуте | 26 | 19 | 24 | 16 | 19 |
| скатившихся на 2-й минуте | 60 | 51 | 46 | 49 | 50 |
| скатившихся на 3-й минуте | 14 | 30 | 20 | 32 | 31 |
| достигших скорости 1.2 м/с | 0 | 0 | 10 | 3 | 0 |
Для улучшения результатов статистической оценки воздействия температурного фактора на плавательную способность плотвы мы, по примеру Козловского (2000), разделили рыб на слабых, средних и сильных пловцов, скатившихся соответственно при скорости течения 0.3, 0.6 и ≥1.0 м/с. Это позволило несколько нивелировать влияние высокого уровня индивидуальных различий. Выполненный после этого дисперсионный анализ показал, что значимое воздействие температура оказывала только на общее время нахождения рыб в гидродинамической установке до момента их сноса (проплываемый путь) (F = 2.57, p < 0.05, df = 4), тогда как её влияние на критическую скорость течения было достоверным лишь при p = = 0.08 (F = 2.1, df = 4).
Использованные в экспериментах особи плотвы имели сходные размеры, поэтому зависимости критической скорости течения (r = 0.3, R2 = 0.1, p < 0.05) и общего пройденного пути (r = 0.3, R2 = = 0.1, p < 0.05) от длины особей были слабыми. То же самое относится и к массе рыб. Также нам не удалось установить какую-либо взаимосвязь между показателями двигательной активности особей и их плавательной способностью.
ОБСУЖДЕНИЕ
Двигательная активность. Для большинства эктотермных организмов температурные условия мест обитания служат одним из главных компонентов их экологических ниш, оказывая влияние на различные аспекты жизнедеятельности. Неслучайно, что и поведение рыб как типичных представителей этой группы в значительной мере определяется температурой окружающей среды. Перемена температурных условий, как правило, приводит к заметному изменению интенсивности плавания рыб разных экологических групп (Beamish, 1978; Павлов, 1979; Persson, 1986; Linløkken et al., 2010; Ottmar, Hurst, 2012; Kent, Ojanguren, 2015).
Полученные результаты наглядно свидетельствуют о значимом влиянии температуры на подвижность молоди плотвы (рис. 1). В холодной воде (7°С) у рыб отмечен продолжительный латентный период, который в среднем длится в 10 раз дольше в сравнении с таковым при близких к оптимальным видовым значениям температуры (25°С). Вероятно, стресс, испытываемый рыбами при пересадке из акклимационного аквариума в экспериментальную установку, в холодной среде развивается в течение большего периода времени. В подобных условиях некоторая часть особей (13%) вообще не демонстрировала какой-либо активности в течение 10 мин наблюдений. По всей видимости, подобный результат объясняется непосредственным воздействием температуры на скорость физиолого-биохимических процессов, протекающих в организме рыб. При исследовании влияния температуры на метаболизм плотвы показано, что с ростом температуры воды с 8 до 20°С происходит значительное снижение температурного коэффициента Q10 при спонтанном плавании с 4.1 до 1.6 (Forstner, Wieser, 1990). Кроме того, метаболические процессы в тканях мозга эктотермных животных характеризуются бóльшими величинами температурного коэффициента Q10 в сравнении с таковыми, протекающими в скелетных мышцах (Слоним, 1986). Вследствие этого именно нервная система рыб более остро реагировала на низкие значения температуры, а значительное замедление протекающих в ней физиологических процессов могло послужить причиной более продолжительного стресса.
Значительное сокращение длительности латентного периода происходило уже при температуре воды 16°С. В целом при 16, 25 и 28°С рыбы были очень активны и начинали движение спустя 11–30 с после посадки в экспериментальную установку. На наш взгляд, полученный температурный диапазон (16–28°С) относительно высокой активности плотвы можно было бы расширить в сторону понижения значений. Это косвенно подтверждается данными литературы, в которых отмечалось снижение интенсивности питания и роста плотвы только после падения температуры ниже 12°С (Hardewig, van Dijk, 2003). При прогреве среды до 31°С величина латентного периода вновь существенно возрастала, что, вероятно, обусловлено дополнительным стрессом от воздействия высокой температуры, достаточно близкой к сублетальному значению (Голованов и др., 2012). Таким образом, молодь плотвы сохраняет высокий уровень активности даже при нахождении в воде со значениями температуры, сильно удалёнными от видового оптимума.
Другие показатели двигательной активности плотвы оказались также весьма восприимчивыми к температуре окружающей среды (рис. 1, табл. 1). Температурная зависимость пути, проплываемого рыбами в течение опытов, имеет форму купола с максимумом при 25°С, а его протяжённость при 7 и 25°С различается более чем в пять раз. Дальнейшее повышение температуры за точку видового оптимума ведёт к постепенному угнетению двигательных функций молоди. Подобно этому изменяется и средняя скорость плавания рыб, определённая за 5 мин наблюдений.
Увеличение температуры способно вызывать ускорение передвижения животных за счёт более быстрого сокращения скелетных мышц, более частых разрядов в мотонейронах и возрастания скорости некоторых других физиологических процессов (Слоним, 1986). Кроме этого с ростом температуры меняются и физические параметры самой среды, в которой перемещаются гидробионты: снижается вязкость воды, уменьшается содержание в ней растворённого кислорода и т.д. (Павлов, 1979; Koumoundouros et al., 2002). Однако основная причина увеличения быстроты плавания рыб под воздействием температуры связана с изменением скорости метаболических процессов (Beamish, 1978; Павлов, 1979). Максимальная скорость плавания молоди плотвы в установке “открытое поле” зарегистрирована при 25°С. Это в полной мере соответствует предложеной Фраем и Хартом (Fry, Hart, 1948) теоретической кривой зависимости скорости движения рыб от температуры, точно повторяющей динамику разности между активным обменом и обменом покоя. В такой системе максимальная скорость движения у гидробионтов возникает в точке наибольшего превышения активного обмена над обменом покоя, приходящейся на температурный видовой оптимум жизнедеятельности.
При поминутном анализе перемещений плотвы из экспериментальных групп были получены интересные различия в значениях её двигательной активности, рассчитанных на начало и конец опытов (рис. 2). В очень холодной (7°С) и тёплой (31°С) средах интенсивность плавания особей была низкой и слабо изменялась в течение 5 мин наблюдений. Однако в воде с температурами 16 и 25°С после выраженного всплеска двигательной активности рыб на начальном этапе опытов наблюдалось её постепенное затухание к их окончанию, особенно заметное в последнем случае. При 28°С плотва сохраняла высокую интенсивность перемещений на протяжении всего периода наблюдений. Примечательно, что к моменту окончания опытов интенсивность движения у рыб фактически совпадала, несмотря на значительные различия в температуре окружающей среды (7, 16, 25, 31°С). По всей видимости, на начальном временнóм отрезке опытов у молоди преобладала исследовательская активность. Преодолев стресс, полученный при пересадке, рыбы активно перемещались по площади экспериментальной установки, обследуя незнакомую им среду. При этом проплываемый ими путь, а также скорость движения напрямую определялись температурой воды (рис. 2, табл. 1). К окончанию опытов двигательная активность рыб постепенно снижалась, по-видимому, до спонтанных значений. Эксперименты на рыбах разных экологических групп показали, что в спокойном и свободно-подвижном состоянии они развивают скорости 0.2–1.0 SL/с, при этом затраты энергии на плавание находятся в пределах стандартного обмена (Белокопытин, 1993). В течение 5-й мин опытов особи плотвы плавали со скоростью 0.9–1.1 SL/с (7, 16, 25, 31°С), что вполне этому соответствует либо несколько отличается в бóльшую сторону – 1.8 SL/с (28°С). Повышенная двигательная активность молоди в последнем случае требует дальнейших уточнений.
В литературе имеются сведения, что в отсутствие пищи скорость плавания особей плотвы в диапазоне 4–20°С слабо зависит от температуры и составляет ~5 см/с (Linløkken et al., 2010). Это фактически совпадает с полученными в настоящем исследовании величинами в течение 5-й мин наблюдений при 7, 16, 25 и 31°С (табл. 1). Однако при появлении кормовых объектов скорость плавания рыб в упомянутой работе возрастала и в диапазоне температуры 4–20°С линейно увеличивалась с ~7 до ~16 см/с, что также вполне соответствует нашим данным, полученным за 1-ю мин наблюдений. В опытах Перссона (Persson, 1986) молодь плотвы во время питания плавала ещё быстрее, схожим образом реагируя на температурные изменения в диапазоне от 12 до 21°С (скорость движения соответственно ~28 и 45 см/с). Повышенные значения в данном случае объясняются влиянием внутривидовой конкуренции, так как в аквариумах находилась группа особей. Таким образом, целенаправленная двигательная активность молоди плотвы в экспериментах в гораздо большей степени зависит от температуры, чем спонтанная.
При изучении спонтанной двигательной активности молоди плотвы отмечалось, что при низкой температуре воды (8°С) рыбы чаще малоподвижны (~ 90% случаев), а скорость их обменных процессов сохраняется на одном уровне, соответствующем стандартному обмену (Forstner, Wieser, 1990). Это согласуется с нашими данными (рис. 2). При более высоких значениях температуры (15 и 20°С) для поведения плотвы характерна повышенная подвижность (соответственно 74 и 96% случаев), что сопровождается значительным ростом скорости метаболических реакций (Forstner, Wieser, 1990). В отличие от этого в наших опытах низкий уровень спонтанной двигательной активности сохранялся у молоди во всём исследованном диапазоне температур, за исключением 28°С. Возможно, повышенная подвижность особей в экспериментах Фостнера и Вейзера (Forstner, Wieser, 1990) могла быть мотивирована чем-то иным, например, состоянием голода, так как опыты длились 2–3 сут без кормления. Известно, что даже временное ограничение пищи оказывает значительное влияние на показатели двигательной активности молоди рыб (Méndez, Wieser, 1993; Зданович, Пушкарь, 2004; Смирнов, Смирнова, 2019).
Плавательная способность. С точки зрения экологии, кроме изучения различных аспектов двигательной активности рыб немалый интерес представляет и определение их плавательной способности. Отдельные показатели последней широко используются как критерий жизнеспособности гидробионтов (Павлов, Черноусов, 1981; Сбикин, Лепская, 1982; Козловский, 2000). Знание видовых и онтогенетических особенностей плавательной способности помогает понять характер распределения особей в реках, их миграционную и нерестовую активность (Павлов и др., 1972; Beamish, 1978; Павлов, 1979). Мы исследовали только один из её показателей – критическую скорость течения. Под ней обычно понимается верхняя граница того интервала скоростей, в пределах которого возможно удержание рыб в потоке (Павлов, Фомин, 1978; Павлов, 1979). Критерием достижения соответствующих величин, наряду со сносом рыб, считается также их переход от плавного движения к броскам (Честной, 1961; Павлов, Фомин, 1978; Павлов, 1979). Значения критической скорости течения зависят от целого ряда факторов: температуры воды, освещённости, количества зрительных ориентиров, числа рыб в группе, их физиологического состояния и других (Павлов, Фомин, 1978).
Результаты опытов показывают, что с ростом температуры воды способность молоди плотвы сопротивляться потоку постепенно повышается (рис. 3). Однако в диапазоне 7–28°С такое увеличение не превышает 24%, что свидетельствует о сравнительно небольшом влиянии температурного фактора на исследуемый показатель. Такая реакция молоди может нести для неё определенные выгоды. Плотва, как и многие другие виды рыб, в течение первого года жизни чаще встречается на мелководном прибрежье, где колебания температуры особенно существенны. Определённая независимость плавательной способности молоди от температурных условий среды обитания может положительно сказаться на успешности её нагула, а также на устойчивости к воздействию хищников (Koumoundouros et al., 2002).
Интересен тот факт, что при всех значениях температуры около половины особей сносились потоком воды, составлявшим 0.6 м/с (табл. 2). Вероятно, для исследованной размерной группы плотвы (SL ~50 мм) такая скорость наиболее близка к критической. Например, у молоди воблы Rutilus rutilus caspicus SL 33–34 мм критическая скорость составляет 0.4–0.5 м/с, а её увеличение при повышении температуры среды с 17 до 20°С – 25.5% (Павлов и др., 1972). Как видно, значения критической скорости течения несколько ниже полученных нами, что наиболее вероятно связано с меньшими размерами особей. Известно, что с увеличением размеров рыб растут и критические скорости течения, при которых происходит их снос (Павлов, 1966, 1979; Koumoundouros et al., 2002; Ottmar, Hurst, 2012). Вследствие небольших отличий в длинах исследованных нами особей плотвы подобная зависимость, хоть и имела место, но её показатели оказались крайне низкими. Критическая скорость плавания молоди в расчёте на длину особи (12.8–15.9 SL/с) несколько выше приведённых в литературе значений. Так, для меньших размерных групп плотвы (SL 18–23 мм) при 17–20°С этот показатель равняется 8.2 SL/с (Скоробогатов и др., 1987). Возможно, некоторая переоценённость величин критической скорости плавания у исследованной нами молоди связана с несоответствием диаметра рабочей камеры гидродинамической установки размеру рыб (Павлов, 1979), а также с процедурой ступенчатого наращивания скорости потока воды (Di Santo et al., 2017).
Более значимое воздействие температуры на плавательную способность рыб было выявлено при рассмотрении их общего времени нахождения в гидродинамической установке, а также проплываемого ими пути до момента сноса (рис. 3, табл. 2). Эта зависимость приближалась к куполообразной с максимумом при температуре 25°С. Как и в случае с критическими скоростями течения, статистическую оценку данных затруднил высокий уровень индивидуальных различий. Существование подобной разнокачественности отмечали у рыб и ранее (Павлов, Черноусов, 1981), при этом она носила достаточно стабильный характер и не менялась при повторном тестировании (Павлов, 1979). По-видимому, наблюдаемые индивидуальные различия обусловлены спецификой формирования фенотипа каждой конкретной особи, её физиологическим состоянием, а кроме того могут быть связаны с существованием внутрипопуляционных форм в пределах одного водоёма (Кодухова, Карабанов, 2017). Интересно, что при неблагоприятных условиях, например высоком уровне метаболитов, индивидуальные различия в плавательной способности рыб уменьшались (Павлов, Черноусов, 1981).
Собственные и литературные данные указывают на то, что при близкой к видовому оптимуму жизнедеятельности температуре у молоди плотвы показатели двигательной активности и плавательной способности улучшаются: сокращается время реакции на стрессовые ситуации, повышаются скорость плавания и эффективность поискового и пищевого поведения. Исходя из этого можно допустить, что чем ближе температура среды обитания к оптимальной, тем больше гипотетических выгод смогут приобрести находящиеся в ней особи. Например, с возрастанием плавательной способности у рыб появляется возможность держаться в районах с бóльшими скоростями течения и тем самым увеличивать объём воды, в котором они находят себе корм (Павлов, Черноусов, 1981). Также при этом возможно улучшение некоторых показателей защитного поведения (Михеев, 2001; Koumoundouros et al., 2002; Kent, Ojanguren, 2015; Öhlund et al., 2015) либо появление преимуществ в межвидовой конкуренции (Lyon et al., 2008).
Пребывание организма в зоне температурного оптимума позволяет ему до минимума снизить затраты на адаптационные нужды и расходовать все доступные ресурсы “только на фундаментальные жизненные процессы” (Шилов, 2001. С. 214). Отклонение значений температуры от оптимальной зоны включает адаптационные механизмы, направленные на компенсацию негативных последствий воздействия температуры (Bryan et al., 1990). Тем самым сокращается количество свободной энергии, доступной организму для совершения каких-либо иных действий. Это хорошо отражено в динамике температурных изменений большинства из исследованных показателей двигательной активности и плавательной способности молоди плотвы, которая близка к часто используемой в англоязычной литературе “кривой температурной зависимости биологических процессов” (thermal performance curve) (Huey, Kingsolver, 1993; Gilchrist, 1995; Kent, Ojanguren, 2015). Принимая во внимание широкий температурный диапазон, в котором особи плотвы демонстрировали удовлетворительные показатели плавательной способности, этот вид уверенно можно отнести к универсалам, способным сохранять высокую активность даже в среде с температурой, значительно отличающейся от оптимальной (Gilchrist, 1995). Последнее особенно актуально в водоёмах умеренного климата, где соответствующие видовому оптимуму температурные условия (23–26°С) существуют в течение непродолжительного периода времени.
В заключение следует отметить, что рассмотренные выше закономерности затрагивают в основном статичные по отношению к температурному фактору условия. В температурно-неоднородной среде характер двигательной активности особей может заметно отличаться. Экспериментально установлено, что в термоградиентных полях рыбы, напротив, двигались с меньшими скоростями при нахождении в зоне температурного оптимума (Ивлев, 1966; Reynolds, Casterlin, 1979; Bryan et al., 1990; Staaks et al., 1999), в то время как при удалении от данной температурной точки показатели их двигательной активности постепенно возрастали. Вероятно, в подобных условиях рыбы демонстрируют, прежде всего, реакцию термопрефферендума, целенаправленно перемещаясь в зону с оптимальными температурными условиями. После чего их двигательная активность снижается до уровня, близкого к спонтанному. При этом затраты, связанные с терморегуляцией, в такой ситуации сводятся к минимуму, тем самым уменьшая количество энергии, отвлекаемой от роста и других важных жизненных процессов (Bryan et al., 1990). Разумеется, всё сказанное справедливо на фоне достаточной обеспеченности рыб другими не менее важными для их жизнедеятельности условиями и, в частности, доступной пищей (Константинов, Зданович, 1993; Zdanovich, 2006; Смирнов, Смирнова, 2019).
ВЫВОДЫ
1. Максимальные значения показателей двигательной активности (минимальные для латентного периода) и плавательной способности молоди плотвы зарегистрированы при температуре воды, близкой к видовому оптимуму жизнедеятельности. Это, вероятнее всего, обусловлено наибольшей сбалансированностью основных жизненных процессов, протекающих на разных уровнях организации живой системы, а также максимальным запасом доступной организму свободной энергии.
2. Целенаправленная двигательная активность молоди плотвы в большей степени подвержена изменениям при воздействии температурного фактора, чем спонтанная.
Список литературы
Белокопытин Ю.С. 1993. Энергетический обмен и двигательная активность морских рыб: Автореф. дис. … докт. биол. наук. Севастополь: ИнБЮМ НАНУ, 55 с.
Голованов В.К. 2013. Температурные критерии жизнедеятельности пресноводных рыб. М.: Полиграф-Плюс, 300 с.
Голованов В.К., Смирнов А.К., Капшай Д.С. 2012. Окончательно избираемые и верхние летальные температуры молоди некоторых видов пресноводных рыб // Тр. КНЦ РАН. № 2. С. 70–75.
Зданович В.В., Пушкарь В.Я. 2004. Влияние потребления пищи на интенсивность дыхания и двигательную активность молоди стерляди Acipenser ruthenus // Вопр. ихтиологии. Т. 44. № 4. С. 567–569.
Ивлев В.С. 1966. Элементы физиологической гидробиологии // Физиология морских животных. М.: Наука. С. 3–45.
Кодухова Ю.В., Карабанов Д.П. 2017. Морфологические изменения в популяции плотвы (Rutilus rutilus, Cyprinidae) озера Плещеево в результате вселения моллюска Dreissena polymorpha (Bivalvia) // Зоол. журн. Т. 96. № 9. С. 1069–1077. https://doi.org/10.7868/S0044513417090100
Козловский С.В. 2000. Исследование реакции на внешние воздействия рыб с различной физической выносливостью // Изв. СамарНЦ РАН. Т. 2. № 2. С.283–289.
Константинов А.С., Зданович В.В. 1993. Некоторые характеристики поведения молоди рыб в термоградиентном поле // Вестн. МГУ. Сер. 16. Биология. № 1. С. 32–38.
Литвинов А.С., Законнова А.В. 2012. Термический режим Рыбинского водохранилища при глобальном потеплении // Метеорология и гидрология. № 9. С. 91–96.
Михеев В.Н. 2001. Поиск корма и успех питания у молоди рыб: роль течений и ориентиров // Вопр. рыболовства. Т. 1. № 1. С. 172–178.
Павлов Д.С. 1966. Отношение молоди рыб к потоку воды и ориентация в нем // Зоол. журн. Т. 45. Вып. 6. С. 891–896.
Павлов Д.С. 1979. Биологические основы управления поведением рыб в потоке воды. М.: Наука, 319 с.
Павлов Д.С., Фомин В.К. 1978. Методика определения критических скоростей течения для рыб // Рыб. хоз-во. № 11. С. 30–32.
Павлов Д.С., Черноусов А.Н. 1981. Изменение плавательной способности у молоди плотвы под влиянием продуктов её метаболизма // ДАН. Т. 261. № 6. С. 1513–1516.
Павлов Д.С., Сбикин Ю.Н., Ващинников А.Е., Мочек А.Д. 1972. Влияние освещённости и температуры воды на критические скорости течения для рыб // Вопр. ихтиологии. Т. 12. Вып. 4(75). С. 769–778.
Сбикин Ю.Н., Лепская В.А. 1982. Плавательная способность осетровых как критерий её жизнестойкости // Рыб. хоз-во. № 8. С. 22–23.
Скоробогатов М.А., Павлов Д.С., Барекян А.Ш. 1987. Изучение связи плавательной способности плотвы Rutilus rutilus (L.) с давлением и углом наклона потока // Вопр. ихтиологии. Т. 27. Вып. 2. С. 313–319.
Слоним А.Д. 1986. Эволюция терморегуляции. Л.: Наука, 76 с.
Смирнов А.К., Смирнова Е.С. 2015. Реакция молоди плотвы Rutilus rutilus (Linnaeus, 1758) на неоднородность кормовых ресурсов в температурном градиенте // Вестн. АГТУ. Сер. Рыб. хоз-во. № 3. С. 44–52.
Смирнов А.К., Смирнова Е.С. 2019. Поведение молоди окуня Perca fluviatilis (Percidae) в гетеротермальной среде при разной обеспеченности пищей // Зоол. журн. Т. 98. № 2. С. 182–192. https://doi.org/10.1134/S0044513419020168
Смирнова Е.С. 2010. Влияние условий выращивания на поведение молоди плотвы Rutilus rutilus (L.) (Cyprinidae) // Биология внутр. вод. № 3. С. 75–81.
Честной В.Н. 1961. Максимальные скорости движения рыб // Рыб. хоз-во. № 9. С. 22–27.
Шилов И.А. 2001. Экология. М.: Высш. шк., 512 с.
Beamish F.W.H. 1978. Swimming capacity // Fish physiology. V. 7. Locomotion / Eds. Hoar W.S., Randall D.J. London: Acad. Press. P. 101–187. https://doi.org/10.1016/S1546-5098(08)60164-8
Brett J.R. 1964. The respiratory metabolism and swimming performance of young sockeye salmon // J. Fish. Res. Board Can. V. 21. № 5. P. 1183–1226. https://doi.org/10.1139/f64-103
Bryan J.D., Kelsch S.W., Neill W.H. 1990. The maximum power principle in behavioral thermoregulation by fishes // Trans. Amer. Fish. Soc. V. 119. № 4. P. 611–621. https://doi.org/10.1577/1548-8659(1990)119<0611:TMPPIB>2.3.CO;2
Dijk P.L.M., van, Staaks G., Hardewig I. 2002. The effect of fasting and refeeding on temperature preference, activity and growth of roach, Rutilus rutilus // Oecologia. V. 130. № 4. P. 496–504. https://doi.org/10.1007/s00442-001-0830-3
Di Santo V., Kenaley C.P., Lauder G.V. 2017. High postural costs and anaerobic metabolism during swimming support the hypothesis of a U-shaped metabolism-speed curve in fishes // Proc. Nat. Acad. Sci. USA. V. 114. № 49. P. 13 048–13 053. https://doi.org/10.1073/pnas.1715141114
Forstner H., Wieser W. 1990. Patterns of routine swimming and metabolic rate in juvenile cyprinids at three temperatures // J. Comp. Physiol. V. 160B. № 1. P. 71–76. https://doi.org/10.1007/BF00258764
Fry F.E.J., Hart J.S. 1948. Cruising speed of goldfish in relation to water temperature // J. Fish. Res. Board Can. V. 7. № 4. P. 169–175. https://doi.org/10.1139/f47-018
Gilchrist G.W. 1995. Specialists and generalists in changing environments. I. Fitness landscapes of thermal sensitivity // Amer. Naturalist. V. 146. № 2. P. 252–270. https://doi.org/10.1086/285797
Hardewig I., Dijk P.L.M., van. 2003. Is digestive capacity limiting growth at low temperatures in roach? // J. Fish Biol. V.62. № 2. P. 358–374. https://doi.org/10.1046/j.1095-8649.2003.00027.x
Huey R.B., Kingsolver J.G. 1993. Evolution of resistance to high temperature in ectotherms // Amer. Naturalist. V. 142. P. S21–S46. https://doi.org/10.1086/285521
Kent M., Ojanguren A.F. 2015. The effect of water temperature on routine swimming behaviour of new born guppies (Poecilia reticulata) // Biol. Open. V. 4. № 4. P. 547–552. https://doi.org/10.1242/bio.20149829
Koumoundouros G., Sfakianakis D.G., Divanach P., Kentouri M. 2002. Effect of temperature on swimming performance of sea bass juveniles // J. Fish Biol. V. 60. № 4. P. 923–932. https://doi.org/10.1006/jfbi.2002.1902
Lee C.G., Farrell A.P., Lotto A. et al. 2003. The effect of temperature on swimming performance and oxygen consumption in adult sockeye (Oncorhynchus nerka) and coho (O. kisutch) salmon stocks // J. Exp. Biol. V. 206. № 18. P. 3239–3251. https://doi.org/10.1242/jeb.00547
Linløkken A.N., Bergman E., Greenberg L. 2010. Effect of temperature and roach Rutilus rutilus group size on swimming speed and prey capture rate of perch Perca fluviatilis and R. rutilus // J. Fish Biol. V. 76. № 4. P. 900–912. https://doi.org/10.1111/j.1095-8649.2010.02545.x
Lyon J.P., Ryan T.J., Scroggie M.P. 2008. Effects of temperature on the fast-start swimming performance of an Australian freshwater fish // Ecol. Freshw. Fish. V. 17. № 1. P. 184–188. https://doi.org/10.1111/j.1600-0633.2007.00244.x
Méndez G., Wieser W. 1993. Metabolic responses to food deprivation and refeeding in juveniles of Rutilus rutilus (Teleostei: Cyprinidae) // Environ. Biol. Fish. V. 36. P. 73–81. https://doi.org/10.1007/BF00005981
Öhlund G., Hedström P., Norman S. et al. 2015. Temperature dependence of predation depends on the relative performance of predators and prey // Proc. Biol. Sci. V. 282. № 1799. P. 1–8. https://doi.org/10.1098/rspb.2014.2254
O’Steen S., Bennett A.F. 2003. Thermal acclimation effects differ between voluntary, maximum, and critical swimming velocities in two cyprinid fishes // Physiol. Biochem. Zool. V. 76. № 4. P. 484–496. https://doi.org/10.1086/376421
Ottmar M.L., Hurst T.P. 2012. Thermal effects on swimming activity and habitat choice in juvenile Pacific cod (Gadus macrocephalus) // Mar. Biol. V. 159. № 10. P. 2185–2194. https://doi.org/10.1007/s00227-012-2004-8
Persson L. 1986. Temperature-induced shift in foraging ability in two fish species, roach (Rutilus rutilus) and perch (Perca fluviatilis) // J. Anim. Ecol. V. 55. № 3. P. 829. https://doi.org/10.2307/4419
Reynolds W.W., Casterlin M.E. 1979. Behavioral thermoregulation and locomotor activity of Perca flavescens // Can. J. Zool. V. 57. № 11. P. 2239–2242. https://doi.org/10.1139/z79-291
Staaks G., Kirschbaum F., Williot P. 1999. Experimental studies on thermal behaviour and diurnal activity rhythms of juvenile European sturgeon (Acipenser sturio) // J. Appl. Ichthyol. V. 15. № 4–5. P. 243–247. https://doi.org/10.1111/j.1439-0426.1999.tb00243.x
Zdanovich V.V. 2006. Alteration of thermoregulation behavior in juvenile fish in relation to satiation level // J. Ichthyol. V. 46. Suppl. 2. P. S188–S193. https://doi.org/10.1134/S0032945206110087
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


