Вопросы ихтиологии, 2020, T. 60, № 3, стр. 341-350
Эколого-популяционные особенности окуня-клювача Sebastes mentella (Sebastidae) Северо-Западной Атлантики на основе анализа его паразитофауны
Ю. И. Бакай *
Полярный филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии − ПИНРО
Мурманск, Россия
* E-mail: bakay@pinro.ru
Поступила в редакцию 26.04.2019
После доработки 13.09.2019
Принята к публикации 08.10.2019
Аннотация
Приведены результаты исследований состава, особенностей экологии, зоогеографии и формирования фауны паразитов окуня-клювача Sebastes mentella на акватории четырёх районов батиали Северо-Западной Атлантики и пелагиали моря Лабрадор. Установлена высокая мера сходства состава паразитофауны этого хозяина из районов банки Гамильтон, северных и южных склонов Большой Ньюфаундлендской банки. Состав и особенности возрастной динамики формирования разнообразия фауны паразитов свидетельствуют о значительной обособленности группировки окуня-клювача, обитающей на банке Флемиш-Кап, от его скоплений в других районах побережья Канады и пелагиали моря Лабрадор. Эти факторы в совокупности с представленными эколого-популяционными характеристиками указывают на популяционный статус группировки окуня-клювача банки Флемиш-Кап.
Окунь-клювач Sebastes mentella, как и другие виды североатлантических окуней рода Sebastes, является придонно-пелагическим видом с внутренним оплодотворением. Многие исследователи считают морских окуней яйцеживородящими (Барсуков, 1981; Литвиненко, 1985; Saborido-Rey, 1994). Окунь-клювач имеет большой ареал: обитает на акваториях шельфа, батиали и мезопелагиали от Баренцева и Гренландского морей до побережья Канады. В настоящее время обосновано существование двух популяций окуня-клювача – норвежско-баренцевоморской и североатлантической (Литвиненко, 1985; Древетняк, 1999; Saborido-Rey et al., 2004; Мельников, Бакай, 2009а; Бакай, 2011; Planque et al., 2013; Melnikov, 2016; Бакай, Попов, 2017). Окуню-клювачу как филогенетически наиболее молодому среди североатлантических видов рода Sebastes (Барсуков, 1981; Artamonova et al., 2013), самому глубоководному и обладающему максимальной миграционной активностью свойственно симпатрическое распределение и слабая видовая дифференциация с американским S. fasciatus и золотистым окунем S. norvegicus во многих районах западной части ареала (Барсуков, Захаров, 1972; Литвиненко, 1985; Барсуков и др., 1990; Saborido-Rey, 1994; Valentin et al., 2002). Последнее усиливается межвидовой гибридизацией между этими видами (Roques et al., 2001; Artamonova et al., 2011; Saha et al., 2017), значительно ограничивая возможность применения результатов генетических исследований и обостряя проблему изучения популяционной структуры клювача (Planque et al., 2013; Melnikov, 2016). Кроме того, большинство данных по окуню-клювачу до 1970-х гг. относится к сборному виду, включавшему американского и золотистого окуней (Барсуков, Захаров, 1972; Барсуков и др., 1990).
Имеющиеся мнения о популяционной структуре окуня-клювача в Северо-Западной Атлантике (СЗА) весьма противоречивы. Некоторые исследователи предполагали существование у побережья Канады нескольких (до четырёх) изолированных группировок (популяций) этого вида (Templeman, 1953; Янулов, 1962; Никольская, 1969), из которых предполагаемая “лабрадорская популяция” клювача формируется из молоди, принесённой из района вымета предличинок в пелагиали моря Ирмингера (Templeman, 1961). Канадские авторы (Roques et al., 2002) по результатам исследований микросателлитных последовательностей ДНК относят придонные скопления окуня-клювача в СЗА (кроме скоплений на банке Флемиш-Кап) к западной составляющей его панокеанической (североатлантической) популяции, населяющей мезопелагиаль морей Ирмингера и Лабрадор с сопредельными районами батиали Гренландии, Исландии и Фарерских о-вов. Другие исследователи (Cadrin et al., 2010), используя тот же метод, относят особей клювача в районах батиали Канады к западной единице запаса, являющейся одной из четырёх генетически обособленных единиц запаса этого вида в морях Северной Атлантики (СА). Однако эти авторы не представили иных данных по популяционной биологии окуня-клювача для дифференциации его выделяемых групп.
В результате анализа морфологических, биологических и генетических данных высказано предположение об относительной изолированности скоплений окуня-клювача на акватории банки Флемиш-Кап от смежных районов (Алтухов, 1974). По итогам анализа эколого-популяционных характеристик, представленных в литературных источниках, высказано мнение о популяционном статусе скоплений окуня-клювача, обитающего на банке Флемиш-Кап (Melnikov, 2016).
Указанные неопределённости повышают актуальность современных эколого-паразитологических исследований этого объекта, поскольку использование паразитов в качестве естественных меток для познания популяционной биологии, миграций, питания и филогении рыб является общепризнанным (Sindermann, 1961; Williams et al., 1992; MacKenzie, Abaunza, 2005; Cadrin et al., 2010). Паразитологический метод предполагает исследование не только видового состава, но и условий формирования и зоогеографии фауны паразитов изучаемого хозяина, что не отражено в немногочисленных публикациях по паразитам окуня-клювача в районах у побережья Канады (Bourgeois, Ni, 1984; Moran et al., 1996; Bakay, 2001; Marcogliese et al., 2003).
Известны попытки некоторых исследователей выделить локальные группировки окуней рода Sebastes у атлантического побережья Канады посредством использования дискретного характера заражения копеподами Sphyrion lumpi, Chondracanthus nodosus и Peniculus clavatus, личинками нематод Anisakis sp. и Contracaecum sp., цестоды Eubothrium sp. (Sindermann, 1961; Янулов, 1962; Kabata, 1963). Они показали различия между скоплениями клювача банки Флемиш-Кап и района моря Лабрадор (банка Гамильтон). Позже представлены отличия по этим паразитам особей клювача из зал. Святого Лаврентия и южного побережья о-ва Ньюфаундленд (Marcogliese et al., 2003). Однако недостатками многих из этих работ является упомянутое выше отсутствие до 1970-х гг. достоверной дифференциации североатлантических видов рода Sebastes (Литвиненко, 1985), а также проведение анализа встречаемости ограниченного числа (1–6) видов паразитов. Подлежит сомнению корректная идентификация двух видов Myxozoa (Myxidium sphaericum и Ceratomyxa macrospora), выполненная некоторыми авторами (Khan et al., 1986; Marcogliese et al., 2003), поскольку в большом объёме нашего материала, собранного в этом районе от трёх видов Sebastes, указанные Myxozoa не встречены (Бакай, Груднев, 2009).
Цель настоящей работы – представить зоогеографическую и экологическую характеристику фауны паразитов окуня-клювача в западной части ареала и использовать её для выявления особенностей популяционной биологии этого хозяина.
МАТЕРИАЛ И МЕТОДИКА
Пробы окуня-клювача взяты из уловов донного трала, полученных на глубинах 400–630 м в апреле–июне 1986–1987 и 1990 гг. в акваториях четырёх доступных для исследований районов батиали банки Флемиш-Кап, южной и северной частей Большой Ньюфаундлендской банки (БНБ), банки Гамильтон, а также из уловов пелагического трала в море Лабрадор в слое 200–450 м в июле 1990–1993 гг. (рис. 1). Полному паразитологическому вскрытию (Донец, Шульман, 1973; Быховская-Павловская, 1985) с видовой идентификацией обнаруженных паразитов подвергли 157 экз. придонного клювача общей длиной (TL) 8–44 см в возрасте 2–24 лет и 199 экз. пелагического клювача TL 28–38 см в возрасте 8–17 лет. Паразитов крови не исследовали. Видовая идентификация особей окуня-клювача выполнена согласно “Методическим указаниям …” (1984). Возраст рыб определён по чешуе и отолитам.
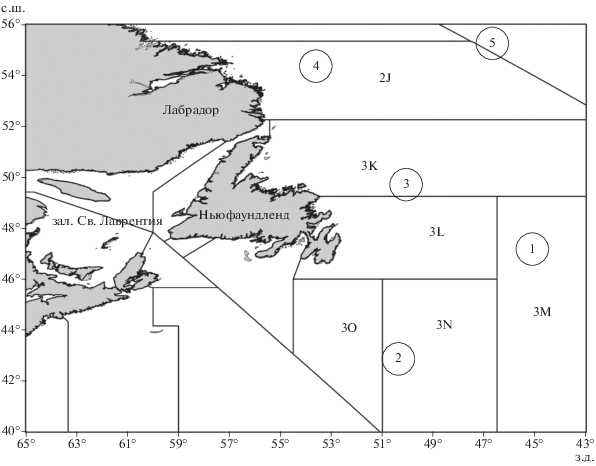
Рис. 1.
Районы исследований окуня-клювача Sebastes mentella: 1 – банка Флемиш-Кап (3М), 2 – южные склоны Большой Ньюфаундлендской банки (3N, 3О), 3 – её северные склоны (3L, 3K), 4 – банка Гамильтон (2J), 5 – пелагиаль моря Лабрадор; (——) – границы микрорайонов 2J−3О, установленные Организацией по регулированию промысла в Северо-Западной Атлантике (NAFO, 2019).
Понятие “популяция” принято в формулировках Тимофеева-Ресовского с соавторами (1973), Алтухова (1974), Яблокова (1987) и других исследователей как элементарная эволюционирующая единица вида, определяющими характеристиками которой являются устойчивое самовоспроизводство, доминирование внутригруппового обмена генами между особями при освоении ими уникальной экологической ниши. Для указания принадлежности к экологическим группировкам окунь-клювач североатлантической популяции, обитающий в пелагиали морей Лабрадор и Ирмингера, назван пелагическим, а приуроченный к акватории батиали Гренландии, Канады и Исландии − придонным. Особям клювача пелагической группировки свойственно более раннее половое созревание (Мельников, Бакай, 2006, 2009б).
Показателями степени заражённости служили: экстенсивность инвазии (ЭИ) – доля рыб, заражённых паразитом данного вида (% числа исследованных); и индекс обилия (ИО) – число паразитов данного вида, приходящихся на одну исследованную рыбу (Bush et al., 1997). При оценке заражённости рыб копеподой Sphyrion lumpi регистрировали как живых особей паразита, так и следы его инвазии (остатки цефалоторакса) (Бакай, Карасев, 1995). К видам, образующим ядро паразитофауны, отнесены наиболее часто (ЭИ преимущественно >10%) и во всех районах встречающиеся паразиты окуня-клювача. Значимость различий в ЭИ для паразитов окуня-клювача банок Флемиш-Кап и БНБ (суммарно по южным и северным склонам БНБ), а также банки Флемиш-Кап и пелагиали моря Лабрадор определена по тесту критерия значимости (χ2) при р < 0.05 (Бреев, 1976). Таксономический состав фауны паразитов указан согласно современным данным (WoRMS, 2019).
В основу экологического анализа паразитофауны положен метод вертикальной зональности экологических группировок, предложенный Гаевской (1984). Принадлежность видов паразитов к зоогеографическим и экологическим комплексам определена по данным литературы (Зубченко, 1993; Lile et al., 1994; Hemmingsen, McKenzie, 2001) и результатам собственных исследований. При оценке степени обособленности сравниваемых групп рыб исходили из её обратной зависимости от значения меры сходства (L0) фауны паразитов (Андреев, Решетников, 1978), определяемой по коэффициенту Сёренсена–Чекановского (Бейли, 1970). Мерой видового разнообразия паразитов окуня-клювача разных размерных групп служит индекс Шеннона (Н) (Мэгарран, 1992).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У исследованных особей окуня-клювача в районах СЗА обнаружены паразиты 22 видов, которые принадлежат к восьми классам: Microsporea (1 вид), Myxozoa (4), Cestoda (4), Trematoda (6), Chromadorea (2), Palaeacanthocephala (1), Clitellata (1), Hexanauplia (3) (таблица). Из выявленных паразитов семь видов указаны впервые для окуня-клювача в западной части его ареала. Ядро фауны паразитов окуня-клювача формируют пять видов, среди которых доминируют (80%), как и во всей паразитофауне этого хозяина (59%), широко распространённые гетероксенные виды. Три вида Myxozoa и все три вида Hexanauplia специфичны роду североатлантических Sebastes (Бакай, 2016).
Эколого-трофический фактор определяет формирование фауны паразитов окуня-клювача, которая характерна для рыб-планктофагов. Это обусловлено питанием его молоди (TL < 32 см, возраст до 11 лет) планктонными беспозвоночными (Calanoida, Euphausiacea, Hyperiidea и др.), служащими промежуточными хозяевами в жизненных циклах большинства видов гельминтов (Køie, 1979, 1981, 1993; Smith, 1983). В питании клювача старшего возраста наряду с зоопланктоном присутствуют креветки (Pandalidae) и планктоноядные рыбы (Myctophidae, молодь рыб), доля которых увеличивается с возрастом окуня (Кашинцев, 1962; Янулов, 1963; Захаров и др., 1977; Albikovskaya, Gerasimova, 1993; Saborido-Rey, 1994).
Фауна паразитов окуня-клювача Sebastes mentella в пяти районах Северо-Западной Атлантики
| Паразит и другие показатели | ЭК | ЗГ | Батиаль | Пелагиаль | ||||
|---|---|---|---|---|---|---|---|---|
| Флемиш-Кап | БНБ | Гамильтон | море Лабрадор | |||||
| юг | север | юг + север | ||||||
| Microsporea: | ||||||||
| Pleistophora sp.1 | мп | атб | 4.3/+ | * | ||||
| Myxozoa: | ||||||||
| Myxidium incurvatum | мб | амб | 9.8/+ | 8.7/+ | 7.4/+ | 8.1/+ | 6.7/+ | 6.5/+ |
| M. obliquelineolatum1, 3 | мб | аб | – | 8.7/+ | 11.1/+ | 10.0*/+ | 6.7/+ | 9.5*/+ |
| Leptotheca adeli1, 3 | мб | аб | 1.1/+ | 4.3/+ | 11.1/+ | 7.9*/+ | 6.7/+ | 9.0*/+ |
| Pseudоalataspora sebastei1, 2, 3 | мб | аб | 20.7/+ | 23.1/+ | 51.8/+ | 37.7*/+ | 13.3/+ | 5.0*/+ |
| Cestoda: | ||||||||
| Bothriocephalus scorpii2 | мп | аамб | 15.2/0.15 | 8.7/0.09 | 18.5/0.19 | 13.7/0.30 | 26.7/0.53 | 12.3/0.19 |
| Diphyllobothrium sp. pl. | мп | атб | 0.5/0.01 | |||||
| Grillotia erinaceus pl. | пз | амб | 1.1/0.01 | 1.1/0.01 | ||||
| Hepatoxylon trichiuri pl. | мп | атб | 0.5/0.01 | |||||
| Monorygma sp. pl.1 | пз | амб | 3.7/0.04 | 1.9/0.02 | 1.6/0.02 | |||
| Scolex pleuronectis pl.2 | пз | к | 15.2/0.72 | 30.4/0.43 | 3.7/0.04 | 17.2/0.22 | 33.3/0.80 | 8.9/0.25 |
| Trematoda: | ||||||||
| Anomalotrema koiae | мб | аб | 4.3/0.10 | 13.0/0.17 | 3.7/0.04 | 8.5/0.09 | 6.7/0.07 | 2.2/0.05 |
| Derogenes varicus | пз | к | 10.8/0.11 | 4.3/0.04 | 7.4/0.07 | 5.9/0.06 | 13.3/0.33 | 1.1*/0.01 |
| Hemiurus levinseni | пз | аамб | 7.1/0.30 | 3.7/0.04 | 1.9/0.02 | 13.3/0.33 | * | |
| Lecithaster gibbosus | пз | аамб | 6.7/0.07 | |||||
| Lecithophyllum botryophoron | мп | аамб | 4.3/0.20 | 26.1/0.35 | 7.4/0.07 | 16.5*/0.19 | 13.3/0.33 | 2.2/0.02 |
| Podocotyle reflexa | мб | аамб | 26.1/0.35 | 3.7/0.04 | 14.7*/0.18 | 46.7/1.00 | 2.8/0.03 | |
| Chromadorea: | ||||||||
| Anisakis simplex l.2 | пз | к | 47.8/2.87 | 95.7/3.35 | 40.7/1.75 | 68.0*/2.24 | 33.3/1.87 | 78.8*/6.21 |
| Hysterothylacium aduncum2 | пз | амб | 71.7/5.72 | 43.5/1.22 | 18.5/0.30 | 30.7*/0.73 | 13.3/0.20 | 7.8*/0.09 |
| Palaeacanthocephala: | ||||||||
| Rhadinorhynchus sp. l.1 | мб | аб | 4.3/0.04 | 2.0/0.02 | 0.5/0.01 | |||
| Clitellata: | ||||||||
| Johanssonia arctica1 | эк | a | 1.1/0.01 | |||||
| Hexanauplia: | ||||||||
| Chondracanthus nodosus3 | мб | аб | 16.3/0.30 | 17.4/0.26 | 3.7/0.04 | 10.4/0.13 | 6.7/0.07 | * |
| Peniculus clavatus3 | мп | аб | 2.2/0.02 | 13.0/0.17 | 3.7/0.04 | 8.5/0.09 | 6.7/0.07 | * |
| Sphyrion lumpi3 | мп | амб | 2.5/0.03 | 2.0/0.05 | 13.5/0.18 | 7.9/0.13 | 20.0/0.33 | 39.7*/0.89 |
| Длина рыб (TL), см: | ||||||||
| – пределы варьирования | 17–44 | 22–39 | 19–44 | 19−44 | 18–37 | 28–38 | ||
| – средняя | 30.5 | 29.6 | 29.5 | 29.5 | 29.2 | 34.2 | ||
| Число исследованных рыб, экз. | 92 | 23 | 27 | 50 | 15 | 199 | ||
| Глубина лова, м | 430–530 | 400–450 | 490–550 | 400−550 | 580–630 | 200–450 | ||
Примечание. ЭК – экологические комплексы: мб – мезобентальный, мп – мезопелагический, пз – полизональный, эк – эпиконтинентальный; ЗК – зоогеографические комплексы: а – арктический, аб – арктическо-бореальный, аамб – аркто-амфибореальный, атб – атлантическо-бореальный, амб – амфибореальный, к – космополиты; БНБ − Большая Ньюфаундлендская банка; перед чертой – экстенсивность инвазии (ЭИ), %; после черты – индекс обилия, экз. (“+” − не определяли у Myxozoa и Microsporea); 1 вид впервые указан для окуня-клювача в западной части его ареала, 2 вид ядра паразитофауны, 3 специфичный роду североатлантических Sebastes вид; пелагиаль моря Лабрадор – по данным Мельникова и Бакая (2009а); *отличия значений ЭИ от банки Флемиш-Кап значимы при р < 0.05.
На банке Флемиш-Кап наблюдается прямая линейная зависимость видового разнообразия совокупностей инфрасообществ паразитов от длины (возраста) хозяина. Так, особям клювача в возрасте 5–7 лет (TL 18–23 см) свойствен рост заражённости видами паразитов, встреченными у его 2-годовиков, в том числе составляющих ядро паразитофауны, и появление новых видов. Рост разнообразия фауны паразитов иллюстрирует динамика индекса Шеннона (Н), значения которого возрастают от 0.5–0.7 у молоди (TL < 32 см) до 0.9 у созревших рыб (TL 32–39 см, 11–18 лет) и 1.2 – у рыб старшего возраста (рис. 2).
Рис. 2.
Динамика видового разнообразия фауны паразитов окуня-клювача Sebastes mentella в зависимости от длины (TL) рыб на банке Флемиш-Кап (- -) и Большой Ньюфаундлендской банке (—).
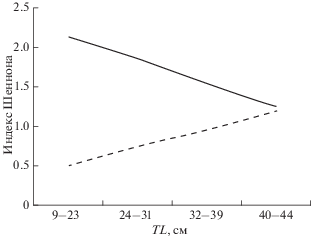
В исследованных районах БНБ наблюдается обратная зависимость формирования разнообразия фауны паразитов в онтогенезе клювача: значения Н снижаются от 2.1–1.8 у молоди до 1.5 у созревших и 1.2 у наиболее старших рыб. Такая динамика разнообразия паразитофауны клювача в районах БНБ при сохранении её количественного состава (11–12 видов) является следствием роста доминирования нематод обоих видов и снижения заражённости видами Myxozoa, цестодой Scolex pleuronectis pl., трематодой Podocotyle reflexa и копеподой Chondracanthus nodosus. Указанные особенности онтогенетического формирования видового разнообразия фауны паразитов свидетельствуют о значимой экологической дифференциации группировок окуня-клювача, обитающих на банках Флемиш-Кап и БНБ.
В пелагиали морей Ирмингера и Лабрадор также происходит снижение разнообразия паразитофауны в онтогенезе клювача, что иллюстрируется снижением Н с 1.7 у впервые созревающих рыб до 0.5 у наиболее старших (Бакай, 2016, 2018). Это обусловлено сужением пищевого спектра хозяина в результате миграции его раносозревающих особей в мезопелагиаль морей СА со смежных участков шельфа Гренландии и последующей возрастной трофической специализацией клювача (Мельников, Бакай, 2009б).
В соответствии с вертикальной зональностью паразитофауны рыб СА фауна паразитов окуня-клювача представлена видами, отнесёнными к четырём экологическим комплексам. Среди них во всех указанных районах СЗА у этого хозяина доминируют паразиты мезобентального (29–50%) и полизонального (25–35%) комплексов (рис. 3а; таблица). Из восьми видов паразитов полизонального комплекса три наиболее массовых вида формируют 60% состава ядра паразитофауны окуня-клювача. Среди паразитов мезопелагического комплекса (23–29% по районам) преобладают редкие для этого хозяина виды. Паразитофауна клювача банки Флемиш-Кап характеризуется минимальной по сравнению с другими районами долей паразитов мезобентального и максимальной долей мезопелагического комплексов (рис. 3а).
Рис. 3.
Соотношение видов паразитов окуня-клювача Sebastes mentella в батиали четырёх районов: а − экологические комплексы (МБ – мезобентальный, ЭК –
эпиконтинентальный, МП – мезопелагический, ПЗ – полизональный), б − зоогеографические
комплексы (АБ – арктическо-бореальный, Б – бореальный, К – космополиты); (◻) − банка
Флемиш-Кап, ( ) – южные склоны Большой Ньюфаундлендской банки, (
) – южные склоны Большой Ньюфаундлендской банки, ( ) – её северные склоны, (
) – её северные склоны, (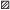 ) – банка Гамильтон.
) – банка Гамильтон.
Результаты зоогеографического анализа фауны паразитов окуня-клювача свидетельствуют о том, что она представлена преимущественно (47–62% по районам) видами арктическо-бореального комплекса (рис. 3б). Виды паразитов бореального комплекса формируют 19–29%, виды-космополиты – 17–19% состава паразитофауны этого хозяина. Окуню-клювачу банки Флемиш-Кап свойственна минимальная доля видов паразитов арктическо-бореального и максимальная доля видов бореального комплексов по сравнению с другими исследованными районами.
Доминирование в гетерогенном составе паразитофауны окуня-клювача видов мезобентального и полизонального комплексов с преобладанием паразитов арктическо-бореального комплекса характеризует этого хозяина как придонно-пелагический вид субполярной и умеренной зон морей СА, обитающего в районах смешения потоков вод арктического и атлантического происхождения.
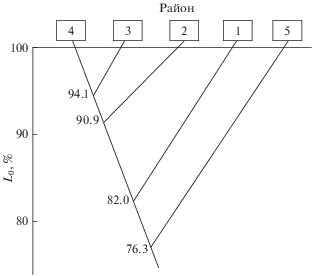
Показатели мер парного сходства (L0) состава паразитофауны окуня-клювача пяти районов СЗА, установленные по коэффициенту Сёренсена–Чекановского, изменяются от 68.6% (банка Флемиш-Кап и пелагиаль моря Лабрадор) до 94.1% (северные склоны БНБ и банка Гамильтон). Дендрограмма сходства паразитофауны демонстрирует значительные отличия её состава у клювача банки Флемиш-Кап от БНБ (L0 = 81.8%) и банки Гамильтон (L0 = 82.3%), а также пелагиали моря Лабрадор от остальных районов (рис. 4). Высокие показатели мер сходства паразитофауны окуня-клювача районов банки Гамильтон и БНБ (L0 = 90.9–94.1%) обусловлены значительной миграционной активностью этого хозяина.
Рис. 4.
Дендрограмма сходства (L0) фауны паразитов окуня-клювача Sebastes mentella в пяти районах Северо-Западной Атлантики; обозначения районов см. на рис. 1.
Относительная оригинальность фауны паразитов на банке Флемиш-Кап выражена в отсутствии специфичной роду североатлантических Sebastes и обычной для клювача во всех районах ареала миксоспоридии Myxidium obliquelineolatum (Бакай, Груднев, 2009), а также трематод Podocotyle reflexa и Lecithaster gibbosus, цестоды Monorygma sp. pl. и скребня Rhadinorhynchus sp. l. (таблица). Нигде в СЗА, кроме банки Флемиш-Кап, не обнаружены редкие для окуня-клювача паразиты – микроспоридия Pleistophora sp., цестода Grillotia erinaceus pl. и пиявка Johanssonia arctica. Кроме этого установлены значимые различия (p < 0.05) в заражённости окуня-клювача банок Флемиш-Кап и БНБ паразитами пяти общих видов: Leptotheca adeli, Pseudоalataspora sebastei, Lecithophyllum botryophoron, Anisakis simplex l. и Hysterothylacium aduncum.
Результаты сравнительного анализа фауны паразитов окуня-клювача банки Флемиш-Кап с опубликованными ранее данными по паразитам этого хозяина в мезопелагиали морей Лабрадор и Ирмингера, где обитают особи клювача пелагической группировки его североатлантической популяции (Bakay, 2001; Мельников, Бакай, 2009а, 2009б), указывают на максимальные их различия (L0 = 68.6%). Так, в мезопелагиали морей СА не встречены обычные для клювача банки Флемиш-Кап трематода Hemiurus levinseni, специфичные копеподы C. nodosus и P. clavatus (таблица). В свою очередь, на банке Флемиш-Кап не обнаружены специфичная североатлантическим Sebastes миксоспоридия M. оbliquelineolatum и гельминты шести видов (Hepatoxylon trichiuri pl., Monorygma sp. pl., Diphyllobothrium sp. pl., P. reflexa, Corynosoma strumosum l., Rhadinorhynchus sp. l.), выявленные у этого хозяина в мезопелагиали морей СА. К тому же из 12 общих для этих районов видов отмечены значимые различия в степени заражённости паразитами шести (50%) видов (L. adeli, P. sebastei, Derogenes varicus, A. simplex l., H. aduncum, S. lumpi).
Установленный рост разнообразия фауны паразитов в ходе онтогенеза окуня-клювача на банке Флемиш-Кап (рис. 2) обусловлен сопутствующим расширением спектра его пищевого рациона. Так, доминирование Calanoida в питании молоди клювача сменяется увеличением его спектра (Euphausiacea, Hyperiidea, Pandalidae, молодь Cephalopoda и рыб) в среднем и старшем возрасте и ростом встречаемости рыбных объектов в питании окуня в осенне-зимние месяцы (Кашинцев, 1962; Янулов, 1963; Захаров и др., 1977; Albikovskaya, Gerasimova, 1993). Обратная зависимость формирования разнообразия паразитофауны этого хозяина в районах БНБ определяется его возрастной трофической специализацией, приводящей к сужению пищевого спектра, выраженного в доминировании Euphausiacea и планктоноядных рыб (преимущественно Myctophidae). Такой процесс обусловлен смещением созревающих особей клювача с участков шельфа БНБ на постоянное обитание в батиаль на глубинах 400–1200 м.
Результаты анализа географической структуры фауны паразитов свидетельствуют о значительной обособленности группировки окуня-клювача, обитающей на банке Флемиш-Кап, от его скоплений на соседней БНБ и от пелагической группировки его североатлантической популяции. Подтверждением этому служит также кардинальное отличие возрастной динамики формирования разнообразия паразитофауны окуня-клювача в этих районах (рис. 2).
Полученные материалы по фауне паразитов окуня-клювача из районов батиали согласуются с данными других авторов, показавших различия в заражённости этого хозяина банок Флемиш-Кап и БНБ паразитами одного–шести видов (Sindermann, 1961; Янулов, 1962; Kabata, 1963; Bourgeois, Ni, 1984). Некоторые исследователи (Алтухов, 1974; Saborido-Rey, 1994) на основании сравнительного анализа биологических, морфологических и генетических данных также высказывали предположение об относительной изолированности скоплений клювача банки Флемиш-Кап от смежных районов.
В отличие от североатлантической популяции окуня-клювача, занимающей обширную акваторию батиали и шельфа Гренландии, Канады, Исландии и мезопелагиали морей Ирмингера и Лабрадор (Saborido-Rey et al., 2004; Мельников, Бакай, 2006, 2009а, 2009б; Planque et al., 2013; Melnikov, 2016), ареал ведущего придонный образ жизни клювача на склонах банки Флемиш-Кап ограничен действующим над ней замкнутым антициклоническим течением. Оно образовано Флемишкапской ветвью Лабрадорского течения и препятствует выносу пелагической молоди окуня-клювача за пределы данной подводной возвышенности, способствуя её дрейфу преимущественно к центру этой банки (Серебряков, 1962; Захаров и др., 1977; Borovkov, Kudlo, 1980; Saborido-Rey, 1994; Боровков и др., 2005). Однако наличие такой циркуляции водных масс и глубоководного жёлоба Флемиш-Пасс, отделяющих этот район от близлежащей БНБ, не может обеспечить полную изоляцию скоплений половозрелых особей клювача этих двух банок.
На обособленность группировки окуня-клювача банки Флемиш-Кап, имеющей признаки отдельной популяции, указывают следующие факторы: наличие особей всех возрастных групп при пространственно-временнóй стабильности на протяжении множества поколений; регулярное спаривание рыб в августе–ноябре на глубинах > 500 м (Серебряков, 1962; Захаров и др., 1977; Saborido-Rey, 1994); массовый вымет предличинок самками в марте–мае на глубинах 400–800 м (Янулов, 1962; Bainbridge, Cooper, 1971; Барсуков и др., 1990; Vaskov, 2002, 2005; Melnikov, 2016); низкий уровень сходства и перекрывания морфологических параметров с особями соседних районов (Алтухов, 1974; Saborido-Rey, 1994). Принято считать, что окунь-клювач совершает сезонные перемещения в пределах этой подводной возвышенности (уход на бόльшую глубину самок для вымета предличинок и молоди по мере роста) и не покидает в массовом количестве пределы банки в течение жизни при отсутствии массовой внешней миграции его особей (Захаров и др., 1977; Барсуков и др., 1990; Saborido-Rey, 1994).
В других районах СЗА отсутствуют массовое спаривание и вымет предличинок окуня-клювача. Указания на существование таковых в зал. Святого Лаврентия, на шельфе Новой Шотландии и БНБ на глубинах < 400 м (Templeman, 1959; Bainbridge, Cooper, 1971; Ni, Templeman, 1985; St-Pierre, Lafontaine, 1995; Dutil, 2003), очевидно, являются ошибочными, поскольку процессы воспроизводства этого вида приурочены к глубинам >400 м. Вероятно, эти сообщения относятся к американскому окуню S. fasciatus, обитающему здесь в массовом количестве, и вызваны некорректной видовой дифференциацией (использовано малое число параметров идентификации) этих видов Sebastes, имеющих значительное морфологическое сходство (Методические указания …, 1984; Литвиненко, 1985; Барсуков и др., 1990; Saborido-Rey, 1994; Valentin, 2002).
Процессы массового воспроизводства окуня-клювача в указанных районах невозможны из-за малой доли его половозрелых особей, обитающих здесь постоянно. Так, у Баффиновой Земли и Лабрадора обитает преимущественно молодь клювача TL ≤ 30 см, имеющая, по мнению ряда авторов (Templeman, 1961; Saborido-Rey et al., 2004), происхождение из района вымета предличинок в мезопелагиали моря Ирмингера. Массовое созревание самок в этих районах не отмечено даже при их максимальной длине. На северных склонах БНБ на глубинах до 550 м преобладают (до 65%) особи клювача с ранним созреванием, при котором они покидают участки батиали, мигрируя в пелагиаль моря Лабрадор и пополняя пелагическую группировку североатлантической популяции этого вида (Захаров и др., 1977; Saborido-Rey et al., 2004; Melnikov, 2016). Поздно созревающие особи клювача, распределяясь над глубинами 550–1200 м, формируют западную часть придонной группировки этой популяции, в которой полное созревание самок отмечается лишь у самых старших рыб (22–25 лет, TL 46–50 см), составляющих < 1% общего числа особей.
Низкий уровень парного сходства фауны паразитов окуня-клювача из пелагиали моря Лабрадор и батиали сопредельных банок Гамильтон и БНБ (L0 соответственно 74.3 и 80.0%) свидетельствует об отсутствии массового возврата его особей из пелагиали моря Лабрадор в выростные районы у канадского побережья. Однако присутствие у 13–20% рыб в батиали Канады на глубинах 550–1000 м следов прошлой заражённости (остатки цефалоторакса) мезопелагической копеподой S. lumpi (таблица), сохраняющихся в рыбе, возможно, до конца жизни (Бакай, Карасев, 1995), свидетельствует о непродолжительном выходе части особей клювача с участков канадской батиали в пелагиаль морей Лабрадор и Ирмингера, где расположен центр инвазии этим специфичным окуню-клювачу паразитом (Bakay, 1989; Мельников, Бакай, 2009а; Бакай, 2011, 2014).
Таким образом, имеются основания полагать, что скопления окуня-клювача, локализованные на акватории банки Флемиш-Кап, представляют отдельную (третью) его популяцию. Большинство неполовозрелых особей среднего и старшего возраста, распределяющихся в районах батиали Лабрадора, БНБ и Баффиновой Земли, формируют западную (канадскую) часть придонной группировки североатлантической популяции этого вида. Такое же мнение о популяционной структуре клювача в западной части его ареала высказано Мельниковым (Melnikov, 2016). Особи окуня-клювача придонной группировки, обитающей в батиали вдоль побережья Канады, значительно обособлены, как и в батиали Исландии и Гренландии, от рыб пелагической группировки этой популяции, которые распределяются в мезопелагиали морей Ирмингера и Лабрадор.
Список литературы
Алтухов Ю.П. 1974. Популяционная генетика рыб. М.: Пищ. пром-сть, 247 с.
Андреев В.Л., Решетников Ю.С. 1978. Анализ состава пресноводной ихтиофауны северо-восточной части СССР на основе методов теории множеств // Зоол. журн. Т. 57. Вып. 2. С. 165–174.
Бакай Ю.И. 2011. Эколого-паразитологическая характеристика окуня-клювача Sebastes mentella (Scorpaeniformes: Sebastidae) Норвежского моря и смежных вод // Вопр. ихтиологии. Т. 51. № 1. С. 97–104.
Бакай Ю.И. 2014. Экологические особенности паразитирования Sphyrion lumpi (Copepoda) у окуня-клювача Sebastes mentella // Тр. Центра паразитологии ИПЭЭ РАН. Т. XLVIII. Систематика и экология паразитов. С. 24–26.
Бакай Ю.И. 2016. Особенности формирования фауны паразитов североатлантических окуней рода Sebastes (Scorpaenidae) // Современные проблемы теоретической и морской паразитологии. Севастополь: Издатель Н.Ю. Бондаренко. С. 208–211.
Бакай Ю.И. 2018. Формирование фауны паразитов cевероатлантических окуней рода Sebastes (Scorpaeniformes: Sebastidae) в онтогенезе // Тр. Центра паразитологии ИПЭЭ РАН. T. L. Биоразнообразие паразитов. С. 25–27.
Бакай Ю.И., Груднев М.А. 2009. Фауна миксоспоридий (Myxozoa: Myxosporea) морских окуней рода Sebastes северной Атлантики // Паразитология. Т. 43. Вып. 4. С. 317–329.
Бакай Ю.И., Карасев А.Б. 1995. Диагностика и регистрация эктопоражений морских окуней (методическое руководство). Мурманск: Изд-во ПИНРО, 22 с.
Бакай Ю.И., Попов В.И. 2017. Эколого-популяционные особенности окуня-клювача Sebastes mentella (Scorpaenidae) Норвежского моря на основе анализа его паразитофауны // Вестн. МГТУ. Т. 20. № 2. С. 412–421. https://doi.org/10.21443/1560-9278-2017-20-2-412-421
Барсуков В.В. 1981. Морские окуни (Sebastinae) Мирового океана – их морфология, экология, распространение, расселение и эволюция: Автореф. дис. … докт. биол. наук. Л.: ЗИН АН СССР, 50 с.
Барсуков В.В., Захаров Г.П. 1972. Морфологические и биологические особенности американского морского окуня // Тр. ПИНРО. Т. 28. С. 143–173.
Барсуков В.В., Оганин И.А., Павлов А.И. 1990. Морфологические и экологические различия Sebastes fasciatus и S. mentella на Ньюфаундлендском шельфе и банке Флемиш-Кап // Вопр. ихтиологии. Т. 30. Вып. 5. С. 791–803.
Бейли Н. 1970. Математика в биологии и медицине. М.: Мир, 326 с.
Боровков В.А., Карсаков А.Л., Васьков А.А. 2005. Роль циркуляции вод в динамике урожайности поколений морского окуня и трески банки Флемиш-Кап // Вопр. промысл. океанологии. № 2. С. 243–252.
Бреев К.А. 1976. Применение математических методов в паразитологии // Изв. ГосНИОРХ. Т. 105. С. 109–126.
Быховская-Павловская И.Е. 1985. Паразиты рыб. Руководство по изучению. Л.: Наука, 120 с.
Гаевская А.В. 1984. Паразиты рыб северо-восточной Атлантики: фауна, экология, особенности формирования: Автореф. дис. … докт. биол. наук. Л.: ЗИН АН СССР, 35 с.
Донец З.С., Шульман С.С. 1973. О методах исследований Myxosporidia (Protozoa, Cnidosporidia) // Паразитология. Т. 7. Вып. 2. С. 191–193.
Древетняк К.В. 1999. Биология и промысел окуня-клювача норвежско-баренцевоморской популяции: Автореф. дис. … канд. биол. наук. М.: ВНИРО, 24 с.
Захаров Г.П., Никольская Т.Л., Сорокин В.П. и др. 1977. Морской окунь клюворылый Sebastes mentella Travin // Промысловые биологические ресурсы северной Атлантики и прилегающих морей Северного Ледовитого океана. Ч. 2. М.: Пищ. пром-сть. С. 72–87.
Зубченко А.В. 1993. Вертикальная зональность и особенности формирования фауны паразитов глубоководных рыб открытой части северной Атлантики // Паразитологические исследования рыб Северного бассейна. Мурманск: Изд-во ПИНРО. С. 39–60.
Кашинцев М.Л. 1962. К вопросу о питании окуня в районе Ньюфаундленда // Советские рыбохозяйственные исследования в северо-западной части Атлантического океана. М.: Изд-во ВНИРО–ПИНРО. С. 263–271.
Литвиненко Н.И. 1985. Морские окуни (род Sebastes) Северной Атлантики − их морфология, экология, распространение, расселение и эволюция: Автореф. дис. … канд. биол. наук. Л.: ЛГУ, 22 с.
Мельников С.П., Бакай Ю.И. 2006. Биолого-экологическое обоснование мер регулирования промысла окуня-клювача в районе Исландии // Рыб. хоз-во. № 1. С. 48–50.
Мельников С.П., Бакай Ю.И. 2009а. Структура скоплений и основные популяционные характеристики окуня-клювача Sebastes mentella (Scorpaeniformes: Scorpaenidae) в пелагиали моря Ирмингера и смежных вод // Вопр. ихтиологии. Т. 49. № 2. С. 200–213.
Мельников С.П., Бакай Ю.И. 2009б. Пополнение запаса окуня-клювача Sebastes mentella (Scorpaeniformes: Scorpaenidae) пелагиали моря Ирмингера и смежных вод // Там же. Т. 49. № 5. С. 669–680.
Методические указания по определению видов морских окуней северной части Атлантического океана и прилежащих морей. 1984. Калининград: Изд-во АтлантНИРО, 28 с.
Мэгарран Э. 1992. Экологическое разнообразие и его измерение. М.: Мир, 161 с.
Никольская Т.Л. 1969. Размерно-возрастной состав и темп роста морского окуня-клювача (Sebastes mentella Travin) южных склонов Большой Ньюфаундлендской банки // Вопр. ихтиологии. Т. 9. Вып. 4(57). С. 657–664.
Серебряков В.П. 1962. К изучению ихтиопланктона районов Ньюфаундленда и Лабрадора // Советские рыбохозяйственные исследования в северо-западной части Атлантического океана. М.: Изд-во ВНИРО–ПИНРО. С. 227–233.
Тимофеев-Ресовский Н.В., Яблоков А.В., Глотов Н.В. 1973. Очерк учения о популяции. М.: Наука, 277 с.
Янулов К.П. 1962. О группировках окуня-клювача (Sebastes mentella Travin) в Лабрадорско-Ньюфаундлендском районе // Советские рыбохозяйственные исследования в северо-западной части Атлантического океана. М.: Изд-во ВНИРО–ПИНРО. С. 285–296.
Яблоков А.В. 1987. Популяционная биология. М.: Высш. шк., 303 с.
Янулов К.П. 1963. Питание окуня-клювача (Sebastes mentella Travin) в водах Ньюфаундленда и Лабрадора // Вопр. ихтиологии. Т. 3. Вып. 4. С. 708–725.
Albikovskaya L., Gerasimova O. 1993. Food and feeding patterns of cod (Gadus morhua L.) and beaked redfish (Sebastes mentella Travin) on Flemish Cap // NAFO Sci. Coun. Stud. V. 19. P. 31–39.
Artamonova V.S., Karabanov D.P., Makhrov A.A. et al. 2011. Hybridization of redfish (genus Sebastes) in the Irminger Sea and its significance for studies of population structure of beaked redfish, S. mentella // ICES Annual Sci. Conf. ICES CM/A: 06. 3 p.
Artamonova V.S., Makhrov A.A., Karabanov D.P. et al. 2013. Hybridization of beaked redfish (Sebastes mentella) with small redfish (S. viviparus) and diversification of redfishes (Scorpaeniformes) in the Irminger Sea // J. Nat. Hist. V. 1. № 47. P. 1791–1801. https://doi.org/10.1080/00222933.2012.752539
Bainbridge V., Cooper G. 1971. Populations of Sebastes larvae in the North Atlantic // ICNAF Res. Bull. № 8. P. 27–35.
Bakay Yu.I. 1989. On infestation of marine redfishes (Sebastes genus) of the North Atlantic by the copepod Sphyrion lumpi (Krøyer, 1845) // Proc. Int. Workshop Sphyrion lumpi. Güstrow, GDR. P. 29–36.
Bakay Yu.I. 2001. Results from the analysis of geographical variability in parasite fauna of redfish Sebastes mentella from the North Atlantic // Deep-Sea Fisheries Symposium. NAFO SCR Doc. 01/153. Ser. № 4503. 11 p.
Borovkov V., Kudlo B. 1980. Results of USSR oceanographic observations on Flemish Kap, 1977–1978 // ICNAF Sel. Pap. № 6. P. 47–52.
Bourgeois C.E., Ni I.-H. 1984. Metazoan parasites of Northwest Atlantic redfishes (Sebastes spp.) // Can. J. Zool. V. 62. P. 1879–1885.
Bush A., Lafferty K., Lotz J., Shostak A. 1997. Parasitology meets ecology on its own terms: Margolis et al. Revisited // J. Parasitol. V. 83. № 4. P. 575–583.
Cadrin S., Bernreuther M., Daníelsdóttir A. et al. 2010. Population structure of beaked redfish, Sebastes mentella: evidence of divergence associated with different habitats // ICES J. Mar. Sci. V. 67. № 8. P. 1617–1630. https://doi.org/10.1093/icesjms/fsq046
Dutil J.-D. 2003. Timing of sexual maturation, mating, breeding and spawning in S. fasciatus and S. mentella // Can. Tech. Rept. Fish. Aquat. Sci. № 2462. P. 103–105.
Hemmingsen W., McKenzie K. 2001. The parasite fauna of the Atlantic cod, Gadus morhua L. // Adv. Mar. Biol. V. 40. P. 1–80. https://doi.org/10.1016/S0065-2881(01)40002-2
Kabata Z. 1963. Parasites as biological tags // ICNAF. Spec. publ. № 4(6). P. 31–37.
Khan R., Bowering W., Bourgeois C. et al. 1986. Myxosporean parasites of marine fish from the continental shelf off Newfoundland and Labrador // Can. J. Zool. V. 64. P. 2218–2286. https://doi.org/10.1139/z86-336
Køie M. 1979. On the morphology and life-history of Derogenes varicus (Müller, 1784) Looss, 1901 (Trematoda, Hemiuridae) // Z. Parasitencunde. V. 59. P. 67–78. https://doi.org/10.1007/BF00927847
Køie M. 1981. On the morphology and life-history of Podocotyle reflexa (Creplin, 1825) Odhner, 1905, and a comparison of its developmental stages with those of P. atomon (Rudolphi, 1802) Odhner, 1905 (Trematoda, Opecoelidae) // Ophelia. V. 20. № 1. P. 17–43.
Køie M. 1993. Aspects of the life cycle and morphology of Hysterothylacium aduncum (Rudolphi, 1802) (Nematoda, Ascaridoidea, Anisakidae) // Can. J. Zool. V. 71. P. 1289–1296.
Lile N., Halvorsen O., Hemmingsen W. 1994. Zoogeographical classification of the macroparasite faunas of four flatfish species from the northeastern Atlantic // Polar Biol. V. 14. P. 137–141.
MacKenzie K., Abaunza P. 2005. Parasites as biological tags // Stock identification methods: applications of fisheries science / Eds. Cadrin S. et al. N.Y.: Elsevier Acad. Press. P. 211–226. https://doi.org/10.1016/B978-012154351-8/50012-5
Marcogliese D., Albert E., Gagnon P., Sevigny J.-M. 2003. Use of parasites in stock identification of the deepwater redfish (Sebastes mentella) in the Northwest Atlantic // Fish. Bull. V. 101. P. 183–188.
Melnikov S.P. 2016. Intraspecies structure of beaked redfish Sebastes mentella of the Atlantic and Arctic oceans // J. Ichthyol. V. 56. № 1. P. 52–71. https://doi.org/10.7868/S0042875216010094
Moran J., Arthur J., Burt M. 1996. Parasites of sharp-beaked redfishes (Sebastes fasciatus and S. mentella) collected from the Gulf of St. Lawrence, Canada // Can. J. Fish Aquat. Sci. V. 53. P. 1821–1826.
NAFO. 2019. Northwest Atlantic Fisheries Organization: Regulatory area map. (https://www.nafo.int/Fisheries/Fishing-Activity-in-the-NRA)
Ni I.-H., Templeman W. 1985. Reproductive cycles of redfishes (Sebastes) in southern Newfoundland waters // J. Northwest. Atl. Fish. Sci. V. 6. P. 113–131.
Planque B., Astakhov A., Kristinsson K. et al. 2013. Monitoring beaked redfish (Sebastes mentella) in the North Atlantic, current challenges and future prospects // Aquat. Liv. Resour. V. 26. P. 293–306. https://doi.org/10.1051/alr/2013062
Roques S., Sevigny J.-M., Bernatchez L. 2001. Evidence for broadscale introgressive hybridization between two redfish (genus Sebastes) in the North-west Atlantic: a rare marine example // Mol. Ecol. V. 10. P. 149–165. https://doi.org/10.1046/j.1365-294x.2001.01195.x
Roques S., Sevigny J.-M., Bernatchez L. 2002. Genetic structure of deep-water redfish, Sebastes mentella, population across the North Atlantic // J. Mar. Biol. Ass. UK. V. 140. P. 297–307. https://doi.org/10.1007/s002270100705
Saborido-Rey F. 1994. The genus Sebastes Cuvier, 1829 (Scorpaenidae) in the North Atlantic: species and population identification using morphometric techniques; growth and reproduction of the Flemish Cap populations: Ph. D. Thesis. Madrid: Univ. Autonoma, 276 p.
Saborido-Rey F., Garabana D., Stransky K. et al. 2004. Review of the population structure and ecology of S. mentella in the Irminger Sea and adjacent waters // Rev. Fish Biol. Fish. V. 14. P. 455–479. https://doi.org/10.10007/s11160-005-3585-9
Saha A., Johansen T., Hedeholm R. et al. 2017. Geographic extent of introgression in Sebastes mentella and its effect on genetic population structure // Evol. Appl. V. 10. № 1. P. 77–90. https://doi.org/10.1111/eva.12429
Sindermann C. 1961. Parasitological tags for redfish of the western North Atlantic // Rapp. Cons. Explor. Mer. V. 150. P. 111–117.
Smith J.W. 1983. Larval Anisakis simplex (Rudolphi, 1809, det. Crabbe, 1978) and larval Hysterothylacium sp. (Nematoda: Ascaridoidea) in euphausiids (Crustacea: Malacostraca) in the North-East Atlantic and northern North Sea // J. Helminthol. V. 57. P. 167–177.
St-Pierre J.-F., de Lafontaine Y. 1995. Fecundity and reproduction characteristics of beaked redfish (Sebastes fasciatus and S. mentella) in the Gulf of St. Lawrence // Can. Tech. Rept. Fish. Aquat. Sci. № 2059. 32 p.
Templeman W. 1953. Knowledge of divisions of stock of cod, haddock, redfish and American plaice in subareas 3 and 2 of Northwest Atlantic Convention Area // ICNAF Ann. Proc. Doc. № 3, 5 p.
Templeman W. 1959. Redfish distribution in the North Atlantic // Bull. Fish. Res. Board Can. V. 120. P. 120–173.
Templeman W. 1961. Redfish distribution of Baffin Island, Northern Labrador, and in Ungava Bay in August-September 1959 // ICNAF Spec. Publ. № 3. P. 157–162.
Valentin A., Sévigny J.-M., Chanut J.-P. 2002. Geometric morphometrics reveals body shape differences between sympatric redfish Sebastes mentella, Sebastes fasciatus and their hybrids in the Gulf of St Lawrence // J. Fish Biol. V. 60. P. 857−875. https://doi.org/10.1006/jfbi.2002.1889
Vaskov A.A. 2002. Assessment of redfish stock in the Flemish Cap based on data from the Russian trawel survey in 2001 // NAFO SCR Doc. 02/9 Ser. № N4610. 16 p.
Vaskov A.A. 2005. Reproduction of deepwater redfish Sebastes mentella on the Flemish Cap Bank // NAFO SCR Doc. 05/4 Ser. № N5079. 10 p.
Williams H., MacKenzie K., McCarthy A. 1992. Parasites as biological indicators of the population biology, migrations, diet and phylogenetics of fish // Rev. Fish Biol. Fish. V. 2. P. 144–176.
WoRMS. 2019. World register of marine species. (http://www.marinespecies.org. Version 09/ 2019). https://doi.org/10.14284/170
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


