Вопросы ихтиологии, 2020, T. 60, № 3, стр. 328-335
Репродуктивная биология азиатской зубастой корюшки Osmerus dentex (Osmeridae) реки Амур
О. В. Бурлак 1, К. А. Жукова 2, *
1 Хабаровский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии − ХабаровскНИРО
Хабаровск, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
* E-mail: kzh@vniro.ru
Поступила в редакцию 12.04.2019
После доработки 09.07.2019
Принята к публикации 12.07.2019
Аннотация
Нерестовое стадо азиатской зубастой корюшки Osmerus dentex в период анадромной миграции в р. Амур представлено особями длиной 15−25 см в возрасте 3−5 полных лет, среди которых преобладают самцы (1 : 2). Гистологический анализ показал, что азиатская зубастая корюшка имеет прерывистый тип оогенеза, синхронное развитие ооцитов в период вителлогенеза и может нереститься несколько раз в жизни. Икрометание проходит единовременно и один раз в нерестовый сезон. Индивидуальная абсолютная плодовитость в разные годы варьирует в пределах 20.9−31.2 тыс. икринок, относительная плодовитость − 679−776 шт/г массы тела. Индивидуальная абсолютная плодовитость достоверно увеличивается с возрастом и размерами, у относительной плодовитости такая тенденция не отмечена.
Азиатская зубастая корюшка Osmerus dentex – арктическо-бореальный анадромный вид, обитающий у арктического и тихоокеанского побережья Северной Америки и Евразии (Берг, 1948; Клюканов, 1969, 1975; Черешнев и др., 2002). На Дальнем Востоке России основные районы воспроизводства зубастой корюшки сосредоточены на Западной и Восточной Камчатке, Сахалине, в Северном Приморье и в бассейне р. Амур (Бугаев и др., 2014).
Исследованиями репродуктивной биологии этого вида занимались многие отечественные учёные. Достаточно полно изучены особенности развития женских и мужских половых клеток, цитоморфологические изменения гонад азиатской корюшки зал. Петра Великого (Шкарина, 1979, 1984, 1991; Шкарина, Кудряева, 1991), особенности нереста и плодовитость азиатских зубастых корюшек водоёмов Чукотки (Голубь и др., 2012), Сахалина (Гриценко, 2002), Приморья (Парпура, Колпаков, 2001). Сведения по биологии азиатской зубастой корюшки р. Амур фрагментарны либо в значительной степени устарели (Берг, 1909; Воскресенский, 1946; Загороднева, 1954; Никольский, 1956; Кузнецова, 1962; Подушко, 1970, 1971; Горбачев, 1999). Не имеет однозначного ответа и вопрос о том, сколько раз в жизни нерестится корюшка р. Амур. Нерестовые отметки на её чешуе не обнаруживаются, поэтому о кратности нереста без исследований на местах нагула делать выводы затруднительно. Гистологические исследования гонад ранее не проводили. Данные об индивидуальной абсолютной и относительной плодовитости были получены в 1950−1970-х гг. (Загороднева, 1954; Никольский, 1956; Подушко, 1971).
Цель работы – изучить размерный, возрастной и половой состав нерестового стада азиатской зубастой корюшки р. Амур, оценить плодовитость, описать строение яичников и семенников, а также морфологию половых клеток.
МАТЕРИАЛ И МЕТОДИКА
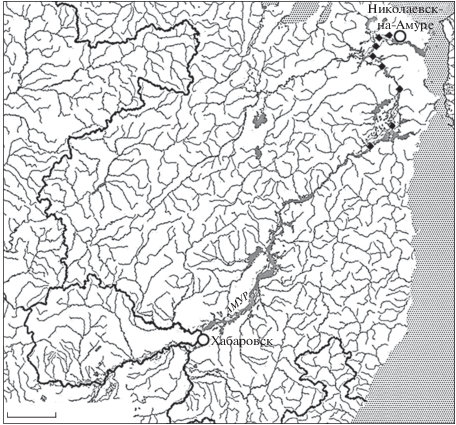
Материал собран в апреле–мае 2018 г. во время нерестового хода азиатской зубастой корюшки в нижнем течении Амура (рис. 1). В подлёдном режиме рыб отлавливали ставными неводами с шагом ячеи 10–12 мм, по открытой воде – закидными неводами с шагом ячеи 12–15 мм.
Рис. 1.
Карта-схема мест отлова (◆) азиатской зубастой корюшки Osmerus dentex в нижнем течении Амура в апреле–мае 2018 г. Масштаб: 90 км.
Биологический анализ 379 экз. выполнен по стандартной методике (Правдин, 1966): измеряли длину по Смитту (FL), массу тела (общую и без внутренностей) и гонад, определяли пол и стадию зрелости гонад, индивидуальную абсолютную (ИАП) и относительную (ОП) плодовитость. Возраст определяли по чешуе (Чугунова, 1959).
Гонадосоматический индекс (ГСИ, %) рассчитывали как отношение массы гонад к массе тела рыбы без внутренностей. ИАП и ОП определили у 67 самок с гонадами IV стадии зрелости путём пересчёта числа ооцитов в пробе на массу яичников; ОП рассчитывали относительно массы тела без внутренностей. Для сравнительного анализа использованы архивные материалы Хабаровского филиала ТИНРО (ныне ХабаровскНИРО), собранные в 2014−2017 гг. в том же районе и в схожие сроки (ИАП и ОП определены у 325 самок с гонадами IV стадии зрелости). Для оценки достоверности различий средних значений ИАП и ОП по каждому году для каждой возрастной группы использован H-критерий Краскела–Уоллиса, поскольку выборки не прошли тест Колмогорова–Смирнова на нормальность распределения.
Гонады 54 особей фиксировали в жидкости Буэна. Диаметр ооцитов (n = 1235) измеряли в фиксированных гонадах с использованием бинокуляра МБС-9 при увеличении 8 × 2. Ядерно-цитоплазматическое соотношение (ЯЦ, %) рассчитывали как отношение диаметра ядра к диаметру клетки. Гистологическую обработку проб проводили по стандартным методикам (Микодина и др., 2009). Для ксилольно-спиртовой проводки использовали автоматическую станцию Microm STP 120, заливку в парафин проводили на установке Microm EC 350-1. Срезы толщиной 3–5 мкм, сделанные на микротоме HM 440E (все приборы фирмы “Thermo Ficher Scientific Inc.”, США), последовательно окрашивали гематоксилином по Эрлиху и эозином (Роскин, 1951). Для изучения и фотосъёмки препаратов использовали световой микроскоп OLYMPUS BX45 с цифровой фотокамерой OLYMPUS DP25 (Япония). Измерения диаметра половых клеток и их структур проводили с использованием программы Image J. При исследовании яичников принята периодизация оогенеза, предложенная Чмилевским (2003); семенников – периодизация сперматогенеза костистых рыб Сакун, Буцкой (1963) и Турдакова (1972).
РЕЗУЛЬТАТЫ
В 2018 г. нерестовый ход азиатской зубастой корюшки начался во II декаде марта подо льдом, совпав с началом весеннего подъёма уровня воды. Пик нерестового хода отмечен перед распалением льда на Амуре, а окончание – спустя 3–5 сут. после ледохода, во II декаде мая.
В нерестовом стаде отмечены особи трёх возрастных групп: от 3- до 5-годовиков; доминировали 4-годовики (91.6%), доля 3-годовиков составила 1.8%, 5-годовиков – 6.6%. В младших возрастных группах (3 и 4 года) по численности преобладали самцы (60%), в группе 5-годовиков – самки (84%). Соотношение полов (самки : самцы) составило 1 : 2. Длина и масса производителей в нерестовом стаде корюшки 2018 г. приведены в табл. 1.
Таблица 1.
Размерные показатели производителей азиатской зубастой корюшки Osmerus dentex бассейна р. Амур в нерестовом стаде 2018 г.
| Показатель | Самцы (n = 217) | Самки (n = 162) | Оба пола (n = 379) |
|---|---|---|---|
| Длина (FL), см | $\frac{{18.3}}{{15.0{\kern 1pt} - {\kern 1pt} 23.6}}$ | $\frac{{19.1}}{{16.0{\kern 1pt} - {\kern 1pt} 24.8}}$ | $\frac{{18.6}}{{15.0{\kern 1pt} - {\kern 1pt} 24.8}}$ |
| Масса, г | $\frac{{46.3}}{{24.3{\kern 1pt} - {\kern 1pt} 93.2}}$ | $\frac{{53.0}}{{22.7{\kern 1pt} - {\kern 1pt} 124.5}}$ | $\frac{{49.1}}{{22.7{\kern 1pt} - {\kern 1pt} 124.5}}$ |
Примечание. Здесь и в табл. 2: над чертой – средние значение, под чертой – пределы варьирования показателя; n – число исследованных рыб, экз.
Особи обоих полов, отловленные на нерестилищах, имели гонады IV (21.7%), V (50.0%) и VI−II (28.3%) стадий зрелости. ГСИ самок с преднерестовыми гонадами варьировал в пределах 10–41 (в среднем 24)%, с посленерестовыми яичниками – 2–5 (3.5)%.
Яичники и семенники азиатской корюшки имели вид несимметричных органов, прикреплённых к дорсальной стенке полости тела с помощью мезовариев или мезорхиев. Левый яичник был в два–три раза меньше, чем правый. Большой (рис. 2а, 2б) и малый (рис. 2в) яичники имели одинаковое строение и набор половых клеток.
Рис. 2.
Большой (а, б, г) и малый яичники (в) и семенники (д, е) азиатской зубастой корюшки Osmerus dentex в преднерестовый (г, д) и посленерестовый (а–в, е) периоды: 1 – оогонии; 2, 3 – ооциты ранней и средней фаз превителлогенеза; 4 – постовуляторный фолликул; 5, 6 – фолликул поздней фазы превителлогенеза и конца вителлогенеза; 7 – сперматогонии, 8 – сперматозоиды, 9 – первичные сперматогонии, 10 – желточное ядро в цитоплазме ооцитов средней и поздней фаз превителлогенеза, 11 – липидные вакуоли, 12 − микропиле на анимальном полюсе ооцита фазы конца вителлогенеза. Масштаб: а, д, е − 50, б, в − 100, г − 200 мкм.
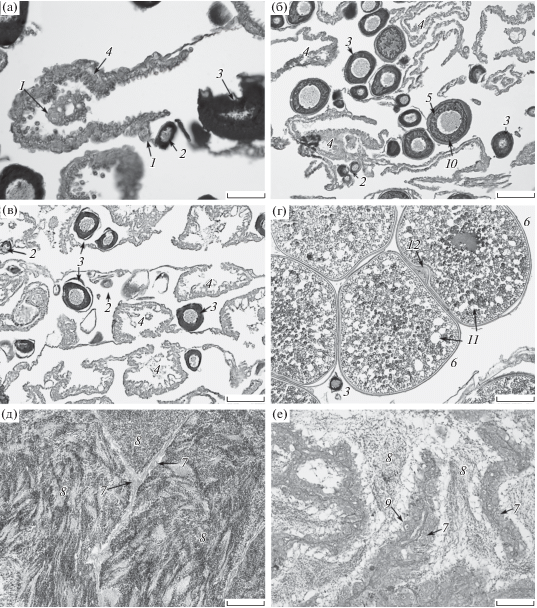
В яичниках всех исследованных самок отмечены оогонии, ооциты ранней профазы мейоза и всех фаз превителлогенеза (рис. 2а–2в). Единичные оогонии разбросаны среди соединительнотканных элементов герминального эпителия. Они сферической формы с гиалиновой ооплазмой. Диаметр оогониев варьировал от 12 до 15 мкм, ядра округлой формы диаметром 7–8 мкм с ядрышком и фибриллярным хроматином; ЯЦ 52−61%.
Ооциты ранней фазы превителлогенеза имели интенсивно окрашенную базофильную цитоплазму; вокруг ядра выделялось небольшое желточное ядро, которое представляет собой скопление РНК и органелл в цитоплазме (Макеева, 1992). Размер ооцитов составлял 21−32 мкм, ЯЦ − 50–66%. Фолликулярные клетки плоские, толщиной 1–2 мкм (рис. 2а–2в).
Ооциты средней фазы превителлогенеза крупнее – 33−92 мкм. Ооплазма окрашена базофильно, желточное ядро увеличилось в размере, прилегало к ядру и имело неровную форму. Диаметр ядра варьировал в пределах 17−54 мкм, ЯЦ – 37−53%. Фолликулярный слой состоял из плоских клеток гранулярного эпителия и васкуляризированной теки (рис. 2а–2в).
В ооцитах поздней фазы превителлогенеза желточное ядро находилось в среднем слое базофильной цитоплазмы, которая окрашена светлее. Размеры ооцитов составляли 194−248 мкм. Ядра ооцитов округлые, диаметром 93–128 мкм, ЯЦ 53–56%. Ядрышки округлой формы и разного размера ориентируются в периферической области кариоплазмы. Фолликулярный слой также представлен плоскими клетками.
В гонадах IV стадии зрелости лидирующей группой половых клеток были ооциты фазы конца вителлогенеза диаметром 715−850 мкм (рис. 2г). Ооплазма была ацидофильной, полностью заполненной округлыми желточными глобулами диаметром 9–12 мкм. Между ними по всему периметру ооцита разбросаны многочисленные липидные вакуоли разного размера – от 13 до 35 мкм. Ядро диаметром 98–107 мкм имело волнистую оболочку и центральное положение. В кариоплазме находились хромосомы типа ламповых щёток и ядрышки, которые располагались в периферических областях под оболочкой ядра. ЯЦ составляло 13–16%. Цитоплазма окружена zona radiata и хорионом. Первая имела ацидофильную окраску и радиальную исчерченность, её толщина составляла ~ 7–10 мкм. На анимальном полюсе ооцитов zona radiata утолщалась до 12–14 мкм и делала углубление внутрь цитоплазмы, образуя микропиле. Хорион на вегетативном полюсе был тоньше (4–5 мкм), чем на анимальном (>16 мкм). Фолликулярная оболочка состояла из гранулярных клеток столбчатой формы и двух слоёв плоских вытянутых клеток теки.
В яичниках после нереста кроме резервного фонда половых клеток присутствовали постовуляторные фолликулы. Такие половые железы соответствовали стадии зрелости VI−II (рис. 2а–2в).
В исследованных семенниках самцов азиатской зубастой корюшки присутствовали первичные сперматогонии, сперматогонии следующих порядков и сперматозоиды. Для первичных сперматогониев и сперматогониев первых порядков характерна светло окрашенная цитоплазма, округлое ядро с крупным ядрышком в центре кариоплазмы (рис. 2д, 2е). Размеры первичных сперматогониев варьировали в пределах 10−13 (11.2) мкм, сперматогониев следующих порядков – 6−8 (7.1) мкм. Диаметр ядер первичных сперматогониев составил 7−8 мкм, ЯЦ – 58–70 (65)%, диаметр ядер сперматогониев – 3−5 мкм, ЯЦ – 50–62 (56.5)%.
В семенниках IV стадии зрелости массы сперматозоидов, вышедшие из цист вследствие спермиации, лежали в семенных канальцах, стенки которых сильно растянуты. Головки сперматозоидов округлые размером ~1 мкм (рис. 2д). В семенниках VI−II стадии зрелости отмечены остаточные, не выметанные в текущем нерестовом сезоне спермии, которые располагались беспорядочно в семенных канальцах, где подвергались резорбции (рис. 2е).
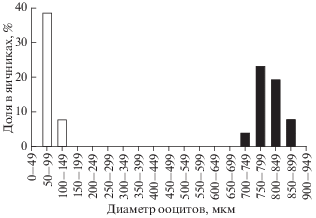
В преднерестовых яичниках выявлены две группы половых клеток, различающиеся по размеру: мелкие ооциты периода превителлогенеза диаметром 50–107 мкм и крупные ооциты фазы конца вителлогенеза диаметром 715–881 мкм (рис. 3). Первая группа представляла собой резервный фонд половых клеток, а вторая – расходный фонд, который должен быть выметан в 2018 г.
Рис. 3.
Размерный состав ооцитов в яичниках в преднерестовый период у самок азиатской зубастой корюшки Osmerus dentex. Диаметр ооцитов измерен по фиксированному материалу (n = 1235 ооцитов): (◻) – превителлогенные ооциты, (◼) – ооциты фазы конца вителлогенеза.
Самые высокие значения ИАП и ОП отмечены в 2015 г. у 5-летних особей − поколение 2010 г. рождения (табл. 2). В 2014−2018 гг. ИАП азиатской корюшки нерестового стада статистически отличалась внутри возрастных групп 3 и 4 года, ОП – только внутри возрастной группы 4 года. За все годы исследования отмечены статистические различия ИАП у особей разных возрастных групп (р < 0.001), тогда как различия ОП недостоверны.
Таблица 2.
Индивидуальная абсолютная и относительная плодовитость азиатской зубастой корюшки Osmerus dentex бассейна р. Амур в разных возрастных группах в 2014–2018 гг.
| Возраст, лет | Год | n | H | ||||
|---|---|---|---|---|---|---|---|
| 2014 | 2015 | 2016 | 2017 | 2018 | |||
| Индивидуальная абсолютная плодовитость, тыс. икринок | |||||||
| 2 | $\frac{{6.0{\text{ (1)}}}}{{6.0}}$ | 1 | |||||
| 3 | $\frac{{24.3{\text{ }}\left( {37} \right)}}{{15.2{\kern 1pt} --{\kern 1pt} 38.6}}$ | $\frac{{27.6{\text{ }}\left( {27} \right)}}{{17.3{\kern 1pt} --{\kern 1pt} 57.7}}$ | $\frac{{26.1{\text{ }}\left( {20} \right)}}{{6.5{\kern 1pt} --{\kern 1pt} 42.8}}$ | $\frac{{16.0{\text{ }}\left( {52} \right)}}{{8.9{\kern 1pt} --{\kern 1pt} 35.4}}$ | 136 | 78.9* | |
| 4 | $\frac{{33.8{\text{ }}\left( {24} \right)}}{{23.0{\kern 1pt} --{\kern 1pt} 48.1}}$ | $\frac{{31.6{\text{ }}\left( {39} \right)}}{{18.1{\kern 1pt} --{\kern 1pt} 60.3}}$ | $\frac{{35.0{\text{ }}\left( {29} \right)}}{{25.8{\kern 1pt} --{\kern 1pt} 46.7}}$ | $\frac{{24.4{\text{ }}\left( {63} \right)}}{{10.5{\kern 1pt} --{\kern 1pt} 54.3}}$ | $\frac{{24.7{\text{ }}\left( {58} \right)}}{{12.7{\kern 1pt} --{\kern 1pt} 39.6}}$ | 213 | 61.4* |
| 5 | $\frac{{51.9{\text{ }}\left( 4 \right)}}{{34.0{\kern 1pt} --{\kern 1pt} 79.2}}$ | $\frac{{44.2{\text{ }}\left( 2 \right)}}{{41.8{\kern 1pt} --{\kern 1pt} 46.5}}$ | $\frac{{37.8{\text{ }}\left( 2 \right)}}{{19.6{\kern 1pt} --{\kern 1pt} 56.1}}$ | $\frac{{35.6{\text{ }}\left( 9 \right)}}{{27.6{\kern 1pt} --{\kern 1pt} 57.4}}$ | 17 | 4.2 | |
| 2−5 | $\frac{{28.0{\text{ }}\left( {61} \right)}}{{15.2{\kern 1pt} --{\kern 1pt} 48.1}}$ | $\frac{{31.2{\text{ }}\left( {70} \right)}}{{13.3{\kern 1pt} --{\kern 1pt} 79.2}}$ | $\frac{{31.4{\text{ }}\left( {52} \right)}}{{6.5{\kern 1pt} --{\kern 1pt} 46.7}}$ | $\frac{{20.9{\text{ }}\left( {117} \right)}}{{8.9{\kern 1pt} --{\kern 1pt} 56.1}}$ | $\frac{{26.2{\text{ }}\left( {67} \right)}}{{12.7{\kern 1pt} --{\kern 1pt} 57.4}}$ | 367 | 81.1* |
| Относительная плодовитость, шт/г массы тела без внутренностей | |||||||
| 2 | $\frac{{415}}{{415}}$ | 1 | |||||
| 3 | $\frac{{758}}{{511{\kern 1pt} --{\kern 1pt} 964}}$ | $\frac{{811}}{{483{\kern 1pt} --{\kern 1pt} 1410}}$ | $\frac{{707}}{{472{\kern 1pt} --{\kern 1pt} 1072}}$ | $\frac{{739}}{{493{\kern 1pt} --{\kern 1pt} 1047}}$ | 136 | 3.6 | |
| 4 | $\frac{{762}}{{575{\kern 1pt} --{\kern 1pt} 1026}}$ | $\frac{{747}}{{511{\kern 1pt} --{\kern 1pt} 1214}}$ | $\frac{{704}}{{466{\kern 1pt} --{\kern 1pt} 965}}$ | $\frac{{785}}{{547{\kern 1pt} --{\kern 1pt} 1225}}$ | $\frac{{670}}{{423{\kern 1pt} --{\kern 1pt} 1035}}$ | 213 | 19.2* |
| 5 | $\frac{{826}}{{625{\kern 1pt} --{\kern 1pt} 1217}}$ | $\frac{{764}}{{739{\kern 1pt} --{\kern 1pt} 789}}$ | $\frac{{727}}{{719{\kern 1pt} --{\kern 1pt} 736}}$ | $\frac{{736}}{{538{\kern 1pt} --{\kern 1pt} 998}}$ | 17 | 0.7 | |
| 2−5 | $\frac{{763}}{{511{\kern 1pt} --{\kern 1pt} 1026}}$ | $\frac{{776}}{{483{\kern 1pt} --{\kern 1pt} 1014}}$ | $\frac{{702}}{{466{\kern 1pt} --{\kern 1pt} 1072}}$ | $\frac{{750}}{{493{\kern 1pt} --{\kern 1pt} 1225}}$ | $\frac{{679}}{{423{\kern 1pt} --{\kern 1pt} 1035}}$ | 367 | 20.3* |
Примечание. Н − H-критерий Краскела−Уоллиса; над чертой в скобках – число самок; * различия достоверны при р < 0.001; ост. обозначения см. в табл. 1.
ИАП увеличивается с размерами рыб и описывается линейным уравнением: ИАП = 5.6962FL – 80.886, R2 = 0.6. ИАП и ОП коррелируют с ГСИ самок, но достаточно слабо: R2 = 0.3 для ИАП, R2 = 0.4 для ОП.
ОБСУЖДЕНИЕ
Сроки начала нерестовой миграции азиатской зубастой корюшки в бассейне р. Амур зависят от начала весеннего подъёма уровня воды, а окончание нерестового хода совпадает с понижением уровня воды в Амуре после ледохода (Подушко, 1970). Анадромные миграции в р. Амур начинаются во второй половине апреля и заканчиваются в начале мая. По реке производители поднимаются на расстояние > 230 км от устья, до с. Мариинское. Массовое половое созревание происходит в возрасте 3–4 года. Нерест приходится на май. Отнерестившиеся особи скатываются в Амурский лиман и далее мигрируют в Охотское море (Подушко, 1971; Горбачев, 1999). В 2018 г. массовое половое созревание было отмечено у поколения 2014 г. рождения (4 года), встречаемость 3-годовиков в уловах составила <2%. По данным Подушко (1971), половой зрелости азиатская зубастая корюшка р. Амур достигает в возрасте 3 года при FL > 15 см, в редких случаях в нересте участвуют особи FL 9 см.
Преобладание самцов в нерестовой части популяции азиатской корюшки характерно как для р. Амур, так и для других водоёмов Дальнего Востока, при этом в течение нереста половой состав уловов может меняться (Парпура, Семенченко, 1989; Василец, 2000; Гриценко, 2002; Голубь и др., 2012). Преобладание самок в старших возрастных группах согласуется с мнением о том, что жизненный цикл самцов короче (Подушко, 1970).
Асимметрия половых органов отмечена как для азиатской корюшки разных регионов (Подушко, 1970; Голубь и др., 2012), так и для других представителей рода Osmerus (Дрягин, 1948; Суворов, 1948; Legault, Delisle, 1968).
По данным Никольского (1956) и Подушко (1971), основная масса особей азиатской корюшки в Амуре нерестятся один–два раза в жизни. По материалам Кузнецовой (1962), большинство самок азиатской корюшки р. Амур нерестятся, по меньшей мере, три раза в жизни. Результаты гистологических исследований подтвердили, что азиатская зубастая корюшка относится к полициклическим видам. В гонадах всех исследованных самок присутствуют оогонии, ооциты ранней профазы мейоза и периода превителлогенеза, которые относятся к резервному фонду половых клеток. Во всех исследованных семенниках обнаружены первичные сперматогонии. Это указывает на то, что такие рыбы принимают участие в нересте несколько раз в жизни (Макеева, 1992; Чмилевский, 2017). Наличие двух групп ооцитов, различающихся по размеру, в преднерестовых яичниках показало, что для азиатской корюшки характерен прерывистый тип оогенеза (Götting, 1961; Овен, 1976). Развитие ооцитов в период вителлогенеза было синхронным, икрометание проходило единовременно и один раз в нерестовый сезон. Сходные репродуктивные характеристики отмечены у кумжи Salmo trutta, атлантического лосося Salmo salar, гольцов рода Salvelinus, морских окуней рода Sebastes, удильщиков рода Lophius, окуня Perca fluviatilis, щуки Esox lucius, атлантической сельди Clupea harengus (Макеева, 1992; Murua, Saborido-Rey, 2003; Тиллер, 2007; Pavlov et al., 2009).
Гистологическое строение гонад исследованных азиатских зубастых корюшек р. Амур имеет много общих черт с таковым корюшек зал. Петра Великого (Шкарина, Кудряева, 1991): ооциты разных фаз развития имеют сходные размеры; в ооцитах фазы конца вителлогенеза присутствуют многочисленные крупные липидные вакуоли, закладка которых начинается в околоядерной области ооцита в фазе вакуолизации цитоплазмы. Хорион обособлен от zona radiata и срастается с ней только в области микропиле. На вегетативном полюсе ооцита толщина хориона в три раза меньше, это обусловлено тем, что после попадания овулировавшей икры в воду хорион на вегетативном полюсе разрывается, сползает, выворачивается, прикрепляясь к субстрату. В результате этого икринки находятся в приподнятом над поверхностью субстрата состоянии. Такой способ прикрепления икры к субстрату характерен и для других видов семейства Osmeridae (Шадрин, 1989). Толщина zona radiata и наличие хориона соответствуют таковым у представителей семейств Osmeridae, Salmonidae, Pleuronectidae, Hexagrammidae, Hemitripteridae, Cottidae и Clupeidae, откладывающих клейкую икру на субстрат (Warfel, Merriman, 1944; Иванков, Курдяева, 1973; Stehr, Hawkes, 1979; Маркевич, 2000; Колпаков, Долганова, 2006; TenBrink, Buckley, 2013; Юсупов, Санталова, 2016).
ИАП и ОП азиатской зубастой корюшки варьируют в разные годы. Чётко прослеживается тенденция увеличения ИАП самок с возрастом и размерами. Возрастные изменения ОП не столь закономерны. В 2014−2018 гг. изменений ОП с возрастом не наблюдалось. В 2017 и 2018 гг. была отмечена пониженная ИАП одновозрастных самок по сравнению с другими годами во всех возрастных классах. Вероятно, это могло быть связано с недостаточной кормовой базой и другими факторами, влияющими на нагул. В целом в 2014−2018 гг. ИАП и ОП соответствуют данным, полученным ранее в р. Амур (Загороднева, 1954; Никольский, 1956; Подушко, 1971), водоёмах Сахалина (Гриценко, 2002), Приморья (Парпура, Колпаков, 2001) и большинства рек Чукотки, за исключением р. Хатырка, где плодовитость азиатской зубастой корюшки в пять раз выше (Голубь и др., 2012). Повышенная ИАП в этом районе, вероятно, связана с более крупными размерами нерестящихся особей (FL 25−35 см).
Результаты нашей работы подтвердили неоднократность нереста данного вида. Цитология и морфология гонад в целом оказались схожими с таковыми у азиатской зубастой корюшки, обитающей в других регионах Дальнего Востока. Анализ репродуктивных параметров не выявил значительных изменений ИАП и ОП по сравнению с 1950−1970-ми гг., что может говорить об относительно стабильном состоянии популяции азиатской зубастой корюшки р. Амур.
Список литературы
Берг Л.С. 1909. Рыбы бассейна Амура // Зап. Императ. АН. Т. 24. № 9. 270 с.
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Ч. 1. М.; Л.: Изд-во АН СССР, 466 с.
Бугаев А.В., Амельченко Ю.Н., Липнягов С.В. 2014. Азиатская зубастая корюшка Osmerus mordax dentex в шельфовой зоне и внутренних водоемах Камчатки: состояние запасов, промысел и биологическая структура // Изв. ТИНРО. Т. 178. С. 3–24.
Василец П.М. 2000. Корюшки прибрежных вод Камчатки: Автореф дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 24 с.
Воскресенский Н.А. 1946. Промысловая характеристика некоторых рыб Амура // Рыб. хоз-во. № 7. С. 23.
Голубь Е.В., Батанов Р.Л., Голубь А.П. 2012. Материалы по биологии азиатской корюшки Оsmerus mordax dentex (Оsmeridae) из водоемов Чукотки // Вестн. СВНЦ ДВО РАН. № 2. С. 50–62.
Горбачев В.А. 1999. Биологическая характеристика нерестового стада азиатской корюшки Osmerus mordax бассейна Амура в 1996−1998 гг. // Тез. докл. конф. “Биомониторинг и рациональное использование морских и пресноводных гидробионтов”. Владивосток: Изд-во ТИНРО-центр. С. 25–26.
Гриценко О.Ф. 2002. Проходные рыбы острова Сахалин (систематика, экология, промысел). М.: Изд-во ВНИРО, 248 с.
Дрягин П.А. 1948. Промысловые рыбы Обь-Иртышского бассейна // Изв. ВНИОРХ. Т. 25. Вып. 2. С. 3–104.
Загороднева Д.С. 1954. Плодовитость жилых рыб реки Амура: Автореф. дис. … канд. биол. наук. Томск: ТГУ, 14 с.
Иванков В.Н., Курдяева В.П. 1973. Систематические различия и экологическое значение строения оболочек яйцеклеток рыб // Вопр. ихтиологии. Т. 13. № 6. С. 1035−1045.
Клюканов В.А. 1969. Морфологические основы систематики корюшек рода Osmerus // Зоол. журн. Т. 48. Вып. 1. С. 99–109.
Клюканов В.А. 1975. Систематика и родственные отношения корюшек родов Osmerus и Hypomesus и их расселение // Там же. Т. 54. Вып. 4. С. 590–596.
Колпаков Н.В., Долганова Н.Т. 2006. Данные по биологии трехлопастного бычка Blepsias cirrhosus (Hemitripteridae) прибрежных вод северного Приморья // Вопр. ихтиологии. Т. 46. № 4. С. 519–524.
Кузнецова А.Ф. 1962. Новые данные об азиатской корюшке Osmerus eperlanus dentex Steindachner // Изв. ТИНРО. Т. 48. С. 214–215.
Макеева А.П. 1992. Эмбриология рыб. М.: Изд-во МГУ, 216 с.
Маркевич А.И. 2000. Размножение костистой рыбы Hemitripterus villosus в заливе Петра Великого Японского моря // Биология моря. Т. 26. № 4. С. 272–274.
Микодина Е.В., Седова М.А., Чмилевский Д.А. и др. 2009. Гистология для ихтиологов. Опыт и советы. М.: Изд-во ВНИРО, 111 с.
Никольский Г.В. 1956. Рыбы бассейна Амура. Итоги Амурской ихтиологической экспедиции 1945–1949 гг. М.: Изд-во АН СССР, 551 с.
Овен Л.С. 1976. Особенности оогенеза и характер нереста морских рыб. Киев: Наук. думка, 131 с.
Парпура И.З., Колпаков В.Н. 2001. Биология и внутренняя дифференциация корюшек Приморья // Чтения памяти В.Я. Леванидова. Вып. 1. С. 284–295.
Парпура И.З., Семенченко А.Ю. 1989. Фауна и биология рыб Северного Приморья // Систематика и экология речных организмов. Владивосток: Изд-во ТИНРО. С. 120–137.
Подушко Ю.Н. 1970. Биологическая характеристика азиатской корюшки Osmerus eperlanus dentex Steindachner в низовьях Амура // Изв. ТИНРО. Т. 74. С. 130–138.
Подушко Ю.Н. 1971. Динамика плодовитости азиатской корюшки Osmerus eperlanus dentex Steindachner и определяющие ее факторы // Там же. Т. 79. С. 72–83.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Роскин Г.И. 1951. Микроскопическая техника. М.: Сов. наука, 447 с.
Сакун О.Ф., Буцкая Н.А. 1963. Определение стадий зрелости и изучение половых циклов рыб. М.: Знание, 36 с.
Суворов Е.К. 1948. Основы ихтиологии. Л.: Сов. наука, 579 с.
Тиллер И.В. 2007. Проходная мальма (Salvelinus malma) Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 9. С. 79–95.
Турдаков А.Ф. 1972. Воспроизводительная система самцов рыб. Фрунзе: Илим, 280 с.
Черешнев И.А., Волобуев В.В., Шестаков А.В. и др. 2002. Лососевидные рыбы северо-востока России. Владивосток: Дальнаука, 491 с.
Чмилевский Д.А. 2003. К вопросу о периодизации оогенеза костистых рыб (обзор) // Вопр. ихтиологии. Т. 43. № 3. С. 375–387.
Чмилевский Д.А. 2017. Оогенез рыб в норме и при экстремальных воздействиях. СПб.: Изд-во СПбГУ, 156 с.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. М.: Изд-во АН СССР, 164 с.
Шадрин А.М. 1989. Эмбрионально-личиночное развитие корюшковых (Osmeridae) Дальнего Востока. III. Морская малоротая корюшка Hypomesus japonicus // Вопр. ихтиологии. Т. 29. Вып. 2. С. 289–301.
Шкарина Т.В. 1979. Гаметогенез, половые циклы и биологическая характеристика нерестовых скоплений дальневосточных корюшек рода Osmerus и рода Hypomesus: Автореф. дис. … канд. биол. наук. Л.: ЛГУ, 23 с.
Шкарина Т.В. 1984. Сперматогенез и половой цикл самцов азиатской и малоротой корюшек (Osmeridae) // Биология проходных рыб Дальнего Востока. Владивосток: Изд-во ДВГУ. С. 79–85.
Шкарина Т.В. 1991. Биология тихоокеанской корюшки Osmerus mordax dentex Южного Приморья // Биология рыб и беспозвоночных северной части Тихого океана. Владивосток: Изд-во ДВГУ. С. 77−84.
Шкарина Т.В., Кудряева В.П. 1991. Цитоморфологические изменения яичников азиатской корюшки Osmerus mordax dentex Steind. Залива Петра Великого в различные сезоны года // Там же. С. 98−104.
Юсупов Р.Р., Санталова М.Ю. 2016. Репродуктивная биология и развитие тихоокеанской мойвы Mallotus villosus catervarius Тауйской губы (северная часть Охотского моря) // Изв. ТИНРО. Т. 185. С. 49–66.
Götting K.J. 1961. Beiträge zur Kenntnis der Grundlagen der Fortpflanzung und zur Fruchtbarkeits-bestimmung bei marinen Teleosteern // Helgol. Wiss. Meeresunters. Bd. 8. № 1. S. 1−43.
Legault R.O., Delisle C. 1968. La fraye d’une population d’éperlans géants, Osmerus eperlanus mordax, au lac Heney, Comté de Gatineau, Québec // J. Fish. Res. Board Canada. V. 25. № 9. P. 1813-1830. https://doi.org/10.1139/f68-167
Murua H., Saborido-Rey F. 2003. Female reproductive strategies of marine fish species of the North Atlantic // J. Northw. Atl. Fish. Sci. V. 33. P. 23–31. https://doi.org/10.2960/J.v33.a2
Pavlov D.A., Emel’yanova N.G., Novikov G.G. 2009. Reproductive dynamics // Fish reproductive biology: implications for assessment and management / Eds. Jakobsen T. et al. Oxford: Blackwell Publ. Ltd. P. 48−90.
Stehr C.M., Hawkes J.W. 1979. The comparative ultrastructure of the egg membrane and associated pore structures in the starry flounder, Platichthys stellatus (Pallas), and pink salmon, Oncorhynchus gorbuscha (Walbaum) // Cell Tiss. Res. V. 202. P. 347–356. https://doi.org/10.1007/BF00220430
TenBrink T.T., Buckley T.W. 2013. Life history aspects of the yellow Irish lord, (Hemilepidotus jordani) in the eastern Bering Sea and Aleutian Islands // Northw. Naturalist. V. 94. P. 126–136. https://doi.org/10.1898/12-33.1
Warfel H.E., Merriman D. 1944. The spawning habits, eggs, and larvae of the sea raven, Hemitripterus americanus in Southern New England // Copeia. № 4. P. 197–205. https://doi.org/10.2307/1438673
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


