Вопросы ихтиологии, 2020, T. 60, № 3, стр. 309-316
Возраст и рост атерины Atherina boyeri (Atherinidae) из акватории Юго-Западного Крыма (Чёрное море)
Д. Н. Куцын 1, *, Ю. В. Самотой 1
1 Институт биологии южный морей РАН – ИнБЮМ РАН
Республика Крым, Севастополь, Россия
* E-mail: makaira88@gmail.com
Поступила в редакцию 22.05.2019
После доработки 17.07.2019
Принята к публикации 17.07.2019
Аннотация
Изучена размерно-возрастная структура и рост атерины Atherina boyeri из акватории Юго-Западного Крыма. Соотношение самцов и самок составляет 1.00 : 1.38; доля самцов снижается в старших возрастных группах; предельный возраст у обоих полов – 4 года. Удельная скорость роста закономерно снижается с 2.29 на 1-м году жизни до 0.25 на 2-м и до 0.10 на – 4-м. Максимальная длина и масса самок больше, чем самцов (12.3 см и 9.25 г против 10.8 см и 7.65 г). Установлено, что темп роста атерины из акватории Юго-Западного Крыма выше, чем у эстуарных и лагунных форм, обитающих в условиях лабильной солёности, но ниже, чем у морских и океанических.
Атерина Atherina boyeri – короткоцикличный эвригалинный вид, широко распространённый и многочисленный в морях Средиземноморского бассейна, встречается в Северо-Восточной Атлантике, от Азорских о-вов до берегов Голландии и северо-западного побережья Шотландии (Quignard, Pras, 1986). Населяет главным образом прибрежные и эстуарные морские воды, лагуны, реже внутренние водоёмы, от пресных до солёных; пелагический планктофаг. В Чёрном и Азовском морях нерестится с мая по август. В Средиземном море промысловый вид; в Чёрном и Азовском морях, несмотря на высокую численность, специализированный промысел не развит (Световидов, 1964).
В пределах средиземноморской и восточноатлантической частей ареала A. boyeri активно изучается. Имеются сведения о размерно-возрастных характеристиках, росте и воспроизводстве атерины турецкого (Gurkan et al., 2010; Ilhan, Ilhan, 2018), греческого (Leonardos, Sinis, 2000) побережий Средиземного моря, португальского (Pombo et al., 2005) и испанского (Fernández-Delgado et al., 1988) побережий Атлантики, пролива Ла-Манш (Henderson, Bamber, 1987) и прибрежных вод Западной Англии и Шотландии (Creech, 1992). Опубликован ряд работ по биологии атерин из внутренних водоёмов: Аральскогого (Маркевич, 1977) и Каспийского (Patimar et al., 2009; Устарбекова, Джабраилов, 2012) морей, озёр Турции (Özeren, 2009) и Греции (Leonardos, 2001). При этом биология атерины Чёрного моря изучена крайне слабо: имеются некоторые сведения о росте, возрасте, питании и воспроизводстве (Ткачева, 1950), а также данные о распространении и биологии A. boyeri северо-западной части Черного моря (Солис, 1987).
Отдельной проблемой является таксономический статус A. boyeri. В современных каталогах и списках видов для Чёрного моря приводятся два вида атерин – A. hepsetus и A. boyeri (Васильева, 2007). Валидность первого не вызывает сомнений, а видовая принадлежность представителей локальных популяций, включаемых в A. boyeri, остаётся дискуссионным вопросом. Вероятно, в пределах бассейна Чёрного моря обитает до трёх криптических видов, обнаруживающих высокий уровень генетической дивергенции, с одной стороны, и ту или иную степень перекрывания морфологических признаков – с другой (Васильева, 2017). В этой связи следует уточнить, что объектом текущего исследования являлась атерина, характеризующаяся отсутствием капсуловидных расширений гемальных дуг, числом жаберных тычинок на 1-й жаберной дуге > 30. Данная форма может быть идентифицирована как A. bonapartei (Мешков, 1941; Драпкин, 1968) или как A. mochon (Васильева, 2017). В то же время, согласно современным таксономическим представлениям (Fricke et al., 2019), A. bonapartei и A. mochon являются синонимами A. boyeri.
Исходя из малоизученности A. boyeri Чёрного моря и её потенциальной промысловой значимости (в качестве сырья для производства рыбной муки и в других технических целях), изучение её возраста и роста видится актуальной проблемой, особенно в контексте климатических изменений и увеличения антропогенной нагрузки на экосистемы. Изучение географической изменчивости биологических показателей атерины в связи с гидрометеорологическими условиями может оказаться весьма информативным в выявлении основных закономерностей её адаптации.
Цель работы – изучить размерно-возрастной состав и закономерности роста A. boyeri Чёрного моря, а также проанализировать географическую изменчивость её биологических особенностей в связи с условиями обитания.
МАТЕРИАЛ И МЕТОДИКА
Рыб отлавливали в бухтах Казачья, Стрелецкая, Севастопольская и в районе м. Толстый (рис. 1) в феврале–мае 2012–2018 гг. ставными неводами (ячея сетного полотна 6 мм), выставляемыми на глубине 12−15 м. Всех рыб (1188 экз.) подвергали полному биологическому анализу согласно стандартным методикам (Правдин, 1966). Общую длину (TL) измеряли с точностью до 0.1 см, массу – до 0.01 г. Возраст определяли по отолитам. Годовым кольцом считали границу между внутренним краем широкой опаковой (светлой в отражённом свете) зоны летнего прироста и внешним краем узкой гиалиновой (тёмной в отражённом свете) зоны зимнего прироста.
Для анализа линейного и весового роста применяли уравнения Берталанфи (Bertalanffy, 1938; Мина, Клевезаль, 1976): L = L∞(1 – e–k(t–t0)) и W = = W∞(1 – e–k(t–t0))b, где L∞ − асимптотическая длина, W∞ − асимптотическая масса; k – константа, характеризующая скорость приближения L к L∞; t0 – возраст рыбы, когда её длина и масса в рассматриваемой модели равны 0; b – показатель степени в зависимости массы от длины (W = aLb). Удельную скорость роста определяли по формуле Шмальгаузена–Броди (Мина, Клевезаль, 1976): C = (lgL2 – ‒ lgL1)/0.4343Δt, где L2 – длина рыбы в конце наблюдения, L1– длина в начале наблюдения, Δt – период наблюдения. Рассчитывали индекс роста для линейных размеров и массы (Pauly et al., 1988): φ = lg k + 2 lg L∞ и φ' = lg k + (2 lg W∞)/3. В основу расчётов положены наблюдённые значения размеров.
При описании размерно-возрастной структуры использовали следующие статистические критерии: для проверки нормальности распределения − W-критерий Шапиро−Уилка, для оценки различий длины и массы в выборках самок и самцов − U-критерий Манна−Уитни, для оценки соотношения полов − χ2-тест. Статистический анализ выполнен с применением программных пакетов MS Excel и Statistica 12.
РЕЗУЛЬТАТЫ
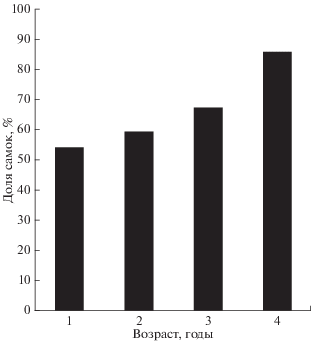
Общее соотношение самцов и самок составляет 1.00 : 1.38, отличия от 1 : 1 статистически значимы (χ2-тест, df = 1, p < 0.05). Половой состав меняется в старших возрастных группах. Доля самцов на первом году жизни составляет 46%, затем сокращается до 33% к третьему году и до 14% – к концу жизненного цикла (рис. 2).
Рис. 2.
Доля самок в разных возрастных группах атерины Atherina boyeri на акватории Юго-Западного Крыма.
Длина самок в уловах варьирует в пределах 5.4–12.3 (8.45 ± 0.04) см, самцов – 5.3–10.8 (8.22 ± ± 0.04) см (рис. 3а). Распределение по линейным размерам у самок в уловах отличается от нормального (W-критерий, n = 687, p < 0.05), у самцов − близко к нормальному (W-критерий, n = 501, p = = 0.07). Различия между средней длиной самок и самцов статистически достоверны (U-критерий, nf = 687, nm = 501, p < 0.05), что связано с преобладанием самок в старших возрастных группах. Для обоих полов средняя длина составляет 8.26 ± 0.02 см (n = 1188).
Рис. 3.
Размерно-возрастной состав уловов атерины Atherina boyeri у юго-западного побережья Крыма: а – длина (TL), б – масса, в – возраст; (◼) − самки, (◻) − самцы, ( ) − оба пола.
) − оба пола.
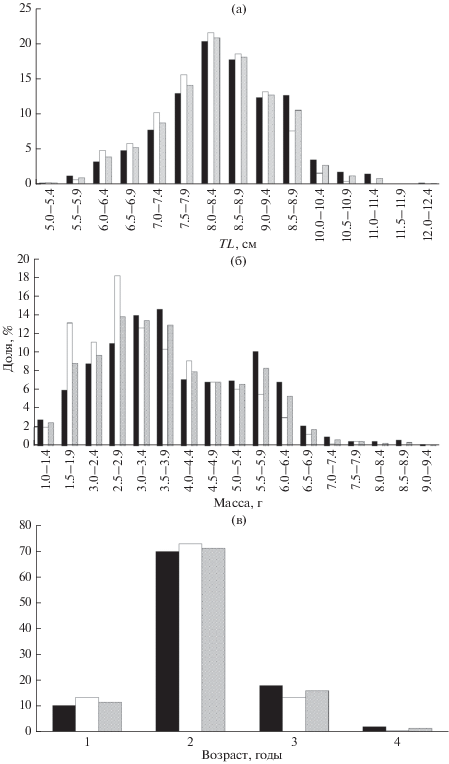
Масса самок варьирует в пределах 1.06–9.25 (4.01 ± 0.06) г, самцов – 0.99–7.65 (3.47 ± 0.07) г (рис. 3б). Распределение по массе как самок, так и самцов отличается от нормального (W-критерий, nf = 602, nm = 396, p < 0.01). Различия средней массы самок и самцов достоверны (U-критерий, nf = 602, nm = 396, p < 0.01). Для обоих полов средняя масса составляет 3.77 ± 0.05 (n = 998).
Максимальный возраст у обоих полов составляет 4 года (рис. 3в). К трём годам погибает 82% половозрелых самцов и несколько меньше (74%) самок, что обусловливает преобладание последних.
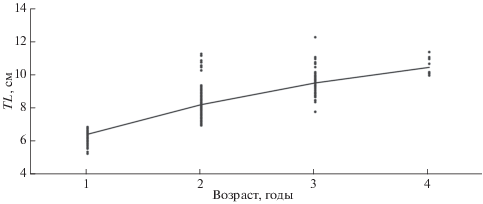
По наблюдённым данным, рост атерины характеризуется двумя этапами. На первом, в течение 1-го года жизни, темп роста наиболее высокий, и к началу 2-го года, когда наступает половое созревание, особи обоих полов достигают в среднем TL 6.40 см и массы 1.79 г (табл. 1). Удельная скорость роста на данном этапе составляет 2.29. После полового созревания начинается второй этап, который характеризуется линейно замедляющимся ростом и близким к изометрическому набором массы (b = 2.89 в уравнении зависимости массы от длины для обоих полов), и к концу жизненного цикла, в возрасте 4 года, атерина достигает TL 10.54 см и массы 6.93 г. Удельная скорость роста на втором этапе закономерно снижается с 0.25 на 2-м году жизни до 0.10 на 4-м.
Таблица 1.
Длина (TL) и масса атерины Atherina boyeri разных возрастных групп из акватории Юго-Западного Крыма (M ± S.E.)
| Возраст, годы | Самцы | Самки | Оба пола | ||||||
|---|---|---|---|---|---|---|---|---|---|
| TL, см | Масса, г | n, экз. | TL, см | Масса, г | n, экз. | TL, см | Масса, г | n, экз. | |
| 1 | 6.40 ± 0.05 | 1.74 ± 0.04 | 51 | 6.40 ± 0.05 | 1.83 ± 0.05 | 60 | 6.40 ± 0.03 | 1.79 ± 0.03 | 111 |
| 2 | 8.13 ± 0.04 | 3.38 ± 0.06 | 276 | 8.26 ± 0.04 | 3.71 ± 0.06 | 402 | 8.21 ± 0.03 | 3.57 ± 0.04 | 678 |
| 3 | 9.47 ± 0.06 | 5.49 ± 0.11 | 51 | 9.63 ± 0.06 | 5.81 ± 0.09 | 104 | 9.57 ± 0.04 | 5.70 ± 0.07 | 156 |
| 4 | 10.20 ± 0.18 | 6.48 ± 0.20 | 2 | 10.60 ± 0.16 | 7.00 ± 0.35 | 12 | 10.54 ± 0.14 | 6.93 ± 0.31 | 14 |
Функция Форда−Уолфорда (Walford, 1946) для обоих полов имеет вид: L(t + 1) = 0.72Lt + 3.61 (R2 = = 0.997), а её значение в точке пересечения с прямой L(t + 1)= Lt близко к расчётным L∞ и составляет 12.97 см, что указывает на высокую достоверность аппроксимации эмпирической кривой роста уравнением Берталанфи (табл. 2). Межполовые различия значений коэффициентов уравнения Берталанфи и индексов роста выражены слабо. Для атерины характерно высокое значение параметра k = 0.32, свойственное для короткоцикличных рыб, и в соответствии с которым 50%-ной предельной длины особи A. boyeri достигают уже к концу первого года жизни. Кривая, описывающая линейный рост атерины для обоих полов по уравнению Берталанфи, представлена на рис. 4.
Таблица 2.
Коэффициенты уравнений Берталанфи, зависимости длина–масса и индексы роста атерины Atherina boyeri из разных частей ареала
| Регион | Пол | L∞, см | k, год–1 | W∞, г | a | b | t0, год | φ | φ′ | Источник информации |
|---|---|---|---|---|---|---|---|---|---|---|
| Чёрное море, Юго-Западный Крым | Самки | 13.04 | 0.33 | 5.96 | 0.0090 | 2.81 | –0.21 | 1.75 | 0.26 | Наши данные |
| Самцы | 12.05 | 0.37 | 5.36 | 0.0070 | 2.95 | –0.29 | 1.73 | 0.26 | ||
| Оба пола | 12.99 | 0.32 | 5.69 | 0.0080 | 2.89 | –0.27 | 1.73 | 0.26 | ||
| Лагуна Риа де Авейро, Западная Португалия | То же | 11.60 | 0.10 | 0.0031 | 3.35 | –3.80 | 1.12 | Pombo et al., 2005 | ||
| Лагуны Месолонги и Этоликон, Западная Греция | » | 11.58 | 0.24 | 0.0042 | 3.15 | –1.27 | 1.51 | Leonardos, Sinis, 2000 | ||
| Эгейское море, Измирский залив | » | 13.45 | 0.23 | 0.0052 | 3.08 | –1.89 | 1.62 | Sezen, 2005 | ||
| Система эстуариев оз. Вистонис, Северная Греция | Самки | 16.65 | 0.16 | –1.90 | 1.65 | Koutrakis et al., 2004 | ||||
| Самцы | 12.81 | 0.26 | –1.64 | 1.63 | ||||||
| Оба пола | 11.70 | 0.35 | 3.22 | –0.99 | 1.68 | |||||
| Озеро Трихонис, Греция | То же | 11.24 | 0.42 | 3.18 | –0.40 | 1.72 | Leonardos, 2001 | |||
| Озеро Изник, Турция | » | 14.11 | 0.27 | 0.0040 | 3.21 | –0.49 | 1.73 | Özeren, 2009 | ||
| Лагуна Мар Менор, юго-восток Иберийского п-ова | Самки | 8.46 | 0.81 | 3.04 | –0.65 | 1.76 | Andreu-Soler et al., 2003 | |||
| Самцы | 8.19 | 0.91 | 3.11 | –0.45 | 1.79 | |||||
| Адриатическое море, восточная часть | Самки | 10.58 | 1.19 | 0.006 | 2.12 | Bartulovic et.al., 2004 | ||||
| Самцы | 9.91 | 0.97 | –0.19 | 1.98 | ||||||
| Оба пола | 13.50 | 0.37 | –0.97 | 1.83 | ||||||
| Каспийское море, юго-восточная часть | Самки | 16.28 | 0.27 | 0.0053 | 3.06 | –0.73 | 1.85 | Patimar et al., 2009 | ||
| Самцы | 15.52 | 0.28 | 0.0050 | 3.02 | –0.74 | 1.83 | ||||
| Ла Манш | Оба пола | 13.80 | 0.70 | 2.12 | Henderson, Bamber, 1987 |
ОБСУЖДЕНИЕ
Структура популяции и особенности роста рыб формируются в соответствии с наследственными факторами, промыслом и условиями среды, определяющими направление и интенсивность отбора (Шмальгаузен, 1968; Никольский, 1974; Шварц, 1980). Промысел атерины в исследуемой акватории не развит, поэтому следует полагать, что её биологические особенности определяются, прежде всего, условиями обитания.
Для исследуемой группировки A. boyeri установлена повышенная смертность самцов и преобладание самок среди особей старших возрастов. Подобная картина характерна для A. boyeri юго-восточной части Каспия (соотношение полов 1.00 : 1.30) (Patimar et al., 2009), лагун Западной Греции (1.00 : 1.24) (Leonardos, Sinis, 2000), эстуария р. Мала Неретва в Хорватии (1.00 : 1.30) (Bartulovic et al., 2004), системы эстуариев оз. Вистонис в Северной Греции (1.00 : 2.50) (Koutrakis et al., 2004) и согласуется с представлениями об эволюционной роли полов, в соответствии с которыми повышенная смертность самцов, связанная, как правило, с более широкой нормой реакции, является выгодной формой информационного взаимодействия популяции со средой, обеспечивающей элиминацию вредных мутаций и закрепление наиболее адаптивных признаков (Геодакян, 1974). С этой точки зрения повышенная смертность самцов A. boyeri и преобладание самок – свидетельство отбора, обеспечивающего высокую скорость адаптационного ответа и устойчивость к лабильным условиям среды, что вносит весомый вклад в формирование эврибионтности данного вида и широкую его экспансию.
По темпу линейного роста A. boyeri из акватории Юго-Западного Крыма занимает промежуточное положение в ряду атерин из других районов (табл. 2). Согласно индексу линейного роста φ, наибольшее сходство по данному показателю обнаруживается с атеринами пресноводных озёр Греции и Турции. При этом исследуемая группировка уступает A. boyeri из Ла Манша, Адриатического моря и Юго-Восточного Каспия. В то же время темп роста атерины Юго-Западного Крыма выше, чем у форм из эстуария Риа де Авейро в Португалии, системы эстуариев оз. Вистонис в Северной Греции, лагун Западной Греции. По всей видимости, низкий темп роста A. boyeri из данных акваторий связан с лабильной солёностью, которая варьирует в широких пределах – 0−35‰ (Koutrakis et al., 2004; Pombo et al., 2005).
Имеются сведения о том, что темп роста и предельные размеры A. boyeri связаны с солёностью и закономерно снижаются с её уменьшением (Henderson, Bamber, 1987). В соответствии с этим утверждением наиболее быстрорастущими являются атерины открытого моря, а прибрежные и солоноватоводные растут медленнее, и наиболее тугорослые формы – пресноводные. Однако проведённый анализ свидетельствует, что наиболее тугорослыми следует считать представителей из солоноватоводных акваторий с неустойчивой солёностью, что может объясняться необходимостью энергетических трат на водно-солевой обмен и его адаптацию к периодически сменяемым условиям. Помимо физиологических предпосылок замедления роста в условиях лабильной солёности, можно предположить и действие отбора, направление которого постоянно меняется, не позволяя закрепиться вариантам признаков, позволяющим наиболее эффективно использовать ресурсы экосистемы.
Следует отметить, что температурные условия не обнаруживают такого выраженного влияния на рост A. boyeri, как солёность. Так, наибольшим темпом роста обладают популяции из Северо-Восточной Атлантики, Адриатики и Юго-Восточного Каспия – регионов, совершенно разных по температурному режиму. A. boyeri акватории Юго-Западного Крыма обитает в условиях сравнительно низкой температуры, сезонности и континентального климата. В этой связи следовало бы ожидать более высокое значение L∞ и низкое k по сравнению с популяциями низких широт, что в реальности либо вовсе не наблюдается, либо выражено слабо.
Таким образом, по своим биологическим особенностям A. boyeri из акватории Юго-Западного Крыма мало отличается от популяций из районов со стабильным режимом солёности, как морских, так и пресноводных. При этом темп её роста и предельные размеры выше, чем у представителей из эстуарных районов с лабильной солёностью, что следует учитывать при организации промысла в пределах Азово-Черноморского бассейна.
Список литературы
Васильева Е.Д. 2007. Рыбы Черного моря. Определитель морских, солоноватоводных, эвригалинных и проходных видов с цветными иллюстрациями, собранными С.В. Богородским. М.: Изд-во ВНИРО, 238 с.
Васильева Е.Д. 2017. Диагностические признаки и таксономия средиземноморских атерин из группы Atherina boyeri (Atherinidae) // Вопр. ихтиологии. Т. 57. № 6. С. 627−639. https://doi.org/10.7868/S0042875217060145
Геодакян В.А. 1974. Дифференциальная смертность и норма реакции мужского и женского пола // Журн. общ. биологии. Т. 35. № 3. С. 376−385.
Драпкин Е.И. 1968. О морфологических признаках черноморско-азовских атерин (Pisces, Atherinidae) // Бюл. МОИП. Отд. биол. Т. 73. Вып. 6. С. 47−54.
Маркевич Н.Б. 1977. Некоторые морфологические показатели атерины Atherina mochon pontica Eichwald в Аральском море в связи с возрастной структурой ее популяции // Вопр. ихтиологии. Т. 17. Вып. 4 (105). С. 698−707.
Мешков М.М. 1941. К систематике рыб семейства Atherinidae Черного и Каспийского морей // Изв. АН СССР. Сер. биол. № 3. С. 400−407.
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Никольский Г.В. 1974. Теория динамики стада рыб. М.: Пищ. пром-сть, 447 с.
Правдин И. Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 391 с.
Световидов А.Н. 1964. Рыбы Черного моря. М.: Наука, 550 с.
Солис М.В. 1987. Атерина Atherina boyeri pontica Risso северо-западной части Черного моря: Автореф. дис. … канд. биол. наук. М.: ВНИРО, 24 с.
Ткачева К.С. 1950. К биологии атерин Черного моря // Тр. Карадаг. биол. ст. Вып. 9. С. 81−94.
Устарбекова Д.А., Джабраилов Ю.М. 2012. Особенности биологии атерины Atherina boyeri caspia (Eichwald, 1838) Каспийского моря // Изв. ДГПУ. Естеств. и точ. науки. № 4 (21). С. 39−44.
Шварц С.С. 1980. Экологические закономерности эволюции. М.: Наука, 277 с.
Шмальгаузен И.И. 1968. Факторы эволюции. Теория стабилизирующего отбора. М.: Наука, 451 с.
Andreu-Soler A., Oliva-Paterna F.J., Fernandez-Delgado C., Torralva M. 2003. Age and growth of the sand smelt, Atherina boyeri (Risso 1810), in the Mar Menor coastal lagoon (SE Iberian Peninsula) // J. Appl. Ichthyol. V. 19. P. 202–208. https://doi.org/10.1046/j.1439-0426.2003.00477.x
Bartulovic V., Glamuzina B., Conides A. et al. 2004. Age, growth, mortality and sex ratio of sand smelt, Atherina boyeri Risso, 1810 (Pisces: Atherinidae) in the estuary of the Mala Neretva River (middle-eastern Adraitic, Croatia) // Ibid. V. 20. P. 427–430. https://doi.org/10.1111/j.1439-0426.2004.00560.x
Bertalanffy L. Von. 1938. A quantitative theory of organic growth (Inquiries on growth laws II) // Human Biol. V. 10. P. 181−213. https://doi.org/10.2307/41447359
Creech S. 1992. A multivariate morphometric investigation of Atherina boyeri Risso, 1810 and A. presbyter Cuvier, 1829 (Teleostei: Atherinidae): Morphometric evidence in support of the two species // J. Fish Biol. V. 41. P. 341−353. https://doi.org/10.1111/j.1095-8649.1992.tb02663.x
Fernández-Delgado C., Hernando J.A., Herrera M., Bellido M. 1988. Life-history patterns of the sandsmelt Atherina boyeri Risso, 1810 in the estuary of the Guadalquivir River, Spain // Estuar. Coast. Shelf Sci. V. 27. P. 697−706. https://doi.org/10.1016/0272-7714(88)90076-5
Fricke R., Eschmeyer W.N., Van der Laan, R. (eds.). 2019. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy. org/research/ichthyology/catalog/ fishcatmain.asp. Version 05/2019)
Gurkan S., Bayhan B., Can Akcinar S., Taskavak E. 2010. Length−weight relationship of fish from shallow waters of Candarli Bay (North Aegean Sea, Turkey) // Pakistan J. Zool. V. 42. № 4. P. 495−498.
Henderson P.A., Bamber R.N. 1987. On reproductive biology of the sand smelt Atherina boyeri Risso (Pisces: Atherinidae) and its evolutionary potential // Biol. J. Linn. Soc. V. 32. № 4. P. 395−415. https://doi.org/10.1111/j.1095-8312.1987.tb00440.x
Ilhan A., Ilhan D. 2018. Length−weight relationship and condition of big-scale sand smelt (Atherina boyeri Risso, 1810) from Marmara Lake (Manisa) and Homa Lagoon (İzmir) // Black Sea J. Sci. V. 8. № 1. P. 25−34. https://doi.org/10.31466/kfbd.403014
Koutrakis E.T., Kamidis N.I., Leonardos I.D. 2004. Age, growth and mortality of a semi-isolated lagoon population of sand smelt, Atherina boyeri (Risso, 1810) (Pisces: Atherinidae) in an estuarine system of northern Greece // J. Appl. Ichthyol. V. 20. P. 382–388. https://doi.org/10.1111/j.1439-0426.2004.00583.x
Leonardos I.D. 2001. Ecology and exploitation pattern of a landlocked population of sand smelt, Atherina boyeri (Risso, 1810), in Trichonis Lake (western Greece) // Ibid. V. 17. P. 262–266. https://doi.org/10.1046/j.1439-0426.2001.00296.x
Leonardos I., Sinis A. 2000. Age, growth and mortality of Atherina boyeri Risso, 1810 (Pisces: Atherinidae) in the Mesolongi and Etolikon lagoons (W. Greece) // Fish. Res. V. 45. P. 81−91. https://doi.org/10.1016/S0165-7836(99)00097-1
Özeren S.C. 2009. Age, growth and reproductive biology of the sand smelt Atherina boyeri, Risso 1810 (Pisces: Atherinidae) in Lake Iznik, Turkey // J. Fish Int. V. 4. P. 34−39.
Patimar R., Yousefi M., Hosieni S.M. 2009. Age, growth and reproduction of the sand smelt Atherina boyeri Risso, 1810 in the Gomishan wetland – southeast Caspian Sea // Estuar. Coast. Shelf Sci. V. 81. P. 457−462. https://doi.org/10.1016/j.ecss.2008.12.007
Pauly D., Moreau J., Prein M. 1988. A comparison of overall growth performance of tilapia in open waters and aquaculture // ICLARM Conf. Proc. V. 15. P. 469–479.
Pombo L., Elliott M., Rebelo J.E. 2005. Ecology, age and growth of Atherina boyeri and Atherina presbyter in the Ria de Aveiro, Portugal // Cybium. V. 29. № 1. P. 47−55.
Quignard J.P., Pras A. 1986. Atherinidae // Fishes of the North-Eastern Atlantic and Mediterranian. Paris: UNESCO. P. 1207−1210.
Sezen B. 2005. İzmir Homa Lagünü gümüş balığı (Atherina boyeri Risso, 1810) populasyonunun biyolojik özelliklerinin incelenmesi. Ege Üniv. Fen Bilimleri Enst. (Yüksek Lisans Tezi). 85 S.
Walford L.A. 1946. A new graphic method of describing the growth of animals // Biol. Bull. V. 90. № 2. P. 141−147.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии