Вопросы ихтиологии, 2020, T. 60, № 4, стр. 442-451
Формирование и реализация плодовитости у черноморского калкана Scophthalmus maeoticus (Scophthalmidae) на юго-западном шельфе Крымского полуострова
В. Е. Гирагосов *
Институт биологии южных морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: vitaly.giragosov@gmail.com
Поступила в редакцию 23.07.2019
После доработки 26.08.2019
Принята к публикации 08.10.2019
Аннотация
Приведены результаты исследования репродуктивных характеристик самок черноморского калкана Scophthalmus maeoticus по материалам, собранным в 2007–2018 гг. в районе юго-западного шельфа Крымского п-ова. Нерест калкана в данном районе длится в среднем 2 мес. – со II декады апреля до конца I декады июня; наиболее интенсивно − в первые две декады мая. При средней массе тела самки (без внутренностей) 2.96 кг среднее число ооцитов периода вителлогенеза, формирующих накануне нереста потенциальную плодовитость, составляет 4368 тыс. шт. В течение нерестового сезона реализуется в среднем 73% потенциальной плодовитости (3189 тыс. ооцитов). Оставшиеся в яичниках желтковые ооциты подвергаются резорбции в течение 2–3 мес. после нереста. Порционная плодовитость составляет в среднем 412 тыс. ооцитов (12.9% реализованной плодовитости); по расчётным данным, каждая самка вымётывает в среднем семь–восемь порций икры в течение нерестового сезона.
Черноморский калкан Scophthalmus maeoticus – ценный промысловый вид рыб и перспективный объект марикультуры. Самки калкана достигают половой зрелости на 6–8-м году жизни (Попова, 1967), единичные особи раньше – в возрасте 3 (Овен, 2004) или 4 (Попова, 1954; Гирагосов и др., 2008) года. По более поздним данным (Надолинский и др., 2018), массовое созревание самок (58%) происходит в возрасте 4 года. Расхождения в оценках этой характеристики могут быть связаны со сложностью определения возраста у калкана − субъективностью интерпретации зон роста его отолитов. Стандартная длина (SL), при которой 50% самок достигают половой зрелости (по результатам пробит-анализа), составляет 39.8 (37.5−41.2) см (Пятинский, 2017). Калкан нерестится вдоль всех берегов Чёрного моря; сроки нереста зависят от района и гидрологических условий конкретного года. В целом калкан нерестится с конца марта по вторую половину июня, иногда до конца июля, наиболее интенсивно – в мае (Попова, 1954).
Калкану свойствен прерывистый оогенез, порционное икрометание и детерминированная плодовитость (Овен, 2004). Потенциальная плодовитость калкана очень высока – от 3 до 13–14 млн икринок в зависимости от размера самки (Кротов, 1941; Попова, 1972; Таликина, Воробьева, 1975). Однако выживаемость пелагической икры в море низкая – от 2–3 до 10–20% (Попова, 1972; Попова, Кокоз, 1973; Игнатьев и др., 2017). Наиболее высокая численность молоди отмечается при таком сочетании течений и преобладающих ветров, которое способствует концентрации икры и личинок в шельфовой зоне, где условия для их развития и выживания, особенно в период перехода молоди к донному образу жизни, более благоприятны, чем в открытых районах моря (Попова, Кокоз, 1973).
Порционная плодовитость у калкана зависит не только от размера тела самки, но и от температуры воды и фазы нерестового периода и варьирует от 50 до 700 тыс. (Воробьева, Таликина, 1976), по другим данным, – от 217 до 473 тыс. икринок (Овен, 2004). В экспериментальных условиях низкие значения температуры воды, близкие к таковым в природной среде (8–9°С), стимулируют у калкана повышение порционной плодовитости (Воробьева, Таликина, 1976).
Расчётное число порций икры, вымётываемых самкой в течение нерестового сезона, варьирует от трёх (Смирнов, 1951; Попова, 1975) и пяти–шести (Калинина, 1960) до не менее десяти (Таликина, Воробьева, 1975) порций. Число порций и скорость их созревания у калкана в искусственных условиях содержания зависят от ряда факторов, таких как температура воды, фотопериод, стадия зрелости половых продуктов в день изъятия производителей из природной среды, способ получения икры – при естественном её созревании или с применением гормональной стимуляции. В искусственных условиях самки продуцируют от двух–трёх до девяти порций икры с интервалом 31–67 ч (Воробьева и др., 1975), одну–семь порций с интервалом 4–52 ч (Туркулова, Новосёлова, 2012), семь–шестнадцать порций при ежедневном сцеживании икры (Aydin, Şahin, 2011), до десяти порций (периодичность созревания не установлена) (Maslova, 2002). При низкой температуре воды (8–9°С) самки калкана продуцируют больше порций, чем при более высокой температуре (Воробьева, Таликина, 1976).
Данные о репродуктивных характеристиках калкана необходимы для оценки эффективности его размножения в природных условиях, прогноза состояния промыслового запаса и разработки биотехнологии культивирования. Сведения по формированию и реализации плодовитости у калкана, полученные в 1940–1970-х гг., не полны и нуждаются в ревизии. В последних публикациях по данной теме (Овен и др., 2001; Овен, 2004) представлены результаты анализа некоторых репродуктивных характеристик лишь шести особей, собранных у берегов Крыма в 1964–1988 гг. Данные же по получению половых продуктов калкана в искусственных условиях могут недостаточно точно отражать особенности репродуктивной биологии этого вида в естественной среде обитания.
Цель работы – выявить особенности формирования и реализации плодовитости у черноморского калкана в современных условиях на юго-западном шельфе Крымского п-ова.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в 2007–2018 гг. на юго-западном шельфе Крымского п-ова (у берегов Севастополя, в акватории с координатами 44°36′–44°41′ с.ш., 33°19′–33°31′ в.д.) из уловов камбальных сетей (ячея 200 мм) на глубинах 50–95 м и донных ловушек на глубинах до 10 м, а также получен от подводных охотников.
Биологический анализ 266 самок проведён по типовым методикам (Правдин, 1966). У рыб измеряли полную (TL) и стандартную (SL) длину, массу тела (полную (W) и без внутренностей (w)), гонад и печени; возраст определяли по отолитам. Рассчитывали гонадосоматический (ГСИ) и гепатосоматический (ГПСИ) индексы. Коэффициенты упитанности по Фултону (КФ) и по Кларк (КК) рассчитаны относительно стандартной длины (SL). Особенности оогенеза, формирования и реализации плодовитости исследовали по пробам яичников 105 половозрелых самок, собранных в нерестовый период (апрель–июнь), и 12 самок, в том числе шести ювенильных, собранных в летний, осенний и зимний периоды. Состояние гонад оценивали по 6-балльной шкале зрелости (Сакун, Буцкая, 1968).
Зрелую икру сцеживали у живых особей, измеряли её объём и массу (вместе с овариальной жидкостью); в пробе объёмом 2 мл подсчитывали число ооцитов и измеряли диаметр 50 икринок и жировых капель. Затем в процессе биологического анализа рыб отбирали пробы ткани яичника. Размерный состав ооцитов в разных частях яичника калкана сравнительно однороден (Таликина, Воробьева, 1975), однако для исключения влияния случайных вариаций общую пробу массой ~5 г формировали из проб, отобранных в передней, верхней, средней и задней частях обеих (правой и левой) долей яичника (рис. 1). Пробы фиксировали 4%-ным раствором формальдегида. Для освобождения ооцитов от стромы яичника пробы пропускали через полиамидную сетку с внутренним размером ячеи 1 мм. Количественный состав ооцитов в пробе определяли объёмным методом в модификации Овен (1976). С помощью бинокулярного микроскопа МБС-9 проводили тотальный подсчёт ооцитов трёх основных групп: безжелтковых (период превителлогенеза), желтковых (период вителлогенеза) и зрелых (период созревания). Основные цитологические признаки этих трёх групп яйцеклеток достаточно хорошо различимы в проходящем свете при увеличении микроскопа 8 × 4–7. Кроме того, соответствие размера ооцитов определённым периодам и фазам оогенеза проверяли по гистологическим препаратам яичников калкана, имеющимся в коллекции ИнБЮМ, и по данным Таликиной (1974). Затем в случайной выборке из каждой пробы измеряли 300–400 ооцитов диаметром ≥0.05 мм. Результаты анализа проб пересчитывали на общую массу яичника.
Рис. 1.
Схема отбора проб из яичника черноморского калкана Scophthalmus maeoticus; часть яичника: 1 – передняя, 2 – верхняя, 3 – средняя, 4 – задняя.

Порционную плодовитость (ПП) определяли как совокупность числа сцеженных икринок и выделенных из ткани яичника зрелых, но ещё не овулировавших ооцитов. Относительное количество превителлогенных и вителлогенных ооцитов и относительная порционная плодовитость (ОПП) рассчитаны на 1 кг массы тела без внутренностей; коэффициент порционности (КП) − доля зрелых ооцитов в общем числе ооцитов периодов вителлогенеза и созревания, %.
Статистический анализ проводили с использованием программного обеспечения Excel и Statistica 10. Данные представлены как среднее значение и стандартное отклонение (М ± σ). Достоверность различий оценивали с помощью однофакторного дисперсионного анализа (ANOVA) при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В апреле−июне в течение всего периода исследований (2007–2018 гг.) уловы камбальных сетей были представлены исключительно половозрелыми особями калкана, среди которых доля самок составила в среднем 19.4% общего числа особей. Тенденция количественного преобладания самцов над самками прослеживается на юго-западном шельфе Крымского п-ова с 1999 г. (Giragosov, Khanaychenko, 2012) и является одним из неблагоприятных показателей репродуктивного потенциала нерестового стада калкана в данном районе.
Полная длина самок, отловленных в течение нерестового сезона, варьировала в пределах 44.4–79.7 (в среднем 57.7) см, SL – 35.7–64.0 (46.9) см, W – 1.63–10.75 (4.00) кг, w – 1.21–6.34 (2.96) кг, масса яичника – 77–3728 (762) г, возраст – 4–12 (6.9) лет, ГСИ – 2.96–58.80 (25.46)%, ГПСИ – 1.73–4.48 (2.97)%, КФ – 2.69–5.94 (3.76), КК – 1.03–4.19 (2.80). У всех характеристик, кроме ГСИ, прослеживается достоверная тенденция (р < 0.05) снижения средних значений в течение нерестового сезона – от апреля к июню (табл. 1).
Таблица 1.
Биологическая характеристика самок черноморского калкана Scophthalmus maeoticus в период нереста
| Показатель | Апрель | Май | Июнь | |||
| n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | |
| Длина, см: | ||||||
| – полная (TL) | 118 | $\frac{{58.9 \pm 6.4}}{{44.4{\kern 1pt} --{\kern 1pt} 79.7}}$ | 117 | $\frac{{57.1 \pm 6.0}}{{44.6{\kern 1pt} --{\kern 1pt} 74.5}}$ | 31 | $\frac{{55.8 \pm 4.4}}{{46.5{\kern 1pt} --{\kern 1pt} 65.2}}$ |
| – стандартная (SL) | 118 | $\frac{{47.9 \pm 5.2}}{{35.7{\kern 1pt} --{\kern 1pt} 64.0}}$ | 117 | $\frac{{46.4 \pm 5.1}}{{36.4{\kern 1pt} --{\kern 1pt} 60.3}}$ | 31 | $\frac{{45.2 \pm 3.7}}{{37.4{\kern 1pt} --{\kern 1pt} 53.2}}$ |
| Масса, кг: | ||||||
| – полная (W) | 104 | $\frac{{4.38 \pm 1.61}}{{1.67{\kern 1pt} --{\kern 1pt} 10.75}}$ | 117 | $\frac{{3.89 \pm 1.24}}{{1.75{\kern 1pt} --{\kern 1pt} 7.58}}$ | 30 | $\frac{{3.07 \pm 0.72}}{{1.63{\kern 1pt} --{\kern 1pt} 4.80}}$ |
| – без внутренностей (w) | 75 | $\frac{{3.28 \pm 1.14}}{{1.21{\kern 1pt} --{\kern 1pt} 6.34}}$ | 83 | $\frac{{2.81 \pm 0.91}}{{1.43{\kern 1pt} --{\kern 1pt} 5.87}}$ | 24 | $\frac{{2.45 \pm 0.57}}{{1.30{\kern 1pt} --{\kern 1pt} 4.00}}$ |
| Масса гонад, г | 75 | $\frac{{843 \pm 610}}{{141{\kern 1pt} --{\kern 1pt} 3728}}$ | 83 | 806 ± 394 158–1660 |
24 | 360 ± 203 77–883 |
| Возраст, годы | 74 | $\frac{{7.3 \pm 1.5}}{{4{\kern 1pt} --{\kern 1pt} 12}}$ | 81 | $\frac{{6.6 \pm 1.3}}{{4{\kern 1pt} --{\kern 1pt} 11}}$ | 24 | $\frac{{6.4 \pm 1.3}}{{4{\kern 1pt} --{\kern 1pt} 12}}$ |
| Индекс: | ||||||
| – гонадосоматический (ГСИ), % | 75 | $\frac{{24.9 \pm 12.4}}{{6.1{\kern 1pt} --{\kern 1pt} 58.8}}$ | 83 | $\frac{{29.1 \pm 11.7}}{{3.2{\kern 1pt} --{\kern 1pt} 52.1}}$ | 24 | $\frac{{14.6 \pm 7.3}}{{3.0{\kern 1pt} --{\kern 1pt} 29.8}}$ |
| – гепатосоматический (ГПСИ), % | 74 | $\frac{{3.10 \pm 0.52}}{{2.14{\kern 1pt} --{\kern 1pt} 4.48}}$ | 83 | $\frac{{3.02 \pm 0.53}}{{1.98{\kern 1pt} --{\kern 1pt} 4.33}}$ | 24 | $\frac{{2.42 \pm 0.34}}{{1.73{\kern 1pt} --{\kern 1pt} 3.17}}$ |
| Коэффициент упитанности: | ||||||
| – по Фултону (КФ) | 104 | $\frac{{3.84 \pm 0.56}}{{2.88{\kern 1pt} --{\kern 1pt} 5.94}}$ | 117 | $\frac{{3.82 \pm 0.49}}{{2.81{\kern 1pt} --{\kern 1pt} 5.19}}$ | 30 | $\frac{{3.29 \pm 034}}{{2.69{\kern 1pt} --{\kern 1pt} 5.94}}$ |
| – по Кларк (КК) | 75 | $\frac{{2.86 \pm 0.34}}{{2.03{\kern 1pt} --{\kern 1pt} 4.20}}$ | 83 | $\frac{{2.80 \pm 0.31}}{{2.21{\kern 1pt} --{\kern 1pt} 3.52}}$ | 24 | $\frac{{2.61 \pm 0.28}}{{2.17{\kern 1pt} --{\kern 1pt} 3.09}}$ |
Примечание. Здесь и в табл. 2: n − число исследованных рыб, M ± σ – среднее значение и стандартное отклонение, min–max – пределы варьирования показателя.
Снижение средних значений длины и массы тела производителей калкана в уловах от начала к концу нерестового периода отмечено также в северо-западной части Чёрного моря в 1997–2000 и 2008 гг. (Туркулова, Новоселова, 2012). Вероятно, более крупные и старшие особи начинают нерест раньше, чем мелкие и молодые. Не исключено также, что это обусловлено неодновременным подходом производителей разных размерно-возрастных групп на глубины, на которых традиционно добывают калкана камбальными сетями. Проверить эти гипотезы можно лишь на основании анализа материала, собранного в локальном районе методом одновременных траловых съёмок на разных глубинах поэтапно – в начале, середине и конце нерестового периода, что в настоящее время проблематично по природоохранным, финансовым и организационным причинам.
Продолжительность и сроки нереста калкана у берегов Севастополя в разные годы сравнительно стабильны – с апреля (обычно со II декады) до середины июня (чаще до конца I декады), а наиболее интенсивный нерест – в первые две декады мая. Динамику нереста отражает соотношение особей с гонадами разных стадий зрелости (рис. 2). Необходимо учитывать, что в июне среди самок с гонадами VI–V стадии зрелости преобладали особи с незначительным количеством зрелых деформированных остаточных ооцитов в полости яичника, т.е. фактически завершившие нерест. Такие же сроки нереста калкана в данном районе указаны и по результатам ихтиопланктонных съёмок (Гордина, Морочковский, 1994). Таким образом, общая продолжительность нереста калкана на юго-западном шельфе Крымского п-ова составляет в среднем 2 мес.
Рис. 2.
Соотношение самок черноморского калкана Scophthalmus maeoticus с гонадами IV (◻), VI−V, V ( ) и VI−II (◼) стадий зрелости в течение нерестового периода.
) и VI−II (◼) стадий зрелости в течение нерестового периода.
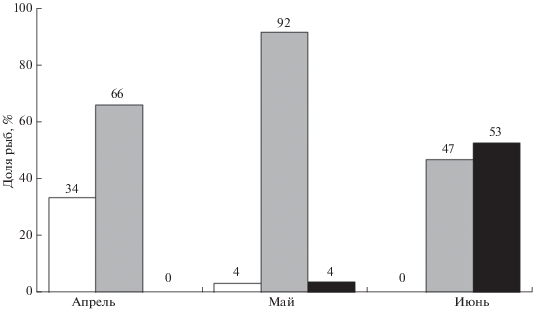
В нашем материале, собранном с помощью пассивных орудий лова, в период нереста не было ни одной особи с гонадами в состоянии покоя (II стадия зрелости). Однако имеются сведения, что в траловых уловах встречаются особи калкана, которые не участвуют в нересте текущего года (доля таких рыб не указана) (Марти, 1939; Попова, 1954). Очевидно, половозрелые особи, пропускающие нерестовый сезон, ведут пассивный образ жизни с малым радиусом индивидуальной активности в отличие от сравнительно подвижных нерестовых особей, которые и облавливаются камбальными сетями. По данным подводных наблюдений, в апреле–начале мая в прибрежных водах на глубине 10–20 м периодически встречаются группы нерестовых особей (самка в сопровождении двух–трёх самцов), которые не зарываются в грунт и довольно активно перемещаются, особенно в вечернее время. Наиболее интенсивный нерест калкана проходит в тёмное время суток, с 18 до 23 ч (Попова, 1972).
Калкан интенсивно питается в зимние месяцы (Попова, 1958), поэтому в начале нереста (в апреле) ему свойственны высокие значения коэффициентов упитанности (табл. 1). Последующее снижение значений КФ и КК связано с продуцированием самками большого количества икры и низкой интенсивностью питания в период нереста. Лишь у 16% самок в пищеварительном тракте были обнаружены пищевые объекты – обычно одна, редко две значительно переваренные рыбы (мерланг Merlangus merlangus euxinus, шпрот Sprattus sprattus phalericus, реже барабуля Mullus barbatus, бычки (Gobiidae) и хамса Engraulis encrasicolus). Однако самки питались всё же интенсивнее, чем самцы, у которых лишь 3% особей имели остатки пищевых объектов в пищеварительном тракте.
Значения ГПСИ особенно значительно снижались в июне (табл. 1). По данным Басовой (2000), печень у калкана в репродуктивный период – функционально активный орган, обеспечивающий гонады пластическим и энергетическим материалом. Для печени самок в период нереста характерен отрицательный белковый баланс, однако абсолютное содержание нуклеиновых кислот растёт и, по-видимому, продолжается белковый синтез, что свидетельствует о высокой метаболической активности печени. После завершения нереста значения ГПСИ у калкана продолжают снижаться, одновременно в печени снижается абсолютное содержание белков, липидов, гликогена и нуклеиновых кислот практически до значений, характерных для зимовального периода.
Значения ГСИ повышались от апреля к маю (табл. 1) за счёт увеличения доли самок со зрелой икрой (процесс гидратации ооцитов сопровождается значительным увеличением массы яичников) и снижались от мая к июню, когда бóльшая часть запаса желтковых ооцитов уже выметана, а доля самок с текучей икрой сократилась.
Оогенез калкана довольно подробно исследован (Калинина, 1960; Таликина, 1974). Наши данные позволяют дополнить эти сведения описанием некоторых особенностей оогенеза и количественными характеристиками, полученными в современный период.
Неполовозрелые самки и половозрелые в межнерестовый период имеют гонады II стадии зрелости: яичники содержат ооциты разных фаз периода превителлогенеза, их максимальный диаметр составляет 0.14–0.16 мм (рис. 3а).
Рис. 3.
Состав ооцитов в яичниках разных стадий зрелости у черноморского калкана Scophthalmus maeoticus; стадия зрелости: а – II, б – III, в – IV, г – V; ооциты периода: (◻) – превителлогенеза,
( ) − вителлогенеза, (
) − вителлогенеза, (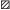 ) − созревания.
) − созревания.
В ноябре–январе у части ооцитов происходит асинхронный рост и начинается накопление трофических веществ, состояние ооцитов периода трофоплазматического роста соответствует фазам вакуолизации и первоначального накопления желтка. У большинства ооцитов, достигших диаметра 0.25–0.30 мм, цитоплазма уже довольно плотно заполнена вакуолями и желтком, ядро визуально почти неразличимо. Диаметр ооцитов старшей генерации увеличивается до 0.35 мм, состояние яичника соответствует III стадии зрелости (рис. 3б).
Далее, в феврале–начале апреля, в течение фазы интенсивного накопления желтка происходит формирование расходного фонда ооцитов (основного запаса по терминологии Калининой (1960)), предназначенного для реализации в ходе нерестового сезона текущего года. Группа вителлогенных ооцитов разной степени развития – от фазы начала вакуолизации цитоплазмы (диаметр клеток 0.20–0.25 мм) до фазы заполненного желтком ооцита (0.60–0.65 мм) – отделяется от превителлогенных ооцитов, составляющих резервный фонд, предназначенный для последующих нерестовых сезонов (рис. 3в). У 93% самок в размерном ряду ооцитов нет разрыва между резервным и расходным фондами, однако относительно малая доля самых мелких желтковых ооцитов диаметром 0.20 мм (рис. 3в) позволяет с уверенностью предположить, что после достижения яичниками завершённой IV стадии зрелости развитие безжелтковых ооцитов прекращается или же пополнение ими расходного фонда ничтожно мало. Таким образом, в данном состоянии яичников накануне нерестового сезона число желтковых ооцитов соответствует потенциальной плодовитости калкана.
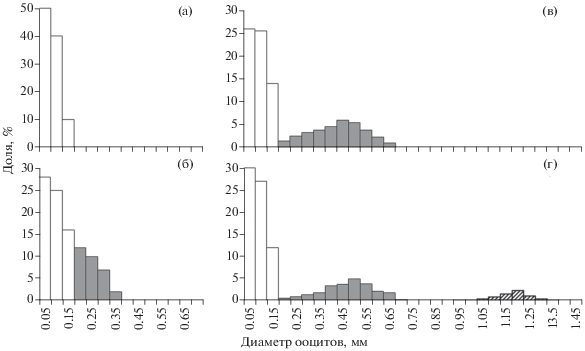
Ооциты диаметром 0.70–0.95 мм имеют признаки переходного состояния между стадиями зрелости IV и V: начинается гидратация, желток приобретает рыхлую структуру. Диаметр овулировавших икринок варьирует в пределах 0.85–1.59 (1.23 ± 0.06) мм, диаметр жировой капли – 0.147–0.288 (0.211 ± 0.012) мм. В размерном ряду группа овулировавших икринок заметно обособлена от следующей генерации ооцитов, максимальный диаметр которых составляет 0.65 мм (рис. 3г). В течение нерестового сезона диаметр зрелых икринок и жировых капель уменьшался, составив в апреле соответственно 1.25 ± 0.05 и 0.215 ± 0.009 мм, в мае – 1.22 ± 0.07 и 0.212 ± 0.011, в июне – 1.20 ± 0.05 и 0.196 ± 0.010 мм.
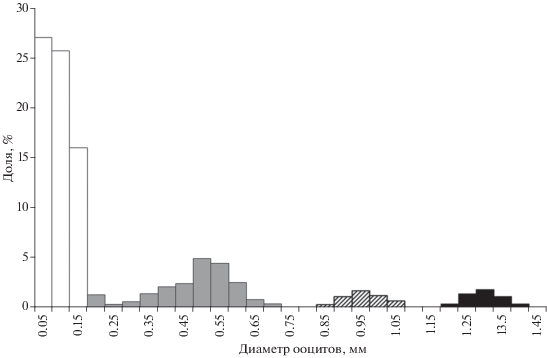
В связи с тем что экспозиция камбальных сетей в море составляет одну–две недели, у самок, находящихся в сетях в течение нескольких суток, могут проявляться сбои в ритме созревания и вымета икры. Икринки в полости яичника перезревают, деформируются, в морской воде имеют отрицательную плавучесть и утрачивают способность к оплодотворению. Возможно даже созревание, овуляция и смешивание двух последовательных порций икры (рис. 4), что затрудняет корректное определение порционной плодовитости. Очевидно, такое состояние яичников не проявляется у самок калкана в природной среде обитания или же оно возможно при исключительных обстоятельствах, нарушающих этологические условия нереста, например, при отсутствии самцов (что крайне маловероятно с учётом значительного преобладания самцов в нерестовом стаде).
Рис. 4.
Состав ооцитов в яичнике самки калкана Scophthalmus maeoticus при нарушении ритма икрометания; (◼) – перезрелые ооциты, ост. обозначения см. на рис. 3.
В конце мая и в июне проявляются признаки завершения нереста: яичники уменьшаются в размерах, они дряблые, багрово-фиолетового цвета, содержат помимо ооцитов резервного фонда резорбирующиеся желтковые ооциты, а в овариальной жидкости полости яичника – остаточные деформированные зрелые икринки. В конце июня ГСИ составляет в среднем 2.9. Такое состояние яичников соответствует VI–II стадии зрелости, оно длится до августа–сентября (Таликина, 1974; наши данные). По завершении процессов резорбции яичники переходят во II стадию зрелости.
Процесс продуцирования превителогенных ооцитов у калкана продолжается и после наступления половой зрелости. Их число у 105 самок, отловленных в апреле–июне, составило 1943–28194 (8358 ± 4960) тыс. шт. Зависимости числа превителогенных ооцитов (Npo) от стандартной длины и массы тела без внутренностей описываются уравнениями: Npo = 0.0247SL3.272, R2 = 0.52 (рис. 5а) и Npo = 2750w – 144, R2 = 0.48 (рис. 5б). Относительное число превителогенных ооцитов составило 979–5381 (2724 ± 1087) тыс. шт/кг массы тела без внутренностей. В течение нерестового сезона значения этого показателя были стабильны (табл. 2) и достоверно не различались, что является доказательством того, что калкану свойствен прерывистый тип оогенеза и в процессе нереста расходный фонд не пополняется ооцитами из резервного фонда.
Рис. 5.
Зависимость числа ооцитов периода превителлогенеза (105 самок, апрель−июнь (а, б)) и вителлогенеза (46 самок, апрель (в, г)) от стандартной длины (а, в) и массы тела без внутренностей (б, г) черноморского калкана Scophthalmus maeoticus.
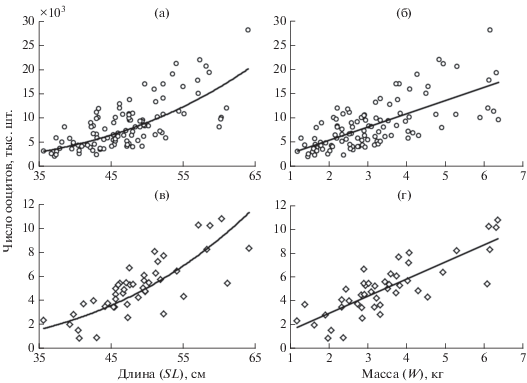
Таблица 2.
Относительное число ооцитов и коэффициент порционности у черноморского калкана Scophthalmus maeoticus в период нереста
| Показатель | Апрель | Май | Июнь | |||
|---|---|---|---|---|---|---|
| n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | n, экз. | $\frac{{M \pm \sigma }}{{{\text{min}}{\kern 1pt} --{\kern 1pt} {\text{max}}}}$ | |
| Число ооцитов, тыс. шт/кг массы тела без внутренностей: | ||||||
| – превителлогенных | 47 | $\frac{{2704 \pm 983}}{{979{\kern 1pt} --{\kern 1pt} 4599}}$ | 41 | $\frac{{2785 \pm 1213}}{{1298{\kern 1pt} --{\kern 1pt} 5381}}$ | 17 | $\frac{{2628 \pm 1081}}{{1457{\kern 1pt} --{\kern 1pt} 4719}}$ |
| – вителлогенных | 46 | $\frac{{1515 \pm 495}}{{395{\kern 1pt} --{\kern 1pt} 3013}}$ | 36 | $\frac{{1117 \pm 372}}{{121{\kern 1pt} --{\kern 1pt} 1652}}$ | 14 | $\frac{{407 \pm 469}}{{19{\kern 1pt} --{\kern 1pt} 1081}}$ |
| Порционная плодовитость, тыс. шт/кг массы тела без внутренностей | 28 | $\frac{{117 \pm 68}}{{19{\kern 1pt} --{\kern 1pt} 239}}$ | 32 | $\frac{{168 \pm 79}}{{63{\kern 1pt} --{\kern 1pt} 328}}$ | 10 | $\frac{{84 \pm 39}}{{13{\kern 1pt} --{\kern 1pt} 132}}$ |
| Коэффициент порционности | 28 | $\frac{{8.8 \pm 6.1}}{{1.05{\kern 1pt} --{\kern 1pt} 30.6}}$ | 32 | $\frac{{15.4 \pm 5.6}}{{5.6{\kern 1pt} --{\kern 1pt} 37.1}}$ | 10 | $\frac{{25.3 \pm 20.0}}{{9.0{\kern 1pt} --{\kern 1pt} 68.7}}$ |
Желтковые ооциты в течение нерестового периода порционно вымётываются, поэтому оценка потенциальной плодовитости калкана возможна только по материалу, собранному накануне нереста (яичники на завершённой IV стадии зрелости) или в самом его начале – в апреле. У 46 самок, собранных в апреле, гонады содержали 894–10804 (5088 ± 2273) тыс. желтковых ооцитов. Зависимости числа вителлогенных ооцитов (Nvo) от длины и массы тела описываются уравнениями: Nvo = 0.0160SL3.239, R2 = 0.55 и Nvo = 1448w + 81.6, R2 = = 0.67 (рис. 5в, 5г). Относительное число желтковых ооцитов в среднем за весь нерестовый период варьировало в пределах 19–3013 (1204 ± 577) тыс. шт/кг массы тела без внутренностей. Средние значения этого показателя снижались (табл. 2): от апреля к маю – на 26%, от мая к июню – на 64%, а общее снижение (от апреля к июню) составило 73%. Таким образом, у калкана, как и у большинства других видов рыб, потенциальная плодовитость полностью не реализуется, а оставшиеся в яичниках желтковые ооциты по окончании нереста подвергаются резорбции.
Средняя масса (без внутренностей) самок в нерестовые сезоны 2007–2018 гг. составила 2.96 кг. Этому значению (согласно установленной связи Nvo−w) соответствует 4368 тыс. желтковых ооцитов. Данное значение является средней потенциальной плодовитостью калкана на юго-западном шельфе Крымского п-ова в 2007–2018 гг. Учитывая, что 73% этого количества ооцитов расходовалось в течение нерестового сезона, значение реализованной (фактической) плодовитости составило 3189 тыс. ооцитов.
Вопрос о числе икрометаний, в ходе которых реализуется плодовитость калкана, довольно сложен в связи с тем, что ПП – наименее стабильный репродуктивный показатель, зависящий не только от размерно-возрастных характеристик самки, но и от ряда других факторов, в том числе от температуры воды (Воробьева, Таликина, 1976) и фазы нерестового периода. Значения ПП в течение нерестового сезона варьировали в широких пределах – 32−1367 (412 ± 288) тыс. шт.; значения ОПП повышались от апреля к маю и значительно снижались от мая к июню (табл. 2), что свидетельствует о постепенном повышении интенсивности икрометания в первой половине нерестового сезона и снижении – во второй. КП повышался по мере расходования запаса желтковых ооцитов в течение всего нерестового периода.
Среднее значение ПП (412 тыс. ооцитов) составило 12.9% среднего значения реализованной плодовитости (3189 тыс. ооцитов), следовательно, кратность икрометания равна 7.7, т.е. каждая самка вымётывает семь–восемь порций икры в течение нерестового сезона.
ВЫВОДЫ
1. Продолжительность нереста черноморского калкана на юго-западном шельфе Крымского п-ова составляет в среднем 2 мес. – с апреля (обычно со II декады) до середины июня (чаще до конца I декады), а наиболее интенсивный нерест – в первые две декады мая.
2. При средней массе тела самки без внутренностей 2.96 кг среднее число желтковых ооцитов, формирующих накануне нереста потенциальную плодовитость, составляет 4368 тыс. шт.
3. В течение нерестового сезона реализуется в среднем 73% потенциальной плодовитости (3189 тыс. ооцитов). Оставшиеся в яичниках желтковые ооциты подвергаются резорбции в течение 2–3 мес. после нереста.
4. ПП калкана составляет в среднем 412 тыс. ооцитов (12.9% реализованной плодовитости); по расчётным данным, каждая самка вымётывает в среднем семь–восемь порций икры в течение нерестового сезона.
Список литературы
Басова М.М. 2000. Роль печени в генеративном процессе у камбаловых рыб (на примере черноморского калкана Psetta maeotica) // Экология моря. Вып. 52. С. 64–67.
Воробьева Н.К., Таликина М.Г. 1976. Результаты анализа созревания самок черноморской камбалы-калкана // Тр. ВНИРО. Т. 115. С. 51–56.
Воробьева Н.К., Таликина М.Г., Золотницкий А.Н. 1975. Исследование созревания самок черноморской камбалы калкан Scophthalmus maeoticus Pallas в экспериментальных условиях // Биол. основы мор. аквакультуры. Вып. 1. С. 42–51.
Гирагосов В.Е., Ханайченко А.Н., Ельников Д.В. 2008. Характер и причины изменчивости основных показателей состояния нерестовой популяции камбалы-калкан на юго-западном шельфе Крыма // Матер. III Междунар. науч.-практ. конф. “Современные проблемы экологии Азово-Черноморского региона”. Керчь: Изд-во ЮгНИРО. С. 3–9.
Гордина А.Д., Морочковский В.А. 1994. Численность и распределение икринок камбалы калкана Psetta maeotica (Scophthalmidae, Pisces) в районе Севастополя // Гидробиол. журн. Т. 30. № 1. С. 99–108.
Игнатьев С.М., Мельников В.В., Климова Т.Н. и др. 2017. Макро- и ихтиопланктон прибрежных районов Крыма летом 2016 г. // Системы контроля окруж. среды. Вып. 28. С. 93–100.
Калинина Э.М. 1960. Особенности порционного икрометания черноморского калкана Scophthalmus maeoticus Pallas // Вопр. ихтиологии. Вып. 16. С. 137–144.
Кротов А.В. 1941. Плодовитость некоторых промысловых рыб северо-западной части Чёрного моря // Докл. АН СССР. Т. 33. № 2. С. 162–163.
Марти Ю.Ю. 1939. Материалы к биологии черноморской камбалы-калкана (Rhombus maeoticus Pallas) // Сборник, посвященный научной деятельности Н.М. Книповича (1885−1939). М.: Изд-во АН СССР. С. 232–253.
Надолинский В.П., Шляхов В.А., Александрова У.Н. 2018. Камбалы Азово-Черноморского бассейна (Bothidae, Scophthalmidae, Pleuronectidae, Soleidae) // Вопр. рыболовства. Т. 19. № 4. С. 424–444.
Овен Л.С. 1976. Особенности оогенеза и характер нереста морских рыб. Киев: Наук. думка, 131 с.
Овен Л.С. 2004. Специфика развития половых клеток морских рыб в период размножения как показатель типа нереста и реакции на условия среды обитания. М.: Изд-во ВНИРО, 188 с.
Овен Л.С., Шевченко Н.Ф., Битюкова Ю.Е. и др. 2001. Размерно-возрастной состав и репродуктивная биология черноморского калкана Psetta maxima maeotica // Вопр. ихтиологии. Т. 41. № 5. С. 631–636.
Попова В.П. 1954. Распределение камбалы в Чёрном море // Тр. ВНИРО. Т. 28. С. 151–159.
Попова В.П. 1958. Питание камбалы-калкан в Чёрном море // Тр. АзЧерНИРО. Вып. 17. С. 141–151.
Попова В.П. 1967. Методы оценки состояния запаса и прогнозирования улова камбалы-калкана Чёрного моря // Тр. ВНИРО. Т. 62. С. 197–204.
Попова В.П. 1972. Особенности биологии размножения черноморской камбалы-калкана Scophthalmus maeoticus maeoticus (Pallas) (наблюдения в море) // Вопр. ихтиологии. Т. 12. Вып. 6. С. 1057–1063.
Попова В.П. 1975. Исследование биологии камбалы калкана в связи с вопросами её искусственного воспроизводства // Биол. основы мор. аквакультуры. Вып. 1. С. 5–12.
Попова В.П., Кокоз Л.М. 1973. О динамике стада черноморской камбалы калкана и его рациональной эксплуатации // Тр. ВНИРО. Т. 91. С. 151–160.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Пятинский М.М. 2017. Определение длины, при которой наступает половая зрелость у черноморского калкана (Scophthalmus maeotica maeotica) // Тр. ЮгНИРО. Т. 54. № 1. С. 71–76.
Сакун О.Ф., Буцкая Н.А. 1968. Определение стадий зрелости и изучение половых циклов рыб. Мурманск: Изд-во Главрыбвод, 47 с.
Смирнов А.И. 1951. Порционность икрометания пелагофильных рыб Чёрного моря // Бюл. МОИП. Отд. биол. Т. 56. № 5. С. 54–57.
Таликина М. Г. 1974. Овогенез и половой цикл черноморской камбалы Scophthalmus maeoticus maeoticus (Pallas) // Вопр. ихтиологии. Т. 14. Вып. 3 (86). С. 436–444.
Таликина М.Г., Воробьева Н.К. 1975. Особенности созревания и характер икрометания черноморской камбалы-калкана (Scophthalmus maeoticus Pall.) в связи с проблемой её искусственного воспроизводства // Тр. ВНИРО. Т. 96. Вып. 4. С. 7–17.
Туркулова В.Н., Новоселова Н.В. 2012. Эколого-физиологические особенности стимуляции созревания производителей черноморского калкана (Psetta maeotica maeotica Pallas) в условиях искусственного воспроизводства // Матер. VII Междунар. конф. “Современные рыбохозяйственные и экологические проблемы Азово-Черноморского региона”. Т. 2. Керчь: Изд-во ЮгНИРО. С. 22–29.
Aydin I., Şahin T. 2011. Reproductive performance of turbot (Psetta maxima) in the southeastern Black Sea // Turk. J. Zool. V. 35. P. 109–113. https://doi.org/10.3906/zoo-0905-26
Giragosov V.E., Khanaychenko A.N. 2012. The state-of-art of the Black Sea turbot spawning population off Crimea (1998–2010) // Turk. J. Fish. Aquat. Sci. V. 12. P. 377–383. https://doi.org/10.4194/1303-2712-v12_2_25
Maslova O.N. 2002. Problems and achievements in seed production of the Black Sea turbot in Russia // Ibid. V. 2. № 1. P. 23–27.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


