Вопросы ихтиологии, 2020, T. 60, № 4, стр. 488-494
Ведущая роль самок большеглазого бычка Gymnogobius heptacanthus (Gobiidae) в преднерестовом поведении
А. И. Маркевич *
Национальный научный центр морской биологии Дальневосточного отделения РАН –
ННЦМБ ДВО РАН
Владивосток, Россия
* E-mail: alexmarkfish@mail.ru
Поступила в редакцию 05.06.2019
После доработки 01.07.2019
Принята к публикации 05.07.2019
Аннотация
Установлено, что самки большеглазого бычка Gymnogobius heptacanthus ярче окрашены и более активны в преднерестовом поведении, чем самцы. В конкуренции за самцов самки проявляют агрессию друг к другу, которая достигает максимума при их полной готовности к нересту. В ухаживании самки тоже играют ведущую роль. Поведенческий репертуар рыб довольно простой. Уровень агрессивности самцов очень низок, за самками они не ухаживают. Территория нерестового участка не является жёстко защищаемым ресурсом. Определяющим фактором активной роли самок является низкая численность нерестовых самцов.
У подавляющего большинства костистых рыб (Teleostei) в процессе размножения (ухаживание, нерест и охрана потомства) наиболее активную роль играют самцы (Helfman et al., 1997). Атрибутами преднерестового поведения являются яркая окраска рыб, зачастую – охрана нерестовой территории и агрессивное поведение как по отношению к конспецифичным, так и гетероспецифичным особям, видоспецифический ритуал ухаживания (Baerends, 1984). Самки обычно играют более пассивную роль в ухаживании и менее активно участвуют в охране территории и уходе за потомством. Но в разных группах рыб есть виды, у которых, наоборот, самки играют более активную роль, чем самцы. Такое изменение полового поведения партнёров отмечено у Canthigaster valentini (Tetraodontidae) (Gladstone, 1987), Julidochromis marlieri (Cichlidae) (Yamagishi, Kohda, 1996), Apogon notatus (Apogonidae) (Okuda et al., 2003), Eucyclogobius newberryi (Swift et al., 1989; Swenson, 1997) и Gobiusculus flavescens (Gobiidae) (Försgren et al., 2004).
У бычков семейства Gobiidae, обитающих в Японском море, подобное явление ранее не отмечалось (Dotu, 1954; Dotsu, 1984; Koyama et al., 2017; Henmi et al., 2018). Но при проведении автором водолазных наблюдений в прибрежной зоне зал. Петра Великого Японского моря активное половое поведение самок было зарегистрировано у большеглазого бычка Gymnogobius heptacanthus (Маркевич, 2010).
Цель настоящей работы − описать преднерестовое поведение большеглазого бычка G. heptacanthus.
МАТЕРИАЛ И МЕТОДИКА
Работы в море проводили периодически в мае–июне 2008, 2010–2012 и 2014–2016 гг. в прибрежье о-ва Попова: в прол. Старка (42°58′48″ с.ш. 131°43′44″ в.д.) и б. Алексеева (42°58′15″ с.ш. 131°44′37″ в.д.). Дно прибрежной мелководной (на глубине до 4.5 м) полосы на этих участках покрыто средним песком с примесью гравия, мелких камней, ракуши и редкими (1–3 экз/м2) растениями морской травы Zostera marina. Зостера не образует сплошные заросли, между отдельными растениями много полян песчаного грунта площадью 1−4 м2. Температура воды изменялась от 3–8°С в начале мая до 14–18°С в конце июня, прозрачность варьировала от 3 до 6 м. Наблюдения за поведением большеглазого бычка вели при поисковых водолазных погружениях один–два раза в сутки в дневное время. За одно наблюдение (40–50 мин) просматривали ~400 м2 (40 × 10 м) дна. На пластиковом планшете отмечали распределение рыб по территории и в отношении друг к другу, описывали особенности их поведения. В 2008 г. для изучения территориального поведения бычков в прол. Старка на глубине 2.5–3.0 м промаркировали площадку размером 2.5 × 4.0 м, где провели 18 ч наблюдений. Общее время визуальных наблюдений составило 146 ч. Поведение рыб дополнительно регистрировали фото- и видеосъёмкой камерами Panasonic Lumix FZ-30 и Canon D550 в подводных боксах, дополнительное освещение не использовали. При видеозаписи снимали либо отдельные 2–5-минутные фрагменты, либо полностью особо характерные сцены поведения (агрессия, ухаживание). Всего отснято 572 фотографии и 42 видеофрагмента общей продолжительностью 4.56 ч. При просмотре фото- и видеофрагментов выделяли типичные элементы поведения рыб; при описании отдельных элементов поведения использовали термины из работ Барендса (Baerends, 1984) и Свенсона (Swenson, 1997). Преднерестовую активность рыб оценивали по интенсивности всех этих действий, рассчитывая частоту их проявления в единицу времени (минуту).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средняя полная длина (TL) взрослых особей большеглазого бычка составляет 58.2 мм, стандартная (SL) − 49.1 мм, масса – 0.770 г; самки незначительно (на 5–7 мм) длиннее самцов (Маркевич, 2010). Самки хорошо отличаются от самцов ярким чёрно-белым пятном, расположенным в конце 1-го спинного плавника, у самцов пятна нет (Fishes …, 2002). Кроме этого, в мае–июне у готовых к нересту самок появляются чёрные полосы по краю анального и 2-го спинного плавников, брюшные плавники становятся полностью чëрными, окраска самцов остаëтся серо-бурой. Во время драк и ухаживания окраска самок усиливается: чёрными становятся почти всё тело, голова и плавники, за исключением грудных, только жëлто-белым пятном выделяется брюшная часть тела (рис. 1).
Рис. 1.
Характерные элементы преднерестового поведения большеглазого бычка Gymnogobius heptacanthus: а – ухаживание самки за самцом, б – самка у норы, в – группа самок в брачной окраске, г – драка самок с взаимозахватом челюстей. Фото А.И. Маркевича.

В конце апреля и начале мая, при повышении температуры воды до 3–8°С, бычки начинают появляться на открытых песчаных участках вблизи зарослей зостеры на глубине 1.2−4.5 м. Общее число рыб в районе наблюдений обычно было невелико: на площади 400 м2 не более 80 (чаще 20–50) особей. Ярко окрашенных (чёрных) самок было ~20%, остальные бычки (серые), не участвующие в размножении самки и самцы, собирались в группы по 6–30 рыб и активно питались планктоном над зостерой. Самок всегда заметно больше, чем самцов; их соотношение варьировало от 2 : 1 до 5 : 1. Чёрных самок с активным поведением обычно встречалось за одно наблюдение не больше 5–10. В 2012 г. в прибрежье прол. Старка почти полностью исчезли заросли зостеры и бычки здесь практически исчезли.
Размножающиеся бычки распределяются у дна поодиночке и небольшими группами по три–пять особей в 0.05–0.50 м от дна; расстояние между рыбами − 0.67 ± 0.46 (0.1–2.5) м (n = 91). В 20–30% случаев самки встречаются поодиночке, в 25% – с одним самцом, но не все пары стойки, многие быстро распадаются. В начале периода размножения группы преимущественно (70–80%) состоят из нескольких самок и одного самца, в конце – чаще только из самок (рис. 1в). Самцы в одной группе обычно остаются только на несколько минут, а затем уплывают к другим группам.
Чёрные самки подолгу придерживаются небольшого участка площадью 2–5 м2, центром которого является одна или несколько нор в песке (рис. 1б). Нора представляет собой один или несколько (до пяти) близко расположенных (20–40 см) друг к другу вертикальных ходов диаметром 2.2 ± 0.7 см и глубиной 25.7 ± 8.6 (14–37) см (n = 28). Пока не выяснено происхождение таких нор. Может быть, бычки сооружают их сами, но такие действия ни разу не наблюдались, кроме нескольких случаев, когда бычки выносили песок из норы, выплёвывая его изо рта. Вероятнее всего, рыбы используют готовые ходы двустворчатых моллюсков или ракообразных, но в ходе наблюдений лишь однажды был встречен моллюск Saxidomus purpurata (Bivalvia: Veneridae). Остаётся неясной внутренняя топография нор.
При приближении опасности (наблюдатель) чёрные самки в половине случаев скрывались в норе, ныряя в неё быстрым броском вниз, в остальных – уходили в сторону на 0.5–1.5 м и возвращались назад при исчезновении угрозы. Другие рыбы группы уходили от опасности в 70% случаев, в остальных – прятались в нору, редко – в песок, быстро ныряя в него головой. В норе рыбы находились от нескольких секунд до минуты, медленно выходя из неё головой вверх. Состав групп был непостоянен: серые самки и самцы перемещались из одной группы в другую, задерживаясь в каждой до получаса и более. Среднее расстояние между группами и отдельными рыбами составляло ~ 0.7 м (0.5–2.8 м). Самцы вели себя пассивно, иногда они распределялись поодиночке вблизи групп самок, реже – образовывали группы до пяти–шести особей. Уровень агрессивности у них очень низок, нападения и драки (удары рылом в голову и хвостом в тело при горизонтальном параллельном расположении соперников) зарегистрированы только два раза, при внешней опасности (наблюдатель) самцы значительно чаще уплывали в сторону на 2–4 м.
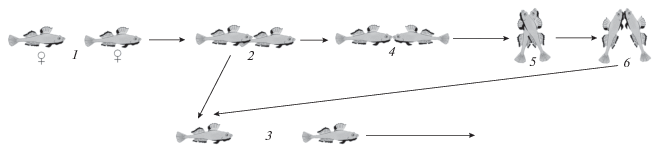
Если возле норы держалась группа бычков, то в ней обычно была только одна чëрная самка, при подходе другой чёрной самки на расстояние 0.5–1.0 м в большинстве случаев (70–80%) происходило нападение резидента участка на вторженца. В подавляющем большинстве случаев (~90%) резидент изгонял вторженца быстрыми ударами рылом в заднюю часть тела и в спинные и анальный плавники, преследуя на расстояние от 0.7 до 2.5 м, и вторженец быстро уплывал (рис. 2). Чаще всего это происходило, когда и резидент, и самка-вторженец были чёрными. Редко атаковывались слабо окрашенные самки и очень редко – самцы, в этих случаях нападение ограничивалось одним броском и ударом, после чего вторженцы уходили в сторону. В 10–15% случаев чёрная самка-вторженец отвечала ударом на удар резидента, и тогда завязывалась ожесточённая драка, длящаяся от 10–20 с до нескольких минут. В драках наблюдали широкий диапазон приёмов: от взаимных ударов рылом в голову, бока, заднюю часть тела и хвост при кружении соперниц в горизонтальном параллельном расположении тела, а также удары хвостом по задней части тела. В особо жëстких противостояниях самки начинали угрожать друг другу, сходясь вплотную и широко раскрывая рты при вертикальном расположении тела, часто эти угрозы быстро переходили во взаимозахват челюстей и последующие сильные взаимные удары рылом в голову (рис. 1г, 2). Драки происходили в 0.3−1.0 м от дна. Интенсивность драк сильно варьировала, в среднем самки-резиденты совершали 5.01 ± 4.45 удара в минуту (n = 70), когда соперницы быстро уплывали, избегая нападения. Захват челюстей при драках проявлялся немного реже – 4.07 ± 4.56 раза в минуту (n = 32). В драках более чем в 90% случаев победу одерживали резиденты территории, но изредка они проигрывали и покидали место схватки. В одном случае чёрная самка напала на проплывающую рядом с ней дальневосточную навагу Eleginus gracilis TL 160 мм. В результате драк к концу июня у большинства чёрных самок были рассечены непарные плавники и видны раны на теле. Несмотря на то что резиденты территории постоянно вытесняли соперниц, последние в большинстве случаев оставались в пределах 1.5−2.0 м от нерестового участка и часто принимали участие в нересте наряду с резидентом.
Рис. 2.
Этограмма агрессивного поведения самок большеглазого бычка Gymnogobius heptacanthus: 1 – быстрое приближение, 2 – удар (укус), 3 – преследование−избегание, 4 – фронтальная демонстрация, 5 – драка, 6 – захват челюстей.
Самки не придерживались строго одной своей норы и окружающей еë территории. Наблюдения на маркированном участке показали, что на площади 10 м2 первоначально встречались три–шесть самок, из которых одна–две были чёрными. Рыбы распределялись поодиночке и придерживались своих нор, отмечали агрессивные атаки соседних рыб. Но в течение трёх–восьми дней регулярных наблюдений рыбы потеряли чёрную окраску, начали перемещаться в стороны от своих участков, число их на площадке постоянно менялось, а и нападений уже не было.
Учащение и усиление брачных отношений продолжается в течение первой половины июня. Ухаживание чёрная самка начинает проявлять сразу же при приближении самца на 0.3–1.0 м. Она плавно описывает круги медленными, но энергичными ундулирующими движениями задней частью тела, хвостом, анальным и 2-м спинным плавником в 0.2–0.5 м от самца, широко расправляет все плавники, приподнимая вверх переднюю часть тела на 30°–70°, демонстрирует светлый округлый живот (рис. 1а, 3). Двигается самка довольно медленно, описывая 3.33 ± 1.75 круга в минуту (n = 50). Если при ухаживании самец двигается, то самка кружит, плавая перед ним (рис. 3). При появлении другой чёрной самки на расстоянии до 1.0–1.5 м первая тут же прекращает ухаживание и нападает на неё. Самка-вторженец либо избегает нападения, либо завязывается драка с захватом челюстей, в результате которой соперница уплывает. Если самец в это время оставался поблизости, самка-резидент возобновляла попытки ухаживания; но в большинстве случаев через 3–4 мин самец уплывал, и процесс ухаживания прерывался (рис. 3). При одном наблюдении самка прекратила кружение и отплыла от самца, после чего он догнал её, укусил за кончик хвоста и анальный плавник, и самка возобновила кружение. В двух случаях самки демонстрировали поведение ухаживания перед рыбами других видов – опоясанным опистоцентром Opisthocentrus zonope и дальневосточной навагой, обитающими вблизи зостеры.
Рис. 3.
Этограмма ухаживания большеглазого бычка Gymnogobius heptacanthus: 1 – приближение самки к самцу, 2 – демонстрация плавников самкой, 3 – кружение самки вокруг самца, 4 – вход самца и самки в нору, 5 – вход 2-й самки в нору, 6 – уход самца и прерывание ухаживания.
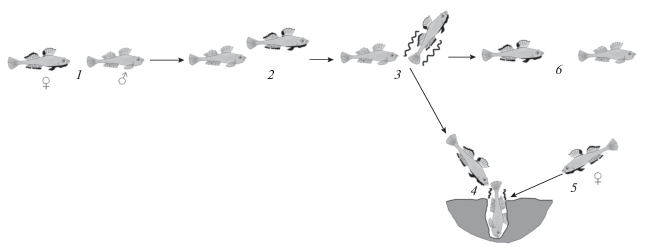
Процесс ухаживания редко заканчивался нерестом; по-видимому, его удалось наблюдать только дважды в середине июня при температуре 14.2 и 17.1°С. В одном случае после ухаживания самка нырнула в нору, за ней вошëл один самец, после чего вошла ещё одна чёрная самка и второй самец; в норе все они оставались ~1 мин. Во втором случае ухаживающая самка нырнула в песок возле корней куста зостеры, за ней – самец и ещё две чёрные самки, все рыбы вышли из песка тоже в течение 1 мин. В обоих случаях ухаживающие самки сначала нападали на соседних чёрных самок, отгоняя их на 1.0–1.5 м от нор, но последние сразу же возвращались назад, что позволило им, по-видимому, тоже принять участие в нересте. Поиск отложенной икры не проводили. В июле чёрных рыб не видели и активного поведения бычков не фиксировали. В середине августа вблизи мест обитаний взрослых большеглазых бычков обычно начинали встречаться группы их мальков TL 15–25 мм.
Проведённые наблюдения показали, что период размножения у большеглазого бычка в зал. Петра Великого начинается в мае, вскоре после полного схода ледового покрова и прогрева воды до 3–8°С. Нерестовые территории находятся в прибрежной полосе на глубине 1.5–3.5 м на песчано-галечном грунте вблизи зарослей зостеры. Кладки икры помещаются в норы-убежища, хозяевами которых являются, вероятно, креветки и моллюски. Например, производители родственных большеглазому бычку видов используют для нереста норы Decapoda: Chaenogobius castanea – раков-кротов Nihonotrypaea japonica (Callianassidae) (Dotu, 1954), а Gymnogobius cylindricus и G. macrognathos – дополнительно и норы Upogebia major и U. yokoai (Upogebiidae) (Koyama et al., 2017). Эти виды ракообразных обитают в водах зал. Петра Великого, но большеглазые бычки в их норах найдены не были (Марин, 2013). В отличие от многих других видов бычков Gobiidae, у которых самцы активно охраняют нерестовую территорию, привлекают самок к нересту и охраняют потомство (Dotu, 1954; Yanagisawa, 1982; Faria et al., 1998; Suc, Choe, 2002; Koyama et al., 2017; Henmi et al., 2018), у большеглазого бычка лидирующую роль в процессе ухаживания и нереста играет самка. Такое активное поведение самок большеглазого бычка является постоянным и постоянным же является пассивное поведение самцов в противоположность, например, бычкам Eucyclogobius newberryi (Swift et al., 1989; Swenson, 1997) и Gobiusculus flavescens (Försgren et al., 2004, Amundsen, 2018), у которых рыбы обоих полов охраняют нерестовую территорию, демонстрируют агрессию к конспецификам и поведение ухаживания с немного более активной ролью самок. Роль самок упомянутых видов изменяется в разные периоды сезона размножения: она усиливается в конце, когда большинство самцов заняты охраной кладок икры и численность оставшихся беременных самок превышает таковую самцов (Suc, Choe, 2002; Amundsen, 2018). Вероятно, этот эффект проявляется и у большеглазого бычка: по визуальным оценкам, число беременных самок на нерестилище постоянно значительно превышало число свободных половозрелых самцов.
Поведенческий репертуар, демонстрируемый самками большеглазого бычка при драках и ухаживании, заметно беднее, чем, например, у цихлиды Aequidens portalegrensis (Baerends, 1984). Но большинство элементов поведения, используемых бычками E. newberryi (Swift et al., 1989; Swenson, 1997) и в меньшей степени рыбами рода Eviota (Sunobe, 1998), наблюдаются и у большеглазого бычка. Так, при быстротечных драках с преследованием самки чаще всего используют такие элементы поведения, как демонстрация плавников (fin display), приближение (approaching), быстрое приближение (charging), преследование (chasing), захватывание, укус (biting), удар хвостом (tail beating), боковая демонстрация (lateral display), избегание (fleeng). При ожесточённых конфликтах между самками основными элементами являются: плавание вокруг (swimming around), демонстрация спереди (frontal display), открывание рта (gape) и захват челюстей (mouth fighting, lock jaws). Следует отметить, что драки с захватом челюстей и практически вертикальным расположением рыб (рис. 1г) являются видоспецифичными для большеглазого бычка; ни у A. portalegrensis (Baerends, 1984), ни у E. newberryi (Swenson, 1997) такой элемент поведения не отмечен. В ухаживании самок большеглазого бычка за самцами отмечены такие ключевые элементы поведения, как демонстрация плавников, кружение (circling), волнообразные удары хвостом (weaving, tail beating) и ведение (leading). Раскрывание жаберных крышек (throat expansion) самки большеглазого бычка ни при агрессивных контактах, ни при ухаживании не используют, но ярко выделяющаяся чёрная окраска головы и горла (рис. 1а) фактически равнозначна этому элементу. Репертуары агрессивного поведения и ухаживания у самок большеглазого бычка очень сходны с таковыми у E. newberryi (Swift et al., 1989; Swenson, 1997). Близким является и низкий уровень агрессивности самок обоих видов по отношению к самцам, поэтому самцы не демонстрируют умиротворяющее поведение, как это наблюдается у самок цихловых рыб во время ухаживания (Baerends, 1984), а либо избегают ухаживания самок, либо отвечают на них. Особенностью, отличающей большеглазого бычка от других бычковых, является их расположение в толще воды, а не в контакте с грунтом. Поэтому у них нет таких поз, служащих важными элементами в поведении ухаживания бычков Eviota, как поднятие и опускание спинных, анального плавников и хвоста, поднятие тела на брюшных плавниках, потряхивание головой (Sunobe, 1998) или сигмоидная поза, как у E. newberryi (Swenson, 1997).
Поведение ухаживания самками большеглазого бычка, наблюдаемое in situ, редко заканчивается откладкой икры: по-видимому, это произошло только в двух случаях из 50 наблюдений (4%); такая же частота отмечена и у E. newberryi (Swenson, 1997) – самка зашла в гнездо самца в одном случае из 23 (4.3%). Следует отметить, что большеглазые бычки используют особую тактику проникновения в песок при нересте, если нет открытого входа в нору или в полость в песке: они закапываются в песок быстрым броском головой вниз. Так делают и Limnichthys nitidus (Creediidae) (Cozzi, Clark, 1995), а также и сами большеглазые бычки, когда скрываются в песке от хищников (Маркевич, 2010).
Несмотря на хорошие камуфляжную окраску и способы укрываться от хищников, по нашим данным, численность бычков довольно заметно меняется год от года. По-видимому, эти колебания зависят от успеха размножения, выживаемости потомства и изменений природных условий, сильно влияющих на рыб с таким коротким жизненным циклом (1 год) (Dotsu, 1984). Также возможно, что немаловажным обстоятельством является и активная роль самок в ухаживании, и неизбежная их частичная гибель в результате преднерестовых драк и более яркой демаскирующей окраски и, как следствие, большей доступности для хищников.
Описанные ранее феномены смены половых ролей в нерестовом поведении рыб объясняли разными факторами – доступным числом убежищ для откладки икры, значительным численным преобладанием самок над самцами, даже различиями в половых ролях в разных частях ареала одного вида (Försgren et al., 2004). Подобное явление, отмеченное нами у большеглазого бычка, дополнило банк данных по размножению бычковых рыб, которые демонстрируют очень большую пластичность репродуктивного поведения. Это поведение зависит не только от биологии отдельных видов, но и широко варьирует в зависимости от складывающихся абиотических и внутрипопуляционных условий.
Список литературы
Марин И.Н. 2013. Малый атлас десятиногих ракообразных России. М.: Т-во науч. изд. КМК, 145 с.
Маркевич А.И. 2010. Модификация социального поведения большеглазого бычка Gymnogobius heptacanthus в течение жизненного цикла // Матер. докл. IV Всерос. конф. “Поведение рыб”. М.: АКВАРОС. С. 218−223.
Amundsen T. 2018. Sex roles and sexual selection: lessons from a dynamic model system // Current Zool. V. 64. № 3. P. 363−392. https://doi.org/10.1093/cz/zoy036
Baerends G.P. 1984. The organization of the pre-spawning behaviour in the cichlid fish Aequidens portalegrensis (Hensel) // Netherl. J. Zool. V. 34. № 3. P. 233−366. https://doi.org/10.1163/2829684x00191
Cozzi J., Clark E. 1995. Darting behavior of a sandburrower fish, Limnichthys nitidus (Creediidae), in the Red Sea // Environ. Biol. Fish. V. 44. № 4. P. 327−336. https://doi.org/10.1007/BF00007352704614
Dotsu Y. 1984. The biology and induced spawning of the gobiid fish, Chaenogobius heptacanthus // Bull. Fac. Fish. Nagasaki Univ. V. 55. P. 9−18.
Dotu Y. 1954. On the life history of a goby, Chaenogobius castanea O’Shaughnessy // Jpn. J. Ichthyol. V. 3. P. 133−138.
Faria C., Almada V.C., Gonçalves E.J. et al. 1998. Notes on the social behavior of Gobius cobitis (Pisces, Gobiidae) // Acta Ethol. V. 1 (1−2). P. 49−56.
Fishes of Japan with pictorial keys to the species. 2002 / Ed. Nakabo T. V. 1−2. Tokyo: Tokai Univ. Press, 1748 p.
Försgren E., Amundsen T., Borg A.A., Bjelvenmark J. 2004. Unusually dynamic sex roles in a fish // Nature. V. 429. P. 551−554. https://doi.org/10.1038/nature02562
Gladstone W. 1987. Role of female territoriality in social and mating systems of Canthigaster valentini (Pisces: Tetraodontidae): evidence from field experiments // Mar. Biol. V. 96. № 2. P. 185−191. https://doi.org/10.1007/BF00427018
Helfman G.S., Collette B.B., Facey D.E. 1997. The diversity of fishes. London: Blackwell Sci., 529 p.
Henmi Y., Eguchi K., Inui R. et al. 2018. Field survey and resin casting of Gymnogobius macrognathos spawning nests in the Tatara river, Fukuoka prefecture, Japan // Ichthyol. Res. V. 65. № 1. P. 168−171. https://doi.org/10.1007/s10228-017-0590-7
Koyama A., Inui R., Umemura K. et al. 2017. The first record of the spawning nest of Gymnogobius cylindricus and Gymnogobius macrognathos // Ibid. V. 64. № 2. P. 261−263. https://doi.org/10.1007/s10228-016-0548-1
Okuda N., Fukumori K., Yanagisawa Y. 2003. Male ornamentation and its condition-dependence in a paternal mouthbrooding cardinalfish with extraordinary sex roles // J. Ethol. V. 21. № 2. P. 153−159. https://doi.org/10.1007/s10164-002-0091-6
Swenson R.O. 1997. Sex-role reversal in the tidewater goby, Eucyclogobius newberryi // Environ. Biol. Fish. V. 50. № 1. P. 27−40. https://doi.org/10.1023/A:1007352704614
Swift C.C., Nelson J.L., Maslow C., Stein T. 1989. Biology and distribution of the tidewater goby, Eucyclogobius newberryi (Pisces: Gobiidae) of California // Nat. Hist. Mus. Los Angeles County. № 404. P. 1−19.
Suc H.Y., Choe J.C. 2002. Females prefer males with larger dorsal fins in the common freshwater goby // J. Fish. Biol. V. 61. № 4. P. 899−914. https://doi.org/10.1111/j.1095-8649.2002tb01851.x
Sunobe T. 1998. Reproductive behavior in six species of Eviota (Gobiidae) in aquaria // Ichthyol. Res. V. 45. № 4. P. 409−412. https://doi.org/10.1007/BF02725195
Yamagishi S., Kohda M. 1996. Is the cichlid fish Julidochromis marlieri polyandrous? // Ibid. V. 43. № 4. P. 469−471. https://doi.org/10.1007/BF02347645
Yanagisawa Y. 1982. Social behaviour and mating system of the gobiid fish Amblyeleotris japonica // Jpn. J. Ichthyol. V. 28. № 4. P. 401−422. https://doi.org/10.11369/jji1950.28.401
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


