Вопросы ихтиологии, 2020, T. 60, № 4, стр. 452-459
Происхождение двух видов гольцов (Salvelinus, Salmonidae) озера Эльгыгытгын: данные по ATPase6–NADH4L-участку митохондриальной ДНК
А. Г. Осинов 1, *, А. А. Волков 2
1 Московский государственный университет
Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
* E-mail: a-osinov@yandex.ru
Поступила в редакцию 19.07.2019
После доработки 06.11.2019
Принята к публикации 08.11.2019
Аннотация
Для проверки надёжности данных анализа полиморфизма длин рестрикционных фрагментов ATPase6–NADH4L-участка митохондриальной ДНК (2162 п.н.), которые однозначно свидетельствуют в пользу аллопатрического происхождения малоротой Salvelinus elgyticus и “боганидской” S. “boganidae” палий оз. Эльгыгытгын, проведено секвенирование этого участка у некоторых представителей S. alpinus–S. malma complex. Показано, что данные по числу сайтов рестрикции и размеру рестриктов для фрагмента 2162 п.н., полученные с помощью рестрикционного анализа, для большинства форм и видов гольцов плохо соответствуют данным по нуклеотидным последовательностям. С учётом выявленных ошибок данные по сайтам рестрикции MvaI для ATPase6–NADH4L-участка митохондриальной ДНК не могут рассматриваться в качестве однозначного свидетельства в пользу аллопатрического происхождения двух видов гольцов оз. Эльгыгытгын. Тем не менее, нуклеотидные данные по этому фрагменту с большой вероятностью позволяют предположить, что малоротая и “боганидская” палии оз. Эльгыгытгын имеют аллопатрическое происхождение.
Гольцы Salvelinus alpinus–S. malma complex являются одними из наиболее фенотипически и экологически изменчивых видов лососёвых рыб (Salmonidae) (Берг, 1948; Behnke, 1980; Савваитова, 1989). Во многих озёрах на их циркумполярном ареале обитают от двух до пяти−семи (например: Esin et al., 2018) форм гольцов, в разной степени репродуктивно изолированных между собой. Происхождение таких форм является предметом длительной дискуссии, особо острой в контексте моделей симпатрического и аллопатрического видообразования. Классическая модель симпатрического видообразования предполагает возникновение сестринских видов из исходно панмиктической популяции при отсутствии географической изоляции. Исходя из этого определения, другие модели внутриозёрного видообразования, в том числе гибридного, когда образование новых видов происходит из гибридного роя (например: Seehausen, 2004), можно лишь условно рассматривать как симпатрические. Отметим, что различить симпатрическое, аллопатрическое и гибридное видообразование у гольцов крайне сложно, особенно когда во вторичный контакт вступили слабо генетически дивергировавшие формы (Осинов, 2001). Некоторые авторы категорически отвергают саму возможность симпатрического видообразования, в том числе у гольцов (Викторовский, 1978). Другие авторы приводят большое число моделей симпатрического видообразования и полагают, что у гольцов есть один убедительный и несколько возможных примеров такого видообразования (Bolnick, Fitzpatrick, 2007). В список возможных примеров симпатрического видообразования у гольцов (Bolnick, Fitzpatrick, 2007) включены и озёрные гольцы из Забайкалья (Alekseyev et al., 2002). Необходимо осторожно подходить к доказательствам симпатрического видообразования (Coyne, Orr, 2004), в том числе и для перечисленных ранее примеров у гольцов (Bolnick, Fitzpatrick, 2007), так как в послеледниковое время в разных частях ареала рода Salvelinus происходили вторичные контакты между основными филогенетическими линиями, а также между молодыми ледниковыми изолятами (Osinov et al., 2015). Например, анализ происхождения разных экологических форм гольца в оз. Даватчан и в других озёрах Забайкалья с использованием морфологических и трофических признаков (Alekseyev et al., 2002), аллозимов (Осинов, 2002) и микросателлитной ДНК (Гордеева и др., 2010) указывал на модель симпатрического видообразования как наиболее вероятную. Согласно результатам анализа геномных данных, наиболее вероятно, что в большинстве озёр Забайкалья имел место вторичный контакт популяций из разных ледниковых рефугиумов (Jacobs et al., 2019).
Ранее на основании анализа изменчивости по микросателиттам и последовательностям контрольного района (550 пар нуклеотидов (п.н.)) и гена цитохрома b (cyt b, 1053 п.н.) митохондриальной (мт) ДНК была подтверждена строгая репродуктивная изоляция трёх видов гольцов оз. Эльгыгытгын и высказано предположение о симпатрическом происхождении малоротой S. elgyticus и “боганидской” палий (Osinov et al., 2015). Однако этому предположению явно противоречили данные анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) ATPase6–NADH4L- участка мтДНК длиной 2162 п.н. (Радченко, 2003), который включает фрагменты генов ATPase6, COIII, NADH3, NADH4L (Oohara et al., 1997). Согласно этим данным малоротая и “боганидская” палии оз. Эльгыгытгын относятся к двум разным митогруппам гольцов из числа пяти, выделенных Радченко (2003), что прямо указывает на их аллопатрическое происхождение. Таким образом, данные по нуклеотидным последовательностям фрагмента контрольного района и гена cyt b находятся в явном противоречии с ПДРФ данными по ATPase6–NADH4L-участку мтДНК. Так как эти данные имеют принципиальное значение для решения вопроса о способах видообразования у двух видов гольцов оз. Эльгыгытгын, мы секвенировали фрагмент мтДНК 2162 п.н. у некоторых представителей Salvelinus alpinus–S. malma complex.
Цель работы – проверить, в какой мере данные ПДРФ-анализа ATPase6–NADH4L-участка мтДНК соответствуют нуклеотидным данным и действительно ли они однозначно свидетельствуют в пользу аллопатрического происхождении двух видов гольцов оз. Эльгыгытгын.
МАТЕРИАЛ И МЕТОДИКА
Озеро Эльгыгытгын, происхождение чаши которого большинство геологов связывают с ударом метеорита около 3.6 млн лет назад (Gurov et al., 2007), располагается на Чукотке (67°30′ с.ш. 172°05′ в.д.) на высоте 490 м над уровнем моря. Оно имеет округлую форму и диаметр 12−15 км. В озере обитают три вида гольцов рода Salvelinus. В работе использован материал по гольцам оз. Эльгыгытгын и из других локальностей, собранный нами или любезно предоставленный нашими коллегами (таблица).
Суммарную ДНК выделяли с применением набора для выделения геномной ДНК (Wizard SV Genomic DNA Purification System, “Promega”, США). Для амплификации ATPase6–NADH4L-участка мтДНК длиной 2162 п.н. использовали пары праймеров P01–P42 (Oohara et al., 1997). Стандартная полимеразная цепная реакция (ПЦР) была составлена в конечном объёме 25 мкл и содержала: 50–100 нг матричной ДНК, 2.5 мкл 10× ПЦР буфера (670 ммоль Трис-HCl pH 8.8, 166 ммоль (NH4)2SO4, 0.1% Tween-20, 2 ммоль MgCl2, 0.45 ммоль каждого дезоксирибонуклеозидтрифосфата, по 10 мкмоль каждого праймера и 5 ед. SmarTaq™ ДНК-полимеразы (“Диалат”, Россия). ПЦР проводили по следующей схеме: 2 мин при 96°C; далее 35 циклов: 10 с при 96°C, 30 с при 58°C, 60 с при 72°C; с последующей достройкой 5 мин при 72°C. После окончания ПЦР продукты амплификации визуализировали на 2%-ном агарозном геле и обрабатывали 10 ед. экзонуклеазы I (“Thermo Scientific”, США) при 37°C в течение 15 мин с последующей инактивацией в течение 10 мин при 80°C. Секвенирование ПЦР-продукта осуществляли в прямом и обратном направлениях с использованием набора BigDye ver. 3.1 (Cycle Sequencing Kit, “Applied Biosystems, Inc.”, США). Разделение продуктов реакции секвенирования проводили на генетическом анализаторе AB3500 (“Applied Biosystems”, США). Для секвенирования в прямом направлении использовали праймеры P01, P11, P21, P31, P41; для секвенирования в обратном направлении – P02, P12, P22, P32, P42 (Oohara et al., 1997). Для получения результирующего *.fasta-файла все хроматограммы, относящиеся к одному и тому же образцу, были выровнены относительно референтной последовательности (S. alpinus NC_000861) с помощью программы Geneious 6.0.4.
Для построения филогенетических деревьев использованы методы присоединения соседей (NJ), максимального правдоподобия (ML) и невзвешенной максимальной экономии (MP). Все расчёты проведены с помощью программы PAUP ver. 4.0b10 (Swofford, 2002). Оптимальную модель нуклеотидных замен искали с помощью программы Modeltest ver. 3.8 (Posada, Crandall, 1998) и AIC-критерия. Для ML дерева использована оптимальная модель замен (GTR + I, pinvar = 0.8394). Стабильность узлов на филогенетических деревьях проверяли с помощью непараметрического бутстрэп-анализа (1000 псевдореплик). Для построения сети гаплотипов гаплогруппы Arctic использовали метод медианного присоединения (median-joining, MJ) (Bandelt et al., 1999), реализованный в программе PopArt (Leigh, Bryant, 2015). Параметр эпсилон принят равным нулю. Для построения филогенетических деревьев и нетворка помимо собственных данных также использованы некоторые последовательности, взятые из генбанка (таблица). В качестве внешней группы использованы последовательности из генбанка южной формы мальмы S. m. krascheninnikovi из Азии (депонирована как S. curilus (KJ746619)) и кунджи S. leucomaenis (KF974452).
РЕЗУЛЬТАТЫ
Сравнение данных ПДРФ-анализа и секвенирования 2162 п.н. мтДНК фрагмента (таблица)
У “боганидской” и малоротой палии из оз. Эльгыгытгын выявлены разные наборы фрагментов рестрикции, хотя их размер и число по результатам двух анализов различаются. Так, согласно данным ПДРФ-анализа, у обоих видов по два фрагмента (один сайт рестрикции), а по нуклеотидным данным их три (два сайта рестрикции). Согласно обоим анализам, малоротая палия и голец из оз. Джульетта из бассейна Колымы имеют один набор рестриктов. По ПДРФ-данным, “боганидская” палия имеет тот же набор рестриктов, что и голец из некоторых озёр (бассейн р. Выквынайваам) Чукотки, а по нуклеотидным данным (голец из оз. Найвак), у них разные наборы фрагментов. По ПДРФ-данным, малоротая палия имеет тот же набор рестриктов, что и северная мальма. По нуклеотидным данным, наборы рестриктов у малоротой палии, с одной стороны, и у северной формы мальмы, а также у гольцов из большой части озёрных популяций из бассейна Колымы, у которых в результате интрогрессивной гибридизации произошёл захват мтДНК северной мальмы (Osinov et al., 2017; Осинов и др., 2018), с другой стороны, различаются. В целом нуклеотидные данные указывают на то, что опубликованные ПДРФ-данные (Радченко, 2003, 2005) содержат существенные неточности, что ставит под сомнение сделанные на их основании выводы.
Размеры рестриктов MvaI фрагмента мтДНК (2162 п.н.) по данным анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) и секвенирования и мтДНК-гаплогруппы у гольцов Salvelinus alpinus–S. malma complex
| Таксон | Локальность | Размер рестриктов, п.н. (число рыб, экз.) |
мтДНК- гапло-группа | Гаплотип | Номер в генбанке | |
|---|---|---|---|---|---|---|
| ПДРФ | Секвенирование | |||||
| S. “boganidae” | Эльгыгытгын, Чукотка | 1600, 520 (22) | 861, 786, 514 (5) | Arctic | ARC2 | MN635497− MN635501 |
| S. elgyticus | То же | 1700, 370 (13) | 1648, 322, 192 (3) | ARC3, ARC4, ARC5 | MN635502− MN635504 | |
| S. alpinus | Джульетта, Колыма | 1700, 370 (25) | 1648, 322, 192 (3) | ARC1 | MN635494− MN635496 | |
| Выквынайваам, Чукотка | 1600, 520 (21) | н.д. | н.д. | н.д. | ||
| Найвак, Чукотка | н.д. | 1648, 514 (3) | ARC7, ARC8 | MN635508− MN635510 | ||
| 3 сайта, Западная Гренландия | н.д. | 1648, 514 (9) | ARC6 | MN635505–MN635507 | ||
| Норт-Слоуп, Аляска, США | н.д. | 1648, 514 (1) | ARC6 | MF621740 | ||
| То же | н.д. | 1648, 514 (1) | ARC9 | MF621741 | ||
| Nauyuk, СЗТ, Канада | н.д. | 1648, 514 (2) | ARC6 | MN635511 | ||
| P & N lakes, СЗТ, Канада | н.д. | 1648, 514 (1) | ARC6 | MN635521 | ||
| Кенгре, Индигирка | н.д. | 1648, 416, 98 (3) | Siberia | SIB1 | MN635515-MN635517 | |
| Лама, Таймыр | 1700, 500 (2) | н.д. | Siberia, Atlantic | н.д. | н.д. | |
| Аян, Таймыр | н.д. | 1648, 393, 23, 98 (1) | Siberia | SIB2 | MN635518 | |
| Fjellfrostvatnet, Норвегия | н.д. | 1648, 416, 98 (1) | Atlantic | ATL1 | MN635519 | |
| Шпицберген | н.д. | 1648, 416, 98 (1) | ATL2 | MN635520 | ||
| Овод, Колыма | н.д. | 1746, 322, 94 (3) | Bering | BER1 | MN635512–MN635514 | |
| S. albus | Азабачье, Камчатка | н.д. | 1746, 322, 94 (1) | BER2 | KT266870 | |
| S. malma | Быстрая, Камчатка | н.д. | 1746, 322, 94 (1) | BER3 | KJ746618 | |
| S. malma | Утаатап, Чукотка | 1700, 370 (12) | н.д. | н.д. | н.д. | |
| S. alpinus | Мак-Мак, Ола, Охотоморье | 1700, 370 (32) | н.д. | н.д. | н.д. | |
Анализ филогенетических деревьев и сети гаплотипов для мтДНК-фрагмента2162 п.н.
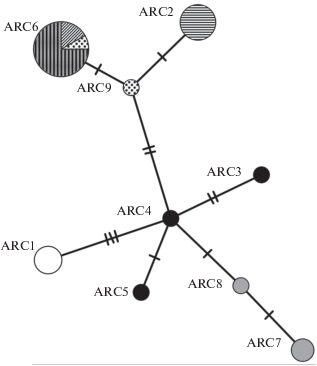
Все филогенетические деревья (NJ, MP, ML) имеют сходную топологию и близкие значения бутстрэп-оценок для большинства выявленных клад. Основное различие между топологией ML‑дерева (рис. 1), с одной стороны, и топологией MP- и NJ-деревьев, с другой стороны, связано с тем, что на последних все таксоны, за исключением кунджи и южной формы мальмы, образуют кладу с высокой бутстрэп-поддержкой (соответственно 92 и 100%). На всех филогенетических деревьях присутствует хорошо поддержанная клада гаплотипов группы Arctic (гаплогруппа гольца Таранца), а внутри неё − клада, объединяющая гаплотипы “боганидской” палии и гольца Таранца S. alpinus taranetzi из северной части Аляски, северо-западных территорий Канады и Западной Гренландии. Последняя клада чётко выделяется на сети гаплотипов (гаплотипы ARC2, ARC9, ARC6) (рис. 2).
Рис. 1.
ML-дерево гаплотипов ATPase6–NADH4L-участка мтДНК гольцов S. alpinus–S. malma complex, построенное с использованием модели GTR + I. Значения бутстрэп-поддержи (в % 1000 реплик) для ML/MP-деревьев указаны около узлов; обозначение таксонов и гаплотипов мтДНК см. в таблице, за исключением S. alpinus ACD1 (AF154851).
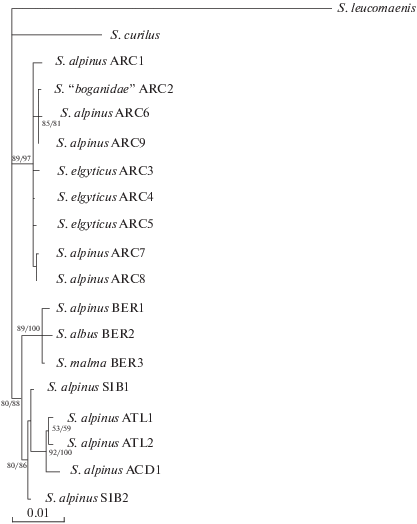
Рис. 2.
MJ-сеть гаплотипов фрагмента мтДНК 2162 п.н. гаплогруппы Arctic, выявленных у “боганидской”
Salvelinus “boganidae” и малоротой S. elgyticus палий оз. Эльгыгытгын, и в популяциях гольца Таранца S. alpinus taranetzi из разных локальностей: ( ) – Аляска, (
) – Аляска, ( ) – Гренландия, (
) – Гренландия, ( ) – “боганидская” палия оз. Эльгыгытгын, (⚫) – малоротая палия оз. Эльгыгытгын, (⚪)
– Колыма, (
) – “боганидская” палия оз. Эльгыгытгын, (⚫) – малоротая палия оз. Эльгыгытгын, (⚪)
– Колыма, ( ) – северо-западные территории Канады, (
) – северо-западные территории Канады, ( ) – оз. Найвак, Чукотка. Число нуклеотидных замен между гаплотипами соответствует
числу поперечных линий на ветвях; обозначение локальностей и гаплотипов мтДНК см.
в таблице.
) – оз. Найвак, Чукотка. Число нуклеотидных замен между гаплотипами соответствует
числу поперечных линий на ветвях; обозначение локальностей и гаплотипов мтДНК см.
в таблице.
ОБСУЖДЕНИЕ
Среди гольцов рода Salvelinus наиболее проблематичны филогенетические взаимоотношения и таксономия внутри группы, которая включает арктического гольца S. alpinus, мальму S. malma и близкие им формы и виды гольцов (Behnke, 1980, 1984; Савваитова, 1989; Осинов, 2001). Эти две группы гольцов часто рассматривают в рамках двух видовых комплексов (S. alpinus complex и S. malma complex) (Behnke, 1984) или одного суперкомплекса S. alpinus–S. malma complex (Осинов, 2001). Предполагается, что S. alpinus complex и S. malma complex монофилитичны (Behnke, 1984), однако до сих пор не решён вопрос о филогенетическом положении южной формы мальмы из Северной Америки (Osinov et al., 2015, 2019). Внутри S. alpinus complex выделяются две основные филогенетические группы: группа арктического гольца Евразии, в которую также входят некоторые популяции с атлантического побережья Северной Америки, и группа гольца Таранца (Осинов, 2001). Согласно данным по контрольному району мтДНК, первая представлена тремя гаплогруппами (Atlantic, Siberia, Acadia), а вторая – гаплогруппой Arctic, гаплотипы которой выявлены в популяциях гольца Чукотки и арктического побережья Северной Америки, а также у малоротой и “боганидской” палий из оз. Эльгыгытгын (Brunner et al., 2001). Что касается происхождения разных экологических форм арктического гольца, которые выявлены в большом числе озёр на всём ареале S. alpinus complex, то многие авторы допускают как симпатрическое, так и аллопатрическое происхождение некоторых из них (Behnke, 1980; Савваитова, 1989; Jonsson, Jonsson, 2001; Осинов, 2001, 2002; Wilson et al., 2004; Alekseyev et al., 2002, 2009).
В оз. Эльгыгытгын обитают три вида гольцов рода Salvelinus, два из которых считаются эндемиками этого водоёма. Это длиннопёрая палия S. svetovidovi (Chereshnev et Scopetz, 1990), которая первоначально была описана в ранге отдельного рода Salvethymus, причём предполагалось, что её возраст сопоставим с возрастом самого озера (Черешнев, Скопец, 1990). Молекулярные данные подтвердили значительный возраст этого вида (1.7−3.5 млн лет), однако указали на необоснованность выделения этого вида в отдельный род (Осинов, Лебедев, 2004; Osinov et al., 2015, 2019; Lecaudey et al., 2018). Вторым эндемиком этого озера является малоротая палия S. elgyticus. Предполагалось, что третий вид гольца, обитающий в этом озере − боганидская палия S. boganidae, идентичен одноимённой форме с Таймыра (Викторовский и др., 1981). Хотя данных сравнения боганидских палий с Таймыра и Чукотки по ядерным генам до сих пор нет, тем не менее данные по мтДНК указывают на их полифилетическое происхождение (Brunner et al., 2001; Осинов, 2002; Радченко, 2005). Это означает, что боганидские палии с Таймыра и Чукотки не могут быть объединены в рамках одного вида (Osinov et al., 2015), в связи с чем видовое название последней мы берём в кавычки. Предполагается, что происхождение “боганидской” и малоротой палий в Эльгыгытгыне связано с аллопатрическим видообразованием. Некоторые авторы считают, что первым вселенцем в озеро была “боганидская” палия (Викторовский и др., 1981; Черешнев, Скопец, 1993), а другие – что это был предок малоротой палии (Глубоковский и др., 1993).
Анализ нуклеотидных последовательностей контрольного района и гена cyt b мтДНК указывает на то, что “боганидская” и малоротая палии из Эльгыгытгына являются молодыми видами, чьё происхождение, скорее всего, связано с событиями последнего ледникового периода (Osinov et al., 2015). Оба вида имеют гаплотипы мтДНК группы Arctic (гаплогруппа гольца Таранца), являются сестринскими видами, которые, возможно, сформировались в самом озере в послеледниковое время. Этому предположению, однако, противоречат данные ПДРФ-анализа ATPase6–NADH4L-участка мтДНК длиною 2162 п.н. (Радченко, 2003, 2005). Из 12 использованных этим автором эндонуклеаз шесть оказались информативными, причём только одна (MvaI) имеет важное значение для анализа происхождения двух молодых видов гольцов из оз. Эльгыгытгын. Согласно этим данным малоротая палия и гольцы из озёр Макси и Джульетта (бассейн Колымы) имеют митотип MvaI-A (два фрагмента рестрикции размером 1700 и 370 п.н.), а “боганидская” палия из оз. Эльгыгытгын и гольцы из озёр бассейна р. Выквынайваам (Чукотка) имеют митотип MvaI-B (два фрагмента рестрикции размером 1600 и 520 п.н.). Учитывая, что для ПДРФ-анализа были использованы репрезентативные по объёму выборки (Радченко, 2003, 2005), эти данные с высокой вероятностью указывают на аллопатрическое происхождение двух видов гольцов из оз. Эльгыгытгын.
Секвенирование ATPase6–NADH4L-участка мтДНК (2162 п.н.) выявило существенные неточности в данных ПДРФ-анализа этого фрагмента, что резко ослабило доказательную силу последних в отношении способа видообразования двух молодых видов гольцов в оз. Эльгыгытгын. Единственное, что осталось подтверждённым, это сходство малоротой палии и гольца из оз. Джульетта (и, вероятно, оз. Макси) из бассейна Колымы по сайтам рестрикции MvaI и их отличие от “боганидской” палии, которая имеет один уникальный сайт рестрикции. Анализ нуклеотидных последовательностей по этому фрагменту мтДНК указывает на близкое родство “боганидской” палии из оз. Эльгыгытгын с гольцом Таранца из Северной Америки и Западной Гренландии, тогда как малоротая палия объединяется с другими популяциями гольца Таранца с Чукотки и Колымы (Джульетта). Напомним, что в большинстве популяций арктического гольца из бассейна Колымы присутствует только мтДНК северной мальмы. Это делает невозможным использование мтДНК для определения их принадлежности к филогенетической группе арктического гольца Евразии или гольца Таранца (Osinov et al., 2017; Осинов и др., 2018), а также не позволяет оценить уровень нуклеотидного и гаплотипического разнообразия мтДНК, который имели эти популяции (или их общий предок) до момента захвата мтДНК северной мальмы.
Результаты филогенетического анализа нуклеотидных данных по ATPase6–NADH4L-участку мтДНК свидетельствуют в пользу аллопатрического происхождения малоротой и “боганидской” палий оз. Эльгыгытгын. Это противоречит результатам анализа фрагментов CR и гена cyt b, согласно которым более вероятно их симпатрическое происхождение (Osinov et al., 2015). Несмотря на противоречивость имеющихся мтДНК-данных, наши данные по ATPase6–NADH4L-участку и (косвенно) данные по участкам CO1, cyt b и CR (Олейник и др., 2017) указывают на заселение современного ареала гольца Таранца, включая оз. Эльгыгытгын, предположительно из двух ледниковых рефугиумов или из одного рефугиума, но двумя разделёнными по времени волнами мигрантов. Анализ попарных различий нуклеотидных последовательностей (мисматч-анализ) контрольного района мтДНК не исключает того, что большая часть современного ареала гольца Таранца была заселена мигрантами из одного рефугиума в результате быстрой экспансии (Осинов и др., 2018). Новые данные по контрольному району мтДНК (Moore et al., 2015; Osinov et al., 2015; Олейник и др., 2017, 2019; наша работа) указывают на то, что в Северной Америке и Гренландии уровень нуклеотидного и гаплотипического разнообразия в популяциях гольца Таранца значительно ниже, чем это предполагалось ранее (Brunner et al., 2001), и несколько ниже, чем в некоторых азиатских популяциях. Это может означать, что предполагаемый рефугиум в Северной Америке (Brunner et al., 2001) был небольшим (Moore et al., 2015), или то, что огромные территории в Северной Америке и Гренландии были заселены в послеледниковое время от генетически обеднённой группы вселенцев из Азии. После образования Берингова пролива голец из Северной Америки смог расселяться на юг, в том числе войти в Анадырь и далее в оз. Эльгыгытгын, а также проникнуть в некоторые водоёмы Камчатки и Чукотки и в некоторые реки и озёра бассейна Охотского моря.
Недавно на основании анализа собственных и литературных данных мтДНК Олейник с соавторами (2019) выделили в филогенетической группе гольца Таранца (они называют её арктической) две подгруппы, одна из которых объединяет популяции из бассейна Колымы и с Чукотки, а вторая – популяции гольца из Канады и с Камчатки. Если под популяциями гольца из бассейна Колымы понимать только те, которые имеют мтДНК гаплогруппы Arctic, то это не противоречит полученным нами результатам. Различия между двумя исследованиями связаны с тем, что малоротую и “боганидскую” палий из Эльгыгытгына авторы включили в первую подгруппу (Олейник и др., 2019), тогда как, по данным по ATPase6–NADH4L-участку мтДНК, эти два вида попадают в разные подгруппы.
Список литературы
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Ч. 1. М.; Л.: Изд-во АН СССР, 467 с.
Викторовский Р.М. 1978. Механизмы видообразования у гольцов. М.: Наука, 112 с.
Викторовский Р.М., Глубоковский М.К., Ермоленко Л.Н., Скопец М.Б. 1981. Гольцы рода Salvelinus из озера Эльгыгытгын (Центральная Чукотка) // Рыбы в экосистемах лососевых рек Дальнего Востока. Владивосток: Изд-во ДВНЦ РАН СССР. С. 67–78.
Глубоковский М.К., Фролов С.В., Ефремов В.В. и др. 1993. Филогенетические связи и систематика гольцовых рыб озера Эльгыгытгын // Природа впадины озера Эльгыгытгын (проблемы изучения и охраны). Магадан: Изд-во СВКНИИ ДВО РАН. С. 149–177.
Гордеева Н.В., Осинов А.Г., Алексеев С.С. и др. 2010. Генетическая дифференциация арктических гольцов Salvelinus alpinus complex Забайкалья, выявленная по микросателлитным маркёрам // Вопр. ихтиологии. Т. 50. № 3. С. 293–304.
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д., Бондарь Е.И. 2017. Генетическое родство чукотского гольца Salvelinus andriashevi с гольцом Таранца Salvelinus taranetzi // Генетика. Т. 53. № 10. С. 1208–1217. https://doi.org/10.7868/S0016675817100071
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д., Бондарь Е.И. 2019. Генетическая дифференциация гольцов Арктической группы Северо-Восточной Азии и Северной Америки // Там же. Т. 55. № 3. С. 325–336. https://doi.org/10.1134/S0016675819030123
Осинов А.Г. 2001. Эволюционные взаимоотношения между основными таксонами Salvelinus alpinus–Salvelinus malma complex: результаты сравнительного анализа аллозимных данных разных авторов // Вопр. ихтиологии. Т. 41. № 2. С. 167–183.
Осинов А.Г. 2002. Арктический голец Salvelinus alpinus Забайкалья и Таймыра: генетическая дифференциация и происхождение // Там же. Т. 42. № 2. С. 149–160.
Осинов А.Г., Лебедев В.С. 2004. Лососевые рыбы (Salmonidae, Salmoniformes): положение в надотряде Protacanthopterygii, основные этапы эволюционной истории, молекулярные датировки // Там же. Т.44. № 6. С. 738–765.
Осинов А.Г., Павлов Д.А., Волков А.А. 2018. К вопросу о происхождении озёрных гольцов Salvelinus alpinus complex из бассейнов Колымы и Охотского моря // Там же. Т. 58. № 3. С. 313–330. https://doi.org/10.7868/S0042875218030086
Радченко О.А. 2003. Изменчивость митохондриальной ДНК в популяциях озёрных гольцов рода Salvelinus Дальнего Востока и Сибири // Там же. Т. 43. № 4. С. 553–561.
Радченко О.А. 2005. Изменчивость митохондриальной ДНК гольцов рода Salvelinus. Магадан: Изд-во ИБПС РАН, 154 с.
Савваитова К.А. 1989. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат, 223 с.
Черешнев И.А., Скопец М.В. 1990. Salvethymus svetovidovi gen. et sp. nova – новая эндемичная рыба из подсемейства лососевых (Salmoninae) из озера Эльгыгытгын (Центральная Чукотка) // Вопр. ихтиологии. Т. 30. Вып. 2. С. 201–213.
Черешнев И.А., Скопец М.В. 1993. Биология гольцовых рыб озера Эльгыгытгын // Природа впадины озера Эльгыгытгын (проблемы изучения и охраны). Магадан: Изд-во СВКНИИ ДВО РАН. С. 105–127.
Alekseyev S.S., Samusenok V.P., Matveev A.N., Pichugin M.Y. 2002. Diversification, sympatric speciation, and trophic polymorphism of Arctic charr, Salvelinus alpinus complex, in Transbaikalia // Environ. Biol. Fish. V. 64. № 1−3. P. 97–114. https://doi.org/10.1023/A:1016050018875
Alekseyev S.S, Bajno R., Gordeeva N.V. et al. 2009. Phylogeography and sympatric differentiation of the Arctic charr Salvelinus alpinus (L.) complex in Siberia as revealed by mtDNA sequence analysis // J. Fish Biol. V. 75. № 2. P. 368–392. https://doi.org/10.1111/j.1095-8649.2009.02331.x
Bandelt H.-J., Forster P., Rohl A. 1999. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. V. 16. P. 37–48.
Behnke R.J. 1980. A systematic review of the genus Salvelinus // Charrs, salmonid fishes of the genus Salvelinus / Ed. Balon E.K. The Hague: Dr. W. Junk Publ. P. 441–481.
Behnke R.J. 1984. Organizing the diversity of the Arctic charr complex // Biology of the Arctic charr / Eds. Johnson L., Burns B.L. Winnipeg: Univ. Manitoba Press. P. 3–21.
Bolnick D.I., Fitzpatrick B.M. 2007. Sympatric speciation: models and empirical evidence // Ann. Rev. Ecol. Evol. Syst. V. 38. P. 459–487.
Brunner P.C., Douglas M.R., Osinov A. et al. 2001. Holarctic phylogeography of Arctic charr (Salvelinus alpinus L.) inferred from mitochondrial DNA sequences // Evolution. V. 55. P. 573–586.
Coyne J.A., Orr H.A. 2004. Speciation. Sunderland, MA: Sinauer Assoc., 480 p.
Esin E.V., Markevich G.N., Pichugin M.Yu. 2018. Juvenile divergence in adaptive traits among seven sympatric fish ecomorphs arises before moving to different lacustrine habitats // J. Evol. Biol. V. 31. № 7. P. 1018−1034. https://doi.org/10.1111/jeb.13283
Gurov E.P., Koeberl C., Yamnichenko A. 2007. El’gygytgyn impact crater, Russia: Structure, tectonics, and morphology // Meteor. Planet. Sci. V. 42. P. 307–319.
Jacobs A., Carruthers M., Yurchenko M.A. et al. 2019. Convergence in form and function overcomes non-parallel evolutionary histories in a Holarctic fish // bioRxiv. https://doi.org/10.1101/265272
Jonsson B., Jonsson N. 2001. Polymorphism and speciation in Arctic charr // J. Fish Biol. V. 58. P. 605–638.
Lecaudey L.A., Schliewen U.K., Osinov A.G. et al. 2018. Inferring phylogenetic structure, hybridization and divergence times within Salmoninae (Teleostei: Salmonidae) using RAD-sequencing // Mol. Phyl. Evol. V. 124. P. 82–99. https://doi.org/10.1016/j.ympev.2018.02.022
Leigh J.W., Bryant D. 2015. PopART: full-feature software for haplotype network construction // Meth. Ecol. Evol. V. 6. P. 1110–1116. https://doi.org/10.1111/2041-210X.12410
Moore J.-S., Bajino R., Reist J.D., Taylor E.B. 2015. Post-glacial recolonization of the North American Arctic by Arctic char (Salvelinus alpinus): genetic evidence of multiple northern refugia and hybridization between glacial lineages // J. Biogeogr. V. 42. P. 2089–2100. https://doi.org/10.1111/jbi.12600
Oohara I., Sawano I., Okazaki T. 1997. Mitochondrial DNA sequence analysis of the masu salmon − phylogeny in the genus Oncorhynchus // Mol. Phyl. Evol. V. 7. P. 71–78.
Osinov A.G., Senchukova A.L., Mugue N.S. et al. 2015. Speciation and genetic divergence of three species of charrs from ancient Lake El’gygytgyn (Chukotka) and their phylogenetic relationships with other representatives of the genus Salvelinus // Biol. J. Linn. Soc. V. 116. P. 63–85. https://doi.org/10.1111/bij.12559
Osinov A.G., Volkov A.A., Alekseyev S.S. et al. 2017. On the origin and phylogenetic position of Arctic charr (Salvelinus alpinus complex, Salmonidae) from Lake Cherechen` (middle Kolyma River basin): controversial genetic data // Polar Biol. V. 40. P. 777–786. https://doi.org/10.1007/s00300-016-2000-4
Osinov A.G., Volkov A.A., Mugue N.S. 2019. Charrs of the genus Salvelinus (Salmonidae): hybridization, phylogeny and evolution // bioRxiv. https://doi.org/10.1101/817775
Posada D., Crandall K.A. 1998. Modeltest: testing the model of DNA substitution // Bioinformatics. V. 14. P. 817–818.
Seehausen O. 2004. Hybridization and adaptive radiation // Trends Ecol. Evol. V. 19. P. 198–207.
Swofford D.L. 2002. PAUP.* Phylogenetic analysis using parsimony (*and other methods). Version 4.0b10. Sunderland, MA: Sinauer Assoc.
Wilson A.J., Gıslason D., Skulason S. et al. 2004. Population genetic structure of Arctic charr, Salvelinus alpinus from northwest Europe on large and spatial scales // Mol. Ecol. V. 13. P. 1129–1142.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


