Вопросы ихтиологии, 2020, T. 60, № 5, стр. 597-602
Находки микижи Parasalmo mykiss на юге Дальнего Востока: к вопросу об ареале вида в азиатской части Северной Пацифики
А. Л. Антонов 1, К. В. Кузищин 2, *, И. В. Костомарова 3
1 Институт водных и экологических проблем Дальневосточного отделения РАН – ИВЭП ДВО РАН
Хабаровск, Россия
2 Московский государственный университет
Москва, Россия
3 Государственный природный заповедник “Ботчинский”
Хабаровский край, Советская, Гавань, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 16.09.2019
После доработки 09.12.2019
Принята к публикации 12.12.2019
Аннотация
Сообщается о поимке 23.05.2018 г. половозрелого самца микижи Parasalmo mykiss в устье р. Матвеевка (приток р. Ботчи, материковое побережье Татарского пролива). Обобщены данные о случаях отлова особей этого вида в реках бассейнов Японского и Охотского морей. Обсуждаются возможные причины проникновения микижи в р. Ботчи.
Микижа Parasalmo mykiss имеет обширный репродуктивный ареал в Северной Америке от Аляски до Калифорнии (Behnke, 1992, 2002), но в Азии он приурочен в основном к водоёмам Камчатки (Савваитова и др., 1973; Павлов и др., 2001). Известна также удалённая краевая пресноводная популяция на Шантарских о-вах в Охотском море (Алексеев, Свириденко, 1985; Груздева и др., 2015). В литературе имеется ряд указаний, что единичные экземпляры микижи изредка попадаются в реках материкового побережья Охотского моря (Берг, 1948), лимане Амура, в реках Приморского края и в р. Саранная на о-ве Беринга (Гребницкий, 1897, Суворов, 1912 – цит. по: Берг, 1948; Кагановский, 1949; Савваитова, Максимов, 1967; Золотухин, 2002). Однако подавляющее большинство таких находок относятся к 1940−1960-м гг., при этом нет свидетельств о существования самовоспроизводящихся популяций за пределами Камчатки и Шантарских о-вов.
Микижа – пластичный и легко адаптирующийся к разнообразным местным условиям вид, быстро формирующий систему локальных адаптаций, особую генетическую и популяционную структуру (Behnke, 2002; Sloat et al., 2014), что делает её одним из наиболее эффективных потенциально инвазивных видов, особенно в связи с масштабными изменениями климата (Quinn, Myers, 2004; Satterthwaite et al., 2009; Benjamin et al., 2013). В конце ХХ–начале XXI вв. стало накапливаться всё больше сообщений о поимках микижи на юге Дальнего Востока. В связи с этим целью настоящего сообщения является обобщение имеющейся информации по поимкам микижи в этом регионе.
МАТЕРИАЛ И МЕТОДИКА
Впервые о поимке одного экземпляра микижи (“камчатской сёмги”) в лимане Амура упоминает Берг (1948): “30 сентября 1938 г. в южной части Амурского лимана, у мыса Джаоре была отловлена половозрелая самка (вес 4470 г, длина по Смитту (FL) 68.3 см; стадия зрелости III, плодовитость 8200 икринок, возраст 6+)” (Кагановский, 1949. С. 200−201). Позже об этой находке сообщил и Никольский (1956); по его мнению, эта особь должна была метать икру весной 1939 г. После этих сообщений последовал длительный перерыв, когда о поимках микижи в Амурском лимане, в реках Приморья и Сахалина не сообщалось вовсе. Новые свидетельства о нахождении микижи в открытой части Японского моря появились только в конце ХХ века. Так, в 1990-е гг. во время морского промысла тихоокеанских лососей были добыты 3 экз. этого вида в северо-западной и центральной частях Японского моря. В июне 1996 г. в точке с координатами 43°26′ с.ш. и 136°57′ в.д. была отловлена самка, предположительно сбежавшая с рыбоводного завода Южной Кореи или Японии (Золотухин, Романов, 1998); 24.05.1998 г. в точке с координатами 41°43′ с.ш. 135°55′ в.д. была поймана микижа с абсолютной длиной (TL) 57.0 см, а 17.05.2000 г. в точке с координатами 41°34′ с.ш. 135°21′ в.д. − немного более крупная особь FL 61.5 см и массой 2850 г (Барабанщиков, 2014). В XXI в. стали поступать сведения о нахождении микижи в реках бассейна Японского моря, впадающих в Уссурийский залив на юге Приморского края. Так, осенью 2012 г. в устье р. Артёмовка был пойман половозрелый самец с выраженным брачным нарядом, а весной 2013 г. в реках Шкотовка и Суходол − несколько неполовозрелых особей микижи массой ~ 300 г (Барабанщиков, 2014).
Южнее Амурского лимана, на материковом побережье Татарского пролива, до настоящего времени был известен всего один случай отлова микижи − две особи в брачном наряде были пойманы 09.05.1999 г. ставной сетью в устье р. Тумнин (Золотухин, 2002). Вероятно, об этой же находке упоминается и в статье Алексеева с соавторами (2004). Устье р. Тумнин находится на 450 км южнее м. Джаоре, где была поймана проходная микижа в 1938 г. (Кагановский, 1949; Никольский, 1956).
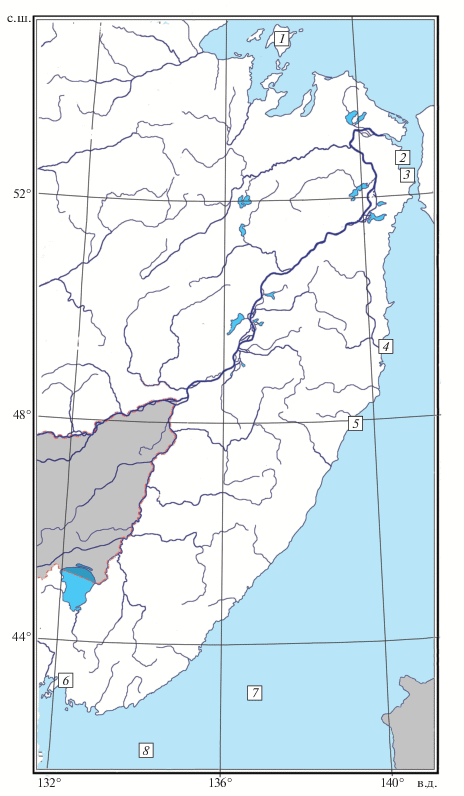
В нашем распоряжении имеется ещё одно свидетельство о находке микижи на материковом побережье Татарского пролива. Она была поймана 23.05.2018 г. рыболовом-любителем В.А. Косоговским на удебную снасть в устье р. Матвеевка близ пос. Гроссевичи (Советско-Гаванский район Хабаровского края), примерно в 200 км южнее устья р. Тумнин и почти на 1000 км севернее Уссурийского залива, в 12 км от границы Ботчинского государственного природного заповедника. Координаты места отлова 47°58′52″ с.ш. 139°31′53″ в.д. (рис. 1). Ранее какой-либо информации о встречах этого вида в р. Ботчи и в целом в Советско-Гаванском районе не поступало.
Рис. 1.
Места обитания и поимок микижи Parasalmo mykiss на юге Дальнего Востока: 1 – о. Большой Шантар; 2 − Амурский лиман, м. Джаоре; 3 – низовья р. Чоме, бассейн лимана Амура; 4 – устье р. Тумнин, 5 – р. Матвеевка, 6 – реки Уссурийского залива; 7 – Японское море, июнь 1996 г.; 8 – Японское море, май 1998 и 2000 гг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Это был половозрелый самец (TL 78 см, масса 5.5 кг, половые железы V стадии зрелости) с выраженным брачным нарядом (рис. 2). Спина зеленовато-оливкового цвета, на боках тела и жаберных крышках розовая полоса, низ головы, жаберные лучи и нижняя челюсть светлые, брюхо серое. Пятна на спине округлые или овальные, редкие, они не доходят до боковой линии, в передней части тела пятна Х-образные и далеко не заходят ниже боковой линии. Грудные, брюшные и анальный плавники бурые с красным оттенком. Жировой плавник серый, неокаймлённый, с размытыми тёмными пятнами. Хвост тёмно-серый, на нём правильные ряды тёмных пятен, средние лучи хвостового плавника блёклого серебристого оттенка, нижние неветвистые лучи светлые, хорошо отличимые от остальной части хвоста, на них нет тёмных пятен. По длине и пропорциям тела и окраске выловленный самец в полной мере соответствует описанию проходной микижи (Савваитова и др., 1973; Behnke, 1992, 2002; Павлов и др., 2001; Черешнев и др., 2002; Дорофеева, 2003) и с высокой долей вероятности является проходным.
Рис. 2.
Проходная микижа Parasalmo mykiss р. Ботчи (поймана 23 мая 2018 г. в устье р. Матвеевка), абсолютная длина тела 78 см, масса тела 5.5 кг, самец, половые железы V стадии зрелости (фото В.А. Косоговского).

Река Матвеевка имеет длину ~ 13 км, берёт начало на юго-западном склоне горы Еловая (610 м; восточные отроги хребта Сихотэ-Алинь), впадает слева в эстуарий (лиман) р. Ботчи примерно в 200 м от его выхода в б. Гроссевичи. На большей части р. Матвеевка представляет собой типичный для побережья Татарского пролива малый горный водоток. Лишь на самом нижнем участке (~2 км) на приморской равнине она меандрирует и имеет медленное течение. Русло на этом участке распадается на несколько проток, дно сложено галькой и гравием; долина заболоченная, с участками тундроподобной растительности (“марь”). Левый рукав лимана р. Ботчи, куда впадает р. Матвеевка, имеет почти прямое русло с галечными дном и берегами (длина ~ 600 м, ширина до 100 м, глубина ~2 м); вода в нём солоноватая; выражены невысокие приливы и отливы. В р. Ботчи, бóльшая часть бассейна которой входит в состав Ботчинского заповедника, обитают более 20 видов рыб (Аднагулов, Олейников, 2011); наиболее обычны горбуша Oncorhynchus gorbuscha, кета O. keta, сима O. masou, южная мальма Salvelinus curilus, кунджа S. leucomaenis, краснопёрки Tribolodon spp., подкаменщики Cottus spp.; встречаются сахалинский таймень Parahucho perryi и жёлтопятнистый хариус Thymallus flavomaculatus. В р. Матвеевка видовой состав беднее – здесь нет кеты, хариуса, тайменя.
Кроме этого, известно о ещё одной находке микижи в южной части Амурского лимана: в октябре 2001 г. шесть крупных половозрелых особей микижи, всего вероятнее, проходных, были обнаружены в улове рыболова в низовьях р. Чоме (~40 км к югу от м. Джаоре). Эти экземпляры имели более яркую окраску, более высокое тело и более крупные размеры, чем рыбы шантарской популяции (личное сообщение В.Б. Козловского11).
Таким образом, можно заключить, что в начале XXI в. участились поимки микижи в реках Татарского пролива, Амурского лимана и юга Приморья. При этом если в середине ХХ века поимки половозрелых рыб отмечались только в осеннее время, то сейчас они регистрируются и осенью, и весной, причём в весеннее время отмечены крупные проходные половозрелые производители. Причины появления микижи в южной части Дальневосточного региона России не ясны. Некоторые авторы связывают появление микижи в реках Южного Приморья с активным развитием марикультуры радужной форели в Японии, Южной Корее и Китае, а начиная с 2005 г. и в России (Барабанщиков, 2014). По мнению этого автора, обнаруженные в реках Уссурийского залива особи микижи могут иметь заводское происхождение22. Известно, что в Китае и Южной Корее, где этот вид давно является объектом аквакультуры, он как инвазивный отмечен в реках на побережье Жёлтого моря (Lutaenko et al., 2013). Кроме того, не исключена и нелегальная интродукция искусственной радужной форели (Барабанщиков, 2014). Тем не менее исключать инвазию искусственно выращенных рыб нельзя, так как есть указание на поимку в 2018 г. микижи на северо-восточном побережье Сахалина в р. Лангери (Кириллова, Кириллов, 2019), хотя ранее её на Сахалине не обнаруживали (Dyldin, Orlov, 2016). Микижа, пойманная в р. Лангери, имела облик, характерный для резидентных особей или рыб садкового выращивания (Е.А. Кириллова, личное сообщение и фотография). В то же время особи, обнаруженные в реках материкового побережья Татарского пролива и лимана Амура, в отличие от рыб из Японского моря и рек Уссурийского залива имеют иные размеры, пропорции тела и окраску, всего вероятнее, принадлежат к проходной форме и не связаны с распространением искусственно выращенной радужной форели. В Хабаровском крае микижу несколько лет выращивают на Анюйском лососёвом рыбоводном заводе (от устья Амура вверх > 700 км); но, по сообщению директора завода А.В. Романова, “убегание” рыб с завода исключено; другие рыбоводные заводы удалены на значительное расстояние от мест находок. Также маловероятным представляется стрэинг микижи из популяции Шантарских о-вов, в которой отсутствуют типично-проходные особи (Груздева и др., 2015). В связи с этим нельзя исключить, что поимки проходной микижи в реках материкового побережья Татарского пролива и лимана Амура могут быть связаны с существованием малых природных популяций в некоторых реках региона.
Одним из необходимых факторов существования популяции микижи в азиатской части репродуктивного ареала является наличие тундровых притоков или тундровых участков рек, где в весеннее время складывается благоприятный температурный режим, необходимый для успешного нереста и инкубации икры (Савваитова и др., 1975; Кузищин и др., 2008; Павлов и др., 2008). Именно в таких реках – Оленьей и Средней − существуют небольшие популяции микижи на о-ве Большой Шантар (Груздева и др., 2015). Реки тундрового типа встречаются и южнее, в том числе к югу от Амурского лимана. В низовьях рек Тумнин и Ботчи есть участки марей − тундроподобных заболоченных ландшафтов с покровом из сфагновых мхов и вересковых кустарников; перед впадением в море образуются спокойные участки и лиманы, что делает вероятным воспроизводство и устойчивое существование микижи в этих реках.
Не исключено также, что возникновение и существование малых популяций микижи в реках материкового побережья Татарского пролива может быть обусловлено крупномасштабными климатическими изменениями в Северной Пацифике. В последние 80−90 лет в регионе было несколько климатических сдвигов, оказавших влияние на структуру океанических экосистем (Mantua, Hare, 2002; Overland et al., 2008; Заволокин, 2015). В конце XX–начале XXI вв. произошло повышение температуры воды по всей северной части Тихого океана, что привело, в частности, к смещению в северном направлении нагульной части ареала почти всех видов лососей, особенно в западной части Тихого океана (Welch et al., 2000; Myers et al., 2007, 2016; Irvine et al., 2009; Abdul-Aziz et al., 2011). В связи с этим представляется вероятным, что на фоне устойчивого роста температуры поверхностных морских вод зона нагула и пути миграций азиатской проходной микижи Камчатки также могли измениться. Часть проходной микижи Камчатки нагуливается и зимует в районе южных Курильских о-вов (Коваленко и др., 2005). Поэтому не исключено, что с конца ХХ в. в результате изменений температурного режима прикурильских вод и южной части Охотского моря произошло расширение зоны зимнего нагула проходной микижи в этих районах и больше рыб стало зимовать тут, не уходя далеко в Тихий океан. В связи с этим есть вероятность того, что часть проходной микижи могла и может попадать в прибрежные материковые районы, заходить в реки и основывать новые природные популяции. Тем самым в начале XXI в. может иметь место проникновение микижи в новые места обитания, вызванное естественными причинами – крупномасштабными сдвигами климата, прежде всего, за счёт расширения зоны зимнего нагула в южной части Охотского моря.
Однако не исключена и другая ситуация: популяции микижи в реках Северного Приморья, как и на Шантарских о-вах, являются древним реликтом, сохранившимся в пределах более широкого плейстоценового ареала, включавшего Приморье и низовья Амура (Алексеев и др., 2004; Груздева и др., 2015). Возможно, популяции микижи в этом районе существовали в течение всего послеледникового периода, но находились на крайне низком уровне численности. А в настоящее время, когда наблюдается потепление поверхностных вод Северной Пацифики, эти популяции, особенно их проходная компонента, оказались в более благоприятной ситуации и наращивают численность.
Полученный материал позволяет предполагать, что в экосистемах и рыбных сообществах рек Северного Приморья могут произойти изменения, связанные с появлением и/или ростом численности в них локальных малых популяций микижи. Происхождение и филогенетические отношения особей из рек юга Дальнего Востока, камчатских и шантарской популяций неясны; для выяснения ситуации необходим дальнейший мониторинг и установление родственных отношений разных географических группировок с помощью молекулярно-генетических методов. Кроме того, необходимы дальнейшие исследования особенностей распространения и биологии микижи в рыбных сообществах рек лимана Амура и Северного Приморья.
Список литературы
Аднагулов Э.В., Олейников А.Ю. 2011. Список позвоночных животных заповедника “Ботчинский” и его охранной зоны // Амур. зоол. журн. Т. 3. № 1. С. 88−99.
Алексеев С.С., Свириденко М.А. 1985. Микижа Salmo mykiss Walbaum (Salmonidae) Шантарских островов // Вопр. ихтиологии. Т. 24. Вып. 1. С. 68−73.
Алексеев С.С., Груздева М.А., Скопец М.Б. 2004. Ихтиофауна Шантарских островов // Там же. Т. 44. № 1. С. 42−58.
Барабанщиков Е.И. 2014. О поимках микижи Parasalmo mykiss на юге Приморского края // Бюл. № 9 изучения тихоокеанских лососей на Дальнем Востоке. С. 188−190.
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Ч. 1. М.; Л.: Изд-во АН СССР, 466 с.
Груздева М. А., Пичугин М. Ю., Кузищин К. В. и др. 2015. Микижа Parasalmo mykiss (Walbaum, 1792) (Salmoniformes: Salmonidae) Шантарских островов: структура популяций, фенетическое и генетическое разнообразие // Биология моря. Т. 41. № 6. С. 403−417.
Дорофеева Е.А. 2003. Parasalmo mykiss (Walbaum, 1792) – микижа // Атлас пресноводных рыб России. Т. 1 / Под ред. Решетникова Ю.С. М.: Наука. С. 92−95.
Заволокин А.В. 2015. Пищевая обеспеченность тихоокеанских лососей в период морского и океанического нагула: Автореф. дис. … докт. биол. наук. Владивосток: ТИНРО-центр, 48 с.
Золотухин С.Ф. 2002. Анадромные рыбы российского материкового побережья Японского моря и современный статус их численности // Изв. ТИНРО. Т. 130. С. 801−818.
Золотухин С.Ф., Романов Н.С. 1998. Случай поимки тихоокеанской форели Parasalmo mykiss в Японском море в экономической зоне России // Вопр. ихтиологии. Т. 38. № 3. С. 418–419.
Кагановский А.Г. 1949. О нахождении семги Salmo penshinensis Pallas в Амурском лимане // Изв. ТИНРО. Т. 31. С. 200−201.
Кириллова Е.А., Кириллов П.И. 2019. Современный состав ихтиофауны р. Лангери (северо-восток о-ва Сахалин) // Чт. памяти В.Я. Леванидова. Вып. 8. С. 39.
Коваленко С.А., Шубин А.О., Немчинова И.А. 2005. Распределение и биологическая характеристика микижи Parasalmo mykiss (Salmonidae) в прикурильских водах Тихого океана и в Охотском море // Вопр. ихтиологии. Т. 45. № 1. С. 70−80.
Кузищин К.В., Мальцев А.Ю., Груздева М.А. и др. 2008. Размножение микижи Parasalmo mykiss в реке Коль (западная Камчатка) и факторы среды, его определяющие // Там же. Т. 48. № 1. С. 50−61.
Никольский Г.В. 1956. Рыбы бассейна Амура. М.: Изд-во АН СССР, 551 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Науч. мир, 200 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2008. Разнообразие жизненных стратегий и структура популяций камчатской микижи Parasalmo mykiss в экосистемах малых лососевых рек разного типа // Вопр. ихтиологии. Т. 48. № 1. С. 42−49.
Савваитова К.А., Максимов В.А. 1967. К систематике камчатской микижи Salmo mykiss Walbaum // Вестн. МГУ. Сер. биол. № 4. С. 14−24.
Савваитова К.А., Максимов В.А., Мина М.В. и др. 1973. Камчатские благородные лососи (систематика, экология, перспективы использования как объекта форелеводства и акклиматизации). Воронеж: Изд-во ВоронежГУ, 120 с.
Савваитова К.А., Мина М.В., Максимов В.А. 1975. Эволюционные аспекты экологии размножения лососей рода Salmo в некоторых водоёмах Камчатки // Вопр. ихтиологии. Т. 15. Вып. 1. С. 21−31.
Черешнев И.А., Волобуев В.В., Шестаков А.В. и др. 2002. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука, 496 с.
Abdul-Aziz O.I., Mantua N.J., Myers K.W. 2011. Potential climate change impacts on thermal habitats of Pacific salmon (Oncorhynchus spp.) in the North Pacific Ocean and adjacent seas // Can. J. Fish. Aquat. Sci. V. 68. P. 1660–1680. https://doi.org/10.1139/f2011-079
Behnke R.J. 1992. Native trout of Western North America // Amer. Fish. Soc. Monorg. V. 6. 275 p.
Behnke R.J. 2002. Trout and salmon of North America. N.Y.: Free Press, 359 p.
Benjamin J.R., Connolly P.J., Romine J.G., Perry R.W. 2013. Potential effects of changes in temperature and food resources on life history trajectories of juvenile Oncorhynchus mykiss // Trans. Amer. Fish. Soc. V. 142. № 1. P. 208–220. https://doi.org/10.1080/00028487.2012.728162
Dyldin Yu.V., Orlov A.M. 2016. Ichthyofauna of fresh and brackish waters of Sakhalin Island: an annotated list with taxonomic comments: 2. Cyprinidae–Salmonidae families // J. Ichthyol. V. 56. № 5. P. 656–693. https://doi.org/10.1134/S0032945216050040
Irvine J.R., Macdonald R.W., Brown R.J. et al. 2009. Salmon in the Arctic and how they avoid lethal low temperatures // NPAFC Bull. № 5. P. 39–50.
Lutaenko K.A., Furota T., Nakayama S. et al. 2013. Atlas of marine invasive species in the NOWPAP Region. Beijing: Nowpap Dinrac, 190 p.
Mantua N.J., Hare S.R. 2002. The Pacific decadal oscillation // J. Oceanogr. V. 58. P. 35−44. https://doi.org/10.1023/A:1015820616384
Myers K.W., Klovach N.V., Gritsenko O.F. et al. 2007. Stock-specific distributions of Asian and North American salmon in the open ocean, interannual changes, and oceanographic conditions // NPAFC Bull. № 4. P. 159–177.
Myers K.W., Irvine J.R., Logerwell E.A. et al. 2016. Pacific salmon and steelhead: life in a changing winter ocean // Ibid. № 6. P. 113–138
Overland J., Rodionov S., Minobe S., Bond N. 2008. North Pacific regime shifts: definitions, issues and recent transitions // Progr. Oceanogr. V. 77. P. 92−102. https://doi.org/10.1016/j.pocean.2008.03.016
Quinn T.P., Myers K.W. 2004. Anadromy and the marine migrations of Pacific salmon and trout: Rounsefell revisited // Rev. Fish Biol. Fish. V. 14. № 4. P. 421–442. https://doi.org/10.1007/s11160-005-0802-5
Satterthwaite W.H., Beakes M.P., Collins E.M. et al. 2009. Steelhead life history on California’s Central Coast: insights from a state-dependent model // Trans. Amer. Fish. Soc. V. 138. P. 532–548. https://doi.org/10.1577/T08-164.1
Sloat M.R., Fraser D.J., Dunham J.B. et al. 2014. Ecological and evolutionary patterns of freshwater maturation in Pacific and Atlantic salmonines // Rev. Fish Biol. Fish. V. 24. № 3. P. 689–707. https://doi.org/10.1007/s11160-014-9344-z
Welch D.W., Ward B.R., Smith B.D., Everson J.P. 2000. Temporal and spatial responses of British Columbia steelhead (Oncorhynchus mykiss) populations to ocean climate shifts // Fish. Oceanogr. V. 9. P. 17−32.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


