Вопросы ихтиологии, 2020, T. 60, № 6, стр. 689-697
Первые данные о возрасте и росте мелкочешуйной антиморы Antimora microlepis (Moridae) из вод подводного Императорского хребта (Северо-Западная Пацифика)
Н. Б. Коростелев 1, 2, А. А. Байталюк 3, И. В. Мальцев 3, А. М. Орлов 1, 4, 5, 6, 7, *
1 Институт проблем экологии и эволюции Северцова РАН – ИПЭЭ РАН
Москва, Россия
2 Институт биологии развития им. Н.К. Кольцова РАН – ИБР РАН
Москва, Россия
3 Тихоокеанский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии − ТИНРО
Владивосток, Россия
4 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
5 Дагестанский государственный университет − ДГУ
Махачкала, Россия
6 Томский государственный университет
Томск, Россия
7 Прикаспийский институт биологических ресурсов Дагестанского научного центра РАН − ПИБР ДНЦ РАН
Махачкала, Россия
* E-mail: orlov@vniro.ru
Поступила в редакцию 09.04.20
После доработки 14.04.20
Принята к публикации 15.04.20
Аннотация
Представлены результаты изучения возраста и роста мелкочешуйной антиморы Antimora microlepis из вод подводного Императорского хребта (открытые воды северо-западной части Тихого океана). В ярусных уловах отмечены рыбы длиной 43.5−84.0 см и массой 550−5640 г в возрасте 18−46 лет с преобладанием особей в возрасте 24−33 года (68.8%). Возраст самок варьирует в пределах 18−46 (в среднем 30) лет, самцов – 19−36 (27) лет. В сравнении с особями из прикурильских и прикамчатских вод Тихого океана и Северо-Восточной Пацифики рыбы из вод Императорского хребта характеризуются более медленным темпом роста.
Род Antimora (Moridae, Gadiformes) включает в себя два вида антимор − мелкочешуйную A. microlepis и клюворылую A. rostrata (Small, 1981; Cohen et al., 1990; Орлов и др., 2018а). Мелкочешуйная антимора обитает в Северной Пацифике и распространена от северной части Берингова моря к югу от м. Наварин на севере до Тайваня, Гавайских о-вов и южной оконечности Калифорнийского п-ова на юге (Yeh, Drazen, 2009; Iwamoto, 2010; Yu, Ho, 2012). В открытых водах она наиболее часто встречается на подводных горах Императорского и Гавайского хребтов, изредка − на подводных возвышенностях зал. Аляска, на подводных хребтах Хуан-де-Фука и Бауэрс, а также в районах некоторых океанических разломов северо-восточной части океана (Orlov et al., 2020). A. microlepis регулярно встречается в прилове на глубоководном траловом, ярусном и ловушечном промысле и в отдельных районах может встречаться в заметных количествах (Fitch, Lavenberg, 1968; Eschmeyer et al., 1983; Cohen et al., 1990). Ранее считалось, что мелкочешуйная антимора не имеет промыслового значения (Orlov, Abramov, 2001; Орлов, Абрамов, 2002), но недавние исследования (Давлетшина и др., 2019) показали, что она может служить источником получения диетического рыбного сырья и использоваться для производства продукции как массового, так и специального назначения. Несмотря на довольно высокую встречаемость в уловах, рост и возраст мелкочешуйной антиморы исследован лишь в водах северных Курильских о-вов, Юго-Восточной Камчатки (Orlov, Abramov, 2001; Орлов, Абрамов, 2002) и западного побережья США (Frey et al., 2017).
Цель работы – представить данные по возрасту и росту мелкочешуйной антиморы из вод подводного Императорского хребта (открытые воды северо-западной части Тихого океана) на основании анализа отолитов (сагитт) и сравнить полученные результаты с ранее опубликованными данными.
МАТЕРИАЛ И МЕТОДИКА
Материал для исследования собирали в период с апреля по август в водах подводного Императорского (Северо-Западного) хребта на глубинах от 585 до 2417 м: в 2014−2017 гг. − в центральной (подводные горы Нинтоку, Дзингу и Оджин) (рис. 1а), в 2018 г. – в северной (подводные горы Дзимму, Суйко и “T454+A”) частях (рис. 1б). Пробы отбирали на судах рыболовных компаний ООО “Южный крест” (СЯМ “Палмер) и АО/РК “Восток-1” (ЯМС “Восток-7”), оснащённых однотипными ярусно-крючковыми линиями с автоматическим наживлением (Autoline Deep Sea System) “MUSTAD”.
Рис. 1.
Места отбора проб ( ) мелкочешуйной антиморы Antimora microlepis в районе подводного Императорского хребта: а – центральная часть хребта, 2014−2017
гг.; б – северная часть хребта, 2018 г.; (—) – изобаты.
) мелкочешуйной антиморы Antimora microlepis в районе подводного Императорского хребта: а – центральная часть хребта, 2014−2017
гг.; б – северная часть хребта, 2018 г.; (—) – изобаты.

Всего проанализировали 149 особей мелкочешуйной антиморы. Полный биологический анализ проводили по стандартным методикам (Laevastu, 1965; Правдин, 1966); измеряли общую длину (TL) и массу тела, определяли пол и стадию зрелости гонад. Отолиты (сагитты) извлекали из свежепойманной рыбы в процессе проведения биологического анализа на борту судна. Измерение, взвешивание отолитов и определение возраста проводили в лабораторных условиях. Длину отолита (Lo) измеряли электронным штангенциркулем (“Kraftool GmbH”, Германия) с точностью до 0.01 мм; массу (Wo) − на электронных весах (“Sartorius GmbH”, Германия) с точностью до 0.001 г.
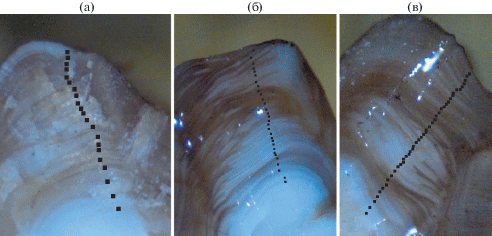
С начала 1980-х гг. при определении возраста рыб широкое применение нашёл способ подсчёта годовых колец по обожжённым сломам (спилам) отолитов, который хорошо зарекомендовал себя для донных (в том числе глубоководных) рыб западного побережья США и Канады (Beamish, McFarlane, 1987). Мелкочешуйная антимора, как и многие глубоководные рыбы, относится к долгоживущим видам (Orlov, Abramov, 2001; Орлов, Абрамов, 2002; Frey et al., 2017), поэтому её возраст определяли в соответствии с методиками, разработанными специально для некоторых долгоживущих глубоководных видов рыб (Beamish, Chilton, 1982; Rodríguez Mendoza, 2006). Отолиты разламывали в центральной части и прокаливали в пламени спиртовой горелки, при необходимости шлифовали. Для шлифовки отолитов использовали абразивные диски с алюминий-оксидным или силикон-карбидным покрытием зернистостью 0.1−0.9 мкм (“Buehler”, США). Возраст определяли путём подсчёта годовых колец на фотографиях (рис. 2) сломов отолитов в программе Adobe Photoshop CS6, ver. 13.0x64 software (“Adobe System Inc.”, СШA). Сломы фотографировали в глицерине под увеличением в отражённом свете с помощью встроенной камеры микроскопа Zeiss Stemi 305 (Германия). По результатам анализа сломов отолитов только у 141 особи отолиты оказались пригодны для определения возраста, отолиты восьми рыб оказались очень хрупкими и рассыпались в момент изготовления слома или имели трудно различимые годовые приросты.
Рис. 2.
Сломы отолитов мелкочешуйной антиморы Antimora microlepis из вод Императорского хребта: а – TL 45 см, возраст 21 год; б – TL 64 см, возраст 30 лет; в − TL 80 см, возраст 44 года; (◼) − годовые зоны роста.
Рост антиморы описывали уравнением Берталанфи, которое широко используется для описания роста представителей рода Antimora (Magnússon, 2001; Orlov, Abramov, 2001; Орлов, Абрамов, 2002; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Frey et al., 2017; Орлов и др., 2018б; Vedishcheva et al., 2019; Korostelev et al., 2019). Величину коэффициента детерминации (R2) определяли методом наименьших квадратов, приведя зависимость к линейному виду (Frey et al., 2017). Среднюю удельную скорость линейного роста оценивали по формуле (Мина, Клевезаль, 1976; Алимов, 1989):
где Ln+1 и Ln − средняя длина рыб в возрасте соответственно tn+1 и tn. Статистическую обработку результатов проводили в программе MS Excel®, коэффициенты уравнения роста Берталанфи рассчитывали с помощью компьютерной программы PAST ver. 3.14 (Hammer et al., 2001).РЕЗУЛЬТАТЫ
В исследуемой выборке ввиду селективности орудия лова мелкочешуйная антимора была представлена только крупными особями TL 435−840 мм и массой 550−5640 г. При этом более 40% в улове пришлось на размерную группу 500−600 мм (рис. 3а); более 30% улова составили особи массой 1001−1500 г (рис. 3б). Доля самцов в уловах составила 21.5%, самок − 78.5%, при этом ювенильные особи в уловах отсутствовали. Самки по сравнению с самцами характеризовались бóльшими размерами. Длина тела самцов варьировала в пределах 450−690 (560 ± 64) мм, а масса тела − 570−2360 (1304 ± 425) г, длина и масса самок − соответственно 435−840 (614 ± 81) мм и 550−5640 (2104 ± 1044) г. При TL 450−550 мм самцы и самки имели одинаковую массу тела, при TL > 550 мм самцы были легче самок (рис. 4).
Рис. 3.
Размерный состав мелкочешуйной антиморы Antimora microlepis в ярусных уловах из вод Императорского хребта: а – длина (TL), б − масса.
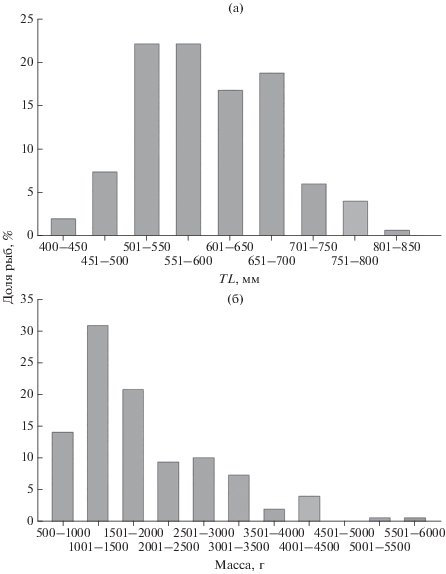
Рис. 4.
Зависимость между длиной (TL) и массой тела мелкочешуйной антиморы Antimora microlepis из вод Императорского хребта; (∙∙∙ ◇ ∙∙∙) – самцы, (- - ⚪ - -) – самки, (—) – оба пола.
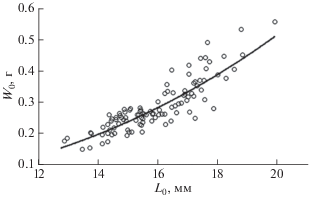
Зависимость между длиной (Lo, мм) и массой отолитов (Wo, г) описывается степенной функцией: Wo = 0.0002$L_{o}^{{2.7085}}$, R2 = 0.7682 (рис. 5).
Рис. 5.
Зависимость между длиной (Lo) и массой (Wo) отолита мелкочешуйной антиморы Antimora microlepis из вод Императорского хребта.
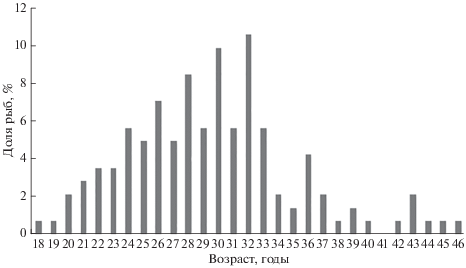
Результаты определения возраста мелкочешуйной антиморы показали, что в улове преобладали особи в возрасте 24−33 лет (68.9%), при этом наиболее многочисленны были рыбы в возрасте 32 года (10.6%) (рис. 6).
Рис. 6.
Возрастной состав мелкочешуйной антиморы Antimora microlepis в ярусных уловах из вод Императорского хребта.
Возрастной состав самцов и самок различался. Минимальный возраст 18 лет отмечен у самки TL 460 мм и массой 660 г. Минимальный возраст самцов (19 лет) отмечен у особи TL 485 мм и массой 680 г. Максимальный возраст (46 лет) зарегистрирован у самки TL 840 мм и массой 5260 г. Самый старый самец в исследованной выборке имел возраст 36 лет при длине 690 мм и массе тела 1800 г (рис. 7). Средний возраст самок составил 30.4 ± ± 5.7, самцов − 26.5 ± 4.2 года.
Рис. 7.
Темп роста самцов (∙∙∙ ◇ ∙∙∙) и самок (- - ⚪ - -) мелкочешуйной антиморы Antimora microlepis в водах Императорского хребта.
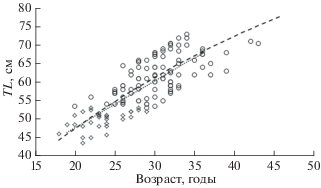
Уравнение Берталанфи, описывающее рост самцов, имеет параметры L∞ = 556.28, k = 0.0025, t0 = 0.96 (R2 = 0.66); самок − L∞ = 118.55, k = 0.0220, t0 = 0.93 (R2 = 0.69). Значения коэффициента детерминации для уравнения связи между возрастом и длиной самцов несколько ниже, чем для самок, что наряду с сильно завышенным значением L∞ у самцов можно объяснить их небольшим числом в выборке. Самцы и самки имеют сходный темп роста (рис. 7). До 23 лет особи обоих полов растут с одинаковой скоростью, затем самки начинают незначительно опережать самцов: средняя длина самцов в возрасте 25 лет составляет 55.5 см, а самок − 57.3 см, в 30 лет самцы имеют TL 60.0 см, самки – 62.8 см. Самцы старше 30 лет встречаются единично и максимального возраста и длины для вида достигают только самки.
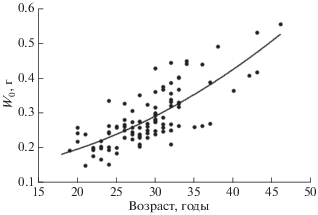
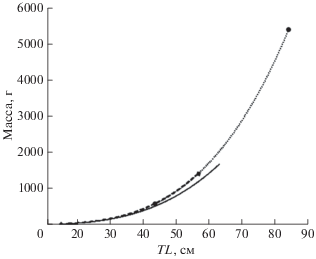
Зависимость между массой отолита (Wo, г) и возрастом (t, годы) лучше всего описывается полиномиальной функцией: Wo = 0.0002t2 − 0.0004t + + 0.1254, R2 = 0.59 (рис. 8).
ОБСУЖДЕНИЕ
Размерно-весовой состав мелкочешуйной антиморы в уловах сильно зависит от типа орудий лова. Так, средняя длина особей в траловых уловах всегда меньше 450 мм (Орлов, Абрамов, 2002; Frey et al., 2017), в то время как в ярусных уловах − ~ 600 мм, что необходимо учитывать при сравнении результатов исследований, основанных на уловах разными типами орудий лова. По нашим данным, в ярусных уловах в водах Императорского хребта самки мелкочешуйной антиморы крупнее самцов, тогда как в траловых уловах в прикамчатских и прикурильских водах Тихого океана средняя длина и масса самцов больше, чем самок (Орлов, Абрамов, 2002).
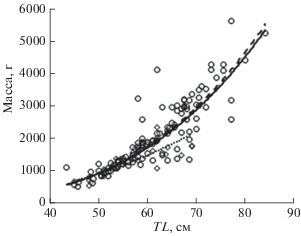
Несмотря на разный размерный состав траловых и ярусных уловов, кривые зависимости длина−масса у мелкочешуйной антиморы из разных районов Северной Пацифики очень схожи (рис. 9) и описываются уравнениями с очень близкими параметрами: для рыб из прикурильских и прикамчатских вод Тихого океана − W = 0.0029 TL3.2048, R2 = 0.934 (наши данные); из Северо-Восточной Пацифики − W = 0.0015 TL3.4018, R2 = 0.954 (Frey et al., 2017); из вод Императорского хребта − W = 0.0016 TL3.395, R2 = 0.807 (настоящая работа).
Рис. 9.
Зависимость между длиной (TL) и массой тела мелкочешуйной антиморы Antimora microlepis из разных районов Северной Пацифики: (∙∙∙ ⚫ ∙∙∙) − воды Императорского хребта (наши данные), (─) − прикурильские и прикамчатские воды Тихого океана (наши данные), (- ◆ -) − Северо-Восточная Пацифика (Frey et al., 2017).
Уравнения, описывающие связь между длиной и массой отолитов антимор из вод Императорского хребта и из прикурильских и прикамчатских вод Тихого океана (наши данные), различаются только значениями линейного коэффициента (0.0002 против 0.0001) при равных показателях степени (2.7085). Вместе с тем полученные нами зависимости массы отолита от возраста заметно отличаются от параметров аналогичных уравнений, рассчитанных для мелкочешуйной антиморы из других районов: Wo = −0.00011t2 + 0.017t + 0.032 (R2 = 0.84) − Северо-Восточная Пацифика (Frey et al., 2017); Wo = 0.00016t2 + 0.058t + 0.0587 (R2 = = 0.82) − прикурильские и прикамчатские воды Тихого океана (наши данные). Эти различия, возможно, обусловлены разным размерно-возрастным составом исследованных выборок.
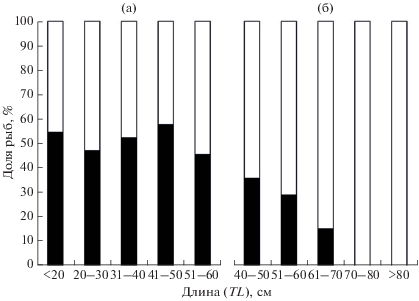
В Северо-Восточной Пацифике отмечены существенные межгодовые колебания соотношения полов мелкочешуйной антиморы в уловах: например, в 2013 г. доля самок составляла 40%, а в 2015 г. − 25% (Frey et al., 2017). В наших же уловах преобладали самки (78.5%). Объяснить данный факт можно тем, что особи рассматриваемого вида по мере роста опускаются на бóльшие глубины (Frey et al., 2017). Поскольку среди молодых особей соотношение полов близко к 1 : 1, а в старших возрастных группах преобладают самки, траловые уловы, получаемые на относительно небольших глубинах, представлены равным соотношением полов (рис. 10а), а в ярусных, осуществляемых на бóльших глубинах, преобладают самки (рис. 10б). Ранее некоторые авторы (Cohen et al., 1990) высказывали предположение о разделённости мест обитания самцов и самок мелкочешуйной антиморы, что не подтверждается нашими данными.
Рис. 10.
Соотношение самок (◻) и самцов (◼) в разных размерных группах мелкочешуйной антиморы Antimora microlepis: а − траловые уловы, прикурильские и прикамчатские воды Тихого океана (наши данные); б − ярусные уловы, воды Императорского хребта.
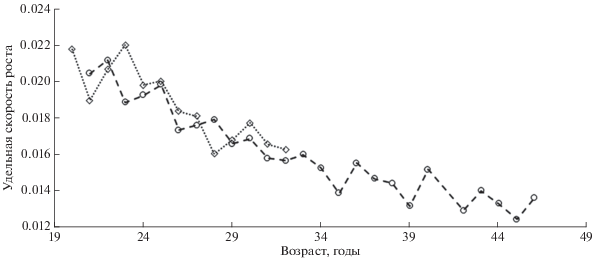
Несмотря на сильно различающиеся параметры уравнения Бератланфи для описания роста самцов и самок мелкочешуйной антиморы из вод Императорского хребта, расчёты удельной скорости роста показали, что с 21-го по 32-й год жизни темпы роста особей обоих полов довольно схожи (рис. 11). Впоследствии самки постепенно замедляют рост, а самцы перестают встречаться в ярусных уловах. В литературе имеются указания на соответствие параметров роста обоих полов антиморы уравнению Берталанфи (Fossen, Bergstad, 2006; Орлов и др., 2018б, Vedishcheva et al., 2019), которое считается применимым ко многим долгоживущим и медленнорастущим рыбам (Morales-Nin, 1990; Allain, Lorance, 2000). Однако в нашем случае значения параметров этого уравнения для самцов, видимо, не отражают закономерности их роста ввиду небольшой по объёму и с коротким размерным рядом выборки.
Рис. 11.
Удельная скорость роста самцов (∙∙∙ ◇ ∙∙∙) и самок (- - ⚪ - -) мелкочешуйной антиморы Antimora microlepis в водах Императорского хребта.
В некоторых работах по изучению возраста клюворылой антиморы (Fossen, Bergstad, 2006; Horn, Sutton, 2015; Орлов и др., 2018б) указывалось на трудности как при приготовлении сломов отолитов, так и при интерпретации полученных данных. В нашей выборке подсчёт годовых колец оказался невозможен в 5% случаев.
Поскольку уловы при ярусном промысле состоят преимущественно из рыб крупного размера, наша выборка была представлена коротким размерным рядом. Именно этим можно объяснить невысокие значения коэффициента детерминации для зависимостей длина тела−возраст и масса отолита−возраст мелкочешуйной антиморы. Подтверждением этому может служить пример из вод Юго-Западной Гренландии (Орлов и др., 2018б), когда величина R2 для ювенильных особей клюворылой антиморы TL 18−42 см была равна 0.58, в то время для самок с более длинным размерным рядом (21−70 см) она уже составляла 0.95.
Параметры уравнения роста Берталанфи, полученные на основании выборки из вод Императорского хребта, значительно отличаются от таковых из других районов Северной Пацифики (таблица), что можно объяснить различиями размерно-возрастного состава выборок, а также разными методиками, поскольку при определении возраста антимор из прикамчатских и прикурильских вод Тихого океана (Orlov, Abramov, 2001; Орлов, Абрамов, 2002) отолиты не прокаливали. Высокое значение предельной длины (L∞), скорее всего, обусловлено значительной долей крупных и отсутствием мелких особей в нашей выборке. Подобные завышения отмечаются и в других исследованиях возраста антимор, например, в тихоокеанских водах северных Курильских о-вов и Юго-Восточной Камчатки (Орлов, Абрамов, 2002), где L∞ = 125.9 см (n = 109), и водах Гренландии (Fossen, Bergstad, 2006), где L∞ = 2332.0 см (n = 68). Значение коэффициента k, который характеризует скорость достижения предельной длины, в выборке из вод Императорского хребта, состоящей из крупных рыб, заметно ниже, чем в уловах из Северо-Восточной Пацифики (Frey et al., 2017) и прикурильских и прикамчатских вод Тихого океана (Орлов, Абрамов, 2002), что может быть связано с замедлением скорости роста по мере старения особей.
Параметры уравнения роста Берталанфи мелкочешуйной антиморы Antimora microlepis в разных частях ареала
| Район | Параметры уравнения роста | n, экз. | Источник информации | |||
|---|---|---|---|---|---|---|
| L∞ (TL) | k | t0 | R2 | |||
| Прикурильские и прикамчатские воды Тихого океана | 125.9 | 0.031 | 0.91 | – | 109 | Орлов, Абрамов, 2002 |
| Северо-Восточная Пацифика | 61.2 | 0.100 | −2.69 | 0.78 | 247 | Frey et al., 2017 |
| Воды Императорского хребта | 138.1 | 0.016 | 0.90 | 0.70 | 141 | Наши данные |
Несмотря на растущее число исследований возраста глубоководных рыб, включая антимор, определение возраста по сломам отолитов нуждается в валидации другими методами. С этой целью была предпринята попытка сравнения определения возраста A. microlepis по позвонкам и отолитам (Korostelev et al., 2020), результаты которой показали практически одинаковое число колец на отолитах и позвонках. Поскольку антиморы ведут глубоководный образ жизни, более надёжные определения её возраста возможны радиометрическим методом, например, с использованием пары изотопов Pb-210/Ra-226 (Smith et al., 1991; Cailliet et al., 2001; Буслов, 2009). Недавние исследования микро- и ультрамикроэлементного состава отолитов двух видов антимор (Коростелев, Орлов, 2020) показали наличие в них концентраций свинца, достаточных для определения возраста радиометрическим методом. Современные способы лова и глубины обитания антимор не позволяют поймать достаточное число их личинок и ранней молоди, поэтому полученные ранее сведения по возрасту и росту могут быть скорректированы по мере получения новых данных об антиморах в первые годы жизни.
Список литературы
Алимов А.Ф. 1989. Введение в продукционную гидробиологию. Л.: Гидрометеоиздат, 152 с.
Буслов А.В. 2009. Определение возраста тресковых (Gadidae) дальневосточных морей: теоретические положения и методические подходы (обзор) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 14. С. 32−46.
Давлетшина Т.А., Шульгина Л.В., Павель К.Г., Мальцев И.В. 2019. Технохимическая характеристика глубоководного объекта антиморы мелкочешуйной Antimora microlepis // Изв. ТИНРО. Т. 198. С. 230−238. https://doi.org/10.26428/1606-9919-2019-198-230-238
Коростелев Н.Б., Орлов А.М. 2020. Содержание микро- и ультрамикроэлементов в отолитах клюворылой Antimora rostrata и мелкочешуйной A. microlepis антимор (Moridae, Teleostei) // Океанология. Т. 60. № 6. С. 910−914.
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Орлов А.М., Абрамов А.А. 2002. Новые данные о мелкочешуйной антиморе Antimora microlepis (Moridae) из северо-западной части Тихого океана // Вопр. ихтиологии. Т. 42. № 1. С. 70–78.
Орлов А.М., Григоров И.В., Лазарева Н.И. 2018а. Сравнительный морфологический анализ антимор (Antimora spp., Moridae, Gadiformes) на основании ихтиологических коллекций // Зоол. исследования. № 20. С. 98−111.
Орлов А.М., Ведищева Е.В., Трофимова А.О., Орлова С.Ю. 2018б. Возраст и рост клюворылой антиморы Аntimora rostrata (Мoridae) в водах юго-западной Гренландии // Вопр. ихтиологии. Т. 58. № 2. С. 192–200. https://doi.org/10.7868/S004287521802008X
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 373 с.
Allain V., Lorance P. 2000. Age estimation and growth of some deep-sea fish from the northeast Atlantic Ocean // Cybium. V. 24. P. 7–16.
Beamish R.J., Chilton D.E. 1982. Preliminary evaluation of a method to determine the age of sablefish (Anoplopoma fimbria) // Can. J. Fish. Aquat. Sci. V. 39. P. 277−287.
Beamish R.J., McFarlane G.A. 1987. Current trends in age determination methodology // Age and growth of fish. Ames: Iowa State Univ. Press. P. 15−42.
Cailliet G.M., Andrews A.H., Burton E.J. et al. 2001. Age determination and validation studies of marine fishes: do deep-dwellers live longer? // Exp. Gerontol. V. 36. P. 739–764.
Cohen D.M., Inada T., Iwamoto T., Scialabba N. 1990. Gadiform fishes of the world (Order Gadiformes) // An annotated and illustrated catalogue of cods, hakes, grenadiers and other gadiform fishes known to date. V. 10. FAO Fish. Synopsis. № 125. FAO: Rome, 442 p.
Eschmeyer W.N., Herald E.S., Hamman H. 1983. A field guide to Pacific coast. Boston: Houghton Mifflin Co., 336 p.
Fitch J.E., Lavenberg R.J. 1968. Deep-water fishes of California. Berkley: Univ. Calif. Press, 155 p.
Frey P.H., Keller A.A., Simon V. 2017. Dynamic population trends observed in the deep-living Pacific flatnose, Antimora microlepis, on the US West Coast // Deep-Sea Res. Pt. I. V. 122. P. 105−112. https://doi.org/10.1016/j.dsr.2017.03.006
Fossen I., Bergstad O.A. 2006. Distribution and biology of blue hake Antimora rostrata (Pisces: Moridae), along the mid-Atlantic Ridge and off Greenland // Fish. Res. V. 82. № 1−3. P. 19−29. https://doi.org/10.1016/j.fishres.2006.08.023
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electron. V. 4. P. 9.
Horn P.L., Sutton C.P. 2015. An assessment of age and growth of violet cod (Antimora rostrata) in the Ross Sea, Antarctica // Polar Biol. V. 38. № 9. P. 1553−1558. https://doi.org/10.1007/s00300-015-1702-3
Iwamoto T. 2010. Antimora microlepis. The IUCN Red List of Threatened Species 2010. Article e.T155287A4766841. https://doi.org/10.2305/IUCN.UK.2010-4.RLTS.T155287A4766841.en
Korostelev N.B., Vedishcheva E.V., Orlov A.M. 2019. Age and growth of Antimora rostrata (Moridae, Gadiformes, Teleostei) from the Kerguelen and Crozet Islands in the southern Indian Ocean // Polar Rec. V. 55. № 6. P. 452–459. https://doi.org/10.1017/S0032247420000157
Korostelev N.B., Frey P.H., Orlov A.M. 2020. Using different hard structures to estimate the age of deep-sea fishes; a case study of the Pacific flatnose, Antimora microlepis (Moridae, Gadiformes, Teleostei) // Fish. Res. V. 232. Article 105731. 4 p. https://doi.org/10.1016/j.fishres.2020.105731
Laevastu T. 1965. Manual of methods in fisheries biology. FAO: Rome, 51 p.
Magnússon J.V. 2001. Distribution and some other biological parameters of two morid species Lepidion eques (Gűnther, 1887) and Antimora rostrata (Gűnther, 1878) in Icelandic waters // Fish. Res. V. 51. № 2−3. P. 267−281. https://doi.org/10.1016/S0165-7836(01)00251-X
Morales-Nin B. 1990. A first attempt at determining growth patterns of some Mediterranean deep-sea fishes // Sci. Mar. V. 54. P. 241–248.
Orlov A.M., Abramov A.A. 2001. New data on Pacific flatnose, Antimora microlepis (Moridae) from the northwestern Pacific Ocean // Oceans, 2001. MTS/IEEE Conference and Exhibition. V. 2. P. 833–841. https://doi.org/10.1109/OCEANS.2001.968227
Orlov A.M., Bannikov A.F., Orlova S.Yu. 2020. Hypothesis of Antimora spp. (Moridae) dispersion in the world oceans based on data on modern distribution, genetic analysis, and ancient records // J. Ichthyol. V. 60. № 3. P. 399–410. https://doi.org/10.1134/S0032945220030108
Rodríguez Mendoza R.P. 2006. Otoliths and their applications in fishery science // Ribarstvo. V. 64. № 3. P. 89−102.
Small G.J. 1981. A review of the bathyal fish genus Antimora (Moridae: Gadiformes) // Proc. Calif. Acad. Sci. V. 42. № 13. P. 341−348.
Smith J.N., Nelson R., Campana S.E. 1991. The use of Pb-210/Ra-226 434 and Th-228/Ra-228 disequilibria in the ageing of otoliths of marine fish // Radionuclides in the study of marine processes. N.Y.: Elsevier. P. 350−359.
Vedishcheva E.V., Korostelev N.B., Gordeev I.I., Orlov A.M. 2019. A first attempt to evaluate the age and growth of blue hake Antimora rostrata (Moridae, Gadiformes, Teleostei) from the Lazarev and Weddell seas (Antarctic) // Polar Rec. V. 55. № 1. P. 25−31. https://doi.org/10.1017/S0032247419000147
Yeh J., Drazen J.C. 2009. Depth zonation and bathymetric trends of deep-sea megafaunal scavengers of the Hawaiian Islands // Deep-Sea Res. Pt. I. V. 56. № 2. P. 251–266. https://doi.org/10.1016/j.dsr.2008.08.005
Yu Y., Ho H.-C. 2012. Review of codfish family Moridae (Teleostei: Gadiformes) from Taiwan // Platax. V. 9. P. 33−59.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии