Вопросы ихтиологии, 2021, T. 61, № 1, стр. 100-108
Особенности репродуктивной биологии Scorpaenopsis papuensis (Scorpaenidae)
Н. Г. Емельянова 1, Д. А. Павлов 1, *
1 Московский государственный университет
Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 12.02.2020
После доработки 27.02.2020
Принята к публикации 03.03.2020
Аннотация
Исследовали строение гонад, морфологию ооцитов, подвижность сперматозоидов после активации и их ультраструктуру у особей Scorpaenopsis papuensis. Ооциты имеют стебельки, прикрепляющиеся к стромальному стержню, расположенному в центре каждого из двух обособленных яичников. Распределение ооцитов по диаметру свидетельствует о непрерывном типе оогенеза и порционном икрометании. В гипертрофированном мочевом пузыре самцов обнаружены сперматозоиды (0.005–0.011 × 109 в мл). Сперматозоиды, взятые из семенников, сохраняют высокую скорость поступательных движений в течение, по крайней мере, 13 мин после активации. По форме сперматозоидов Sc. papuensis существенно не отличается от представителей подотряда Scorpaenoidei с внешним осеменением. Углубление в основании ядра сперматозоида отсутствует, проксимальная и дистальная центриоли расположены ортогонально друг к другу.
Скорпеновидные рыбы (Scorpaenoidei) включают около 500 видов, распространённых в тропических, субтропических и умеренных водах, но главным образом в Индо-Пацифике (Fricke et al., 2020). Несмотря на то что эти рыбы широко известны, поскольку представляют опасность из-за наличия ядовитых желёз в основании лучей плавников, а также повсеместно содержатся в морских аквариумах, биология большинства видов остаётся неисследованной. Достаточно полно описана биология некоторых промысловых видов семейства Sebastidae, видов того же семейства и семейства Synanceiidae, являющихся объектами аквакультуры, а также представителей подсемейства Pteroinae в связи с инвазией в прибрежные зоны Северо-Западной Атлантики, Карибских о-вов и Мексиканского залива (Kwik, 2011; Santhanam, 2019). В ряде тропических регионов в связи с интенсивным промыслом и изъятием из экосистемы крупных хищных рыб скорпеновидные рыбы являются конечным звеном трофической цепи. При этом многие виды обитают в прибрежных зонах с биотопами, особенно подверженными деградации вследствие антропогенного воздействия и глобального изменения климата. В связи с этим исследование их репродуктивных характеристик является особенно актуальным для сохранения биоразнообразия сложившихся биотопов.
Биология размножения представителей многих таксономических групп, редко используемых в качестве объектов промысла или аквариумного бизнеса, остаётся неизвестной. Одна из таких групп – род Scorpaenopsis (Scorpaenidae: Scorpaeninae), включающий 28 валидных видов (Froese, Pauly, 2019). Объект нашей работы – Scorpaenopsis papuensis. Вид распространён в Тихом океане от Индонезии и Филиппин до о-вов Общества, к северу от о‑вов Рюкю, к югу от Большого Барьерного Рифа и Фиджи (Froese, Pauly, 2019). Рыбы достигают максимальной длины (TL) 250 мм (Myers, 1999), по другим данным, не более SL 195 мм и редко превышают 170 мм (Randall, Eschmeyer, 2001). Обитают в районах коралловых рифов и на каменистых участках на глубине до 40 м (Myers, 1999), а также в эстуариях и лагунах, часто среди водорослей, покрывающих твёрдый грунт (Kuiter, Tonozuka, 2001). Являются хищниками-засадчиками с покровительственной окраской тела, ведут одиночный образ жизни (Allen, Erdmann, 2012). При освещении голубым или ультрафиолетовым светом тело излучает красный цвет; биолюминисценция может использоваться для внутривидовой коммуникации и обеспечения покровительственной окраски (Sparks et al., 2014).
Цель работы – исследовать особенности биологии размножения Sc. papuensis, включая строение гонад, состав и морфологию ооцитов и ультраструктуру сперматозоидов. Последний показатель значительно варьирует в разных таксономических группах (Jamieson, 1991; Mattei, 1991) и может быть использован для уточнения родственных отношений скорпеновидных рыб, которые остаются во многом неясными (Smith, Wheeler, 2004; Smith et al., 2018).
МАТЕРИАЛ И МЕТОДИКА
Сбор материала выполнен на базе Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра (г. Нячанг, Вьетнам) в марте 2015 и апреле 2017 гг. Особей Sc. papuensis отлавливали в прибрежной зоне залива Нячанг Южно-Китайского моря и в течение нескольких часов живыми доставляли в лабораторию. Вид идентифицировали по определителю рода Scorpaenopsis Индо-Пацифики (Randall, Eschmeyer, 2001). Биологический анализ проведён на наркотизированных (MS-222) особях.
Самцы ряда видов рыб подотряда Scorpaenoidei обладают гипертрофированным мочевым пузырём, в содержимом которого обнаружены сперматозоиды (Павлов, Емельянова, 2007, 2013, 2019; Pavlov, Emel’yanova, 2010; Емельянова, Павлов, 2020). Длину (K) и ширину (k) наполненного мочевого пузыря самцов и самок измеряли с помощью электронного штангенциркуля. Объём мочевого пузыря (V) рассчитывали по формуле для сплюснутого сфероида: V = π/6 × K2 × k. Концентрацию сперматозоидов в мочевом пузыре определяли в камере Горяева после разведения его содержимого в 10 раз.
Для анализа размерного состава ооцитов использовали фрагменты свежих гонад, помещённые в физиологический раствор. Изображения клеток получали с помощью микроскопа Nikon Eclipse E-200 и видеокамеры. Диаметр ооцитов измеряли с использованием программы ImageJ, ооциты диаметром <50 мкм не учитывали. Для световой микроскопии фрагменты яичников фиксировали в жидкости Буэна; дальнейшая гистологическая обработка проведена общепринятыми методами с окрашиванием гематоксилин–эозином (Роскин, Левинсон, 1957).
Подвижность сперматозоидов одного из самцов регистрировали посредством компьютерного анализа (Павлов, 2006). На предметное стекло наносили мазок спермы, взятой из измельчённого семенника, после чего сперму активировали каплей морской воды и накрывали покровным стеклом. Для видеозаписи использовали микроскоп Nikon Eclipse E-200 (объектив ×40, окуляр ×10), видеокамеру и компьютер. Видеозапись подвижности сперматозоидов (в течение 13 мин при 25°C) начинали через 1 мин после активации спермы с периодичностью 2 мин, сохраняя 16 кадров, соответствующих перемещению клеток в течение 0.5 с. Скорость перемещения сперматозоидов по реальной криволинейной траектории (VCL) и прямолинейной (между начальной и конечной точками) траектории (VSL) определяли при помощи программы ImageJ, модуль MTrack2.
Для электронной микроскопии зафиксированы фрагменты семенников трёх самцов. Фиксатор – смесь 2.5%-ного раствора глутарового альдегида и 2%-ного параформальдегида на фосфатном буфере при pH 7.4 с добавлением хлористого натрия (2.5%). Постфиксацию осуществляли в 1%-ном растворе четырёхокиси осмия. Дальнейшую обработку для сканирующей электронной микроскопии (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ) проводили по общепринятым методам (Уикли, 1975). Объекты для СЭМ напыляли сплавом золота с палладием и исследовали в сканирующем электронном микроскопе CamScan S-4 (“Cambridge Instruments”, Великобритания) при ускоряющем напряжении 20 кВ. Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1011 (“Jeol”, Япония) при ускоряющем напряжении 80 кВ. Для получения изображений использовали цифровую камеру ES-500W (“Gatan”, СШA) и программу Digital Micrograph.
Измерения сперматозоидов проведены на их изображениях (СЭМ) посредством программы ImageJ. Для описания формы головки и средней части сперматозоида использовали четыре индекса: HL/HW – отношение длины головки к её ширине, MPW/MPL – отношение ширины средней части к её длине, HL/MPL – отношение длины головки к длине средней части, HW/MPW – отношение ширины головки к ширине средней части (Павлов, Емельянова, 2018). Статистический анализ проведён с помощью программы GraphPad Prism 5.03.
РЕЗУЛЬТАТЫ
Размер рыб, половой дихроматизм и строение внутренних органов
Биологические показатели рыб приведены в табл. 1. Самки представлены особями с яичниками II, II–III (TL 116–150 мм, n = 5) и IV (TL 140–170 мм, n = 5) стадий зрелости. Семенники самцов имели IV стадию зрелости. Соотношение длина (TL, см) – масса тела (W, г) для рыб обоих полов аппроксимировано уравнением: W = 0.0155TL3.0466, R2 = 0.972.
Таблица 1.
Биологические показатели исследованных особей Scorpaenopsis papuensis
| Пол | Число рыб, экз. | Длина, мм | Масса, г | ГСИ, % | |||
|---|---|---|---|---|---|---|---|
| TL | SL | W | w | g | |||
| Самки | 10 | $\frac{{116{\kern 1pt} --{\kern 1pt} 170}}{{144\,\,\left( {16} \right)}}$ | $\frac{{95{\kern 1pt} --{\kern 1pt} 134}}{{118\,\,(12)}}$ | $\frac{{23{\kern 1pt} --{\kern 1pt} 74}}{{53\,\,(15)}}$ | $\frac{{21{\kern 1pt} --{\kern 1pt} 69}}{{48\,\,(14)}}$ | $\frac{{0.03{\kern 1pt} --{\kern 1pt} 0.94}}{{0.47\,\,\left( {0.31} \right)}}$ | $\frac{{0.14{\kern 1pt} --{\kern 1pt} 1.60}}{{0.91\,\,\left( {0.49} \right)}}$ |
| Самцы | 11 | $\frac{{134{\kern 1pt} --{\kern 1pt} 217}}{{172\,\,\left( {25} \right)}}$ | $\frac{{109{\kern 1pt} --{\kern 1pt} 182}}{{142\,\,\left( {21} \right)}}$ | $\frac{{40{\kern 1pt} --{\kern 1pt} 188}}{{98\,\,\left( {46} \right)}}$ | $\frac{{34{\kern 1pt} --{\kern 1pt} 178}}{{90\,\,\left( {45} \right)}}$ | $\frac{{0.01{\kern 1pt} --{\kern 1pt} 0.16}}{{0.06\,\,\left( {0.04} \right)}}$ | $\frac{{0.02{\kern 1pt} --{\kern 1pt} 0.10}}{{0.06\,\,(0.03)}}$ |
В окончании колючей части спинного плавника самцов (включающей 11 колючих лучей) имеется тёмное пятно. Пятно смещено к верхней кромке плавника, а его расположение варьирует у разных особей: между лучами 7–8 (рис. 1а), 6–10 (рис. 1б) или 7–9 (рис. 1в). В колючей части спинного плавника всех самок пятно отсутствует (рис. 1г, 1д). У особей обоих полов тёмные размытые пятна могут присутствовать в верхней передней и задней областях мягкой части спинного плавника (включающей последний (12-й) колючий луч и 9 членистых).
Рис. 1.
Scorpaenopsis papuensis: а – самец TL 209 мм, IV стадия зрелости гонад; б−д − колючая часть спинного плавника (б – самец TL 164 мм, IV стадия; в – самец TL 163 мм, IV; г – самка TL 143 мм, II; д – самка TL 136 мм, II–III); е – мочеполовая система самца TL 158 мм, IV (контуры семенников и семяпроводов обведены); ж – яичники самки TL 140 мм, IV; 1 – семенники, 2 – семяпроводы, 3 – мочевой пузырь, 4–6 – анальное, половое и мочевое отверстия. Масштаб: 10 мм.

У самцов небольшие семенники лежат в ростральной части полости тела, а удлинённые семяпроводы разделены на всём протяжении и сливаются непосредственно перед генитальным отверстием (рис. 1е). Гипертрофированный мочевой пузырь занимает среднюю и каудальную часть полости тела. Семяпроводы лежат на поверхности мочевого пузыря. Объём мочевого пузыря самцов TL 145–190 мм составляет 4.1–5.4 мл (n = 4). В мочевых пузырях обнаружены зрелые сперматозоиды, концентрация которых составила 0.005–0.011 × × 109 в мл (n = 3). Яичники самок полностью обособлены, а яйцеводы сливаются непосредственно перед половым отверстием (рис. 1ж). Объём мочевого пузыря самок TL 116–150 мм варьирует в пределах 0.04–0.80 (в среднем 0.46) мл (n = 4).
Размерный состав и морфология ооцитов
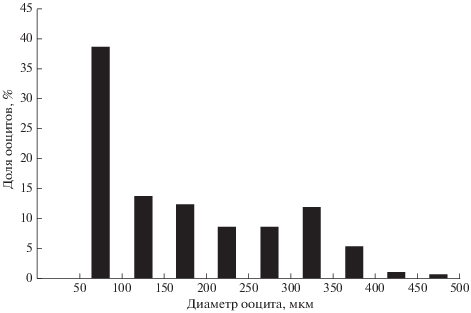
Гонадосоматический индекс (ГСИ) самок с яичниками II и II–III стадий зрелости составляет 0.14–0.67 (0.48)% (n = 5), с яичниками IV стадии – 1.08–1.60 (1.33)% (n = 5). В яичниках IV стадии зрелости доминируют превителлогенные ооциты диаметром до 100 мкм (рис. 2). Среди клеток диаметром 100–150 мкм практически все ооциты, кроме единичных, наиболее мелких, вступили в период вителлогенеза. Доля ооцитов, завершивших вителлогенез, диаметром 400–500 мкм является наименьшей.
Рис. 2.
Распределение ооцитов (число ооцитов 212) по диаметру у самки Scorpaenopsis papuensis TL 170 мм, IV стадия зрелости гонад, гонадосоматический индекс 1.4%.
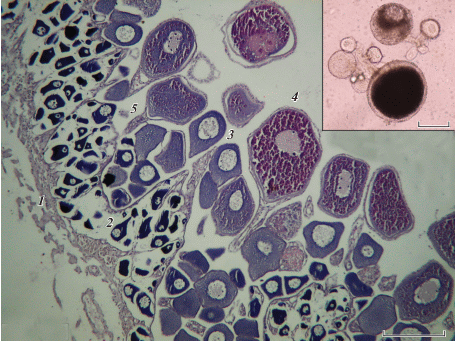
Яичники имеют экзовариальную полость. В центре каждого яичника находится стромальный стержень из соматической ткани, к которому прикрепляются стебельки половых клеток (рис. 3). Стебельки, включающие соединительную ткань и кровеносные сосуды, удлиняются по мере увеличения диаметра ооцитов. Превителлогенные ооциты прилегают к стромальному стержню, а старшая генерация представлена заполненными желтком ооцитами с ядром в центре, локализующимися по периферии герминативной части яичника. Яйценосные пластинки не выражены. Нативные ооциты, извлечённые из яичника, не распадаются на отдельные клетки, а остаются в компактных группах, соединённых основаниями стебельков.
Рис. 3.
Фрагмент яичника самки Scorpaenopsis papuensis (TL 170 мм, стадия зрелости гонад IV, гонадосоматический индекс 1.4%) и ооциты in vivo (на врезке): 1 – строма, 2 – превителлогенный ооцит, 3 – вителлогенный ооцит в начале накопления желточных включений, 4 – заполненный желтком ооцит, 5 – стебелёк. Масштаб: 200 мкм.
Подвижность сперматозоидов после активации
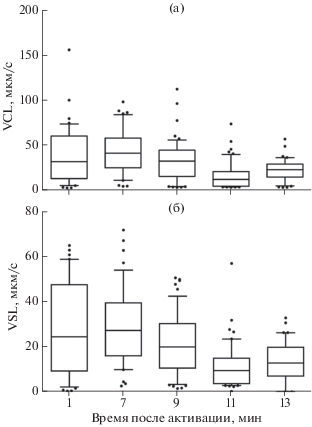
Средняя скорость перемещения сперматозоидов по реальной криволинейной траектории и по прямолинейной траектории (между начальной и конечной точками) через 1 мин после активации составляет соответственно 38.8 и 27.4 мкм/с (рис. 4); через 13 мин − 22.2 и 12.6 мкм/с. Через 30 мин после активации высокую подвижность сохраняют ~ 20% сперматозоидов.
Рис. 4.
Скорость перемещения сперматозоидов самца Scorpaenopsis papuensis (TL 190 мм, IV стадия зрелости гонад, гонадосоматический индекс 0.1%) в зависимости от времени после активации: а – по реальной траектории (VCL); б – между начальной и конечной точками (VSL). Каждый бокс включает 5 горизонтальных линий, которые обозначают 10, 25, 50 (медиана), 75 и 90% данных (от 25 до 75% данных заключены в прямоугольник); (•) − значения за пределами 10 и 90% данных.
Ультраструктура сперматозоидов
Сперматозоиды Sc. papuensis имеют головку округлой формы, умеренно развитую среднюю часть и жгутик (рис. 5а). По данным СЭМ, длина головки составляет в среднем 1.76 мкм, ширина – 1.87 мкм (n = 11). Относительные размеры головки и средней части, характеризующие форму сперматозоидов, приведены в табл. 2.
Рис. 5.
Ультраструктура сперматозоидов Scorpaenopsis papuensis: а – общий вид сперматозоида (сканирующая электронная микроскопия, СЭМ); б, в – головка сперматозоида (трансмиссионная электронная микроскопия, ТЭМ); 1 – проксимальная центриоль, 2 – дистальная центриоль, 3 – расширение цитоплазматического канала, 4 – митохондрия, 5 – поперечные срезы жгутиков. Масштаб: а – 10; б, в – 1 мкм.
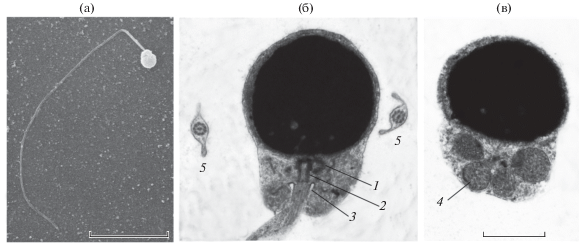
Таблица 2.
Морфологические параметры сперматозоидов Scorpaenopsis papuensis (n = 11)
| Показатель | lim | M | σ |
|---|---|---|---|
| HL/HW | 0.80–1.03 | 0.94 | 0.07 |
| MPW/MPL | 1.73–2.82 | 2.05 | 0.34 |
| HL/MPL | 2.14–3.65 | 2.66 | 0.47 |
| HW/MPW | 1.23–1.59 | 1.38 | 0.12 |
| Длина жгутика, мкм | 21.45–39.1 | 30.7 | 5.7 |
Головка сперматозоида окружена ядерной мембраной, не содержащей пор, и плазмалеммой. Хроматиновый материал головки плотно упакован. В нём иногда встречаются небольшие полости со светлым матриксом. Углубление в основании ядра, в цитоплазме которого обычно находится центриолярный комплекс, отсутствует. Проксимальная и дистальная центриоли расположены под основанием головки и лежат ортогонально друг к другу; проксимальная центриоль торцом обращена к боковой поверхности дистальной (рис. 5б). В цитоплазме средней части обычно заметны два–пять сечений митохондрий (рис. 5в). Митохондрии имеют, как правило, округлую форму и матрикс средней плотности. Цитоплазматический канал, в котором расположена начальная часть жгутика, имеет небольшое расширение каплевидной формы. Аксонема жгутика построена по классической схеме и состоит из девяти дуплетов периферических микротрубочек и двух центральных (9 × 2 + 2). Микротрубочки аксонемы электронопрозрачны. Аксонема окружена цитоплазматическим чехлом, имеющим неодинаковую ширину в разных участках жгутика.
ОБСУЖДЕНИЕ
Из шести самок, отловленных в марте 2015 г., лишь одна имела яичники IV стадии зрелости и высокий ГСИ (1.6%). Можно предположить, что наиболее мелкая самка (TL 116 мм) является неполовозрелой, а более крупные особи с гонадами II и II–III стадий зрелости достигли половой зрелости, но не размножаются в марте. Все самки, собранные в апреле 2017 г., имели гонады IV стадии зрелости, что предполагает их участие в размножении.
В соответствии с диагностическими признаками (Myers, 1999) особи Sc. papuensis имеют пурпурное пятно в окончании колючей части спинного плавника. Вместе с тем на иллюстрациях, приведённых в FishBase (Froese, Pauly, 2019), такое пятно выглядит тёмным, а у части особей отсутствует. Мы обнаружили половой дихроматизм Sc. papuensis: наличие тёмного пятна у самцов и отсутствие у самок. При этом как половой дихроматизм, так и половой диморфизм в целом не свойственны представителям подотряда Scorpaenoidei, за исключением различий в темпе роста и длине самцов и самок, например, у видов родов Sebastes (Lenarz, Wyllie Echeverria, 1991; Love et al., 2002), Pterois (Edwards et al., 2014), Dendrochirus (Павлов, Емельянова, 2019), Scorpaena (Куцын и др., 2019) и Inimicus (Емельянова, Павлов, 2020).
Уникальное для костистых рыб строение яичников с яйценосной стромой, расположенной в центре гонады, и ооцитами, развивающимися на стебельках, а после овуляции включающимися в желеобразную массу (cystovarian type II-3) (Takano, 1989 − цит. по: Koya, Muñoz, 2007), описано у ряда видов подотряда Scorpaenoidei из разных таксономических групп: Scorpaena notata, Scorpaenopsis possi, Sebastapistes cyanostigma (Scorpaenidae: Scorpaeninae) (Muñoz et al., 2002a; Павлов, Емельянова, 2007; Muñoz, 2010; Pavlov, Emel’yanova, 2010), Dendrochirus brachypterus, D. zebra, Pterois miles, P. volitans (Scorpaenidae: Pteroinae) (Fishelson, 1978; Pavlov, Emel’yanova, 2010; Morris et al., 2011), Helicolenus dactylopterus (Sebastidae: Sebastinae) (Koya, Muñoz, 2007; Muñoz, 2010), Synanceia horrida (Synanceiidae: Synanceiinae) (Емельянова, Павлов, 2020). Такое же строение яичников обнаружено и у Sc. papuensis. Судя по распределению ооцитов в яичниках половозрелых самок, этому виду свойствен непрерывный тип оогенеза с порционным икрометанием. Такой тип размножения тропических рыб семейства Scorpaenidae сопровождается низкими значениями ГСИ самок с яичниками IV стадии зрелости: 1.08–1.60% у Sc. papuensis (настоящая статья), 0.89−1.05% у Sc. possi и 1.30−1.61% у Sebastapistes cyanostigma (Павлов, Емельянова, 2007; Pavlov, Emel’yanova, 2010). Тем не менее ГСИ нескольких самок D. zebra с таким же типом икрометания и яичниками близкими к овуляции (IV–V стадия зрелости) превысил 8% (Павлов, Емельянова, 2019). Такие самки обычно отсутствуют в уловах скорпеновых рыб с мелкими (диаметром ~1 мм) овулирующими ооцитами, поскольку их гидратация и переход к овуляции происходят очень быстро (возможно, на протяжении нескольких часов).
Половозрелые самцы Sc. papuensis имеют гипертрофированный мочевой пузырь, в котором обнаружены зрелые сперматозоиды. Их концентрация меньше, чем в мочевом пузыре D. zebra (Павлов, Емельянова, 2019) − 0.005–0.011 против 0.015–0.202 × 109 в мл. Роль гипертрофированного мочевого пузыря самцов рыб отряда Scorpaeniformes в размножении (включая непосредственное участие в осеменении), а также путь проникновения сперматозоидов в мочевой пузырь неоднократно обсуждались (Черняев, 1979; Павлов, Емельянова, 2007, 2013, 2019; Pavlov, Emel’yanova, 2010; Емельянова, Павлов, 2020), но пока остаются неясными.
В соответствии с оценкой подвижности сперматозоидов рыб, принятой для компьютерного анализа спермы, сперматозоиды с VCL > 20 мкм/с и VSL > 3 мкм/с являются полностью подвижными (Lahnsteiner et al., 1996; Павлов, 2006). Через 13 мин после активации сперматозоидов Sc. papuensis средние значения этих показателей выше и, таким образом, сперматозоиды способны к осеменению. Продолжительность поступательного перемещения сперматозоидов Sc. papuensis близка к таковой, отмеченной у взятых из мочевого пузыря половых клеток Sc. possi (≥15 мин) и S. cyanostigma (12–15 мин), но сперматозоиды, полученные из семенников, перемещались в течение 5–6 мин (Павлов, Емельянова, 2007; Pavlov, Emel’yanova, 2010). В целом продолжительность подвижности сперматозоидов после активации у видов семейства Scorpaenidae существенно больше, чем у многих морских рыб (за исключением представителей семейств Sparidae, Labridae и отряда Anguilliformes, сперматозоиды которых остаются подвижными до 15–20 мин). Вместе с тем начальная скорость перемещения сперматозоидов ряда промысловых морских рыб (Hippoglossus hippoglossus, Gadus morhua, Merluccius merluccius, Scophthalmus maximus, Thunnus thynnus) существенно больше, чем у скорпеновых: через 1 мин после активации от 70 до >200 мкм/с (Cosson et al., 2008). Продолжительная фертильность сперматозоидов рыб семейства Scorpaenidae, очевидно, связана с особым способом соединения гамет. Предполагается, что сперматозоиды вымётываются внутрь кладки ооцитов, представляющей собой полую слизистую плавучую трубочку, образованную двумя слоями ооцитов. В результате последующего смыкания концов трубочки сперма удерживается внутри кладки, повышая вероятность контакта между гаметами (Morris et al., 2011; Павлов, Емельянова, 2013).
Ультраструктура сперматозоидов скорпеновидных рыб описана у небольшого числа видов (Muñoz et al., 2002b; Vila et al., 2007, 2010; Павлов, Емельянова, 2007, 2018; Sàbat et al., 2009; Емельянова, Павлов, 2020). По форме головки и средней части сперматозоида Sc. papuensis существенно не отличается от исследованных ранее видов семейств Scorpaenidae (роды Scorpaena, Sebastapistes, Scorpaenopsis, Parascorpaena, Dendrochirus) и Synanceiidae (роды Synanceia и Inimicus), сравнение параметров сперматозоидов которых приведено ранее (Павлов, Емельянова, 2018; Емельянова, Павлов, 2020). При этом по отношению длины головки к её ширине (HL/HW = 0.94) Sc. papuensis сближается не с представителем того же рода Sc. possi (HL/HW = 0.87), а с видами Scorpaena notata (HL/HW = 0.93) и S. horrida (HL/HW = 0.91). В целом индекс HL/HW у представителей семейства Sebastidae с внутренним осеменением (роды Sebastes, Sebasticus, Helicolenus) существенно больше, чем у видов с внешним осеменением. Например, у Helicolenus dactylopterus, характеризующегося внутренним осеменением и вымётыванием желеобразной кладки на ранних стадиях эмбриогенеза (Koya, Muñoz, 2007), HL/HW составляет ≈2.6–3.6 (Vila et al., 2010. Figs. 1F, 2D). Удлинённая головка ряда видов рыб с внутренним осеменением является приспособлением к проникновению в среду с вязким содержимым (Jamieson, 1991; Mattei, 1991; Burns, Weitzman, 2005; Frehlick et al., 2006). Таким образом, по форме головки сперматозоида представители семейства Synanceiidae сближаются с видами семейства Scorpaenidae и обособлены от видов семейства Sebastidae, что не соответствует последней филогенетической схеме (Smith et al., 2018), построенной на основе большого числа морфологических и молекулярных признаков. Согласно этой схеме монофилетическое семейство Synanceiidae представляет собой обособленную кладу, а представители Scorpaenidae и Sebastidae входят в состав большой сестринской клады (названной Scorpaenidae), причём виды последнего семейства рассматриваются как наиболее продвинутые.
По ультраструктуре сперматозоидов Sc. papuensis отличается от всех исследованных видов подотряда Scorpaenoidei полным отсутствием углубления в основании головки, в котором обычно располагается центриолярный комплекс, и наличием расширения цитоплазматического канала (в котором расположена базальная часть жгутика) своеобразной каплевидной формы. Аналогичное расширение отмечено только у Parascorpaena picta (Павлов, Емельянова, 2018), но оно занимает значительно бóльшую площадь, имеет форму неправильного треугольника, а на его плазмалемме локализуются электроноплотные частицы, не отмеченные у других видов. Ортогональное расположение проксимальной и дистальной центриолей в сперматозоиде Sc. papuensis свойственно также D. zebra и Inimicus sinensis (Павлов, Емельянова, 2018; Емельянова, Павлов, 2020). Такая же взаимная локализация центриолей отмечена и у S. horrida, хотя в части клеток наблюдается латеральное смещение проксимальной центриоли и её локализация под острым углом к дистальной (Павлов, Емельянова, 2018). Эта изменчивость может быть связана с незавершённостью формирования сперматозоидов из сперматид у части клеток, что отмечено для H. dactylopterus (Vila et al., 2010). Анализ проведённого ранее сравнения ультраструктуры сператозоидов скорпеновидных рыб (Павлов, Емельянова, 2018) показал, что по числу сечений митохондрий в средней части сперматозоида Sc. papuensis имеет сходство с D. zebra, S. cyanostigma и S. notata, а по длине жгутика – с S. horrida, S. cyanostigma и представителем того же рода (Sc. possi). Накопление данных по ультраструктуре сперматозоидов скорпеновидных рыб позволит более точно выявить специфику таксономических групп разного ранга.
Список литературы
Емельянова Н.Г, Павлов Д.А. 2020. Некоторые данные по репродуктивной биологии Inimicus sinensis (Synanceiidae) // Вопр. ихтиологии. Т. 60. № 3. С. 318–327. https://doi.org/10.31857/S0042875220030108
Куцын Д.Н., Скуратовская Е.Н., Чеснокова И.И. 2019. Размерно-возрастная структура, рост и созревание морского ерша Scorpaena porcus (Scorpaenidae) из вод юго-западного Крыма (Чёрное море) // Там же. Т. 59. № 6. С. 651−656. https://doi.org/10.1134/S0042875219060067
Павлов Д.А. 2006. Метод оценки качества спермы рыб // Там же. Т. 46. № 3. С. 384–392.
Павлов Д.А., Емельянова Н.Г. 2007. Особенности биологии размножения двух видов тропических рыб семейства Scorpaenidae // Там же. Т. 47. № 3. С. 347–360.
Павлов Д.А., Емельянова Н.Г. 2013. Переход к живорождению в отряде Scorpaeniformes: краткий обзор // Там же. Т. 53. № 1. С. 69–86. https://doi.org/10.7868/S0042875213010116
Павлов Д.А., Емельянова Н.Г. 2018. Сравнительный анализ морфологии сперматозоидов у трёх видов рыб подотряда Scorpaenoidei // Там же. Т. 58. № 2. С. 201–214. https://doi.org/10.7868/S0042875218020091
Павлов Д.А., Емельянова Н.Г. 2019. Биологическая характеристика Dendrochirus zebra (Cuvier, 1829) (Scorpaeniformes: Scorpaenidae) из залива Нячанг Южно-Китайского моря // Биология моря. Т. 45. № 2. С. 75–85. https://doi.org/10.1134/S0134347519020104
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.: Сов. наука, 467 с.
Уикли Б. 1975. Электронная микроскопия для начинающих. М.: Мир, 324 с.
Черняев Ж.А. 1979. Размножение и развитие большеголовой широколобки Batrachocottus baicalensis (Dyb.) оз. Байкал // Вопр. ихтиологии. Т. 19. Вып. 6 (119). С. 1053–1067.
Allen G.R., Erdmann M.V. 2012. Reef fishes of the East Indies. V. I–III. Tropical Reef Research. Perth, Australia: Univ. Hawaii Press, 1260 p.
Burns J.R., Weitzman S.H. 2005. Insemination in ostariophysan fishes // Viviparous fishes / Eds. Uribe M.C., Grier H.J. Homestead, Florida: New Life Publ. P. 107–134.
Cosson J., Groison A.L., Suquet M. et al. 2008. Studying sperm motility in marine fish: an overview on the state of the art // J. Appl. Ichthyol. V. 24. № 4. P. 460–486. https://doi.org/10.1111/j.1439-0426.2008.01151.x
Edwards M.A., Frazer T.K., Jacoby C.A. 2014. Age and growth of invasive lionfish (Pterois spp.) in the Caribbean Sea, with implications for management // Bull. Mar. Sci. V. 90. № 4. P. 953–966. https://doi.org/10.5343/bms.2014.1022
Fishelson L. 1978. Oogenesis and spawn-formation in the pigmy lion fish Dendrochirus brachypterus (Pteroidae) // Mar. Biol. V. 46. P. 341–348.
Frehlick L.J., Eirín-López J.M., Prado A. et al. 2006. Sperm nuclear basic proteins of two closely related species of Scorpaeniform fish (Sebastes maliger, Sebastolobus sp.) with different sexual reproduction and the evolution of fish protamines // J. Exp. Zool. V. 305A. P. 277–287.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2020. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp. Version 01/ 2020)
Froese R., Pauly D. (eds.). 2019. FishBase. (http://www. fishbase.org. Version 08/2019)
Jamieson B.G.M. 1991. Fish evolution and systematics: evidence from spermatozoa. Cambridge, UK: Cambr. Univ. Press, 319 p.
Koya Y., Muñoz M. 2007. Comparative study on ovarian structures in scorpaenids: possible evolutional process of reproductive mode // Ichthyol. Res. V. 54. P. 221–230. https://doi.org/10.1007/s10228-006-0394-7
Kuiter R.H., Tonozuka T. 2001. Pictorial guide to Indonesian reef fishes. Pt. 1. Eels–Snappers, Muraenidae–Lutjanidae. Zoonetics, Australia. Perth, Australia: Universitiy of Hawai'i Press, 302 p.
Kwik J.T.B. 2011. The biology and ecology of small tropical scorpaenoids inhabiting shallow coastal habitats in Singapore: Ph. D. Thesis. Singapore: Nat. Univ. Singapore, 219 p. (http://scholarbank.nus.sg/handle/10635/31654)
Lahnsteiner F., Berger B., Weismann T., Patzner R.A. 1996. Motility of spermatozoa of Alburnus alburnus (Cyprinidae) and its relationship to seminal plasma composition and sperm metabolism // Fish Physiol. Biochem. V. 15. P. 167–179.
Lenarz W.H., Wyllie Echeverria T. 1991. Sexual dimorphism in Sebastes // Environ. Biol. Fish. V. 30. № 1–2. P. 71–80.
Love M.S., Yoklavich M., Thorsteinson L. 2002. The rock-fishes of the Northeast Pacific. Berkeley: Univ. Calif. Press, 406 p.
Mattei X. 1991. Spermatozoon ultrastructure and its systematic implication in fishes // Can. J. Zool. V. 69. № 12. P. 3038–3055. https://doi.org/10.1139/z91-428
Morris J.A. Jr., Sullivan C.V., Govoni J.J. 2011. Oogenesis and spawn formation in the invasive lionfish, Pterois miles and Pterois volitans // Sci. Mar. V. 75. № 1. P. 147–154. https://doi.org/10.3989/scimar.2011.75n1147
Muñoz M. 2010. Reproduction in Scorpaeniformes // Reproduction and sexuality in marine fishes: patterns and processes / Ed. Cole K.S. Berkeley, Los Angeles: Univ. Calif. Press. P. 65–87.
Muñoz M., Casadevall M., Bonet S. 2002a. The ovarian morphology of Scorpaena notata shows a specialized mode of oviparity // J. Fish Biol. V. 61. № 4. P. 877–887. https://doi.org/10.1111/j.1095-8649.2002.tb01849.x
Muñoz M., Casadevall M., Bonet S. 2002b. Testicular structure and semicystic spermatogenesis in a specialized ovuliparous species: Scorpaena notata (Pisces, Scorpaenidae) // Acta Zool. V. 83. № 3. P. 213–219. https://doi.org/10.1046/j.1463-6395.2002.00114.x
Myers R.F. 1999. Micronesian reef fishes: a comprehensive guide to the coral reef fishes of Micronesia. Barrigada, Guam: Coral Graphics, 522 p.
Pavlov D.A., Emel’yanova N.G. 2010. Reproductive biology of species from the family Scorpaenidae and transition from oviparity to viviparity in the southern and northern Percomorpha // Viviparous Fishes II / Eds. Uribe M.C., Grier H.J. Homestead, Florida: New Life Publ. P. 89–105.
Randall J.E., Eschmeyer W.N. 2001. Revision of the Indo-Pacific scorpionfish genus Scopaenopsis, with descriptions of eight new species // Indo-Pac. Fish. № 34. 79 p.
Sàbat M., Lo Nostro F., Casadevall M., Muñoz M. 2009. A light and electron microscopic study on the organization of the testis and the semicystic spermatogenesis of the genus Scorpaena (Teleostei, Scorpaenidae) // J. Morphol. V. 270. № 6. P. 662–672. https://doi.org/10.1002/jmor.10707
Santhanam R. 2019. Biology and ecology of venomous marine scorpionfishes. London: Acad. Press, 312 p.
Smith W.L., Wheeler W.C. 2004. Polyphyly of the mail-cheeked fishes (Teleostei: Scorpaeniformes): evidence from mitochondrial and nuclear sequence data // Mol. Phylogen. Evol. V. 32. № 2. P. 627–646. https://doi.org/10.1016/j.ympev.2004.02.006
Smith W.L., Everman E., Richardson C. 2018. Phylogeny and taxonomy of flatheads, scorpionfishes, sea robins, and stonefishes (Percomorpha: Scorpaeniformes) and the evolution of the lachrymal saber // Copeia. V. 106. № 1. P. 94–119. https://doi.org/10.1643/CG-17-669
Sparks J.S., Schelly R.C., Smith W. et al. 2014. The covert world of fish biofluorescence: a phylogenetically widespread and phenotypically variable phenomenon // PLoS One. V. 9. № 1. Article e83259. https://doi.org/10.1371/journal.pone.0083259
Vila S., Munoz M., Sabat M., Casadevall M. 2007. Annual cycle of stored spermatozoa within the ovaries of Helicolenus dactylopterus dactylopterus (Teleostei, Scorpaenidae) // J. Fish Biol. V. 71. № 2. P. 596–609. https://doi.org/10.1111/j.1095-8649.2007.01525.x
Vila S., Sàbat M., Muñoz M., Casadevall M. 2010. Spermiogenesis particularities of a sperm storage species: Helicolenus dactylopterus (Teleostei: Scorpaenidae) // Sci. Mar. V. 74. № 4. P. 687–704. https://doi.org/10.3989/scimar.2010.74n4697
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


