Вопросы ихтиологии, 2021, T. 61, № 1, стр. 20-34
Морфология отолитов и родственные отношения некоторых видов рыб подотряда Scorpaenoidei
Д. А. Павлов *
Московский государственный университет
Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 16.01.2020
После доработки 21.01.2020
Принята к публикации 21.01.2020
Аннотация
Описана морфология сагитты шести видов тропических рыб, относящихся к разным родам подотряда Scorpaenoidei: Synanceia horrida, Inimicus sinensis, Parascorpaena picta, Sebastapistes cyanostigma, Scorpaenopsis papuensis, Dendrochirus zebra. По форме отолитов (6 индексов, эллиптический анализ Фурье) S. horrida сближается с Sc. papuensis, а I. sinensis – с D. zebra. Сравнение формы отолитов P. picta, D. zebra и трёх видов семейства Sebastidae (Helicolenus dactylopterus, Sebastes semicinctus, S. hopkinsi) с использованием эллиптического анализа Фурье и метода главных компонент показало, что кластеры H. dactylopterus и S. semicinctus частично перекрываются с кластером D. zebra, а кластер S. hopkinsi – с кластером P. picta. Данные по форме отолитов не соответствуют существующим филогенетическим схемам, в чём проявляется относительная независимость эволюции внутреннего уха.
Три пары отолитов в виде отдельных структур – уникальные образования костных рыб, участвующие в оценке перемещения тела в пространстве и в восприятии звука (Popper et al., 2005; Lundberg et al., 2015). Отолиты являются фенотипическими маркерами, включающими информацию о генотипе особи и её специфических взаимоотношениях со средой. Морфология отолитов костистых рыб широко используется в палеонтологии, причём некоторые вымершие виды описаны исключительно по отолитам на основе сравнения с отолитами близких форм ныне живущих рыб (Schulz-Mirbach, Reichenbacher, 2006; Schwarzhans et al., 2017). В последнее время структура отолитов и в особенности их форма широко используются для дифференциации видов (Karahan et al., 2014; Павлов, 2016; Zhang et al., 2017; Tao He et al., 2018) и популяций (Campana, Casselman, 1993; Mérigot et al., 2007; Legua et al., 2013; Мазникова и др., 2017; Павлов, 2018) преимущественно морских рыб. Работы по идентификации групп более высокого таксономического ранга по отолитам немногочисленны. В частности, на основе морфологии отолитов проведён анализ положения отряда Myctophiformes в связи с эволюцией Acanthopterygii и Paracanthopterygii (Schwarzhans, 1978). По структуре сагитты, в особенности сулкуса (sulcus acusticus), семейство Cichlidae является монофилетической группой и чётко обособлено от семейств Labridae, Embiotocidae, Pomacentridae и Centrarchidae (Gaemers, 1984). Морфология отолитов костистых рыб специфична на уровне многих семейств (Lin, Chang, 2012). Тем не менее во многих группах рыб наблюдается конвергенция в структуре отолитов, и эта структура может быть настолько редуцирована, что плезиоморфные признаки не прослеживаются (Schwarzhans, 1978, 2013, 2014; Tuset et al., 2016a). В ряде работ отмечена сильная корреляция формы и размера отолитов с особенностями биотопов, трофической нишей и глубиной обитания вне зависимости от таксономического положения видов (Volpedo, Echeverría, 2003; Lombarte, Cruz, 2007; Volpedo et al., 2008; Jaramillo et al., 2014). При исследовании нототениевых рыб (Nototheniidae) Антарктики и Субантарктики обнаружена слабая связь между формой сагитты и положением вида на филогенетической схеме, но выявлена чёткая зависимость между относительным размером и формой отолита и трофической нишей (Lombarte et al., 2010). Дальнейшие исследования морфологии отолитов в отдельных группах рыб позволят лучше понять связь между эволюцией и формированием адаптаций к специфическим биотопам.
До недавнего времени взаимоотношения видов в подотряде Scorpaenoidei оставались наименее понятными среди других подотрядов Scorpaeniformes (Smith, Wheeler, 2004). Подотряд включает около 500 видов, распространённых преимущественно в Индо-Пацифике (Fricke et al., 2020). Эти виды существенно различаются как по форме тела, так и по морфологии отолитов. Например, в атласе отолитов рыб Тайваня у представителей подотряда (рассматриваемого в ранге семейства Scorpaenidae) выделено семь морфотипов сагитт (Lin, Chang, 2012). В соответствии с последней филогенетической схемой, построенной на основании кладистического анализа большого числа морфологических и молекулярных признаков, Scorpaenoidei включают две наиболее крупные клады: Synanceiidae и Scorpaenidae (рис. 1). В последнюю кладу входят семейства Scorpaenidae и Sebastidae, состав которых принят в современной систематике (Fricke et al., 2020). Следует отметить, что морфология отолитов скорпеновидных рыб в сравнительном плане остаётся мало исследованной, за исключением многочисленных работ по идентификации и филогенетическим взаимоотношениям видов рода Sebastes (Stransky, MacLellan, 2005; Tuset et al., 2015, 2016b; Zhuang et al., 2015; Афанасьев и др., 2017). В базе данных AFORO (Automated Taxon Identification of Teleost fishes using an otolith online database) (Lombarte et al., 2006) иллюстрации отолитов большинства видов отсутствуют, причём наибольшее число изображений приведено для представителей рода Sebastes.
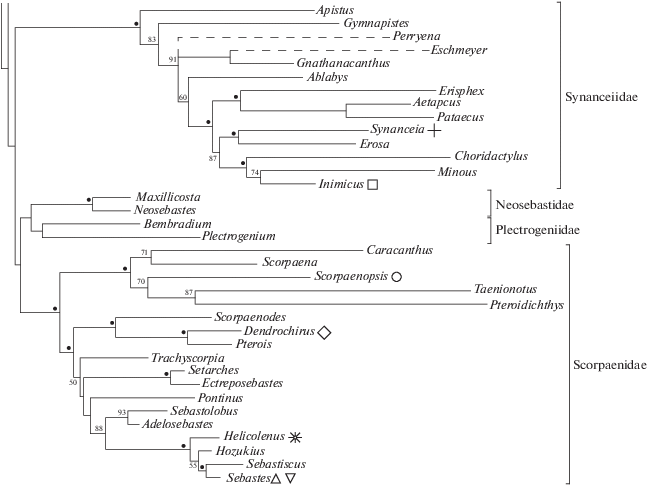
Рис. 1.
Часть оптимальной кладограммы подотряда Scorpaenoidei на основе вероятностного анализа базы данных, включающей 113 фенотипических и 5280 нуклеотидных признаков (Smith et al., 2018). Сохранены клады, имеющие бутстреп-поддержку ≥50%; указаны их бутстреп-оценки; (⚫) – узлы с бутстреп-поддержкой ≥ 95%; (– –) – ветви на основе только морфологических данных, которые не вошли в бутстреп-анализ; справа – классификация на уровне семейств (по: Smith et al., 2018). Отмечены роды, включающие виды, которые анализируются в нашей статье: (+) – Synanceia horrida, (◻) – Inimicus sinensis, (⚪) – Scorpaenopsis papuensis, (◇) – Dendrochirus zebra, (∗) – Helicolenus dactylopterus, (△) – Sebastes semicinctus, (▽) – S. hopkinsi.
Цель настоящей работы – описать морфологию отолитов шести тропических видов скорпеновидных рыб, относящихся к разным родам семейств Synanceiidae и Scorpaenidae, и установить, соответствует ли строение отолитов существующим филогенетическим схемам. Для сравнения проведён анализ изображений отолитов у трёх видов рыб из семейства Sebastidae.
МАТЕРИАЛ И МЕТОДИКА
Представители шести родов рыб подотряда Scorpaenoidei отловлены местными рыбаками в зал. Нячанг (Южно-Китайское море) в 2012–2016 гг. Для определения рыб использовали преимущественно определитель ФАО (Carpenter, Niem, 1999). Исследованные виды рыб и их таксономическое положение в соответствии с традиционными представлениями (Fricke et al., 2020) приведены в табл. 1. Биологический анализ проведён на свежих экземплярах на базе Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра (Нячанг, Вьетнам). Подавляющее большинство рыб были половозрелыми с гонадами III, IV, IV–V и V стадий зрелости. Лишь среди особей Dendrochirus zebra доля неполовозрелых рыб была значительной: 43% самок и 28% самцов. Самцы данного вида созревают по достижении полной длины (TL) свыше 106 мм, а 50% самок достигают половой зрелости при TL 113 мм (Павлов, Емельянова, 2019).
Таблица 1.
Длина тела (TL, мм) шести исследованных и трёх привлечённых для сравнительного анализа видов подотряда Scorpaenoidei
| Семейство | Подсемейство | Вид | Самки | Самцы | Оба пола |
|---|---|---|---|---|---|
| Synanceiidae | Synanceiinae | Synanceia horrida | $\frac{{140{\kern 1pt} --{\kern 1pt} 151}}{{145\,\,\left( 3 \right)}}$ | $\frac{{148{\kern 1pt} --{\kern 1pt} 189}}{{166\,\,\left( 6 \right)}}$ | |
| Choridactylinae | Inimicus sinensis | $\frac{{120{\kern 1pt} --{\kern 1pt} 230}}{{177\,\,\left( 8 \right)}}$ | $\frac{{158{\kern 1pt} --{\kern 1pt} 183}}{{171\,\,\left( 2 \right)}}$ | ||
| Scorpaenidae | Scorpaeninae | Parascorpaena picta | $\frac{{90{\kern 1pt} --{\kern 1pt} 121}}{{108\,\,\left( {11} \right)}}$ | $\frac{{92{\kern 1pt} --{\kern 1pt} 141}}{{122\,\,(21)}}$ | |
| Sebastapistes cyanostigma | $\frac{{55{\kern 1pt} --{\kern 1pt} 70}}{{64\,\,\left( {19} \right)}}$ | $\frac{{61{\kern 1pt} --{\kern 1pt} 84}}{{76\,\,\left( {15} \right)}}$ | |||
| Scorpaenopsis papuensis | $\frac{{116{\kern 1pt} --{\kern 1pt} 143}}{{131\,\,\left( 4 \right)}}$ | $\frac{{134{\kern 1pt} --{\kern 1pt} 190}}{{162\,\,\left( 5 \right)}}$ | |||
| Pteroinae | Dendrochirus zebra | $\frac{{80{\kern 1pt} --{\kern 1pt} 155}}{{119\,\,\left( {47} \right)}}$ | $\frac{{94{\kern 1pt} --{\kern 1pt} 173}}{{141\,\,\left( {25} \right)}}$ | ||
| Sebastidae* | Sebastinae | Helicolenus dactylopterus | $\frac{{85{\kern 1pt} - {\kern 1pt} 190}}{{140\,\,\left( {10} \right)}}$ | ||
| Sebastes semicinctus | $\frac{{152{\kern 1pt} - {\kern 1pt} 200}}{{182\,\,\left( 9 \right)}}$ | ||||
| Sebastes hopkinsi | $\frac{{147{\kern 1pt} - {\kern 1pt} 243}}{{214\,\,\left( {10} \right)}}$ |
Отолиты (сагитты) извлекали с обеих сторон головы каждой особи и помещали в пробирки (эпендорфы) с 95%-ным этанолом. После выдерживания отолитов в 10%-ном растворе гипохлорита натрия в течение 10 мин (Secor et al., 1991) под бинокулярным микроскопом отделяли окружающие ткани. Отолиты ориентировали в положении рострумом влево и sulcus acusticus вверх и фотографировали под бинокулярным микроскопом Leica MZ6, соединённым с цифровой камерой Leica DFC295 и компьютером. С целью выявления морфологических структур на поверхности отолита использовали падающий свет, направленный сбоку. Для анализа формы отолитов получали их контрастные изображения в проходящем свете с помощью программ Leica DFC Twain 7.7.1 и XnView 2.12. В программе ImageJ после автоматического поиска порога оттенков серого (Image – Adjust – Threshold) и использования инструмента Wand (tracing) tool получали изображение белого отолита на чёрном фоне, которое конвертировали в файл RGB (24-bit) bmp для последующей обработки.
При описании морфологии отолитов использовали терминологию, применяемую в ряде работ (Schwarzhans, 1978; Gaemers, 1984; Lin, Chang, 2012). Измеряли следующие параметры отолита: максимальную длину вдоль переднезадней оси (L, мм), ширину вдоль дорсовентральной оси (l, мм), периметр (P, мм) и площадь (A, мм2). Относительную длину отолита определяли по формуле L/TL, а относительную площадь (RA) по формуле RA = = 1000 × A × TL–2 (Lombarte, Cruz, 2007). Для сравнения формы отолитов рассчитывали следующие индексы: отношение длины к ширине (L/l), отношение квадрата периметра к площади (P/A = = P2/A), фактор формы (FF = 4πA/P2), округлость (RO = 4A/πL2), прямоугольность (RE = A/(L × l)), эллиптичность (EL = (L – l)/(L + l)). Биологический смысл этих индексов изложен в предыдущей статье (Павлов, 2016).
Для интегрального сравнения контуров отолитов использовали эллиптический анализ Фурье и пакет SHAPE 1.3 (Iwata, Ukai, 2002). Для получения стандартных изображений левого и правого отолитов (bmp-файлы) использовали зеркальное изображение левого отолита в программе Photoshop. Контур отолита описывается несколькими гармониками, каждая из которых характеризуется четырьмя коэффициентами (дескрипторами Фурье). Чем больше число гармоник, тем более точно описывается контур (Kuhl, Giardina, 1982). Для определения необходимого и достаточного числа гармоник в программе PAST 2.17 (Hammer et al., 2001) последовательно уменьшали число гармоник и анализировали распределение кластеров разных видов в пространстве главных компонент. Это распределение не менялось при уменьшении числа гармоник от 20 до 6. Три первых коэффициента первой гармоники не использованы для анализа, поскольку они являются константами и применяются для нормализации остальных гармоник, но четвёртый коэффициент включён в модель. Таким образом, число дескрипторов Фурье, описывающих контур каждого отолита, составило 21.
Помимо шести исследованных видов с использованием эллиптического анализа Фурье проведён сравнительный анализ формы отолитов у трёх видов семейства Sebastidae из клады Scorpaenidae (рис. 1; табл. 1): Helicolenus dactylopterus, Sebastes semicinctus, S. hopkinsi. Изображения их отолитов взяты из базы данных AFORO (Lombarte et al., 2006). Эти виды выбраны в связи с тем, что форма их отолитов значительно различается, а длина тела близка к таковой у шести исследованных видов.
Эллиптический анализ Фурье предусматривает описание контура, которое не зависит от его ориентации, размера и начальной точки отсчёта. Тем не менее как индексы формы отолита, так и дескрипторы Фурье могут зависеть от TL, отражая аллометрическое изменение формы сагитты в онтогенезе. В связи с тем что в данной работе использованы виды, относящиеся к разным родам, характеризующиеся разным характером аллометрических зависимостей и существенно не различающиеся по длине тела (за исключением особей S. cyanostigma наименьшего размера), коррекцию показателей по размеру не проводили.
Для оценки наличия направленной билатеральной асимметрии сагитты анализировали разность (со знаком) между параметрами правого и левого отолита (Palmer, 1994) и оценивали её статистическое отличие от нуля, используя одновыборочный t-критерий Стьюдента. Для сравнения абсолютных параметров отолитов и индексов формы у самок и самцов в пределах группы, а также между группами после оценки нормальности распределения значений (тест Д’Агостино−Пирсона) использовали параметрические (критерий Стьюдента; однофакторный дисперсионный анализ ANOVA, критерий Тьюки) или непараметрические (критерий Манна–Уитни) тесты.
РЕЗУЛЬТАТЫ
Особенности морфологии отолитов
У исследованных видов медиальная сторона сагитты выпуклая, латеральная – вогнутая. Сулкус (sulcus acusticus) медиальный (расположен посередине между дорсальным и вентральным краем отолита) и открыт спереди (имеется excisura), в связи с чем его можно отнести к остилярному типу (ostial sulcus). Вместе с тем сулкус нечётко обособлен от заднего края отолита. Поэтому он имеет признаки биостилярного типа (biostial sulcus). В сулкусе выделяются передняя (остиум) и задняя (кауда) части, причём кауда шире остиума.
Synanceia horrida (рис. 2а). Отолит удлинённый, его дорсальный край почти параллелен вентральному. Рострум хорошо выражен, его длина составляет ≈0.2 длины отолита, антирострум (небольшой выступ в передней дорсальной части) слабо выражен или отсутствует. Дорсальный край сагитты слегка закруглён, наибольшей высоты отолит достигает в его средней части или в задней трети. Дорсальный край с 10–13 лопастями разной ширины, лопасти отделены неглубокими выемками. Лопасти (2–7), часто неправильной формы, разного размера и отделённые глубокими выемками, имеются и в задней части отолита. Вентральный край сагитты закруглён преимущественно в передней части; имеет мелкие заострённые лопасти разной ширины, выраженные главным образом в передней половине отолита. Сулкус широко открывается в передней части отолита. Граница между остиумом и каудой находится в передней половине отолита и хорошо заметна по сужению сулкуса (neck) вследствие резкого изгиба вентрального края сулкуса (crista inferior) в дорсальном направлении.
Рис. 2.
Отолиты представителей подотряда Scorpaenoidei (правая сагитта, медиальная сторона): а – Synanceia horrida, самец, TL 189 мм, V стадия зрелости гонад; б – Inimicus sinensis, самец TL 158 мм, IV; в – Parascorpaena picta, самка, TL 110 мм, III; г – Sebastapistes cyanostigma, самец, TL 81 мм, V; д – Scorpaenopsis papuensis, самец TL 190 мм, V; е – Dendrochirus zebra, самка, TL 113 мм, IV; a, p, d, v – соответственно передняя, задняя, дорсальная и вентральная стороны. Масштаб: 1 мм.
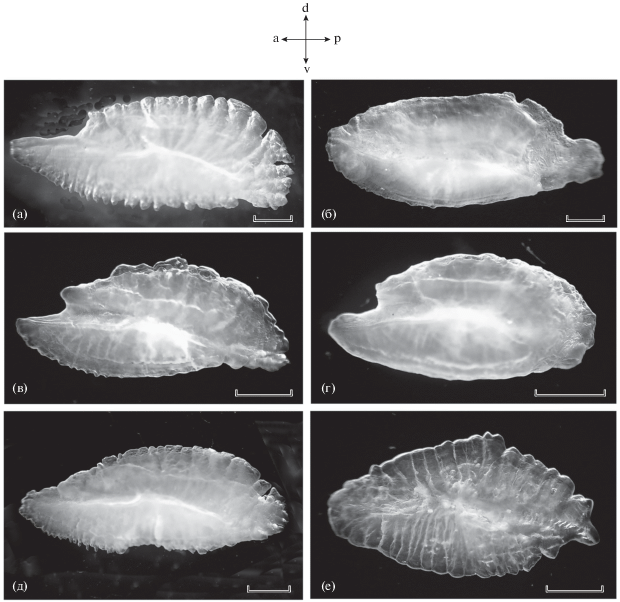
Inimicus sinensis (рис. 2б). Отолит имеет овальную форму, сравнительно высокий; его высота достигает максимума на границе передней трети длины отолита. Рострум слегка заострён или закруглён и слабо выражен, антирострум отсутствует. Дорсальный край отолита выпуклый с несколькими неясно выраженными лопастями или без лопастей. Вентральный край отолита ровный или слабо выпуклый, слегка волнистый. Задний край отолита часто слегка выступает, а его форма сильно варьирует: от равномерно закруглённой до выемчатой с двумя или тремя лопастями. Граница между остиумом и каудой выражена нечётко и находится в передней половине отолита.
Parascorpaena picta (рис. 2в). Отолит умеренно удлинённый, его высота наибольшая в средней части. Рострум хорошо выражен, его длина составляет ≈0.2 длины отолита. Имеется антирострум, который слегка выдаётся вперёд в передней дорсальной части отолита. В некоторых отолитах антирострум не выражен. Дорсальный закруглённый край имеет 7–14 лопастей разной ширины, в большинстве отолитов границы лопастей не отделены глубокими выемками (край отолита слабо волнистый); лопасти переходят на заднюю часть отолита, достигая верхнего края сулкуса (crista superior). Вентральный край слегка закруглён, волнистый, имеет до 18 неясно выраженных лопастей. Структура задней части отолита сильно варьирует: от тупо закруглённой до сложной с несколькими лопастями, отделёнными глубокими выемками. Граница между остиумом и каудой находится в передней половине отолита и заметна по сужению сулкуса в области изгиба crista inferior в дорсальном направлении.
Sebastapistes cyanostigma (рис. 2г). Отолит сравнительно высокий с хорошо выраженным рострумом; длина рострума составляет 0.1–0.2 длины отолита. Антирострум имеется лишь в единичных отолитах. Дорсальный край наиболее выпуклый в средней части отолита, слегка волнистый с неясно выраженными крупными лопастями. Вентральный край почти ровный или слегка выпуклый в средней части отолита, может иметь небольшие волнообразные выступы. Задний край тупо закруглённый, иногда с небольшими выступами. Граница между остиумом и каудой выражена нечётко и находится в средней части отолита.
Scorpaenopsis papuensis (рис. 2д). Отолит удлинённый, его дорсальный край слегка выпуклый в средней части, вентральный край почти прямой, незначительно закруглён или имеет небольшую выемку в средней части. Рострум хорошо выражен, его длина составляет 0.12–0.24 длины отолита, антирострум отсутствует или имеется в некоторых отолитах в виде небольшого дорсального выступа. Дорсальный край с 12–20 лопастями разной ширины, лопасти отделены неглубокими выемками, лопасти продолжаются до crista inferior. В вентральном крае число лопастей больше, чем в дорсальном, они более мелкие и в передних частях большинства отолитов имеют заострённые вершины; лопасти продолжаются до crista inferior. В задней части отолита могут быть глубокие выемки, отделяющие 2–6 лопастей разного размера. Сулкус глубокий, его границы хорошо заметны. Граница между остиумом и каудой находится в средней части отолита.
Dendrochirus zebra (рис. 2е). Отолит является более прозрачным по сравнению с описанными выше отолитами других видов, что, по-видимому, связано с относительно меньшим содержанием органического матрикса. Отолит сравнительно высокий, имеет форму трапецоида, высота достигает максимума позади половины длины отолита. Передняя часть отолита закруглённая, рострум обычно отсутствует, антирострум не выражен. Края отолита волнистые, без глубоких вырезок. Дорсальный край отолита выпуклый с 5–15 дорсальными лопастями, но лопасти могут быть не выражены. Лопасти могут достигать crista inferior. Вентральный край отолита выпуклый в меньшей степени, чем дорсальный. Число лопастей в вентральном крае несколько больше, чем в дорсальном. Задний край отолита тупо закруглён, без глубоких выемок. Граница между остиумом и каудой выражена нечётко и находится в средней части отолита.
Параметры отолитов
Перед сравнением относительной длины и относительной площади отолитов исследованных видов оценивали наличие направленной билатеральной асимметрии и полового диморфизма по четырём параметрам (L, l, P, A).
Билатеральная асимметрия. Статистически значимая направленная билатеральная асимметрия отмечена у S. horrida (A: p = 0.006) и Sc. papuensis (P: p = 0.033). Наличие направленной асимметрии, очевидно, обусловлено небольшим числом особей в выборках этих видов (n = 9). У остальных четырёх видов значимые различия между параметрами левых и правых отолитов отсутствуют.
Половой диморфизм. Параметры правых отолитов самок и самцов статистически значимо не различаются у S. horrida (критерий Манна−Уитни), I. sinensis и Sc. papuensis (t-критерий Стьюдента). У самок P. picta площадь отолитов значимо меньше, чем у самцов (в среднем 8.3 против 9.9 мм2, p = 0.032). У двух видов (S. cyanostigma и D. zebra) значения четырёх параметров отолитов значимо меньше у самок, чем у самцов (t-критерий Стьюдента, p соответственно <0.001 и <0.05). Так, у самок и самцов S. cyanostigma средние значения L, l, P, A составляют соответственно 3.1 и 3.5 мм, 1.7 и 1.9 мм, 8.4 и 9.5 мм, 3.7 и 4.8 мм2; у самок и самцов D. zebra − 4.9 и 5.4 мм, 2.4 и 2.6 мм, 12.8 и 14.2 мм, 8.2 и 9.7 мм2. Эти различия отражают половой диморфизм по длине тела рыб (табл. 1). В связи со значительной вариабельностью размера особей D. zebra проведено сравнение прямолинейных зависимостей: параметр правого отолита–длина (TL) самок и самцов. Половые различия не обнаружены как по наклону прямых, так и по интерсептам (критерий Фишера, p > 0.05). Несмотря на наличие полового диморфизма по параметрам отолитов у трёх из шести видов, для последующего межвидового сравнения показатели самок и самцов объединены (табл. 2).
Таблица 2.
Морфологические параметры правых отолитов шести видов подотряда Scorpaenoidei
| Вид | Длина (L), мм | Ширина (l), мм | Периметр (P), мм | Площадь (A), мм2 |
|---|---|---|---|---|
| Synanceia horrida | $\frac{{6.4{\kern 1pt} --{\kern 1pt} 8.5}}{{7.0\,\,\left( {0.7} \right)}}$ | $\frac{{2.4{\kern 1pt} --{\kern 1pt} 3.2}}{{2.8\,\,\left( {0.3} \right)}}$ | $\frac{{18.5{\kern 1pt} --{\kern 1pt} 27.5}}{{20.9\,\,\left( {3.2} \right)}}$ | $\frac{{11.4{\kern 1pt} --{\kern 1pt} 18.5}}{{13.6\,\,\left( {2.7} \right)}}$ |
| Inimicus sinensis | $\frac{{4.6{\kern 1pt} --{\kern 1pt} 7.5}}{{6.3\,\,\left( {1.1} \right)}}$ | $\frac{{2.3{\kern 1pt} --{\kern 1pt} 3.8}}{{3.1\,\,\left( {0.6} \right)}}$ | $\frac{{11.7{\kern 1pt} --{\kern 1pt} 20.8}}{{16.9\,\,\left( {3.3} \right)}}$ | $\frac{{7.3{\kern 1pt} --{\kern 1pt} 20.2}}{{14.6\,\,\left( {5.0} \right)}}$ |
| Parascorpaena picta | $\frac{{4.3{\kern 1pt} --{\kern 1pt} 6.6}}{{5.5\,\,\left( {0.6} \right)}}$ | $\frac{{1.7{\kern 1pt} --{\kern 1pt} 3.0}}{{2.4\,\,\left( {0.3} \right)}}$ | $\frac{{11.2{\kern 1pt} --{\kern 1pt} 20.1}}{{15.6\,\,\left( {2.5} \right)}}$ | $\frac{{5.5{\kern 1pt} --{\kern 1pt} 13.1}}{{9.3\,\,\left( {2.0} \right)}}$ |
| Sebastapistes cyanostigma | $\frac{{2.7{\kern 1pt} --{\kern 1pt} 4.0}}{{3.3\,\,\left( {0.3} \right)}}$ | $\frac{{1.4{\kern 1pt} --{\kern 1pt} 2.1}}{{1.7\,\,\left( {0.2} \right)}}$ | $\frac{{7.2{\kern 1pt} --{\kern 1pt} 10.8}}{{8.9\,\,\left( {0.9} \right)}}$ | $\frac{{2.9{\kern 1pt} --{\kern 1pt} 6.1}}{{4.2\,\,\left( {0.8} \right)}}$ |
| Scorpaenopsis papuensis | $\frac{{5.2{\kern 1pt} --{\kern 1pt} 8.5}}{{6.4\,\,\left( {1.0} \right)}}$ | $\frac{{2.2{\kern 1pt} --{\kern 1pt} 3.3}}{{2.6\,\,\left( {0.3} \right)}}$ | $\frac{{14.3{\kern 1pt} --{\kern 1pt} 29.1}}{{19.0\,\,\left( {4.3} \right)}}$ | $\frac{{8.7{\kern 1pt} --{\kern 1pt} 19.4}}{{11.8\,\,\left( {3.3} \right)}}$ |
| Dendrochirus zebra | $\frac{{3.3{\kern 1pt} --{\kern 1pt} 6.6}}{{5.1\,\,\left( {0.7} \right)}}$ | $\frac{{1.6{\kern 1pt} --{\kern 1pt} 3.2}}{{2.5\,\,\left( {0.3} \right)}}$ | $\frac{{8.3{\kern 1pt} --{\kern 1pt} 18.4}}{{13.1\,\,\left( {2.0} \right)}}$ | $\frac{{3.6{\kern 1pt} --{\kern 1pt} 13.6}}{{8.5\,\,\left( {2.2} \right)}}$ |
Относительный размер. Относительная длина сагитты (L/TL) является наименьшей у I. sinensis и D. zebra (рис. 3а), что отчасти связано со слабым развитием или полным отсутствием рострума. Различия по этому показателю между остальными видами не являются статистически значимыми (ANOVA, критерий Тьюки). Относительная площадь правой сагитты Sb. cyanostigma существенно превышает значения этого показателя у других видов, достигая в среднем 0.87 (рис. 3б). Относительная площадь отолитов S. horrida, I. sinensis, Sc. papuensis и D. zebra является наименьшей, а различия по этому показателю не являются значимыми (ANOVA, критерий Тьюки). Тем не менее при сравнении отолитов самца Sc. papuensis TL 163 мм (длина тела близка к средней для вида) и самца D. zebra TL 169 мм (длина тела близка к максимальной для вида) как абсолютный, так и относительный размер отолитов второго вида был существенно меньше (рис. 4): L − 7.0 против 5.4 мм, l − 2.6 и 2.6 мм, A − 12.3 против 9.6 мм2, L/TL − 0.04 против 0.03, RA − 0.46 против 0.34.
Рис. 3.
Параметры правой сагитты у шести видов подотряда Scorpaenoidei: а − относительная длина (L/TL), б − относительная площадь (RA); 1 – Synanceia horrida, 2 – Inimicus sinensis, 3 – Parascorpaena picta, 4 – Sebastapistes cyanostigma, 5 – Scorpaenopsis papuensis, 6 – Dendrochirus zebra. Каждый бокс включает пять горизонтальных линий, которые обозначают 10, 25, 50 (медиана), 75 и 90% данных (от 25 до 75% данных заключены в прямоугольник); (⚫) − значения за пределами 10 и 90% данных. А, В, С − при отсутствии статистически значимых различий между видами боксы обозначены одинаковыми буквами.
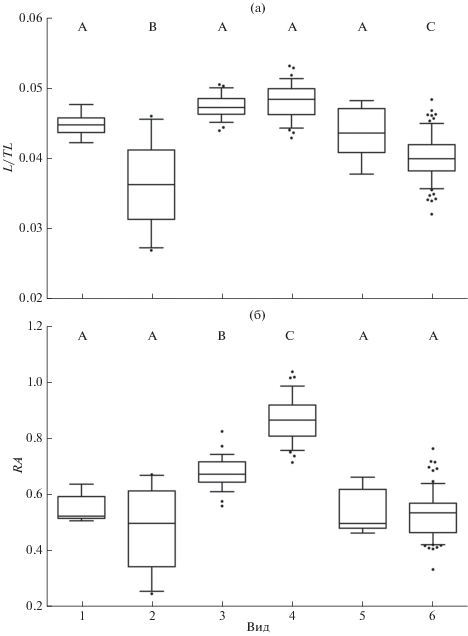
Рис. 4.
Левая сагитта (вид сверху): а − Scorpaenopsis papuensis, самец TL 163 мм, V стадия зрелости гонад; б − Dendrochirus zebra, самец TL 169 мм, IV–V; m, lt – медиальная и латеральная стороны; ост. обозначения см. на рис. 2. Масштаб: 1 мм.

Форма отолитов
Индексы формы. В связи с наибольшей изменчивостью длины особей D. zebra, у этого вида прослежена зависимость между значениями индексов формы правых отолитов и TL. Слабая значимая отрицательная регрессия наблюдается между FF и TL (R2 = 0.09, p = 0.014) и RE и TL (R2 = 0.07, p = 0.033), а значимая положительная – между P/A и TL (R2 = 0.09, p = 0.012). Регрессия между значениями остальных трёх индексов (L/l, RO, EL) и TL не является значимой (p > 0.13).
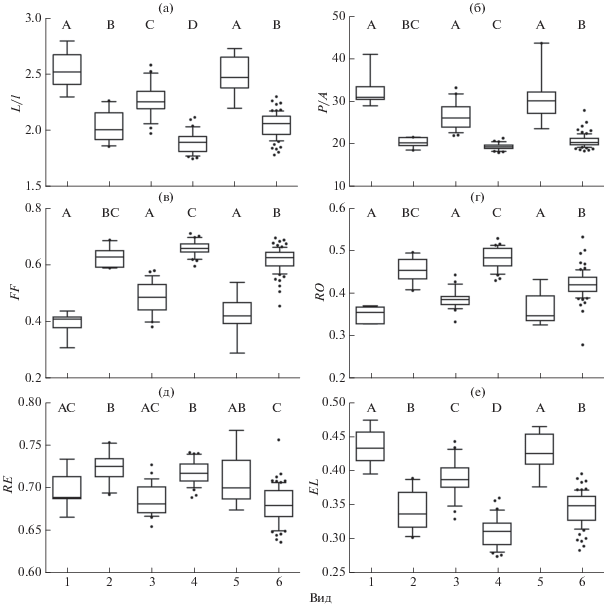
Сагитта S. horrida и Sc. papuensis наиболее вытянута в переднезаднем направлении, в связи с чем индекс L/l у этих видов наибольший; данный индекс является наименьшим у S. cyanostigma (рис. 5а). Эти виды, а также P. picta имеют наибольший индекс P/A (рис. 5б) и наименьшие индексы FF и RO (рис. 5в, 5г). По индексу RE чёткие различия между видами отсутствуют (рис. 5д), а индекс EL наибольший у S. horrida и Sc. papuensis и наименьший у S. cyanostigma (рис. 5е). Значительное сходство наблюдается между I. sinensis и D. zebra: эти виды значимо не различаются по пяти индексам за исключением RE (рис. 5).
Рис. 5.
Индексы формы правого отолита у шести видов подотряда Scorpaenoidei: а – отношение длины к ширине (L/l), б – отношение квадрата периметра к площади (P/A), в – фактор формы (FF), г – округлость (RO), д – прямоугольность (RE), е – эллиптичность (EL); обозначения см. на рис. 3.
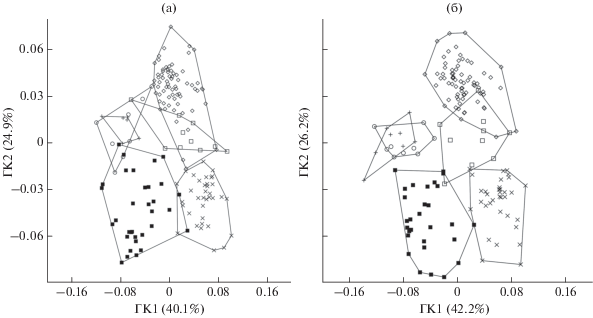
Эллиптический анализ Фурье. Анализ реконструированных контуров отолитов подтверждает сходство I. sinensis и D. zebra, не имеющих выраженного рострума, и обособление S. cyanostigma с самыми высокими отолитами (рис. 6). Распределение особей по форме отолитов на основе анализа коэффициентов Фурье в пространстве главных компонент свидетельствует, что форма отолитов наиболее близка у S. horrida и Sc. papuensis, а также у I. sinensis и D. zebra (рис. 7). Виды P. picta и S. cyanostigma обособлены как от других видов, так и друг от друга.
Рис. 6.
Реконструированные контуры правого отолита по результатам анализа коэффициентов Фурье методом главных компонент: а – Synanceia horrida, б – Inimicus sinensis, в – Parascorpaena picta, г – Sebastapistes cyanostigma, д – Scorpaenopsis papuensis, е – Dendrochirus zebra; 2σ – два средних квадратических отклонения, M – усреднённый контур; ориентация отолитов как на рис. 2.
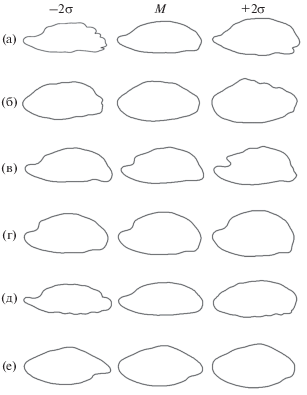
Рис. 7.
Распределение особей в выборках представителей подотряда Scorpaenoidei по форме отолитов на основе анализа коэффициентов Фурье в пространстве главных компонент (ГК1, 2): а – левые отолиты, б – правые отолиты; (◼) – Parascorpaena picta, (×) – Sebastapistes cyanostigma; ост. обозначения см. на рис. 1.
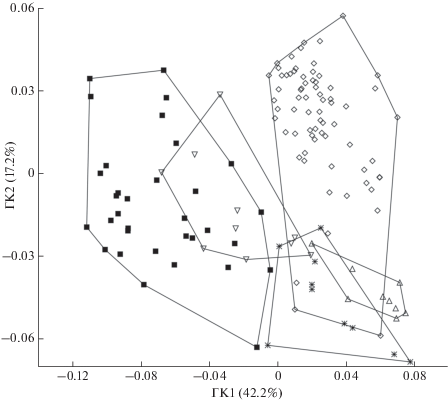
Сравнение формы отолитов некоторых видов клады Scorpaenidae (рис. 1) показало, что H. dactylopterus сближается с S. semicinctus, причём кластеры обоих видов частично перекрываются с кластером D. zebra (рис. 8). Кластер S. hopkinsi частично перекрывается с кластером P. picta: отолиты этих видов имеют сравнительно хорошо развитый рострум.
Рис. 8.
Распределение особей в выборках представителей подотряда Scorpaenoidei по форме левых отолитов на основе анализа коэффициентов Фурье в пространстве главных компонент (ГК1, 2); обозначения см. на рис. 1.
ОБСУЖДЕНИЕ
В данной статье описана морфология сагитты шести видов рыб, относящихся к шести разным родам подотряда Scorpaenoidei. Изображения отолитов двух из этих видов (P. picta и D. zebra) имеются в базе данных AFORO (Lombarte et al., 2006). В этой же базе приведены изображения отолитов рыб из родов Inimicus (I. japonicus), Scorpaenopsis (Sc. neglecta) и Sebastapistes (S. tinkhami). В целом форма отолитов близка к таковой, описанной в нашей работе, у видов из тех же родов (I. sinensis, Sc. papuensis и S. cyanostigma).
Наши данные по форме отолитов Scorpaenoidei не соответствуют существующим филогенетическим схемам и, в частности, одной из последних схем (рис. 1). Например, S. horrida и I. sinensis, входящие в одну большую кладу и монофилетическое семейство Synanceiidae (Smith et al., 2018), существенно различаются по форме отолитов и группируются соответственно с Sc. papuensis и D. zebra. Два последних вида входят в состав другой сестринской монофилетической клады (Scorpaenidae), включающей семейства Scorpaenidae и Sebastidae. Существенно различается и форма отолитов представителей родов Helicolenus и Sebastes, включённых по морфологическим и молекулярным данным в одну субкладу традиционного семейства Sebastidae (Ishida, 1994; Imamura, 2004; Smith, Wheeler, 2004; Smith, Craig, 2007; Lautredou et al., 2013; Smith et al., 2018). В частности, виды S. semicinctus и S. hopkinsi с альтернативной эллиптической (elliptic, morph III) и удлинённой (oblong, morph VI) формой отолитов (Tuset et al., 2015, 2016b) имеют сходство соответственно с P. picta (Scorpaenidae: Scorpaeninae) и D. zebra (Scorpaenidae: Pteroinae) (рис. 8).
На основе анализа базы данных AFORO (Lombarte et al., 2006) плезиоморфная морфология сагитты, свойственная базальным группам Percomorpha (например, представителям семейств Serranidae, Epinephelidae и Percidae), включает следующие признаки. Отолит вытянут в переднезаднем направлении, рострум хорошо выражен, сулкус сравнительно широкий, открыт спереди и проходит вдоль всей медиальной поверхности отолита. Такая морфология свойственна многим родам Scorpaenoidei: Synanceia (Synanceiidae), Scorpaenopsis, Parascorpaena, Scorpaena, Sebastapistes (Scorpaenidae) и др. Морфология отолитов родов Trigla (Triglidae), Apistus (Apistidae), Inimicus, Minous (Synanceiidae), Dendrochirus, Pterois (Scorpaenidae), а также некоторых видов родов Sebastes и Sebasticus (Sebastidae) существенно отличается вследствие слабого развития или полного отсутствия рострума (Lombarte et al., 2006; наша статья). В соответствии с филогенетической схемой (рис. 1) можно предположить, что формирование более округлого отолита со слабо выраженным или отсутствующим рострумом шло параллельно в разных группах рыб. Несмотря на то что по форме отолитов I. sinensis и D. zebra имеют большое сходство (рис. 5, 7), гомология, по-видимому, отсутствует: высота отолита первого вида достигает максимума на уровне 1/3 длины отолита, высота отолита второго вида – позади 1/2 его длины. Это отличие не идентифицируется при использовании индексов формы отолитов, но заметно при сравнении контуров отолитов, реконструированных по результатам анализа коэффициентов Фурье (рис. 6).
Общий план строения отолитов, несомненно, определяется эволюционной историей группы. Например, представители подотряда Gobioidei (Perciformes) имеют редуцированную морфологию с отсутствием выраженных выступов и центрально расположенным сулкусом в виде подошвы (Gierl et al., 2013; Schwarzhans et al., 2017). Вместе с тем морфология отолитов в значительной степени зависит от биологии вида и сама по себе не может быть использована для реконструкции филогенетических взаимоотношений (Schwarzhans, 2013, 2014; Tuset et al., 2016а). Вариабельность групп рыб по форме тела коррелирует с изменчивостью формы отолитов (Tuset et al., 2016b), что проявляется у представителей подотряда Scorpaenoidei. Многие авторы строение сагитты связывают с особенностями экологии вида: глубиной обитания, локомоторной способностью, характером питания и особенностями слуховой коммуникации (Tuset et al., 2016a). По отношению к скорпеновидным рыбам подобный анализ не всегда возможен в связи с тем, что биология многих видов детально не исследована.
Как известно, удлинённые отолиты с хорошо развитым рострумом и глубокой V-образной выемкой (excisura) между рострумом и антирострумом характерны для активно плавающих пелагических видов рыб. Отолиты донных рыб, обитающих на мягком грунте, имеют округлую форму и неразвитый рострум, а отолиты донных рыб, обитающих на твёрдом субстрате, – короткий рострум (Volpedo, Echeverría, 2003; Volpedo et al., 2008; Tuset et al., 2016a). Кроме этого, донные рыбы, живущие на мягких грунтах, имеют наиболее высокие отолиты (Jaramillo et al., 2014). У видов рода Sebastes удлинённые и веретенообразные отолиты характерны для рыб с прогонистым телом, сравнительно тусклой окраской, слабым развитием шипов на голове и тенденцией к большей плавательной активности. Отолиты эллиптической формы со слабо развитым рострумом обнаружены у малоподвижных ярко окрашенных донных видов с высоким телом, большой головой и хорошо развитыми головными гребнями и шипами (Tuset et al., 2015).
Шесть видов скорпеновидных рыб, отолиты которых описаны в нашей статье, обитают в прибрежной зоне на небольших глубинах и являются хищниками-засадчиками, способными к чрезвычайно быстрому захвату добычи. Отолиты I. sinensis с невыраженным рострумом имеют сходство с отолитами других скорпеновидных рыб, которые обладают свободными лучами грудного плавника (от одного до трёх), по- видимому, не несущими сенсорную функцию и используемыми для “хождения” по дну (Gosline, 1994). Например, отолит Minous pictus и M. quincarinatus (Synanceiidae: Minoinae) имеет форму трапецоида с наибольшей высотой на уровне передней трети длины, отолит Apistus carinatus (Apistidae) по форме сходен с отолитом Inimicus, а отолит Trigla lyra (Triglidae) является наиболее высоким (L/l = 1.1–1.4), особенно в средней части (база данных AFORO: Lombarte et al., 2006). Следует отметить, что, несмотря на существенные различия строения отолитов, S. horrida и I. sinensis имеют одинаковый способ охоты: рыбы могут закапываться в грунт (оставляя на поверхности лишь конечную часть головы), остаются неподвижными и поджидают добычу, которую мгновенно засасывают в открывающийся рот (Scott, 2001; Wild Singapore, 2019). S. horrida, несомненно, не относится к хорошим пловцам и, таким образом, наличие хорошо развитого рострума сагитты не согласуется с изложенными выше данными литературы.
Из шести исследованных видов D. zebra, очевидно, наибольшее время проводит, плавая в придонном слое воды, а пищевое поведение крылаток подсемейства Pteroinae (Dendrochirus и Pterois) имеет свои особенности. Обнаружив добычу, рыба медленно приближается к ней, используя широкие окрашенные и расправленные грудные плавники для маскировки. Поимка добычи осуществляется посредством одного акта заглатывания, в результате которого она засасывается в большой широко открытый рот. Глотание происходит столь быстро и незаметно, что не пугает остальную добычу в стае (например, апогонов) и крылатка поедает рыб одну за другой (Fishelson, 1975). Связь морфологии отолитов крылаток с особенностями экологии и пищевого поведения остаётся неясной.
Относительная площадь сулкуса (в % А) у шести исследованных нами видов составила в среднем от 20% у P. picta до 26% у Sc. papuensis и D. zebra. Близкие значения этого индекса отмечены у антарктических мезопелагических рыб, совершающих протяжённые (группа 3) и короткие (группа 4) вертикальные миграции (Volpedo et al., 2008). У Scorpaena notata, Sc. porcus, Sc. elongata и H. dactylopterus средние значения индекса составляют соответственно 21, 13, 16 и 24% (Jaramillo et al., 2014). Структура сулкуса связана, главным образом, с восприятием акустических стимулов и является видоспецифичной (Gauldie 1988; Torres et al., 2000; Tuset et al., 2016a; наша статья). Вместе с тем функциональная роль соотношения размеров остиума и кауды или слияния этих отделов, отмеченного у многих донных видов, остаётся неясной (Platt, Popper, 1981; Kasumyan, 2004; Popper et al., 2005; Schwarzhans, 2014).
Вариабельность формы и размера отолитов может быть связана с чувствительностью к частотным характеристикам, силе и направлению звуковых импульсов (Gauldie, 1988; Lychakov, Rebane, 2000; Kasumyan, 2004; Popper et al., 2005). В соответствии с гипотезой сенсорного драйва дифференциация по особенностям слуховой коммуникации может привести к репродуктивной изоляции между популяциями и к последующему видообразованию (Endler, 1993). Средние значения индексов L/TL и RA у трёх видов рода Scorpaena (Sc. notata, Sc. porcus и Sc. scrofa) составили соответственно 0.04–0.05 и 0.50–0.86, но были выше у Sc. elongata (0.06 и 0.99) (Lombarte, Cruz, 2007). Значения индексов у трёх первых видов близки к таковым у исследованных нами (рис. 3). Относительный размер отолитов связывают с глубиной обитания рыб и способностью к восприятию звуков (Cruz, Lombarte, 2004), но далеко не всегда прослеживается корреляция с таксономическим положением и особенностями биотопов. Как правило, быстро плавающие пелагические рыбы имеют мелкие отолиты (Paxton, 2000; Volpedo, Echeverría, 2003), а наиболее крупнее отолиты обнаружены у представителей семейства Scianidae, способных к продукции звуков низкой частоты во время питания или на протяжении нерестового сезона (Horodysky et al., 2008). Исследованные нами виды ведут преимущественно одиночный образ жизни, и слуховая коммуникация вряд ли имеет большое значение. Исключение, возможно, представляет S. cyanostigma, особи которого образуют небольшие группы (Allen, Erdmann, 2012). С наличием слуховой коммуникации может быть связана сравнительно большая относительная площадь отолитов у этого вида (рис. 3б). В данном случае отмеченный ранее (Paxton, 2000) аллометрический эффект (больший относительный размер отолитов у рыб меньшего размера) не прослеживается, поскольку относительная длина сагитты S. cyanostigma существенно не отличается от этого показателя у других исследованных видов с близкой формой отолитов (рис. 3а).
Таким образом, у ряда видов подотряда Scorpaenoidei морфологические признаки тела, на основе которых (или с привлечением молекулярных данных) построены филогенетические схемы, и морфология сагитты, очевидно, связанная со строением внутреннего уха и саккулуса, в значительной степени разобщены. Слабая связь между формой отолитов и филогенией, но чёткая корреляция размера и формы отолитов с трофической нишей прослежена у нототениевых рыб (Lombarte et al., 2010). Аналогичная ситуация отмечена у видов рода Sebastes (Tuset et al., 2016а). У скорпеновидных рыб относительная независимость эволюционных преобразований разных систем органов прослеживается и для морфологических структур, связанных с размножением. В частности, у самок описаны яичники двух цистовариальных типов: II-3 и II-1. В яичниках типа II-3, обнаруженных у многих видов семейства Scorpaenidae, яйценосная строма находится в центре гонады, ооциты развиваются на стебельках, после овуляции заключаются в желеобразную массу и вымётываются в виде полых структур с яйцами, расположенными на периферии (Koya, Muñoz, 2007; McMillan, 2007). Яичники типа II-1 с дорсальным расположением яйценосных пластинок имеются у подавляющего большинства костистых рыб. Несмотря на то что роды Synanceia и Inimicus относятся к одной субкладе (рис. 1) и одному семейству, яичники самок имеют соответственно цистовариальные типы II-3 и II-1 (Емельянова, Павлов, 2020). В семействе Sebastidae яичники типа II-3 обнаружены у Helicolenus, типа II-1 − у Sebastes и Sebastiscus (Koya, Muñoz, 2007). По ультраструктуре сперматозоидов P. picta и S. cyanostigma существенно отличаются от других представителей семейства Scorpaenidae, в то время как S. horrida (Synanceiidae) не имеет таких отличий (Павлов, Емельянова, 2018). Несоответствие строения некоторых морфологических структур (в частности, морфологии отолитов, гонад и гамет) существующим филогенетическим схемам может быть связано и с тем, что эти структуры не используются для кладистического анализа и сами схемы не в полной мере отражают реальную ситуацию.
Список литературы
Афанасьев П.К., Орлов А.М., Рольский А.Ю. 2017. Сравнительный анализ формы отолитов как инструмент видовой идентификации и изучения популяционной организации различных видов рыб // Зоол. журн. Т. 96. № 2. С. 192–200. https://doi.org/10.7868/S0044513416120035
Емельянова Н.Г., Павлов Д.А. 2020. Некоторые данные по репродуктивной биологии Inimicus sinensis (Synanceiidae) // Вопр. ихтиологии. Т. 60. № 3. С. 318−327.
Мазникова О.А., Афанасьев П.К., Орлов А.М. и др. 2017. Сравнительный анализ формы отолитов, пространственное распределение и размерный состав черного палтуса Reinhardtius hippoglossoides matsuurae в западной части Берингова моря // Изв. ТИНРО. Т. 191. С. 97–113.
Павлов Д.А. 2016. Дифференциация трех видов рода Upeneus (Mullidae) по форме отолитов // Вопр. ихтиологии. Т. 55. № 1. С. 41–55. https://doi.org/10.7868/S0042875216010112
Павлов Д.А. 2018. Дифференциация чернополосой козобородки Upeneus tragula Richardson, 1846 (Perciformes: Mullidae) в прибрежной зоне Вьетнама на основе анализа формы отолитов // Биология моря. Т. 44. № 5. С. 347–356. https://doi.org/10.1134/S0134347518050078
Павлов Д.А., Емельянова Н.Г. 2018. Сравнительный анализ морфологии сперматозоидов у трёх видов рыб подотряда Scorpaenoidei // Вопр. ихтиологии. Т. 58. № 2. С. 201–214. https://doi.org/10.7868/S0042875218020091
Павлов Д.А., Емельянова Н.Г. 2019. Биологическая характеристика Dendrochirus zebra (Cuvier, 1829) (Scorpaeniformes: Scorpaenidae) из залива Нячанг Южно-Китайского моря // Биология моря. Т. 45. № 2. С. 75–85. https://doi.org/10.1134/S0134347519020104
Allen G.R., Erdmann M.V. 2012. Reef fishes of the East Indies. V. I–III. Perth, Australia: Tropical Reef Res., 1292 p.
Campana S.E., Casselman J.M. 1993. Stock discrimination using otolith shape analysis // Can. J. Fish. Aquat. Sci. V. 50. P. 1062–1083.
Carpenter K.E., Niem V.H. (eds.). 1999. FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. V. 4. Bony fishes. Pt. 2 (Mugilidae to Carangidae). Rome: FAO. P. 2069–2790.
Cruz A., Lombarte A. 2004. Otolith size and its relationship with colour patterns and sound production // J. Fish Biol. V. 65. P. 1512–1525. https://doi.org/10.1111/J.0022-1112.2004.00558.X
Endler J.A. 1993. Some general comments on the evolution and design of animal communication systems // Philos. Trans. Roy. Soc. London. V. 340B. P. 215–225.
Fishelson L. 1975. Ethology and reproduction of pteroid fishes found in the Gulf of Aqaba (Red Sea), especially Dendrochirus brachypterus (Cuvier), (Pteroidae, Teleostei) // Pubbl. Staz. Zool. Napoli. V. 39. P. 635–656.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2020. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/catalog /fishcatmain.asp. Version 01/2020)
Gaemers P.A.M. 1984. Taxonomic position of Cichlidae (Pisces, Perciformes) as demonstrated by the morphology of their otoliths // Netherl. J. Zool. V. 34. № 4. P. 566–595.
Gauldie R.W. 1988. Function, form and time-keeping properties of fish otoliths // Comp. Biochem. Physiol. Comp. Physiol. V. 91A. P. 395–402. https://doi.org/10.1016/0300-9629(88)90436-7
Gierl C., Reichenbacher B., Gaudant J. et al. 2013. An extraordinary gobioid fish fossil from Southern France // PLoS ONE. V. 8. № 5. P. 1–17. https://doi.org/10.1371/journal.pone.0064117
Gosline W.A. 1994. Function and structure in the paired fins of scorpaenifom fishes // Environ. Biol. Fish. V. 40. P. 219–226.
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: paleontological statistics software package for education and data analysis // Palaeontol. Electron. V. 4. № 1. P. 1–9.
Horodysky A.Z., Brill R.W., Warrant E.J. et al. 2008. Comparative visual function in five sciaenid fishes inhabiting Chesapeake Bay // J. Exper. Biol. V. 211. P. 3601–3612. https://doi.org/10.1242/JEB.023358
Imamura H. 2004. Phylogenetic relationships and new classification of the superfamily Scorpaenoidea (Actinopterygii: Perciformes) // Spec. Div. V. 9. P. 1–36.
Ishida M. 1994. Phylogeny of the suborder Scorpaenoidei (Pisces: Scorpaeniformes) // Bull. Nansei Nat. Fish. Res. Inst. V. 27. P. 1–112.
Iwata H., Ukai Y. 2002. Shape: a computer program package for quantitative evaluation of biological shapes based on elliptic Fourier descriptors // J. Hered. V. 93. P. 384–385.
Jaramillo A.M., Tombari A.D., Dura V.B. et al. 2014. Otolith eco-morphological patterns of benthic fishes from the coast of Valencia (Spain) // Thalassas. V. 30. № 1. P. 57–66.
Karahan A., Borsa P., Gucu A.C. et al. 2014. Geometric morphometrics, Fourier analysis of otolith shape, and nuclear-DNA markers distinguish two anchovy species (Engraulis spp.) in the Eastern Mediterranean Sea // Fish. Res. V. 159. P. 45–55. https://doi.org/10.1016/j.fishres.2014.05.009
Kasumyan A.O. 2004. The vestibular system and sense of equilibrium in fish // J. Ichthyol. V. 44. Suppl. 2. P. S224–S268.
Koya Y., Muñoz M. 2007. Comparative study on ovarian structures in scorpaenids: possible evolutional process of reproductive mode // Ichthyol. Res. V. 54. P. 221–230.
Kuhl F.P., Giardina C.R. 1982. Elliptic Fourier features of a closed contour // Comput. Graphics Image Process. V. 18. P. 236–258.
Lautredou A.C., Motomura H., Gallut C. et al. 2013. New nuclear markers and exploration of the relationships among Serraniformes (Acanthomorpha, Teleostei): the importance of working at multiple scales // Mol. Phylogen. Evol. V. 67. P. 140–155.
Legua J., Plaza G., Perez D., Arkhipkin A. 2013. Otolith shape analysis as a tool for stock identification of the southern blue whiting, Micromesistius australis // Lat. Amer. J. Aquat. Res. V. 41. № 3. P. 479–489.
Lin C.-H., Chang C.-W. 2012. Otolith atlas of Taiwan fishes // NMMBA Atlas. Ser. 12. Taiwan: Nat. Mus. Mar. Biol. Aquarium, 415 p.
Lombarte A., Cruz A. 2007. Otolith size trends in marine fish communities from different depth strata // J. Fish Biol. V. 71. P. 53–76. https://doi.org/10.1111/j.1095-8649.2007.01465.x
Lombarte A., Chic Ò., Parisi-Baradad V. et al. 2006. A web-based environment from shape analysis of fish otoliths. The AFORO database // Sci. Mar. V. 70. P. 147–152.
Lombarte A., Palmer M., Matallanas J. et al. 2010. Ecomorphological trends and phylogenetic inertia of otolith sagittae in Nototheniidae // Environ. Biol. Fish. V. 89. P. 607–618.
Lundberg Y.W., Xu Y., Thiessen K.D., Kramer K.L. 2015. Mechanisms of otoconia and otolith development // Devel. Dyn. V. 244. № 3. P. 239–253. https://doi.org/10.1002/DVDY.24195
Lychakov D.V., Rebane Y.T. 2000. Otolith regularities // Hear. Res. V. 143. P. 83–102.
McMillan D.B. 2007. Fish histology. Female reproductive system. Dordrecht: Springer, 598 p.
Mérigot B., Letourneur Y., Lecomte-Finiger R. 2007. Characterization of local populations of the common sole Solea solea (Pisces, Soleidae) in the NW Mediterranean through otolith morphometrics and shape analysis // Mar. Biol. V. 151. P. 997–1008.
Palmer A.R. 1994. Fluctuating asymmetry analyses: a primer // Developmental instability: its origins and implications / Ed. Markow T.A. Dordrecht: Kluwer. P. 335–364.
Paxton J.R. 2000. Fish otoliths: do sizes correlate with taxonomic group, habitat or luminescence? // Philos. Trans. Roy. Soc. London. Biol. Sci. V. 355B. P. 1299–1303. https://doi.org/10.1098/RSTB.2000.0688
Platt C., Popper A.N. 1981. Fine structure and function of the ear // Hearing and sound communication in fishes / Eds. Tavolga W.N. et al. Berlin: Springer. P. 3–38.
Popper A.N., Ramcharitar J., Campana S.E. 2005. Why otoliths? Insights from inner ear physiology and fisheries biology // Mar. Freshw. Res. V. 56. P. 497–504.
Schulz-Mirbach T., Reichenbacher B. 2006. Reconstruction of Oligocene and Neogene freshwater fish faunas – an actualistic study on cypriniform otoliths // Acta Palaeontol. Pol. V. 51. P. 283–304.
Schwarzhans W. 1978. Otolith-morphology and its usage for higher systematical units, with special reference to the Myctophiformes s.1 // Meded. Werkgr. Tert. Kwart. Geol. V. 15. № 4. P. 167–185.
Schwarzhans W. 2013. The use of otolith morphology in ichthyology // 9th Indo-Pacific Fish Conference. Okinawa. (https://www.researchgate.net/publication/264301127_The_ use_of_ otolith_morphology_in_ichthyology)
Schwarzhans W. 2014. Head and otolith morphology of the genera Hymenocephalus, Hymenogadus and Spicomacrurus (Macrouridae), with the description of three new species // Zootaxa. V. 3888. P. 1–73.
Schwarzhans W., Ohe F., Ando Y. 2017. An early Oligocene fish-fauna from Japan reconstructed from otoliths // Zitteliana. № 90. P. 3–26.
Scott M. 2001. Speak of the devil: fish of the genus Inimicus // SeaScope. V. 18. P. 1, 3.
Secor D.H., Dean J.M., Laban E.H. 1991. Manual for otolith removal and preparation for microstructural examination. Columbia, S.C.: Baruch Inst. Mar. Biol. Coastal Res., 87 p.
Smith W.L., Craig M.T. 2007. Casting the percomorph net widely: the importance of broad taxonomic sampling in the search for the placement of serranid and percid fishes // Copeia. № 1. P. 35–55.
Smith W.L., Wheeler W.C. 2004. Polyphyly of the mail-cheeked fishes (Teleostei: Scorpaeniformes): evidence from mitochondrial and nuclear sequence data // Mol. Phylogen. Evol. V. 32. P. 627–646.
Smith W.L., Everman E., Richardson C. 2018. Phylogeny and taxonomy of flatheads, scorpionfishes, sea robins, and stonefishes (Percomorpha: Scorpaeniformes) and the evolution of the lachrymal saber // Copeia. V. 106. № 1. P. 94–119. https://doi.org/10.1643/CG-17-669
Stransky C., MacLellan S.E. 2005. Species separation and zoogeography of redfish and rockfish (genus Sebastes) by otolith shape analysis // Can. J. Fish. Aquat. Sci. V. 62. P. 2265–2276.
Tao He, Jiao Cheng, Jian-guang Qin et al. 2018. Comparative analysis of otolith morphology in three species of Scomber // Ichthyol. Res. V. 65. P. 192–201. https://doi.org/10.1007/s10228-017-0605-4
Torres G.J., Lombarte A., Morales-Nin B. 2000. Variability of the sulcus acusticus in the sagitta otolith of the genus Merluccius // Fish. Res. V. 46. P. 5–13. https://doi.org/10.1016/S0165-7836(00)00128-4
Tuset V.M., Imondi R., Aguado G. et al. 2015. Otolith patterns of rockfishes from the Northeastern Pacific // J. Morphol. V. 276. P. 458–469. https://doi.org/10.1002/JMOR.20353
Tuset V.M., Otero-Ferrer J.L., Gómez-Zurita J.G. et al. 2016a. Otolith shape lends support to the sensory drive hypothesis in rockfishes // J. Evol. Biol. V. 29. P. 2083–2097. https://doi.org/10.1111/jeb.12932
Tuset V.M., Farré M., Otero-Ferrer J.L. et al. 2016b. Testing otolith morphology for measuring marine fish biodiversity // Mar. Freshw. Res. V. 67. P. 1037–1048. https://doi.org/10.1071/MF15052
Volpedo A.V., Echeverría D.D. 2003. Ecomorphological patterns of the sagitta in fish on the continental shelf off Argentine // Fish. Res. V. 60. P. 551–560. https://doi.org/10.1016/S0165-7836(02)00170-4
Volpedo A.V., Tombari A.D., Echeverría D.D. 2008. Eco-morphological patterns of the sagitta of Antarctic fish // Polar Biol. V. 31. P. 635–640. https://doi.org/10.1007/s00300-007-0400-1
Wild Singapore. 2019. Hollow-cheeked stonefish Synanceia horrida. Family Synanceiidae. (http://www.wildsingapore.com/wildfacts/vertebrates/fish/synanceiidae/horrida.htm)
Zhang C., Fan Y., Ye Z. et al. 2017. Identification of five Pampus species from the coast of China based on sagittal otolith morphology analysis // Acta Oceanol. Sin. V. 36. № 2. P. 51–56.
Zhuang L., Ye Z., Zhang C. 2015. Application of otolith shape analysis to species separation in Sebastes spp. from the Bohai Sea and the Yellow Sea, northwest Pacific // Environ. Biol. Fish. V. 98. P. 547–558.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


