Вопросы ихтиологии, 2021, T. 61, № 2, стр. 219-225
Электрические разряды перистоусых сомов Synodontis (Mochokidae): особенности и механизмы электрогенерации
В. Д. Барон 1, *, А. А. Орлов 1
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: vbaron@mail.ru
Поступила в редакцию 06.05.2020
После доработки 10.05.2020
Принята к публикации 11.05.2020
Аннотация
Изучены электрические разряды у двух видов перистоусых сомов Synodontis clarias и S. membranaceus. У S. clarias обнаружена постоянная генерация слабых электрических импульсов с относительно стабильной частотой (~30 с−1) и амплитудой, достигающей 200 мкВ. У представителей обоих видов при агрессивно-оборонительном поведении в парах особей зарегистрированы как относительно короткие двухфазные разряды двух типов, отличающиеся суммарной длительностью и отношением положительной и отрицательной фаз, так и продолжительные импульсы разнообразной формы с характерной фронтальной изрезанностью. У S. membranaceus зарегистрированы короткие двухфазные разряды как первого, так и второго типа. С помощью простой компьютерной модели осуществлена попытка реконструкции процесса образования продолжительных электрических разрядов из коротких элементарных импульсов.
Кроме хорошо известных двух основных групп пресноводных слабоэлектрических рыб – африканских Mormyriformes и южноамериканских Gymnotoidei, − использующих свои электрические органы и электрорецепторные системы для коммуникации и локации (обнаружения объектов), в последние годы обнаружены представители ещё ряда таксонов, генерирующих электрические разряды, которые в основном составляют группу слабоэлектрических сомов. Способность генерировать электрические разряды обнаружена к настоящему времени у представителей пяти семейств сомообразных (Siluriformes). Кроме хорошо известного сильноэлектрического сома Malapterurus electricus (Malapteruridae), специализированная электрическая активность зарегистрирована у представителей родов: Synodontis (Mochokidae) (Hagedorn et al., 1990; Baron et al., 1994a, 2002; Boyle et al., 2014; Орлов и др., 2017, 2019; Kéver et al., 2020), Clarias и Heterobranchus (Clariidae) (Baron et al., 1994b; Барон и др., 2008; Olshanskiy et al., 2020), Ompok (Siluridae) (Моршнев, Ольшанский, 1997) и Auchenoglanis (Claroteidae) (Барон и др., 1996; Орлов и др., 2015). Анализ морфологических характеристик позволяет рассматривать представителей семейства Claroteidae и сильноэлектрических сомов (Malapteruridae) как филогенетически близкородственные линии (de Pinna, 1993). Однако более поздние данные указывают, что электрические органы (электрогенераторные структуры в случае Claroteidae) у представителей этих двух таксонов возникли, скорее всего, независимо друг от друга (Alves-Gomes, 2001).
Формы разрядов электрических органов у Mormyriformes и Gymnotoidei за счёт высокой синхронизации, которая обеспечивается системой нервного контроля, в точности повторяют форму разрядов одиночных электрических клеток (электроцитов). В большинстве случаев паттерны разрядов у этих рыб являются видовым или родовым признаком, а их электрические параметры, например длительность, жёстко привязаны к интервалу частот соответствующего типа электрорецепторов, что позволяет использовать электрические органы и сенсорные системы для обнаружения объектов или коммуникации (Heiligenberg, 1977; Hopkins, 1986).
Обнаруженные у большинства слабоэлектрических сомов паттерны разрядов крайне разнообразны. Попытка систематизации разнообразия формы электрических разрядов, зарегистрированных в продолжительных по времени опытах у представителей нескольких видов перистоусых сомов Synodontis нильской фауны, показала, что наравне с постоянно встречающимися сравнительно короткими импульсами, не превышающими нескольких миллисекунд, основной массив электрической активности у Synodontis представлен более длительными (>10−20 мс) разрядами разной продолжительности и формы (Орлов и др., 2017, 2019). Это позволило предположить, что механизм образования таких импульсов может быть связан с последовательной временнóй суммацией коротких (элементарных) импульсов отдельных электроцитов, подобно тому, как это происходит в мышечных тканях при образовании тетануса в результате согласованной активности отдельных мышечных волокон. Похожие по длительности типы разрядов описаны у представителей родов Clarias и Auchenoglanis и неизвестны в других группах пресноводных электрических рыб (Baron et al., 1994b; Орлов и др., 2015).
Калмийн (Kalmijn, 1974) полагал, что электросенсорная система сомов, образованная исключительно низкочастотными ампулированными электрорецепторами, способна лишь к пассивной рецепции внешних электрических полей в основном абиотического происхождения. Однако обнаруженные у ряда представителей сомообразных электрические разряды, параметры которых за счёт увеличения длительности и амплитуды в процессе суммации приближаются к оптимальным динамическим и частотным диапазонам чувствительности собственных ампулированных рецепторов (Lissmann, Machin, 1963; Peters, Buwalda, 1972; Hanika, Kramer, 2000), показывают возможность, по крайней мере, внутривидовой коммуникации.
Цель работы – изучить электрическую активность S. clarias и S. membranaceus (двух из 11 видов перистоусых сомов, представляющих нильскую фауну, на которых ранее исследования подобного рода не проводились) и с помощью простой компьютерной модели реконструировать процесс образования продолжительных электрических разрядов из коротких элементарных импульсов.
МАТЕРИАЛ И МЕТОДИКА
Объекты исследования – 6 экз. S. clarias стандартной длиной (SL) 118–180 мм и 5 экз. S. membranaseus SL 211–245 мм − были выловлены из системы р. Баро (Baro) и её притоков в бассейне Белого Нила на юго-западе Эфиопии. Рыб отлавливали жаберными или рамными сетями, после чего доставляли в полевую лабораторию, где содержали в пластиковых 40-литровых контейнерах в воде из водоёма, в котором они были добыты, при постоянной аэрации и активной фильтрации. Период акклимации перед первыми записями составлял от 2 ч до нескольких суток. Температура и электропроводность воды в разных локальностях варьировали в пределах 27.0–29.5°C и 108−159 мкСм/см. Опыты проводили при естественной освещённости круглосуточно в экспериментальном аквариуме размером 40 × 30 × 20 см, наполненном водой, в которой рыб содержали.
Электрические разряды регистрировали, как правило, у свободно плавающих рыб с помощью двух стержневых электродов из графита, прикреплённых к коротким стенкам аквариума. Усиленные дифференциальным усилителем (Isolated Low-Noise Bio-Amplifier, Iso-DAM, WPI) сигналы (×100, 0.0001−10 кГц) подавались на вход аналого-цифрового преобразователя (DAQ-card AI-16E-4, National Instruments), соединённого с PCMCIA-входом ноутбука, и оцифровывались (частота дискретизации 20 кГц, 12 бит). Для записи и анализа сигналов в реальном времени использовали адаптированное к устройству оцифровки собственное программное обеспечение, разработанное в программной среде LabView 7.0. Данный софт снабжён регулируемым пороговым устройством (дискриминатором), которое позволяет записывать в отдельные файлы только те сигналы, амплитуды которых превышают в конкретном опыте некоторый заданный уровень, и отсеивать тем самым прочий электрический фон.
Для реконструкции процесса образования продолжительных электрических разрядов из коротких элементарных импульсов использовали программу, написанную в среде LabWindows SVI (National Instruments). Она выполнена в виде графического интерфейса и может одновременно импортировать до 20 предварительно записанных элементарных разрядов, после чего в режиме реального времени позволяет вручную производить суперпозицию (алгебраическое сложение) всех загруженных импульсов. Изменяя соответствующим образом (как правило, поочерёдно) амплитуды и фазы импульсов можно добиться довольно близкого сходства паттерна получающегося суммарного импульса с реальным реконструируемым электрическим разрядом.
РЕЗУЛЬТАТЫ
У одиночных свободно плавающих особей S. clarias обнаружена постоянная и продолжающаяся всё время наблюдений спонтанная генерация слабых электрических разрядов с частотой ~30 с−1 (рис. 1а). Амплитуды разрядов при нахождении рыбы в центральной части аквариума составляли 30–200 мкВ, в то время как величины межимпульсных интервалов отличались крайней стабильностью: у всех исследованных рыб эти значения находились в диапазоне 33−36 мс. Для более точного определения формы отдельных импульсов рыб помещали в препятствующий свободному движению цилиндрический футляр из крупноячеистой пластиковой сетки, а отведение осуществляли точечным электродом относительно индифферентного, расположенного в дальнем углу аквариума. Один из таких разрядов, записанный в нескольких миллиметрах от дорсальной поверхности головы рыбы (рис. 1б), представляет собой двухфазный импульс с короткой начальной фазой длительностью ~1.9−2.0 мс и значительно более длинной второй фазой с существенно меньшей амплитудой. Полярность первой фазы электрических разрядов S. clarias всегда была электроотрицательна относительно области головы.
Рис. 1.
Электрические разряды Synodontis clarias (а–г) и S. membranaceus (д–з); на всех записях отклонение вверх соответствует по знаку электроотрицательности ростральной части рыбы: а − амплитудная модуляция разрядов связана с изменением положения рыбы относительно электродов при свободном движении; б–з – нормированные по амплитуде осциллограммы. Масштаб: а – 50, б–з – 5 мс.
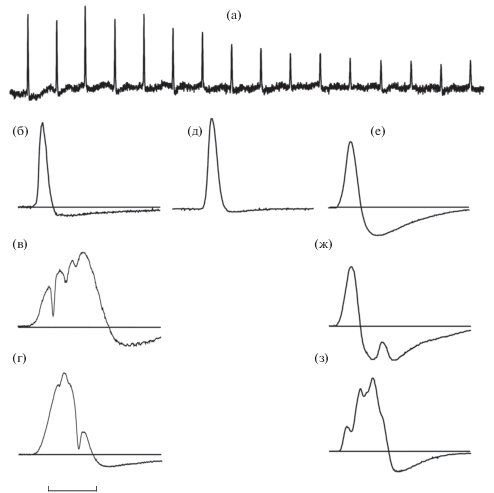
Одиночные особи S. clarias кроме постоянной электрической активности в микровольтовом диапазоне практически не генерировали какие-либо другие электрические разряды. Ситуация менялась при помещении в аквариум пары рыб. В этом случае генерация разрядов в основном происходила при агрессивно-оборонительных взаимодействиях пары рыб, когда одна из них, занимающая, по-видимому, доминирующее положение, в условиях ограниченного пространства предпринимала серии атак. Число таких поведенческих актов у разных пар рыб за время одного опыта также могло заметно различаться: некоторые рыбы вообще не проявляли склонность к агрессивному поведению и, соответственно, к генерации электрических разрядов. В таких случаях для достижения нужного результата приходилось неоднократно менять индивидуальный набор пар.
Зарегистрированные разряды можно разделить на две группы: к первой можно отнести короткие (элементарные) двухфазные импульсы, практически идентичные по форме таковым на рис. 1а и 1б, но с большей амплитудой, которая достигала 1−3 мВ. Единственный варьирующий параметр разрядов этого типа, который можно отметить по материалам регистрации от разных особей, – это небольшие изменения относительной амплитуды второй фазы разряда, являющиеся, вероятно, индивидуальным признаком. Вторую группу представляют продолжительные во времени разряды, характеризующиеся увеличенной длительностью первой фазы, достигающей 20−30 мс, и изрезанностью её восходящего фронта (рис. 1в, 1г). Трудно привести какие-либо количественные данные, касающиеся частоты генерации сомами электрических разрядов при агрессивном поведении, так как это зависело от индивидуальных особенностей рыб, используемых в опытах, а учитывая относительную кратковременность последних в полевых условиях, в первую очередь от их физиологического состояния. Однако отметим, что в стандартном опыте от одной из активных пар рыб за период измерений 260 мин было зарегистрировано 22 разряда, из которых лишь четыре представляли первую группу коротких разрядов (рис. 1б).
Электрические разряды S. membranaseus, а также условия, при которых они генерировались рыбами, во многом совпадали с описанными выше у S. clarias. Основное отличие состояло в отсутствии какой-либо спонтанной электрической активности при одиночном содержании у всех использованных в опытах пяти рыб. Кроме того, наравне с короткими двухфазными импульсами, у которых длительность первой фазы составляла 2.0–2.2 мс (рис. 1д), т. е. совсем немного превосходила соответствующее значение у похожих импульсов S. clarias, был обнаружен и второй тип элементарных разрядов с неизменной повторяющейся формой (рис. 1е). Их характерной особенностью являлась как увеличенная до 2.5–2.7 мс длительность первой фазы, так и возросшая амплитуда второй, приводящая к другому соотношению положительной и отрицательной фаз. Хотя эти разряды были обнаружены только у трёх рыб, частота их генерации при агрессивно-оборонительном поведении была приблизительно такой же, как и у элементарных импульсов первого типа. Так, в примерно одинаковых по длительности опытах (на двух разных парах рыб) в интервале 17 мин было зарегистрировано шесть продолжительных разрядов второго типа (рис. 1е) и семь коротких разрядов первого типа (рис. 1д). Основной же массив электрических разрядов S. membranaseus, как и у S. clarias, состоял из сравнительно длительных импульсов с изрезанностью, которая проявлялась либо на продолжительной второй фазе разряда (рис. 1ж), либо на восходящем фронте начальной фазы (рис. 1з).
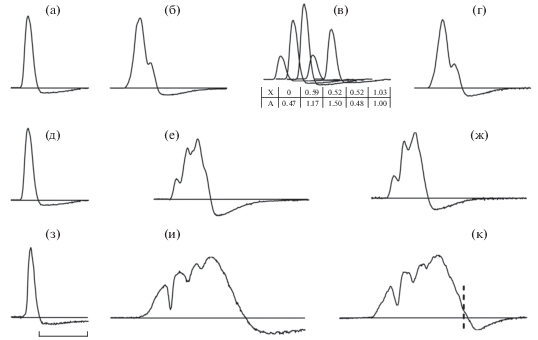
Для проверки предположения о механизме образования длительных электрических разрядов Synodontis в результате последовательной суммации более коротких импульсов, условно отнесённых к элементарным разрядам, которые генерируются непосредственно отдельными электрическими клетками, использовали программу, позволяющую провести качественную, основанную на визуальной оценке реконструкцию зарегистрированных продолжительных импульсов. На рис. 2а−2г представлен один из примеров такой реконструкции электрического разряда S. membranaseus. Поскольку разряд сравнительно короткий (рис. 2б), то для его аппроксимации в первом приближении оказалось достаточно всего пяти слагаемых элементарных импульсов с разными амплитудами и фазами (рис. 2в). На рис. 2д−2к приводятся два других примера реконструкции более длительных электрических разрядов S. membranaseus (рис. 2е) и S. clarias (рис. 2и). Для получения большего сходства, а также при реконструкции более длинных разрядов число слагаемых импульсов нужно увеличивать. Особенно это касается случаев, когда аппроксимируются пологие и гладкие участки фронта разрядов. Так, для реконструкции продолжительного разряда S. clarias (рис. 2к) число слагаемых элементарных импульсов должно быть существенно больше 20 – максимального числа импортируемых импульсов, которое позволяет использовать применяемая программа. Полученные данные позволяют считать, что, с точки зрения сравнительной визуальной оценки получившихся разрядов, данный метод позволяет вполне удовлетворительно реконструировать сложные продолжительные разряды.
Рис. 2.
Электрические разряды Synodontis membranaceus (а–ж) и S. clarias (з–к): а, д, з – короткие элементарные разряды; б, е, и – зарегистрированные продолжительные разряды разной формы; г, ж, к – импульсы, полученные в результате реконструкции при последовательном сложении соответствующих элементарных разрядов; в – схематическое представление слагаемых элементарных импульсов для реконструкции разряда (б) [X (мс) – фазовые сдвиги между пятью слагаемыми импульсами, A (относительные единицы) − их амплитуды]; (⁞) – граница доступной для аппроксимации зоны. Масштаб: 5 мс.
ОБСУЖДЕНИЕ
Процесс образования разнообразных по форме электрических разрядов связан с механизмом последовательной временнóй суммации элементарных разрядов, формы которых, в свою очередь, определяются особенностями электрогенеза в одиночных электрических клетках. У представителей Synodontis структуры, отвечающие за генерацию электрических разрядов, обнаружены в протракторных мышцах, прикреплённых к плавательному пузырю (Hagedorn et al., 1990) и, как считается, входящих в систему звукообразования (Parmentier, Diogo, 2006). У ряда видов Synodontis в мышечных волокнах этих мышц обнаружено пониженное содержание миофибрилл, которые являются одним из основных компонентов сократительного аппарата, и одновременно с этим повышенная способность к электрогенерации, выражающаяся в генерации разрядов увеличенной амплитуды (Boyle et al., 2014). Так, у пяти исследованных видов Synodontis была получена отрицательная корреляция между плотностью миофибрилл в волокнах протракторных мышц и способностью рыб к электрогенерации, в то время как для генерации звуков эта корреляция была положительная. Таким образом, электрогенераторными структурами Synodontis и, соответственно, электрическими клетками (электроцитами), вероятно, являются модифицированные мышечные волокна, в которых потеря сократительного аппарата замещается появлением способности к генерации электрических токов во внешней среде. По мнению Боуле с соавторами (Boyle et al., 2014), протракторные мышцы могут представлять собой комплексную структуру, в которой происходит постепенный эволюционный переход от системы, участвующей в процессе звукообразования, к электрогенерации.
Не менее важным является то, что, по-видимому, разные виды Synodontis находятся на разных стадиях этого перехода, что связано не только с морфологическим разнообразием тканей, но и с функциональными характеристиками образующейся электрогенераторной системы, к которым можно отнести как особенности электрогенеза электрических клеток, так и системы нервного контроля.
У S. membranaceus и S. clarias обнаружены два типа двухфазных электрических разрядов (рис. 1б, 1д, 1е), которые по своим временны́м параметрам схожи с разрядами ряда известных слабоэлектрических рыб; их условно можно считать элементарными (т. е. не подверженными процессу временнóй суммации) и отнести к электрогенезу одиночных электрических клеток. Основное различие этих двух типов разрядов состоит в разном соотношении амплитуд положительных и отрицательных фаз разрядов и интегральных значений площадей под каждой из них. От последнего фактора зависит величина и знак постоянной составляющей разряда. Кроме рассматриваемых видов разряды первого типа (рис. 1б, 1д) с большим значением отношения фазовых амплитуд (условно превышающих значение 3) были зарегистрированы у S. serratus, S. sorex и S.eupterus (Baron et al., 2002; Орлов и др., 2017, 2019), а разряды второго типа − кроме S. membranaceus (рис. 1е) у S. caudovitatus (Орлов и др., 2017). Крайне необычным является то, что у представителей двух видов – S. membranaceus и S. batensoda (Орлов и др., 2019), – в том числе у одних и тех же особей, были получены разряды как одного, так и другого типа.
У некоторых видов Synodontis элементарные электрические разряды образуют пачки импульсов. Это происходит в случае, когда период повторения импульсов превышает длительность самих разрядов и эффекта временнóй суммации не происходит. Продолжительные пачки импульсов длительностью >100 мс были обнаружены у S. nigriventris (Kéver et al., 2020), S. marmorata (Boyle et al., 2014), S. schall (Барон, Моршнев, 1998) и S. nigrita (Baron et al., 1994a). Отметим, что у последних двух видов одиночные электрические разряды, образующие пачку, относятся к разрядам первого типа.
Трудно объяснить функциональное значение периодической спонтанной электрической активности, которая кроме S. clarias была обнаружена у S. nigrita (Hagedorn et al., 1990; Baron et al., 1994a) и S. caudovittatus (Орлов и др., 2017). Сочетание крайне слабой амплитуды разрядов, не превышающей в лучшем случае нескольких сот микровольт в нескольких сантиметрах от рыбы (относительно удалённого электрода), и коротких импульсов длительностью несколько миллисекунд не привязано к рабочему диапазону чувствительности ампулированных электрорецепторов и не позволяет использовать разряды в качестве коммуникационных сигналов. В то же время адекватная стимуляция электрорецепторной системы Synodontis электрическими импульсами даже на пороговом уровне вызывает заметное изменение частоты спонтанной электрической активности, которое, как правило, заключается в её торможении. Пороговые значения и другие характеристики электрорецепторов Synodontis, полученные этим методом (Орлов, Барон, 2005), оказываются сравнимы с данными, полученными у других видов сомов в электрофизиологических и поведенческих опытах (Peters, Buwalda, 1972; Hanika, Kramer, 2000).
Не совсем ясны механизмы нервного контроля, при котором модифицированные мышечные волокна (электроциты) протракторной мышцы обеспечивают генерацию электрических импульсов разной амплитуды и формы. Можно лишь предполагать, что продуцирование у S. clarias отдельных коротких импульсов, совпадающих по форме со спонтанно генерируемыми разрядами (рис. 1а, 1б), но с увеличенными более чем на порядок амплитудами, связано с синхронной активацией мотонейронами большего числа электроцитов, которые в результате последовательно-параллельного соединения увеличивают амплитуду итогового разряда. А последующее увеличение длительности электрических разрядов Synodontis за счёт последовательной суммации приводит к их согласованной работе с ампулированными электрорецепторами и позволяет использовать электрогенераторную и электрорецепторную системы сомов для электрической сигнализации и коммуникации.
Список литературы
Барон В.Д., Моршнев К.С. 1998. Характеристика электрогенерации у двух африканских видов Synodontis (Mochokidae, Siluriformes) // Докл. АН. Т. 361. № 1. С. 123−125.
Барон В.Д., Орлов А.А., Голубцов А.С. 1996. Обнаружение электрических разрядов у африканского сома Auchenoglanis occidentalis (Siluriformes: Bagridae) // Там же. Т. 349. № 4. С. 512−515.
Барон В.Д., Орлов А.А., Голубцов А.С. 2008. Электрические разряды африканских сомов Clarias anguillaris и Heterobranchus longifilis // Там же. Т. 418. № 2. С. 274–276.
Моршнев К.С., Ольшанский В.М. 1997. Электрические разряды азиатского сома Ompok bimaculatus (Siluridae) // Там же. Т. 354. № 3. С. 419–422.
Орлов А.А., Барон В.Д. 2005. Реакции электрогенераторной системы Synodontis (Mochokidae, Siluriformes) на слабые электрические поля // Там же. Т. 403. № 4. С. 566−569.
Орлов А.А., Барон В.Д., Голубцов А.С. 2015. Электрические разряды двух видов африканских сомов рода Auchenoglanis (Claroteidae, Siluriformes) // Там же. Т. 462. № 3. С. 370–372. https://doi.org/10.7868/S0869565215150293
Орлов А.А., Барон В.Д., Голубцов А.С. 2017. Электрические разряды и особенности электрогенеза у африканских перистоусых сомов Synodontis caudovittatus и S. eupterus (Mochokidae, Siluriformes) // Там же. Т. 474. № 5. С. 649−651. https://doi.org/10.7868/S0042875217040014
Орлов А.А., Барон В.Д., Голубцов А.С. 2019. Особенности электрогенерации у африканских перистоусых сомов Synodontis sorex и S. batensoda (Mochokidae, Siluriformes) // Там же. Т. 487. № 6. С. 711–714. https://doi.org/10.31857/S0869-56524876711-714
Alves-Gomes J. 2001. The evolution of electroreception and bioelectrogenesis in teleost fish: a phylogenetic perspective // J. Fish Biol. V. 58. P. 1489−1511. https://doi.org/10.1111/j.1095-8649.2001.tb02307.x
Baron V.D., Morshnev K.S., Olshansky V.M., Orlov A.A. 1994a. Electric organ discharges of two species African catfish (Synodontis) during social behaviour // Anim. Behav. V. 48. № 6. P. 1472−1475. https://doi.org/10.1006/anbe.1994.1387
Baron V.D., Orlov A.A., Golubtsov A.S. 1994b. African clarias catfish elicits long-lasting weakly electric pulses // Experientia. V. 50. P. 664–647. https://doi.org/10.1007/bf01952864
Baron V.D., Orlov A.A., Morshnev K.S. 2002. Triggering of the electric discharges in catfish Synodontis serratus and Clarias gariepinus // J. Ichthyology. V. 42. Suppl. 2. P. S223−S320.
Boyle K.S., Colleye O., Parmentier E. 2014. Sound production to electric discharge: sonic muscle evolution in progress in Synodontis spp. catfishes (Mochokidae) // Proc. Roy. Soc. V. 281B. № 20 141 197. https://doi.org/10.1098/rspb.2014.1197
De Pinna M.C.C. 1993. Higer-level phylogeny of Siluriformes (Teleostei, Ostariophysi), with a new classification of the order: Ph. D. Thesis. N.Y.: Univ. New York, 994 p.
Hagedorn M., Womble M., Finger T.E. 1990. Synodontid catfish: a new group of weakly electric fish // Brain Behav. Evol. V. 35. P. 268–277. https://doi.org/10.1159/000115873
Hanika S., Kramer B. 2000. Electrosensory prey detection in the African sharptooth catfish, Clarias gariepinus (Clariidae), of a weakly electric mormyrid fish, the bulldog (Marcusenius macrolepidotus) // Behav. Ecol. Sociobiol. V. 48. P. 218−228. https://doi.org/10.1007/s002650000232
Heiligenberg W. 1977. Principles of electrolocation and jamming avoidance in electric fish. A neuroethological approach. Berlin: Springer, 85 p.
Hopkins C.D. 1986. Behavior of Mormyridae // Electroreception / Eds. Bullock T.H., Heiligenberg W. N.Y.: John Wiley. P. 527–576.
Kalmijn A.J. 1974. The detection of electric fields from inanimate and animate sources other than electric organs // Electroreceptors and other specialized receptors in lower vertrebrates. Handbook of sensory physiology. V. III/3 / Ed. Fessard A. Berlin: Springer. P. 147−200.
Kéver L., Bass A.H., Parmentier E., Chagnaud B.P. 2020. Neuroanatomical and neurophysiological mechanisms of acoustic and weakly electric signaling in synodontid catfish // J. Comp. Neurol. P. 1−18. https://doi.org/10.1002/cne.24920
Lissmann H.W., Machin K.E. 1963. Electric receptors in a non-electric fish Clarias // Nature. V. 199. P. 88−89. https://doi.org/10.1038/199088a0
Olshanskiy V.M., Kasumyan A.O. Moller P. 2020. On mating and function of associated electric pulses in Clarias microcephalus (Günther 1864): probing an old puzzle, first posed by Charles Darwin // Environ. Biol. Fish. V. 103. P. 99–114. https://doi.org/10.1007/s10641-019-00936-w
Parmentier E., Diogo R. 2006. Evolutionary trends of swimbladder sound mechanisms in some teleost fishes // Communication in fishes / Eds. Ladich F. et al. Enfield: Sci. Publ. Inc. P. 43–68.
Peters R.C., Buwalda R.J.A. 1972. Frequency response of the electroreceptors (small pit organs) of the catfish, Ictalurus nebulosus // J. Comp. Physiol. V. 79. P. 29−38. https://doi.org/10.1007/BF00693616
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


