Вопросы ихтиологии, 2021, T. 61, № 2, стр. 194-204
Распределение ихтиопланктона в связи с особенностями гидрологического режима у берегов Крыма (Чёрное море) в весенне-летний сезон 2017 г.
Т. Н. Климова 1, *, А. А. Субботин 1, И. В. Вдодович 1, Ю. А. Загородняя 1, П. С. Подрезова 1, О. А. Гарбазей 1
1 Институт биологии южных морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: tnklim@mail.ru
Поступила в редакцию 23.03.2020
После доработки 26.03.2020
Принята к публикации 26.03.2020
Аннотация
Представлены особенности видового состава, пространственного распределения и трофических взаимоотношений ихтио- и зоопланктона в весенне-летний период 2017 г. в зависимости от интенсивности прогрева верхнего слоя моря на фоне перестройки системы поверхностных течений от зимнего к летнему типу циркуляции. В апреле−мае низкие значения температуры поверхности моря (8.0−9.0°С) на шельфе Крымского п-ова от Керченского пролива до м. Сарыч привели к пролонгированию результативного нереста умеренноводных видов рыб. Максимальная численность икры Sprattus sprattus достигала 162.8 шт/м2, а личинок – 116.0 экз/м2. Теплолюбивые виды встречались только в западном секторе исследований – от Гераклейского п-ова до м. Тарханкут, где температура воды была максимальной и достигала 14–15°С. В июне−июле запаздывание летнего гидрологического сезона не способствовало прогреву верхнего квазиоднородного слоя, его толщина варьировала от 1−5 до 10−15 м. Несмотря на большое число видов в ихтиопланктоне, максимальная численность икры не превышала 50 шт/м2, а личинок – 14 экз/м2. Доля личинок умеренноводных видов рыб в среднем составляла 32%, а в глубоководных районах достигала 40%. В питании личинок рыб как в весенний, так и в летний сезон преобладали ювенильные стадии копепод холодолюбивого комплекса.
В Чёрном море выделяют две группы собственно морских рыб, которые достоверно размножаются в морях умеренного пояса с хорошо выраженной сезонностью: умеренноводные бореально-атлантические реликты и тепловодные южнобореальные, субтропические и тропические виды (Расс, 1965). Видовой состав и численность ихтиопланктона в разных районах моря в значительной мере определяются термохалинной структурой и динамикой вод (Климова и др., 2019). Нерест теплолюбивых видов рыб в Чёрном море наблюдается с апреля по октябрь при температуре поверхности моря 14−27°С и ограничен верхним квазиоднородным слоем моря. Массовый нерест умеренноводных видов рыб обычно приурочен к зимнему гидрологическому сезону и ограничен декабрём–февралём. Благодаря наличию холодного промежуточного слоя в Чёрном море в летний гидрологический сезон, икра и личинки некоторых видов рыб с многопорционным нерестом (шпрот Sprattus sprattus, мерланг Merlangius merlangus, французская тресочка Trisopterus luscus) присутствуют в ихтиопланктоне круглый год (Алеев, 1958; Расс, 1965; Alonso-Fernández, 2011; Klimova, Podrezova, 2018). Глобальное потепление наиболее явственно прослеживается в морских экосистемах умеренного пояса, имеющих чёткие сезонные различия, которые и определяют видовые особенности фенологии гидробионтов (Edwards, Richardson, 2004; Visser, Both, 2005). Показано, что изменения в фенологии нереста как теплолюбивых, так и холодолюбивых рыб приводят к одновременному присутствию в ихтиопланктоне личинок теплолюбивого и умеренноводного комплексов (Edwards, Richardson, 2004; Visser, Both, 2005; Auth et al., 2017). В настоящее время массовый нерест шпрота в Чёрном море наблюдается в ноябре (Klimova, Podrezova, 2018). Расширился нерестовый сезон теплолюбивых видов рыб. Если результативный нерест массового теплолюбивого вида хамсы Engraulis encrasicolus ранее ограничивался июнем–сентябрём, то в настоящее время личинки хамсы встречаются в планктоне с мая по октябрь (Дехник, 1970; Климова и др., 2019).
Цель работы − изучить особенности видового разнообразия, пространственного распределения ихтиопланктона и трофических взаимоотношений личинок рыб в планктонном сообществе Чёрного моря у Крымского п-ова в весенний и в начале летнего гидрологических сезонов 2017 г. в зависимости от гидрологического режима и состояния кормовой базы рыб
МАТЕРИАЛ И МЕТОДИКА
Материал собран 22.04−06.05 и 14.06− 06.07.2017 г. в шельфовых и глубоководных районах Чёрного моря у берегов Крыма в 94-м и 95-м рейсах НИС “Профессор Водяницкий”. Ихтиопланктон собирали обратно-конической сетью Богорова−Расса (БР 80/113, площадь входного отверстия 0.5 м2, ячея газа 400 мкм). Одновременно с ловами ихтиопланктона отбирали пробы зоопланктона сетью Джеди (диаметр входного отверстия 38 см, ячея газа 140 мкм). Ихтиопланктон и зоопланктон собирали в режиме тотальных вертикальных ловов. На мелководных станциях облавливали слой от поверхности до дна, а в глубоководной части моря − до границы сероводородной зоны, определяемой по изопикне δt = 16.2 усл. ед. по данным зонда “Sea-Bird STDplus”. Пробы для последующей обработки в лаборатории фиксировали 4%-ным раствором формальдегида. Всего собрано и проанализировано 159 проб ихтиопланктона (59 – в 94-м и 100 – в 95-м рейсе) и 40 проб зоопланктона, собранных в двух рейсах.
Идентификацию ихтиопланктона проводили по описанным ранее методикам (Дехник, 1973; Russell, 1976). Видовые названия гидробионтов даны по Всемирному реестру морских видов (WoRMS, 2019). Рассчитывали индексы разнообразия (Shannon, Weaver, 1949; Simpson, 1949; Pielou, 1966; Одум, 1986). Численность ихтиопланктона приведена под 1 м2 морской поверхности, а зоопланктона − в 1 м3. Питание личинок рыб анализировали по методике Дуки и Синюковой (1976). Для перехода от размерных характеристик зоопланктона к единицам биомассы использовали известные для черноморских видов размерно-весовые соотношения (Петипа, 1957; Численко, 1968). Для анализа гидрологического режима и поверхностной циркуляции вод использованы материалы рейсовых наблюдений (Артамонов и др., 2019), космические снимки поверхности моря в инфракрасном (ИК) диапазоне и альтиметрические данные за период с середины апреля до середины июля 2017 г. (Морской портал, 2019), а также данные ежемесячных наблюдений за температурой и соленостью вод в прибрежной зоне Севастополя (Трощенко и др., 2019).
РЕЗУЛЬТАТЫ
Особенности гидрологического режима
Анализ доступной информации о термическом режиме поверхностных вод на примыкающей к Крымскому п-ову акватории Чёрного моря за период, предшествующий нашим съёмкам, показал, что зимний гидрологический сезон 2016−2017 гг. начался в декабре 2016 г. и продолжался до середины апреля 2017 г. Медленное повышение температуры поверхности моря (ТПМ) с градиентами >0.1°С/сут (3.0−3.5°С/мес.), соответствующее весеннему гидрологическому сезону, наблюдалось с середины апреля по конец мая. Интенсивный прогрев поверхностного слоя воды, вызвавший резкий рост ТПМ с градиентами ~0.2°С/сут и характеризующий начало летнего гидрологического сезона, начался лишь в начале июня.
Весенний гидрологический сезон характеризуется перестройкой системы поверхностных течений от зимнего типа циркуляции к летнему. В апреле−мае, согласно геострофическим расчётам и данным инструментальных наблюдений (Артамонов и др., 2019), основными элементами циркуляции поверхностных вод являлись северная периферия Основного Черноморского течения (ОЧТ) и два квазистационарных антициклонических вихря (АЦВ), характерные для этого времени года: Севастопольский (СевАЦВ) – над Большой топографической ложбиной (БТЛ) к западу от Крымского п-ова и Крымский (КрАЦВ) – к югу от м. Меганом (Oguz et al., 1993; Korotaev et al., 2003; Иванов, Белокопытов, 2011; Климова и др., 2019).
При измеренных значениях ТПМ от 8.0−8.5 до 14.5−15.5°С наиболее прогретыми оказались воды ОЧТ в западном секторе исследований (м. Тарханкут–Гераклейский п-ов) и СевАЦВ, а наименее – прибрежной зоны шельфа Крыма от Керченского пролива до м. Сарыч (Артамонов и др., 2019) (рис. 1а). Поверхностные воды северной периферии ОЧТ в центральном (м. Сарыч–Алушта) и восточном (Алушта–Керченский пролив) секторах исследуемой акватории были прогреты лишь до 11.0−11.5°С. На начальной стадии весеннего прогрева термическая структура толщи вод характеризовалась квазиоднородным вертикальным распределением зимнего типа.
Рис. 1.
Распределение температуры (a, в) и солёности (б, г) поверхностного слоя воды Чёрного моря у берегов Крыма, по данным съемок 2017 г.: а, б – апрель; в, г − июнь (по: Артамонов и др., 2019, с изменениями); (⚫) − станции.
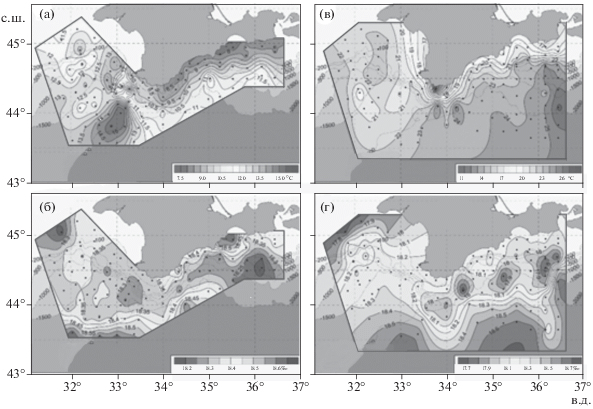
В зонах влияния вод струи ОЧТ верхний слой моря толщиной до 5−10 м занимала прослойка относительно тёплых вод (>10°С) с максимальными вертикальными градиентами температуры. Холодный промежуточный слой (ХПС) в его классическом виде (Иванов, Белокопытов, 2011) наблюдался на большей части исследуемой акватории в виде локальных пятен повышенных и пониженных значений температуры в его ядре. При этом области с минимальными значениями температуры (7.0−7.3°С) соответствовали максимальному заглублению ядра ХПС (до 60−80 м) и были приурочены к зонам вероятной конвергенции вдоль внешней границы струи ОЧТ над свалом глубин и на северной периферии СевАЦВ.
Солёность поверхностных вод варьировала в пределах 18.2−18.7‰. На большей части акватории солёность составляла 18.2−18.4‰, а максимальные значения (до 18.5−18.7‰) отмечены в прибрежной зоне к юго-западу от Феодосийского залива и в юго-западной части полигона на северной периферии западного ядра основного циклонического круговорота (ОЦК) (рис. 1б).
Период выполнения летней съёмки (14.06− 06.07.2017 г.) совпал с начальной фазой летнего гидрологического сезона. Сезонное ослабление ОЧТ и его активное меандрирование вдоль континентального склона, а также интенсивный прогрев поверхностного слоя моря привели к существенной перестройке в циркуляции и термохалинной структуре вод. При сохранении наиболее значимых динамических образований, отмеченных во время выполнения весенней съёмки, активизация циклонического меандра ОЧТ в северо-западной части моря вдоль западного склона БТЛ привела к усилению СевАЦВ и его смещению на восток ложбины. Одновременно отмечено перемещение западного ядра ОЦК на север. В восточном секторе исследований КрАЦВ сместился вдоль границ шельфа на юго-запад к району Алушты.
Наиболее прогретые (до 25−26°С) воды занимали юго-восточную часть исследуемой акватории. Менее прогретые (до 23−24°С) воды соответствовали зоне локализации СевАЦВ. Прибрежная зона вдоль всего Крымского п-ова от Керченского пролива до п-ова Тарханкут характеризовалась пониженными (до 16−18°С) значениями ТПМ. На этом фоне минимальные значения ТПМ (11−12°С) наблюдались в районе м. Сарыч (Артамонов и др., 2019) (рис. 1в). Подобное распределение ТПМ является признаком проявления квазистационарного прибрежного апвеллинга (ПА). Анализ космических снимков в ИК-диапазоне позволил выделить важный элемент поддержания ПА – активную грибовидную структуру − вихревой диполь (ВД). Обнаруженный ВД зародился в северо-восточной части моря южнее Таманского п-ова 5−6 июня в результате резкого усиления северо-восточного ветра по типу “боры”. Перемещение ВД из прибрежной зоны в сторону открытого моря происходило вдоль свала глубин и наблюдалось на космических снимках в ИК-диапазоне вплоть до его полной трансформации на траверзе Ялтинского залива 25−26 июня. Процесс развития и транформации ВД соответствовал классической схеме и данным наблюдений аналогичного явления (Гинзбург, Федоров, 1984; Гришин, Субботин, 1992). В своей тыловой части ВД обеспечил компенсационный подъём подповерхностных вод в прибрежной зоне моря от Анапы до Керченского пролива и усиление ПА вдоль побережья Юго-Восточного Крыма. При этом в самой струе ВД ТПМ отличалась от окружающих вод на 3−4°С.
Запаздывание летнего гидрологического сезона привело к тому, что толщина верхнего квазиоднородного слоя (ВКС) в период съёмки не превышала 10−15 м. При этом максимальные значения наблюдались в зонах СевАЦВ и КрАЦВ, а минимальные (1−5 м) соответствовали зонам подъёма вод в ПА на большей части прибрежной зоны Крыма. Параметры ХПС (толщина, глубина залегания ядра и минимальные значения температуры) также соответствовали положению основных динамических образований: наиболее высокие значения температуры (7.8−8.0°С), минимальные показатели толщины и глубины залегания ядра (40−45 м) были приурочены к зонам подъёма вод в восточном и западном циклонических круговоротах, а минимальные значения температуры (7.0−7.3°С) и максимальные глубины залегания ядра (85−90 м) отмечены в виде локальных пятен вдоль зоны конвергенции на внешней границе ОЧТ и в областях СевАЦВ и КрАЦВ.
В поле распределения поверхностной солёности значительных изменений по сравнению с весенней съёмкой не произошло. Большую часть исследуемой акватории занимали воды верхней черноморской водной массы солёностью 18.0−18.7‰ (Иванов, Белокопытов, 2011). Наименее солёные воды (17.8−17.9‰) наблюдались в северо-западной части полигона к юго-западу от м. Тарханкут и в восточной части полигона в виде цепочки линз распреснённых поверхностных вод вдоль оси перемещения ВД (рис. 1г).
Видовой состав и распределение ихтиопланктона
В период весенней съёмки (22.04−06.05.2017 г.) ихтиопланктон был представлен шестью видами икры и личинок рыб. Средняя численность икры составляла 13.7 шт/м2, а личинок − 14.4 экз/м2. Икра весенненерестующей камбалы-калкана Scophthalmus maeoticus встречалась единично только на шельфе до глубины 150 м от траверза Карадага до м. Тарханкут; причём живые икринки были отмечены только у м. Тарханкут. Личинки теплолюбивых пелагической иглы-рыбы Syngnathus schmidti и бычка-бубыря малого Pomatoschistus minutus были отмечены только в западном секторе исследований на траверзе Каламитского залива и на прибрежной станции у Балаклавы. Ихтиопланктон отсутствовал на одной станции у м. Тарханкут, а также на глубоководных участках юго-западного и центрального секторов съёмки (рис. 2а).
Рис. 2.
Распределение ихтиопланктона у берегов Крыма в апреле−мае (а) и июне−июле (б) 2017 г.: (◼) – пустые пробы, (⚪) – икра, шт/м2; (⚫) – личинки, экз/м2.
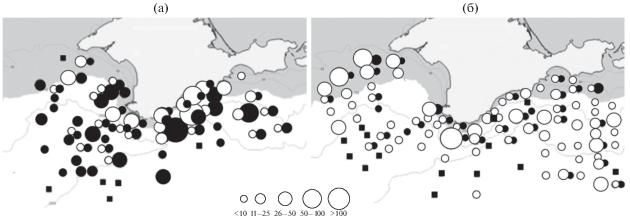
Продолжался нерест умеренноводных шпрота, мерланга и французской тресочки (Klimova, Podrezova, 2018). Средняя численность икры шпрота составляла 12.2 шт/м2, а мерланга не превышала 1.1 шт/м2 (табл. 1). Разновозрастные личинки S. sprattus и T. luscus встречались во всех районах исследования. Шпрот доминировал в ихтиопланктоне, доля его икры составляла 89%, а личинок – 96%. На станциях у Южного берега Крыма максимальная численность икры шпрота составляла 162.8 шт/м2, личинок − 116 экз/м2 (рис. 2а).
Таблица 1.
Видовой состав ихтиопланктона, а также средняя численность икры и личинок рыб у Крымского п-ова (22.04–06.05 и 14.06–06.07.2017 г.), % общей численности
| Видовой состав и другие показатели | Апрель–май | Июнь–июль | ||
|---|---|---|---|---|
| Икра | Личинки | Икра | Личинки | |
| Engraulis encrasicolus (Linnaeus, 1758) | 82.49 | 13.00 | ||
| Sprattus sprattus (Linnaeus, 1758) | 89.05 | 95.84 | 0.34 | 28.00 |
| Merlangius merlangus (Linnaeus, 1758) | 8.03 | 3.03 | 2.00 | |
| Trisopterus luscus (Linnaeus, 1758) | 2.78 | 2.00 | ||
| Atherina boyeri Risso, 1810 | 1.00 | |||
| Syngnathus schmidti Popov, 1927 | 0.69 | 20.00 | ||
| Scorpaena porcus Linnaeus, 1758 | 0.34 | 1.00 | ||
| Lepadogaster candolii Risso, 1810 | 2.00 | |||
| Gobius niger Linnaeus, 1758 | 14.00 | |||
| Pomatoschistus minutus (Pallas, 1770) | 0.69 | 5.00 | ||
| P. pictus (Malm, 1865) | 2.00 | |||
| Aphia minuta (Risso, 1810) | 1.00 | |||
| Ctenolabrus rupestris (Linnaeus, 1758) | 1.00 | |||
| Symphodus rostratus (Bloch, 1791) | 1.00 | |||
| S. ocellatus (Linnaeus, 1758) | 1.00 | |||
| Mugil cephalus Linnaeus, 1758 | 0.17 | |||
| Trachurus mediterraneus (Steindachner, 1868) | 8.75 | |||
| Mullus barbatus barbatus Linnaeus, 1758 | 1.68 | |||
| Pomatomus saltatrix (Linnaeus, 1766) | 0.50 | |||
| Sciaena umbra Linnaeus, 1758 | 0.34 | |||
| Serranus scriba (Linnaeus, 1758) | 1.01 | |||
| Diplodus annularis (Linnaeus, 1758) | 0.67 | 6.00 | ||
| Sarda sarda (Bloch, 1793) | 0.34 | |||
| Scophthalmus maeoticus (Pallas,1814) | 2.92 | 0.34 | ||
| Число видов | 3 | 4 | 13 | 16 |
| Средняя численность, шт/м2/экз/м2 | 13.70 | 14.40 | 11.88 | 2.00 |
| Стандартное отклонение | 29.45 | 18.85 | 20.31 | 3.50 |
В период летней съёмки (14.06–06.07.2017 г.) ихтиопланктон был представлен икрой и личинками 24 видов рыб из 18 семейств. Средняя численность икры составляла 11.9 шт/м2, а личинок 2.0 экз/м2 (табл. 1, рис. 2б). Икра в ихтиопланктоне была представлена 13 видами из 13 семейств. Доминировала икра теплолюбивой хамсы − 82.5% общей численности икры всех встреченных видов, около 9% составляла икра ставриды Trachurus mediterraneus, икра остальных видов рыб встречалась только единично. Доля икры умеренноводных видов рыб (шпрот и мерланг) в сумме составляла 3.4%. Единичные икринки шпрота были отмечены над глубинами от 86 до 900 м, икра мерланга единично встречалась до 100-метровой изобаты.
Личинки были представлены 16 видами рыб из 10 семейств (табл. 1). Личинки теплолюбивых видов из демерсальной икры в сумме не превышали 27%. Доля личинок S. schmidti составляла 20%. Личинки из пелагической икры в сумме составляли 21%, преобладала E. encrasicolus (13%). Доля личинок умеренноводных рыб (шпрот, мерланг и французская тресочка) в сумме составляла 32%. Преобладали личинки шпрота (28%), которые были отмечены над глубинами от 70 до 2000 м. Мерланг встречался только на свале глубин на траверзе Севастополя и Ялты, личинки французской тресочки − над глубинами 1400 и 1800 м на траверзе Карадага и Феодосийского залива.
Численность и видовое разнообразие ихтиопланктона изменялись по мере удаления станций от берега. На шельфе Крымского п-ова (глубины ≤200 м) ихтиопланктон был представлен 20 видами (13 видов икры и 10 видов личинок) рыб. Средняя численность икры составляла 25 шт/м2, личинок − 3.2 экз/м2. В пробах доминировала (94.4%) икра теплолюбивых видов рыб. При этом 77% приходилось на икру хамсы и 12% − на икру ставриды, икра остальных 9 видов встречалась единично. Икра умеренноводных рыб была представлена шпротом и мерлангом. Преобладали личинки теплолюбивых видов рыб, из них личинки из демерсальной икры составляли 46.7%, из пелагической − 36.3%. Личинки умеренноводных рыб были представлены только шпротом, их доля в общей численности личинок на шельфе была достаточно высокой (16%). Средняя численность и число видов в ихтиопланктоне были сопоставимы с показателями июля 1989−1992 гг., когда в период массового нереста теплолюбивых видов рыб на шельфе у Крымского п-ова число видов едва достигало 15, а численность икры и личинок не превышала соответственно 22 шт/м2 и 3 экз/м2. Однако в эти годы (Klimova, 1998) наблюдалась деградация планктонного сообщества в связи с вселением и массовым развитием гребневика Mnemiopsis leidyi.
В глубоководных участках моря (глубины >200 м) ихтиопланктон в основном собирали в последних числах июня и начале июля. Здесь были идентифицированы 12 видов икры и личинок рыб. Средняя численность икры составляла 7.3 шт/м2, личинок − 1.4 экз/м2. Теплолюбивые виды были представлены икрой хамсы (94%) и ставриды (4%), а умеренноводные − шпрота и мерланга (2%). Среди личинок в пробах преобладали личинки теплолюбивых видов рыб (60%). Личинки из демерсальной икры составляли 51%, все они, по-видимому, были вынесены сюда с прибрежных участков шельфа. Доля личинок умеренноводных видов рыб составляла 40% (35% − шпрот).
Для оценки состояния ихтиопланктонных комплексов над разными глубинами были рассчитаны индексы разнообразия (Shannon, Weaver, 1949; Simpson, 1949; Одум, 1986; Pielou, 1966). Наиболее благоприятные условия для эмбрионального и постэмбрионального развития рыб были на шельфе Крымского п-ова (табл. 2). В глубоководных районах число видов в ихтиопланктоне было в два раза ниже, чем на шельфе, индекс видового богатства снизился с 13.84 до 10.63. Здесь наблюдался интенсивный нерест хамсы, доля её икры в пробах превышала 95% (индекс доминирования 0.72), что способствовало снижению показателей индексов видового разнообразия и выровненности.
Зоопланктон и питание личинок рыб
В работе приведены сведения о зоопланктоне как кормовой базе рыб, для которого Кусморская (1950) предложила термин “кормовой зоопланктон”. Используя этот термин, мы подразумеваем всех зоопланктёров, которых потребляют рыбы. В апреле−мае кормовой зоопланктон был представлен обычными черноморскими видами. Обнаружены шесть видов копепод (Calanus euxinus, Pseudocalanus elongatus, Acartia clausi, Paracalanus parvus, Oithona similis и вселенец O. davisae), единично встречалась кладоцера Pleopis polyphemoides. Личинки донных животных были представлены моллюсками (Bivalvia и Gastropoda), полихетами (Polychaeta) и усоногими раками (Cirripedia). Все они были малочисленными в планктоне. Постоянно присутствовали аппендикулярии Oikopleura (Vexillaria) dioica и сагитты Parasagitta setosa, крайне редко встречались коловратки рода Synchaeta. Количественные показатели зоопланктона в весенне-летний период 2017 г. приведены в табл. 3.
Таблица 3.
Численность и биомасса зоопланктона в Чёрном море у берегов Крыма весной и летом 2017 г.
| Показатель | Апрель–май | Июнь–июль | ||
|---|---|---|---|---|
| Шельф (<100 м) | Свал глубин (100–200 м) |
Глубоководные районы (>200 м) | Глубоководные районы (>200 м) | |
| Численность, экз/м3: | ||||
| – копеподы | 1545.5 | 1245.4 | 1285.5 | 839.5 |
| – кормовой зоопланктон | 1658.7 | 1325.2 | 1375.3 | 879.2 |
| Биомасса, мг/м3: | ||||
| – копеподы | 79.91 | 53.98 | 68.88 | 42.60 |
| – кормовой зоопланктон | 103.70 | 88.87 | 197.98 | 96.90 |
На шельфе копеподы составляли 93.2% численности и 70.3% биомассы кормового зоопланктона. На свале глубин их вклад мало изменился по численности (94.0%), а по биомассе снизился до 60.7%. В глубоководной части моря доля копепод в кормовом зоопланктоне по численности осталась практически такой же (93.5%), но существенно уменьшилась по биомассе (34.8%) в пользу присутствующих в пробах крупных сагитт. Численность копепод уменьшилась на свале глубин и оставалась на том же уровне в открытом море. Биомасса копепод была минимальной на свале глубин, увеличиваясь на шельфе и в глубоководных районах моря. Среди копепод доминировали холодолюбивые виды: С. euxinus и P. elongatus, причём первый преобладал по биомассе, а второй − по численности на всей исследованной акватории.
Видовой состав зоопланктона в глубоководной части моря в июне−июле 2017 г. мало изменился. Появилась тепловодная копепода Centropages ponticus, которая встречалась единично и составляла, как и циклопоиды O. davisae, доли процента численности копепод. Как и весной, существенную часть кормового зоопланктона составляли копеподы − 95.5% численности и 44% биомассы. Среди копепод по-прежнему доминировали холодолюбивые виды – С. euxinus и P. elongatus, причём, как и весной, первый вид преобладал по биомассе, второй – по численности. Более половины биомассы кормового зоопланктона приходилось на сагитты (55.8%), среди которых преобладали крупные экземпляры. В целом численность и биомасса копепод, как и всего кормового зоопланктона, в глубоководной части моря летом оказалась ниже, чем весной. Обращает на себя внимание низкая численность мелкоразмерной фракции рачкового зоопланктона летом. В частности, науплиусы копепод отряда Calanoida весной составляли 30.2% численности копепод, тогда как летом их доля снизилась до 19.0%.
В апреле−мае 2017 г. в ихтиопланктонных пробах доминировали личинки шпрота. Опубликованные данные о размерно-весовом составе и особенностях питания личинок шпрота на шельфе и в глубоководной части Чёрного моря у Крымского п-ова относятся к марту−апрелю 1986 г. (Ткач и др., 1991). Для сравнительного анализа размерного состава и питания личинок шпрота весной 2017 и 1986 гг. мы распределили личинок на три размерные группы, аналогичные приведённым в упомянутой работе (табл. 4). Средняя длина личинок в этих размерных группах в апреле−мае 2017 г. оказалась больше, чем весной 1986 г. По данным Дехник (1973), в марте−апреле шпрот обычно завершает нерест. В 1986 г. доля личинок младшей возрастной группы (3.5–10.0 мм) составляла только 5%. В апреле−мае 2017 г. интенсивный нерест шпрота продолжался, о чём свидетельствует высокая доля (80%) личинок TL ≤ 10 мм в общей численности личинок.
Таблица 4.
Размерный состав личинок шпрота Sprattus sprattus и число личинок с пищей в 1986 и 2017 гг.
| Показатель | Март–апрель 1986 г. | Апрель–май 2017 г. | Июнь–июль 2017 г. | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Ткач и др., 1991 | Наши данные | ||||||||
| I | II | III | I | II | III | I | II | III | |
| Число личинок, экз. | 18 | 84 | 258 | 308 | 64 | 13 | 3 | 12 | 4 |
| Доля личинок, % | 5 | 23 | 72 | 80 | 16 | 4 | 16 | 63 | 21 |
| Средняя длина (TL), мм | 4.7 | 10.8 | 16.9 | 5.6 | 12.7 | 18.1 | 5.1 | 13.4 | 18.2 |
| Личинки с пищей в кишечнике: | |||||||||
| – число особей, экз. | 9 | 6 | 38 | 29* | 36 | 6 | 1* | 10 | 4 |
| – доля, % особей в группе | 50 | 7 | 15 | 14 | 56 | 46 | 33 | 83 | 100 |
Весной 2017 г. основными объектами питания личинок шпрота были ювенильные стадии копепод, в основном Calanoida, которые встречались в кишечниках в сильно переваренном виде. Число копепод в одном кишечнике варьировало в пределах 1−21 экз., их размер − 0.15−0.35 мм. Кроме того, в пищевом комке в небольшом количестве встречались яйца гидробионтов (1−4 шт. на один кишечник). Доля личинок с пищей в размерных группах II и III была выше, чем в 1986 г. (табл. 4). Низкую долю личинок с пищей в размерной группе I в 2017 г. можно объяснить высокой численностью в сборах личинок TL ≤ 4.3 мм, у которых, согласно данным Дехник (1973), ещё нет ротового отверстия.
Видовой состав объектов питания личинок шпрота в 1986 и 2017 гг. несколько различался. В марте–апреле 1986 г. (Ткач и др., 1991) основной их пищей были копеподы Oithona nana, P. elongatus, Calanus helgolanticus (в настоящее время С. euxinus), P. parvus ювенильных и взрослых стадий развития; при этом науплиусы О. nana составили от 14.3 до 75.0% числа всех потреблённых объектов. В 2017 г. виды семейства Oithonidae не обнаружены в кишечниках личинок шпрота, что связано с исчезновением из планктона массового круглогодичного вида О. nana (Загородняя, Скрябин, 1995), а вселенец 2000-х гг. – O. davisae (Загородняя, 2002) – массового развития достигает в тёплое время года (Темных и др., 2012). В период весенней съёмки O. davisae была обнаружена только на нескольких станциях; её численность была крайне низкой и составляла в среднем на шельфе и в глубоководной части моря соответственно 0.33 и 1.70 экз/м3.
Питание личинок рыб в июне–июле 2017 г. изучено у личинок (70 экз.), относящихся к 12 видам. Личинки шпрота (19 экз.) были представлены широким размерным диапазоном (TL 1.7−20.0 мм); их средняя длина была сопоставима с таковой в апреле–мае 2017 г., но больше, чем весной 1986 г. (табл. 4). В кишечниках личинок шпрота отмечены копеподы (Calanoida) ювенильных стадий − от 1 до 7 экз. на один кишечник. Из 18 личинок пелагической иглы, пойманных в глубоководной части моря (глубины >200 м), у 2 экз. (TL 8.2 и 20.0 мм) пища в кишечниках не обнаружена; у остальных личинок (TL 14.2–20.0 мм) в пищевом комке идентифицированы копеподы Calanoida размером 0.15−0.58 мм − 1−10 экз. на один кишечник. У иглы-рыбы TL 14.6 мм, пойманной на меньших глубинах (≤200 м), в кишечнике идентифицированы 6 экз. копепод (Calanoida) 0.2−0.4 мм. У личинок морского карася Diplodus annularis (5 экз. TL 3.5−4.4 мм), пойманных на шельфе (<200 м), в кишечниках обнаружены копеподы ювенильных стадий размером 0.12−0.35 мм и единичные яйца гидробионтов. У 10 личинок семейства Gobiidae (TL 3.7−10.0 мм) в пищевом комке, кроме копепод (Calanoida), отмечены Cladocera sp. и яйца гидробионтов; у 6 личинок TL 2.6−5.0 мм пищевые объекты не обнаружены. Личинки остальных видов рыб были представлены единичными экземплярами, качественный состав содержимого кишечников которых практически не отличался от преобладающих в пробах у личинок других видов и был представлен в основном копеподами ювенильных стадий.
ОБСУЖДЕНИЕ
Первая съёмка (22.04−06.05.2017 г.) соответствовала завершению нереста умеренноводных и началу нерестового сезона теплолюбивых видов рыб, вторая съёмка (14.06−06.07.2017 г.) − периоду начала активного нереста теплолюбивых видов рыб. Анализ серии последовательных космических снимков в ИК-диапазоне (Морской портал, 2019) позволил изучить динамику процесса прогрева поверхностных вод на разных этапах гидрологических сезонов и объяснить выявленные особенности видового состава и пространственного распределения ихтиопланктона.
На начальном этапе весенней съёмки диапазон изменчивости ТПМ составил 8−12°С: минимальные значения ТПМ (8−9°С) наблюдались в прибрежной зоне Крыма от Керченского пролива до Гераклейского п-ова, а максимальные (11−12°С) – на акватории Каламитского залива. К концу съёмки прогрев верхних слоёв воды привёл к пространственной перестройке поля ТПМ. При диапазоне изменчивости ТПМ 9−15°С наиболее прогретыми остались акватория Каламитского залива и воды ОЧТ в западном секторе исследований с резкой границей от м. Тарханкут в юго-западную часть моря, а наиболее холодные воды отмечены в восточном секторе исследований.
В период весенней ихтиопланктонной съёмки теплолюбивые виды были обнаружены только в наиболее прогретых водах на траверзе Каламитского залива. На шельфе и в глубоководных районах моря Крымского п-ова от Гераклейского п-ова до Керченского пролива температура воды была благоприятной для нереста умеренноводных видов рыб. В пробах доминировали икра и личинки шпрота. На траверзе Южного берега Крыма максимальная численность икры шпрота составляла 162.8 шт/м2, а личинок − 116 экз/м2. О массовом результативном нересте шпрота свидетельствовала и высокая доля личинок младшей возрастной группы (80%).
Состояние кормовой базы в районе исследований способствовало выживанию личинок шпрота, что подтверждается низкой долей личинок с пустым кишечником. На шельфе и в глубоководных районах исследований преобладали копеподы (>90% численности кормового зоопланктона); среди них доминировали холодноводные виды − C. euxinus и P. elongatus, которые обычно составляют основу пищи шпрота. Доля мелкоразмерной фракции в кормовом зоопланктоне превышала 50%. В кишечниках личинок шпрота преобладали копеподы ювенильных стадий, в основном Calanoida, чьи науплиусы составляли 30% численности мелкоразмерной фракции кормового зоопланктона. Сравнительно высокая биомасса в глубоководных участках моря крупных хищных сагитт не оказывала существенного влияния на численность рачкового зоопланктона, так как сагитту активно поедает взрослый шпрот. По данным Чаянова (1958), доля сагитт в кишечниках шпрота достигала 90%.
Период летней съёмки соответствовал переходу от весеннего к летнему гидрологическому сезону и сопровождался резким ростом ТПМ и формированием летнего типа термической стратификации (Артамонов и др., 2019). Пространственно-временны́е изменения в характере распределении ТПМ происходили в соответствии с региональной инерционностью прогрева толщи вод и с влиянием разных квазистационарных (АЦВ и ОЦК) и нестационарных (ПА и ВД) динамических структур. В середине июня диапазон изменчивости ТПМ составлял 18−22°С с максимальными значениями на большей части исследуемой акватории, включая ОЧТ, СевАЦВ и КрАЦВ, а минимальными – в узкой прибрежной зоне Крыма от Керченского пролива до Гераклейского п-ова, как следствие проявления “скрытого” ПА. К началу июля ТПМ повысилась до 19−26°С. Наиболее прогретыми оказались воды из системы ОЧТ в восточной части полигона, при этом в прибрежной зоне Крыма ТПМ увеличилась до 23−24°С. Минимальными значениями ТПМ (19−20°С) характеризовались северные периферии западного и восточного ядер ОЦК. В период съёмки максимальная толщина ВКС не превышала 10−15 м, а минимальная в зонах апвеллинга снижалась до 1−5 м.
Нерест теплолюбивых видов рыб и ранние стадии их развития проходят исключительно в пределах ВКС, где температура воды благоприятна для эмбрионального и постэмбрионального развития рыб. В шельфовых и глубоководных районах Чёрного моря у Крымского п-ова в ихтиопланктоне были идентифицированы 24 вида рыб. Видовой состав ихтиопланктона соответствовал началу летнего нерестового сезона, при этом средняя численность икры (11.9 шт/м2) и личинок (2.0 экз/м2) были сравнительно низкими: например, во II декаде июня 2016 г. при том же видовом составе средняя численность икры была вдвое, а личинок – в пять раз выше (Игнатьев и др., 2017). В глубоководных районах моря преобладали личинки умеренноводных (40%) и теплолюбивых видов рыб из демерсальной икры (51%), пойманные в основном в северо-восточном секторе исследований. Вынос личинок теплолюбивых видов рыб (обитателей прибрежных акваторий Чёрного моря) в глубоководные районы исследований, вероятно, произошёл благодаря активной грибовидной структуре (ВД), которая образовалась в I декаде июня и перемещалась вдоль свала глубин в сторону открытого моря вплоть до полной трансформации на траверзе Ялты в III декаде июня. Её перемещение сопровождалось компенсационным подъёмом подповерхностных вод в прибрежной зоне моря от Анапы до Керченского пролива и усилением прибрежного апвеллинга вдоль юго-восточного побережья Крыма, что привело к снижению численности икры и личинок теплолюбивых видов рыб и продолжению результативного нереста шпрота.
В летний период численность личинок оказалась существенно ниже, чем в весенний, что, вероятно, связано с особенностями температурного режима моря в связи с запаздыванием летнего гидрологического сезона. Июнь 2017 г. был холодным для эмбрионального развития теплолюбивых рыб. В кормовом зоопланктоне по-прежнему доминировали холодолюбивые виды – С. euxinus и P. elongatus. Известно, что виды холодолюбивого комплекса имеют преимущественное развитие в весенний период, а в отдельных случаях и в летний (Грезе, Федорина, 1979), что мы и наблюдали в июне 2017 г. Вероятно, шпрот уже завершал свой нерест и мигрировал в прибрежные акватории моря на летний нагул (Алеев, 1958), так как его икра и личинки встречались единично. В отсутствие хищников и конкурентов в питании доля крупных сагитт в биомассе кормового зоопланктона возросла до 55.8%. По сравнению с весенним сезоном исследований численность и биомасса рачкового зоопланктона в глубоководных районах снизилась в 1.5 раза, а доля науплиусов копепод составляла всего 19% численности Calanoida. Снижение мелкоразмерной фракции в кормовом зоопланктоне, по-видимому, послужило отрицательным фактором для выживания личинок прибрежных видов рыб, вынесенных в глубоководные районы исследований.
ЗАКЛЮЧЕНИЕ
В апреле−мае 2017 г. диапазон изменчивости ТПМ составлял 8–15°С. Более прогретыми оказались воды Каламитского залива и воды ОЧТ в западном секторе исследований с субмеридиональной границей от м. Тарханкут. Более холодные воды отмечены в прибрежной зоне Крыма от Гераклейского п-ова до Керченского пролива. При низких значениях температуры воды вдоль Крымского п-ова наблюдался активный нерест умеренноводного шпрота. Теплолюбивые виды ихтиопланктона (икра камбалы-калкана, личинки бычков и иглы-рыбы) встречались только в западном секторе исследований, где температура поверхности воды в море достигала 15°С.
В июне−начале июля 2017 г. из-за запаздывания летнего гидрологического сезона толщина верхнего квазиоднородного слоя в среднем не превышала 10−15 м, а в прибрежье в зонах влияния “скрытого” апвеллинга сокращалась до 1−5 м. Средняя численность икры и личинок теплолюбивых видов рыб была значительно ниже, чем в июне 2016 г. Доля личинок умеренноводных видов рыб в среднем составляла 32%, а в глубоководных районах достигала 40%. В I декаде июня 2017 г. резкое усиление северо-восточного ветра привело к образованию активной грибовидной структуры (ВД) в прибрежной зоне к югу от Таманского п-ова и выносу личинок прибрежных видов рыб из демерсальной икры в глубоководные районы, где их доля в общей численности личинок рыб составила 51%.
В период исследований весной и летом 2017 г. не выявлено существенных различий в качественном составе пищи личинок разных видов рыб на шельфе и в глубоководных районах моря. В оба сезона в питании личинок рыб преобладали копеподы отряда Calanoida ювенильных стадий, копеподы взрослые и старших стадий доминировали в зоопланктоне. Одновременное присутствие в пробах личинок широкого размерного диапазона умеренноводных и теплолюбивых видов рыб, наличие личинок с разным типом питания, а также низкая доля личинок с пустыми кишечниками косвенно свидетельствуют о благоприятных условиях для их выживания. Это подтверждает состояние кормовой базы, так как, несмотря на снижение количественных показателей кормового зоопланктона летом в глубоководных районах моря, отмечено преобладание в планктоне копепод с относительно высокой долей науплиусов.
Список литературы
Алеев Ю.Г. 1958. О биологии и хозяйственном значении черноморского шпрота Sprattus sprattus phalericus (Risso) // Тр. Севастоп. биостанции. Т. 10. С. 90–107.
Артамонов Ю.В., Федирко А.В., Скрипалева Е.А. и др. 2019. Структура вод в зоне Основного Черноморского течения весной и летом 2017 г. (94-й, 95-й рейсы НИС “Профессор Водяницкий”) // Экол. безопасность прибрежной и шельфовой зон моря. № 1. С. 16−28. https://doi.org/10.22449/2413-5577-2019-1-16-28
Гинзбург А.И., Фёдоров К.Н. 1984. Грибовидные течения в океане (по данным спутниковых изображений) // Исследования Земли из космоса. № 3. С. 18−26.
Грезе В.Н., Федорина А.И. 1979. Численность и биомасса зоопланктона // Основы биологической продуктивности Чёрного моря / Под ред. Грезе В.Н. Киев: Наук. думка. С. 157−164.
Гришин Г.А., Субботин А.А. 1992. Изучение вихревого диполя в Чёрном море по спутниковым данным и судовым измерениям // Исследование Земли из космоса. № 5. С. 56–64.
Дехник Т.В. 1970. Распределение и численность пелагических икринок и личинок // Размножение и экология массовых рыб Чёрного моря на ранних стадиях онтогенеза. Киев: Наук. думка. С. 59−88.
Дехник Т. В. 1973. Ихтиопланктон Чёрного моря. Киев: Наук. думка, 234 с.
Дука Л.А., Синюкова В.И. 1976. Руководство по изучению питания личинок и мальков морских рыб в естественных и экспериментальных условиях. Киев: Наук. думка, 133 с.
Загородняя Ю.А. 2002. Oithona brevicornis в Севастопольской бухте − случайность или новый вселенец в Черное море? // Экология моря. Вып. 61. С. 43.
Загородняя Ю.А., Скрябин В.А. 1995. Современные тенденции изменений зоопланктона в прибрежных районах Черного моря // Исследования шельфовой зоны Азово-Черноморского бассейна. Севастополь: Изд-во МГИ НАНУ. С. 87−95.
Иванов В.А., Белокопытов В.Н. 2011. Океанография Чёрного моря. Севастополь: ЭКОСИ-Гидрофизика, 212 с.
Игнатьев С.М., Мельников В.В., Климова Т.Н. и др. 2017. Макро- и ихтиопланктон прибрежных районов Крыма летом 2016 г. // Системы контроля окружающей среды. Вып. 8 (28). Севастополь: ЭКОСИ-Гидрофизика. С. 93−101.
Климова Т.Н., Субботин А.А., Мельников В.В. и др. 2019. Пространственное распределение ихтиопланктона у Крымского полуострова в летний нерестовый сезон 2013 г. // Мор. биол. журн. Т. 4. № 1. С. 63−80.https://doi.org/10.21072/mbj.2019.04.1.06
Кусморская А.П. 1950. О зоопланктоне Чёрного моря // Тр. АзЧерНИРО. Вып. 14. С. 177−214.
Морской портал. 2019. Архив данных по Чёрному морю. http://dvs.net.ru/mp/data/main_ru.shtml. Version 09/2019
Одум Ю. 1986. Экология. Т. 2. М.: Мир, 376 с.
Петипа Т.С. 1957. О среднем весе основных форм зоопланктона Чёрного моря // Тр. Севастоп. биостанции. Т. 9. С. 39−57.
Расс Т.С. 1965. Рыбные ресурсы европейских морей СССР и возможности их пополнения акклиматизацией. М.: Наука, 107 с.
Темных А.В., Токарев Ю.Н., Мельников В.В., Загородняя Ю.А. 2012. Суточная динамика и вертикальное распределение пелагических Copepoda в открытых водах у юго-западного Крыма (Чёрное море) осенью 2010 г. // Мор. экол. журн. Т. 11. № 2. С. 75−84.
Ткач А.В., Глущенко Т.И., Загородняя Ю.А. 1991. Питание личинок и мальков черноморского шпрота Sprattus sprattus phalericus (Risso) в ранне-весенний период // Экология моря. Вып. 37. С. 56−61.
Трощенко О.А., Субботин А.А., Еремин И.Ю. 2019. Изменчивость основных лимитирующих факторов среды в процессе выращивания двустворчатых моллюсков на ферме в районе Севастополя // Уч. зап. КФУ. Сер. география и геология. Т. 5. № 71. № 2. С. 308−321.
Чаянова Л.А. 1958. Питание черноморского шпрота // Тр. ВНИРО. Т. 36. С.106−127.
Численко Л.Л. 1968. Номограммы для определения веса водных организмов по размерам и форме тела (морской зообентос и планктон). Л.: Наука, 106 с.
Alonso-Fernández A. 2011. Bioenergetics approach to fish reproductive potential: case of Trisopterus luscus (Teleostei) on the Galician Shelf (NW Iberian Peninsula): Ph. D. Thesis. Vigo, Spain: Univ. Vigo, 280 p.
Auth T.D., Daly E.A., Brodeur R.D., Fisher J.L. 2017. Phenological and distributional shifts in ichthyoplankton associated with recent warming in the northeast Pacific Ocean // Global Change Biol. V. 24. № 1. P. 259−272. https://doi.org/10.1111/gcb.13872
Edwards M., Richardson A.J. 2004. Impact of climate change on marine pelagic phenology and trophic mismatch // Nature. V. 430. P. 881−884. https://doi.org/10.1038/nature02808
Klimova T.N. 1998. Dynamics of species composition and numbers of ichthyoplankton of the Black Sea in the area of the Crimea in the summer periods of 1988−1992 // J. Ichthyol. V. 38. № 8. P. 645−651.
Klimova T.N., Podrezova P.S. 2018. Seasonal distribution of the Black Sea ichthyoplankton near the Crimean Peninsula // Region. Stud. Mar. Sci. V. 24. P. 260–269. https://doi.org/10.1016/j.rsma.2018.08.013
Korotaev G., Oguz T., Nikiforov A., Koblinsky C. 2003. Seasonal, interannual, and mesoscale variability of the Black Sea upper layer circulation derived from altimeter data // J. Geophys. Res. V. 108. № C4. P. 19(1)–19(15). https://doi.org/10.1029/2002JC001508.
Oguz T., Latun V.S., Latif M.A. et al. 1993. Circulation in the surface and intermediate layers of the Black Sea // Deep Sea Res. V. 40. Pt. 1. № 8. P. 1597–1612. https://doi.org/10.1016/0967-0637(93)90018-X.
Pielou E.C. 1966. Species-diversity and pattern- diversity in the study of ecological succession // J. Theor. Biol. V. 10. P. 370–383.
Russell F.S. 1976. The eggs and planktonic stages of British marine fishes. London et al.: Acad. Press, 524 p.
Shannon C.E., Weaver W. 1949. The mathematical theory of communication. Urbana: Univ. Illinois Press, 117 p.
Simpson E.H. 1949. Measurement of diversity // Nature. V. 163. P. 688. https://doi.org/10.1038/163688a0
Visser M.E., Both C. 2005. Shifts in phenology due to global climate change: the need for a yardstick // Proc. R. Soc. Ser. B. Biol. Sci. V. 272. № 1581. P. 2561–2569. DOI: 10/1098/ rspb.2005.3356.
WoRMS. 2019. World register of marine species. http://www.marinespecies.org/index.php. Version 11/2019. https://doi.org/10.14284/170.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


