Вопросы ихтиологии, 2021, T. 61, № 2, стр. 185-193
Популяционно-генетическая структура тихоокеанской сельди Clupea pallasii в северо-западной части Тихого океана на основе микросателлитного анализа
Д. С. Курносов 1, *, С. Ю. Орлова 2
1 Тихоокеанский филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – ТИНРО
Владивосток, Россия
2 Всероссийский научно-исследовательский институт
рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
* E-mail: denkurnos@mail.ru
Поступила в редакцию 18.03.2020
После доработки 22.07.2020
Принята к публикации 24.07.2020
Аннотация
Исследована популяционно-генетическая структура тихоокеанской сельди Clupea pallasii в северо-западной части Тихого океана на основе анализа полиморфизма 11 микросателлитных локусов. Обнаружены достоверные генетические различия между озёрными и морскими формами сельди (FST 0.0197−0.0521). Сельди озёр Айнское и Вилюй являются отдельными популяциями. Выборки морских форм по индексу генетической дифференциации FST (0.0086−0.0218) разделяются на две географические группы – группу Охотского и Японского морей и группу Берингова моря. Внутри этих групп дифференцированы пять популяционных группировок: 1) зал. Петра Великого, 2) северо-западной части Охотского моря (охотская), 3) зал. Шелихова (гижигинская), 4) Карагинского залива, 5) северной части Берингова моря. В период высокой численности у сельди отсутствуют чёткие экологические границы, её популяционная структура может измениться за несколько поколений на значительной части ареала. Современную популяционную структуру морских форм сформировали депрессия численности в Беринговом море и вспышка численности в Охотском море.
Основное направление филогеографических исследований – изучение влияния исторических событий и современных процессов на распространение и популяционную структуру видов (Avice, 2000). На данный момент популяционная структура пелагических морских рыб изучена недостаточно хорошо (Jorgensen et al., 2005; Machado-Schiaffino et al., 2009; Савенков и др., 2018; Orlova et al., 2019b). Отсутствие барьеров и совместные зоны миграций могут облегчить обмен генами между популяциями и усложнить определение границ между ними (Palumbi, 1994). Факторы, которые могут ограничить поток генов у таких популяций, условно можно разделить на несколько типов: исторические (малые ледниковые периоды, изменение уровня моря), поведенческие (период нереста и нагула) и гидрологические (современные океанические течения, температура, солёность) (Shaw et al., 1999; Bekkevold et al., 2005; Jorgensen et al., 2005; Skarstein et al., 2007). Слабая выраженность этих факторов во время роста численности среди популяций пелагических рыб также усложняет определение их популяционной структуры (Строганов и др., 2013; Савенков и др., 2014; Orlova et al., 2019b; Smirnova et al., 2019).
Тихоокеанская сельдь Clupea pallasii – неритическая рыба, обитает в пределах континентального шельфа и над глубинами в смежных районах, образуя локальные стада, которые различаются численностью, биологическими и экологическими характеристиками, районами нереста и нагула (Андрияшев, Чернова, 1994; Ivshina, 2000; Науменко, 2001). Ареал этого вида крайне широк: от Берингова пролива по шельфу Евразийского континента до Корейского п-ова, а по шельфу Североамериканского континента до Сан-Диего (Калифорния) (Науменко, 2001).
Ранее полагали, что большинство нерестовых скоплений тихоокеанской сельди представляют собой отдельные популяции, различающиеся по морфологическим признакам, а также времени и месту нереста (Фролов, 1964; Науменко, 2001; Смирнов и др., 2005). Однако с развитием генетических методов картина пространственного распределения популяций северо-западной части Тихого океана существенно изменилась. Первым этапом в исследованиях популяционной структуры сельди стало применение нового вида маркеров (Рыбникова и др., 1983; Рыбникова, 1985). Полученные на основании анализа аллозимов результаты демонстрировали однородность выборок северной и юго-западной части Японского моря. Аналогичный результат, свидетельствующий об отсутствии локальных популяций в Японском море и северной части Охотского моря, был получен и при исследовании полиморфизма митохондриальной ДНК (мтДНК) (Горбачев и др., 2011; Grant et al., 2012; Liu et al., 2012; Shimizu et al., 2018; Orlova et al., 2019a). В результате исследований с использованием микросателлитных локусов (Liu et al., 2012; Семенова и др., 2012; Курносов и др., 2016) сформировались две точки зрения на популяционную структуру сельди. Согласно первой дифференциация между популяциями отсутствует или предполагается наличие всего двух суперпопуляций, разделённых границей в северо-западной части Берингова моря, и присутствие нескольких малочисленных стад на периферии ареала (Liu et al., 2012). Вторая точка зрения предполагает наличие более сложной популяционной структуры (Beacham et al., 2008; Курносов и др., 2016; Семенова и др., 2018). В предыдущих исследованиях (Курносов и др., 2016; Orlova et al., 2019a) мы показали наличие дифференцированных озёрных популяций сельди, а также генетические различия между популяциями в Охотском и Беринговом морях.
Цель работы − изучить популяционную структуру тихоокеанской сельди северо-западной части Тихого океана (оценка генетического разнообразия внутри Японского, Охотского и Берингова морей) с использованием микросателлитных ДНК-маркеров.
МАТЕРИАЛ И МЕТОДИКА
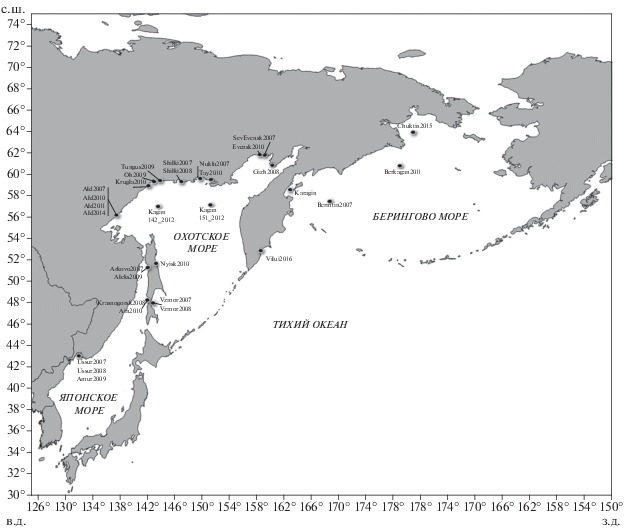
Образцы тканей от 1245 особей были собраны в 31 локации Японского, Охотского и Берингова морей в 2007−2016 гг. (табл. 1, рис. 1). Пять выборок были собраны в море в преднерестовый период (Kagan142_2012, Kagan151_2012, Chuktin2015, Berkagan2011, Bermtin2007), остальные на нерестилищах.
Таблица 1.
Места сбора и объём выборок тихоокеанской сельди Clupea pallasii
| № | Название выборки | Место сбора | Год | Координаты | Число проб | |
|---|---|---|---|---|---|---|
| с.ш. | в.д. | |||||
| Японское море | ||||||
| 1 | Ussur2007 | зал. Уссурийский | 2007 | 43°19′1′′ | 132°32′6′′ | 37 |
| 2 | Ussur2008 | То же | 2008 | 43°19′1′′ | 132°32′6′′ | 41 |
| 3 | Amur2009 | зал. Амурский | 2009 | 43°29′2′′ | 131°48′0′′ | 44 |
| 4 | Krasnogsk2008 | пос. Красногорск | 2008 | 48°24′6′′ | 142°04′8′′ | 42 |
| 5 | Ain2010 | оз. Айнское, Сахалин | 2010 | 48°29′4′′ | 142°03′0′′ | 42 |
| 6 | Arkovo2007 | зал. Александровский | 2007 | 50°57′0′′ | 142°10′2′′ | 41 |
| 7 | Aleks2009 | То же | 2009 | 50°57′0′′ | 142°10′2′′ | 43 |
| Охотское море | ||||||
| 8 | Vzmor2007 | зал. Терпения | 2007 | 47°51′0′′ | 142°34′2′′ | 42 |
| 9 | Vzmor2008 | То же | 2008 | 47°51′0′′ | 142°34′2′′ | 38 |
| 10 | Nyisk2010 | зал. Ныйский | 2010 | 51°54′6′′ | 143°10′8′′ | 43 |
| 11 | Ald2007 | зал. Алдома | 2007 | 56°48′0′′ | 138°29′4′′ | 38 |
| 12 | Ald2010 | То же | 2010 | 56°48′0′′ | 138°29′4′′ | 23 |
| 13 | Ald2011 | –“– | 2011 | 56°48′0′′ | 138°29′4′′ | 48 |
| 14 | Ald2014 | –“– | 2014 | 56°48′0′′ | 138°29′4′′ | 43 |
| 15 | Kagan142_2012 | открытые воды | 2012 | 57°11′4′′ | 142°45′6′′ | 48 |
| 16 | Kagan151_2012 | То же | 2012 | 57°14′4′′ | 151°37′8′′ | 45 |
| 17 | Krugla2010 | б. Круглая | 2010 | 59°12′6′′ | 142°34′8′′ | 46 |
| 18 | Oh2009 | пос. Охотск | 2009 | 59°20′4′′ | 143°13′2′′ | 32 |
| 19 | Tungus2009 | б. Тунгусская | 2009 | 59°21′6′′ | 145°34′2′′ | 38 |
| 20 | Shilki2007 | б. Шилки | 2007 | 59°16′2′′ | 147°37′2′′ | 46 |
| 21 | Shilki2008 | То же | 2008 | 59°16′2′′ | 147°37′2′′ | 42 |
| 22 | Tay2010 | зал. Амахтонский | 2010 | 59°42′0′′ | 149°22′8′′ | 22 |
| 23 | Nukla2007 | То же | 2007 | 59°10′2′′ | 151°30′0′′ | 47 |
| 24 | SevEvensk2007 | зал. Шелихова | 2007 | 61°45′0′′ | 157°33′0′′ | 48 |
| 25 | Gizh2008 | То же | 2008 | 61°45′6′′ | 160°1′8′′ | 41 |
| 26 | Evensk2010 | –“– | 2010 | 61°51′0′′ | 159°9′0′′ | 30 |
| 27 | Vilui2016 | оз. Вилюй, Камчатка | 2016 | 52°49′2′′ | 158°32′4′′ | 39 |
| Берингово море | ||||||
| 28 | Karagin | зал. Карагинский | 2008 | 57°52′2′′ | 162°06′6′′ | 39 |
| 29 | Chuktin2015 | открытые воды | 2015 | 63°18′6′′ | 175°26′4′′ | 29 |
| 30 | Berkagan2011 | То же | 2011 | 61°01′0′′ | 179°18′0′′ | 46 |
| 31 | Bermtin2007 | –“– | 2007 | 57°41′4′′ | 165°00′0′′ | 42 |
Рис. 1.
Карта сбора выборок (⚫) тихоокеанской сельди Clupea pallasii: Японское море: Ussur2007, Ussur2008 – Уссурийский залив, Amur2009 – Амурский залив, Krasnogsk2008 – пос. Красногорск, Ain2010 – оз. Айнское, Сахалин; Arkovo2007, Aleks2009 – зал. Александровский; Охотское море: Vzmor2007, Vzmor2008 – зал. Терпения, Nyisk2010 – зал. Ныйский; Ald2007, Ald2010, Ald2011, Ald2014 – зал. Алдома; Kagan142_2012, Kagan151_2012 – открытые воды; Krugla2010 – б. Круглая, Oh2009 – пос. Охотск, Tungus2009 – б. Тунгусская; Shilki2007, Shilki2008 – бух. Шилки; Tay2010, Nukla2007 – зал. Амахтонский; SevEvensk2007, Gizh2008, Evensk2010 – зал. Шелихова; Vilui2016 – оз. Вилюй, Камчатка; Берингово море: Karagin – зал. Карагинский; Chuktin2015, Berkagan2011, Bermtin2007 – открытые воды.
Пробы тканей (кусочек мышечной ткани или грудного плавника) фиксировали в 96%-ном этаноле. Выделение и очистку ДНК проводили с помощью набора для выделения ДНК Wizard SV 96 Genomic DNA Purification System (Promega, США) согласно протоколу фирмы-изготовителя.
Апробировано 19 микросателлитных локусов. По итогам предварительных исследований (Курносов и др., 2016) выбраны 11 наиболее подходящих для дальнейшей работы тетрануклеотидных микросателлитных локусов (табл. 2). Из них четыре локуса ранее были разработаны для исследований атлантической сельди C. harengus. Прямой праймер каждого локуса содержал одну из трёх флуоресцентных меток (HEX, FAM, TAMRA). Праймеры формируют четыре мультиплекса.
Таблица 2.
Характеристика микросателлитных локусов
| Мультиплекс | Локус | Число аллелей |
Размер фрагмента, п.н. | Метка | Температура отжига, °C | Источник информации |
|---|---|---|---|---|---|---|
| Multiplex1 | Cpa113 | 20 | 130–210 | TAMRA | 60 | Olsen et al., 2002 |
| Cpa112 | 14 | 230–310 | R6G | 60 | То же | |
| Cpa108 | 13 | 210–290 | FAM | 60 | –“– | |
| Cha1017 | 6 | 140–180 | FAM | 60 | McPherson et al., 2001 | |
| Multiplex2 | Msild32 | 16 | 160–260 | FAM | 60 | Libungan et al., 2012 |
| Cpa104 | 23 | 160–270 | R6G | 60 | Olsen et al., 2002 | |
| Multiplex3 | Cha1059 | 13 | 40–100 | FAM | 60 | McPherson et al., 2001 |
| Cpa111 | 17 | 220–310 | FAM | 60 | Olsen et al., 2002 | |
| Cpa114 | 18 | 180–260 | R6G | 60 | То же | |
| Multiplex4 | Cpa105 | 21 | 150–270 | R6G | 60 | –“– |
| Cha1202 | 10 | 80–130 | FAM | 60 | McPherson et al., 2001 |
Для проведения реакций амплификации были подобраны следующие условия: денатурация ДНК − 95°С в течение 5 мин. Далее следовали 34 цикла: 15 с денатурации ДНК матрицы при 92°С, 30 с отжига праймеров при 60°С и синтеза новых цепей в течение 1 мин при 72°С. Затем следовала завершающая элонгация 5 мин при 72°С. После проведения полимеразной цепной реакции полученный продукт амплификации микросателлитных локусов в объёме 2 мкл очищали от примесей методом этанол-преципитации (Silva et al., 2001). Электрофоретическое разделение продуктов амплификации проводили с помощью системы капиллярного электрофореза ABI 3100 Genetic Analyzer. Полученные исходные хроматограммы обрабатывали с помощью программного обеспечения GeneMarker software1.2. Оценку индекса генетической дифференциации (FST) и уровней значимости генетических различий осуществляли с помощью программы Arlequin 3.5. GenAlEx 6.41. (Excoffier, Lischer, 2010), визуализацию значений FST проводили с помощью пакета программы R 3.0.0.
Оценку уникальности аллельного состава исследованных выборок по микросателлитным локусам проводили в программе STRUCTURE 2.3.4. для определения принадлежности особей к той или иной популяции (Pritchard et al., 2000). Значение числа популяционных групп задавалось от 1 до 12, повторность была равна 5. Предполагая возможное смешанное происхождение группировок, использовали модель admixture с параметрами LOCOPRIOR, Initial Value of ALPHA−0.08 (Wang, 2017), шагов MCMC 500 000, исключая первые 50 000. Определение оптимального числа кластеров проводили в программе STRUCTURE HARVESTER (Earl, Vonholdt, 2012).
РЕЗУЛЬТАТЫ
Анализ микросателлитных локусов показал высокую степень полиморфизма всех 11 тетрануклеотидных локусов. Наибольшее число аллелей было обнаружено в локусе Cpa104 – 32, наименьшее в Cha1017 – 10. Среднее число аллелей составило 19.6.
Исследованные выборки не показали отклонений от равновесия Харди−Вайнберга по большинству локусов, за исключением разработанных для атлантической сельди C. harengus (Приложение 1 ).
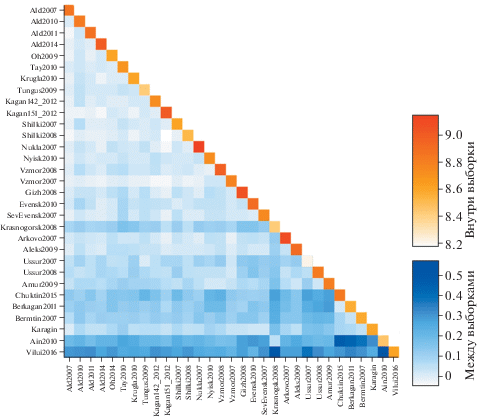
Наибольшее генетическое разнообразие наблюдалось в выборке из Охотского моря (Nukla2007), наименьшее − в выборке Японского моря (Ussur2007). В среднем выборки из Берингова моря обладают меньшим разнообразием, чем выборки из Охотского и Японского морей (рис. 2, Приложение 1 ). Полученные в результате попарной оценки генетической дифференциации значения FST варьировали от 0 до 0.0639 (рис. 2, Приложение 2 ). Максимальные и достоверно значимые значения FST = 0.0639 обнаружены между выборками из озёр Айнское и Вилюй (Ain2010, Vilui2016) и остальными выборками (0.0197−0.0521). Наименьшие значения FST наблюдались между выборками из Охотского моря (Ald2007, Kagan151_2012, Shilki2008). По наибольшему расхождению FST (0.0086−0.0324) морские выборки достоверно разделились на две географические группы: группу Охотского и Японского морей и группу Берингова моря. Среди выборок Охотского моря отдельную группу формируют выборки зал. Шелихова (Gizh2008, Evensk2010, SevEvensk2007), но достоверные отличия FST (от 0 до 0.018) наблюдаются не для всех пар. Среди выборок Японского моря отдельную группу формируют выборки зал. Петра Великого (Amur2009, Ussur2007, Ussur2008), но достоверные отличия FST = 0.0017−0.0324 также наблюдались не для всех пар. В Беринговом море выборка Карагинского залива (Karagin) не имеет достоверных отличий от выборок зал. Шелихова.
Рис. 2.
Диаграмма попарных различий и разнообразия выборок (обозначения выборок см. на рис. 1) тихоокеанской сельди Clupea pallasii.
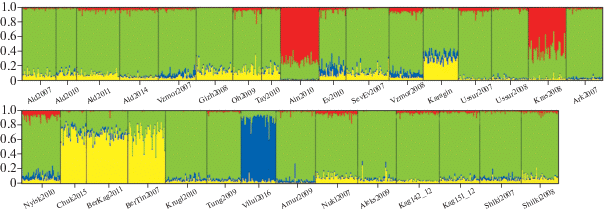
Более детальное деление на группировки было получено при оценке уникальности аллельного состава микросателлитных локусов. Оптимальным является отнесение всех образцов к четырём кластерам. По вероятностям принадлежности особей к этим кластерам выборки объединяются в четыре группировки (рис. 3). Первая группировка включает две выборки – из Японского моря (Krasnogsk2008) и из оз. Айнское (Ain2010). Вторую образует выборка из оз. Вилюй (Vilui2016). Остальные выборки разбились на две большие географические группы: Берингова моря и Японского и Охотского морей.
Рис. 3.
Кластерный анализ выборок тихоокеанской сельди Clupea pallasii на основе алгоритма программы STRUCTURE 2.3.4: разные цвета соответствуют четырём кластерам и отображают вероятность принадлежности к ним особей; обозначения выборок см. на рис. 1.
ОБСУЖДЕНИЕ
При анализе истории исследований популяций атлантической и тихоокеанской сельдей с помощью генетических методов в полученных результатах можно заметить общие для этих видов противоречия. В более ранних работах по изучению популяционной структуры с использованием аллозимов и мтДНК не были обнаружены генетические неоднородности, несмотря на значительный географический масштаб работ (Ryman et al., 1984; Рыбникова, 1985; King et al., 1987; Kornfield, Bagdanowicz, 1987; Dahle, Eriksen, 1990; Пушникова, Рыбникова, 1991; Лапинский и др., 2008; Горбачев и др., 2011; Grant et al., 2012). В исследованиях с применением микросателлитных маркеров была обнаружена генетическая дифференциация между популяциями (Shaw et al., 1999; Sugaya et al., 2008; Liu et al., 2012; Семенова, 2012; Курносов и др., 2016). Во время изучения возможности применения микросателлитных маркеров для генетических исследований рыб было высказано предположение о том, что более высокие показатели мутации (и, как следствие, полиморфизма у микросателлитных маркеров) приводят к повышению эффективности дифференцирования популяций в сравнении с исследованиями, базирующимися на анализе аллозимов и мтДНК (Goudet, 1995; Rousset, Raymond, 1995). Позже это предположение было подтверждено на примерах изучения популяционной структуры и других видов (Estoup et al., 1998; Ruzzante et al., 1998; Shaw et al., 1999).
Полузамкнутый характер Охотского и Японского морей, отделённость Берингова моря Камчатским п-овом и Алеутским архипелагом могут служить барьером, препятствующим смешиванию популяций. Нерест сельди происходит в бухтах и лагунах, икра крепится на водоросли, личинки обитают в районе нерестилищ до полного рассасывания желточного мешка и перехода на активное питание (Фридлянд, 1951; Дарда, 1960). Учитывая все эти факторы, мы ожидали найти генетические различия не только между популяциями, населяющими Японское, Охотское и Берингово моря, но и внутри этих морей. Наибольшие отличия по микросателлитам были получены между выборками из озёр Вилюй и Айнское и всеми морскими выборками. Этот результат согласуется с полученными ранее выводами (Orlova et al., 2019b) о том, что тихоокеанские сельди каждого озера являются в генетическом плане обособленными и могут быть выделены в отдельную группировку озерных форм. Выборка из Японского моря (Krasnogsk2008), собранная рядом с устьем реки, вытекающей из оз. Айнское, вероятно, состоит из смеси озёрной и морской форм сельди, что объясняет её дифференциацию от морской формы и генетическое сходство с озёрной.
Самую крупную группировку формирует сельдь Охотского и Японского морей. Слабая достоверная дифференциация наблюдается только для выборок с самой южной (зал. Петра Великого) и северной (зал. Шелихова) части ареала. Сельдь из этих заливов многие исследователи считают отдельными популяциями (Посадова, 1988; Рыбникова, 1999; Науменко, 2001; Смирнов, 2009; Горбатенко и др., 2013). Подобный результат может быть следствием роста численности популяций северо-западной части Охотского моря начиная с 1995 г. (Мельников, 2005; Антонов и др., 2016). Появление в этом районе сверхурожайных поколений привело к экспансии охотской сельди в Японское море в настоящее время (Shimizu et al., 2018). Это объясняет результат, полученный по образцам сельди, собранным в 1980-х гг. (Рыбникова, 1985; Картавцев и др., 2008), когда численность сельди Охотского моря находилась на низком уровне (Антонов и др., 2016). Авторы сделали выводы о существовании генетической дифференциации тихоокеанской сельди, обитающей в зал. Петра Великого, западного и восточного побережья Сахалина и северной части Охотского моря. Можно предположить, что при низкой численности сельдь образует обособленные локальные стада, обитающие в заливах и не совершающие длительных миграций. Численность сельди заливов Петра Великого и Шелихова в последние десятилетия находится на низком уровне (Науменко, 2012). Через некоторое время, учитывая адаптацию вида к условиям окружающей среды через естественный отбор, возможна генетическая дифференциация этих стад. Однако рост численности сельди северо-западной части Охотского моря в последние 25 лет привёл к смешению разных стад и отсутствию чётких генетических различий между сельдью Охотского и Японского моря. Результат этого смешения можно наблюдать в увеличении числа недостоверных различий между выборками из зал. Петра Великого и из Охотского моря. Для выборки 2007 г. (Ussur2007) таких пар обнаружено две, для выборки 2009 г. (Amur2009) − уже пять. Это объясняет и то, что наибольшее генетическое разнообразие мы получили в выборках Сахалина, являющегося контактной зоной для особей, обитающих в этих морях.
Между Охотским морем и северной частью Берингова моря обнаружены достоверные генетические различия по индексу дифференциации (FST 0.0086−0.0218), которые ранее выявили и другие исследователи (Grant et al., 2012; Liu et al., 2012). Подобный разрыв объясняется изоляцией сельди восточной части Берингова моря в период плейстоценового оледенения. По нашим данным, сельдь Берингова моря разбивается на две группы: северной части моря и Карагинского залива. Интересно отметить, что достоверные отличия выборки из Карагинского залива от выборок из зал. Шелихова Охотского моря не обнаружены. Это можно объяснить способностью сельди зал. Шелихова совершать длительные миграции (Правоторова, 1965; Шунтов, 2001). По данным проведённого в 1958−1968 гг. мечения сельди (фондовые материалы МагаданНИРО; Правоторова, 1991), меченые весной в зал. Шелихова особи были обнаружены как в этом заливе (повторно пришли на нерест), так и в Кроноцком заливе, находящемся в 500 км от Карагинского залива. Можно предположить, что в период высокой численности этот миграционный путь с западного побережья Камчатки к восточному привёл сельдь из зал. Шелихова в Карагинский залив. Сельдь Карагинского залива совершает морские миграции только в годы высокой численности (Науменко, 2001), в остальное время её ареал ограничен водами Карагинского и Олюторского заливов. Наличие достоверной генетической дифференциации между группами внутри Берингова моря при небольшом географическом расстоянии согласуется с их низкой численностью (Науменко, 2012; Антонов и др., 2016).
ЗАКЛЮЧЕНИЕ
В результате наших исследований у морских форм тихоокеанской сельди северо-западной части Тихого океана выявлены пять популяционных группировок: зал. Петра Великого, северо-западной части Охотского моря, зал. Шелихова, Карагинского залива и северной части Берингова моря. Популяционную структуру озёрных форм тихоокеанской сельди, учитывая их генетическую обособленность, логично рассматривать отдельно от морских форм. В данном исследовании сельди озёр Айнское и Вилюй рассматриваются в качестве отдельных популяций.
Выявленная популяционная структура является результатом как исторических, так и современных процессов. К историческим процессам относятся: образование озёрных форм сельди во время изменения уровня моря в среднем голоцене (6.0−7.5 тыс. лет назад); формирование популяции сельди в северо-восточной части Берингова моря во время географической изоляции в период плейстоценового оледенения (Жузе, 1962). Современные процессы сформировали низкую пространственно-генетическую дифференциацию, которую мы наблюдаем в настоящее время в Охотском и Японском морях. Активное расселение сельди северо-западной части Охотского моря нивелировало внутривидовую подразделённость на значительной части ареала. Дифференциация популяций заливов Петра Великого и Шелихова наблюдается благодаря их удаленности от зоны экспансии охотоморской сельди и многолетнему состоянию низкой численности. Учитывая способность сельди к расселению и отсутствие чётких экологических границ, можно предположить, что её популяционная структура может измениться за несколько поколений на значительной части ареала.
Список литературы
Андрияшев А.П., Чернова Н.В. 1994. Аннотированный список рыбообразных и рыб морей Арктики и сопредельных вод // Вопр. ихтиологии. Т. 34. № 4. С. 435−456.
Антонов Н.П., Датский А.В., Мазникова О.А., Митенкова Л.В. 2016. Современное состояние промысла тихоокеанской сельди в дальневосточных морях // Рыб. хоз-во. № 1. С. 54−58.
Горбатенко К.М., Мельников И.В., Кияшко С.И. и др. 2013. Стадоспецифичность и трофический статус сельди в пелагиали северной части Охотского моря // Изв. ТИНРО. Т. 172. С. 237−252.
Горбачев В.В., Соловенчук Л.Л., Черноиванова Л.А. 2011. Внутривидовая структура тихоокеанской сельди Clupea pallasii Val. Японского и южной части Охотского морей по данным об изменчивости контрольного региона митохондриальной ДНК // Биология моря. Т. 37. № 6. С. 472−476.
Дарда М.А. 1960. О распределении личинок и сеголетков сельди у юго-западного побережья Сахалина // Сб. работ по биологии, технике рыболовства и технологии. Вып. 1. Южно-Сахалинск: Изд-во СахТИНРО. С. 15−26.
Жузе А.П. 1962. Стратиграфические и палеогеографические исследования в северо-западной части Тихого океана. М.: Изд-во АН СССР, 260 с.
Картавцев Ю.Ф., Пушникова Г.М., Рыбникова И.Г. 2008. Многомерный морфометрический анализ комплекса внешних признаков сельди Clupea pallasii (Clupeiformes: Clupeidae) из вод Сахалина: исследование дифференциации популяций // Биология моря. Т. 34. № 5. С. 324−335.
Курносов Д.С., Орлова С.Ю., Смирнова М.А. 2016. Генетическая изменчивость тихоокеанской сельди (Clupea pallasii Val.) Охотского моря и озера Айнского по микросателлитным локусам // Изв. ТИНРО. Т. 187. С. 116−121.
Лапинский А.Г., Смирнов А.А., Горбачев В.В., Соловенчук Л.Л. 2008. Генетическая дифференциация североохотоморской группировки тихоокеанской сельди Clupea pallasii Valenciennes, 1847 (Clupeidae, Clupeiformes) по данным RAPD // Вопр. рыболовства. Т. 9. № 1 (33). С. 128−137.
Мельников И.В. 2005. Тихоокеанская сельдь Clupea pallasii (Val.): некоторые итоги и перспективы исследований // Изв. ТИНРО. Т. 141. С. 135−145.
Науменко Н.И. 2001. Биология и промысел морских сельдей Дальнего Востока. Петропавловск-Камчатский.: Камчат. печат. двор, 334 с.
Науменко Н.И. 2012. О численной депрессии в некоторых популяциях тихоокеанской сельди Clupea pallasii Val. // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 24. С. 68−74.
Посадова В.П. 1988. Состояние запасов сельди залива Петра Великого // Изменчивость состава ихтиофауны, урожайности поколений и методы прогнозирования запасов рыб в северной части Тихого океана. Владивосток: Изд-во ТИНРО. С. 64–69.
Правоторова Е.П. 1965. Некоторые данные по биологии гижигинско-камчатской сельди в связи с колебанием ее численности и изменением ареала нагула // Изв. ТИНРО. Т. 59. С. 102−128.
Правоторова Е.П. 1991. Распределение гижигинско-камчатской сельди в период нереста и нагула, состояние ее запасов и рекомендации по их освоению // Тез. докл. отчет. сессии ТИНРО и его отделений по результатам науч.-исслед. работ 1990 г. Владивосток: Изд-во ТИНРО. С. 47−48.
Пушникова Г.М., Рыбникова И.Г. 1991. О популяционной структуре сельди северо-западной Пацифики // Рациональное использование биоресурсов Тихого океана. Владивосток: Изд-во ТИНРО. С. 169−170.
Рыбникова И.Г. 1985 Популяционно-генетическая структура сельдей Охотского моря // Сельдевые северной части Тихого океана. Владивосток: Изд-во ТИНРО. С. 57−62.
Рыбникова И.Г. 1999. Популяционная структура тихоокеанской сельди Clupea palasii (Valenciennes) Японского и Охотского морей: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО, 23 с.
Рыбникова И.Г., Упрямов В.Е., Пушникова Г.М. 1983. Электрофоретический анализ белков озерных сельдей Сахалина и Камчатки // Матер. II регион. конф. молодых ученых и специалистов Дальнего Востока “Биологические ресурсы шельфа, их рациональное использование и охрана”. Владивосток. С. 63−64.
Савенков В.В., Шпигальская Н.Ю., Варкентин А.И. и др. 2014. Изменчивость микросателлитных локусов в выборках минтая из нерестовых скоплений Охотского, Берингова морей и тихоокеанских вод, прилегающих к Северным Курильским островам // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 34. С. 72–80.
Савенков В.В., Шпигальская Н.Ю., Варкентин А.И. и др. 2018. Дифференциация минтая (Theragra chalcogramma) Охотского моря по микросателлитным локусам // Там же. Вып. 48. С. 5−13.
Семенова А.В., Андреева А.П., Строганов А.Н. и др. 2012. Предварительные данные по изменчивости четырех микросателлитных локусов у тихоокеанских сельдей Clupea pallasii // Генетика. Т. 48. № 1. С. 97–103.
Семенова А.В., Строганов А.Н., Афанасьев К.И. и др. 2018. Микросателлитная изменчивость тихоокеанской сельди Clupea pallasii Val., 1847 Охотского и Берингова морей // Генетика. Т. 54. № 3. С. 349−360. https://doi.org/10.7868/S0016675818030086
Смирнов А.А. 2009. Гижигинско-камчатская сельдь. Магадан: Изд-во МагаданНИРО, 149 с.
Смирнов А.А., Марченко С.Л., Кащенко Е.В. 2005. Оценка популяционного статуса сельди Тауйской губы Охотского моря по результатам морфометрического анализа 2001–2002 гг. // Тез. докл. VI науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 253–255.
Строганов А.Н., Блейл М., Оберст Р. и др. 2013. О дифференциации группировок трески (Gadus morhua L.) Балтийского моря // Генетика. Т. 49. № 9. С. 1079−1087. https://doi.org/10.7868/S0016675813080158
Фридлянд И.Г. 1951. Размножение сельди у юго-западного берега Сахалина // Изв. ТИНРО. Т. 35. С. 105−146.
Фролов А.П. 1964. Морфологическая характеристика сельдей вод Сахалина // Там же. Т. 55. С. 39−53.
Шунтов В.П. 2001. Биология дальневосточных морей России. Т. 1. Владивосток: Изд-во ТИНРО-центр, 580 с.
Avice J.C. 2000. Phylogeography: the history and formation of species. Cambridge: Harvard Univ. Press, 447 p.
Beacham T.D., Schweigert J.F., McConnachie C. et al. 2008. Use of microsatellites to determine population structure and migration of Pacific herring in British Columbia and adjacent regions // Trans. Amer. Fish. Soc. V. 137. № 6. P. 1795–1811. https://doi.org/10.1577/T08-033.1
Bekkevold D., Andre C., Dahlgren T.G. et al. 2005. Environmental correlates of population differentiation in Atlantic herring // Evolution. V. 59. P. 2656–2668. https://doi.org/10.1111/j.0014-3820.2005.tb00977.x
Dahle G., Eriksen A.G. 1990. Spring and autumn spawners of herring (Clupea harengus) in the North Sea, Skagerrak and Kattegat, population genetic analysis // Fish. Res. V. 9. P. 131–141. https://doi.org/10.1016/0165-7836(90)90060-9
Earl D.A., Vonholdt B.M. 2012. Structure harvester: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Gen. Resour. V. 4. № 2. P. 359−361. https://doi.org/10.1007/s12686-011-9548-7
Estoup A., Rousset F., Michalakis Y. et al. 1998. Comparative analysis of microsatellite and allozyme markers: a case study investigating microgeographic differentiation in brown trout (Salmo trutta) // Mol. Ecol. V. 7. P. 339–353. https://doi.org/10.1046/j.1365-294X.1998.00362.x
Excoffier L., Lischer H.E.L. 2010. Arlequin suite ver. 3.5: a new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Resour. V. 10. № 3. P. 564−567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
Goudet J. 1995. F-Stat (version 1.2): a computer program to calculate F-statistics // J. Hered. V. 86. № 6. P. 485–486. https://doi.org/10.1093/oxfordjournals.jhered.a111627
Grant W.S., Liu M., Gao T., Yanagimoto T. 2012. Limits of Bayesian skyline plot analysis of mtDNA sequences to infer historical demographies in Pacific herring (and other species) // Mol. Phylogen. Evol. V. 65. P. 203–212. https://doi.org/10.1016/j.ympev.2012.06.006
Ivshina E.R. 2000. Decline of the Sakhalin-Hokkaido herring spawning grounds near the Sakhalin coast // Herring: expectations for a new millennium. Alaska Sea Grant College Program. AK-SG-01-04. P. 245–254.
Jorgensen H.B.H., Hansen M.M., Bekkevold et al. 2005. Marine landscapes and population genetic structure of herring (Clupea harengus L.) in the Baltic Sea // Mol. Ecol. V. 14. C. 3219–3234. https://doi.org/10.1111/j.1365-294X.2005.02658.x.
King D.P.F., Ferguson A., Moffett I.J.J. 1987. Aspects of population genetics of herring, Clupea harengus around the British Isles and in the Baltic Sea // Fish. Res. V. 6. P. 35–52. https://doi.org/10.1016/0165-7836(87)90005-1
Kornfield I., Bogdanowicz S.M. 1987. Differentiation of mitochondrial-DNA in Atlantic herring Clupea harengus // Fish. Bull. V. 85. P. 561–568.
Libungan L.A., Olafsdottir G., Skírnisdottir S. 2012. Fourteen new microsatellite markers for Atlantic herring (Clupea harengus) // J. Fish Biol. V. 81. P. 1422–1426. https://doi.org/10.1111/j.1095-8649.2012.03391.x
Liu M., Lin L., Gao T. et al. 2012. What maintains the central North Pacific genetic discontinuity in Pacific herring? // PLoS ONE. V. 7. № 12. Article e50 340. https://doi.org/10.1371/journal.pone.0050340
Machado-Schiaffino G., Campo D., Garcia-Vazquez E. 2009. Strong genetic differentiation of the Austral hake (Mevluccius austvalis) across the species range // Mol. Phylogen. Erol. V. 53. P. 35l−356. https://doi.org/10.1016/j.ympev.2009.02.017
McPherson A.A., O’Reilly P.T., McParland T.L. et al. 2001. Isolation of nine novel tetranucleotide microsatelites in Atlantic herring (Clupea harengus) // Mol. Ecol. Resour. V. 1. № 1−2. P. 31–32. https://doi.org/10.1046/j.1471-8278.2000.00012.x
Olsen J.B., Lewis C.J., Kretschme E.J. et al. 2002. Characterization of 14 tetranucleotide microsatellite loci derived from Pacific herring // Mol. Ecol. Notes. V. 2. № 2. P. 101−103. https://doi.org/10.1046/j.1471-8286.2002.00160.x
Orlova S.Yu., Kurnosov D.S., Chikurova E.A., Shchepetov D.M. 2019a. Genetic relationship between lake and marine forms of Pacific herring Clupea pallasii // J. Ichthyol. V. 59. № 6. P. 843−852.
Orlova S.Y., Smirnova M.A., Stroganov A.N. et al. 2019b. Population structure and microevolution of Pacific cod Gadus macrocephalus based on the analysis of the control region (mtDNA) polymorphism // Rus. J. Genet. V. 55. № 5. P. 580−591. https://doi.org/10.1134/S1022795419040100
Palumbi S.R. l994. Genetic divergence, reproductive isolation, and marine speciation // Ann. Rev. Ecol. Systemat. V. 25. P. 547−572.
Pritchard J.K., Stephens M., Donnelly P. 2000. Inference of population structure using multilocus genotype data // Genetics. V. 155. P. 945–959.
Rousset F., Raymond M. 1995. Testing heterozygote excess and deficiency // Ibid. V. 140. P. 1413–1419.
Ruzzante D.E., Taggart C.T., Cook D. 1998. A nuclear DNA basis for shelf- and bank-scale population structure in NW Atlantic cod (Gadus morhua): Labrador to Georges Bank // Mol. Ecol. V. 7. P. 1663–1680. https://doi.org/10.1046/j.1365-294x.1998.00497.x
Ryman N., Lagercrantz U., Andersson L. et al. 1984. Lack of correspondence between genetic and morphologic variability patterns in Atlantic herring (Clupea harengus) // Heredity. V. 53. P. 687–704. https://doi.org/10.1038/hdy.1984.127
Shaw P.W., Turan C., Wright J.M. et al. 1999. Microsatellite DNA analysis of population structure in Atlantic herring (Clupea harengus), with direct comparison to allozyme and mtDNA data // Ibid. V. 83. P. 490−499. https://doi.org/10.1038/sj.hdy.6885860
Shimizu Y., Takahashi H., Takayanagi S. 2018. Population structure of the Pacific herring, Clupea pallasii, around Hokkaido Island inferred on the basis of mitochondrial DNA sequences // Sci. Rept. Hokkaido Fish. Res. Inst. № 94. P. 1−40.
Silva W.A., Costa M.C.R., Jr., Valente V. et al. 2001. PCR template preparation for capillary DNA sequencing // BioTechniques. V. 30. № 3. P. 537−540. https://doi.org/10.2144/01303st05
Skarstein T.H., Westgaard J.I., Fevolden S.E. 2007. Comparing microsatellite variation in north east Atlantic cod (Gadus morhua L.) to genetic structuring as revealed by pantophysin (PanI) // J. Fish Biol.V. 70C. P. 271–290. https://doi.org/10.1111/j.1095-8649.2007.01456.x
Smirnova M.A., Orlova S.Y., Orlov A.M. 2019. The population genetic organization of Pacific cod Gadus macrocephalus in the North Pacific based on microsatellite analysis // J. Ichthyol. V. 59. № 4. P. 555−565. https://doi.org/10.1134/S0032945219040155
Sugaya T., Sato M., Yokoyama E. et al. 2008. Population genetic structure and variability of Pacific herring Clupea pallasii in the stocking area along the Pacific coast of Northern Japan // Fish. Sci. V. 74. P. 579–588. https://doi.org/10.1111/j.1444-2906.2008.01561.x
Wang J. 2017. The computer program STRUCTURE for assigning individuals to populations: easy to use but easier to misuse // Mol. Ecol. Resour. https://doi.org/10.1111/1755-0998.12650
Дополнительные материалы
- скачать ESM_1.docx
- Приложение 1. Генетическая характеристика исследованных выборок тихоокеанской сельди Clupea pallasii по микросателлитным локусам
- скачать ESM_2.docx
- Приложение 2. Значения попарной генетической дифференциации (FST) между выборками тихоокеанской сельди Clupea pallasii по микросателлитным маркерам
Инструменты
Вопросы ихтиологии


