Вопросы ихтиологии, 2021, T. 61, № 3, стр. 337-351
Речной изолят северной мальмы Salvelinus malma на острове Беринга (Командорские острова)
А. М. Малютина 1, К. В. Кузищин 1, 2, *, А. В. Семенова 1, М. А. Груздева 1
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 18.03.2020
После доработки 06.04.2020
Принята к публикации 08.04.2020
Аннотация
Впервые на о-ве Беринга (Командорские о-ва) обнаружена изолированная популяция северной мальмы Salvelinus malma. Она населяет только р. Водопадная, отделённую от моря непреодолимым для проходных рыб водопадом высотой 6 м, другие виды рыб в ней отсутствуют. Мальма изолированной популяции – тугорослая, продолжительность жизни до 12 лет; размеры самок, плодовитость и диаметр икры меньше, чем у проходной северной мальмы из других рек о-ва Беринга. Изолированная популяция р. Водопадная является дериватом проходной мальмы, сохранившим основные определительные признаки вида, но при этом размеры рыб существенно бóльше, чем у ручьевых изолятов из других участков ареала, которые представлены мелкими особями с ювенильным обликом и небольшой продолжительностью жизни. Вероятно, возникновение изолированной популяции гольцов в р. Водопадная произошло в результате подъёма литосферного блока в нижнем течении реки во время сильного землетрясения в период от 12 до 4−3 тыс. лет назад, скорее всего, около 9.5 тыс. лет назад. Изолированная популяция гольцов характеризуется значительным снижением показателей генетического разнообразия по сравнению с проходной мальмой Командорских о-вов. Выявлен значительный уровень генетической дивергенции (FST = 0.248) между изолированной и проходной мальмой о-ва Беринга. Обнаруженный изолят по ряду морфологических и генетических особенностей может рассматриваться как уникальная единица разнообразия как среди Командорских, так и среди других популяций вида в целом.
Северная мальма Salvelinus malma – один из наиболее распространённых видов лососёвых рыб (Salmonidae) в Северной Пацифике, населяет разнообразные типы водоёмов, обитает в широком диапазоне условий внешней среды и характеризуется высоким уровнем полиморфизма на ареале (Савваитова, 1989; Behnke, 2002; Есин, Маркевич, 2017). Для северной мальмы в азиатской части ареала свойственны в основном анадромные популяции, но в то же время известны пресноводные озёрные и озёрно-речные группировки вида, в которых могут происходить процессы вторичной дивергенции (Есин, Маркевич, 2017). Реже встречаются ручьевые обоеполые группировки, представленные мелкими особями, сохраняющими ювенильный облик, которые населяют верховья рек, отрезанные порогами и водопадами от основного бассейна. Их возникновение связывают с появлением в историческом прошлом непреодолимых преград на пути анадромных производителей (Савваитова, Романов, 1969; Волобуев, 1978; Есин, 2015; Есин, Маркевич, 2017). Исследователи, изучавшие ручьевые изоляты гольцов рода Salvelinus, особо указывают на то, что они имеют разное время существования, механизм изоляции и пути адаптации, тем самым представляя собой горизонтальные реконструкции эволюционного процесса (Савваитова и др., 2004; Behnke, 2002; Рыбы …, 2012; Klemetsen, 2013). Таким образом, выявление и описание изолятов мальмы как особого элемента внутривидовой структуры важно для понимания масштабов изменчивости и протекания микроэволюционных процессов в прошлом и настоящем.
Ручьевые и речные изоляты южной мальмы S. curilus часто встречаются на Курилах и о-ве Хоккайдо (Mitsuboshi et al., 1992; Савваитова и др., 2004; Пичугин и др., 2006; Yamamoto et al., 2006; Рыбы …, 2012). Появление множества ручьевых изолятов у южной мальмы разные исследователи связывают со сложными климато-эвстатическими циклами, вулканизмом, тектоникой и трансгрессиями моря, свойственными этим регионам и приведшими к многократным исчезновениям проходной формы в популяциях при сохранении их пресноводной компоненты (Омельченко, 2005; Oleinik et al., 2007).
У северной мальмы ручьевые изоляты более редки, они выявлены преимущественно на Камчатке (Савваитова, 1989; Есин, 2015) и единично – в некоторых реках материкового побережья Охотского моря (Волобуев, 1978; Черешнев и др., 2002). Но до сих пор упоминания о ручьевых изолятах северной мальмы на островах Берингова моря или Тихого океана (Командорских и Алеутских) в литературе отсутствуют. На Командорских о-вах северная мальма – самый распространённый вид лососёвых рыб, она населяет практически все водные системы, однако на настоящий момент известны только проходные популяции вида. В то же время исследования, проведённые нами в 2013−2016 гг. на о-вах Беринга и Медный, выявили водные системы, в бассейнах которых есть крутые пороги и водопады, что создаёт предпосылки для возникновения жилой формы, подобно тому, как это описано для Курильских о-вов. В связи с этим одной из задач комплексного исследования ихтиофауны Командорских о-вов было обследование водопадных систем, поиск и выявление изолятов мальмы и других видов рыб. В 2015 г. была обнаружена единственная резидентная изолированная популяция северной мальмы в р. Водопадная на о-ве Беринга, обитающая выше непреодолимого для проходных особей водопада.
Цель данной работы − описание изолята мальмы на Командорских островах и его сравнительный анализ с проходными популяциями вида.
МАТЕРИАЛ И МЕТОДИКА
Материал собирали в 2013−2016 гг. на о-вах Беринга и Медный в рамках совместных экспедиций МГУ и Государственного природного биосферного заповедника “Командорский” имени С.В. Маракова. Всего обследовали 32 реки на о‑ве Беринга и три реки на о-ве Медный. Проводили комплексные исследования водоёмов, оценивали важнейшие геоморфологические характеристики речных систем, обращая особое внимание на изолированность или доступность участков рек для проходных рыб. Так как подробное описание геоморфологических особенностей р. Водопадная в литературе отсутствует, мы исследовали её речной бассейн с помощью метода Биссона с соавторами (Bisson et al., 2006). Температурный режим определяли с помощью автоматических электронных записывающих датчиков Vemco Minilog T8K 8-bit DataLogger, измерения проводили с периодичностью 1 раз в час. Места выходов грунтовых вод определяли пьезометрическим методом (Dahm, Valett, 1996; Baxter et al., 2003).
Участки, непреодолимые для проходных особей мальмы и других лососей, были обнаружены на многих реках о-ва Беринга, кроме коротких водотоков в его северной части и некоторых других в центральной и южной частях (Гаванская, Лодыгинская, Большой Ракушечник и др.). Часть рек в центральной части о-ва Беринга (Малый Ракушечник, Китовая, Кислая, Сухая Табложанка) имеют водопады вблизи устьев. Но изолированная популяция гольцов выше водопада обнаружена только в бассейне одной реки – Водопадной – на юго-западном (тихоокеанском) побережье о-ва Беринга (рис. 1).
Рис. 1.
Карта-схема о-ва Беринга: 1 – р. Гаванская, 2 – р. Подутёсная, 3 – р. Водопадная, 4 – р. Лисинская, 5 – р. Товарищеская Шайба, 6 – р. Буян; (- -) – граница подножья гор. Масштаб: 1 км.
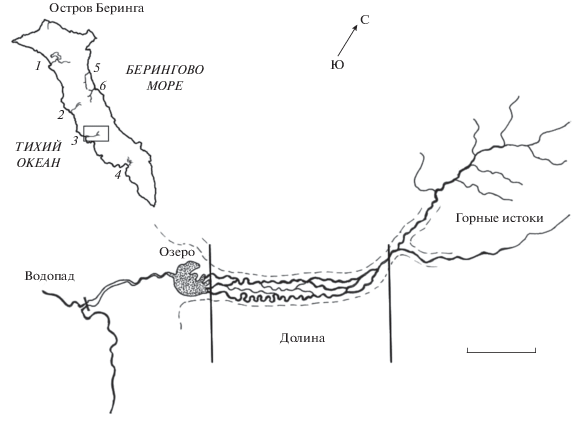
Как показали наши исследования, изолированная группировка в бассейне р. Водопадная принадлежит к виду северная мальма и является её дериватом. Однако в данной публикации мы называем изолированную популяцию изолятом, или гольцами изолированной популяции, во избежание недопонимания и путаницы с проходными популяциями мальмы, которых мы называем проходной мальмой. Для сравнительного анализа были привлечены наши сборы проходной мальмы из популяций, обитающих в близлежащих реках, а также из рек другого побережья острова (рис. 1). Объёмы выборок указаны в соответствующих таблицах и на рисунках.
Наблюдения за перемещениями и поведением рыб проводили с берега и с возвышенности на берегах в дневное и ночное время, однако бóльшая часть данных получена в ясные дни (всего 38 ч). Половозрелых проходных и резидентных рыб и молодь отлавливали стандартным набором ставных жаберных сетей с шагом ячеи от 15 × 15 до 55 × 55 мм, сетками Киналёва, мальковыми ловушками и удебными снастями. Часть рыб изучали по принципу “поймал–отпусти”, т.е. не подвергали биологическому анализу и выпускали обратно в водоём без нанесения травм. Для всех остальных рыб выполнен полный биологический анализ (Правдин, 1966); пол и стадию зрелости гонад определяли визуально (Мурза, Христофоров, 1991). Возраст рыб определяли по отолитам sagitta.
В связи с малочисленностью выборки рост рыб оценивали с помощью метода обратного расчисления длины тела по отолитам. Для этого измеряли наибольший горизонтальный радиус отолита (R), ширину годовых приростов, на основе которых рассчитывали l1, l2, l3 … l+ – приросты длины тела в 1-й, 2-й, 3-й … и в текущий годы жизни. Обратное расчисление длины тела рыб в разном возрасте проводили по формуле Ли (Busaker et al., 1990): Li – c = ri/R(FL – c), где Li − вычисляемая длина особи в i-том возрасте, ri – радиус i-того годового кольца на отолите, R – радиус отолита, FL – наблюдённая длина по Смитту, с – свободный член, вычисляемый по уравнению линейной связи радиуса отолита с длиной рыбы: FL = c + bR, при этом коэффициент корреляции составил 0.958. Учитывая высокую корреляцию между радиусом отолита и длиной тела рыб, полученные данные по росту рыб изолированной популяции использованы в качестве приближённых для сравнения с рыбами проходных популяций.
У половозрелых рыб изучены 26 пластических признаков по модифицированной схеме Правдина (Павлов и др., 2001), все измерения выполнены одним оператором в поле на свежем материале. Меристические признаки изучены у 11 половозрелых рыб и 17 экз. молоди FL 148–183 мм; число элементов у молоди подсчитывали на свежем материале под бинокуляром МБС-9. Состав пищи исследовали счётно-весовым методом (Шорыгин, 1952; Руководство .., 1961). Общую массу пищевого комка и отдельных компонентов определяли с точностью до 0.1 г, взвешивали общую массу объектов каждой крупной группы компонентов пищи. Морфологический материал обработан методами унивариантного статистического анализа (Лакин, 1990).
Генетический анализ проводили по девяти микросателлитным локусам. Их описание, а также методики выделения ДНК, амплификации и разделения ПЦР-продуктов опубликованы ранее (Груздева и др., 2020). Проведён сравнительный анализ генетических показателей изолированной популяции гольцов р. Водопадная и анадромной мальмы из р. Гаванская (о. Беринга).
Для проверки качества данных и наличия неамплифицируемых нуль-аллелей использовали программу Micro-Cheker 2.2.3 (Van Oosterhout et al., 2004). Популяционно-генетические статистики (аллельное разнообразие (А), число приватных (популяционно-специфических) аллелей (APR, учитывали только аллели, частота встречаемости которых >0.05), наблюдаемая (HO) и ожидаемая (HE) гетерозиготность, генетическая дифференциация FST) получены с использованием программ GDA 1.1 и GENEPOP 4.7 (Raymond, Rousset, 1995; Lewis, Zaykin, 2001). Однофакторный дисперсионный анализ (ANOVA) проведён в программе Excel для оценки различий между выборками по A и HE.
Для определения возможного прохождения популяций мальмы через “горлышко бутылки”, т.е. сильного снижения эффективной численности в относительно недавнем прошлом, использовали тесты, основанные на том, что при снижении численности популяций потеря числа аллелей происходит быстрее, чем уменьшение гетерозиготности (Cornuet, Luikart, 1996), а значение показателя, выражающего отношение числа аллелей к диапазону их размеров, уменьшается (Garza, Williamson, 2001). Гипотезу об избытке гетерозиготности тестировали в программе Bottleneck 1.2.02 (Piry et al., 1999) с использованием статистического теста Уилкоксона для трёх моделей мутационного процесса: пошаговой (SMM), бесконечного числа аллелей (IAM) и двухфазной (TPM). Для TPM предполагался 90%-ный вклад SMM-мутаций. Также был рассчитан коэффициент М = k/r, где k – число аллелей в локусе, r = Smax – Smin + 1 (максимальная разница в размерах аллелей в локусе, выраженная в числе повторов, плюс единица) (Garza, Williamson, 2001). Согласно данным этих авторов, среднее значение М < 0.68 с высокой долей вероятности свидетельствует о недавнем прохождении популяцией “горлышка бутылки”.
Для оценки времени дивергенции между изолированной и анадромной популяциями мальмы в программе MSA 4.05 (Dieringer, Schlötterer, 2003) вычислены (δμ)2 дистанции (Goldstein et al., 1995). Время дивергенции, выраженное в числе поколений (длину поколения принимали равную 4 годам), рассчитывали по формуле τ = (δμ)2/2w (Zhivotovsky, 2001), где w – темп мутирования на локус на поколение − полагали равным 0.00152 (оценка, полученная для динуклеотидных микросателлитных локусов (Dib et al., 1996)).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среда обитания гольцов и распределение в речной системе
Река Водопадная расположена в центральной части западного побережья о-ва Беринга, впадает в Тихий океан (рис. 1). Истоки реки – несколько бурных, коротких ручьёв, расположенных в горных распадках. В среднем течении река протекает через выровненную долину между горными отрогами шириной ~400 м. В пределах долины река распадается на несколько параллельных, сильно меандрирующих русел. В долине и по берегам проток густо растёт непроходимый ивовый стланик. В западной (нижней) части долины расположено проточное озеровидное расширение (далее − озеро) размером 500 × 250 м, вытянутое по направлению течения. С южной стороны к берегу озера подступает горный склон, отчего берег обрывистый, у кромки воды глубина >0.5 м. Другие берега пологие, северный и северо-восточный − сильно изрезаны, образуют несколько заливов. Дно озера каменистое или галечное с участками россыпи гравия, значительные площади дна (~30%) покрыты слоем ила толщиной до 10−15 см. Глубина озера варьирует от 1.1−1.5 м в северной части до 5 м в заливах южной части. Река впадает в озеро несколькими протоками, а вытекает единым слабо меандрирующим руслом. При впадении в океан река образует водопад высотой 6 м, непреодолимый для проходных рыб. Ниже водопада река протекает коротким (~35 м) участком, который полностью находится под воздействием приливно-отливных течений.
Длина реки по основному руслу составляет 8.3 км, верхнего (горного) участка – 3.9 км, участка долины – 3.5 км, от озера до водопада – 1.4 км. В участках горных теснин ширина ручьёв-истоков 1.0−1.5 м, глубина ~0.3 м (до 1.5 м в омутах), уклон ложа 10−12 м/км, скорость течения > 1.5 м/с, дно сложено крупнообломочными горными породами или выходами коренных горных пород. Температура воды на участке горных истоков варьирует от 3.5−4.1 в июле до 4.8−5.0°С в начале сентября. На участке долины ширина русел ~2.5 м и глубина 0.3−0.4 м, уклон ложа ~4.5 м/км, скорость течения 0.6−0.7 м/с, дно сложено гравием и реже – крупной галькой. Участок реки от озера до водопада представляет собой ровный поток с корытообразным сечением ложа, имеет ширину 6–10 м (в некоторых местах до 20 м) и глубину 0.5–0.7 м, уклон ложа ~0.5 м/км, скорость течения 0.6–0.8 м/с, дно сложено в основном выходами коренных горных пород с наносами валунов и крупной гальки. Бьеф водопада образован коренными горными породами. Питание реки смешанное: за счёт снежников в горных истоках (которые стаивают примерно к началу августа), атмосферных осадков и грунтовых вод. В верхнем течении, где река течёт через горные распадки, места выходов грунтовых вод единичны. Наоборот, в пределах долины в русле проток и пойме расположены обширные поля мощных выходов холодных (температура в течение всего летне-осеннего периода ~3−4°С) грунтовых вод. Всё дно озера представляет собой сплошное родниковое поле выходов холодных грунтовых вод. В вытекающей реке выходов грунтовых вод практически нет.
В зимнее время долина и участки верхнего течения скрыты под толстым (>1.5 м) слоем снега, но льда под ним нет. Озеро покрывается тонким льдом только в суровые зимы, над вытекающим из озера участком реки формируется глубокий снежный покров, но лёд не образуется, река протекает в снеговом туннеле.
В системе р. Водопадная гольцы изолированной популяции – единственный вид рыб. На коротком участке реки ниже водопада проходные и пресноводные рыбы не обитают, иногда туда может заходить и нереститься горбуша Oncorhynchus gorbuscha, но все нерестилища разрушаются первым же штормом. Выше водопада распределение рыб мозаичное. На участке реки от озера до водопада обнаружены единичные особи молоди и только непосредственно вблизи озера. Основное место обитания половозрелых гольцов и части молоди – озеро. На участке долины, во всех протоках, в весеннее и летнее время обнаружена только молодь гольцов, включая сеголеток. Выше участка долины, в верхнем течении, в районе горных истоков ни молоди, ни половозрелых особей не обнаружено. Таким образом, зона обитания изолированной популяции гольцов охватывает озеро и систему параллельных русел на участке реки в пределах долины. Отсутствие гольцов в горных участках реки обусловлено, по-видимому, большими уклонами ложа и очень сильным течением.
В озере крупные, всего вероятнее, половозрелые рыбы (FL > 20 см) и молодь постоянно перемещаются. По нашим наблюдениям, в ясный день половозрелые рыбы совершают зигзагообразные перемещения вдоль береговой линии, а также в сторону берега и от него, в центральную часть. Молодь в мелководной зоне северо-западной части озера не проявляет стайного образа жизни, в ясные дни особи FL ~ 150 мм держатся поодиночке и совершают вялые ненаправленные перемещения у самого дна или в расщелинах между валунами в поисках корма. В ночное время как молодь, так и крупные половозрелые рыбы могут выходить на мелководья с глубиной всего 15−20 см (по данным обловов ставными сетями и сетками Киналёва), особенно часто это происходит в августе и сентябре. Половозрелые особи чаще встречаются у северо-западного края по кромкам заливов, часто заходят в заливы, где их перемещения носят круговой характер. У юго-западного обрывистого берега озера гольцы перемещаются преимущественно вдоль береговой линии, с заметно бóльшей скоростью, чем у противоположного берега, но часто они прячутся под нависающей над водой прибрежной растительностью. Крупные особи держатся и перемещаются небольшими группами по три−пять особей, которые состоят из рыб более или менее сходной длины. По нашим наблюдениям, в озере активность у гольцов проявляется и в светлое, и в тёмное время суток, наиболее высока она в сумерках. Молодь в озере не образует скоплений, держится разрозненно вдоль береговой линии и в заливах северо-западной части. Половозрелые особи и молодь всегда придерживаются придонного слоя воды и не поднимаются к поверхности, отчего озеро днём, а также в утренние и вечерние сумерки производит впечатление безрыбного. Во время летних коротких и относительно светлых ночей также не установлено никаких признаков активности рыб (круги на воде, плески). Даже во время тёмных осенних ночей половозрелые рыбы, которые обычны на мелководьях (глубина 20−30 см, просматриваемая полоса до 10−15 м от уреза воды) также не поднимаются к поверхности и никак не проявляют себя. Заметные сезонные различия в поведении крупных рыб в озере не выявлены.
На участке долины молодь гольцов обитает во всех параллельных протоках, ведёт скрытный образ жизни, держится поодиночке в придонном слое воды и предпочитает плёсы с крупногалечным грунтом. По данным обловов сеткой Киналёва (56 ловов, обловленная площадь >3000 м2), плотность молоди низкая, обычно <1 экз/м2. Как и в озере, на участке долины молодь часто располагается у подмытых берегов, под нависающей над водой дерновиной, прибрежной травой и кустарниками. Каких-либо сезонных различий в распределении молоди на участках долины не установлено.
По-видимому, у гольцов в озере отсутствуют угрозы со стороны наземных хищников или рыбоядных птиц. По нашим наблюдениям, все рыбоядные птицы очень редко залетают на озеро. В течение практически всего безлёдного периода на зорях над озером висит плотный туман, что является неблагоприятным фактором для питания рыбоядных птиц, питающихся преимущественно по утрам. На берегах озера обнаружены только единичные следы песцов – единственного вида наземных животных, способных охотиться на гольцов. Однако ни одного факта, указывающего на добычу песцами молоди или взрослых рыб, не установлено.
Определить численность популяции затруднительно. По нашим экспертным оценкам, основанным на данных уловов и визуальных наблюдений, популяция может насчитывать 250−300 половозрелых особей.
Описание северной мальмы р. Водопадная
У половозрелых рыб (n = 11) тело веретеновидное, умеренно высокое (22% FL), вальковатое, наибольшая высота тела у начала спинного плавника, хвостовой стебель умеренно высокий (lpc 7−9% FL), более или менее округлый в сечении (рис. 2). У молоди (n = 14) тело прогонистое, сжатое с боков, хвостовой стебель низкий (h < 7% FL) и также заметно сжат с боков. У половозрелых рыб грудные плавники короткие, закруглённые, не достигают 1/2 пектовентрального расстояния (P–V). Боковая линия чаще всего прямая, у немногих рыб – слегка изогнутая книзу в средней части тела. Хвостовой плавник усечённый (62% рыб) или слабовыемчатый (38%). У более крупных рыб хвостовой плавник чаще усечённый, чем выемчатый. Голова небольшая (c < 19% FL), закруглённая. Нижняя челюсть – укороченная как у молоди, так и у половозрелых рыб независимо от пола. У 62% половозрелых особей нижняя челюсть чуть короче верхней, у остальных – значительно короче верхней, и верхняя челюсть нависает над нижней. Верхнечелюстная кость у всех рыб (у молоди и половозрелых особей) прямая и слегка заходит за задний край глаза. У половозрелых особей антедорсальное расстояние (aD) всегда меньше, чем постдорсальное (pD), у молоди они примерно равны. Примечательно, что при небольшом объёме выборки – 11 экз., показатели ошибки среднего невелики, а пределы варьирования признаков незначительны (табл. 1).
Рис. 2.
Внешний вид особей изолированной популяции северной мальмы Salvelinus malma р. Водопадная о. Беринга: а – самка FL 407 мм, IV–V стадия зрелости яичников (особь имеет два фенодевианта: 1 – дополнительный ряд прободённых чешуй над основным в передней части тела, 2 – разреженный основной ряд прободённых чешуй боковой линии на хвостовом стебле); б – самка FL 355 мм, IV стадия зрелости; в – самец FL 262 мм, IV стадия зрелости семенников.

Таблица 1.
Пластические признаки половозрелых особей (n = 11) изолированной популяции северной мальмы Salvelinus malma р. Водопадная (о. Беринга, Командорские о-ва)
| Признак | M ± m | SD | lim |
|---|---|---|---|
| FL, мм | 311.1 ± 5.6 | 18.6 | 233–418 |
| В % FL | |||
| c | 18.80 ± 0.30 | 1.01 | 17.0–20.3 |
| ao | 4.51 ± 0.10 | 0.33 | 4.1–5.1 |
| o | 2.63 ± 0.09 | 0.32 | 2.2–3.2 |
| op | 10.87 ± 0.11 | 0.36 | 10.2–11.6 |
| cH | 11.76 ± 0.24 | 0.80 | 10.3–12.5 |
| ch | 8.98 ± 0.17 | 0.56 | 8.4–10.0 |
| lmx | 8.20 ± 0.16 | 0.51 | 7.4–9.0 |
| lm | 6.60 ± 0.14 | 0.46 | 5.8–7.2 |
| hmx | 1.20 ± 0.04 | 0.14 | 1.02–1.45 |
| lmd | 10.28 ± 0.21 | 0.69 | 9.6–12.1 |
| H | 21.92 ± 0.29 | 0.98 | 20.3–23.3 |
| h | 8.66 ± 0.17 | 0.58 | 7.3–9.3 |
| lpc | 17.82 ± 0.13 | 0.45 | 16.7–18.3 |
| lD | 11.19 ± 0.28 | 0.94 | 9.8–12.5 |
| hD | 11.77 ± 0.14 | 0.46 | 10.5–12.1 |
| lA | 9.44 ± 0.17 | 0.58 | 8.8–10.7 |
| hA | 12.29 ± 0.10 | 0.33 | 11.7–12.7 |
| lP | 13.45 ± 0.13 | 0.43 | 12.7–13.9 |
| lV | 10.57 ± 0.16 | 0.53 | 10.0–11.7 |
| aD | 42.50 ± 0.21 | 0.69 | 41.6–43.8 |
| pD | 46.69 ± 0.25 | 0.83 | 42.2–44.9 |
| aV | 47.39 ± 0.32 | 1.05 | 45.9–48.7 |
| aA | 68.06 ± 0.15 | 0.51 | 67.3–69.2 |
| P–V | 30.27 ± 0.35 | 1.15 | 28.4–31.7 |
| V–A | 21.06 ± 0.18 | 0.60 | 20.1–21.9 |
Примечание. FL – длина по Смитту, c – длина головы, ao – длина рыла, o – горизонтальный диаметр глаза, op – заглазничное расстояние, cH – высота головы на уровне затылка, ch – то же на уровне глазниц, lmx – длина верхней челюсти; lm, hmx – длина и высота верхнечелюстной кости; lmd – длина нижней челюсти, H – наибольшая высота тела, h – высота хвостового стебля, lpc – длина хвостового стебля, lD – длина основания спинного плавника, hD – высота спинного плавника, lA – длина основания анального плавника, hA – высота анального плавника; lP, lV – длина грудного и брюшного плавников; aD – расстояние от кончика рыла до начала основания спинного плавника, pD – расстояние от заднего края спинного плавника до основания средних лучей хвостового плавника; aV, aA, P–V и V–A – антевентральное, антеанальное, пектовентральное и вентроанальное расстояния; M ± m – среднее значение и его ошибка, SD – среднее квадратичное отклонение, lim – пределы варьирования показателя.
У половозрелых рыб окраска блёклая – общий фон тела светлый или светло-серый, без явного серебристого отблеска (рис. 2). Спина серая, бока тела серые или серо-оливковые, брюхо светлее боков и иногда с точечной пигментацией. Верх головы серый, жаберная крышка светлая с розоватым или светло-фиолетовым отливом, жаберные лучи и нижняя челюсть светлые. У крупных особей начало обеих челюстей слабо оранжевое. Пасть тёмно-серого цвета. Выше и ниже боковой линии по бокам тела расположены многочисленные очень мелкие пятнышки. Выше боковой линии их много (6–8 на 1 см2), они светлые, диаметром ~1/3 диаметра зрачка, равномерно покрывают спину. Ниже боковой линии пятнышки менее многочисленные (3–4 на 1 см2), но более крупные, ~1/2–3/4 диаметра зрачка, оранжевого или розоватого цвета. Примерно у 30% рыб мелкие светлые пятнышки есть у основания верхней лопасти хвостового плавника. Хвостовой плавник серый, со светлой каймой по заднему краю, верхние и нижние неветвистые лучи хвостового плавника более светлые, с оранжевым отливом. Брюшные и анальный плавники серые с хорошо выраженным оранжевым отливом, первые неветвистые лучи белые. Грудные плавники светло-оранжевые, их первые лучи по цвету не отличаются от остальной части плавника. Спинной плавник серый, с хорошо выраженной контрастной оранжевой вершиной. Жировой плавник серо-оранжевый, с тёмной каймой по наружному краю. В наших сборах не было ни одной особи с какими-то элементами брачного наряда, даже в том случае, когда половые железы находились на IV–V стадии зрелости. В пасмурные дни и при тумане половозрелые особи трудно различимы на фоне озёрного дна на глубине всего 30−40 см. Мышцы всех изученных половозрелых особей имели ярко-оранжевый цвет.
Молодь также имеет блёклую окраску – серую спину, серо-белые бока и светлое брюхо. На боках тела имеется шесть−восемь плохо различимых мальковых пятен (parr marks) с размытым краем. Сеголетки (FL ~ 30−40 мм) по окраске сходны с молодью FL > 100 мм, но мальковые пятна у них более контрастные.
У части рыб выявлены фенодевианты. В большинстве случаев это разного рода отклонения в строении боковой линии. Так, у 33% рыб в передней части тела имеется дополнительная верхняя боковая линия, она содержит 21−25 прободённых чешуй. У 22% половозрелых рыб боковая линия разреженная, между прободёнными чешуями имеется четыре–пять непрободённых (такие особи были исключены из выборки для оценки меристических признаков). У 33% рыб в передней половине тела через прободённые чешуи проходят вертикальные или диагональные бороздки-углубления длиной примерно четыре−шесть чешуй. У двух рыб боковая линия не достигает основания хвостового плавника, у трёх рыб в передней части тела имеются участки из 12−15 чешуй, увеличенных примерно в два раза по сравнению с обычными.
Биология
Длина тела половозрелых особей в выборке 205−418 (в среднем 304) мм, масса тела – 82–709 (328) г, возраст 5+−11+ (табл. 2). Возможно, в озере обитают и более крупные особи, поймать которых не удалось. Гольцы р. Водопадная характеризуются медленным темпом роста, к 7−8-летнему возрасту достигают FL ~ 300 мм (табл. 2). Рост молоди равномерный до возраста 4+, после чего наблюдается его ускорение (рис. 3). По-видимому, изменение темпа роста обусловлено миграцией молоди из проток в озеро. Возраст наступления полового созревания – 6 лет, в этом возрастном классе отмечена самка с яичниками III−IV стадии зрелости и самец с семенниками IV стадии. В выборке самки и самцы имели сходные длину и массу тела.
Таблица 2.
Длина и масса тела, возрастной состав половозрелых особей (n = 12) изолированной популяции северной мальмы Salvelinus malma р. Водопадная (о. Беринга, Командорские о-ва)
| Показатель | Возраст, лет | ||||||
|---|---|---|---|---|---|---|---|
| 5+ | 6+ | 7+ | 8+ | 9+ | 10+ | 11+ | |
| Длина (FL), мм | $\frac{{205{\kern 1pt} - {\kern 1pt} 233}}{{219.0}}$ | $\frac{{250{\kern 1pt} - {\kern 1pt} 262}}{{256.0}}$ | $\frac{{290{\kern 1pt} - {\kern 1pt} 304}}{{298.0}}$ | $\frac{{340{\kern 1pt} - {\kern 1pt} 355}}{{347.5}}$ | 388 | 407 | 418 |
| Масса, г | $\frac{{82{\kern 1pt} - {\kern 1pt} 170}}{{126.0}}$ | $\frac{{228{\kern 1pt} - {\kern 1pt} 240}}{{254.0}}$ | $\frac{{257{\kern 1pt} - {\kern 1pt} 270}}{{292.3}}$ | $\frac{{362{\kern 1pt} - {\kern 1pt} 413}}{{387.5}}$ | 654 | 702 | 709 |
| Число рыб (самок/самцов), экз. | 2 (1/1) | 2 (1/1) | 3 (1/2) | 2 (1/1) | 1 (–/1) | 1 (1/–) | 1 (1/–) |
| Доля рыб, % | 16.7 | 16.7 | 25.0 | 16.7 | 8.3 | 8.3 | 8.3 |
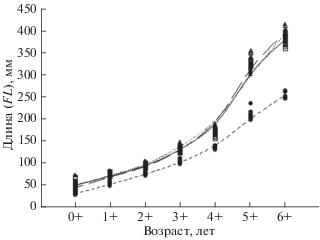
Рис. 3.
Темп роста (по расчисленным длинам) северной мальмы Salvelinus malma в разных реках о-ва Беринга: (-⚫-) – р. Водопадная, n = 11; (─◻─) – р. Гаванская, n = 38; (─△─) – р. Лисинская, n = 40; ($ \cdots $▲$ \cdots $) – р. Буян, n = 14.
Плодовитость варьирует от 350–420 икринок у самок FL 233–262 мм до 1400–1500 шт. у самок FL 407–418 мм. Диаметр икринок у самок с яичниками IV стадии зрелости составляет 3.9–4.2 мм.
Молодь гольцов, пойманная в озере (n = 16), имела FL 132–188 (168) мм, массу 8.5–31.0 (21.1) г., молодь из проток на участке долины (n = 23) в целом имела сходные показатели – 102–175 (159) мм и 7.8–23 (17.3) г.
Половозрелые гольцы в озере питаются беспозвоночными, наибольшее значение в питании имеют гаммарусы (Gammaridae): частота встречаемости – 100%, их доля по массе в пищевом комке >75%. Оставшаяся часть приходится на личинок амфибиотических насекомых: хирономид (Chironomidae) и мелких ручейников (Trichoptera), единично отмечены личинки подёнок (Ephemeroptera). Случаи каннибализма не установлены. Молодь FL < 150 мм в озере чаще питается личинками хирономид, а в протоках долины – личинками хирономид (~63% массы пищи) и мошек (Simuliidae) (~29% массы пищи).
Особенности размножения гольцов остаются не выясненными. По-видимому, какая-то их часть из озера уходит вверх по течению, в протоки долины и размножается в местах, где дно образовано гравием и имеются мощные выходы грунтовых вод. Именно в таких местах была обнаружена мелкая молодь, вероятнее всего, сеголетки FL < < 40 мм. Не исключён и озёрный нерест, так как на дне озера имеются участки с мощными выходами грунтовых вод и гравийным дном.
Генетическая изменчивость
Программа Micro-Cheker не выявила ошибок генотипирования или присутствия нуль-аллелей ни в одном из локусов. Достоверных отклонений от равновесия Харди–Вайнберга не обнаружено. Изолированная популяция мальмы из р. Водопадная характеризуется значительным снижением генетического разнообразия по сравнению с проходной мальмой из р. Гаванская по всем локусам (табл. 3). Средние оценки ожидаемой гетерозиготности и аллельного разнообразия проходной мальмы (HE = 0.689, А = 7.1) более чем в два раза превышают таковые у гольцов изолированной популяции (HE = 0.335, А = 3.4). Кроме того, практически в каждом локусе у проходной мальмы имеются популяционно-специфические (приватные) аллели, которые у гольцов из р. Водопадная встречаются только в одном.
Таблица 3.
Генетическая изменчивость северной мальмы Salvelinus malma Командорских о-вов по микросателлитным локусам
| Локус | Изолированная популяция р. Водопадная (n = 24) | Проходная популяция р. Гаванская (n = 24) | ||||||
|---|---|---|---|---|---|---|---|---|
| A | APR | HE | HO | A | APR | HE | HO | |
| Smm-3 | 2 | – | 0.223 | 0.166 | 2 | – | 0.509 | 0.375 |
| Smm-10 | 4 | – | 0.592 | 0.583 | 11 | 5 | 0.862 | 0.791 |
| Smm-17 | 6 | – | 0.774 | 0.636 | 10 | 2 | 0.847 | 0.750 |
| Smm-21 | 2 | – | 0.041 | 0.041 | 9 | 3 | 0.813 | 0.708 |
| Sco202 | 2 | – | 0.081 | 0.083 | 4 | 1 | 0.328 | 0.375 |
| Sco211 | 7 | – | 0.558 | 0.500 | 14 | 4 | 0.922 | 0.791 |
| SSOSL456 | 3 | 1 | 0.296 | 0.333 | 7 | 3 | 0.733 | 0.583 |
| Sle6 | 3 | – | 0.411 | 0.333 | 5 | 1 | 0.735 | 0.875 |
| Omy301 | 2 | – | 0.041 | 0.041 | 2 | – | 0.453 | 0.500 |
| В среднем | 3.4 | 0.1 | 0.335 | 0.302 | 7.1 | 2.1 | 0.689 | 0.638 |
Генетическое разнообразие проходной мальмы р. Гаванская сопоставимо с таковым у проходной мальмы Камчатки и материкового побережья Охотского моря. Так, показатели изменчивости в выборке р. Утхолок, рассчитанные по тем же микросателлитным локусам, составляют: HE = 0.700, А = 5.8 (Груздева и др., 2020). В камчатских и охотоморских популяциях S. malma оценки А варьируют в пределах 4.9−6.2, HE – 0.501−0.650 (Gordeeva et al., 2010). Уровень изменчивости популяций мальмы Командорских о-вов, сходный с таковым в материковых популяциях Камчатки, был продемонстрирован и по результатам исследования митохондриальной ДНК (Сошнина и др., 2016).
Тестирование популяций мальмы на сокращение численности, или “горлышко бутылки”, на основании показателя М указывает на возможность этого события как у изолированной популяции гольцов из р. Водопадная (М = 0.541), так и у проходной мальмы р. Гаванская (М = 0.565). В то же время программа Bottleneck не выявила снижения эффективной численности популяций мальмы ни в одной из рек, так как достоверного избытка гетерозиготности не обнаружено. Более того, для SMM- и TPM-моделей мутационного процесса выявлен достоверный дефицит гетерозиготности (p < 0.001) как у анадромной, так и у изолированной популяции гольцов. Известно, что используемые нами методы на основании М-показателя и реализуемые в программе Bottleneck различаются по чувствительности к обнаружению событий редукции численности: показатель М выявляет события, произошедшие в более отдалённом прошлом, чем анализ Bottleneck (Williamson-Natesan, 2005). Также определено, что при мутационных SMM- или TPM-моделях после “горлышка бутылки” может выявляться и дефицит гетерозиготности, обычно указывающий на увеличение численности (Cornuet, Luikart, 1996). Вероятно, полученные данные следует интерпретировать как свидетельство прохождения в отдалённом прошлом популяциями мальмы “горлышка бутылки”. Суровые нестабильные климатические условия, свойственные Командорским о-вам (Мараков, 1972), могут быть причиной демографических изменений, связанных с сокращением численности в популяциях гольцов. Имеются данные, что многие современные популяции северной мальмы вследствие обитания в суровых климатических условиях периодически подвергаются депрессии численности (Олейник и др., 2007; Everett et al., 1998).
При этом изолированная популяция мальмы р. Водопадная, вероятно, переживала этап очень сильного снижения численности и/или была образована очень небольшим числом особей (“эффект основателя”), о чём свидетельствуют низкие оценки генетической изменчивости в этой популяции. Снижение генетической изменчивости в изолированной популяции мальмы р. Водопадная может быть связано и с дрейфом генов в условиях географической изоляции, с течением времени приводящего к значительной потере генетического разнообразия (Алтухов, 2003). Потеря генетической изменчивости, скорее всего, была ускорена и небольшой эффективной численностью популяции, оказавшейся в изоляции, а также инбридингом. Наличие среди гольцов р. Водопадная значительного числа особей с отклонениями морфологических признаков (фенодевиантов) свидетельствует в пользу существования инбридинга в этой популяции. Снижение генетической изменчивости вследствие дрейфа генов и “эффекта основателя” показано в изолированных популяциях как северной, так и южной мальмы (Олейник и др., 2007; Осинов, Гордеева, 2008).
Генетическая дифференциация между изолированной популяцией мальмы из р. Водопадная и проходной мальмой р. Гаванская, рассчитанная по всем локусам, значительна и достоверна − FST = = 0.248 (p < 0.0001). Судя по данным литературы, эта оценка выше по сравнению с показателями дифференциации популяций проходной северной мальмы на ареале, полученными по микросателлитным локусам. Так, например, различия между популяциями мальмы из рек северной части Охотского моря и Камчатки составляют FST = = 0.016−0.140 (Салменкова и др., 2009; Gordeeva et al., 2010).
Оценка времени дивергенции между изолированной и проходной мальмой Командорских о-вов, вычисленная на основании генетической дистанции (δμ)2, составила около 2376 поколений, что соответствует почти 9500 годам изоляции жилой мальмы в р. Водопадная.
Сравнительные замечания
По длине и массе тела мальма изолированной популяции из р. Водопадная меньше, чем проходная северная мальма из других рек о-ва Беринга. Длина проходной мальмы варьирует от 300 до 500 мм, в разных реках средняя длина составляет 400−450 мм (Малютина и др., 2017), тогда как наибольшая длина производителей из р. Водопадная чуть более 400 мм (табл. 2). Гольцы из р. Водопадная имеют замедленный темп роста по сравнению с проходной мальмой из других рек о-ва Беринга (рис. 3). Причиной низкого их темпа роста в системе р. Водопадная является скудная кормовая база, ограниченная только мелкими беспозвоночными животными, тогда как проходная мальма питается высококалорийной пищей не только в море, но и в пресных водах – икрой тихоокеанских лососей рода Oncorhynchus, которая играет весьма важную роль в существовании вида, являясь условием дозревания самок и самцов в реке (Wipfli et al., 2003; Denton et al., 2009; Armstrong, Bond, 2013; Пичугин, 2015). Не исключено, что скудная кормовая база изолированной популяции гольцов в р. Водопадная является причиной низкой плодовитости самок и небольшого диаметра икры по сравнению с самками проходной мальмы: плодовитость проходных самок FL 400−430 мм составляет 2200−4300 шт., диаметр икринок 3.2−5.0 мм в реках Гаванская (n = 30), Лисинская (n = 21), Буян (n = 11). Наши данные подтверждаются данными других авторов о том, что в условиях скудной кормовой базы в изолированных популяциях северной мальмы и арктического гольца S. alpinus плодовитость самок существенно меньше по сравнению с проходными (Armstrong, Morrow, 1980; McCart, 1980).
Весьма вероятно, что небольшие размеры производителей в р. Водопадная обусловлены, помимо низкого темпа роста, ещё и небольшими размерами нерестовых проток долины. Для северной мальмы описана прямая корреляция между средними и максимальными размерами производителей и размерами (ширина, глубина и водность) нерестового потока (Kitano, Shimazaki, 1995; Mochnacz et al., 2010). По нашим наблюдениям, в других реках о‑ва Беринга проходная мальма нерестится на участках с бóльшей шириной, глубиной и скоростью течения.
Окраска тела производителей гольцов из р. Водопадная в целом соответствует типичной для жилой формы и отличается от таковой проходной мальмы из рек о-ва Беринга. В отличие от проходной мальмы, гольцы р. Водопадная имеют более высокое тело, почти округлое в сечении, компактную голову, высокий и толстый хвостовой стебель, укороченную нижнюю челюсть. В то же время по меристическим признакам гольцы р. Водопадная сходны с проходной мальмой из рек о-ва Беринга, отличия несущественны и могут быть следствием малочисленности выборки (табл. 4).
Таблица 4.
Меристические признаки северной мальмы Salvelinus malma из водоёмов о-ва Беринга
| Признак | Изолированная популяция р. Водопадная (n = 28) |
Проходная мальма | ||
|---|---|---|---|---|
| р. Лисинская (n = 42) | р. Гаванская (n = 55) |
р. Буян (n = 14) |
||
| ll | $\frac{{131.60 \pm 0.77{\kern 1pt} *}}{{127{\kern 1pt} - {\kern 1pt} 135}}$ | $\frac{{132.70 \pm 0.59}}{{126{\kern 1pt} - {\kern 1pt} 140}}$ | $\frac{{132.30 \pm 0.54}}{{125{\kern 1pt} - {\kern 1pt} 146}}$ | $\frac{{133.30 \pm 0.69}}{{128{\kern 1pt} - {\kern 1pt} 139}}$ |
| D | $\frac{{9.54 \pm 0.16}}{{9{\kern 1pt} - {\kern 1pt} 10}}$ | $\frac{{9.91 \pm 0.11}}{{9{\kern 1pt} - {\kern 1pt} 11}}$ | $\frac{{9.83 \pm 0.11}}{{9{\kern 1pt} - {\kern 1pt} 11}}$ | $\frac{{9.93 \pm 0.17}}{{9{\kern 1pt} - {\kern 1pt} 11}}$ |
| A | $\frac{{9.27 \pm 0.14}}{{9{\kern 1pt} - {\kern 1pt} 10}}$ | $\frac{{8.82 \pm 0.12}}{{8{\kern 1pt} - {\kern 1pt} 10}}$ | $\frac{{8.74 \pm 0.12}}{{8{\kern 1pt} - {\kern 1pt} 10}}$ | $\frac{{8.86 \pm 0.16}}{{8{\kern 1pt} - {\kern 1pt} 10}}$ |
| P | $\frac{{13.18 \pm 0.18}}{{12{\kern 1pt} - {\kern 1pt} 14}}$ | $\frac{{12.65 \pm 0.16}}{{12{\kern 1pt} - {\kern 1pt} 15}}$ | $\frac{{12.53 \pm 0.14}}{{12{\kern 1pt} - {\kern 1pt} 14}}$ | $\frac{{12.59 \pm 0.20}}{{12{\kern 1pt} - {\kern 1pt} 15}}$ |
| V | $\frac{{8.00 \pm 0}}{ - }$ | $\frac{{7.87 \pm 0.10}}{{7{\kern 1pt} - {\kern 1pt} 8}}$ | $\frac{{7.92 \pm 0.08}}{{7{\kern 1pt} - {\kern 1pt} 8}}$ | $\frac{{7.95 \pm 0.13}}{{7{\kern 1pt} - {\kern 1pt} 8}}$ |
| rb.1 | $\frac{{11.82 \pm 0.23}}{{11{\kern 1pt} - {\kern 1pt} 13}}$ | $\frac{{11.71 \pm 0.17}}{{10{\kern 1pt} - {\kern 1pt} 13}}$ | $\frac{{11.73 \pm 0.18}}{{10{\kern 1pt} - {\kern 1pt} 13}}$ | $\frac{{11.84 \pm 0.24}}{{10{\kern 1pt} - {\kern 1pt} 13}}$ |
| rb.2 | $\frac{{11.54 \pm 0.16}}{{11{\kern 1pt} - {\kern 1pt} 12}}$ | $\frac{{11.46 \pm 0.16}}{{10{\kern 1pt} - {\kern 1pt} 13}}$ | $\frac{{11.22 \pm 0.16}}{{9{\kern 1pt} - {\kern 1pt} 12}}$ | $\frac{{11.50 \pm 0.22}}{{10{\kern 1pt} - {\kern 1pt} 12}}$ |
| sp.br | $\frac{{23.81 \pm 0.29}}{{22{\kern 1pt} - {\kern 1pt} 25}}$ | $\frac{{21.76 \pm 0.22}}{{20{\kern 1pt} - {\kern 1pt} 25}}$ | $\frac{{21.81 \pm 0.19}}{{19{\kern 1pt} - {\kern 1pt} 24}}$ | $\frac{{21.70 \pm 0.28}}{{19{\kern 1pt} - {\kern 1pt} 24}}$ |
| vert. | $\frac{{66.82 \pm 0.40}}{{64{\kern 1pt} - {\kern 1pt} 68}}$ | $\frac{{66.33 \pm 0.44}}{{64{\kern 1pt} - {\kern 1pt} 69}}$ | $\frac{{66.18 \pm 0.39}}{{64{\kern 1pt} - {\kern 1pt} 69}}$ | $\frac{{66.46 \pm 0.62}}{{65{\kern 1pt} - {\kern 1pt} 68}}$ |
Примечание. ll – число прободённых чешуй в боковой линии; D, A, P, V – число ветвистых лучей в спинном, анальном, грудном и брюшном плавниках; rb.1, rb.2 – число жаберных лучей на 1-й жаберной дуге слева и справа; sp.br – число жаберных тычинок слева, vert. – число позвонков; *n = 21; над чертой – среднее значение и его ошибка, под чертой – пределы варьирования показателя.
Данные сравнительного анализа говорят о том, что изолированная популяция гольцов р. Водопадная является дериватом проходной мальмы, сохранившим основные определительные признаки вида. Об этом свидетельствует и аллельный состав микросателлитных локусов изолированной популяции, разнообразие которых находится в пределах изменчивости аллелей анадромной мальмы, за исключением одного приватного аллеля, обнаруженного у гольцов р. Водопадная, но не выявленного у проходных гольцов (табл. 3). Примечательно, что в условиях изоляции практически не произошло существенных смещений диагностических морфологических признаков; изменения затронули в основном темп роста. Однако при этом у гольцов р. Водопадная не произошло резкого уменьшения размеров тела, как это часто наблюдается у ручьевых изолятов северной мальмы (Волобуев, 1978; Reist et al., 2001; Behnke, 2002; Kowalchuk et al., 2010a, 2010b; Есин, 2015).
Обнаруженный нами изолят северной мальмы на Командорских о-вах по своим биологическим характеристикам несколько отличается от других описанных изолированных популяций вида. Как правило, изоляты северной мальмы − это населяющие небольшие ручьи обоеполые группировки, представленные мелкими (FL 100−180 мм) особями с ювенильным обликом, с меньшей продолжительностью жизни по сравнению с проходными рыбами (Reist et al., 2001; Behnke, 2002; Groening, 2008; Mochnacz et al., 2009; Kowalchuk et al., 2010а, 2010б; Reist, Sawatzky, 2010; Есин, 2015). В р. Водопадная гольцы изолированной популяции имеют сравнительно крупные размеры, специфическую окраску, отличающую их как от ювенильных, так и от проходных особей северной мальмы. Характерной особенностью гольцов из р. Водопадная является невыраженный брачный наряд половозрелых особей, тогда как для ручьевых изолятов северной мальмы, наоборот, свойственна яркая окраска даже вне периода размножения (Kowalchuk et al., 2010а; Stewart et al., 2010; Есин, 2015). Отличия изолированной популяции гольцов из р. Водопадная определяются, по-видимому, геоморфологией речного бассейна, когда в бассейне типичной горной реки образовалось озероподобное расширение и участок с системой параллельных проток, протекающих по более или менее выровненной местности. В результате популяция гольцов обитает в системе озеро−долина, в которой сложились уникальные (для изолята мальмы) условия существования, предопределившие, помимо прочего, озёрно-речной образ жизни рыб. Кроме того, непреодолимый для проходных рыб водопад расположен в нижнем участке р. Водопадная, фактически – при её впадении в море. По этой причине ниже водопада не обитает проходная мальма, что также делает изолированную выше водопада популяцию уникальным явлением в структуре вида S. malma.
В то же время происхождение изолята мальмы в р. Водопадная в полной мере соответствует другим случаям, описанным в литературе. А именно, за редчайшими исключениями (одна популяция ручьевых гольцов в р. Пономарка (бассейн оз. Азабачье) на Камчатке (Есин, 2015)) возникновение и формирование резидентного образа жизни и обоеполой самовоспроизводящейся изолированной популяции связано с возникновением в результате геологических процессов непреодолимого барьера на пути анадромных особей проходной мальмы (Armstrong, Morrow, 1980; McCart, 1980; Hino et al., 1990; Reist et al., 2001; Behnke, 2002; Groening, 2008; Mochnacz et al., 2009; Kowalchuk et al., 2010а, 2010б; Reist, Sawatzky, 2010; Есин, 2015). По типу происхождения резидентных обоеполых популяций северная мальма отличается от южной S. curilus, у которой такие пресноводные группировки могут образовываться как в условиях полной изоляции выше непреодолимых преград, так и в условиях свободного стока ручья или реки и доступа в них проходных рыб при сохранении своей обособленности (Maekawa, 1984; Morita et al., 2005; Пичугин и др., 2006; Umatani et al., 2008; Рыбы …, 2012).
Возникновение водопада в бассейне р. Водопадная является результатом сложных тектонических процессов, происходящих в так называемой зоне Командорского горизонтального сдвига, которая характеризуется наличием множества разломов разного размера, проходящих как по океанскому дну, так и по суше самих островов (Бахтеев и др., 1992; Селивёрстов, 1998; Баранов и др., 2010). Непосредственно на о-ве Беринга имеется от 9 до 13 локальных тектонических разрывов (Baranov et al., 1991; Баранов и др., 2010; Чебров и др., 2019), формирующих несколько десятков трансформных блоков (Кравчуновская, 2008). Известно, что активные разломы секут молодые формы рельефа, смещают русла рек; в районе разломов наблюдаются вертикальные смещения, особенно в районе русел рек, которые могут достигать значений от нескольких до 20−25 м (Левин и др., 2006; Kozhurin, 2007; Баранов и др., 2010). Кроме того, по границам разломов могут наблюдаться и другие явления, в том числе – сбросы горных пород, особенно вдоль обрывистой береговой линии (Левин и др., 2006). Тихоокеанское побережье о-ва Беринга, где расположена р. Водопадная, как раз и является такой зоной – с близким положением океанского свала и изрезанной береговой линией (Чуян и др., 2004). Таким образом, водопад в нижнем течении р. Водопадная мог сформироваться как в результате мощного сброса, характерного для тектонических процессов на тихоокеанском побережье о-ва Беринга, так и в результате вертикального поднятия трансформенных блоков земной коры. Видимо, более вероятен второй путь – поднятие блоков, так как именно в окрестностях р. Водопадная находятся несколько литосферных блоков, опережающих фоновое поднятие, свойственное о-ву Беринга в целом (Кравчуновская, 2008). Косвенным свидетельством тому является сравнительно широкая зона поднятия приморского участка (~ 1 км) нижнего течения р. Водопадная, фактически – от места вытекания реки из озера, что указывает на подпорный характер озера. Точное время образования водопада не ясно. Есть основания полагать, что подъём литосферного блока в нижнем течении реки прото-Водопадная мог произойти в результате сильного землетрясения примерно 12−10 тыс. лет назад (Чебров и др., 2019) или существенно позже − всего 4−3 тыс. лет назад (Мараков, 1972). Учитывая, что оледенения на Комадорских о-вах не установлены (Левин и др., 2006; Кравчуновская, 2008), возраст существования изолята мальмы в современной р. Водопадная может составлять от 3 до 12 тыс. лет. Датировка формирования изолированной популяции на основании генетических дистанций в 9500 лет соответствует этим предположениям и позволяет считать гольцов в р. Водопадная изолированными в течение довольно длительного времени. Значительный уровень генетической дивергенции, наблюдаемый между изолированной жилой и проходной мальмой Командорских о-вов, свидетельствует в пользу гипотезы о продолжительной самостоятельной эволюции исследуемых популяций.
В реках о-ва Беринга водопады встречаются не только в бассейне р. Водопадная. Обследование, проведённое нами в 2015 и 2016 гг. на 32 водных системах острова, показало, что крутые водопады с перепадом высот от 1 до 3 м встречаются в большинстве из них. Но почти все эти водопады расположены в верховьях рек, среди горных отрогов и отрезают сравнительно короткие участки длиной от 200 до 700 м. Обычно в верховьях рек о‑ва Беринга, даже при отсутствии каких-либо водопадов или порогов, рыбы нет; даже проходная мальма не использует их для размножения. Таким образом, в р. Водопадная в настоящее время обитает единственная на островах Беринга и Медный изолированная популяция вида.
Проходная мальма Командорских о-вов имеет ряд отличий от других популяций северной мальмы по возрастному составу, некоторым морфологическим и генетическим признакам (Сошнина и др., 2016; Малютина и др., 2017). Обнаруженный же нами изолят северной мальмы по морфологическим параметрам в целом укладывается в рамки изменчивости командорских популяций вида, однако характеризуется более чем в два раза меньшими оценками генетического разнообразия по сравнению с проходной мальмой Командорских о-вов и значительным уровнем генетической дивергенции от неё. Эти особенности сформировались в результате случайного “дрейфа” генов в течение длительного периода изоляции, а также, вероятно, связаны с “эффектом основателя”, периодическим снижением эффективной численности популяции и инбридингом. Биологические и генетические особенности изолята, низкая численность и обитание в очень ограниченном пространстве дают основание говорить о том, что популяция гольцов р. Водопадная представляет собой уникальную единицу разнообразия как среди Командорских популяций, так и в целом у вида северная мальма.
Река Водопадная расположена на территории Командорского заповедника и, следовательно, изолят северной мальмы в этой реке находится под особой охраной и по этой причине может рассматриваться как свободный от антропогенного воздействия модельный первозданный природный объект для изучения микроэволюционных процессов и потенциальных возможностей рыб при освоении ими разнообразных мест обитания в меняющихся условиях бореальной зоны Северной Пацифики.
Список литературы
Алтухов Ю.П. 2003. Генетические процессы в популяциях. М.: Академкнига, 432 с.
Баранов Б.В., Гедике К., Фрейтаг Р., Дозорова К.А. 2010. Активные разломы юго-восточной части Камчатского полуострова и Командорская зона сдвига // Вестн. КРАУНЦ. Науки о Земле. № 2. Вып. № 16. С. 66–77.
Бахтеев М.К., Морозов О.Ю., Тихомирова С.Р. 1992. О парагенезисе позднекайнозойских структур зоны сочленения Курило-Камчатской и Алеутской островных дуг // Изв. вузов. Геология и разведка. № 3. С. 18–25.
Волобуев В.В. 1978. О карликовых ручьевых гольцах рода Salvelinus (Nilsson) Richardson материкового побережья Охотского моря // Систематика и биология пресноводных организмов северо-востока Азии. Т. 49. Владивосток: Изд-во БПИ ДВО АН СССР. С. 96–111.
Груздева М.А., Семенова А.В., Кузищин К.В. и др. 2020. Генетическая изменчивость мальмы (Salvelinus malma), кунджи (Salvelinus leuсomaenis) и межвидовых гибридов из реки Утхолок (северо-западная Камчатка) // Генетика. Т. 56. № 1. С. 78–88. https://doi.org/10.31857/S0016675819090066
Есин Е.В. 2015. Ручьевая мальма Salvelinus malma полуострова Камчатка // Вопр. ихтиологии. Т. 55. № 2. С. 180–195. https://doi.org/10.7868/S0042875215020083
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus Азиатской части Северной Пацифики: происхождение, эволюция и современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Кравчуновская Е.А. 2008. Определение относительного возраста движения блоков земной коры методами морфотектоники (на примере острова Беринга) // Вестн. МГУ. Сер. 5. География. № 4. С. 37−41.
Лакин Г.Ф. 1990. Биометрия. М.: Высш. шк., 347 с.
Левин В.Е., Магуськин М.А., Бахтиаров В.Ф. и др. 2006. Мультисистемный геодезический мониторинг современных движений земной коры на Камчатке и Командорских островах // Вулканология и сейсмология. № 3. С. 54−67.
Малютина А.М., Филенко В.А., Поляков М.П. и др. 2017. Структура популяций и биологические особенности мальмы Salvelinus malma (Walbaum) из рек острова Беринга (Командорские острова) // Матер. XVIII Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 340−345.
Мараков С.В. 1972. Природа и животный мир Командор. М.: Наука, 184 с.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Л.: Изд-во ГосНИОРХ, 102 с.
Олейник А.Г., Скурихина Л.А., Чукова Е.И. 2007. Влияние изоляции на генетические характеристики популяций гольцов рода Salvelinus // Генетика. Т. 43. № 9. С. 1209−1217.
Омельченко В.Т. 2005. Гольцы рода Salvelinus Richardson (Salmoniformes, Salmonidae): генетическая дивергенция популяций Северо-Востока и Дальнего Востока России // Чт. памяти В.Я. Леванидова. Вып. 3. С. 492−509.
Осинов А.Г., Гордеева Н.В. 2008. Изменчивость микросателлитной ДНК и генетическая дифференциация популяций жилой формы мальмы Salvelinus malma krascheninnikovi Сахалина // Вопр. ихтиологии. Т. 48. № 6. С. 723−738.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Науч. мир, 200 с.
Пичугин М.Ю. 2015. Особенности роста и развития скелета ранней молоди северной мальмы Salvelinus malma malma из рек западной Камчатки в связи с температурным режимом нерестилищ // Вопр. ихтиологии. Т. 55. № 4. С. 435−452. https://doi.org/10.7868/S0042875215040128
Пичугин М.Ю., Сидоров Л.К., Гриценко О.Ф. 2006. О ручьевых гольцах южных Курильских островов и возможном механизме образования карликовых форм мальмы Salvelinus malma curilus // Там же. Т. 46. № 2. С. 224−239.
Правдин И.Ф. 1966. Руководство по изучению рыб. М: Пищепромиздат, 420 с.
Руководство по изучению питания рыб в естественных условиях. 1961. М.: Изд-во АН СССР, 263 с.
Рыбы Курильских островов. 2012 / Под ред. Гриценко О.Ф. М.: Изд-во ВНИРО, 384 с.
Савваитова К.А. 1989. Арктические гольцы. М.: Агропромиздат, 224 с.
Савваитова К.А., Романов Н.С. 1969. Некоторые особенности систематики и биологии карликовой ручьевой формы и молоди озёрно-речной формы арктического гольца Salvelinus alpinus (L.) из бассейна Азабачьего озера (Камчатка) // Биол. науки. № 8. С. 16–28.
Савваитова К.А., Груздева М.А., Кузищин К.В. и др. 2004. Ручьевые гольцы рода Salvelinus северных Курильских островов // Вопр. ихтиологии. Т. 44. № 1. С. 89–101.
Салменкова Е.А., Омельченко В.Т., Афанасьев К.И. и др. 2009. Генетическая дивергенция популяций белого гольца Salvelinus albus, северной и южной форм мальмы S. malma (Salmonidae) по микросателлитным локусам ДНК // Там же. Т. 49. № 6. С. 752–762.
Селиверстов Н.И. 1998. Строение дна прикамчатских акваторий и геодинамика зоны сочленения Курило-Камчатской и Алеутской островных дуг. М.: Науч. мир, 164 с.
Сошнина В.А., Павлов С.Д., Зеленина Д.А. 2016. Генетическое разнообразие гольцов Командорских островов по результатам исследования митохондриальной ДНК // Генетика. Т. 52. № 11. С. 1336–1341. https://doi.org/10.7868/S0016675816100106
Чебров Д.В., Чеброва А.Ю., Матвеенко Е.А. и др. 2019. Камчатка и Командорские острова // Землетрясения Северной Евразии. Вып. 22. Обнинск: Изд-во ФИЦ ЕГС РАН. С. 198–213. https://doi.org/10.35540/1818-6254.2019.22.17.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Лососевидные рыбы северо-востока России. Владивосток: Дальнаука, 496 с.
Чуян Г.Н., Разжигаева Н.Г., Быкасов В.Е. 2004. Геоморфология прибрежной зоны острова Беринга // Тр. Камчат. филиала ТИГ ДВО РАН. Вып. V. С. 421–426.
Шорыгин А.А. 1952. Питание и пищевые взаимоотношения рыб Каспийского моря. М.: Пищепромиздат, 268 с.
Armstrong J.B., Bond M.H. 2013. Phenotype flexibility in wild fish: Dolly Varden regulate assimilative capacity to capitalize on annual pulsed subsidies // J. Anim. Ecol. V. 82. P. 966–975. https://doi.org/10.1111/1365-2656.12066
Armstrong R.H., Morrow J.E. 1980. The Dolly Varden charr Salvelinus malma // Charrs, salmonid fishes of the genus Salvelinus / Ed. Balon E.K. Hague: Dr. W. Junk Publ. P. 99−139.
Baranov B.V., Seliverstov N.I., Muravev A.V. et al. 1991. The Komandorsky Basin as a product of spreading behind a transform plate boundary // Tectonophysics. V. 199. P. 237–269.
Baxter C.V., Hauer F.R., Woessner W.W. 2003. Measuring groundwater-stream water exchange: new techniques for installing minipiezometers and estimating hydraulic conductivity // Trans. Amer. Fish. Soc. V. 132. P. 493–502. https://doi.org/10.1577/1548-8659(2003)132<0493:MG-WENT>2.0.CO;2
Behnke R.J. 2002. Trout and salmon of North America. N. Y. et al.: Free Press, 359 p.
Bisson P.A., Montgomery D.R., Buffington J.M. 2006. Valley segments, stream reaches and channel units // Methods in stream ecology / Eds. Hauer F.R., Lamberti G.A. San Diego: Acad. Press. P. 23–51.
Busaker G.P., Adelman I.K., Goolish E.M. 1990. Growth // Methods for fish biology. V. 1 / Eds. Schreck C.B., Moule P.B. Bethesda, USA: Amer. Fish. Soc. P. 363–387.
Cornuet J.M., Luikart G. 1996. Description and power analysis of two tests for detecting recent population bottlenecks from allele frequency data // Genetics. V. 144. № 4. P. 2001–2014.
Dahm C.N., Valett H.M. 1996. Hyporheic Zones // Methods in stream ecology / Eds. Hauer F.R., Lamberti G.A. San Diego: Acad. Press. P. 107–123.
Denton K.P., Rich H.B., Quinn T.P. 2009. Diet, movement, and growth of Dolly Varden in response to sockeye salmon subsidies // Trans. Amer. Fish. Soc. V. 138. P. 1207–1219. https://doi.org/10.1577/T09-006.1
Dib C., Fauré S., Fizames C. et al. 1996. A comprehensive genetic map of the human genome based on 5,264 microsatellites // Nature. V. 380. № 6570. P. 152–154.
Dieringer D., Schlötterer C. 2003. Microsatellite analyser (MSA): a platform independent analysis tool for large microsatellite data sets // Mol. Ecol. Notes. V. 3. № 1. P. 167–169. https://doi.org/10.1046/j.1471-8286.2003.00351.x
Everett R.J., Wilmot R.L., Krueger C.C. 1998. Genetics investigations of Dolly Varden char (Salvelinus malma) of the North Slope of Alaska. Alaska Fish. Tech. Rept. № 43. Anchorage, Alaska: US Fish and Wildlife Service, 39 p.
Garza J.C., Williamson E.G. 2001. Detection of reduction in population size using data from microsatellite loci // Mol. Ecol. V. 10. № 2. P. 305−318. https://doi.org/10.1046/j.1365-294x.2001.01190.x
Goldstein D.B., Linares A.R., Cavalli-Sforza L.L., Feldman M.W. 1995. An evaluation of genetic distances for use with microsatellite loci // Genetics. V. 139. № 1. P. 463–471.
Gordeeva N.V., Chukova E.I., Oleinik A.G. 2010. Microsatellite genetic variation of Asian populations of Dolly Varden char // Hydrobiologia. V. 650. № 1. P. 133–144. https://doi.org/10.1007/s10750-010-0104-3
Groening L. 2008. Variation of Dolly Varden Salvelinus malma in northwestern North America: PcD Thesis. Univ. Winnipeg, 44 p.
Hino T., Maekawa K., Reinolds J.B. 1990. Alternative male mating behaviors in landlocked Dolly Varden (Salvelinus malma) in south-central Alaska // J. Ethol. V. 8. P. 13–20.
Kitano S., Shimazaki K. 1995. Spawning habitat and nest depth of female Dolly Varden Salvelinus malma of different body size // Fish. Sci. V. 61. № 5. P. 776–779.
Klemetsen A. 2013. The most variable vertebrate on Earth // J. Ichthyol. V. 53. № 10. P. 781–791. https://doi.org/10.1134/S0032945213100044
Kowalchuk M.W., Sawatzky C.D., Reist J.D. 2010a. A review of the taxonomic structure within Dolly Varden, Salvelinus malma (Walbaum 1792), of North America // DFO Can. Sci. Advis. Secr. Res. Doc. 2010/013. 16 p.
Kowalchuk M.W., Reist J.D., Bajno R., Sawatzky C.D. 2010б. Population structuring and inter-river movements of northern form Dolly Varden, Salvelinus malma malma (Walbaum 1792), along the North Slope of Canada and Alaska // Ibid. Doc. 2010/038. 17 p.
Kozhurin A. 2007. Active faulting in the Kamchatsky Peninsula, Kamchatka-Aleutian junction // Volcanism and Subduction: Kamchatka Region / Eds. Eichelberger J. et al. Washington: Amer. Geophys. Union. P. 263−282.
Lewis P.O., Zaykin D. 2001. Genetic data analysis: computer program for the analysis of allelic data. Version 1.0 (d16c). (http://lewis.eeb.uconn.edu/lewishome/software.html)
Maekawa K. 1984. Life history patterns of Miyabe charr in Shikaribetsu Lake, Japan // Biology of the Arctic charr / Eds. Johnson L., Burns B.L. Winnipeg: Univ. Manitoba Press. P. 223–250.
McCart P.J. 1980. A review of the systematics and ecology of Arctic charr, Salvelinus alpinus, in the western Arctic // Can. Tech. Rept. Fish. Aquat. Sci. № 935. 89 p.
Mitsuboshi T., Goto A., Yamazaki F. 1992. Genetic differentiation of the Dolly Varden Salvelinus malma in Hokkaido, Japan // Bull. Fac. Fish. Hokkaido Univ. V. 43. № 4. P. 153–161.
Mochnacz N.J., Backhouse S.M., Bajno R., Reist J.D. 2009. Biological and habitat data for fish collected during stream surveys in the southern (Deh Cho) and central (Sahtu) Northwest Territories, 2007 // Can. Data Rept. Fish. Aquat. Sci. V. 1209. 29 p.
Mochnacz N.J., Schroeder B.S., Sawatzky C.D., Reist J.D. 2010. Assessment of northern Dolly Varden, Salvelinus malma (Walbaum, 1792), habitat in Canada // Can. Manuscr. Rept. Fish. Aquat. Sci. № 2926. 58 p.
Morita K., Arai T., Kishi D., Tsuboi J. 2005. Small anadromous Salvelinus malma at the southern limits of its distribution // J. Fish. Biol. V. 66. P. 1187–1192. https://doi.org/10.1111/j.0022-1112.2005.00672.x
Oleinik A.G., Skurikhina L.A., Brykov V.A. 2007. Divergence of Salvelinus species from northeast Asia based on mitochondrial DNA // Ecol. Freshwat. Fish. V. 16. № 1. P. 87–98. https://doi.org/10.1111/j.1600-0633.2006.00187.x
Piry S., Luikart G., Cornuet J.M. 1999. BOTTLENECK: a computer program for detecting recent reductions in the effective population size using allele frequency data // J. Hered. V. 90. P. 502−503.
Raymond M., Rousset F. 1995. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism // Ibid. V. 86. P. 248−249.
Reist J.D., Sawatzky C.D. 2010. Diversity and distribution of chars, genus Salvelinus, in northwestern North America in the context of northern Dolly Varden (Salvelinus malma malma (Walbaum 1792)) // DFO Can. Sci. Advis. Secr. Res. Doc. 2010/014. 18 p.
Reist J.D., Babaluk J.A., Papst M.A. 2001. Biodiversity, life history and management of the anadromous fish of the western Canadian Arctic. Winnipeg: Fish. Oceans Canada, 77 p.
Stewart D.B., Mochnacz N.J., Reist J.D. et al. 2010. Fish life history and habitat use in the Northwest Territories: Dolly Varden (Salvelinus malma) // Can. Manuscr. Rept. Fish. Aquat. Sci. № 2915. 63 p.
Umatani Y., Arai T., Maekawa K. 2008. Variation in migratory history of Dolly Varden in a stream with an artificial dam in the Shiretoko Peninsula, Hokkaido, Japan // Environ. Biol. Fish. V. 83. P. 37–44. https://doi.org/10.1007/s10641-007-9249-y
Van Oosterhout C., Hutchinson W.F., Wills D.P., Shipley P. 2004. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. V. 4. № 3. P. 535–538. https://doi.org/10.1111/j.1471-8286.2004.00684.x
Williamson-Natesan E.G. 2005. Comparison of methods for detecting bottlenecks from microsatellite loci // Conserv. Genet. V. 6. № 4. P. 551−562. https://doi.org/10.1007/s10592-005-9009-5
Wipfli M.S., Hudson J.P., Caouette J.P., Chaloner D.T. 2003. Marine subsidies in freshwater ecosystems: salmon carcasses increase the growth rates of stream-resident salmonids // Trans. Amer. Fish. Soc. V. 132. P. 371–381. https://doi.org/10.1577/1548-8659(2003)132<0371:MSI-FES>2.0.CO;2
Yamamoto S., Kitano S., Maekawa K. et al. 2006. Introgressive hybridization between Dolly Varden Salvelinus malma and white-spotted char Salvelinus leucomaenis on Hokkaido Island, Japan // J. Fish Biol. V. 68. Suppl. A. P. 68–85. https://doi.org/10.1111/j.0022-1112.2006.00994.x.
Zhivotovsky L.A. 2001. Estimating divergence time with the use of microsatellite genetic distances: impacts of population growth and gene flow // Mol. Biol. Evol. V. 18. № 5. P. 700–709. https://doi.org/10.1093/oxfordjournals.molbev.a0038
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


