Вопросы ихтиологии, 2021, T. 61, № 3, стр. 273-286
Необычное строение органа обоняния у лунной Thalassoma lunare и шестиполосой T. hardwicke талассом (Labridae)
Н. И. Пащенко 1, *, А. О. Касумян 1, 2, Л. Т. К. Оань 3
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
3 Приморское отделение Совместного российско-вьетнамского тропического научно-исследовательского
и технологического центра
Нячанг, Вьетнам
* E-mail: visitgrusha@gmail.com
Поступила в редакцию 13.04.20
После доработки 15.04.20
Принята к публикации 15.04.20
Аннотация
Исследована макроморфология органа обоняния лунной Thalassoma lunare и шестиполосой T. hardwicke талассом. Орган обоняния имеет две ноздри. Тонкие стенки трубки передней ноздри легко смыкаются, задняя ноздря снабжена клапаном. Обонятельная розетка отсутствует, но имеется обонятельный диск и вертикальная перепонка – структуры, ранее не известные для органа обоняния рыб. Диск располагается на дне обонятельной полости в её ростральной части. По поверхности диска проходят небольшие гребни-складки, представляющие собой, по-видимому, рудименты первичных обонятельных складок. Выраженность гребней-складок, толщина и форма диска у лунной и шестиполосой талассом различаются. У обоих видов один вентиляционный мешок (лакримальный), он крупный и примыкает снизу к обонятельной полости, вход в него расположен на дне полости каудальнее от диска. Предложена схема вентиляции органа обоняния. Обсуждается возможность получения талассомами запаховой информации во время нахождения рыб в грунте при пережидании опасности.
Губановые (Labridae) − одно из наиболее многочисленных семейств морских костистых рыб, насчитывающее свыше 550 видов (Fricke et al., 2020). Совместно с филогенетически близкими Pomacentridae, входящими в подотряд Labroidei, губановые формируют основу прибрежной морской ихтиофауны в тропической и субтропической зонах, в частности коралловых рифов, – экосистем с крайне высокими продуктивностью и биоразнообразием. В последние годы сообщества коралловых рифов находятся под серьёзной угрозой существования из-за последствий, связанных с деятельностью человека и глобальными изменениями климата (Wilkinson, 2008; Ткаченко, 2015). Это предопределяет большое внимание к исследованиям биологии обитающих здесь организмов, в том числе рыб, играющих ключевую роль в этих экосистемах.
Губановые не только многочисленная группа рыб коралловых рифов, но и крайне разнообразная по биологии. Это делает их привлекательными объектами для различных сравнительных и других исследований, касающихся экологической и функциональной морфологии и локомоции (Wainwright, 1988; Wainwright et al., 2002, 2004; Walker, Westneat, 2002; Collar et al., 2008); размножения, эмбрионального развития и популяционной динамики (Hourigan et al., 1991; Masterson et al., 1997; Sponaugle, Cowen, 1997; Warner, 2005); питания, трофических и иных взаимодействий с другими представителями сообщества (Grutter, 2000; Jones et al., 2004; Bellwood et al., 2006; Nagel, Grutter, 2007; Morton et al., 2008; Lek et al., 2011, 2018; Price et al., 2011; Holmes et al., 2012; Holstein et al., 2014; Stier, White, 2014; Kramer et al., 2015). Уточняется систематика и филогения этой важной группы рыб (Westneat, 1993; Streelman, Karl, 1997; Westneat, Alfaro, 2005; Yaakub et al., 2006; Rocha, Bowen, 2008; Cowman et al., 2009; Kazancioglu et al., 2009; Price et al., 2011). На примере губановых, особенно в последние годы, выяснены многие интересные особенности поведения рыб – нерестового (Colin, 2010; Suzuki et al., 2010), территориального (Kramer, Chapman, 1999; Jones, 2005, 2007; Topping et al., 2005; Chateau, Wantiez, 2007), пищевого (Shepherd, Clarkson, 2001; Ferry-Graham et al., 2002; Fulton, Bellwood, 2002; Colefax et al., 2016), включая санитарное (рыбы-чистильщики) (Cheney et al., 2008; Francini-Filho, Sazima, 2008), стайного и других форм социальности (Мочек, 1987; White, Warner, 2007). На примере губановых исследуется мимикрия, характерная также для других рыб коралловых рифов (Moland et al., 2005; Randall, 2005; Robertson, 2013), обучение и когнитивные проявления (Coyer, 1995; Paśko, 2010; Jones et al., 2011; Brown, 2012; Miller, Pawlick, 2013; Dunn, 2016). Предпринимаются попытки искусственного воспроизводства некоторых видов рыб этого семейства (Slamet, Hutapea, 2005).
В исследованиях сенсорных систем губановых основные работы касаются зрения (Barry, Hawryshyn, 1999; Siebeck, Marshall, 2000; Lara, 2001), окраски и зрительной коммуникации в видимой области спектра (Losey et al., 1999; Marshall, 2000; Michiels et al., 2008; Braun et al., 2014). Чувствительность к ультрафиолетовому излучению у губановых, в отличие от близкородственных помацентровых, отрицается (Siebeck, Marshall, 2001), хотя ультрафиолетовые протекторы в их кожной слизи присутствуют (Eckes et al., 2008). Другие сенсорные системы изучены значительно слабее. Наличие у губановых развитого слуха и звуковой сигнализации ранее ставилось под сомнение (Tavolga, Wodinsky, 1963), однако позднее была выявлена способность этих рыб определять направление на источник звука (Schuijf et al., 1972), а также издавать звуки при охране своих участков и нересте (Steinberg et al., 1965; Boyle, Cox, 2009; Tricas, Boyle, 2014). Специальные исследования вкусовой системы губановых не проводились, но использование этих рыб (Thalassoma spp.) в экспериментах по тестированию вкусовых качеств различных гидробионтов (Pawlik et al., 1995; McClintock et al., 1999; Schubert et al., 2003; Marty et al., 2016) указывает на наличие у них развитой вкусовой рецепции.
В последние годы начаты работы по изучению обоняния губановых. Эти исследования инициированы попытками выяснить, каким образом ранняя молодь, проходящая у губановых и ряда других рыб коралловых рифов пелагическую фазу в открытом океане (до 4 мес.) (Victor, 1986), находит путь к берегам мест расселения. Показано, что ориентация мигрирующей молоди, а также выбор конкретного биотопа в пределах кораллового рифа могут происходить с участием обоняния (Sweatman, 1988; Atema et al., 2002; Døving et al., 2006; Gerlach et al., 2007; Lecchini et al., 2007; Dixson et al., 2008; Vail, McCormick, 2011; Coppock et al., 2013, 2016; Lecchini, Nakamura, 2013). Известно, что к возрасту перехода от пелагического к оседлому образу жизни в органе обоняния сформированы входные и выходные обонятельные отверстия (ноздри), различающиеся у разных видов морфологией (Lara, 2008). У одних видов обонятельные складки отсутствуют или рудиментарны, у других развиты лучше и образуют обонятельную розетку (Døving et al., 1977; Yamamoto, Ueda, 1979; Lara, 2008). Имеется дополнительный мешок, вентилирующий обонятельную полость (Døving et al., 1977). В обонятельном эпителии найдены жгутиковые и микровиллярные сенсорные нейроны, их распределение и плотность на единицу поверхности видоспецифичны (Yamamoto, Ueda, 1979; Lara, 2008). Однако в целом имеющиеся данные об устройстве органа обоняния у губановых рыб, включая макроморфологию его основных структур, малочисленны, фрагментарны и в значительной части поверхностны, некоторые из них не совпадают у разных видов или противоречивы. Последнее может быть обусловлено необычайно большим разнообразием биологических характеристик губановых (Randall et al., 1997; Westneat et al., 2005).
Цель работы − выполнить детальное описание органа обоняния у двух представителей этого семейства, широко распространённых в коралловых рифах Индо-Пацифики – лунной талассомы Thalassoma lunare и шестиполосой талассомы T. hardwicke, а также исследовать вентиляцию органа обоняния, поскольку для губановых характерен малоподвижный и скрытый образ жизни в ночные часы, образование слизистого защитного кокона и/или зарывание в грунт (Winn, 1955; Winn, Bardach, 1959; Randall et al., 1997; DeLoach, 1999; Lara, 2008; Grutter et al., 2011).
МАТЕРИАЛ И МЕТОДИКА
Морфологическому анализу подвергнуты особи разного возраста двух видов талассом – лунной и шестиполосой. Рыб отловили сетными орудиями на коралловых рифах в зал. Нячанг (Южно-Китайское море, Вьетнам) и доставили живыми в лабораторию Приморского отделения Совместного российско-вьетнамского тропического научно-исследовательского и технологического центра (г. Нячанг). После измерения абсолютной длины (TL) рыб фиксировали в 6%-ном формалине, затем переводили в 70%-ный этиловый спирт. Препарирование и исследование морфологии органа обоняния выполнены под бинокулярным микроскопом МБС-1. Фотографии и рисунки на их основе выполнены с использованием цифровой фотокамеры Levenhuk M500 Base. Для измерений использовали окулярный микрометр. Наблюдения за потоками воды в органе обоняния выполнены на фиксированных препаратах при механической имитации движения челюстей с использованием взвеси чёрной китайской туши. Всего морфологическому исследованию подвергнуты 10 особей лунной талассомы (TL 6.5–14.5 см) и 11 особей шестиполосой талассомы (TL 9.5–14.5 см).
РЕЗУЛЬТАТЫ
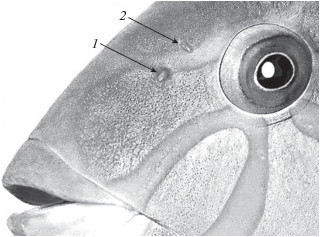
Строение ограна обоняния. Парные органы обоняния у обоих видов талассом располагаются на дорсальной поверхности головы впереди и медиальнее глаз и открываются наружу небольшими ноздрями – передней (входной) и задней (выходной) (рис. 1). Передняя ноздря имеет вид короткой обращённой вперёд трубки, выступающей из центра неглубокой выемки (рис. 2а). Стенки передней ноздри тонкие и легко смыкаются в латерально-медиальном направлении, полностью перекрывая ток воды во внутрь обонятельной полости (рис. 2б). Задняя ноздря − округлое отверстие с тонким эпидермальным клапаном почти полулунной формы, отходящим от рострального края ноздри (рис. 2в). Клапан способен полностью перекрывать отверстие или оставлять открытым лишь поперечный щелевидный просвет (рис. 2г). Внешний вид и относительные размеры передней ноздри у обоих видов примерно одинаковы, а относительные размеры задней ноздри у лунной талассомы меньше, чем у шестиполосой (таблица). У обоих видов просвет передней ноздри примерно в 1.5 раза меньше, чем у задней.
Рис. 2.
Ноздри шестиполосой талассомы Thalassoma hardwicke: а, б – передняя (а – открытая, б − с сомкнутыми стенками трубки); в, г – задняя (в − с открытым клапаном, г − с закрытым); Р↔К – рострокаудальное направление. Масштаб: 1 мм.

Некоторые морфологические параметры лунной Thalassoma lunare и шестиполосой T. hardwicke талассом
| Признак | T. lunare | T. hardwicke | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Длина (TL), мм | |||||||||||||||||||||
| 65 | 80 | 90 | 110 | 110 | 110 | 115 | 115 | 120 | 145 | 95 | 100 | 100 | 110 | 115 | 125 | 130 | 140 | 140 | 140 | 145 | |
| В мм | |||||||||||||||||||||
| c | 15.3 | 18.0 | 22.0 | 24.0 | 25.0 | 24.0 | 28.0 | 28.0 | 34.0 | 40.0 | 25.0 | 26.0 | 28.0 | 26.0 | 34.0 | 32.0 | 35.0 | 33.0 | 36.0 | 36.0 | 36.0 |
| o | 3.2 | 3.8 | 4.5 | 4.4 | 4.9 | 4.9 | 4.5 | 4.3 | 5.0 | 5.6 | 4.5 | 4.7 | 4.8 | 4.7 | 5.8 | 5.4 | 6.2 | 5.9 | 7.7 | 6.2 | 6.2 |
| Loo | 2.0 | 2.1 | 2.5 | 2.6 | 2.7 | 2.2 | 2.7 | 2.5 | 3.3 | 4.3 | 2.7 | 2.4 | 2.7 | 2.1 | 3.3 | 2.5 | 2.7 | 3.8 | 3.9 | 3.5 | 4.2 |
| Don | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 | 0.5 | 0.4 | 0.6 | 0.6 | 0.5 | 0.4 | 0.4 | 0.3 | 0.4 | 0.4 | 0.5 | 0.6 | 0.6 | 0.5 | 0.6 |
| Lon | 0.4 | 0.4 | 0.5 | 0.6 | 0.6 | 0.5 | 0.6 | 0.5 | 0.8 | 0.8 | 0.7 | 0.7 | 0.6 | 0.4 | 0.7 | 0.7 | 0.8 | 0.8 | 1.0 | 0.8 | 0.8 |
| Wpn | 0.4 | 0.4 | 0.5 | 0.5 | 0.5 | 0.5 | 0.8 | 0.5 | 0.9 | 0.9 | 0.7 | 0.5 | 0.6 | 0.5 | 0.9 | 0.7 | 1.0 | 1.0 | 1.1 | 1.1 | 1.1 |
| Lor | 0.8 | 0.9 | 1.1 | 1.2 | 1.4 | 1.3 | 1.3 | 1.2 | 1.5 | 2.4 | 1.1 | 1.4 | 1.1 | 1.1 | 1.4 | 1.5 | 1.7 | 1.8 | 1.8 | 1.7 | 2.1 |
| Wor | 0.9 | 0.8 | 1.0 | 1.2 | 1.2 | 1.3 | 1.1 | 1.1 | 1.4 | 1.9 | 1.2 | 1.4 | 1.3 | 0.6 | 1.8 | 1.6 | 1.8 | 1.7 | 1.9 | 1.9 | 1.9 |
| Las | 2.3 | 2.5 | 3.0 | 4.0 | 4.0 | 4.2 | 4.0 | 4.0 | 4.2 | 4.2 | 4.5 | 5.0 | 5.2 | 4.8 | 6.0 | 7.0 | 7.2 | 6.5 | 8.0 | 8.2 | 8.0 |
| Was | 2.5 | 2.0 | 2.5 | 2.9 | 3.0 | 3.2 | 3.3 | 3.4 | 3.3 | 3.2 | 2.7 | 3.0 | 4.0 | 2.5 | 4.8 | 4.2 | 4.7 | 4.6 | 5.0 | 5.0 | 4.5 |
| В % TL | |||||||||||||||||||||
| o | 4.92 | 4.75 | 5.00 | 4.00 | 4.45 | 4.45 | 3.91 | 3.74 | 4.17 | 3.86 | 4.74 | 4.70 | 4.80 | 4.27 | 5.04 | 4.32 | 4.77 | 4.21 | 5.50 | 4.43 | 4.28 |
| Loo | 3.08 | 2.63 | 2.78 | 2.36 | 2.45 | 2.00 | 2.35 | 2.17 | 2.75 | 2.97 | 2.84 | 2.40 | 2.70 | 1.91 | 2.87 | 2.00 | 2.08 | 2.71 | 2.79 | 2.50 | 2.90 |
| Lor | 1.23 | 1.13 | 1.22 | 1.09 | 1.27 | 1.18 | 1.13 | 1.04 | 1.25 | 1.66 | 1.16 | 1.40 | 1.10 | 1.00 | 1.22 | 1.20 | 1.31 | 1.29 | 1.29 | 1.21 | 1.45 |
Примечание. TL – полная длина, с – длина головы, o – диаметр глаза, Loo – длина обонятельной капсулы, Don – толщина трубки передней ноздри, Lon – длина трубки передней ноздри, Wpn – длина щели задней ноздри, Lor – длина обонятельной пластины, Wor – ширина обонятельной пластины, Las – длина вентиляционного мешка, Was – ширина вентиляционного мешка.
Обонятельная полость овальной формы, уплощена в латерально-медиальном направлении (сильнее у лунной талассомы, чем у шестиполосой), окружена скелетной капсулой и перекрыта костно-хрящевой крышей. Размеры обонятельной полости у близких по длине особей обоих видов примерно равны (таблица). В ростральной части полости на вентромедиальной поверхности располагается округлый обонятельный диск с невысоким коническим выступом в центре (рис. 3). Проекция передней ноздри на диск и вершина выступа совпадают (рис. 4). У лунной талассомы диск тонкий (~0.1 мм) и более правильной формы (рис. 3а), у шестиполосой − более толстый (~0.3 мм), сложнее по форме и сильнее выступающий над прилегающей поверхностью (рис. 3б).
Рис. 3.
Обонятельная полость лунной Thalassoma lunare (а) и шестиполосой T. hardwicke (б) талассом: 3 – обонятельный диск, 4 – отверстие, ведущее в лакримальный вентиляционный мешок; ост. обозначения см. на рис. 2. Масштаб: 0.5 мм.
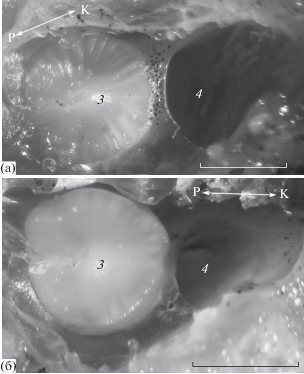
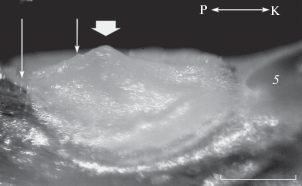
Рис. 4.
Обонятельный диск шестиполосой талассомы Thalassoma hardwicke, вид сбоку: ($ \downarrow $) – на чало и конец соединительнотканной перепонки, (⇓) – конический выступ обонятельного диска, 5 – лакримальный вентиляционный мешок; ост. обозначения см. на рис. 2. Масштаб: 0.5 мм.
На поверхности диска видны небольшие гребни – рудименты обонятельных складок – и тёмные островки, образованные, по-видимому, киноцилиями реснитчатых клеток. Гребни-складки расходятся радиально от рострального конца рудимента центральной складки (септы), ориентированного рострокаудально и смещённого от центра диска в ростральную сторону, но не доходящего до края диска. Микрорельеф, образуемый гребнями-складками, выражен лучше у лунной талассомы, чем у шестиполосой, у которой гребни широкие, пологие и плохо различимые (рис. 3). Под гребнями просматриваются нервные тяжи и формируемый ими обонятельный нерв, который тянется от центра диска в направлении головного мозга.
Ростральнее от рудимента центральной складки находится вертикальная полупрозрачная соединительнотканная перепонка (рис. 4). Она идёт от дна обонятельной полости, проходит через выемку в диске и достигает свода полости. У наиболее крупных особей ширина перепонки составляет почти половину расстояния от центра диска до его края у лунной талассомы и почти треть этого расстояния у шестиполосой.
На дне носовой полости каудальнее обонятельного диска находится отверстие лакримального вентиляционного мешка. По размеру отверстие близко к размерам задней ноздри, у лунной талассомы оно несколько больше диаметра обонятельного диска, у шестиполосой – значительно меньше его (рис. 3). Вентиляционный мешок располагается под обонятельной полостью, у лунной талассомы он приближается к глазу намного больше (рис. 5а, 5б), чем у шестиполосой (рис. 5в, 5г). Мешок выстлан тонкой и прочной соединительнотканной оболочкой, которая в дорсальной части мешка отделяет его от обонятельной полости. Относительные размеры (объём) вентиляционного мешка меньше у лунной талассомы по сравнению с шестиполосой, у которой форма мешка сложнее из-за рельефных выступов окружающих его костей.
Рис. 5.
Орган обоняния у особей лунной талассомы Thalassoma lunare (а, б) и шестиполосой талассомы T. hardwicke (в, г) разного размера: а – TL 6.5 см, б – TL 14.0 см, в – TL 9.5 см, г – TL 14.5 см; обозначения см. на рис. 2−4.
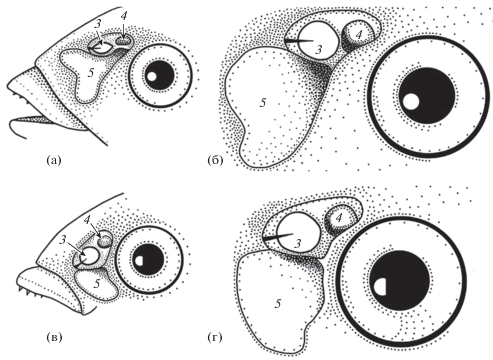
Чем крупнее рыбы, тем больше абсолютные размеры органа обоняния и его структур (таблица) и больше рудиментарных складок-гребней на поверхности обонятельного диска. Так, у особей лунной талассомы TL 6.5 и 14.5 см гребней-складок соответственно 7 и 24. Образование рудиментов новых гребней-складок происходит в ростральной части обонятельного диска с медиальной и латеральной сторон от места крепления вертикальной перепонки. Здесь сквозь гомогенный по структуре диск нервные тяжи ещё не видны, а на его ровной поверхности гребни-складки отсутствуют либо выражены крайне слабо.
По мере увеличения длины рыб вентиляционный мешок становится больше по своим абсолютным (длина, ширина) и относительным (по сравнению с обонятельной полостью и глазом) размерам (рис. 5; таблица).
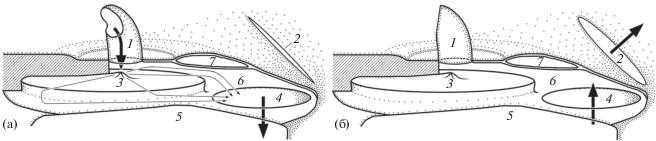
Вентиляция органа обоняния. Принудительное раскрытие и закрытие челюстей у фиксированных препаратов рыб позволило проследить за потоками воды в органе обоняния. При раскрытии челюстей вода поступает в обонятельную полость. Клапан задней ноздри при этом прилегает к отверстию и перекрывает его. Вода входит через переднюю ноздрю и попадает на конусовидное выпячивание в центре обонятельного диска (рис. 6а), рассекающее поток и направляющее его вдоль гребней-складок на поверхности диска. Далее вода вовлекается внутрь расширяющегося лакримального мешка. При закрывании челюстей вода выталкивается из сжимающегося вентиляционного мешка, а затем – из обонятельной полости наружу через заднюю ноздрю (рис. 6б). Выход воды через заднюю ноздрю происходит благодаря блокированию передней ноздри, тонкие стенки которой смыкаются, и полному раскрытию задней ноздри, складка-клапан которой потоком отводится вверх.
Рис. 6.
Схема потоков воды, входящих (а) и выходящих (б) из органа обоняния талассом Thalassoma, вид сбоку: ( ) – основные потоки, (→) – микропотоки, (
) – основные потоки, (→) – микропотоки, ( ) − соединительнотканная перепонка, 6 – обонятельная полость, 7 – носовая кость; ост. обозначения см. на рис. 1, 3, 4.
) − соединительнотканная перепонка, 6 – обонятельная полость, 7 – носовая кость; ост. обозначения см. на рис. 1, 3, 4.
ОБСУЖДЕНИЕ
Примерно треть всех морских рыб (~ 5000 видов) обитает в коралловых рифах (Lieske, Myers, 1994; Helfman et al., 1997). Среди этих рыб губановые по числу видов уступают лишь Gobiidae (Большой Барьерный риф) (Randall et al., 1997), но значительно превосходят другие группы по разнообразию своей морфологии, поведения и других сторон биологии (Nelson et al., 2016). Результаты нашего исследования подтверждают предположение о том, что разнообразие биологии губановых отражается и на строении органа обоняния. В отличие от ранее изученных рыб, у обоих видов талассом обонятельная розетка имеет необычный вид и представляет собой крупный обонятельный диск. Его форма и толщина у лунной и шестиполосой талассом различаются. По своей сути диск является конгломератом из слившихся вместе рудиментов первичных обонятельных складок, представляющих собой невысокие гребни на поверхности диска и названные нами гребнями-складками. Нервные тяжи под гребнями-складками подтверждают их исходную принадлежность к обонятельным складкам. Редукция, возможно, вызвана тем, что у талассом обонятельная полость небольшая и уплощённая.
Гребни-складки хорошо различимы у лунной талассомы, хуже – у шестиполосой. Без специальных гистологических исследований нельзя сказать определённо, чем заполнено пространство между редуцированными первичными складками. Вполне возможно, что его заполняет клеточная масса, образующаяся за счёт пролиферации клеток эпителия складок. Таким путём заполняется пространство между жаберными пластинками у золотого карася Carassius carassius при содержании в условиях нормоксии или при низкой температуре воды. У золотого карася морфологические преобразования в жабрах обратимы за счёт регуляции темпов клеточной пролиферации и апоптоза (Sollid et al., 2003, 2005), что вряд ли происходит у талассом.
Непонятно также, в каком возрасте и каким образом обонятельный диск формируется в онтогенезе талассом: сразу же как цельная структура или путём слияния молодых и остающихся некоторое время свободными первичных обонятельных складок? У наиболее мелкой из исследованных нами рыб – лунной талассомы TL 6.5 см − обонятельный диск уже имеется, а на его поверхности различимы семь гребней-складок. У шестиполосой талассомы TL 9.5 см гребни-складки на диске также присутствуют. Остаётся неясным, формируется ли обонятельный диск в онтогенезе талассом сразу как единая структура либо этому предшествует появление свободных обонятельных складок, сливающихся позднее. Поскольку у более крупных рыб гребней-складок становится больше, крайне интересно проследить за процессом появления новых рудиментов в уже образовавшемся обонятельном диске. Образование новых гребней-складок у талассом происходит в ростральной части обонятельного диска, т.е. аналогично тому, как возникают новые складки в обонятельной розетке у других рыб (Пащенко, Касумян, 1983, 1986, 2015, 2017).
Известно, что у губановой рыбы Parajulis poecilepterus TL 14 см имеется обонятельная розетка из восьми расходящихся веером складок, небольших по высоте, но хорошо заметных. У лжегубана Pseudolabrus japonicus (TL 8 см) обонятельных складок десять, но об их морфологическом развитии не сообщается (Yamamoto, Ueda, 1979). Упоминается об обонятельной розетке радиального типа с некрупными складками у радужного губана Labrus berggylta и губана-рябчика Crenilabrus cinereus (Døving et al., 1977). У других Labridae морфология органа обоняния изучена лишь у ранней молоди атлантических видов вскоре после завершения пелагической фазы и перехода к оседлости на коралловых рифах: обонятельные складки у молоди обнаружены не были, что послужило основанием для предположения о позднем их появлении (Lara, 2008). Ни у одного из перечисленных выше видов не отмечено наличие обонятельного диска. Исследованные нами T. lunare и T. hardwicke вместе с P. poecilepterus и P. japonicus в семействе Labridae входят в одну кладу (Aiello et al., 2017). Но, несмотря на близкое родство, эти виды различаются по макроморфологии органа обоняния. У P. poecilepterus и P. japonicus имеется обонятельная розетка, образованная хоть и некрупными, но морфологически выраженными и обособленными друг от друга обонятельными складками. У T. lunare и T. hardwicke такие складки отсутствуют, они сливаются и образуют единый обонятельный диск, в котором рудименты складок лишь угадываются. Считается, что устройство органа обоняния, в том числе тип обонятельной розетки и число складок в ней, является довольно консервативным морфологическим признаком (Yamamoto, 1982; Zeiske et al., 1992; Kasumyan, 2004). Выявленные различия между близкородственными видами Labridae являются отражением необычайно высокого морфологического и экологического разнообразия рыб этого обширного семейства. Несомненно, что представители Labridae могут служить удобными модельными объектами для более углублённого исследования диверсификации макроморфологии органа обоняния у близкородственных видов рыб.
Исследованные нами талассомы имеют две ноздри, входную и выходную, т.е. принадлежат к многочисленной группе рыб с дитремным типом органа обоняния (Døving, 1986). Особенность заключается в том, что задняя ноздря и, по-видимому, передняя у талассом могут перекрываться и временно блокировать сообщение между обонятельной полостью и окружающим рыб пространством. Достигаться это может при смыкании тонких стенок короткой трубки передней ноздри и при опускании клапана задней ноздри. Такая особенность имеет прямое отношение к водообмену в обонятельной полости (см. ниже). Но другим назначением такого устройства ноздрей может быть предотвращение попадания в орган обоняния мелких частиц при зарывании рыб в грунт при испуге или для безопасного ночлега, что характерно для исследованных талласом и многих других Labridae (Sponaugle, Cowen, 1997; Lara, 2008; Goemans, 2012). Такое защитное поведение характерно не только для взрослых рыб, но и для молоди, что объясняет относительно раннее формирование трубки передней ноздри и клапана в задней ноздре – уже у личинок и мальков этих рыб к моменту их расселения на рифе. В этом возрасте молодь Labridae может не покидать грунт длительное время (Lara, 2008). Кроме Labridae, наличие клапана в ноздрях характерно для многих других рыб, преимущественно малоподвижных донных и придонных, т.е. сталкивающихся с риском попадания в орган обоняния частиц грунта (Belanger et al., 2003; Mandal et al., 2005; Kuciel et al., 2011; Khaparde et al., 2012; Biswas et al., 2013; Sarkar et al., 2014; Kim et al., 2016; Касумян и др., 2021).
Прослеживание возрастных изменений морфологии органа обоняния у талассом не входило в задачи настоящей работы. Можно отметить, что обонятельный диск у талассом первоначально занимает вентромедиальное положение в обонятельной полости, но у крупных рыб он смещается на её медиальную стенку, что может быть вызвано уплощением обонятельной полости и формированием расположенного вплотную к ней крупного вентиляционного мешка.
Способ обмена воды в органе обоняния с помощью вентиляционных мешков называют циклосматией (Døving, 1986). Считается, что чаще всего циклосматия встречается у рыб, ведущих малоподвижный образ жизни или населяющих водоёмы со стоячей водой (Pleuronectidae, Polypteridae, Dipnoi и др.), хотя в этом правиле много исключений (Clupeidae, Salmonidae, Thunnidae, Coryphaenidae, Istiophoridae) (Gooding, 1963; Mana, Kawamura, 2002; Kasumyan, 2004). Большинство исследованных видов отряда Perciformes имеют два вентиляционных мешка – лакримальный и медиальный (Burne, 1909; Kapoor, Ojha, 1972, 1973; Døving et al., 1977; Sinha, Sinha, 1990; Belanger et al., 2003; Касумян и др., 2021). Но у некоторых представителей этого отряда имеется три вентиляционных мешка – угольщик Aphanopus carbo (Trichiuridae) (Holl, Meinel, 1968), у других видов, как и у талассом, только один вентиляционный мешок – малый морской дракон Trachinus viper (Trachinidae), атлантическая скумбрия Scomber scombrus (Scombridae), золотистый змееголов Channa marulius (Channidae), обыкновенный илистый прыгун Periophthalmus barbarus (Periophthalmidae) и др. (Burne, 1909; Kuciel et al., 2013).
Регулируемый просвет ноздрей, узкая обонятельная полость и большой вентиляционный мешок обеспечивают эффективный водообмен у поверхности обонятельного диска талассом, где у них, вероятно, располагаются обонятельные сенсорные нейроны. На это указывают характерные участки на поверхности диска, образованные, по-видимому, киноцилями реснитчатых клеток, между которыми могут находиться островки сенсорного эпителия. У других Labridae, имеющих хоть рудиментарные, но более выраженные, чем у талассом, обонятельные складки, сенсорные нейроны располагаются на боковой поверхности складок непрерывно или образуют равномерно распределённые участки сенсорного эпителия, окружённые несенсорным эпителием из мерцательных клеток (Yamamoto, Ueda, 1979; Lara, 2008).
У талассом, как и у других рыб-циклосматов, ритмичные дыхательные движения изменяют объём вентиляционного мешка: увеличивают его при раскрытии челюстей и уменьшают при их смыкании. Разрежение, создаваемое при увеличении мешка, вовлекает воду через переднюю ноздрю в обонятельную полость (рис. 7а). Одновременно с этим клапан перекрывает заднюю ноздрю и блокирует поступление воды через неё внутрь. При закрытии челюстей и уменьшении вентиляционного мешка происходит обратный процесс: вода выталкивается из вентиляционного мешка вначале в обонятельную полость, а затем наружу через заднюю ноздрю; клапан, которой отходит под давлением воды, открывает её (рис. 7б). Интересно, что у радужного губана L. berggylta и губана-рябчика C. cinereus, обладающих вентиляционным мешком, но не имеющих клапана в задней ноздре, направление потоков воды в органе обоняния такие же, как у талассом (Døving et al., 1977). Это подчёркивает важность блокирования, хотя бы частичного, выхода воды из обонятельной полости наружу через переднюю ноздрю. У талассом это происходит из-за меньшего, чем у задней ноздри, диаметра передней ноздри и, возможно, за счёт сжатия её стенок. На наш взгляд, крайне сомнительно, что в перекрытии ноздри может участвовать вертикальная перепонка, располагающаяся ростральнее от внутреннего отверстия передней ноздри. Возможно, она предназначена для ламинирования или частичного разделения входящего потока. Следует подчеркнуть, что структура, подобная перепонке, обнаруженной нами у талассом, в органе обоняния у других рыб не отмечена (Yamamoto, 1982; Zeiske et al., 1992; Kasumyan, 2004).
Рис. 7.
Схема вентиляции органа обоняния талассом Thalassoma на вдохе (а) и выдохе (б): 8 – клапан задней ноздри; ( ) – потоки воды в обонятельную полость и в вентиляционные мешки и выход из них; (→)
– токи воды в обонятельной полости; (
) – потоки воды в обонятельную полость и в вентиляционные мешки и выход из них; (→)
– токи воды в обонятельной полости; (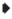 ), (- -) – расширение и сжатие полости лакримального вентиляционного носового мешка;
ост. обозначения см. на рис. 1, 3, 4.
), (- -) – расширение и сжатие полости лакримального вентиляционного носового мешка;
ост. обозначения см. на рис. 1, 3, 4.
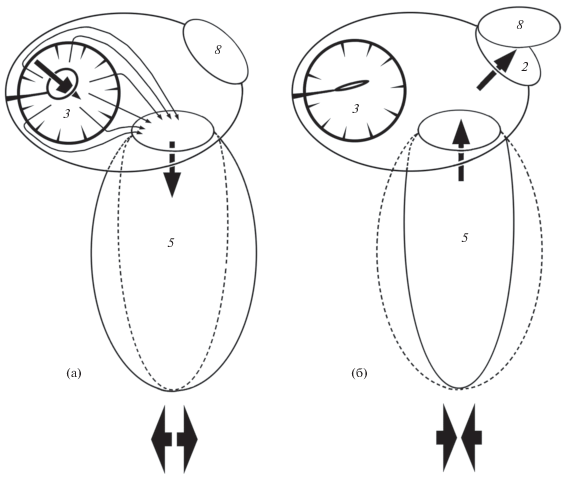
В светлое время суток большинство Labridae, в частности талассомы, активно двигаются, значительную часть времени проводя в толще воды. Но из-за особенностей устройства ноздрей водообмена в органе обоняния за счёт течений или плавания рыбы (напорная вентиляция) не происходит или он крайне незначителен. Он возможен за счёт изосматии – работы многочисленных мерцательных клеток обонятельного эпителия. Изосматия является основным механизмом вентиляции органа обоняния у ранней молоди Labridae, поскольку вентиляционный мешок у неё ещё отсутствует или слабо развит, а ноздри, изолирующие обонятельную полость, уже сформированы (Lara, 2008). В ночные часы многие Labridae предпочитают зарываться в грунт или находиться в слизевом коконе, формируемом для защиты (Winn, 1955; Winn, Bardach, 1959; Парин, 1971; Randall et al., 1997; DeLoach, 1999; Lara, 2008; Grutter et al., 2011). Находясь в грунте или внутри слизевого кокона, Labridae могут получать запаховую информацию только в том случае, если в органе обоняния неподвижных рыб будет происходить водообмен. Наличие вентиляционного мешка делает вентиляцию более эффективной. По-видимому, это особенно важно для Labridae, временно скрывающихся в грунте для пережидания опасности. Возможность получать запаховые сигналы, даже находясь в грунте, позволяет им оценивать ситуацию и покидать убежище не случайным образом, а в благоприятное для этого время.
Таким образом, результаты исследования показали, что орган обоняния у талассом наряду с общими для Labridae морфологическими признаками имеет ряд специфических, ранее не известных у рыб. К общим признакам можно отнести дитремный тип органа обоняния, наличие вентиляционного мешка, слабо выраженные или в разной степени редуцированные первичные обонятельные складки. У некоторых видов эти складки тем не менее формируют обонятельную розетку, которая у Labridae может быть разной формы. Специфичным для исследованных нами талассом является полное отсутствие типичных обонятельных складок, наличие обонятельного диска и вертикальной перепонки – новых для органа обоняния рыб структур.
Адаптивное преимущество, получаемое талассомами благодаря полной редукции обонятельных складок и слияния их в обонятельный диск, также остаётся не раскрытым. Имеет ли появление обонятельного диска отношение к особой форме защитного поведения, проявляемого талассомами и другими Labridae – длительному пребыванию в грунте? Каким образом формируется обонятельный диск и каково предназначение вертикальной перепонки? Вполне возможно, что ответы на этот и другие вопросы будут получены в результате дальнейших исследований, в частности, сравнительного изучения органа обоняния у других Labridae, таких как наиболее специализированные к уходу и пережиданию опасности в грунте представители родов Iniistius и Xyrichtys. В целом продолжение исследований Labridae, представителей этого крайне разнообразного по биологии и поведению входящих в него видов семейства, имеет большой интерес и перспективы для оценки широты и степени диверсификации близкородственных рыб по макроморфологии органа обоняния.
Список литературы
Касумян А.О., Пащенко Н.И., Оань Л.Т.К. 2020. Морфология органа обоняния анабаса Anabas testudineus (Anabantidae, Perciformes) // Зоол. журн. Т. 100. № 1. С. 40−56.
Мочек А.Д. 1987. Этологическая организация прибрежных сообществ морских рыб. М.: Наука, 267 с.
Парин Н.В. 1971. Семейство Губановые (Labridae) // Жизнь животных. Т. 4. Ч. I. Рыбы / Под ред. Расса Т.С. М.: Просвещение. С. 491−492.
Пащенко Н.И., Касумян А.О. 1983. Некоторые морфофункциональные особенности развития органа обоняния в онтогенезе гольяна // Зоол. журн. Т. 62. Вып. 3. С. 367–377.
Пащенко Н.И., Касумян А.О. 1986. Морфофункциональные особенности развития органа обоняния карповых рыб (Cypriniformes, Cyprinidae). I. Развитие морфологии и функции органа обоняния в онтогенезе белого амура Ctenopharyngodon idella (Val.) // Вопр. ихтиологии. Т. 26. Вып. 2. С. 303–317.
Пащенко Н.И., Касумян А.О. 2015. Исследование формирования органа обоняния в онтогенезе белого амура Ctenopharyngodon idella с помощью сканирующей электронной микроскопии // Там же. Т. 55. № 6. С. 692−712.https://doi.org/10.7868/S004287521506017X
Пащенко Н.И., Касумян А.О. 2017. Развитие органа обоняния в онтогенезе карповых рыб (Cyprinidae) // Там же. Т. 57. № 1. С. 96–111. .https://doi.org/10.7868/S0042875217010106
Ткаченко К.С. 2015. Коралловые рифы перед экологическими угрозами XXI века // Журн. общ. биологии. Т. 76. № 5. С. 390–414.
Aiello B.R., Westneat M.W., Hale M.E. 2017. Mechanosensation is evolutionarily tuned to locomotor mechanics // Proc. Natl. Acad. Sci. V. 114. № 17. P. 4459–4464. https://doi.org/10.1073/pnas.1616839114
Atema J., Kingsford M.J., Gerlach G. 2002. Larval reef fish could use odour for detection, retention and orientation to reefs // Mar. Ecol. Prog. Ser. V. 241. P. 151–160. https://doi.org/10.3354/meps241151
Barry K.L., Hawryshyn C.W. 1999. Spectral sensitivity of the Hawaiian saddle wrasse, Thalassoma duperrey, and implications for visually mediated behaviour on coral reefs // Environ. Biol. Fish. V. 56. P. 429–442. https://doi.org/10.1023/A:1007556112449
Belanger R.M., Smith C.M., Corkum L.D., Zielinski B.S. 2003. Morphology and histochemistry of the peripheral olfactory organ in the round goby, Neogobius melanostomus (Teleostei: Gobiidae) // J. Morphol. V. 257. P. 62–71. https://doi.org/10.1002/jmor.10106
Bellwood D.R., Wainwright P.C., Fulton C.J., Hoey A.S. 2006. Functional versatility supports coral reef biodiversity // Proc. Roy. Soc. London. V. 273B. P. 101–107. https://doi.org/10.1098/rspb.2005.3276
Biswas S., Datta N.C., Sarkar S.K., De S.K. 2013. Anatomical variation in the olfactory apparatus of marine teleosts // J. Res. Biol. V. 3. № 1. P. 742−748.
Boyle K.S., Cox T.E. 2009. Courtship and spawning sounds in bird wrasse Gomphosus varius and saddle wrasse Thalassoma duperrey // J. Fish Biol. V. 75. P. 2670–2681. https://doi.org/10.1111/j.1095-8649.2009.02459.x
Braun C., Michiels N.K., Siebeck U.E., Sprenger D. 2014. Signalling function of long wavelength colours during agonistic male−male interactions in the wrasse Coris julis // Mar. Ecol. Prog. Ser. V. 504. P. 277–286. https://doi.org/10.3354/meps10760
Brown C. 2012. Tool use in fishes // Fish Fisher. V. 13. P. 105–115. https://doi.org/10.1111/j.1467-2979.2011.00451.x
Burne R.H. 1909. The anatomy of the olfactory organ of teleostean fishes // Proc. Zool. Soc. London. V. 2. 610–663.
Chateau O., Wantiez L. 2007. Site fidelity and activity patterns of a humphead wrasse, Cheilinus undulatus (Labridae), as determined by acoustic telemetry // Environ. Biol. Fish. V. 80. P. 503–508. https://doi.org/10.1007/s10641-006-9149-6
Cheney K.L., Bshary R., Grutter A.S. 2008. Cleaner fish cause predators to reduce aggression toward bystanders at cleaning stations // Behav. Ecol. V. 19. P. 1063–1067. https://doi.org/10.1093/beheco/arn067
Colefax A.P., Haywood M.D.E., Tibbetts I.R. 2016. Effect of angling intensity on feeding behaviour and community structure of subtropical reef‑associated fishes // Mar. Biol. V. 163. P. 1−14. https://doi.org/10.1007/s00227-016-2857-3
Colin P.L. 2010. Aggregation and spawning of the humphead wrasse Cheilinus undulatus (Pisces: Labridae): general aspects of spawning behavior // J. Fish Biol. V. 76. P. 987–1007. https://doi.org/10.1111/j.1095-8649.2010.02553.x
Collar D.C., Wainwright P.C., Alfaro M. 2008. Integrated diversification of locomotion and feeding in labrid fishes // Biol. Lett. V. 4. P. 84–86. https://doi.org/10.1098/rsbl.2007.0509
Coppock A.G., Gardiner N.M., Jones G.P. 2013. Olfactory discrimination in juvenile coral reef fishes: response to conspecifics and corals // J. Exp. Mar. Biol. Ecol. V. 443. P. 21−26. https://doi.org/10.1016/J.JEMBE.2013.02.026
Coppock A.G., Gardiner N.G., Jones G.P. 2016. Olfactory responses of coral-reef fishes to coral degradation and crown-of-thorns (Acanthaster planci) // Mar. Freshwat. Res. V. 67. P. 605–611. https://doi.org/10.1071/MF14424
Cowman P.F., Bellwood D.R., van Herwerden L. 2009. Dating the evolutionary origins of the wrasses (Labridae) and the rise of trophic novelty on coral reefs // Mol. Phylogen. Evol. V. 52. P. 621–631. https://doi.org/10.1016/j.ympev.2009.05.015
Coyer J. 1995. Use of a rock as an anvil for breaking scallops by the yellowhead wrasse, Halichoeres garnoti (Labridae) // Bull. Mar. Sci. V. 57. P. 548–549.
DeLoach N. 1999. Reef fish behavior: Florida, Caribbean, Bahamas. Jacksonville, FL: New World Publ., Inc., 363 p.
Dixson D.L., Jones G.P., Munday P.L. et al. 2008. Coral reef fish smell leaves to find island homes // Proc. Roy. Soc. Biol. Sci. V. 275B. P. 2831−2839. https://doi.org/10.1098/rspb.2008.0876
Døving K.B. 1986. Functional properties of the fish olfactory system // Progr. Sens. Physiol. V. 6. P. 39–104.
Døving K.B., Dubois-Dauphin M., Holley A., Jourdan F. 1977. Functional anatomy of the olfactory organ of fish and the ciliary mechanism of water transport // Acta Zool. V. 58. P. 245−255.
Døving K.B., Stabell O.B., Östlund-Nilsson S., Fisher R. 2006. Site fidelity and homing in tropical coral reef cardinalfish: are they using olfactory cues? // Chem. Senses. V. 31. P. 265–272. https://doi.org/10.1093/chemse/bjj028
Dunn R.P. 2016. Tool use by a temperate wrasse, California sheephead Semicossyphus pulcher // J. Fish Biol. V. 88. № 2. P. 805–810. https://doi.org/10.1111/jfb.12856
Eckes M.J., Siebeck U.E., Dove S., Grutter A.S. 2008. Ultraviolet sunscreens in reef fish mucus // Mar. Ecol. Prog. Ser. V. 353. P. 203–211. https://doi.org/10.3354/meps07210
Ferry-Graham L.A., Wainwright P.C., Westneat M.W., Bellwood D.R. 2002. Mechanisms of benthic prey capture in wrasses (Labridae) // Mar. Biol. V. 141. P. 819–830. https://doi.org/10.1007/s00227-002-0882-x
Francini-Filho R.B., Sazima I. 2008. A comparative study of cleaning activity of two reef fishes at Fernando de Noronha Archipelago, tropical West Atlantic // Environ. Biol. Fish. V. 83. P. 213–220. https://doi.org/10.1007/s10641-007-9322-6
Fricke R., Eschmeyer W.N., Van der Laan R. (eds.). 2018. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/ catalog/ fishcatmain.asp. Version 12/2020)
Fulton C.J., Bellwood D.R. 2002. Patterns of foraging in labrid fishes // Mar. Ecol. Prog. Ser. V. 226. P. 135–142. http://www.int-res.com/abstracts/meps/v226.
Gerlach G., Atema J., Kingsford M.J. et al. 2007. Smelling home can prevent dispersal of reef fish larvae // Proc. Natl. Acad. Sci. V. 104. P. 858−863. https://doi.org/10.1073_pnas.0606777104.
Goemans B. 2012. Thalassoma hardwicke (Bennett, 1828). http://www.saltcorner.com/AquariumLibrary/browsespecies.php?CritterID=1964. Version 04/2019.
Gooding K.B. 1963. The olfactory organ of the skipjack, Katsuwonus pelamis // FAO Fish Rept. V. 6. P. 1621–1631.
Grutter A.S. 2000. Ontogenetic variation in the diet of the cleaner fish Labroides dimidiatus and its ecological consequences // Mar. Ecol. Prog. Ser. V. 197. P. 241–246. https://doi.org/10.3354/meps197241
Grutter A.S., Rumney J.G., Sinclair-Taylor T. et al. 2011. Fish mucous cocoons: the ‘mosquito nets’ of the sea // Biol. Lett. V. 7. P. 292–294. https://doi.org/10.1098/rsbl.2010.0916
Helfman G.S., Collette B.B., Facey D.E. 1997. The diversity of fishes. Malden, MA: Blackwell Sci., Inc., 528 p.
Holl A., Meinel W. 1968. Das Geruchsorgan des Tiefseefisches Aphanopus carho (Percomorphi, Trichiuridae) // Helgoländer Wiss. Meeresunters. V. 18. P. 404-423. https://doi.org/10.1007/BF01611678
Holmes T.H., Wilson S.K., Vanderklift M. et al. 2012. The role of Thalassoma lunare as a predator of juvenile fish on a sub-tropical coral reef // Coral Reefs. V. 31. P. 1113–1123. https://doi.org/10.1007/s00338-012-0934-8
olstein D.M., Paris C.B., Mumby P.J. 2014. Consistency and inconsistency in multispecies population network dynamics of coral reef ecosystems // Mar. Ecol. Prog. Ser. V. 499. P. 1–18. 10.3354/meps1064
Hourigan T.F., Nakamura N., Nagahama Y. et al. 1991. Histology, ultrastructure, and in vitro steroidogenesis of the testes of two male phenotypes of the protogynous fish, Thalassoma duperrey (Labridae) // Gen. Comp. Endocrinol. V. 83. P. 193–217. https://doi.org/10.1016/0016-6480(91)90023-y
Jones A., Brown C., Gardener S. 2011. Tool use in the spotted tuskfish, Choerodon schoenleinii? // Coral Reefs. V. 30. P. 865. https://doi.org/10.1007/s00338-011-0790-y
Jones K.M.M. 2005. Home range areas and activity centres in six species of Caribbean wrasses (Labridae) // J. Fish Biol. V. 66. P. 150–166. https://doi.org/10.1111/j.1095-8649.2004.00589.x
Jones K.M.M. 2007. Distribution of behaviours and species interactions within home range contours in five Caribbean reef fish species (Family Labridae) // Environ. Biol. Fishes. V. 80. P. 35–49. https://doi.org/10.1007/s10641-006-9104-6
Jones M.C., Grutter A.S., Cribb T.H. 2004. Cleaner fish become hosts: a novel form of parasite transmission // Coral Reefs. V. 23. P. 521–529. https://doi.org/10.1007/s00338-004-0411-0
Kapoor A.S., Ojha P.P. 1972. Studies on ventilation of the olfactory chambers of fishes with a critical reevaluation of the role of the accessory nasal sacs // Arch. Biol. V. 83. P. 167–178.
Kapoor A.S., Ojha P.P. 1973. Functional anatomy of the nose and accessory nasal sacs in the teleost Channa punctatus Bloch. // Acta Anat. (Basel). V. 84. № 1. P. 84–96.
Kasumyan A.O. 2004. The olfactory system in fish: structure, function, and role in behavior // J. Ichthyol. V. 44. № 2. P. S180–S223.
Kazancioglu E., Near T.J., Hanel R., Wainwright P.C. 2009. Influence of sexual selection and feeding functional morphology on diversification rate of parrotfishes (Scaridae) // Proc. Roy. Soc. London. V. 276B. P. 3439–3446. https://doi.org/10.1098/rspb.2009.0876
Khaparde K.P., Baile V.V., Masram S.C. et al. 2012. Functional significance of olfactory cells of a snakehead Ophiocephalus striatus (Bloch) // Bionano Frontier. V. 5. № 2–I. P. 145–148.
Kim B.H.T., Kim H.S., Park J.Y. 2016. The anatomy and histology of the olfactory organ in the Korean sand goby Favonigobius gymnauchen (Pisces, Gobiidae) // Korean J. Ichthyol. V. 28. № 1. P. 28−34.
Kramer D., Chapman M. 1999. Implications of fish home range size and relocation for marine reserve function // Environ. Biol. Fish. V. 55. P. 65–79. https://doi.org/10.1023/A:1007481206399
Kramer M.J., Bellwood O., Fulton C.J., Bellwood D.R. 2015. Refining the invertivore: diversity and specialisation in fish predation on coral reef crustaceans // Mar. Biol. V. 162. P. 1779–1786. https://doi.org/10.1007/s00227-015-2710-0
Kuciel M., Zuwała K., Jakubowski M. 2011. A new type of fish olfactory organ structure in Periophthalmus barbarus (Oxudercinae) // Acta Zool. V. 92. P. 276–280. https://doi.org/10.1111/j.1463-6395.2010.00459.x
Kuciel M., Zuwała K., Satapoominb U. 2013. Comparative morphology (SEM) of the peripheral olfactory organ in the Oxudercinae subfamily (Gobiidae, Perciformes) // Zool. Anz. J. Comp. Zool. V. 252. № 4. P. 424–430. https://doi.org/10.1016/j.jcz.2013.03.002
Lara M.R. 2001. Morphology of the eye and visual acuities in the settlement-intervals of some coral reef fishes (Labridae, Scaridae) // Environ. Biol. Fish. V. 62. P. 365–378. https://doi.org/10.1023/A:1012214229164
Lara M.R. 2008. Development of the nasal olfactory organs in the larvae, settlement-stages and some adults of 14 species of Caribbean reef fishes (Labridae, Scaridae, Pomacentridae) // Mar. Biol. V. 154. № 1. P. 51−64. https://doi.org/10.1007/s00227-007-0899-2
Lecchini D., Nakamura Y. 2013. Use of chemical cues by coral reef animal larvae for habitat selection // Aquat. Biol. V. 19. P. 231–238. https://doi.org/10.3354/ab00532
Lecchini D., Osenberg C.W., Shima J.S. et al. 2007. Ontogenetic changes in habitat selection during settlement in a coral reef fish: ecological determinants and sensory mechanisms // Coral Reefs. V. 26. P. 423–432. https://doi.org/10.1007/s00338-007-0212-3
Lek E., Fairclough D.V., Platell M.E. et al. 2011. To what extents are the dietary compositions of three abundant, co-occuring labrid species different and related to latitude, habitat, body size and season? // J. Fish Biol. V. 78. P. 1913–1943. https://doi.org/10.1111/j.1095-8649.2011.02961.x
Lek E., Platell M.E., Fairclough D.V. et al. 2018. Diets of reef-dwelling labrids (Choerodon species) vary with body size, season and habitat: influence of foraging ability, specialization and opportunism // Ibid. V. 92. P. 901–928. https://doi.org/10.1111/jfb.13541
Lieske E., Myers R. 1994. Collins pocket guide. Coral reef fishes: Indo-Pacific and Caribbean including the Red Sea. London: Haper Collins Publ., 400 p.
Losey G.S., Cronin T., Goldsmith T.H. et al. 1999. The UV visual world of fishes: a review // J. Fish Biol. V. 54. P. 921–943. https://doi.org/10.1006/jfbi.1998.0919
Mana R.R., Kawamura G. 2002. Olfactory organs of two pelagic teleost fish – opah (Lampris guttatus) and dolphin fish (Coryphaena hippurus) // S. Pacif. Stud. V. 22. № 2. P. 53–64.
Mandal D.K., Roy D., Ghosh L. 2005. Structural organization of the olfactory epithelium of a spotted snakehead fish, Channa punctatus // Acta Ichthyol. Piscat. V. 35. № 1. P. 45–50.
Marshall N.J. 2000. Communication and camouflage with the same “bright” colours in reef fishes // Phil. Trans. Roy. Soc. London. V. 355B. P. 1243−1248. https://doi.org/10.1098/rstb.2000.0676
Marty M.J., Blum J.E., Pawlik J.R. 2016. No accounting for taste: palatability of variably defended Caribbean sponge species is unrelated to predator abundance // J. Exp. Mar. Biol. Ecol. V. 485. P. 57–64. https://doi.org/10.1016/j.jembe.2016.08.014
Masterson C.F., Danilowicz B.S., Sale P.F. 1997. Yearly and inter-island variation in the recruitment dynamics of the bluehead wrasse (Thalassoma bifasciatum, Bloch) // Ibid. V. 214. P. 149−166. https://doi.org/10.1016/S0022-0981(97)00020-8
McClintock J.B., Baker B.J., Baumiller T.K., Messing C.G. 1999. Lack of chemical defense in two species of stalked crinoids: support for the predation hypothesis for Mesozoic bathymetric restriction // Ibid. V. 232. P. 1−7. https://doi.org/10.1016/S0022-0981(98)00003-3
Michiels N.K., Anthes N., Hart N.S. et al. 2008. Red fluorescence in reef fish: A novel signalling mechanism? // BMC Ecol. V. 8. P. 16. https://doi.org/10.1186/1472-6785-8-16
Miller A.M., Pawlik J.R. 2013. Do coral reef fish learn to avoid unpalatable prey using visual cues? // Anim. Behav. V. 85. № 2. P. 339–347. https://doi.org/10.1016/j.anbehav.2012.11.002
Moland E., Eagle J.V., Jones G.P. 2005. Ecology and evolution of mimicry in coral reef fishes // Oceanogr. Mar. Biol. V. 43. P. 455–482.
Morton J., Platell M., Gladstone W. 2008. Differences in feeding ecology among three co-occurring species of wrasse (Teleostei: Labridae) on rocky reefs of temperate Australia // Mar. Biol. V. 154. P. 577–592. https://doi.org/10.1007/s00227-008-0951-x
Nagel L., Grutter A.S. 2007. Host preference and specialization in Gnathia sp., a common parasitic isopod of coral reef fishes // J. Fish Biol. V. 70. P. 497–508. https://doi.org/10.1111/j.1095-8649.2007.01320.x
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the world. Hoboken, N.J.: John Wiley and Sons, 752 p.
Paśko K. 2010. Tool-like behavior in the sixbar wrasse, Thalassoma hardwicke (Bennett, 1830) // ZooBiol. V. 29. P. 767–773.
Pawlik J.R., Chanas B., Toonen R.J., Fenical W. 1995. Defenses of Caribbean sponges against predatory reef fish. 1. Chemical deterrency // Mar. Ecol. Prog. Ser. V. 127. P. 183–194. https://doi.org/10.3354/meps127183
Price S.A., Holzman R., Near T.J., Wainwright P.C. 2011. Coral reefs promote the evolution of morphological diversity and ecological novelty in labrid fishes // Ecol. Lett. V. 14. P. 462–469. https://doi.org/10.1111/j.1461-0248.2011.01607.x
Randall J.E. 2005. A review of mimicry in marine fishes // Zool. Stud. V. 44. № 3. P. 299–328.
Randall J.E., Allen G.R., Steene R.C. 1997. Fishes of the Great Barrier Reef and Coral Sea. Bathurst, Australia: Crawford House Publ., 580 p.
Robertson D.R. 2013. Who resembles whom? Mimetic and coincidental look-alikes among tropical reef fishes // PLoS ONE. V. 8. № 1. Article e54939. https://doi.org/10.1371/journal.pone.0054939
Rocha R.A., Bowen B.W. 2008. Speciation in coral-reef fishes // J. Fish Biol. V. 72. P. 1101–1121. https://doi.org/10.1111/j.1095-8649.2007.01770.x
Sarkar S.K., Acharya A., Jana S., De S.K. 2014. Macro-anatomical variation of the olfactory apparatus in some Indian teleosts with special reference to their ecological habitat // Folia Morphol. V. 73. № 2. P. 122–128. https://doi.org/10.13140/RG.2.1.4362.5124
Schubert M., Munday P.L., Caley M.J. et al. 2003. The toxicity of skin secretions from coral-dwelling gobies and their potential role as a predator deterrent // Environ. Biol. Fish. V. 67. P. 359–367. https://doi.org/10.1023/A:1025826829548
Schuijf A., Baretta J.W., Wildschut J.T. 1972. A field investigation on the discrimination of sound direction in Labrus bergylta (Pisces: Perciformes) // Netherl. J. Zool. V. 22. P. 81–104.
Shepherd S.A., Clarkson P.S. 2001. Diet, feeding behaviour, activity and predation of the temperate blue-throated wrasse, Notolabrus tetricus // Mar. Freshwat. Res. V. 52. P. 311–322. https://doi.org/10.1071/MF99040
Siebeck U.E., Marshall N.J. 2000. Transmission of ocular media in labrid fishes // Phil. Trans. Roy. Soc. London. V. 355B. P. 1257–1261. https://doi.org/10.1098/rstb.2000.0679
Siebeck U.E., Marshall N.J. 2001. Ocular media transmission of coral reef fish – can coral reef fish see ultraviolet light? // Vision Res. V. 41. P. 133–149. https://doi.org/10.1016/S0042-6989(00)00240-6
Sinha S.K., Sinha R.K. 1990. Morphology and the anatomy of the olfactory organs of the marine fish Thynnus thunnina (Cuv. Et Val.) // Folia Morphol. V. 38. № 2. P. 169–173.
Slamet B., Hutapea J.H. 2005. First successful hatchery production of Napoleon wrasse at Gondol Research Institute for Mariculture, Bali // S. Pacif. Comm. Live Reef Fish Inform. Bull. V. 13. P. 43–44.
Sollid J., De Angelis P., Gundersen K., Nilsson G.E. 2003. Hypoxia induces adaptive and reversible gross morphological changes in crucian carp gills // J. Exp. Biol. V. 206. P. 3667–3673. https://doi.org/10.1242/jeb.00594
Sollid J., Weber R.E., Nilsson G.E. 2005. Temperature alters the respiratory surface area of crucian carp Carassius carassius and goldfish Carassius auratus // Ibid. V. 208. P. 1109–1116. https://doi.org/10.1242/jeb.01505
Sponaugle S., Cowen R.K. 1997. Early life history traits and recruitment patterns of Caribbean wrasses (Labridae) // Ecol. Monogr. V. 67. P. 177–202.
Steinberg J.C., Cummings W.C., Brahy B.D., MacBain J.Y. 1965. Further bio-acoustic studies off the west coast of north Bimini, Bahamas // Bull. Mar. Sci. V. 15. P. 942–963.
Stier A.C., White J.W. 2014. Predator density and the functional responses of coral reef fish // Coral Reefs. V. 33. P. 235–240. https://doi.org/10.1007/s00338-013-1096-z
Streelman J.T., Karl S.A. 1997. Reconstructing labroid evolution with single-copy nuclear DNA // Proc. Roy. Soc. London. V. 264B. P. 1011−1020. https://doi.org/10.1098/rspb.1997.0140
Suzuki S., Kuwamura T., Nakashima Y. et al. 2010. Social factors of group spawning as an alternative mating tactic in the territorial males of the threespot wrasse Halichoeres trimaculatus // Environ. Biol. Fish. V. 89. P. 71–77. https://doi.org/10.1007/s10641-010-9691-0
Sweatman H.P.A. 1988. Field evidence that settling coral reef fish larvae detect resident fishes using dissolved chemical cues // J. Exp. Mar. Biol. Ecol. V. 124. P. 163–174. https://doi.org/10.1016/0022-0981(88)90170-0
Tavolga W.N., Wodinsky J. 1963. Auditory capacities in fishes. Pure tone thresholds in nine species of marine teleosts // Bull. Amer. Mus. Nat. Hist. V. 126. P. 97–115.
Topping D.T., Lowe C.G., Caselle J.E. 2005. Home range and habitat utilization of adult California sheephead, Semicossyphus pulcher (Labridae), in a temperate no-take marine reserve // Mar. Biol. V. 147. P. 301–311. https://doi.org/10.1007/s00227-005-1573-1
Tricas T.C., Boyle K.S. 2014. Acoustic behaviors in Hawaiian coral reef fish communities // Mar. Ecol. Prog. Ser. V. 511. P. 1−16. https://doi.org/10.3354/meps10930
Vail A.L., McCormick M.I. 2011. Metamorphosing reef fishes avoid predator scent when choosing a home // Biol. Lett. V. 7. P. 921–924. https://doi.org/10.1098/rsbl.2011.0380
Victor B.C. 1986. Duration of the planktonic larval stage of one hundred species of Pacific and Atlantic wrasses (family Labridae) // Mar. Biol. V. 90. P. 317–326. https://doi.org/10.1007/BF00428555
Wainwright P.C. 1988. Morphology and ecology: functional basis of feeding constraints in Caribbean labrid fishes // Ecology. V. 69. P. 635–645.
Wainwright P.C., Bellwood D.R., Westneat M.W. 2002. Ecomorphology of locomotion in labrid fishes // Environ. Biol. Fish. V. 65. P. 47–62. https://doi.org/10.1023/A:1019671131001
Wainwright P.C., Bellwood D.R., Westneat M.W. et al. 2004. A functional morphospace for the skull of labrid fishes: patterns of diversity in a complex biomechanical system // Biol. J. Linn. Soc. V. 82. P. 1–25. https://doi.org/10.1111/j.1095-8312.2004.00313.x
Walker J.A., Westneat M.W. 2002. Performance limits of labriform propulsion and correlates with fin shape and motion // J. Exp. Biol. V. 205. P. 177–187.
Warner R.R. 2005. The role of extreme iteroparity and risk avoidance in the evolution of mating systems // J. Fish Biol. V. 53. Suppl. A. P. 82–93. https://doi.org/10.1111/j.1095-8649.1998.tb01019.x
Westneat M.W. 1993. Phylogenetic relationships of the tribe Cheilinini (Labridae: Perciformes) // Bull. Mar. Sci. V. 52. P. 351–394.
Westneat M.W., Alfaro M.E. 2005. Phylogenetic relationships and evolutionary history of the reef fish family Labridae // Mol. Phylogen. Evol. V. 36. P. 370–390. https://doi.org/10.1016/j.ympev.2005.02.001
Westneat M.W., Alfaro M.E., Wainwright P.C. et al. 2005. Local phylogenetic divergence and global evolutionary convergence of skull function in reef fishes of the family Labridae // Proc. Roy. Soc. London. V. 272B. P. 993−1000. https://doi.org/10.1098/rspb.2004.3013
White J.W., Warner R.R. 2007. Behavioral and energetic costs of group membership in a coral reef fish // Oecologia. V. 154. P. 423–433. https://doi.org/10.1007/s00442-007-0838-4
Wilkinson C. (ed.). 2008. Status of coral reefs of the world: 2008. Townsville, Australia: Global Coral Reef Monitoring Network. 298 p.
Winn H.E. 1955. Formation of a mucous envelope at night by parrot fishes // Zoologica. V. 40. P. 145–148.
Winn H.E., Bardach J.E. 1959. Differential food selection by moray eels and a possible role of the mucous envelope of parrot fishes in reduction of predation // Ecology. V. 40. P. 296–298.
Yaakub S.M., Bellwood D.R., van Herwerden L., Walsh F.M. 2006. Hybridization in coral reef fishes: introgression and bi-directional gene exchange in Thalassoma (family Labridae) // Mol. Phylogen. Evol. V. 40. P. 84–100. https://doi.org/10.1016/j.ympev.2006.02.012
Yamamoto M. 1982. Comparative morphology of fish olfactory organ in teleosts // Chemoreception in fishes / Ed. Hara T.J. N.Y.: Elsevier. P. 39–59.
Yamamoto M., Ueda K. 1979. Comparative morphology of fish olfactory epithelium. X. Perciformes, Beryciformes, Scorpaeniformes, and Pleuronectiformes // J. Fac. Sci. Tokyo Univ. V. 14. P. 273–297.
Zeiske E., Theisen B., Breucker H. 1992. Structure, development, and evolutionary aspects of the peripheral olfactory system // Fish Chemoreception. Fish and Fish. Ser. V. 6 / Ed. Hara T.J. Dordrecht: Springer. P. 13–39. https://doi.org/10.1007/978-94-011-2332-7_2.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии