Вопросы ихтиологии, 2021, T. 61, № 4, стр. 471-485
Наземные источники полиненасыщенных жирных кислот для аквакультуры
1 Институт биофизики Сибирского отделения РАН − ИБФ СО РАН
Красноярск, Россия
2 Сибирский федеральный университет − СФУ
Красноярск, Россия
* E-mail: glad@ibp.ru
Поступила в редакцию 06.04.2020
После доработки 20.04.2020
Принята к публикации 21.04.2020
Аннотация
В обзоре рассматриваются вероятные способы преодоления дефицита эйкозапентаеновой и докозагексаеновой кислот в рационе человека путём рационального развития аквакультуры. В настоящее время аквакультура является не производителем, а потребителем полиненасыщенных жирных кислот, поскольку базируется на кормах, основными компонентами которых служат рыбная мука и рыбий жир, добываемые из промысловых уловов. Предлагается превратить выращиваемую рыбу из потребителя этих полиненасыщенных жирных кислот в их производителя. Источником производства эйкозапентаеновой и докозагексаеновой кислоты в аквакультуре может служить их синтез рыбами из короткоцепочечной α-линоленовой кислоты, содержащейся в масле наземных сельскохозяйственных растений. Приведены расчёты пороговой величины содержания эйкозапентаеновой и докозагексаеновой кислот в корме для лососёвых рыб (Salmonidae) при частичной замене рыбьего жира растительным маслом. Другим возможным способом превращения аквакультуры в производителя полиненасыщенных жирных кислот является частичная замена рыбной муки в кормах мукой из наземных беспозвоночных. Рассматриваются некоторые виды насекомых и червей, перспективных в качестве объектов производства кормовой муки для аквакультуры.
Аквакультура рассматривается в качестве источника снабжения человека биологически активными веществами, отсутствующими в наземных сельскохозяйственных животных и растениях. Одними из самых значимых биологически активных веществ, производителем которых может служить аквакультура, являются длинноцепочечные полиненасыщенные жирные кислоты семейства омега-3 (ПНЖК), а именно эйкозапентаеновая (20:5n-3, ЭПК) и докозагексаеновой (22:6n-3, ДГК) кислоты. В последние десятилетия получен огромный массив доказательств особой роли ЭПК и ДГК в нормальном функционировании организма человека и многих животных (Simopoulos, 2000; Lauritzen et al., 2001; Kris-Etherton et al., 2009; Casula et al., 2013; Calder et al., 2018; Gladyshev, Sushchik, 2019). ЭПК совместно с арахидоновой кислотой (20:4n-6, АРК), относящейся к семейству омега-6, является предшественником синтеза эндогормонов – эйкозаноидов (тромбоксаны, простагландины и лейкотриены) (SanGiovanni, Chew, 2005). Эйкозаноиды омега-6 и омега-3 являются контрегуляторами: производные АРК вызывают у людей сужение сосудов, усиливают агрегацию тромбоцитов (т.е. вызывают образование тромбов и повышают артериальное давление), запускают воспалительную и аллергическую реакции, индуцируют боль; тогда как производные ЭПК снижают артериальное давление, обладают противовоспалительным и антиаллергическим действием (Broughton et al., 1997; Simopoulos, 2000; Lauritzen et al., 2001; Kris-Etherton et al., 2002; SanGiovanni, Chew, 2005; Wall et al., 2010). ДГК ингибирует синтез омега-6-эйкозаноидов (Adkins, Kelley, 2010; Norris, Dennis, 2012) и, кроме того, является основным компонентом фосфолипидов мембран нервных клеток, включая клетки коры головного мозга и сетчатки глаза (SanGiovanni, Chew, 2005; McNamara, Carlson, 2006). Таким образом, для нормального функционирования организма человека необходим баланс соотношения омега-6/омега-3 (n-3/n-6) ПНЖК.
Для большинства исследованных групп людей, в основном жителей Европы, Северной Азии и Северной Америки, оптимальным является соотношение n-3/n-6-ПНЖК в пропорции 1 : 1 (Simopoulos, 2000). Важно отметить, что синтез длинноцепочечных ПНЖК в организме упомянутых групп людей происходит неэффективно и способен обеспечить лишь ~ 5% физиологических потребностей организма (Davis, Kris-Etherton, 2003; Wall et al., 2010). Таким образом, человек должен получать омега-3-ЭПК и ДГК так же, как и омега-6- АРК, с пищей, причём в пище эти кислоты должны содержаться в соотношении 1 : 1 (Simopoulos, 2000). Однако это соотношение стало резко меняться со второй половины XX в. в связи с индустриализацией сельского хозяйства и преобладанием в рационе мясной продукции, выращиваемой на кормах, богатых зерном с высоким содержанием омега-6- кислот. В настоящее время в индустриально развитых странах с диетой “западного типа” соотношение n-3/n-6-ПНЖК в пище составляет 20 : 1 (Simopoulos, 2000; Wall et al., 2010). Глобальное соотношение n-3/n-6-ПНЖК в потребляемом человеком масле и жире составляет 24 : 1 (Tocher, 2015).
Рост доли омега-6-ПНЖК в рационе человека сопровождался резким увеличением числа сердечно-сосудистых заболеваний, и одной из основных причин этого роста явился дисбаланс синтеза эндогормонов – омега-6 и омега-3-эйкозаноидов (Simopoulos, 2000). Результаты эпидемиологических и клинических исследований, проведённых в США и Западной Европе, убедительно доказали, что повышенное потребление ЭПК и ДГК снижает риск сердечно-сосудистых заболеваний почти в 10 раз, смертность заболевших − на 35% (Harris et al., 2009). Как отмечалось выше, механизм действия ЭПК состоит в увеличении синтеза эйкозаноидов, расширяющих сосуды, снижающих тромбообразование и артериальное давление, а ДГК ингибирует избыточный синтез омега-6-эйкозаноидов, обеспечивает эффективное проведение сигналов в нервных клетках, препятствующих аритмии и спазмам сердца и сосудов (SanGiovanni, Chew, 2005; Plourde, Cunnane, 2007; Phang et al., 2011). Всемирной организацией здравоохранения и многими национальными медицинскими организациями для предотвращения сердечно-сосудистых заболеваний рекомендовано персональное потребление ЭПК+ДГК 0.5−1.0 г/сут (Harris et al., 2009; Kris-Etherton et al., 2009; Adkins, Kelley, 2010; Nagasaka et al., 2014; Tocher et al., 2019).
Цель обзора − анализ вероятных способов преодоления глобального дефицита ЭПК и ДГК в рационе человека путём развития аквакультуры.
РЫБА КАК ОСНОВНОЙ ИСТОЧНИК ОМЕГА-3-ПНЖК ДЛЯ ЧЕЛОВЕКА
Водные экосистемы как основной производитель ЭПК и ДГК в биосфере
Сосудистые растения не способны синтезировать ЭПК и ДГК, они производят лишь короткоцепочечную α-линоленовую кислоту (18:3n-3, АЛК), являющуюся основным компонентом фотосинтетических мембран хлоропластов (Sayanova, Napier, 2004; Ward, Singh, 2005; Sayanova et al., 2006; Ruiz-Lopez et al., 2012). Травоядные позвоночные животные и человек для обеспечения своих физиологических потребностей способны синтезировать ЭПК и ДГК из растительной АЛК, получаемой с пищей (синтез происходит в основном в печени) (Wood et al., 2008; Kang et al., 2010; Kouba, Mourot, 2011). Некоторые почвенные беспозвоночные, в частности Nematoda, способны к синтезу ЭПК de novo (Menzel et al., 2018, 2019). Почвенные малощетинковые черви (Oligochaeta) Lumbricus terrestris и Eisenia fetida также могут содержать в своей биомассе значимое количество ЭПК, которая предположительно синтезируется их кишечной микрофлорой (Sampedro et al., 2006; Gladyshev, Sushchik, 2019). Однако в глобальном масштабе основными производителями ЭПК и ДГК в биосфере являются водоросли Bacillariophyceae (Diatomea), Dinophyceae (Peridinea), Cryptophyceae и некоторые другие, но не Chlorophyceae (Gladyshev et al., 2013).
ПНЖК, производимые микроводорослями, передаются по пищевой сети к организмам высших трофических уровней: беспозвоночным и рыбам (Gladyshev et al., 2009, 2011). Таким образом, водные экосистемы являются основным поставщиком ЭПК и ДГК для многих животных, включая некоторых всеядных и хищных обитателей наземных экосистем и человека (Gladyshev et al., 2009, 2013). Главным источником ЭПК и ДГК для человека является рыба (Robert, 2006; Bell, Tocher, 2009; Gladyshev et al., 2009, 2013; Adkins, Kelley, 2010; Tacon, Metian, 2013; Cladis et al., 2014; Tocher et al., 2019). С мировыми уловами человек ежегодно получает 180 × 106 кг ЭПК+ДГК (Gladyshev et al., 2009). Второй по значимости пищевой источник ПНЖК – печень сельскохозяйственных животных (коров, свиней и кур) − даёт человеку лишь ~4 × 106 кг ЭПК+ДГК в год, при этом доля омега-6- кислот в печени перечисленных животных намного выше, чем в рыбе (Gladyshev et al., 2015).
Среднее глобальное потребление ЭПК и ДГК человеком оценивается на уровне 0.10–0.16 г/сут (Gladyshev et al., 2009; Tocher et al., 2019). Однако норма потребления этих ПНЖК, необходимая для сбалансированного синтеза эндогормонов и, следовательно, профилактики сердечно-сосудистых и некоторых других заболеваний, составляет 0.5–1.0 г/сут (Harris et al., 2009; Kris-Etherton et al., 2009; Adkins, Kelley, 2010; Nagasaka et al., 2014; Fayet-Moore et al., 2015; Tocher et al., 2019). Отсюда вытекает неутешительный вывод: человечество испытывает острый дефицит ЭПК и ДГК в рационе (Gladyshev et al., 2009, 2013; Tocher, 2015). Следовательно, важной научно-практической задачей является поиск путей увеличения ЭПК и ДГК в рационе человека.
Аквакультура как потенциальный источник ПНЖК
Мировые уловы достигли максимума (~100 млн т/год) и не могут быть существенно увеличены (Pauly et al., 2002; Qian et al., 2020). На первый взгляд, очевидным способом увеличения потребления рыбы человеком при ограниченных уловах является развитие её искусственного производства, т.е. аквакультуры. Действительно, в последние десятилетия объём производства рыбы и беспозвоночных в аквакультуре рос, продолжает расти быстрыми темпами и уже превысил 70 млн т/год, т.е. приблизился к объёму мировых уловов (De Silva, 2012). Потребление человеком в пищу рыбы, выращиваемой в аквакультуре, сравнялось с потреблением дикой рыбы и даже слегка превысило его (Iaconisi et al., 2018; Fawole et al., 2020).
Однако существует принципиальное ограничение, сдерживающее развитие аквакультуры как дополнительного источника ПНЖК для питания человека. Дело в том, что рыбе, как и всем позвоночным животным, для роста и развития необходимо значительное количество ЭПК и особенно ДГК, получаемое в основном из корма (Sargent et al., 1999; Tocher, 2003; Vizcaino-Ochoa et al., 2010; Zakeri et al., 2011; Trushenski et al., 2012; Wang et al., 2020). Основными компонентами кормов для аквакультуры, содержащими ЭПК и ДГК, являются рыбная мука и рыбий жир, получаемые из промысловых уловов рыб (Turchini et al., 2009; Shepherd, Jackson, 2013; Betancor et al., 2015; Tocher, 2015; Qian et al., 2020), которые не могут быть существенно увеличены. В настоящее время 21 млн т добываемой рыбы не используется непосредственно для питания человека, из них 76% идёт на производство рыбной муки и рыбьего жира для аквакультуры (Iaconisi et al., 2018). Ежегодное извлечение рыбьего жира составляет >1 млн т, 70−75% этого количества используется на производство кормов (в основном для лососёвых (Salmonidae)), и лишь ~20% непосредственно потребляется человеком (Sijtsma, de Swaaf, 2004; Shepherd, Jackson, 2013; Tocher, 2015).
Таким образом, аквакультура не является дополнительным источником (производителем) ЭПК и ДГК для человека (Turchini et al., 2011; Gladyshev et al., 2013). Более того, в аквакультуре происходят существенные потери (рассеивание) ПНЖК. Это означает, что с выращиваемой биомассой рыб из аквакультуры извлекается меньше ЭПК+ДГК, чем добавляется с кормом (Teoh et al., 2011; Turchini et al., 2011; Gladyshev et al., 2018b). Эффективность включения жирных кислот (ЖК) из корма в выращиваемую биомассу рыб, или ЖК-продуктивность в съедобной биомассе (филе) (FFAPV – fillet fatty acid productive value) рассчитывается как отношение увеличения ЖК в биомассе (мг или г) к массе ЖК, потреблённой с кормом (Thanuthong et al., 2011a). Например, для радужной форели Oncorhynchus (=Parasalmo) mykiss величины FFAPV для ЭПК и ДГК составляют соответственно 17.3 и 44.4% (Thanuthong et al., 2011a); для мальков серебристого горбыля Argyrosomus regius − 17.9−31.3 и 37.5–56.1% (Carvalho et al., 2018). По данным Турчини с соавторами (Turchini et al., 2011), в аквакультуре лососёвых рыб на производство 1 г ПНЖК в филе расходуется 5 г кормовых ПНЖК. Следовательно, в глобальном масштабе аквакультура, теряя ПНЖК, не снижает, а увеличивает их дефицит.
Содержание ПНЖК в рыбе как индикатор питательной ценности
Для человека суточная норма потребления суммы ЭПК и ДГК составляет 0.5–1.0 г; согласно стандартам, принятым в диетологии и токсикологии, средняя порция рыбы, употребляемая за один присест, составляет 200 г (Ruffle et al., 1994). Следовательно, имеющая высокую питательную ценность рыба должна содержать ЭПК+ДГК не менее 2.5 мг/г (Gladyshev et al., 2018b).
Продолжая рассуждения о питательной ценности, важно отметить, что содержание суммы ЭПК и ДГК в биомассе рыбы из природных местообитаний в значительной мере определяется её таксономической принадлежностью (генотипом) (Leaver et al., 2011; Henriques et al., 2014; Gladyshev et al., 2018a) и варьирует в широких пределах: от 36.0 мг/г у сайры Cololabis saira (Cheung et al., 2016) до 0.12 мг/г у ската-бабочки Gymnura sp. (Aziz et al., 2013). Различия в содержании ЭПК+ДГК в биомассе рыбы, выращенной в аквакультуре, весьма велики: 43.6 мг/г у атлантического лосося Salmo salar (Ansorena et al., 2010) против 0.08 мг/г у тиляпии Oreochromis sp. (Teoh, Ng, 2016). Легко подсчитать, что для получения рекомендованной суточной нормы ЭПК+ДГК человеку необходимо съесть 12.5 кг такой тиляпии. Очевидно, что критериям реального источника ЭПК и ДГК для человека соответствуют далеко не все объекты промысла и аквакультуры: представители отрядов карпообразных (Cypriniformes) и окунеобразных (Perciformes) имеют сравнительно низкие медианные значения содержания ЭПК и ДГК, тогда как лососеобразные (Salmoniformes) отличаются высоким содержанием этих кислот (рис. 1).
Рис. 1.
Содержание суммы эйкозапентаеновой и докозагексаеновой кислот (PUFA) в рыбах разных отрядов: 1 − Salmoniformes, 2 − Clupeiformes, 3 − Scorpaeniformes, 4 − Perciformes, 5 − Osmeriformes, 6 − Cypriniformes, 7 − Siluriformes, 8 − Pleuronectiformes, 9 – Gadiformes, 10 – Anguilliformes, Beloniformes, Beryciformes, Esociformes, Ceratodontiformes, Mugiliformes и Myliobatiformes; (I) – пределы варьирования, (◻) − 25–75% данных, (◼) – медианы (Cheung et al., 2016; Taipale et al., 2016; Gladyshev et al., 2017, 2018a, 2018b; Sushchik et al., 2017, 2018, 2020; Khalili Tilami et al., 2018; Artamonova et al., 2020).
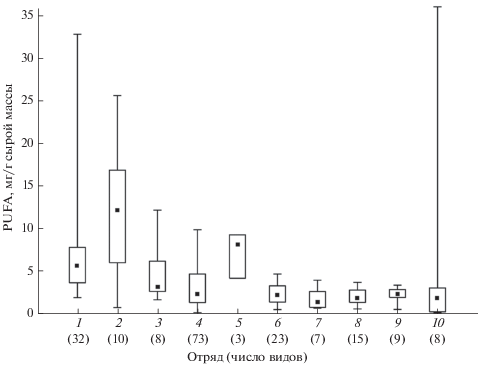
Необходимо отметить, что в данной работе понятие высокой и низкой пищевой ценности рыбы относится исключительно к содержанию в ней ЭПК и ДГК. Рыба, являющаяся малоценным источником этих веществ для человека, может быть полезным продуктом в отношении, например, белков и микроэлементов. Тем не менее уникальность рыбы как пищевого продукта определяется не содержанием в ней белков, имеющихся также в мясе наземных животных и в растительной пище, а именно наличием ЭПК и ДГК, практически отсутствующих в большинстве других продуктов питания. Действительно, рыбный белок составляет всего лишь ~6% суммарного количества животного и растительного белка, потребляемого человеком (Tacon, Metian, 2013), тогда как доля ЭПК+ДГК, получаемых из рыбы, составляет в рационе человека >97% (Gladyshev et al., 2015).
Таким образом, для преодоления глобального дефицита ЭПК и ДГК в рационе человека необходимо решить задачу превращения аквакультуры в дополнительный источник ПНЖК. В общем виде данную задачу можно решить путём частичной замены рыбьего жира и рыбной муки, добываемой из промысловой рыбы, иными компонентами.
ЗАМЕНА В КОРМАХ АКВАКУЛЬТУРЫ РЫБЬЕГО ЖИРА РАСТИТЕЛЬНЫМ МАСЛОМ
Синтез ЭПК и ДГК рыбами из растительной АЛК
Замена рыбьего жира в кормах для аквакультуры маслом наземных сельскохозяйственных масличных растений или животными жирами является чрезвычайно актуальной научной и практической задачей (Turchini et al., 2009; Shepherd, Jackson, 2013; Betancor et al., 2015, 2016; Salini et al., 2015; Gregory et al., 2016; Sprague et al., 2016; Monteiro et al., 2018; Campos et al., 2019; Mock et al., 2019; Pereira et al., 2019; Qian et al., 2020). Масло семян наземных растений не содержит ЭПК и ДГК, но некоторые виды богаты незаменимой 18-атомной АЛК. Незаменимость в данном контексте означает, что рыбы, как и все позвоночные животные, не имеют десатуразы Δ12Fad и не способны de novo синтезировать АЛК – исходную ЖК семейства омега-3 (Bell, Tocher, 2009). Таким образом, рыбы получают АЛК исключительно с пищей. Основная часть усвоенной АЛК катаболизируется, т.е. служит для обеспечения энергетических потребностей организма, а сравнительно небольшая доля, составляющая в среднем ~5%, может быть использована рыбами для собственного синтеза ЭПК и ДГК (Bell, Tocher, 2009; Chen et al., 2018).
В природе доля синтезируемых ЭПК и ДГК значительно варьирует у разных видов рыб и на разных этапах онтогенеза и зависит от их трофического уровня и условий обитания (Thanuthong et al., 2011b; Tocher, 2015; You et al., 2017). Собственный синтез ЭПК и ДГК из пищевой АЛК наземного происхождения, т.е. содержащейся в растительном масле, которое добавляется в корм вместо рыбьего жира, потенциально может рассматриваться как дополнительный источник длинноцепочечных ПНЖК в аквакультуре (Qian et al., 2020). Важно отметить, что способность к синтезу ЭПК и ДГК из АЛК является относительно высокой у пресноводных рыб и лососеобразных, тогда как морские рыбы, особенно ихтиофаги, почти не синтезируют эти ПНЖК и обеспечивают свои потребности в них исключительно из пищи (Turchini et al., 2009; Tocher, 2015; Chen et al., 2017). Кроме того, у некоторых видов рыб, например у японского угря Anguilla japonica, наивысшая активность синтеза ЭПК и ДГК из АЛА проявляется в мозгу, глазах и печени, но не в мышцах (Wang et al., 2014), так как далеко не всем рыбам в связи с их образом жизни необходим высокий уровень ПНЖК в мышечной ткани (Gladyshev et al., 2018a).
Интенсивность синтеза ЭПК и ДГК из АЛК зависит от рациона рыб: ферменты синтеза длинноцепочечных ПНЖК, десатуразы и элонгазы, активируются при недостатке ЭПК и ДГК и ингибируются при их избытке (Olsen et al., 1990; Thanuthong et al., 2011b; Betancor et al., 2016; Carvalho et al., 2018; Lima et al., 2019). Кроме того, синтез длинноцепочечных ПНЖК является субстратзависимым: при увеличении количества субстрата – пищевой АЛК − валовая продукция ЭПК и ДГК в биомассе рыбы возрастает, хотя по мере насыщения относительная активность одного из ключевых ферментов, десатуразы Δ6Fad, участвующего в двух стадиях метаболического пути синтеза ПНЖК, уменьшается (Thanuthong et al., 2011b; Chen et al., 2018; Mock et al., 2019). Экспрессия генов FADS2a(Δ6), ELOVL5 и ELOVL2, кодирующих соответствующие десатуразы и элонгазы, которые обеспечивают синтез длинноцепочечных ПНЖК у рыб (на примере молоди радужной форели), увеличивается при высоком содержании АЛК в пище, но ингибируется пищевой ДГК (Gregory et al., 2016). Аналогично экспрессия генов FADS2 и ELOVL5 у мальков серебристого горбыля была наивысшей при минимальном содержании ЭПК и ДГК в корме (Carvalho et al., 2018). Трёхиглая колюшка Gasterosteus aculeatus, обладающая более высокой копийностью гена FADS2, имеет более высокую выживаемость на корме, лишённом ДГК, по сравнению с родственным видом G. nipponicus (Ishikawa et al., 2019). Естественно, виды (формы) с более высокой копийностью FADS2 имеют более высокое содержание ДГК в биомассе при одинаково низком содержании этой ПНЖК в корме (Ishikawa et al., 2019). Таким образом, интенсивность синтеза ЭПК и ДГК рыбами может регулироваться путём изменения ЖК состава корма.
Изменение ЖК состава корма, а именно замена рыбьего жира маслом наземных сельскохозяйственных культур, является широко распространённой практикой в последнее десятилетие (Turchini et al., 2009; Betancor et al., 2015, 2016; Sprague et al., 2016; Lima et al., 2019; Tocher et al., 2019). Замена рыбьего жира, содержащего ЭПК и ДГК, растительным маслом, содержащим только АЛК, стимулирует собственный синтез ЭПК и ДГК рыбами путём десатурации и элонгации АЛК, повышая экспрессию соответствующих генов и активность ферментов – десатураз и элонгаз (Betancor et al., 2015, 2016; Gregory et al., 2016; Chen et al., 2018; Xie et al., 2018; Lima et al., 2019; Mock et al., 2019). Хотя собственный синтез рыбами в аквакультуре ЭПК и ДГК из АЛК наземных растений является очевидным дополнительным источником этих длинноцепочечных ПНЖК для человека, он почти не учитывается в настоящее время (Turchini et al., 2011). Основной причиной подобного пренебрежения является тот факт, что собственный синтез ЭПК и ДГК из АЛК рыбами, питающимися кормом на основе растительного масла, не способен поддерживать их содержание в биомассе на столь же высоком уровне, как у рыб, питающихся кормом на основе рыбьего жира (Tocher, 2015; Betancor et al., 2016). То есть рыбы, выращенные на корме без рыбьего жира, имеют относительно низкое содержание ЭПК и ДГК (Turchini et al., 2011; Shepherd, Jackson, 2013; Mock et al., 2019; Pereira et al., 2019).
Фактически собственный синтез ЭПК и ДГК направлен лишь на поддержание сравнительно небольших нормальных физиологических потребностей и эволюционно не приспособлен для обеспечения запасов этих ПНЖК в резервных липидах, таких как триацилглицериды (ТАГ) (Tocher, 2015). Следовательно, возникает вопрос, можно ли одновременно решить две задачи: 1) превратить аквакультуру из потребителя ЭПК и ДГК в источник этих ЖК, т.е. получать с продукцией аквакультуры больше ПНЖК, чем внесено с кормом; 2) при этом производить продукцию, обладающую реальной питательной ценностью, т.е. содержащую ЭПК+ДГК не менее 2.5 мг/г? Для ответа на данный вопрос необходимо сделать некоторые предварительные количественные оценки.
Оценка эффективности использования ПНЖК в аквакультуре
Количественная оценка прироста ПНЖК в аквакультуре, т.е. увеличение (уменьшение) количества ПНЖК, получаемого с биомассой выращиваемых рыб по сравнению с количеством ПНЖК, потреблённого с кормом, может быть получена на основе расчётов общей эффективности питания (использования корма на рост) и содержания ПНЖК в корме и биомассе. В аквакультуре в качестве показателя эффективности использования корма на рост обычно используется коэффициент конвертации пищи (feed conversion ratio), равный отношению потреблённой сухой массы корма к приросту сырой массы рыб (Turchini et al., 2011; Gregory et al., 2016; Monteiro et al., 2018). Однако можно использовать и обратную величину − эффективность питания (feed efficiency ratio, FER), рассчитываемую как отношение прироста общей массы рыб (total weight gain, TWG), выраженной в единицах сырой массы к количеству потреблённого сухого (экструдированного) корма (feed consumption, FC) (Codabaccus et al., 2012; Betancor et al., 2016; Chen et al., 2018; Perez-Velazquez et al., 2019):
Очевидно, что FER аналогичен коэффициенту Ивлева K1, хотя коэффициент Ивлева рассчитывается в энергетических единицах (Ивлев, 1939; Warren, Davis, 1967).
Прирост ПНЖК (суммы ЭПК+ДГК) с товарной биомассой (GPUFA, мг) может быть рассчитан с использованием их содержания в биомассе (BPUFA, мг/г). При условии, что BPUFA ≈ const в исходной и конечной биомассе и/или TWG намного больше исходной биомассы, прирост ПНЖК может быть рассчитан следующим образом:
Количество ПНЖК, потреблённого с кормом (CPUFA, мг), может быть рассчитано с использованием их содержания в корме (FPUFA, мг/г):
Тогда эффективность прироста ПНЖК в аквакультуре, коэффициент EPUFA (%), может быть рассчитан как:
С использованием формул 1−3, формула 4 может быть преобразована следующим образом:
(5)
${{E}_{{{\text{PUFA}}}}} = FER\left( {{{B}_{{{\text{PUFA}}}}}/{{F}_{{{\text{PUFA}}}}}} \right) \times 100.$Результаты расчётов зависимости эффективности прироста ПНЖК (EPUFA) от их содержания в корме (FPUFA) при выращивании лососёвых рыб, выполненные на основе данных из работ, содержащих всю необходимую информацию (Stone et al., 2011; Codabaccus et al., 2012; Emery et al., 2016; Mock et al., 2019), представлены на рис. 2. Примечательно, что значения, полученные в четырёх разных экспериментах, которые проведены на двух разных видах рыб (S. salar и O. mykiss), хорошо аппроксимируются (p < 0.001) одним уравнением регрессии (6):
Рис. 2.
Зависимость эффективности прироста суммы эйкозапентаеновой и докозагексаеновой кислот (EPUFA) от их содержания в корме (FPUFA) при выращивании радужной форели Onychorhynchus mykiss (+, ⚫, ◼) и атлантического лосося Salmo salar (▲): (+) – Stone et al., 2011, (⚫) – Codabaccus et al., 2012, (◼) – Emery et al., 2016, (▲) – Mock et al., 2019, (—) – аппроксимация уравнением EPUFA = 245.7× 1/FPUFA + 16.3.
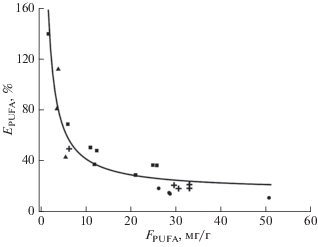
Из уравнения (6) следует, что EPUFA = 100% при FPUFA = 2.9 мг/г. Таким образом, при FPUFA > 2.9 мг/г аквакультура является потребителем ПНЖК, поскольку человек получает с товарной продукцией меньше этих веществ, чем вносит с кормом, а при FPUFA < 2.9 мг/г аквакультура превращается в производителя ПНЖК, которые синтезируются. Близкие к нашим теоретическим расчётам значения были эмпирически получены Куиан с соавторами (Qian et al., 2020). В этой работе интервалы концентраций значительно превышали те, которые были использованы при аппроксимации в уравнении (6), поэтому пороговый уровень содержания ЭПК+ДГК в корме молоди S. salar был определён как лежащий между 3 и 7 мг/г. Ниже этого порога ингибировалась скорость роста, а выше пороговой величины снижалась усвояемость ПНЖК рыбой.
Применение предложенных формул для анализа данных литературы позволило определить не оцениваемую ранее эффективность прироста ПНЖК в аквакультуре. Например, рассчитанные по формуле (5) данные по результатам выращивания молоди атлантического лосося (Codabaccus et al., 2012) показали, что при использовании корма, содержащего рыбий жир, значения EPUFA ниже, чем при использовании корма, в котором 50% рыбьего жира заменены маслом рапса (11 против 18%). Показано также, что частичная замена рыбьего жира в корме радужной форели смесью говяжьего сала, льняного и подсолнечного масел способна повысить эффективность включения ЭПК и ДГК из корма в выращиваемую биомассу (FFAPV) с 17.3 и 44.4% до 32.8 и 98.5% соответственно (Thanuthong et al., 2011a).
Турчини с соавторами (Turchini et al., 2011) в приведённые выше формулы дополнительно ввели соотношение съедобной массы (филе) к общей массе и использовали обратное соотношение (FPUFA/BPUFA), показывающее, сколько грамм ПНЖК-корма используется для производства 1 г ЭПК+ДГК в филе. У радужной форели, потреблявшей корм на основе рыбьего жира, величина FPUFA/BPUFA составила 4.68, а у рыб, питавшихся кормом, содержащим смесь рыбьего жира и льняного масла, − 0.50. То есть аквакультура форели, питающейся кормом на основе льняного масла с добавлением некоторого количества рыбьего жира, является не потребителем, а производителем ЭПК и ДГК. При этом содержание ЭПК и ДГК в биомассе форели, выращенной на льняном масле, было ниже, чем у форели, выращенной на рыбьем жире (5.6 против 18.6 и мг/г) (Turchini et al., 2011), но значительно превышало пороговое значение питательной ценности 2.5 мг/г.
По данным Мока с соавторами (Mock et al., 2019), при замене рыбьего жира маслом рыжика посевного Camelina sativa (Brassicaceae) содержание ЭПК+ДГК в корме (FPUFA) снижается с 9.7 до 2.6 мг/г; снижается также содержание ЭПК+ДГК (BPUFA) в филе выращиваемого атлантического лосося (с 5.6 до 4.0 мг/г) и скорость роста. Однако эффективность прироста ПНЖК (EPUFA) возросла с 43 до 112%, т.е. аквакультура лосося стала производителем ПНЖК. При этом выращиваемая рыба по-прежнему осталась реальным пищевым источником ЭПК и ДГК для человека (BPUFA > > 2.5 мг/г), способным обеспечить суточную норму этих протекторов сердечно-сосудистых заболеваний.
Все приведённые выше данные касались аквакультуры лососеобразных рыб. Представители других отрядов имеют генетически обусловленное относительно низкое содержание ЭПК и ДГК, поэтому применение в корме растительного масла вместо рыбьего жира лишь снижает их питательную ценность, хотя и формально превращает культуру таких рыб в источник ЭПК и ДГК. Например, гибриды тиляпий Oreochromis sp. и O. niloticus (Perciformes), выращиваемые на кормах, не содержащих ЭПК и ДГК, за счёт их синтеза из пищевой АЛК имели в своей биомассе BPUFA соответственно 0.96 и 1.27 мг/г (Teoh et al., 2011). Для получения рекомендованной суточной дозы ПНЖК человеку необходимо потребить в пищу 1.04 и 0.79 кг такой рыбы. По данным, приведённым в работе малайзийских исследователей (Teoh, Ng, 2016), можно рассчитать собственный синтез ЭПК+ДГК Oreochromis sp., выращиваемой на растительных маслах с разным содержанием АЛК − масле периллы Perilla frutescens (высокое), рапсовом (среднее), подсолнечном и пальмовом (следы). По расчётам, этот синтез составляет соответственно 0.28, 0.54, 0.09 и 0.11 мг/г в сутки. Однако даже при самом эффективном синтезе, наблюдаемом на рапсовом масле, содержание ЭПК+ДГК в выращиваемой биомассе тиляпии составило всего лишь 0.42 мг/г (Teoh, Ng, 2016), т.е. для получения рекомендованной суточной дозы ПНЖК человеку необходимо съесть 2.38 кг такой рыбы. В других экспериментах в биомассе тиляпии O. niloticus, выращиваемой исключительно на растительном масле, по мере увеличения содержания АЛК в корме до 2.04% происходило линейное увеличение содержания ЭПК+ДГК до 1.4 мг/г (Chen et al., 2018), что соответствует суточной порции рыбы 0.71 кг.
Следовательно, поставленная выше задача увеличения собственного синтеза ЭПК и ДГК в аквакультуре при сохранении высокой питательной ценности рыбы (ЭПК+ДГК > 2.5 мг/г) может быть решена в основном в аквакультуре лососёвых рыб. Например, при увеличении доли растительного масла в корме атлантического лосося до ~30% содержание ЭПК и ДГК в товарной биомассе снижается с 27.4 до 13.6 мг/г (Sprague et al., 2016). Однако очевидно, что пищевая ценность такой рыбы значительно выше порогового значения и она продолжает оставаться ценным источником ПНЖК для человека. Следует отметить, что в последние годы появляются обнадёживающие данные и по другим видам рыб. Например, даже при полной замене рыбьего жира на животный при выращивании лаврака Dicentrarchus labrax содержание ЭПК+ДГК в мышцах было 2.7 мг/г, тогда как при кормлении стандартным кормом оно составляло 4.8 мг/г (Monteiro et al., 2018). Тем не менее необходимо подчеркнуть, что в большинстве экспериментов с заменой рыбьего жира и рыбной муки рыбу не доращивали до товарных размеров, поэтому окончательные выводы о возможности использования конкретных сортов растительного масла и их пропорций для тех или иных видов рыб следует делать с осторожностью (Pettersson et al., 2010).
Важно напомнить, что способность к синтезу и накоплению ЭПК и ДГК в мышцах (филе) является генетически детерминированным наследуемым признаком (Henriques et al., 2014). Следовательно, внутри одного вида путём направленной селекции могут быть выведены породы рыб с максимальной способностью к синтезу и накоплению ЭПК и ДГК при питании растительным маслом (Bell et al., 2010; Turchini et al., 2011; Shepherd, Jackson, 2013). Однако вряд ли возможно преодолеть генетические различия между крупными таксонами (рис. 1), т.е. путём селекции или за счёт специальной диеты вырастить, например, тиляпию или карпа Cyprinus carpio с содержанием ПНЖК как у лосося.
Влияние замены рыбьего жира в корме на скорость роста рыб
Наряду с рассматриваемым качеством производимой в аквакультуре биомассы весьма важным для товарного производства является и количественный параметр, а именно скорость роста рыб. По данным большого числа экспериментов, замена рыбьего жира растительными маслами и животными жирами в кормах аквакультуры практически не сказывается на скорости роста и выживаемости пресноводных и анадромных рыб: радужной форели (Stone et al., 2011; Turchini et al., 2011; Gregory et al., 2016; Turchini et al., 2018; Lima et al., 2019), арктического гольца Salvelinus alpinus (Pettersson et al., 2010), бурого паку Colossoma macropomum (Characiformes) (Paulino et al., 2018), а также солоноватоводного баррамунди (латеса) Lates calcarifer (Perciformes) (Salini et al., 2015).
Морские рыбы, в отличие от пресноводных, не обладают способностью к синтезу ЭПК и ДГК из АЛК, поэтому замена в их корме рыбьего жира на растительное масло или животный жир вызывает дефицит этих ПНЖК, негативно влияющий на рост и развитие. Например, при выращивании желтопёрого морского леща Acanthopagrus latus (Perciformes) замена рыбьего жира подсолнечным маслом ведёт к резкому снижению плодовитости и выживаемости рыб (Zakeri et al., 2011). У желтохвостой сериолы Seriola dorsalis (Carangiformes) применение соевого масла снижает скорость роста и выживаемость (Rombenso et al., 2016). У оранжевопятнистого групера Epinephelus coioides (Perciformes) при замене рыбьего жира маслом периллы значительно снижается скорость роста (Chen et al., 2017). Полная замена рыбьего жира животными жирами ингибирует темп роста лаврака D. labrax (Monteiro et al., 2018), но использование жира домашней птицы даже при полной замене рыбьего жира не приводит к изменению скорости роста лаврака (Campos et al., 2019). В то же время морская растительноядная рыба сиган-орамин Siganus canaliculatus (Perciformes) одинаково хорошо растёт на корме, содержащем и рыбий жир, и растительное масло, эффективно синтезируя ДГК из АЛК (Xie et al., 2018). У морского языка Solea senegalensis (Pleuronectiformes) замена рыбьего жира на растительное масло снижает скорость роста молоди, но не отражается на конечной товарной массе рыб, хотя содержание ЭПК+ДГК в мышечной ткани снижается с 2.6 до 0.9 мг/г (Pereira et al., 2019).
Что касается атлантического лосося, то имеются данные как об отсутствии влияния добавления растительного масла в корм на скорость роста (Torstensen et al., 2004; Betancor et al., 2016; Sprague et al., 2016), так и о её снижении (Mock et al., 2019). Таким образом, даже для морских рыб, не говоря уж об анадромных и пресноводных, оказывается возможным подобрать условия, при которых в аквакультуре при замене рыбьего жира растительным маслом не произойдет снижения не только качественных (содержания ЭПК и ДГК), но и количественных характеристик, а именно скорости роста (выхода товарной продукции).
ЗАМЕНА РЫБНОЙ МУКИ В КОРМАХ АКВАКУЛЬТУРЫ
Рыбная мука в кормах аквакультуры, в отличие от рыбьего жира как основного источника липидов, прежде всего является источником белка (аминокислот), содержание которого составляет в ней 60−70%, но в её составе также присутствует и некоторое количество липидов (5−10%), в том числе ЭПК и ДГК (Robert, 2006; Shepherd, Jackson, 2013). Производство рыбной муки так же, как и производство рыбьего жира, ограничено верхним пределом мировых уловов и составляет около 6 млн т в год, причём её основная доля приходится на один вид − перуанский анчоус Engraulis ringens (Clupeiformes), добываемый Перу и Чили (Shepherd, Jackson, 2013). Если в 1960-е гг. >90% производимой рыбной муки использовалось в птицеводстве и свиноводстве, то к 2010 г. основным её потребителем (> 70%) стала аквакультура (Shepherd, Jackson, 2013). Очевидно, что для дальнейшего развития аквакультуры, как и в случае рыбьего жира, требуется замена рыбной муки на компоненты наземного происхождения.
В качестве альтернативных источников белка для аквакультуры используется растительная мука, отходы животноводства и беспозвоночные. Однако корм на основе растительного сырья не может полностью заменить рыбную муку, прежде всего, из-за различий в аминокислотном составе растительных и животных белков (Barroso et al., 2014; Fawole et al., 2020). Что касается продуктов животноводства, более подходящих по составу аминокислот, то большинство из них запрещено использовать для изготовления рыбных кормов из соображений пищевой безопасности (Barroso et al., 2014). В последние годы в качестве альтернативного источника белка в кормах аквакультуры всё чаще рассматриваются наземные насекомые, которые, как известно, составляют значительную часть рациона многих пресноводных рыб в природных местообитаниях и имеют состав аминокислот, почти совпадающий с таковым рыб (Barroso et al., 2014; Ушакова и др., 2020; Fawole et al., 2020; Zarantoniello et al., 2020).
Необходимо отметить, что ни сельскохозяйственные растения, ни насекомые, культивируемые в промышленных масштабах на органических отходах растениеводства и животноводства, практически не содержат ЭПК и ДГК и, соответственно, не могут служить источником этих ПНЖК для аквакультуры (Barroso et al., 2014; Zarantoniello et al., 2020). Например, полная замена рыбной муки в продукционном корме атлантического лосося на муку из личинок мухи чёрной львинки Hermetia illucens (Stratiomyidae, Diptera) не привела к снижению скорости роста и конечной массы рыб (Belghit et al., 2019). Однако в этот корм добавляли рыбий жир для компенсации недостатка омега-3-ПНЖК, а также лизин и метионин (Belghit et al., 2019).
Тем не менее существует возможность повысить содержание ПНЖК в биомассе насекомых при выращивании их на кормах, богатых этими жирными кислотами. Например, когда личинок чёрной львинки выращивали на отходах производства кофе с добавлением промышленной культуры морских одноклеточных микроорганизмов (траустохитриды рода Schizochytrium) с высоким содержанием ДГК, то частичная (75%) замена рыбной муки на биомассу личинок львинки в корме для Danio rerio (Cypriniformes) увеличила скорость роста и не вызвала снижение уровня ДГК в мышечной ткани выращиваемых рыб (Zarantoniello et al., 2020). Таким образом, выращивание личинок насекомых на специальных субстратах, обеспечивающих приемлемые уровни омега-3-ПНЖК (включая АЛК) в их биомассе, можно рассматривать как перспективное направление в производстве кормов для аквакультуры (Belghit et al., 2019).
В отличие от наземных насекомых, не содержащих омега-3-ПНЖК, некоторые представители почвенных червей (Nematoda и Annelida) могут иметь в своей биомассе значимые количества этих ПНЖК (Sampedro et al., 2006; Menzel et al., 2018, 2019; Gladyshev, Sushchik, 2019). Например, кольчатый навозный червь Eisenia fetida (Haplotaxida) имеет достаточно высокий уровень ЭПК − >8% суммы ЖК (Kumlu et al., 2018), или 0.37 мг/г сырой массы (Gladyshev, Sushchik, 2019). Однако этот вид практически не содержит ДГК, поэтому его использование в качестве альтернативы рыбной муке и рыбьему жиру вызывает большие сомнения (Kumlu et al., 2018). Нематода уксусная угрица Turbatrix aceti (Rhabditida) способна синтезировать ЭПК de novo и имеет достаточно высокий уровень этой кислоты − >18% суммы ЖК (Hundt et al., 2015). Однако T. aceti в качестве единственного живого корма для личинок сига Coregonus maraena из-за трудно перевариваемой кутикулы не смогла обеспечить высокую выживаемость и скорость роста по сравнению с науплиями Artemia sp., хотя и содержащими намного меньше ЭПК (Hundt et al., 2015).
Из всех видов червей, которые потенциально могут использоваться в качестве компонента корма для рыб, в настоящее время возрождается интерес к белому (горшечному) червю Enchytraeus albidus (Oligochaeta, Annelida). Это вид массово выращивали в СССР в качестве живого корма для рыб, и его среднесуточная продукция могла достигать 2800 г/м2 (Ивлев, Протасов, 1947; Ивлева, 1969). Уровень ЭПК в биомассе E. albidus составляет до 17%, что, по приблизительной оценке, соответствует 19 мг/г сухой массы (Fairchild et al., 2017). Хотя E. albidus, питающиеся, например, отходами зерна, имеют, как и все перечисленные выше наземные беспозвоночные, слишком высокое содержание омега-6-ПНЖК, доля омега-3-ПНЖК в их биомассе, вероятно, может быть увеличена при переходе на другие растительные корма, богатые АЛК (Fairchild et al., 2017). Таким образом, имеются перспективы использования биомассы наземных беспозвоночных в качестве частичной или даже полной замены рыбной муки не только как источника белка, но и как источника длинноцепочечных полиненасыщенных омега-3-ПНЖК.
ДРУГИЕ ПОТЕНЦИАЛЬНЫЕ ИСТОЧНИКИ ПНЖК ДЛЯ АКВАКУЛЬТУРЫ
Альтернативным коммерчески приемлемым способом производства ПНЖК для аквакультуры потенциально могли бы стать генетически модифицированные масличные растения с внедрёнными в них генами микроводорослей и других микроорганизмов, способных синтезировать ЭПК и ДГК (Robert, 2006; Damude, Kinney, 2007; Bell, Tocher, 2009; Sprague et al., 2016; Tocher et al., 2019). Например, масло трансгенного рыжика посевного C. sativa, содержащее >20% ЭПК от общей суммы ЖК, успешно использовалось в экспериментах по выращиванию S. salar (Betancor et al., 2015, 2016). Однако общественное мнение настроено против генетически модифицированных сельскохозяйственных культур (Turchini et al., 2009; Shepherd, Jackson, 2013), и в России их использование в сельском хозяйстве запрещено законодательно. Тем не менее некоторые авторы рассматривают генетически модифицированные масличные растения как единственный способ увеличения продукции аквакультуры, обеспечивающей возрастающие потребности человека в ПНЖК (Bell, Tocher, 2009).
Ещё одним источником ПНЖК для аквакультуры является масло, получаемое из промышленных культур одноклеточных организмов (Sijtsma, de Swaaf, 2004). Например, корм из культивируемых одноклеточных микроорганизмов цианопрокариот Arthrospira sp. (прежнее название Spirulina) и траустохитриды Schizochytrium limacinum успешно использовали для примерно 50%-ной замены рыбной муки и рыбьего жира при выращивании гибрида Morone crhysops × M. saxatilis без снижения скорости роста и уровня ДГК выращиваемых рыб (Perez-Velazquez et al., 2019).
Однако промышленное культивирование микроводорослей, которое тоже может быть условно отнесено к наземным источникам ЭПК и ДГК, имеет существенные ограничения по урожайности и, как следствие, высокую стоимость, препятствующую их коммерческому использованию (Sijtsma, de Swaaf, 2004; Damude, Kinney, 2007). Дело в том, что даже в самых технологически продвинутых биореакторах из-за принципиально не решаемых проблем, таких как самозатенение и накопление кислорода, невозможно достигнуть достаточно высокой плотности культуры микроводорослей, после которой производство стало бы экономически рентабельным (Sijtsma, de Swaaf, 2004; Ward, Singh, 2005; Mendes et al., 2009). В связи с высокой стоимостью промышленные культуры микроводорослей (Chaetoceros, Isochrysis, Nannochloropsis, Pavlova и Phaeodactylum) используются в основном только как живой корм для зоопланктона и личинок рыб (Khozin-Goldberg et al., 2011).
Действительно, согласно теоретическим расчётам, при использовании плоских биореакторов в промышленном масштабе (площадь 100 га, общий объём 57 700 м3) в стране с большим количеством тёплых и солнечных дней (Испания) при годовой продуктивности 12170 т сухой массы микроводорослей на 100 га с содержанием в них ЭПК и ДГК 6% от сухой массы стоимость 1 кг ЭПК+ДГК может составить 19.5 $ США (Chauton et al., 2015). В стране с менее благоприятным климатом (Нидерланды) стоимость 1 кг ПНЖК составит уже 73.9 $ США (Chauton et al., 2015). Очевидно, что для большей части территории России рентабельность промышленного культивирования микроводорослей будет еще ниже. По самым оптимистическим расчётам, если станет возможным создать высокопродуктивные штаммы и далее оптимизировать технологии их культивирования и сбора, используя благоприятный климат и сточные воды, стоимость может быть снижена до 11 $ США, что будет всё равно выше самой высокой цены на ЭПК+ДГК в рыбьем жире, составляющей 8 $ США за 1 кг (Chauton et al., 2015).
Продукционный потенциал гетеротрофных микроорганизмов, таких как раустохитриды Schizochytrium sp. и другие, существенно выше, чем автотрофных микроводорослей. Однако производимые ими в биореакторах ПНЖК (преимущественно ДГК) также имеют слишком высокую стоимость и в основном используются в качестве добавок в молочные смеси для грудных детей (Sijtsma, de Swaaf, 2004). Таким образом, в глобальном масштабе получение ПНЖК из промышленных культур микроводорослей и гетеротрофных микроорганизмов не сможет удовлетворить потребности в них аквакультуры и, соответственно, человека (Turchini et al., 2009, 2011; Tocher, 2015).
ВЫВОДЫ
1. Для преодоления глобального дефицита ЭПК и ДГК в рационе человека за счёт развития аквакультуры необходимо превратить выращиваемую рыбу из потребителя этих ПНЖК, получаемых из достигших верхнего предела промысловых уловов, в их производителя.
2. Превращение аквакультуры из потребителя в производителя ЭПК и ДГК может быть достигнуто путём частичной замены рыбьего жира в кормах аквакультуры на растительное масло, содержащее АЛК, из которой рыба будет синтезировать длинноцепочечные ПНЖК.
3. Аквакультура должна производить рыбу, обладающую высокой питательной ценностью для человека, т.е. способную реально обеспечить необходимую суточную дозу 0.5−1.0 г ЭПК+ДГК, рекомендованную Всемирной организацией здравоохранения. Данному критерию отвечает рыба, содержащая в мышцах не менее 2.5 мг ЭПК+ДГК/г сырой массы, что характерно в основном для лососёвых.
4. По предварительным расчётам, при уровне ЭПК+ДГК > 2.9 мг/г в корме радужной форели и атлантического лосося товарная продукция содержит меньше этих веществ, чем расходуется на её производство.
5. Частичная замена рыбьего жира маслом наземных сельскохозяйственных растений в кормах аквакультуры потенциально позволяет обеспечить как высокий уровень ПНЖК в товарной рыбе, так и высокую скорость роста рыб.
6. Наряду с заменой рыбьего жира растительным маслом возможным способом превращения аквакультуры в производителя ПНЖК является частичная замена рыбной муки в кормах мукой из наземных беспозвоночных, содержащих ЭПК. По имеющимся данным, одним из наиболее перспективных объектов для производства кормовой муки для аквакультуры может служить малощетинковый червь E. albidus.
Список литературы
Ивлев В.С. 1939. Энергетический баланс карпов // Зоол. журн. Т. 18. № 2. С. 315–326.
Ивлев В.С., Протасов А.А. 1947. Получение живого корма для массового рыборазведения // Рыб. хоз-во. № 4. С. 41–42.
Ивлева И.В. 1969. Биологические основы и методы массового культивирования кормовых беспозвоночных. М.: Наука, 171 с.
Ушакова Н.А., Пономарев С.В., Федоровых Ю.В. и др. 2020. Физиологические основы питательной ценности концентрата личинок Hermetia illucens в рационе рыб // Изв. РАН. Сер. биол. № 3. С. 293–300.
Adkins Y., Kelley D.S. 2010. Mechanisms underlying the cardioprotective effects of omega-3 polyunsaturated fatty acids // J. Nutr. Biochem. V. 21. P. 781–792. https://doi.org/10.1016/j.jnutbio.2009.12.004
Ansorena D., Guembe A., Mendizabal T., Astiasaran I. 2010. Effect of fish and oil nature on frying process and nutritional product quality // J. Food Sci. V. 75. P. H62–H67. https://doi.org/10.1111/j.1750-3841.2009.01472.x
Artamonova V.S., Makhrov A.A., Gladyshev M.I. et al. 2020. Polyunsaturated fatty acid content in muscle tissue is associated with the duration of embryo development in salmonoid fishes (Salmonoidei) // Dokl. Biochem. Biophys. V. 491. P. 113–116. https://doi.org/10.1134/S1607672920020039
Aziz N.A., Azlan A., Ismail A. et al. 2013. Quantitative determination of fatty acids in marine fish and shellfish from warm water of straits of Malacca for nutraceutical purposes // BioMed Res. Int. Article ID 284329, 12 p. https://doi.org/10.1155/2013/284329
Barroso F.G., de Haro C., Sanchez-Muros M.-J. et al. 2014. The potential of various insect species for use as food for fish // Aquaculture. V. 422–423. P. 193–201. https://doi.org/10.1016/j.aquaculture.2013.12.024
Belghit I., Liland N.S., Gjesdal P. et al. 2019. Black soldier fly larvae meal can replace fish meal in diets of sea-water phase Atlantic salmon (Salmo salar) // Ibid. V. 503. P. 609–619. https://doi.org/10.1016/j.aquaculture.2018.12.032
Bell J.G., Pratoomyot J., Strachan F. et al. 2010. Growth, flesh adiposity and fatty acid composition of Atlantic salmon (Salmo salar) families with contrasting flesh adiposity: effects of replacement of dietary fish oil with vegetable oils // Ibid. V. 306. P. 225–232. https://doi.org/10.1016/j.aquaculture.2010.05.021
Bell M.V., Tocher D.R. 2009. Biosynthesis of polyunsaturated fatty acids in aquatic ecosystems: general pathways and new directions // Lipids in aquatic ecosystems / Eds. Arts M.T. et al. N. Y.: Springer. P. 211–236.
Betancor M.B., Sprague M., Sayanova O. et al. 2015. Evaluation of a high-EPA oil from transgenic Camelina sativa in feeds for Atlantic salmon (Salmo salar L.): effects on tissue fatty acid composition, histology and gene expression // Aquaculture. V. 444. P. 1–12. https://doi.org/10.1016/j.aquaculture.2015.03.020
Betancor M.B., Sprague M., Sayanova O. et al. 2016. Nutritional evaluation of an EPA-DHA oil from transgenic Camelina sativa in feeds for post-smolt Atlantic salmon (Salmo salar L.) // PLoS ONE. V. 11. № 7. Article e0159934. https://doi.org/10.1371/journal.pone.0159934
Broughton K.S., Johnson C.S., Pace B.K. et al. 1997. Reduced asthma symptoms with n-3 fatty acid ingestion are related to 5-series leukotriene production // Amer. J. Clin. Nutr. V. 65. P. 1011–1017.
Calder P.C. 2018. Very long-chain n-3 fatty acids and human health: fact, fiction and the future // Proc. Nutr. Soc. V. 77. P. 52–72. https://doi.org/10.1017/S0029665117003950
Campos I., Matos E., Maia M.R.G. et al. 2019. Partial and total replacement of fish oil by poultry fat in diets for European seabass (Dicentrarchus labrax) juveniles: effects on nutrient utilization, growth performance, tissue composition and lipid metabolism // Aquaculture. V. 502. P. 107–120.
Carvalho M., Peres H., Saleh R. et al. 2018. Dietary requirement for n-3 long-chain polyunsaturated fatty acids for fast growth of meagre (Argyrosomus regius, Asso 1801) fingerlings // Ibid. V. 488. P. 105–113. https://doi.org/10.1016/j.aquaculture.2018.12.004
Casula M., Soranna D., Catapano A.L., Corrao G. 2013. Long-term effect of high dose omega-3 fatty acid supplementation for secondary prevention of cardiovascular outcomes: a meta-analysis of randomized, double blind, placebo controlled trials // Atheroscler. Suppl. V. 14. P. 243–251.
Chauton M.S., Reitana K.I., Norsker N.H. et al. 2015. A techno-economic analysis of industrial production of marine microalgae as a source of EPA and DHA-rich raw material for aquafeed: research challenges and possibilities // Aquaculture. V. 436. P. 95–103. https://doi.org/10.1016/j.aquaculture.2014.10.038
Chen C., Chen J., Wang S. et al. 2017. Effects of different dietary ratios of linolenic to linoleic acids or docosahexaenoic to eicosapentaenoic acids on the growth and immune indices in grouper, Epinephelus coioides // Ibid. V. 473. P. 153–160. https://doi.org/10.1016/j.aquaculture.2017.02.010
Chen C., Guan W., Xie Q. et al. 2018. n-3 essential fatty acids in Nile tilapia, Oreochromis niloticus: bioconverting LNA to DHA is relatively efficient and the LC-PUFA biosynthetic pathway is substrate limited in juvenile fish // Ibid. V. 495. P. 513–522. https://doi.org/10.1016/j.aquaculture.2018.06.023
Cheung L.K.Y., Tomita H., Takemori T. 2016. Mechanisms of docosahexaenoic and eicosapentaenoic acid loss from Pacific saury and comparison of their retention rates after various cooking methods // J. Food Sci. V. 81. P. C1899–C1907. https://doi.org/10.1111/1750-3841.13367
Cladis D.P., Kleiner A.C., Freiser H.H., Santerre C.R. 2014. Fatty acid profiles of commercially available finfish fillets in the United States // Lipids. V. 49. P. 1005–1018. https://doi.org/10.1007/s11745-014-3932-5
Codabaccus B.M., Carter C.G., Bridle A.R., Nichols P.D. 2012. The “n-3 LC-PUFA sparing effect” of modified dietary n-3 LC-PUFA content and DHA to EPA ratio in Atlantic salmon smolt // Aquaculture. V. 356–357. P. 135–140. https://doi.org/10.1016/j.aquaculture.2012.05.024
Damude H.G., Kinney A.J. 2007. Engineering oilseed plants for a sustainable, land-based source of long chain polyunsaturated fatty acids // Lipids. V. 42. P. 179–185. https://doi.org/10.1007/s11745-007-3049-1
Davis B.C., Kris-Etherton P.M. 2003. Achieving optimal essential fatty acid status in vegetarians: current knowledge and practical implications // Amer. J. Clin. Nutr. V. 78. Suppl. P. 640S–646S.
De Silva S.S. 2012. Aquaculture: a newly emergent food production sector—and perspectives of its impacts on biodiversity and conservation // Biodivers. Conserv. V. 21. P. 3187–3220. https://doi.org/10.1007/s10531-012-0360-9
Emery A.F., Norambuena F., Trushenski J., Turchini G.M. 2016. Uncoupling of EPA and DHA in fish nutrition: dietary demand is limited in Atlantic salmon and effectively met by DHA alone // Lipids. V. 51. P. 399–412. https://doi.org/10.1007/s11745-016-4136-y
Fairchild E.A., Bergman A.M., Trushenski J.T. 2017. Production and nutritional composition of white worms Enchytraeus albidus fed different low-cost feeds // Aquaculture. V. 481. P. 16–24. https://doi.org/10.1016/j.aquaculture.2017.08.019
Fawole F.J., Adeoye A.A., Tiamiyu L.O. et al. 2020. Substituting fishmeal with Hermetia illucens in the diets of African catfish (Clarias gariepinus): effects on growth, nutrient utilization, haematophysiological response, and oxidative stress biomarker // Ibid. V. 518. 734849. https://doi.org/10.1016/j.aquaculture.2019.734849
Fayet-Moore F., Baghurst K., Meyer B.J. 2015. Four models including fish, seafood, red meat and enriched foods to achieve Australian dietary recommendations for n-3 LCPUFA for all life-stages // Nutrients. V. 7. № 10. P. 8602–8614.
Gladyshev M.I., Sushchik N.N. 2019. Long-chain omega-3 polyunsaturated fatty acids in natural ecosystems and the human diet: assumptions and challenges // Biomolecules. V. 9. P. 485. https://doi.org/10.3390/biom9090485
Gladyshev M.I., Arts M.T., Sushchik N.N. 2009. Preliminary estimates of the export of omega-3 highly unsaturated fatty acids (EPA+DHA) from aquatic to terrestrial ecosystems // Lipids in aquatic ecosystems / Eds. Arts M.T. et al. N.Y.: Springer. P. 179–209.
Gladyshev M.I., Sushchik N.N., Anishchenko O.V. et al. 2011. Efficiency of transfer of essential polyunsaturated fatty acids versus organic carbon from producers to consumers in a eutrophic reservoir // Oecologia. V. 165. P. 521–531. https://doi.org/10.1007/s00442-010-1843-6
Gladyshev M.I., Sushchik N.N., Makhutova O.N. 2013. Production of EPA and DHA in aquatic ecosystems and their transfer to the land // Prostaglandins Other Lipid Mediat. V. 107. P. 117–126. https://doi.org/10.1016/j.prostaglandins.2013.03.002
Gladyshev M.I., Makhutova O.N., Gubanenko G.A. et al. 2015. Livers of terrestrial production animals as a source of long-chain polyunsaturated fatty acids for humans: An alternative to fish? // Eur. J. Lipid. Sci. Tech. V. 117. P. 1417–1421. https://doi.org/10.1002/ejlt.201400449
Gladyshev M.I., Sushchik N.N., Makhutova O.N. et al. 2017. Fatty acid composition and contents of seven commercial fish species of genus Coregonus from Russian Subarctic water bodies // Lipids. V. 52. P. 1033–1044. https://doi.org/10.1007/s11745-017-4304-8
Gladyshev M.I., Sushchik N.N., Tolomeev A.P., Dgebuadze Y.Y. 2018a. Meta-analysis of factors associated with omega-3 fatty acid contents of wild fish // Rev. Fish Biol. Fish. V. 28. P. 277–299. https://doi.org/10.1007/s11160-017-9511-0
Gladyshev M.I., Glushchenko L.A., Makhutova O.N. et al. 2018b. Comparative analysis of content of omega-3 polyunsaturated fatty acids in food and muscle tissue of fish from aquaculture and natural habitats // Contemp. Probl. Ecol. V. 11. P.297–308. https://doi.org/10.1134/S199542551803006X
Gregory M.K., Collins R.O., Tocher D.R. et al. 2016. Nutritional regulation of long-chain PUFA biosynthetic genes in rainbow trout (Oncorhynchus mykiss) // Brit. J. Nutr. V. 115. P. 1721–1729. https://doi.org/10.1017/S0007114516000830
Harris W.S., Mozaffarian D., Lefevre M. et al. 2009. Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids // J. Nutr. V. 139. P. 804S–819S.
Henriques J., Dick J.R., Tocher D.R., Bell J.G. 2014. Nutritional quality of salmon products available from major retailers in the UK: content and composition of n-3 long-chain PUFA // Brit. J. Nutr. V. 112. P. 964–975. https://doi.org/10.3945/jn.108.101329
Hundt M., Bruggemann J., Grote B. et al. 2015. Fatty acid composition of Turbatrix aceti and its use in feeding regimes of Coregonus maraena (Bloch, 1779): is it really a suitable alternative to Artemia nauplii? // J. Appl. Ichthyol. V. 31. P. 343–348. https://doi.org/0.1111/jai.12668
Iaconisi V., Bonelli A., Pupino R. et al. 2018. Mealworm as dietary protein source for rainbow trout: Body and fillet quality traits // Aquaculture. V. 484. P. 197–204. https://doi.org/10.1016/j.aquaculture.2017.11.034
Ishikawa A., Kabeya N., Ikeya K. et al. 2019. A key metabolic gene for recurrent freshwater colonization and radiation in fishes // Science. V. 364. P. 886–889.
Kang X., Bai Y., Sun G. et al. 2010. Molecular cloning, characterization, and expression analysis of chicken Δ-6 desaturase // Asian-Austral. J. Anim. Sci. V. 23. P. 116–121.
Khalili Tilami S., Sampels S., Zajic T. et al. 2018. Nutritional value of several commercially important river fish species from the Czech Republic // PeerJ. V. 6. Article e5729. https://doi.org/10.7717/peerj.5729
Khozin-Goldberg I., Iskandarov U., Cohen Z. 2011. LC-PUFA from photosynthetic microalgae: occurrence, biosynthesis, and prospects in biotechnology // Appl. Microbiol. Biotechn. V. 91. P. 905–915. https://doi.org/10.1007/s00253-011-3441-x
Kouba M., Mourot J. 2011. A review of nutritional effects on fat composition of animal products with special emphasis on n-3 polyunsaturated fatty acids // Biochimie. V. 93. P. 13–17. https://doi.org/10.1016/j.meatsci.2008.03.029
Kris-Etherton P.M., Harris W.S., Appel L.J. 2002. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease // Circulation. V. 106. P. 2747–2757. https://doi.org/10.1161/01.CIR.0000038493.65177.94
Kris-Etherton P.M., Grieger J.A., Etherton T.D. 2009. Dietary reference intakes for DHA and EPA // Prostaglandins Leukot. Essent. Fat. Acids. V. 81. P. 99–104. https://doi.org/10.1016/j.plefa.2009.05.011
Kumlu M., Beksari A., Eroldogan O.T. et al. 2018. DHA enrichment of the red earthworm Eisenia fetida for improving its potential as dietary source for aquaculture // Aquaculture. V. 496. P. 10–18. https://doi.org/10.1016/j.aquaculture.2018.07.005
Lauritzen L., Hansen H.S., Jorgensen M.H., Michaelsen K.F. 2001. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina // Prog. Lipid Res. V. 40. P. 1–94.
Leaver M.J., Taggart J.B., Villeneuve L. et al. 2011. Heritability and mechanisms of n-3 long chain polyunsaturated fatty acid deposition in the flesh of Atlantic salmon // Comp. Biochem. Phys. V. 6D. P. 62–69. https://doi.org/10.1016/j.cbd.2010.04.002
Lima B.T.M., Takahashi N.S., Tabata Y.A. et al. 2019. Balanced omega-3 and -6 vegetable oil of Amazonian sacha inchi act as LC-PUFA precursors in rainbow trout juveniles: Effects on growth and fatty acid biosynthesis // Aquaculture. V. 509. P. 236–245. https://doi.org/10.1016/j.aquaculture.2019.05.004
McNamara R.K., Carlson S.E. 2006. Role of omega-3 fatty acids in brain development and function: potential implications for the pathogenesis and prevention of psychopathology // Prostaglandins Leukot. Essent. Fatty Acids. V. 75. P. 329–349. https://doi.org/10.1016/j.plefa.2006.07.010
Mendes A., Reis A., Vasconcelos R. et al. 2009. Crypthecodinium cohnii with emphasis on DHA production: a review // J. Appl. Phycol. V. 21. P. 199–214. https://doi.org/10.1007/s10811-008-9351-3
Menzel R., Geweiler D., Sass A. et al. 2018. Nematodes as important source for omega-3 long-chain fatty acids in the soil food web and the impact in nutrition for higher trophic levels // Front. Ecol. Evol. V. 6. P. 96. https://doi.org/10.3389/fevo.2018.00096
Menzel R., von Chrzanowski H., Tonat T. et al. 2019. Presence or absence? Primary structure, regioselectivity and evolution of Δ12/ω3 fatty acid desaturases in nematodes // Biochim. Biophys. Acta Mol. Cell Biol. Lipids. V. 1864. № 9. P. 1194–1205. https://doi.org/10.1016/j.bbalip.2019.05.001
Mock T.S., Francis D.S., Jago M.K. et al. 2019. Altered levels of shorter vs long-chain omega-3 fatty acids in commercial diets for market-sized Atlantic salmon reared in seawater – effects on fatty acid composition, metabolism and product quality // Aquaculture. V. 499. P. 167–177. https://doi.org/10.1016/j.aquaculture.2018.09.020
Monteiro M., Matos E., Ramos R. et al. 2018. A blend of land animal fats can replace up to 75% fish oil without affecting growth and nutrient utilization of European seabass // Ibid. V. 487. P. 22–31. https://doi.org/10.1016/j.aquaculture.2017.12.043
Nagasaka R., Gagnon C., Swist E. et al. 2014. EPA and DHA status of South Asian and white Canadians living in the National Capital Region of Canada // Lipids. V. 49. P. 1057–1069. https://doi.org/10.1007/s11745-014-3942-3
Norris P.C., Dennis E.A. 2012. Omega-3 fatty acids cause dramatic changes in TLR4 and purinergic eicosanoid signaling // Proc. Natl. Acad. Sci. V. 109. P. 8517–8522.
Olsen R.E., Henderson R.J., McAndrew B.J. 1990. The conversion of linoleic acid and linolenic acid to longer chain polyunsaturated fatty acids by Tilapia (Oreochromis) nilotica in vivo // Fish Physiol. Biochem. V. 8. P. 261–270. https://doi.org/10.1073/pnas.1200189109
Paulino R.R., Pereira R.T., Fontes T.V. et al. 2018. Optimal dietary linoleic acid to linolenic acid ratio improved fatty acid profile of the juvenile tambaqui (Colossoma macropomum) // Aquaculture. V. 488. P. 9–16. https://doi.org/10.1016/j.aquaculture.2018.01.014
Pauly D., Christensen V., Guenette S. et al. 2002. Towards sustainability in world fisheries // Nature. V. 418. P. 689–695. https://doi.org/10.1038/nature01017
Pereira R., Basto A., Conde-Sieira M. et al. 2019. Growth performance and nutrient utilisation of Senegalese sole fed vegetable oils in plant protein-rich diets from juvenile to market size // Aquaculture. V. 511. 734229. https://doi.org/10.1016/j.aquaculture.2019.734229
Perez-Velazquez M., Gatlin III D.M., Gonzalez-Felix M.L. et al. 2019. Effect of fishmeal and fish oil replacement by algal meals on biological performance and fatty acid profile of hybrid striped bass (Morone crhysops ♀× M. saxatilis ♂) // Ibid. V. 507. P. 83–90. https://doi.org/10.1016/j.aquaculture.2019.04.011
Pettersson A., Pickova J., Brannas E. 2010. Swimming performance at different temperatures and fatty acid composition of Arctic charr (Salvelinus alpinus) fed palm and rapeseed oils // Ibid. V. 300. P. 176–181. https://doi.org/10.1016/j.aquaculture.2010.01.017
Phang M., Lazarus S., Wood L.G., Garg M. 2011. Diet and thrombosis risk: nutrients for prevention of thrombotic disease // Semin. Thromb. Hemost. V. 37. P. 199–208.
Plourde M., Cunnane S.C. 2007. Extremely limited synthesis of long chain polyunsaturates in adults: implications for their dietary essentiality and use as supplements // Appl. Physiol. Nutr. Metab. V. 32. P. 619–634. https://doi.org/10.1055/s-0031-1273084
Qian C., Hart B., Colombo S.M. 2020. Re-evaluating the dietary requirement of EPA and DHA for Atlantic salmon in freshwater // Aquaculture. V. 518. Article 734870. https://doi.org/10.1016/j.aquaculture.2019.734870
Robert S.S. 2006. Production of eicosapentaenoic and docosahexaenoic acid-containing oils in transgenic land plants for human and aquaculture nutrition // Mar. Biotechn. V. 8. P. 103–109. https://doi.org/10.1007/s10126-005-5142-x
Rombenso A.N., Trushenski J.T., Jirsa D., Drawbridge M. 2016. Docosahexaenoic acid (DHA) and arachidonic acid (ARA) are essential to meet LC-PUFA requirements of juvenile California yellowtail (Seriola dorsalis) // Aquaculture. V. 463. P. 123–134. https://doi.org/10.1016/j.aquaculture.2016.05.004
Ruffle B., Burmaster D.E., Anderson P.D., Gordon H.D. 1994. Lognormal distributions for fish consumption by the general U.S. population // Risk Anal. V. 14. P. 395–404.
Ruiz-Lopez N., Sayanova O., Napier J.A., Haslam R.P. 2012. Metabolic engineering of the omega-3 long chain polyunsaturated fatty acid biosynthetic pathway into transgenic plants // J. Exp. Bot. V. 63. P. 2397–2410. https://doi.org/10.1093/jxb/err454
Salini M., Irvin S., Bourne N. et al. 2015. Marginal efficiencies of long chain-polyunsaturated fatty acid use by barramundi (Lates calcarifer) when fed diets with varying blends of fish oil and poultry fat // Aquaculture. V. 449. P. 48–57. https://doi.org/10.1016/j.aquaculture.2015.02.027
Sampedro L., Jeannotte R., Whalen J.K. 2006.Trophic transfer of fatty acids from gut microbiota to the earthworm Lumbricus terrestris L. // Soil Biol. Biochem. V. 38. P. 2188–2198. https://doi.org/10.1016/j.soilbio.2006.02.001
SanGiovanni J.P., Chew E.Y. 2005. The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina // Prog. Retin. Eye Res. V. 24. P. 87–138.
Sargent J., Bell G., McEvoy L. et al. 1999. Recent developments in the essential fatty acid nutrition of fish // Aquaculture. V. 177. P. 191–199. https://doi.org/10.1016/j.preteyeres.2004.06.002
Sayanova O.V., Napier J.A. 2004. Eicosapentaenoic acid: biosynthetic routes and the potential for synthesis in transgenic plants // Phytochemistry. V. 65. P. 147–158. .
Sayanova O., Haslam R., Guschina I. et al. 2006. A bifunctional Δ12, Δ15-desaturase from Acanthamoeba castellanii directs the synthesis of highly unusual n-1 series unsaturated fatty acids // J. Biol. Chem. V. 281. P. 36533–36541.
Shepherd C.J., Jackson A.J. 2013. Global fishmeal and fish-oil supply: inputs, outputs and markets // J. Fish Biol. V. 83. P. 1046–1066. https://doi.org/10.1111/jfb.12224
Sijtsma L., de Swaaf M.E. 2004. Biotechnological production and applications of the ω-3 polyunsaturated fatty acid docosahexaenoic acid // Appl. Microbiol. Biotechnol. V. 64. P. 146–153. https://doi.org/10.1007/s00253-003-1525-y
Simopoulos A.P. 2000. Human requirement for n-3 polyunsaturated fatty acids // Poultry Sci. V. 79. P. 961–970.
Sprague M., Dick J.R., Tocher D.R. 2016. Impact of sustainable feeds on omega-3 long-chain fatty acid levels in farmed Atlantic salmon, 2006−2015 // Sci. Rept. V. 6. 21892. https://doi.org/10.1038/srep21892
Stone D.A.J., Oliveira A.C.M., Plante S. et al. 2011. Enhancing highly unsaturated omega-3 fatty acids in phase-fed rainbow trout (Oncorhynchus mykiss) using Alaskan fish oils // Aquacult. Nutr. V. 17. P. E501–E510. https://doi.org/10.1111/j.1365-2095.2010.00790.x
Sushchik N.N., Rudchenko A.E., Gladyshev M.I. 2017. Effect of season and trophic level on fatty acid composition and content of four commercial fish species from Krasnoyarsk Reservoir (Siberia, Russia) // Fish. Res. V. 187. V. 178–187. https://doi.org/10.1016/j.fishres.2016.11.016
Sushchik N.N., Zuev I.V., Kalachova G.S. et al. 2018. Content of highly unsaturated fatty acids in fish from rivers of contrasting temperature // River Res. Appl. V. 34. P. 565–574. https://doi.org/10.1002/rra.3286
Sushchik N.N., Makhutova O.N., Rudchenko A.E. et al. 2020. Comparison of fatty acid contents in major lipid classes of seven salmonid species from Siberian Arctic lakes // Biomolecules. V. 10. P. 419. https://doi.org/10.3390/biom10030419
Tacon A.G.J., Metian M. 2013. Fish matters: importance of aquatic foods in human nutrition and global food supply // Rev. Fish. Sci. V. 21. P. 22–38. https://doi.org/10.1080/10641262.2012.753405
Taipale S.J., Vuorioc K., Strandberg U. et al. 2016. Lake eutrophication and brownification downgrade availability and transfer of essential fatty acids for human consumption // Environ. Int. V. 96. P. 156–166. https://doi.org/10.1016/j.envint.2016.08.018
Teoh C.Y., Ng W.K. 2016. The implications of substituting dietary fish oil with vegetable oils on the growth performance, fillet fatty acid profile and modulation of the fatty acid elongase, desaturase and oxidation activities of red hybrid tilapia, Oreochromis sp. // Aquaculture. V. 465. P. 311–322. https://doi.org/10.1016/j.aquaculture.2016.09.023
Teoh C.Y., Turchini G.M., Ng W.K. 2011. Genetically improved farmed Nile tilapia and red hybrid tilapia showed differences in fatty acid metabolism when fed diets with added fish oil or a vegetable oil blend // Ibid. V. 312. P. 126–136. https://doi.org/10.1016/j.aquaculture.2010.12.018
Thanuthong T., Francis D.S., Senadheera S.D. et al. 2011a. Fish oil replacement in rainbow trout diets and total dietary PUFA content: I. Effects on feed efficiency, fat deposition and the efficiency of a finishing strategy // Ibid. V. 320. P. 82–90. https://doi.org/10.1016/j.aquaculture.2011.08.007
Thanuthong T., Francis D.S., Manickam E. et al. 2011b. Fish oil replacement in rainbow trout diets and total dietary PUFA content: II. Effects on fatty acid metabolism and in vivo fatty acid bioconversion // Ibid. V. 322–323. P. 99–108. https://doi.org/10.1016/j.aquaculture.2011.09.026
Tocher D.R. 2003. Metabolism and functions of lipids and fatty acids in teleost fish // Rev. Fish. Sci. V. 11. P. 107–184.
Tocher D.R. 2015. Omega-3 long-chain polyunsaturated fatty acids and aquaculture in perspective // Aquaculture. V. 449. P. 94–107. https://doi.org/10.1016/j.aquaculture.2015.01.010
Tocher D.R., Betancor M.B., Sprague M. et al. 2019. Omega-3 long-chain polyunsaturated fatty acids, EPA and DHA: bridging the gap between supply and demand // Nutrients. V. 11. P. 89. https://doi.org/10.3390/nu11010089
Torstensen B.E., Froyland L., Ornsrud R., Lie O. 2004. Tailoring of a cardioprotective muscle fatty acid composition of Atlantic salmon (Salmo salar) fed vegetable oils // Food Chem. V. 87. P. 567–580. https://doi.org/10.1016/j.foodchem.2004.01.009
Trushenski J., Schwarz M., Bergman A. et al. 2012. DHA is essential, EPA appears largely expendable, in meeting the n-3 long-chain polyunsaturated fatty acid requirements of juvenile cobia Rachycentron canadum // Aquaculture. V. 326–329. P. 81–89. https://doi.org/10.1016/j.aquaculture.2011.11.033
Turchini G.M., Torstensen B.E., Ng W.K. 2009. Fish oil replacement in finfish nutrition // Rev. Aquacult. V. 1. P. 10–57. https://doi.org/10.1111/j.1753-5131.2008.01001.x
Turchini G.M., Francis D.S., Keast R.S.J., Sinclair A.J. 2011. Transforming salmonid aquaculture from a consumer to a producer of long chain omega-3 fatty acids // Food Chem. V. 124. P. 609–614. https://doi.org/10.1016/j.foodchem.2010.06.083
Turchini G.M., Hermon K.M., Francis D.S. 2018. Fatty acids and beyond: fillet nutritional characterisation of rainbow trout (Oncorhynchus mykiss) fed different dietary oil sources // Aquaculture. V. 491. P. 391–397. https://doi.org/10.1016/j.aquaculture.2017.11.056
Vizcaino-Ochoa V., Lazo J.P., Baron-Sevilla B., Drawbridge M.A. 2010. The effect of dietary docosahexaenoic acid (DHA) on growth, survival and pigmentation of California halibut Paralichthys californicus larvae (Ayres, 1810) // Ibid. V. 302. P. 228–234. https://doi.org/10.1016/j.aquaculture.2010.02.022
Wall R., Ross R.P., Fitzgerald G.F., Stanton C. 2010. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids // Nutr. Rev. V. 68. P. 280–289. https://doi.org/10.1111/j.1753-4887.2010.00287.x
Wang C.-C., Liu W.-B., Huang Y.-Y. et al. 2020. Dietary DHA affects muscle fiber development by activating AMPK/Sirt1 pathway in blunt snout bream (Megalobrama amblycephala) // Aquaculture. V. 518. 734835. https://doi.org/10.1016/j.aquaculture.2019.734835
Wang S., Monroig O., Tang G. et al. 2014. Investigating long-chain polyunsaturated fatty acid biosynthesis in teleost fish: functional characterization of fatty acyl desaturase (Fads2) and Elovl5 elongase in the catadromous species, Japanese eel Anguilla japonica // Ibid. V. 434. P. 57–65. https://doi.org/10.1016/j.aquaculture.2014.07.016
Ward O.P., Singh A. 2005. Omega-3/6 fatty acids: alternative sources of production // Process Biochem. V. 40. P. 3627–3652. https://doi.org/10.1016/j.procbio.2005.02.020
Warren C.E., Davis G.E. 1967. Laboratory studies on the feeding, bioenergetics, and growth of fish // The biological basis of freshwater fish production / Ed. Gerking S.D. London: Blackwell. P. 175–214.
Wood J.D., Enser M., Fisher A.V. et al. 2008. Fat deposition, fatty acid composition and meat quality: a review // Meat Sci. V. 78. P. 343–358. https://doi.org/10.1016/j.meatsci.2007.07.019
Xie D., Liu X., Wang S. et al. 2018. Effects of dietary LNA/LA ratios on growth performance, fatty acid composition and expression levels of elovl5, Δ4 fad and Δ6/Δ5 fad in the marine teleost Siganus canaliculatus // Aquaculture. V. 484. P. 309–316. https://doi.org/10.1016/j.aquaculture.2017.08.039
You C., Miao S., Lin S. et al. 2017. Expression of long-chain polyunsaturated fatty acids (LC-PUFA) biosynthesis genes and utilization of fatty acids during early development in rabbitfish Siganus canaliculatus // Ibid. V. 479. P. 774–779. https://doi.org/10.1016/j.aquaculture.2017.07.028
Zakeri M., Kochanian P., Marammazi J.G. et al. 2011. Effects of dietary n-3 HUFA concentrations on spawning performance and fatty acids composition of broodstock, eggs and larvae in yellowfin sea bream, Acanthopagrus latus // Ibid. V. 310. 388–394. https://doi.org/10.1016/j.aquaculture.2010.11.009
Zarantoniello M., Zimbelli A., Randazzo B. et al. 2020. Black soldier fly (Hermetia illucens) reared on roasted coffee by-product and Schizochytrium sp. as a sustainable terrestrial ingredient for aquafeeds production // Ibid. V. 518. 734659. https://doi.org/10.1016/j.aquaculture.2019.734659
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


