Вопросы ихтиологии, 2021, T. 61, № 4, стр. 375-383
Новый вид липаровых рода Careproctus (Liparidae) с северного склона Алеутской котловины (Берингово море)
Н. В. Чернова 1, *, Е. В. Ведищева 2, А. В. Датский 2
1 Зоологический институт РАН – ЗИН РАН
Санкт-Петербург, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии – ВНИРО
Москва, Россия
* E-mail: nchernova@mail.ru
Поступила в редакцию 05.11.2020
После доработки 11.01.2021
Принята к публикации 11.01.2021
Аннотация
Новый вид липаровых Careproctus schmidti sp. nov. описан из северо-западной части Берингова моря. Экземпляр пойман в мезобентали Алеутской котловины на глубине 852−862 м (голотип ЗИН № 56 620 – самка TL 194 мм). От большинства карепроктов северной части Тихого океана его отличает комплекс признаков: большое число позвонков (63) и лучей в плавниках (D 56, A 50, Р 34, С 10), наличие двух пар плевральных рёбер, сравнительно удлинённый (21% SL) грудной плавник с выемкой и короткой нижней лопастью (12% SL), две супрабранхиальные поры, простые зубы, голая кожа и чёрный перитонеум. По меристическим признакам карепрокт Шмидта сходен с тремя северотихоокеанскими видами, но от C. colletti отличается короткой нижней лопастью грудного плавника, уплощённым диском треугольных очертаний, более длинным жаберным отверстием; от C. roseofuscus – более низким телом, вентрально расположенным грудным плавником и анусом, расположенным сразу за диском; от C. ambustus − фиолетово-лиловой окраской, простыми зубами с острыми вершинами и меньшим их числом, вертикальным и выше расположенным жаберным отверстием, короткой нижней лопастью грудного плавника, формой диска и положением ануса. Наличие яйцеклада может свидетельствовать о сложном репродуктивном поведении (карцинофилия или другие типы репродуктивного комменсализма). Северо-западный склон Алеутской котловины, где пойман экземпляр C. schmidti, находится в зоне влияния Беринговоморского склонового течения и сезонного апвеллинга, сопряжённого с подъёмом глубинных вод. Приводится состав ихтиоцена в районе поимки, включающий до 20 видов, с доминированием Macrouridae.
Семейство липаровых (Liparidae) насчитывает до 32 родов и более 400 видов (Chernova et al., 2004; Orr et al., 2019), распространённых преимущественно в умеренных и холодных морских водах и на глубинах океана. Отсутствие кожного вооружения и мягкое студенистое тело делают их трудным для изучения объектом. Систематика группы активно разрабатывается. Новые виды описывают и в настоящее время, в том числе из северной части Тихого океана (Orr, Maslenikov, 2007; Sakurai, Shinohara, 2008; Machi et al., 2012; Orr, 2012; Orr et al., 2015, 2020; Murasaki et al., 2017; Chernova et al., 2020; Matsuzaki et al., 2020). В семействе наиболее обширен род Careproctus, в котором насчитывают до 140 видов; в северной части Тихого океана обитают около 50 из них.
Настоящая статья посвящена описанию нового вида из северо-западной части Берингова моря. Экземпляр Careproctus, пойманный на континентальном склоне Алеутской котловины (рис. 1), отличается от всех известных видов по комплексу признаков.
МАТЕРИАЛ И МЕТОДИКА
Научно-исследовательские работы проводили в Западно-Беринговоморской зоне промыслового районирования с борта НИС “ТИНРО” 26−28.09.2018 г. В районе с координатами 61°10′–61°37′ с.ш. 175°55′–176°52′ в.д. и охватом глубин 852−968 м было выполнено шесть траловых станций. В качестве орудия лова использовали донный трал ДТ/ТВ 27.1/24.4 с горизонтальным раскрытием 16 м, оснащённый мягким грунтропом; вставка из мелкоячейной дели в траловом мешке имела шаг ячеи 10 мм. Продолжительность тралений составляла 30 мин при скорости судна 2.3–2.4 узла.
Экземпляр после поимки сфотографировали и зафиксировали 4%-ным раствором формальдегида. Дальнейшие работы осуществлены в ЗИН РАН. Измерения фиксированного экземпляра приведены относительно стандартной длины (SL − от вершины рыла до основания лучей хвостового плавника) и относительно длины головы (c − от вершины рыла до конца оперкулярной лопасти).
Положение семейства Liparidae в системе рыб (в отряде Cottiformes) принято по новейшим данным, согласно которым до ранга отряда поднят подотряд Cottoidei Berg, 1940 (Imamura, Yabe, 2002; Wiley, Johnson, 2010). Формула сенсорных пор приведена по Бёрку (Burke, 1930; Андрияшев, 2003). Зубы подсчитаны по методу Эйбла и Мак-Алистера (Able, McAllister, 1980). Формула грудного плавника (Р) включает число лучей верхней лопасти (считая наиболее короткий луч выемки) и нижней его лопасти (Андрияшев, 2003). При сравнении с другими видами использовали признаки типовых экземпляров из первоописаний, поскольку широко распространённые виды могут представлять собой видовые комплексы, как это показано для C. melanurus/C. ambustus (Orr et al., 2020).
В сравнительных целях изучены экземпляры карепроктов из коллекций Университета штата Орегон (Oregon State University − OSU) и ЗИН РАН.
C. cypselurus (Jordan et Gilbert in Jordan, Evermann, 1898): OSU № 013014 – самка TL 265 мм, SL 233 мм, Берингово море, 60°45′ с.ш. 179°28′ з.д., 28.07.1983 г., судно 515, рейс 821, ст. 86.
C. melanurus Gilbert, 1892: OSU № 1925 – взрослый самец TL 213 мм, SL 196 мм, Орегон, “Fur Farm”, 17.03.1959 г.; OSU № 0747 – 1 экз. TL 151 мм, SL 136 мм, Орегон, “Yaquina №6606”, 08.06.1966 г., глубина 640−650 м.
C. roseofuscus Gilbert et Burke, 1912: ЗИН № 56 432 – самец TL 180 мм, SL 157 мм и самка TL 165 мм, SL 146 мм, Охотское море, 57°46′ с.ш. 151°24′ в.д., глубина 209−207 м, 16.08.2006 г., “Капитан Маламуд”, трал 154, коллектор М.В. Назаркин, определил Д.Л. Питрук.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Careproctus schmidti sp. nov. – карепрокт Шмидта (рис. 2)
Голотип. ЗИН № 56 620 – самка с незрелой икрой, TL 194 мм, SL 169 мм; Берингово море, 61°20′–61°22′ с.ш. 176°17′–176°18′ в.д., глубина 852–862 м, 26.09.2018 г., НИС “ТИНРО”, трал 96, температура у дна 3.1°C, коллектор Е.В. Ведищева.
Диагноз. Позвонков 63, D 56, A 50, P 34, C 10. Плевральных ребёр две пары. Зубы простые. Пор 2−6−7−2. Грудной плавник расположен вентрально: его верхний луч находится на уровне рта. Верхняя лопасть Р удлинена (21% SL); нижняя лопасть Р короче его верхней лопасти (12% SL). Диск 4% SL (16% c), уплощённый. Нет промежутка между задним краем диска и анусом. Жаберная щель немного не доходит до основания грудного плавника, её длина в 1.4 раза больше глаза. Кожа голая. Окраска лиловая с сиреневым оттенком, конец хвостовой части и края плавников чёрные, перитонеум чёрный.
Этимология. Вид назван в честь Петра Юльевича Шмидта (1872−1949) − русского и советского зоолога и ихтиолога, сотрудника Зоологического музея АН СССР (ныне ЗИН), автора сводных работ по фауне рыб дальневосточных морей (Шмидт, 1904, 1948, 1950).
Описание. Тело довольно низкое, удлинённое, его высота содержится 5.0 раза в SL. Дорсальный контур полого снижается назад от начала D. Голова большая и сжатая с боков: её длина содержится 3.9 раза в SL, а высота в 1.7 раза больше ширины. Глаз содержится 4.5 раза в с, зрачок круглый. Межглазничное расстояние в 1.7 раза больше глаза. Рыло закруглённое, слабо выдаётся над верхней челюстью, его длина в 1.6 раза больше глаза. Рот горизонтальный; ротовая щель достигает вертикали начала глаза, задний конец верхней челюсти – вертикали заднего края зрачка. Нижняя челюсть несколько короче верхней челюсти. Зубы простые, мелкие, задние в рядах заострённые; на каждой челюсти образуют не менее 30 косых рядов, по четыре−пять зубов в полных рядах спереди. Жаберное отверстие вертикальное, вниз немного не доходит до основания верхнего луча Р (на 1/2 диаметра глаза); его длина в 1.4 раза больше глаза (рис. 2г, 2д). Оперкулярная лопасть широко треугольная и закруглена на вершине; оперкулярный отросток направлен назад, его конец находится на уровне нижнего края глаза. Сенсорных пор 2−6−7−2. Подбородочные поры не сближены (рис. 2б).
Рис. 2.
Careproctus schmidti sp. nov. − самка TL 194 мм, SL 169 мм, голотип ЗИН № 56 620 до (а, б) и после (в, д) фиксации: а, г – вид сбоку; б − подбородочные поры не сближены, за диском расположен трубчатый яйцеклад; в − диск уплощённый, треугольных очертаний, анус и яйцеклад расположены сразу за диском; д − голова: грудной плавник низко расположен, жаберное отверстие не достигает его верхнего луча.

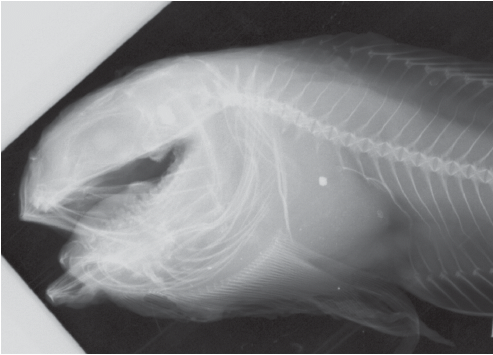
Рентгенограмма. (рис. 3). Позвонков, включая уростилярный, 63 (10 + 53), лучей D 56, A 50, C 10 (5/5). Плевральных рёбер две пары на последних предхвостовых позвонках. Птеригиофор 1-го луча D расположен между невральными отростками 4-го и 5-го позвонков. Свободных interneuralia 2, между невральными отростками 2-го и 3-го, 3-го и 4-го позвонков. Лучей D в предхвостовом отделе семь. Один птеригиофор (с лучом А) перед 1-м гемальным отростком. Гипуральная пластинка дистально разделена щелью.
Рис. 3.
Рентгенограмма голотипа Careproctus schmidti sp. nov.: плевральные рёбра развиты на двух предхвостовых позвонках.
Грудные плавники низко расположены: верхний луч на уровне рта, основание нижнего луча под передней половиной глаза. Лучей Р 34 (27 + 7). Верхняя лопасть удлинена (21% SL и 81% с) и достигает 6−7-го луча анального плавника. Нижняя лопасть Р заметно короче верхней лопасти (12% SL и 46.5% с); её лучи разделены на 2/3 длины и слегка утолщены; наиболее удлинённый (6-й снизу) луч достигает вертикали 2/3 заглазничного расстояния. Выемка правого и левого грудных плавников мелкая: длина наиболее короткого (8-го снизу) луча составляет 9 и 10% SL (35 и 37% с). Плавниковые мембраны грудных плавников впереди диска разделены (не образуют поперечную складку).
Спинной и анальный плавники невысокие; анальный расширяется в передней трети своей длины, спинной – в средней трети, каждый не превышает половину высоты этих участков тела. D и A соединены с хвостовым плавником примерно на 40% его длины.
Диск уплощённый и небольшой (4% SL, 16% c), треугольных очертаний; его центральная часть крупная, краевая часть узкая; мускулатура слабо развита, кожная кайма тонкая и завёрнута внутрь. Анус открывается сразу за диском (нет промежутка от заднего края диска до ануса) и находится на вертикали заднего края глаза. Расположенный за анусом яйцеклад трубчатый (рис. 2б, 2в), его длина 4% SL. Расстояние от ануса до начала А в 1.6 раза больше длины от подбородка до ануса. Кожа голая. При жизни покровы тела студенистые.
Голотип – молодая самка (стадия зрелости гонад III), диаметр незрелых икринок в яичниках не превышает 1 мм.
Измерения, в % SL (% c): длина головы 25.4, ширина головы 11.8 (46.5), длина рыла до края орбиты 8.9 (34.9), диаметр открытой части глаза 5.6 (22.1), диаметр орбиты 6.5 (25.6), заглазничное расстояние от края глаза до конца оперкулярной лопасти 11.8 (46.5), межглазничное расстояние 9.8 (38.4), длина верхней челюсти 11.8 (46.5), ширина рта 9.8 (38.4), длина жаберного отверстия 8.0 (31.4), высота головы 20.1 (79.1), наибольшая высота тела 20.1 (79.1), высота у начала А 20.1 (79.1), антедорсальное расстояние 28.7 (112.8), антеанальное расстояние 34.3 (134.9), расстояние от вершины нижней челюсти до ануса 12.4 (48.8), то же до диска 7.2 (28.4), длина диска 4.1 (16.3), его ширина 3.0 (11.9); расстояния: от ануса до начала А 19.5 (76.7), от диска до ануса 0, от вершины нижней челюсти до симфизиса Р 5.9 (23.3); длина грудного плавника: верхней лопасти 20.7 (81.4), короткого луча выемки 9.5 и 8.9 (37 и 35), нижней лопасти 11.8 (46.5).
Окраска при жизни лиловая с сиреневым отливом (рис. 2а). Область предкрышки и брюшко выглядят тёмными из-за чёрной выстилки жаберной и брюшной полостей. Конец хвостовой части и края плавников чёрные, грудной плавник черноватый. После фиксации экземпляра красные тона окраски исчезают, чёрная меланофорная пигментация сохраняется (рис. 2г). Кожа вокруг рта и область жаберного отверстия, низ головы и диск серые; внутренняя поверхность грудных плавников черноватая. Ротовая полость тёмно-серая, жаберная полость и перитонеум чёрные.
Сравнительные замечания. Новый вид отличается от большинства карепроктов северной части Тихого океана комплексом признаков, перечисленных в диагнозе. По счётным признакам он наиболее сходен с тремя северотихоокеанскими карепроктами – C. colletti Gilbert, 1896, C. roseofuscus и выделенным недавно C. ambustus Orr, 2020. Характерным признаком C. colletti, описанного из вод к югу от п-ова Аляска, является заметно удлинённая нижняя лопасть грудного плавника, значительно превышающая по длине лучи его верхней лопасти, маленькое (меньше диаметра глаза) жаберное отверстие и глубоко вогнутый (чашевидный) диск (Gilbert, 1896). У экземпляра C. schmidti, напротив, нижняя лопасть грудного плавника короче его верхней лопасти; жаберное отверстие больше глаза (в 1.4 раза), диск уплощённый.
C. roseofuscus, описанный из Охотского моря от о-ва Сахалин, сходен с карепроктом Шмидта строением грудного плавника, нижняя лопасть которого не удлинена. В отличие от C. schmidti у него меньше основных лучей С (8 против 10); анус открывается не сразу за диском, а отстоит от него на расстояние (6% SL), сходное с диаметром диска (5.5% SL) (Gilbert, Burke, 1912a). У изученных для сравнения экземпляров C. roseofuscus (рис. 4), помимо перечисленных различий, тело листовидно сжатое с боков и очень высокое (наибольшая высота содержится 3.4 раза в SL против 5.0 раза у C. schmidti, составляя 29–31% SL против 20%); грудной плавник расположен латерально – его верхний луч находится на уровне глаза (у C. schmidti – на уровне рта); диск почти в два раза крупнее (7.5–8.4 против 4.1% SL), расстояние от подбородка до ануса в два раза больше (23–27 против 12% SL у C. schmidti).
От C. ambustus наш вид отличается комплексом признаков. У C. ambustus челюстные зубы слабо трёхлопастные и мелкие (образуют 23–45 косых рядов по 11–27 зубов), диск продольно-овальный и вогнутый, анус открывается на некотором расстоянии от диска (равном примерно 1/3 длины диска); нижняя лопасть Р по длине почти равна верхней лопасти (в среднем соответственно 16.7 и 18.5% SL) (Orr et al., 2020. Table 1 ). Голотип C. ambustus, пойманный в Тихом океане к югу от о‑ва Амля (Алеутский архипелаг) на глубине 330 м, имеет розово-красную кожу с оранжевым оттенком (Orr et al., 2020. Fig. 2); спина у него горбатая в средней части тела (высота тела в этой области заметно больше высоты у затылка); жаберное отверстие косое и низко расположено (его верхний край на уровне нижнего края глаза); оперкулярный отросток направлен вентрально и заходит заметно ниже орбиты. У C. schmidti челюстные зубы простые с острыми вершинами (по четыре–пять в рядах), уплощённый диск имеет треугольные очертания, анус открывается сразу позади диска, нижняя лопасть Р заметно короче верхней (12 против 21% SL); кожа фиолетово-лиловая, выcота тела не повышается к середине его длины, жаберное отверстие вертикальное и выше расположено (начинается от уровня верхнего края глаза), оперкулярный отросток направлен каудально.
Прочие виды, более или менее сходные габитуально с карепроктом Шмидта, также отличаются от него: у C. nigricans Schmidt, 1950 зубы трёхлопастные, у C. entomelas Gilbert, 1896, С. cryptocanthoides Krasyukova 1984, С. bathycoetus Gilbert, 1896 и С. melanuroides Schmidt, 1950 лучей в грудном плавнике меньше (26–28), у С. longifilis Garman, 1892, C. filamentosus Stein, 1978 и C. microstomus Stein, 1978 иная формула пор (2−6−7−1) (Garman, 1892; Gilbert, 1896; Шмидт, 1950; Stein, 1978; Красюкова, 1984).
Несколько новых видов карепроктов недавно описаны из Западной Пацифики: C. iacchus Kai, Tohkairin, Fujiwara et Hamatsu, 2018, C. kamikawai Orr, 2012, C. lycopersicus Orr, 2012, C. nelsoni Orr, 2016, C. notosaikaiensis Kai, Ikeguchi et Nakabo, 2011, C. rotundifrons Sakurai et Shinohara, 2008, C. shigemii Matsuzaki, Mori, Kamiunten, Yanagimoto et Kai, 2020, C. staufferi Orr, 2016, C. surugaensis Murasaki, Takami et Fukui, 2017. У всех этих видов зубы трёхлопастные и число позвонков меньше, чем у C. schmidti, – от 42 до 58 против 63 (Sakurai, Shinohara, 2008; Kai et al., 2011, 2018; Orr, 2012, 2016; Murasaki et al., 2017; Matsuzaki et al., 2020). У глубоководных видов C. pulcher, C. globulus, C. laperousei и C. brevipectoralis, описанных из района пролива Буссоль Курильского архипелага (Chernova et al., 2020), позвонков также меньше – 46 или 55–57 против 63 у C. schmidti.
В географическом отношении бóльшая часть северотихоокеанских карепроктов известна из более южных, чем C. schmidti, районов: из Японского и Охотского морей, от Курильских о-вов, Юго-Восточной Камчатки, Алеутских о-вов, из зал. Аляска, от побережья Орегона и Калифорнии (Chernova et al., 2004). В северо-западной части Берингова моря на континентальном склоне южнее м. Наварин отмечены немногие виды: C. colletti, C. cypselurus, C. furcellus Gilbert et Burke, 1912, C. melanurus, C. ostentum Gilbert, 1896, C. rastrinus Gilbert et Burke, 1912 и C. simus Gilbert, 1896 (Балыкин, Токранов, 2010; Парин и др., 2014). Все они также отличаются от нового вида. У C. cypselurus, описанного из западной части Берингова моря (к северу от о-ва Богослов Алеутской гряды), позвонков больше (65–70 против 63), зубы простые, но очень мелкие, грудной плавник лишён выемки, анус отстоит от диска на заметное расстояние, равное половине заглазничного промежутка (Jordan, Gilbert in Jordan, Evermann, 1898. Р. 2866; наши данные: OSU № 013014). У типового экземпляра C. furcellus, согласно первоописанию, голова приплюснутая (её ширина 17 против 12% SL у C. schmidti); межглазничное расстояние широкое (14 против 10% SL), тело заметно выше (27 против 20% SL), диск больше (6 против 4% SL), голова и передняя часть тела полностью розовые (Gilbert, Burke, 1912b). У типовых экземпляров C. melanurus (из вод Орегона и Калифорнии) перитонеум серебристый с чёрным крапом, диск очень мал и составляет 3/5 диаметра глаза (Gilbert, 1892). Кроме того, жаберное отверстие у C. melanurus косое и низко расположено (его верхний край ниже уровня глаза), анус открывается на небольшом расстоянии за диском, а нижняя лопасть Р (в среднем 16.7% SL) по длине сходна с его верхней лопастью (18.5% SL) (Orr et al., 2020). У C. ostentum зубы трёхлопастные, диск очень мал (~1.3% SL), лучей С 8, перитонеум серебристый (Gilbert, 1896). У C. rastrinus кожа густо усеяна шипиками, перитонеум серебристый. У C. simus зубы трёхлопастные, перитонеум светлый (Gilbert, 1896).
Распространение. Голотип C. schmidti пойман в западной части Берингова моря к юго-западу от м. Наварин, в мезобентали на глубине 852–862 м. Район расположен на северном склоне Алеутской котловины, изолированной от остальных вод Тихого океана Алеутской грядой и подводными хребтами Ширшова и Бауэрса. Участок находится в зоне влияния Беринговоморского склонового течения, переносящего водные массы от юго-востока Берингова моря вдоль его склона в северо-западном направлении (Stabeno et al., 1999; Panteleev et al., 2012). В летний период здесь формируется ветровой апвеллинг, сопряжённый с подъёмом глубинных вод (Андреев, 2019). Условия обитания вида, таким образом, иные по гидрологическим характеристикам, чем у карепроктов из Охотского и Японского морей, каждое из которых отличается по степени изолированности от других акваторий Тихого океана и по особенностям гидрологии.
Ихтиоцен мезобентали в районе поимки C. schmidti, по результатам шести донных тралений, включает до 20 видов. Основу численности составляют макрурусы (Macrouridae): малоглазый Albatrosia pectoralis (Gilbert, 1892), пепельный Coryphaenoides cinereus (Gilbert, 1896) и чёрный C. acrolepis (Bean, 1884). Обычны были миктофовые (Myctophidae) Stenobrachius leucopsarus (Eigenmann et Eigenmann, 1890) и S. nannochir (Gilbert, 1890), липаровые (Liparidae) Elassodiscus sp. и Paraliparis sp., психролютовые (Psychrolutidae) Psychrolutes phrictus Stein et Bond, 1978, батилаговые (Bathylagidae) Pseudobathylagus milleri (Jordan et Gilbert, 1898) и стомиевые (Stomiidae) Chauliodus macouni Bean, 1890. Из головоногих моллюсков в уловах преобладал кальмар Gonatus madokai (Okutani, 1977).
В улове трала, которым был пойман карепрокт Шмидта, численно преобладали два вида – пепельный C. cinereus и малоглазый A. pectoralis макрурусы (75.7 и 18%). Доли в улове чёрного макруруса C. acrolepis, липарид Elassodiscus sp. (два вида) и Paraliparis sp., а также батилага Миллера P. milleri составляли ~1% (каждого вида). Единично встретились: фиолетовый скат Bathyraja violacea (Suvorov, 1935) (Arhynchobatidae), тихоокеанский хаулиод C. macouni, темнопёрый S. nannochir и светлопёрый S. leucopsarus стенобрахи, луковидный онейрод Oneirodes bulbosus Chapman, 1939 (Oneirodidae), аляскинский шипощёк Sebastolobus alascanus Bean, 1890 (Sebastidae), белорылый психролют P. phrictus; бельдюговые – берингийский ликод Lycodes beringi Andriashev, 1935, лиценхел Ратманова Lycenchelys ratmanovi Andriashev, 1955, Lycenchelys sp., Bothrocarina sp. (Zoarcidae), а также длиннопёрая малоротая камбала Glyptocephalus zachirus Lockington, 1879 (Pleuronectidae). Все эти виды отмечали и ранее в Западно-Беринговоморском промысловом районе Берингова моря (Балыкин, Токранов, 2010; Парин и др., 2014).
Биология. Среди характерных особенностей C. schmidti обращает на себя внимание наличие у самки яйцеклада, что может свидетельствовать о сложном репродуктивном поведении особей этого вида. Биология липарид изучена недостаточно, но для ряда представителей семейства известны случаи репродуктивного комменсализма. Для арктического C. fulvus Chernova, 2014 из Карского моря описана спонгиофилия: развитие икры в парагастральной полости стеклянных губок Schaudinnia rosea (Hexactinellida: Rossellidae) (Чернова, 2014). Более широко известна карцинофилия (Андрияшев, 2003) – репродуктивный комменсализм карепроктов и крабоидов семейства Lithodidae (Decapoda, Reptantia) (Расс, 1950; Hunter, 1969; Parrish, 1972, Somerton, Donaldson, 1998; Полтев, Мухаметов, 2009; Полтев, 2013). Карцинофилия имеет антитропическое распространение: наблюдается у видов, обитающих в северной части Тихого океана, а также в юго-восточных районах Пацифики и Атлантики. Среди северотихоокеанских видов карцинофилия известна для C. melanurus, C. cypselurus, C. furcellus и C. rastrinus. Оплодотворение у них внутреннее. Самки при помощи яйцеклада откладывают икру под карапакс крабоидов, где проходит эмбриональное и личиночное развитие. Инкубационный период у карепроктов продолжительный (занимает несколько месяцев), и карцинофилия увеличивает выживаемость молоди. По всей видимости, C. schmidti также входит в группу рыб, проявляющих заботу о потомстве.
Список литературы
Андреев А.Г. 2019. Циркуляция вод в северо-западной части Берингова моря по спутниковым данным // Исследование Земли из космоса. № 4. С. 40–47. https://doi.org/10.31857/S0205-96142019440-47
Андрияшев А.П. 2003. Липаровые рыбы (Liparidae, Scorpaeniformes) Южного океана и сопредельных вод // Исследования фауны морей. Т. 53 (61). СПб.: Изд-во ЗИН, 478 с.
Балыкин П.А., Токранов А.М. 2010. Ихтиофауна и рыболовство северо-западной части Берингова моря // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 17. С. 48-65.
Красюкова З.В. 1984. Новые виды липаровых рыб (Scorpaeniformes, Liparidae), описанные П.Ю. Шмидтом по материалам Курило-Сахалинской экспедиции Зоологического института Академии наук СССР (1947−1949) // Тр. ЗИН АН СССР. Т. 127. С. 5−16.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России – аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Полтев Ю.Н. 2013. О карцинофилии рыб рода Careproctus (Scorpaeniformes: Liparidae) в водах юго-восточного Сахалина (Охотское море) // Вопр. ихтиологии. Т. 53. № 4. С. 450−458. https://doi.org/10.7868/S0042875213030090
Полтев Ю.Н., Мухаметов И.Н. 2009. К вопросу о карцинофилии видов рода Careproctus (Scorpaeniformes: Liparidae) у северных Курильских островов // Биология моря. Т. 35. № 2. С. 132–139.
Расс Т.С. 1950. Замечательный случай биологической связи рыбы и краба // Природа. № 7. С. 68−69.
Чернова Н.В. 2014. Новый вид рода Сareproctus (Scorpaeniformes: Liparidae) из Карского моря с замечаниями о спонгиофилии – репродуктивном комменсализме рыб и губок (Rossellidae) // Вопр. ихтиологии. Т. 54. № 5. С. 508−519. https://doi.org/10.7868/S0042875214050038.
Шмидт П.Ю. 1904. Рыбы восточных морей Российской Империи. СПб.: Изд-во Императ. рус. геогр. о-ва, 466 с.
Шмидт П.Ю. 1948. Рыбы Тихого океана: очерк современных теорий и воззрений на распространение и развитие фауны рыб Тихого океана. М.: Пищепромиздат, 123 с.
Шмидт П.Ю. 1950. Рыбы Охотского моря. М.; Л.: Изд-во АН СССР, 370 с.
Able K.W., McAllister D.E. 1980. Revision of the snailfish genus Liparis from Arctic Canada // Can. Bull. Fish. Aquat. Sci. № 208. i–viii+52 p.
Burke C.V. 1930. Revision of the fishes of the family Liparidae // Bull. US Nat. Mus. № 150. 204 p.
Chernova N.V., Stein D.L., Andriashev A.P. 2004. Family Liparidae Scopoli 1777 – snailfishes // Calif. Acad. Sci. Annotated Checklists of Fishes. № 31. P. 1–72.
Chernova N., Thiel R., Eidus I. 2020. Four new species of Careproctus (Cottoidei: Liparidae) from the deep-water vicinity of the southern Kurile Islands (Western North Pacific) // Zootaxa. V. 4821. № 1. P. 071−087. https://doi.org/10.11646/zootaxa.4821.1.3.
Garman S. 1892. The Discoboli. Cyclopteridae, Liparopsidae, and Liparididae // Mem. Mus. Comp. Zool. V. 14. Pt 2. P. 1−96+ Pls. 1−13.
Gilbert C.H. 1892. Descriptions of thirty-four new species of fishes collected in 1888 and 1889, principally among the Santa Barbara Islands and in the Gulf of California // Proc. US Nat. Mus. V. 14. Scientific results of explorations by the U.S. Fish Commission steamer Albatross. № 880. P. 539−566.
Gilbert C.H. 1896. The ichthyological collections of the steamer Albatross during the years 1890 and 1891 // US Comm. Fish and Fisheries. Rept. Commissioner. V. 19. № 6. P. 393−476.
Gilbert C.H., Burke C.V. 1912a. New cyclogasterid fishes from Japan // Proc. US Nat. Mus. V. 42. P. 351–380.
Gilbert C.H., Burke C.V. 1912b. Fishes from Bering Sea and Kamchatka // Bull. Bureau Fish. V. 30. № 754. P. 31−96.
Hunter C.J. 1969. Confirmation of symbiotic relationship between liparid fishes (Careproctus spp.) and male king crab (Paralithodes camtschatica) // Pacif. Sci. V. 23. № 4. P. 546−547.
Imamura H., Yabe M. 2002. Demise of the Scorpaeniformes (Actinopterygii: Percomorpha): an alternative phylogenetic hypothesis // Bull. Fish. Sci. Hokkaido Univ. V. 53. № 3. P. 107−128.
Jordan D.S., Evermann B.W. 1898. The fishes of North and Middle America: a descriptive catalogue of the species of fish-like vertebrates found in the waters of North America north of the Isthmus of Panama. Pt. 3 // Bull. US Nat. Mus. № 47. i-xxiv + 2183a−3136 p.
Kai Y., Ikeguchi S., Nakabo T. 2011. A new species of the genus Careproctus (Liparidae) from the Sea of Japan // Ichthyol. Res. V. 58. № 4. P. 350–354. https://doi.org/10.1007/s10228-011-0241-3
Kai Y., Tohkairin A., Fujiwara K., Hamatsu T. 2018. Careproctus iacchus, a new variegated snailfish (Liparidae) from the Seas of Japan and Okhotsk // Ibid. V. 65. № 4. P. 417–422. https://doi.org/10.1007/s10228-018-0626-7
Machi K., Nobetsu T., Yabe M. 2012. Careproctus rausuensis, a new liparid fish (Percomorphacea: Cottiformes), collected from Hokkaido, Japan // Bull. Nat. Mus. Nat. Sci. Ser. A. Suppl. 6. P. 33–40.
Matsuzaki K., Mori T., Kamiunten M., Kai Y., Yanagimoto T. 2020. A new species of Careproctus (Cottoidei: Liparidae) from the Sea of Okhotsk and a redescription of the blacktip snailfish Careproctus zachirus // Ichthyol. Res. V. 67. № 3. P. 399–407. https://doi.org/10.1007/s10228-020-00734-w
Murasaki K., Takami M., Fukui A. 2017. Careproctus surugaensis sp. nov. (Liparidae), a new snailfish from Suruga Trough, Japan // Ibid. V. 65. № 2. P. 237−244 (2018). https://doi.org/10.1007/s10228-017-0611-6
Orr J.W. 2012. Two new species of snailfishes of the genus Careproctus (Scorpaeniformes: Liparidae) from the Bering Sea and eastern North Pacific Ocean, with a redescription of Careproctus ovigerus // Copeia. V. 100. № 2. P. 257−265. https://doi.org/10.2307/23273219
Orr J.W. 2016. Two new species of snailfishes of the genus Careproctus (Liparidae) from the Aleutian Islands, Alaska // Ibid. V. 104. № 4. P. 890–896. https://doi.org/10.1643/CI-15-378
Orr J.W., Maslenikov K.P. 2007. Two new variegated snailfishes of the genus Careproctus (Teleostei: Scorpaeniformes: Liparidae) from the Aleutian Islands, Alaska // Ibid. V. 95. № 3. P. 699–710. https://doi.org/10.1643/0045-8511(2007)2007[699:TNVSOT]2.0.CO;2
Orr J.W., Kai Y., Nakabo T. 2015. Snailfishes of the Careproctus rastrinus complex (Liparidae): redescriptions of seven species in the North Pacific Ocean region, with the description of a new species from the Beaufort Sea // Zootaxa. V. 4018. № 3. P. 301–348. https://doi.org/10.11646/zootaxa.4018.3.1
Orr J.W., Spies I., Stevenson D.E. et al. 2019. Molecular phylogenetics of snailfishes (Cottoidei: Liparidae) based on MtDNA and RADseq genomic analyses, with comments on selected morphological characters // Ibid. V. 4642. № 1, 79 p. https://doi.org/10.11646/zootaxa.4642.1.1.
Orr J.W., Pitruk D.L., Manning R. et al. 2020. New species of snailfish (Cottiformes: Liparidae) closely related to Careproctus melanurus of the Eastern North Pacific // Copeia. V. 108. № 4. P. 711−726. https://doi.org/10.1643/CI2020008
Panteleev G., Yaremchuk M., Luchin V. et al. 2012. Variability of the Bering Sea circulation in the period 1992–2010 // J. Oceanogr. V. 68. P. 485−496. https://doi.org/10.1007/s10872-012-0113-0
Parrish R. 1972. Symbiosis in the blacktail snailfish, Careproctus melanurus, and the box crab, Lopholithodes foraminatus // Calif. Fish. Game. V. 58. № 3. P. 239−240.
Sakurai H., Shinohara G. 2008. Careproctus rotundifrons, a new snailfish (Scorpaeniformes: Liparidae) from Japan // Bull. Nat. Mus. Nat. Sci. Ser. A. Suppl. 2. P. 39–45.
Somerton D.A., Donaldson W. 1998. Parasitism of the golden king crab, Lithodes aequispinus, by two species of snailfish, genus Careproctus // Fish. Bull. V. 96. № 4. P. 871–884.
Stabeno P.J., Schumacher J.D., Ohtani K. 1999. The physical oceanography of the Bering Sea // Dynamics of the Bering Sea: a summary of physical, chemical, and biological characteristics, and a synopsis of research on the Bering Sea / Eds. Loughlin T.R., Ohtani K. Sidney, British Columbia: North Pacific Marine Science Organization (PICES), 28 p. (https://www.pmel.noaa.gov/pubs/outstand/stab1878/general.shtml)
Stein D.L. 1978. A review of the deepwater Liparidae (Pisces) from the coast of Oregon and adjacent waters // Proc. Calif. Acad. Sci. V. 127. P. 1−55.
Wiley E.O., Johnson G.D. 2010. A teleost classification based on monophyletic groups // Origin and phylogenetic interrelationships of Teleosts / Eds. Nelson J.S. et al. München: Verlag Dr. Friedrich Pfeil. P. 123−182.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии