Вопросы ихтиологии, 2021, T. 61, № 4, стр. 432-440
Экогеографические единицы и единицы запаса кеты Oncorhynchus keta Амурской зоогеографической провинции
Л. А. Животовский 1, 2, *, Е. В. Подорожнюк 3, С. Е. Кульбачный 3, М. В. Шитова 1, Т. А. Ракицкая 1, А. И. Никифоров 4, Г. А. Рубцова 1, К. И. Афанасьев 1, 2
1 Институт общей генетики РАН – ИОГен РАН,
Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
3 Хабаровский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии − ХабаровскНИРО
Хабаровск, Россия
4 Московский государственный институт международных отношений (университет)
МИД Российской Федерации − МГИМО
Москва, Россия
* E-mail: levazh@gmail.com
Поступила в редакцию 02.07.2020
После доработки 03.08.2020
Принята к публикации 04.08.2020
Аннотация
На примере кеты Oncorhynchus keta Амурской зоогеографической провинции рассматривается принцип подразделения вида на популяционные группировки. На основе зоогеографического районирования и биологических границ группировок кеты по районам нереста, соответственно их распространению, миграции и воспроизводству, а также оценок их дифференциации по микросателлитным ДНК-маркерам, в Амурской провинции выделено восемь экогеографических единиц. В Амурском зоогеографическом районе этой провинции к ним отнесли летнюю кету Амуро-Амгуньского экорегиона, осеннюю кету нижнего Амура (Амуро-Амгуньского и Амуро-Уссурийского экорегионов); в Шантарском зоогеографическом районе провинции – удско-тугурскую и ульбанскую группировки; в сахалинской части Амурской провинции − группировки северозападной и северовосточной частей Сахалина, а также летнюю и осеннюю кету р. Поронай. Эти экогеографические единицы могут рассматриваться как базовые нерестовые единицы запаса кеты данной части ареала вида.
Для разработки планов управления природными биологическими ресурсами – их продуктивностью, воспроизводством, промыслом, охраной – необходимо выделять единицы запаса интересующего нас вида как популяционные группировки, обитающие на определённых частях видового ареала. Обратимся за примером к кете Oncorhynchus keta Walbaum, являющейся в настоящее время основным объектом пастбищного лососеводства России (Глубоковский и др., 2010). Выделение единиц её запаса необходимо, поскольку за последние два десятка лет выпуск заводской молоди кеты вырос более чем в два раза (Леман и др., 2015); при этом нередки бессистемные перевозки кеты, в том числе из рек, далеко отстоящих от места выпуска молоди. Поэтому становится важным установление ограничений на перевозки оплодотворённой икры между рыбоводными заводами, на распределение норм вылова и регуляцию воспроизводства с учётом популяционной структуры вида и требований к эффективности воспроизводства как заводской, так и дикой кеты (Животовский, Смирнов, 2018).
Географически кета – наиболее распространённый вид тихоокеанских лососей, который нагуливается в северной части Тихого океана и заходит на нерест в реки азиатского и американского побережий (Salo, 1991; Макоедов и др., 2009). В пределах российского Дальнего Востока выделяют от шести до семи основных региональных нерестовых группировок кеты, одна из которых представлена бассейном р. Амур (Карпенко, Рассадников, 2004). Амурская кета представляет также один из пяти крупных генетических кластеров кеты Дальнего Востока, выделяемых по ДНК-маркерам (Животовский и др., 2010). Важной особенностью кеты, как и других тихоокеанских лососей, является наличие у неё темпоральных форм, выявленных вначале у амурской кеты: летней и осенней (яровая и озимая расы − по: Берг, 1934), которые в районах совместного обитания размножаются симпатрически в одних и тех же речных бассейнах, но на разных типах нерестилищ (Бирман, 1954; Волобуев и др., 1990; Рослый, 2002; Волобуев, Марченко, 2011).
Чтобы эффективно управлять природными ресурсами, следует выделять единицы запаса соответственно популяционно-биологической и генетической структурам вида. Для конкретного вида существуют границы, определяемые его биологическими особенностями, в том числе сроком и местом нереста, типом нерестилищ, поведением, миграционными обменами. Например, для кеты охотоморского побережья материка Волобуев и Марченко (2011) предлагают иерархическую организацию кеты: локальные стада, их темпоральные формы, а затем более мелкие внутрибассейновые группировки. Напротив, Иванков с соавторами (2010) полагают, что популяционная структура кеты, как и других видов тихоокеанских лососей, в первую очередь определяется по типу нерестилищ – русловой и ключевой формами; более мелкие подразделения основаны на сроках и местах нереста.
Объединяющим для выделения единиц запаса как внутривидовых популяционных группировок видится подход, основанный на биогеографических принципах, с привлечением данных по экологии и генетике популяций. В частности, для их выделения можно воспользоваться концепцией экогеографических единиц (ЭГЕ) (Zhivotovsky et al., 2015; Животовский, 2016а, 2017): каждая ЭГЕ определяется как группа географически близких популяций, ареал которых характеризуется сходными экологическими условиями, с возможным обменом между собой генными потоками, но значительно обособленных от других ЭГЕ, что можно тестировать с помощью ДНК-маркеров.
В настоящей работе на примере кеты Амурской зоогеографической провинции рассматриваются принципы подразделения вида и его ареала на основе биогеографических, экологических и генетических данных.
МАТЕРИАЛ И МЕТОДИКА
Процедура выделения ЭГЕ состоит из двух этапов (Zhivotovsky et al., 2015; Животовский, 2016а, 2017). На первом этапе следует предварительно разбить ареал вида на эколого-географические районы, используя важные для изучаемого вида характеристики местообитания, а затем выделенные эколого-географические районы подразделить на ЭГЕ с учётом биологии вида. Каждая ЭГЕ может включать несколько популяций. На втором этапе выделенные ЭГЕ следует верифицировать – проверить их на генетическое отличие друг от друга, имея множественные выборки особей из популяций каждой ЭГЕ, после чего какие-то ЭГЕ объединить друг с другом, а какие-то далее подразделить; при неопределённости следует провести дальнейшие исследования.
Например, для пресноводных рыб и других гидробионтов, репродукция которых проходит в реках и озёрах, эколого-географические районы можно выделять, накладывая друг на друга разные подразделения ареала вида (по бассейнам стока рек, гидробиологическим особенностям, ихтиофауне, приуроченности данного вида к тем или иным местообитаниям, климатическим параметрам, миграциям и пр.). В частности, одними из границ нерестовых ЭГЕ для тихоокеанских лососей и других лососёвых рыб дальневосточного региона, у которых критический период онтогенеза или вся жизнь проходят в реках и озёрах, может служить биота пресноводных бассейнов, являющаяся индикатором и средой обитания изучаемого вида. В этом качестве мы принимаем ихтиологическое районирование по Черешневу (1998). В качестве других границ может быть выбран водосборный бассейн как целостная единица в организации ландшафта: он задаёт гидрологический режим территории, бассейны стока определяют особенности температурного режима и другие характеристики водоёмов (Мартыненко, Бочарников, 2008; Корытный, 2017). Бассейновый принцип подразделения ареала для кеты, как и для многих других видов, для которых пресноводный период является важнейший этапом онтогенеза, имеет существенное значение, так как на этот период приходится основная адаптивная нагрузка и закладывается механизм хоминга.
Дальнейшее подразделение эколого-географических районов на ЭГЕ осуществляется с учётом биологии вида – миграционных, репродуктивных и других характеристик. В частности, при подразделении кеты важно учитывать наличие темпоральных группировок, в первую очередь – летней и осенней форм, приуроченных к русловым и ключевым нерестилищам (Иванков и др., 2010; Иванков, Иванкова, 2013, 2020). Репродуктивная обособленность между расами значительна, в особенности в р. Амур, и выражается как в морфофизиологических различиях, в частности в числе пилорических придатков (Берг, 1934; Григо, 1953; Куликова, 1970; Смирнов, 1975; Животовский и др., 2017), так и по генетическим маркерам (Салменкова и др., 1994; Животовский и др., 2017).
Для ДНК-тестирования ЭГЕ генотипировали биологические образцы кеты по микросателлитным маркерам (Ssa197, Ssa20-19, Ogo2, Oke3, Oke11, One103, One109, Ots3, Oki1-1 и Oki1-2) согласно методике Афанасьева с соавторами (2011). Все исследованные выборки кеты указаны на рис. 1 и перечислены в табл. 1.
Рис. 1.
Амурская зоогеографическая провинция (по: Черешнев, 1998) ( ) и места взятия выборок кеты Oncorhynchus keta для ДНК-анализа (⚫). Зоогеографические районы (цифры в кругах): Шантарский (13' −
Удско-Тугурский, 13'' – Ульбанский подрайоны), Амурский (14' − Амуро-Амгуньский, 14''
– Амуро-Уссурийский подрайоны) и Северосахалинский (15). Границы Амуро-Амгуньского
и Амуро-Уссурийского зоогеографических подрайонов (—) соответствуют экорегионам по:
Симонов, Егидаров, 2015. Нумерацию выборок см. в табл. 1 (по р. Тымь обозначено устье).
) и места взятия выборок кеты Oncorhynchus keta для ДНК-анализа (⚫). Зоогеографические районы (цифры в кругах): Шантарский (13' −
Удско-Тугурский, 13'' – Ульбанский подрайоны), Амурский (14' − Амуро-Амгуньский, 14''
– Амуро-Уссурийский подрайоны) и Северосахалинский (15). Границы Амуро-Амгуньского
и Амуро-Уссурийского зоогеографических подрайонов (—) соответствуют экорегионам по:
Симонов, Егидаров, 2015. Нумерацию выборок см. в табл. 1 (по р. Тымь обозначено устье).

Таблица 1.
Места, даты сбора и объём генотипированных образцов кеты Oncorhynchus keta Амурской зоогеографической провинции
| № | Место сбора | Дата сбора | Форма | Число рыб, экз. |
|---|---|---|---|---|
| 0 | Устье Амура | Июль 2003 | Летняя | 50 |
| 1 | Оз. Орель | 13−14.07.2018 | 30 | |
| 2 | Пальвинская протока | 16.07.2018 | 20 | |
| 3 | Р. Сомня (приток р. Амгунь) | 17−21.07.2018 | 14 | |
| 26−28.07.2018 | 39 | |||
| 3а | Р. Амгунь (чуть ниже устья р. Сомня) | 31.07.2018 | 100 | |
| 4 | Р. Нимелен (приток р. Амгунь) | 13.09.2018 | Осенняя | 50 |
| 5 | Р. Дуки (приток р. Амгунь) | Июнь 2012 | 48* | |
| 15.09.2018 | 50 | |||
| 6 | Р. Хилка | 20.07.2012 | Летняя | 17 |
| 7 | Р. Гера | 21.07.2012 | 20 | |
| 22−24.07.2018 | 53 | |||
| 8 | Протока Ухта (оз. Удыль) | 25.07.2018 | 50 | |
| 9 | Р. Гур (ЛРЗ “Гурский”) | 21.09.2018 | Осенняя | 50 |
| 10 | Р. Анюй | Октябрь 2002 | 46 | |
| 04.10.2012 | 19 | |||
| 19−21.09.2018 | 38 | |||
| 20.09.2018 | 50 | |||
| 11 | Пемзенская протока (р. Амур) | 20.09−05.10.2012 | 24 | |
| 12 | Амурская протока (р. Уссури) | Июнь 2012 | 48* | |
| 26−30.09.2012 | 72 | |||
| 03.10.2018 | 50 | |||
| 13 | Р. Хор (приток р. Уссури) | 26.10.2012 | 12 | |
| 14 | Р. Тунгуска | 2003 | 27 | |
| 26−30.09.2018 | 50 | |||
| 15 | Р. Биджан (Биджанский ЛРЗ) | Октябрь 2018 | 25 | |
| 16 | Р. Тугур: | |||
| – устье | 05.08.2009 | Летняя | 48 | |
| – низовье | 18.08−02.09.2013 | 28 | ||
| 17 | Р. Тугур | 20.09.2008 | Осенняя | 34 |
| 02−08.09.2012 | 20 | |||
| 18 | Р. Тугур (протока Гадек) | 01−05.09.2011 | Летняя | 25 |
| 19 | Ручей Грунтовый (р. Тугур) | Август 2011 | 62 | |
| 20 | Р. Конин (приток р. Тугур) | 07, 16−18.08.2013 | Осенняя | 44 |
| 08−10.09.2012 | 48 | |||
| 21 | Р. Иткан | 09−12.07.2009 | 48 | |
| 22 | Петровская коса | 24.07.2009 | 48 | |
| 23 | Р. Лангры | 24.07.2008 | 20 | |
| 05.08.2008 | 18 | |||
| Октябрь 2011 | 17 | |||
| 23 | Большой Камулан (приток р. Лангры) | Октябрь 2011 | 15 | |
| 24 | Р. Тымь (Адо-Тымовский ЛРЗ) | 04.09.2003 | 51 | |
| 17.09.2004 | 50 | |||
| 02−24.09.2012 | 27 |
Биологические образцы предоставлены: по кете бассейна р. Амур за 2018 г. – Е.В. Подорожнюк, К.И. Афанасьевым, Г.А. Рубцовой, М.В. Шитовой, А.И. Никифоровым; Шантарского района (бассейн реки Тугур и Иткан) и Петровской косы – С.Е. Кульбачным; р. Тымь за 2012 г. – А.Е. Лапшиной; р. Лангры за 2008 г. – А.Ю. Семенченко и А.А. Юрченко, за 2011 г. – Х.Ю. Кимом. Для полноты исследования привлекли опубликованные данные: по кете р. Тымь за 2003 и 2004 гг. и североохотской кете (Афанасьев и др., 2011), по кете бассейна р. Амур за 2012 г. и ранее (Животовский и др., 2017).
Популяционно-генетические статистики (FIS, оценки θP и θS для FST-статистики популяционной дифференциации, генетическая дистанция Рейнолдса и др.) оценивали согласно руководству Вейра (Weir, 1996) с использованием программы GDA (Lewis, Zaykin, 2001). Для кластеризации выборок применяли метод главных координат с использованием пакета SPSS for Windows (George, Mallery, 2005). Поправки на множественные сравнения проводили согласно процедуре (Benjamini, Hochberg, 1995) в каждой выборке по 55 тестам на соотношения Харди−Вайнберга и двухлокусные равновесия по сцеплению. Статистически значимое отклонение обнаружено по локусу Oke3 и его неравновесию с локусом Oki12 в выборке из р. Тугур (осенняя, 2012 г., р = 0.0028 после поправки). Однако по этому локусу нет нехватки гетерозигот (FIS = –0.068), так что отклонение не связано с наличием нуль-аллелей и могло быть вызвано малым объёмом выборки (n = 20). К тому же при поправке по всей массе наблюдений (табл. 1) выявленное отклонение проявляет себя как незначимое.
РЕЗУЛЬТАТЫ
Применяя описанную выше методику, мы выделяем нерестовые ЭГЕ кеты Амурской зоогеографической провинции согласно следующему алгоритму. Вначале разбили исследуемую часть ареала вида в соответствии с зоогеографическим районированием Дальнего Востока по Черешневу (1998), который Амурскую зоогеографическую провинцию подразделяет на Шантарский, Амурский и Северосахалинский районы, представленные на рис. 1 под номерами 13–15 (соответственно нумерации автора). Далее мы наложили на это подразделение нерестового ареала биологические границы группировок кеты и получили следующие ЭГЕ этого вида.
В Амурском зоогеографическом районе мы ограничиваемся Амуро-Амгуньским (14') и Амуро-Уссурийским (14'') подрайонами нижнего Амура (по экологической классификации бассейна р. Амур (Симонов, Егидарев, 2015)), где расположены основные нерестовые площади амурской кеты и откуда собраны наши выборки (рис. 1); отметим, что амурская кета чётко отличается генетически от охотоморской кеты (рис. 2). Согласно экологическим и генетическим данным, кету Амурского зоогеографического района относим к двум ЭГЕ. Одна из ЭГЕ – это летняя кета, которая имеет ограниченный нерестовый ареал в отличие от гораздо более широко расселённой осенней формы. Летняя кета Амура была ранее выделена Золотухиным (2019) как отдельная ЭГЕ, но мы для определённости ограничиваем её территорию Амуро-Амгуньским экорегионом (14'), что практически совпадает с установленными границами нереста летней кеты (ср.: Золотухин (2019. Рис. 1) и Симонов, Егидарев (2015. Рис. 2.2 )). Генетические данные указывают на значительные отличия летней кеты Амура от осенней формы по изученным ДНК-маркерам (рис. 3), что подтверждает более раннее заключение (Животовский и др., 2017).
Рис. 2.
Генетическая дифференциация исследованных выборок кеты Oncorhynchus keta из бассейна р. Амур (⚪) и охотоморского побережья (⚫) в пространстве главных компонент (здесь и на рис. 3, 4 – ГК); в генетический кластер охотоморского побережья вошли выборки из Шантарского, Северосахалинского и Североохотского зоогеографических районов.
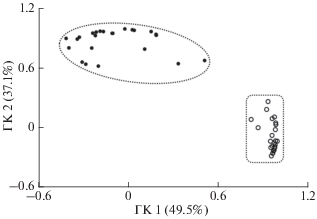
Рис. 3.
Генетическая дифференциация кеты Oncorhynchus keta бассейна р. Амур летней (⚪) и осенней форм из Амуро-Амгуньского ( ) и Амуро-Уссурийского подрайонов (⚫), к последнему району относятся также выборки
из бассейна р. Уссури ((△) – Амурская протока, (▲) – р. Хор) и из Пемзенской протоки
(+).
) и Амуро-Уссурийского подрайонов (⚫), к последнему району относятся также выборки
из бассейна р. Уссури ((△) – Амурская протока, (▲) – р. Хор) и из Пемзенской протоки
(+).
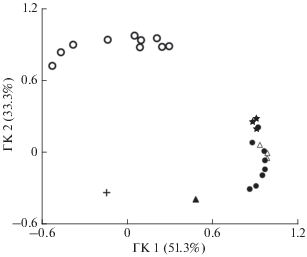
Что касается осенней кеты Амура, то, согласно экологическому районированию региона (Симонов, Егидарев, 2015), естественно выделить Амуро-Амгуньский экорегион в качестве одного из кандидатов на отдельную ЭГЕ осенней кеты. Однако генетические данные не позволяют разделить исследованные выборки осенней кеты Амура на чётко различимые пространственно или темпорально разделённые группировки (рис. 3). Поэтому в качестве второй ЭГЕ амурской кеты мы рассматриваем осеннюю кету, нерестящуюся в пределах всего нижнего Амура − Амуро-Амгуньского и Амуро-Уссурийского экорегионов. (Мы не имеем детальной информации о воспроизводстве кеты среднего и верхнего Амура, потому её не анализируем.)
Шантарский зоогеографический район мы разбиваем на удско-тугурскую (13') и ульбанскую (13'') экогеографические единицы (рис. 1), так как, согласно Кульбачному (2010), нерестовые подходы кеты к рекам этих подрайонов противоположны по направлению (соответственно с северо-востока и юго-востока), а значит, могут принадлежать разным группировкам вида. Данные рис. 4 и табл. 2 демонстрируют генетические отличия тугурской кеты от других группировок вида. Ульбанская кета также предварительно верифицируется генетически как отдельная ЭГЕ (табл. 2), однако требуются дальнейшие уточнения, так как она представлена единственной выборкой из р. Иткан.
Рис. 4.
Генетическая дифференциация кеты Oncorhynchus keta охотоморского побережья: (⚪) – ручьевая и (⚫) – ключевая формы из р. Тугур; (△) –
Североохотский зоогеографический район; ( ) – р. Тымь; (×) – ранняя и (+) – поздняя формы из р. Лангры. Группировки, представленные
одной выборкой, не показаны.
) – р. Тымь; (×) – ранняя и (+) – поздняя формы из р. Лангры. Группировки, представленные
одной выборкой, не показаны.
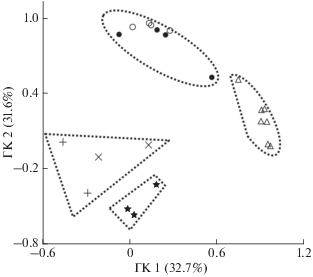
Таблица 2.
Генетическая подразделённость экогеографических единиц (ЭГЕ) кеты Oncorhynchus keta Амурской зоогеографической провинции (для сравнения добавлены североохотские выборки кеты)
| ЭГЕ | ЭГЕ | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 1. Амур осенняя | $\frac{{0.64}}{{p < 0.005}}$ | 1.75 | 6.33 | 4.70 | 5.52 | 6.04 | 6.33 |
| 2. Амур летняя | 1.17 | $\frac{{0.45{\kern 1pt} *}}{{p = 0.01}}$ | 4.05 | 4.02 | 3.85 | 4.91 | 4.58 |
| 3. Удско-тугурская | 5.73 | 3.52 | $\frac{{0.65}}{{p = 0.01}}$ | 2.05 | 2.78 | 3.32 | 1.63 |
| 4. Ульбанская | 4.11 | 3.64 | 1.47 | − | 3.64 | 3.78 | 1.37 |
| 5. Северо-Западный Сахалин | 4.92 | 3.37 | 2.13 | 3.20 | $\frac{{0.72}}{{p = 0.03}}$ | 1.44 | 2.57 |
| 6. Северо-Восточный Сахалин | 5.47 | 4.51 | 2.75 | 3.52 | 0.96 | $\frac{{0.37}}{{p = 0.06}}$ | 2.42 |
| 7. Североохотская | 5.82 | 4.23 | 1.15 | 1.13 | 2.22 | 2.11 | $\frac{{0.28}}{{p = 0.08}}$ |
Примечание. Над диагональю – точечные оценки θS, под диагональю – θP (нижние границы 99%-ных доверительных интервалов всех оценок положительны, т.е. p < 0.005); по диагонали: над чертой – значения θ между популяциями внутри ЭГЕ, под чертой – уровень значимости отличия θ от нуля. *Одна выборка (р. Хилка) сильно отклоняется по ДНК-маркерам от остальных девяти выборок летней кеты Амура; без неё внутрирасовая межпопуляционная гетерогенность уменьшается до 0.25% (p = 0.024); из-за неё летняя кета в прежнем материале (три выборки: Животовский и др., 2017) выглядела более гетерогенной и гораздо более отличной от осенней кеты Амура, чем в нашем более обширном материале (но из-за этого же доверительный интервал оценок был прежде очень широкий); “–” – представлена единственной выборкой.
Северосахалинский зоогеографический район включает две ЭГЕ сахалинской кеты, представленные в нашем материале реками Лангры и Тымь; добавим также, что этот район включает ещё две ранее выделенные ЭГЕ – летнюю и осеннюю расы кеты бассейна р. Поронай (Животовский, 2019).
Все выделенные ЭГЕ Амурской зоогеографической провинции значимо отличаются друг от друга по исследованным ДНК-маркерам (табл. 2).
ОБСУЖДЕНИЕ
В Амурской зоогеографической провинции мы выделяем четыре континентальные ЭГЕ кеты: амуро-амгуньскую летнюю, нижнеамурскую осеннюю, удско-тугурскую и, предварительно, ульбанскую. Их нерестовые ареалы отличаются друг от друга по биогеографическим параметрам, экологии, климатическим особенностям. Генетически они отличаются друг от друга и от других группировок кеты Дальнего Востока, в том числе Северного Сахалина (рис. 2–4, табл. 2). Следует особо отметить большие генетические отличия кеты бассейна р. Амура от кеты р. Лангры, несмотря на географическую близость устьев этих рек (обе они впадают в Амурский лиман), что могло бы гипотетически вызвать обмен генными потоками между ними. Вероятно, этот вывод можно распространить на все реки северо-запада Сахалина, но для окончательных суждений требуется генетический анализ выборок кеты из этих рек.
По имеющимся зоогеографическим, экологическим и генетическим данным, летняя кета бассейна р. Амур однозначно выделяется в качестве единицы запаса амурской кеты. Другой единицей запаса является осенняя кета нижнего Амура (Амуро-Амгуньского и Амуро-Уссурийского экорегионов). Согласно нашему подходу, у нижнеамурской осенней кеты можно было бы выделить не одну, а две ЭГЕ − амуро-амгуньскую (рис. 1: 14') и амуро-уссурийскую (14''), что соответствовало бы выводу Золотухина (2019). Тем более такое выделение напрашивается, потому что нерестовый ареал осенней кеты бассейна р. Амур подразделяется по типу нерестилищ: в нижнем течении Амура бóльшая часть нерестилищ снабжается водой из парафлювиальных источников, в то время как выше по течению её нерестилища расположены на выходах ключей (Золотухин, 2019). Более того, выборки осенней кеты Амуро-Амгуньского экорегиона лежат на краю генетического кластера осенней амурской кеты (рис. 3), что могло бы быть дополнительным основанием в пользу предварительного разделения нижнеамурской осенней кеты на две указанные ЭГЕ. Однако генетически эти две группы кеты не образуют разных отделённых друг от друга генетических кластеров, поэтому мы объединяем их в единую ЭГЕ. Действительно, генетическая дифференциация между ними невелика и статистически незначима (θS = = 0.74, θP = 0.16, р = 0.13). С другой стороны, статистическая незначимость различий могла быть обусловлена небольшим объёмом материала из Амуро-Амгуньского экорегиона (всего три выборки). Поэтому для тестирования гипотезы о подразделении осенней кеты нижнего Амура на две ЭГЕ желательно иметь данные по большему числу выборок из Амуро-Амгуньского экорегиона с повторностями по годам. Кроме того, Золотухин (2019) выявил озёрную форму кеты, нерестящуюся в оз. Чля (близ оз. Орель); такую редкую популяцию также необходимо тестировать генетически. Добавим также, что необходимо в дальнейшем лучше охватить выборками бассейн р. Уссури, имеющиеся три выборки из которого мало репрезентативны для столь значительного притока Амура (Рослый, 2002; Литвинцева и др., 2009).
Для кеты южной части охотоморского побережья материка мы ограничиваемся Шантарским экогеографическим районом (по другим водоёмам генетических данных нет), где выделяем две экогеографические единицы – удско-тугурскую и ульбанскую. По динамике численности и ихтиологическим критериям Кульбачный (2010) выделяет два стада кеты в этой части нерестового ареала кеты − аяно-тугурское (от р. Алдома до рек Уда и Тугур) и ульбано-искинское (впадающие в Ульбанский залив реки и далее на юго-восток до рек Сахалинского залива); т.е. нерестовый ареал этих двух стад простирается за пределы Шантарского зоогеографического района. Насколько эти стада соответствуют выделенным экогеографическим единицам и какое между ними соответствие, сказать с определённостью трудно из-за отсутствия необходимых генетических данных. Выборка кеты, выловленная у Петровской косы (рис. 1), генетически сильно отличается от кеты р. Иткан, так что наследственное единство ульбано-искинского стада остаётся под вопросом. Не исключено, что оно подразделяется на части, одна из которых – это ульбанская ЭГЕ. С другой стороны, Ульбанский зоогеографический подрайон (рис. 1) представлен в нашем материале только одной выборкой – из р. Иткан. Поэтому требуется дальнейшее генетическое изучение кеты этого подрайона для её окончательной верификации как отдельной ЭГЕ.
Следует отметить тенденцию к генетической дифференциации ручьевой и ключевой форм кеты бассейна р. Тугур, соответствующих летней и осенней кете Амура (Кульбачный, Иванков, 2011). Однако генетические различия между ними неизмеримо меньше (θS = 0.74, θP = 0.21, р = 0.06), чем между сезонными расами амурской кеты (табл. 2). Возможно, это вызвано большей интенсивностью генных потоков между ними из-за пространственной близости их нерестилищ. Поэтому следует детальнее исследовать кету других водоёмов Шантарского зоогеографического района, в том числе из рек Уда и Алдома.
Как соотносятся между собой экогеографическая единица и единица запаса? Под единицей запаса может пониматься популяция, стадо, локальное стадо или другие подразделения вида (Карпенко, 2013). Иванков и Иванкова (2020) определяют единицу запаса как локальную популяцию, являющуюся одновременно и единицей промысла. Животовский (2016б, 2017) определил единицу запаса как одну или несколько природных и/или искусственно разводимых популяций, обитающих в сходных средовых условиях, обладающих сходными биологическими признаками, генетически близких друг к другу по сравнению с их отличиями от других популяций этого вида, а также объединённых единым планом управления (воспроизводства, промысла, охраны). Последнее требование (единый план управления) означает, что единица запаса – это не только популяционная группировка, но и хозяйственно важное подразделение вида. Все остальные требования относятся, по сути, к экогеографической единице.
Экогеографическая единица, объединяющая популяции на основе общих эколого-географических и генетических характеристик и возможных миграционных обменов между ними, может стать удобным объектом для выделения нерестовых единиц запаса вида. Так определённая единица запаса как хозяйственный объект может подразделяться на отдельные локальные популяции – элементарные единицы запаса (Иванков, Иванкова, 2020) или же, напротив, объединяться друг с другом в большие стада (Карпенко, 2013), если того требует хозяйственная стратегия. Однако именно ЭГЕ является базовой единицей запаса вида: с одной стороны, ЭГЕ биогеографически и генетически обосновывает, почему данные популяции группируют в одну нерестовую единицу запаса; с другой стороны, она очерчивает границы единицы запаса, что удобно для практических целей разработки стратегии управления видом. Соответственно, разные единицы запаса могут управляться и регулироваться независимо от других единиц запаса данного вида.
Для выделения единиц запаса анадромных видов рыб важно учитывать их пространственные и временны́е границы (Животовский, 2019; Иванков, Иванкова, 2020). С учётом популяционно-биологических, биогеографических и генетических критериев в качестве базовой нерестовой единицы запаса кеты можно брать её экогеографическую единицу. Поэтому, как и ЭГЕ, каждая единица запаса кеты состоит из одной или нескольких соседних природных и/или искусственно разводимых локальных популяций (отдельных рек и притоков крупных рек), объединённых общими условиями и временем воспроизводства, сходными биологическими признаками, генетически отличными от других единиц запаса этого вида.
Соответственно сказанному, на исследованной части континентального побережья Амурской зоогеографической провинции мы выделяем четыре базовых единицы запаса кеты: летнюю кету Амура, осеннюю кету нижнего Амура, удско-тугурскую и, предварительно, ульбанскую (кету среднего и верхнего Амура генетически не изучали, поэтому её статус в этой статье не рассматривали). В сахалинской части Амурской провинции также выделяются четыре единицы запаса: северовосточной и северозападной частей Сахалина, а также летняя и осенняя кета бассейна р. Поронай.
Список литературы
Афанасьев К.И., Рубцова Г.А., Шитова М.В. и др. 2011. Популяционная структура кеты Oncorhynchus keta российского Дальнего Востока, выявленная по микросателлитным маркерам // Биология моря. Т. 37. № 1. С. 39−47.
Берг Л.С. 1934. Яровые и озимые расы у проходных рыб // Изв. АН СССР. VII сер. Отд. матем. и естеств. наук. № 5. С. 711−732.
Бирман И.Б. 1954. Динамика численности и современное состояние запасов кеты и горбуши в бассейне Амура // Тр. совещания по лососевому хозяйству Дальнего Востока. М.: Изд-во АН СССР. С. 22−37.
Волобуев В.В., Марченко С.Л. 2011. Тихоокеанские лососи континентального побережья Охотского моря (биология, популяционная структура, динамика численности, промысел). Магадан: Изд-во СВНЦ ДВО РАН, 303 с.
Волобуев В.В., Рогатных А.Ю., Кузищин К.В. 1990. О внутривидовых формах кеты Oncorhynchus keta материкового побережья Охотского моря // Вопр. ихтиологии. Т. 30. Вып. 2. С. 221−228.
Глубоковский М.К., Павлов Д.С., Леман В.Н. и др. 2010. Методические рекомендации по организации РХЗЗ на примере лососевых рыб Дальнего Востока России // Лососевые рыбохозяйственные заповедные зоны на Дальнем Востоке России. М.: Изд-во ВНИРО. С. 98−122.
Григо Л.Д. 1953. О морфологических отличиях летней и осенней кеты Oncorhynchus keta (Walbaum) // ДАН СССР. Т. 92. № 6. С. 1225−1228.
Животовский Л.А. 2016а. Популяционная структура вида: эко-географические единицы и генетическая дифференциация популяций // Биология моря. Т. 42. № 3. С. 323–333.
Животовский Л.А. 2016б. Провизорное районирование единиц запаса кеты Дальнего Востока России // Бюл. № 11 изучения тихоокеанских лососей на Дальнем Востоке. С. 193−198.
Животовский Л.А. 2017. Две ветви исследований популяционной структуры вида – экологическая и генетическая: история, проблемы, решения // Генетика. Т. 53. № 11. С. 1244–1253. https://doi.org/10.7868/S0016675817110133
Животовский Л.А. 2019. Экогеографические единицы и единицы запаса вида в пресноводных экосистемах (на примере кеты о. Сахалин) // Принципы и способы сохранения биоразнообразия. Йошкар-Ола: Изд-во МарГУ. С. 276−278.
Животовский Л.А., Смирнов Б.П. 2018. Стратегия воспроизводства тихоокеанских лососей в Сахалинской области // Вопр. рыболовства. Т. 19. № 3. С. 285−299.
Животовский Л.А., Рубцова Г.И., Шитова М.В. и др. 2010. База микросателлитных ДНК-данных по кете Дальнего Востока России // Реализация “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Бюл. № 5. С. 53−63.
Животовский Л.А., Лапшина А.Е., Михеев П.Б. и др. 2017. Дивергенция сезонных рас кеты (Oncorhynchus keta) рек Амур и Поронай: Экология, генетика, морфология // Биология моря. Т. 43. № 4. С. 284−292.
Золотухин С.Ф. 2019. Внутривидовые группировки кеты Oncorhynchus keta (Salmonidae) реки Амур и их распределение по бассейну // Изв. ТИНРО. Т. 197. С. 21−34. https://doi.org/10.26428/1606-9919-2019-197-21-34
Иванков В.Н., Иванкова Е.В. 2013. Внутривидовые репродуктивные стратегии у тихоокеанских лососей рода Оncorhynchus (фундаментальное сходство и видовые различия) // Там же. Т. 173. С. 103−118.
Иванков В.Н., Иванкова Е.В. 2020. Эколого-темпоральная дифференциация, единицы запаса и сохранение популяционного разнообразия анадромных рыб // Биология моря. Т. 46. № 2. С. 85–90. https://doi.org/10.31857/S0134347520020059
Иванков В.Н., Иванкова Е.В., Кульбачный С.Е. 2010. Внутривидовая экологическая и темпоральная дифференциация у тихоокеанских лососей. Эколого темпоральные расы и темпоральные популяции кеты Оncorhynchus keta // Изв. ТИНРО. Т. 163. С. 91−105.
Карпенко В.И. 2013. Оценка состояния запасов и управление промыслом тихоокеанских лососей на Камчатке. Петропавловск-Камчатский: Изд-во КГТУ, 64 с.
Карпенко В.И., Рассадников О.А. 2004. Состояние запасов дальневосточных лососей (Salmonidae) в современный период (1972–2002) // Исследования водных биологических ресурсов Камчатки и северо-западной части тихого океана. Вып. 7. С. 14–26.
Корытный Л.М. 2017. Бассейновая концепция: от гидрологии к природопользованию // География и природ. ресурсы. № 2. С. 5–16. https://doi.org/10.21782/GIPR0206-1619-2017-2(5-16)
Куликова Н.И. 1970. Локальные стада кеты советского Дальнего Востока: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО, 19 с.
Кульбачный С.Е. 2010. Экология и структура популяций кеты северо-западной части континентального побережья Охотского моря: Автореф. дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 25 с.
Кульбачный С. Е., Иванков В. Н. 2011. Темпоральная дифференциация и условия размножения кеты Oncorhynchus keta (Salmoniformes: Salmonidae) бассейна реки Тугур (Хабаровский край) // Вопр. ихтиологии. Т. 51. № 1. С. 70–79.
Леман В.Н., Смирнов Б.П., Точилина Т.Г. 2015. Пастбищное лососеводство на Дальнем Востоке: современное состояние и существующие проблемы // Тр. ВНИРО. Т. 153. С. 105−120.
Литвинцева В.А., Литвинцев А.А., Коцюк Е.А. 2009. Характеристика фонда рыбохозяйственных водоемов Хабаровского края: степень освоения, классификация и значение водных объектов // Вопр. рыболовства. Т. 10. № 3 (39). С. 423−432.
Макоедов А.Н., Коротаев Ю.А., Антонов Н.П. 2009. Азиатская кета. Петропавловск-Камчатский: Изд-во КамчатНИРО, 356 с.
Мартыненко А.Б., Бочарников В.Н. 2008. Экологическое районирование Дальнего Востока // Изв. РАН. Сер. географ. № 2. С. 76−84.
Рослый Ю.С. 2002. Динамика популяций и воспроизводство тихоокеанских лососей в бассейне Амура. Хабаровск: Хабаров. книж. изд-во, 210 с.
Салменкова Е.А., Омельченко В.Т., Рослый Ю.С. и др. 1994. Генетическая дифференциация кеты бассейна Амура // Генетика. Т. 30. № 4. С. 518−528.
Симонов Е.А., Егидарев Е.Г. 2015. Бассейн реки Амур: характеристика и особенности использования водных ресурсов // Комплексная эколого-экономическая оценка развития гидроэнергетики бассейна реки Амур. М.: WWF и др. С. 21−32.
Смирнов А.И. 1975. Биология, размножение и развитие тихоокеанских лососей. М.: Изд-во МГУ, 335 с.
Черешнев И.А. 1998. Биогеография пресноводных рыб Дальнего Востока России. Владивосток: Дальнаука, 131с.
Benjamini Y., Hochberg Y. 1995. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. Roy. Stat. Soc. Ser. B. V. 57. P. 289−300. https://doi.org/10.1111/j.2517-6161.1995.tb02031.x
George D., Mallery P. 2005. SPSS for Windows step by step. Boston: Pearson, 386 p.
Lewis P.O., Zaykin D. 2001. Genetic data analysis: computer program for the analysis of allelic data. Version 1.0 (d16c). (http://lewis.eeb.uconn.edu/lewishome/software.html)
Salo E.O. 1991. Life history of chum salmon (Oncorhynchus keta) // Pacific salmon life histories. Vancouver: UBC Press. P. 231−309.
Weir B.S. 1996. Genetic data analysis II. Methods for discrete population genetic data. Sunderland: Sinauer Ass., 445 p.
Zhivotovsky L.A., Yurchenko A.A., Nikitin V.D. et al. 2015. Eco-geographic units, population hierarchy, and a two-level conservation strategy with reference to a critically endangered salmonid, Sakhalin taimen Parahucho perryi // Conserv. Gen. V. 16. P. 431–441. https://doi.org/10.1007/s10592-014-0670-4
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


