Вопросы ихтиологии, 2021, T. 61, № 5, стр. 584-589
Влияние уровня воды на выход анабаса Anabas testudineus на сушу и особенности его перемещений
Е. Д. Павлов 1, *, Д. С. Павлов 1, Е. В. Ганжа 1, В. В. Костин 1, Чан Дык Зьен 2, 3
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Приморское отделение Российско-вьетнамского тропического
научно-исследовательского и технологического центра
Нячанг, Вьетнам
3 Высший научно-технический университет Вьетнамской академии наук и технологий
Ханой, Вьетнам
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 03.08.2020
После доработки 05.08.2020
Принята к публикации 05.08.2020
Аннотация
Представлены результаты изучения поведения и особенностей перемещения анабаса Anabas testudineus в установке “сухой лабиринт”. При падении уровня воды в стартовом бассейне ниже критического отмечены два типа поведения анабаса: пережидание (часто в компактной группе на дне стартового бассейна) или выход на сушу и перемещение (миграция). Перемещения чаще проходят группой из двух–четырёх особей. Выбор рыбами бассейна с водой носит случайный характер. Попав в него, особи остаются здесь до конца опыта, тогда как из бассейна без воды они, как правило, уходят и продолжают поиск воды. Таким образом, именно поиск нового водоёма определяет миграцию анабаса по суше.
Миграция – одна из важнейших эволюционно сформированных адаптаций, направленная на повышение выживаемости вида. Помимо нагульных и нерестовых миграций, как правило, приуроченных к определённому времени года, миграции рыб могут быть вызваны неблагоприятными условиями обитания, такими как снижение обеспеченности пищей и уровня воды, уменьшение числа убежищ и другими (Olsson et al., 2006; Павлов и др., 2007; Ferguson et al., 2019).
В отличие от большинства рыб анабас Anabas testudineus способен совершать перемещения не только в воде, но и по суше. Этот вид может продолжительное время находиться вне воды за счёт дыхания по 3-фазному циклу смены воздуха в наджаберной полости, для обеспечения которого вода не требуется (Liem, 1987; Касумян и др., 2021). Миграции по суше позволяют анабасу расселяться по ближайшим не связанным друг с другом водоёмам (Das, 1928; Smith, 1945; Liem, 1987; Davenport, Matin, 1990; Graham, 1997; Perera et al., 2013). Сведения о миграциях и особенностях ориентации анабаса на суше и о факторах, вызывающих миграцию, крайне скудны (Касумян и др., 2021). Известно, что частота выхода из воды у анабаса значительно повышается при голодании и увеличении пищевой конкуренции в водоёме (Liem, 1987). Экспериментально показано, что одним из элементов миграции по суше у анабаса являются прыжки, изменение частоты которых также связано с голоданием рыб (Павлов и др., 2019). Сухопутные миграции анабас совершает в тёмное время суток − в ночные или предутренние часы (Das, 1928; Liem, 1987).
Цель данной работы – экспериментальным путём оценить влияние уровня воды на выход анабаса на сушу и исследовать особенности его перемещений в поисках нового водоёма.
МАТЕРИАЛ И МЕТОДИКА
Исследования проведены в январе–феврале 2020 г. в Приморском отделении Российско-вьетнамского тропического научно-исследовательского и технологического центра (СРВ, г. Нячанг). Особей анабаса (средняя длина 71 ± 1.9 мм, масса 12 ± 1.2 г) отловили в прудах (глубина 70 см, прозрачность воды до 30 см, температура 24°C), входящих в систему рисовых полей, около г. Ниньхоа (12°30′34′′ с.ш. 109°09′40′′ в.д., провинция Кханьхоа). Рыб отловили при помощи искусственных укрытий-ловушек. В лаборатории их содержали при температуре воды 25–26°C в четырёх аквариумах объёмом 100 л по 25 экз. в каждом. Чтобы исключить попытки анабаса выпрыгнуть, аквариумы заполняли водой наполовину (50 л) и накрывали стеклянными крышками (с небольшим зазором для доступа воздуха). В период акклимации (3 сут) воду в аквариумах заменяли два раза в сутки, в последующие дни – один раз в сутки. Рыб кормили два раза в сутки (в 07:00 и 19:00) сухим гранулированным кормом Humpy Head (“Yi Hu Fish Farm Traiding”, Сингапур) с диаметром гранул ~ 3 мм и средней массой 10 мг, рацион избыточный. Большинство рыб начали потреблять гранулированный корм в течение первых 3 сут.
Перемещения анабаса по суше изучали в специализированной установке “сухой лабиринт” (рис. 1а). Установка состояла из трёх бассейнов длиной и шириной по 0.4 м и высотой 0.5 м. Высота стен над уровнем воды (≥32 см) исключала возможность выпрыгивания рыб из установки. В каждом бассейне был установлен трап, идущий с наклоном 27° от дна бассейна до входа в горизонтальный коридор № 1 (длина 0.8 м), идущий до пересечения с коридором № 2 (длина 1.8 м). На дне каждого бассейна под трапом размещён кран для спуска воды. Коридоры установки находились на высоте 0.2 м относительно дна бассейнов. Трапы и дно коридоров были покрыты жёлтой хлопковой тканью для увеличения сцепления анабаса с поверхностью. Белая внутренняя поверхность стен трапа для облегчения зрительной ориентации рыб заштрихована чёрными наклонными линиями шириной 2–3 мм. Белые боковые стенки коридоров не заштрихованы.
Рис. 1.
Установка “сухой лабиринт”: а – вид сверху, б − стартовый бассейн, вид сбоку; ( ) − доступное анабасу Anabas testudineus пространство в течение опыта; (– – –) – уровень воды в стартовом бассейне в начале
опыта.
) − доступное анабасу Anabas testudineus пространство в течение опыта; (– – –) – уровень воды в стартовом бассейне в начале
опыта.

В “сухом лабиринте” и аквариумах для содержания рыб использовали одну и ту же воду, предварительно отстоянную не менее 3 сут в бассейне-накопителе. В стартовый бассейн заливали воду практически до уровня коридоров и помещали в него 10 особей (рис. 1б). К этому моменту рыбы не питались ~ 18 ч. Выход из стартового бассейна в коридор перекрывали пластиковой съёмной белой перегородкой. Такой же уровень воды был в одном из двух других бассейнов, второй оставался без воды, но ткань трапа в нём смачивали. Продолжительность акклимации рыб составляла 20 мин, затем начинали опыт: перегородку убирали и открывали кран для выпуска воды из стартового бассейна. Уровень воды в бассейне с 18 до 0 см снижался за 5 мин; его изменение фиксировали с помощью установленной над бассейном видеокамеры по шкале, нанесённой на стену бассейна. Температура воздуха в “сухом лабиринте” составляла 26–27°С, температура воды в бассейнах установки и в аквариумах, в которых содержали рыбы, – 25–26°C. Опыты проводили с 7 утра до 16 ч; освещённость в этот период варьировала от 215 лк днём до 32 лк к вечеру, в среднем составляя 153 лк (люксметр “Amtast LX1330B”). Различия освещённости в левой и правой частях коридора № 2 не превышали 16 ± 5.2 (1–55)11 лк.
С помощью видеокамеры GoPro Hero 7 Black, установленной на высоте ~1.5 м, в течение всего опыта (30 мин) регистрировали перемещения рыб в коридорах; с помощью видеокамер Yi Basic Edition и SjCam A10, установленных над бассейнами, регистрировали выход рыб в лабиринт и продолжительность нахождения каждой особи в бассейне. Чтобы избежать реакции рыб на оператора, наблюдение в реальном времени и управление видеозаписью осуществляли удалённо с помощью планшета и смартфона с установленным программным обеспечением. По видеозаписям определяли число захватов рыбами воздуха и число прыжков из воды; время, необходимое рыбам на выход в коридоры, на пребывание в бассейнах № 1 и № 2; направление перемещений. Скорость перемещений рыб по коридорам рассчитывали у особей, которые не делали продолжительных (в сумме за переход из бассейна в бассейн >30 с) остановок и двигались преимущественно в одном направлении. За выход анабаса из воды (на сушу) принимали случаи, когда рыба поднималась на трап полностью. Всего проведено 10 опытов на 50 особях (каждую рыбу использовали для опытов дважды с перерывом 1 сут).
Статистическая обработка данных проведена при помощи непараметрического дисперсионного анализа (H-критерий Краскела–Уоллиса) и критерия Стьюдента для долей.
РЕЗУЛЬТАТЫ
В течение 20-минутной акклимации рыбы свободно плавали в стартовом бассейне, находились на дне или лежали на подводной части трапа головой вверх. Время от времени особи совершали прыжки, направленные преимущественно в сторону стенок бассейна, крайне редко выпрыгивали на трап.
В начале опыта снижение уровня воды в стартовом бассейне с 18 до 16 см вызывало у рыб беспокойство: они активнее, чем в период акклимации, плавали по бассейну, чаще поднимались к поверхности воды и захватывали воздух, подходили к урезу воды у трапа. При уровне воды 16−8 см число подъёмов рыб к поверхности для захвата воздуха увеличивалось, а с уровня 6 см и ниже сокращалось (рис. 2). В среднем за период снижения уровня воды с 18 до 4 см в группе 10 особей регистрировали пять подъёмов к поверхности. Изменение уровня воды в стартовом бассейне в течение опыта показано на рис. 3.
Рис. 2.
Число захватываний атмосферного воздуха (⬜) и прыжков из воды (◼) у анабаса Anabas testudineus (суммарно 10 особей) в зависимости от уровня воды в стартовом бассейне; (|) – ошибка средней. В связи с низкой вариабельностью числа прыжков по ним не указана ошибка средней.
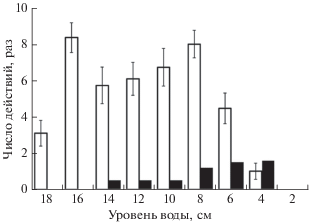
Рис. 3.
Динамика снижения уровня воды (–) и выхода особей анабаса Anabas testudineus из стартового бассейна ( ) в течение первых 10 мин опыта.
) в течение первых 10 мин опыта.

Прыжки анабаса из воды наблюдались при уровне 14 см и ниже (рис. 2). Непараметрический дисперсионный анализ показал, что частота прыжков рыб зависит (H-критерий: p < 0.001) от уровня воды; она возрастает при снижении уровня до 8–4 см. Особи в равной степени (50%) выпрыгивали как в сторону стен стартового бассейна, так и на трап. При уровне воды <2 см рыбы не совершали прыжки, так как им не хватало глубины для их реализации.
Для анабаса было характерно два типа выхода на трап. Первый – спокойный (ползание) за счёт движений тела и жаберных крышек. Второй – прыжок в направлении трапа, завершающийся попаданием обычно на первую его треть. Спокойный выход на трап особи совершали как при наличии воды в бассейне, так и практически при её полном отсутствии. При прыжке на трап бóльшая часть особей выходила в лабиринт, остальные скатывались обратно в воду. Рыбы начинали выходить на трап при уровне воды <3 см (4-я мин опыта), наиболее интенсивно − при его падении до 0 см: в течение 5−6-й мин из бассейна выползли более половины рыб, покинувших его за всё время опыта, или 36% общего числа особей (рис. 3). На трап особи достоверно (критерий Стьюдента для долей: p = 0.0047) реже выходили поодиночке (40% всех вышедших особей), чем группой (2–3 экз., реже 4), образуя цепочку, в которой за первой рыбой устремлялись следующие. Расстояние между соседними особями, двигавшимися в группе, как правило, не превышало 1.5 полной длины (TL). Групповой выход рыб в основном происходил при уровне воды ≤1 см. Группа рыб сохранялась и в коридорах, но длина их цепочки изменялась за счёт индивидуальных особенностей. Так, перемещавшиеся сзади особи могли догонять и обгонять рыб, двигавшихся до этого впереди. В коридорах группа никогда не увеличивалась за счёт примкнувших особей, но могла распадаться. В коридорах время от времени особи ненадолго останавливались, затем продолжали движение, как правило, в том же направлении. По достижении перекрёстка (коридора № 2) число особей в группе могло сокращаться за счёт выбора рыбами разного направления дальнейшего движения.
При перемещении по коридорам рыбы преимущественно двигались вдоль стен. Время перемещения особей от одного бассейна к другому (между любыми двумя бассейнами) составляло 75 ± 7.0 (18–292) с (n = 83). Заметная вариабельность обусловлена тем, что часть особей быстро достигала нового бассейна, а другие передвигались медленнее, с частыми, иногда длительными (>10 с) остановками, меняли направление движения. Скорость движения рыб в коридорах была 4.3 ± 0.24 (1.6–10.6) см/с (n = 71). Вниз по трапам рыбы всегда скатывались, перекатываясь вдоль продольной оси тела.
К концу опыта стартовый бассейн покинуло достоверно (критерий Стьюдента для долей: p < 0.001) больше рыб (69%), чем осталось в нём (31%) (рис. 4). Оставшиеся особи лежали на дне бассейна либо одиночно, либо группами, образуя плотные неподвижные скопления. В течение опыта некоторые из вышедших в лабиринт рыб могли вернуться в стартовый бассейн. В ряде случаев (16% всех особей) рыбы, вышедшие в коридоры, возвращались в бассейны, которые покинули (стартовый или бассейн без воды). В дальнейшем они могли выйти в коридор повторно. Особи примерно в равных долях (критерий Стьюдента для долей: p = 0.30) достигали бассейна с водой (30%) или без воды (37%). Различия в освещённости левой и правой частей коридора № 2 не влияли (H-критерий: p = 1.0) на направление перемещений особей. Две трети рыб, попавших в бассейн без воды, покидали его через 2.5 ± 0.7 (0.6–11.2) мин и перемещались по коридорам в стартовый бассейн или бассейн с водой. Во время движения из бассейна без воды они иногда встречались в коридорах с рыбами, ещё не достигшими этого бассейна. При этом ни те, ни другие встретившиеся особи не меняли направление движения. К концу опытов в стартовом бассейне было 40% рыб, в бассейнах с водой и без воды – соответственно 44 и 14%, в коридорах оставалось лишь 2% особей. Достоверно (критерий Стьюдента для долей: р = 0.0001) бóльшая часть рыб (44%, или 2/3 особей, покинувших стартовый бассейн) оказались в отсеке с водой.
ОБСУЖДЕНИЕ
Результаты исследования показали, что одним из важнейших факторов, стимулирующих анабаса мигрировать по суше, является снижение уровня воды в водоёме. Снижение уровня воды в течение 5 мин практически до нуля стимулирует рыб к быстрому ответу – перемещению по суше в поисках нового водоёма. Уровень воды ≤ 3 см можно считать для исследованных рыб и условий эксперимента критическим, при котором анабас начинает выходить на сушу. Отметим, что в эксперименте вода из бассейна уходила стремительно, что не наблюдается в природе. Влияние скорости снижения уровня воды на мотивацию анабаса к перемещениям по суше нуждается в дальнейшем исследовании.
Миграции анабаса по суше связывают преимущественно с голоданием и возрастающей пищевой конкуренцией (Liem, 1987). В нашем эксперименте использованы особи, не потреблявшие корм в течение ~18 ч. В период акклимации попытки выхода рыб по наклонному трапу в коридоры установки не отмечены. Это свидетельствует о том, что указанный срок голодания недостаточен для того, чтобы анабас покидал водную среду в поисках пищи. Ранее проведённые работы (Павлов и др., 2019) показали, что для повышения миграционной активности анабаса требуется более продолжительное время голодания особей (>2 сут).
В период засухи анабас может зарываться в грунт (Smith, 1945; Mookerjee, Mazumdar, 1946 – цит. по: Datta et al., 1976) либо переползать по суше в новые водоёмы (Linke, 1992). В проведённых экспериментах рыбы проявляли разную реакцию на снижение уровня воды: в то время как одни особи пережидали на дне стартового бассейна, другие выходили на сушу. Пережидающие неблагоприятные условия особи зачастую формировали компактные группы на дне бассейна, что, по-видимому, позволяло им дольше сохранять влажность тела. Вероятно, такие скопления рыб, как и их зарывание в грунт при засухе, имеют адаптивное значение. Второй тип поведения направлен на активный поиск новых условий обитания – других водоёмов. Успешность того или иного поведения при критическом снижении уровня воды полностью зависит от формирующихся в дальнейшем условий среды. При высокой влажности воздуха и близком расположении нового водоёма активный поиск может быть выгоднее, чем пережидание. В то же время пережидание позволяет особям сохранять энергетические ресурсы продолжительное время, так как движение рыб по суше энергетически высоко затратное (Sayer, Davenport, 1991). Отметим, что мы наблюдали первоначальные (ограниченные по времени 30 мин) реакции рыб, при этом выделенные два типа их поведения не являлись стабильными. На это указывает смена первоначального направления перемещений одиночных особей в коридорах установки, их возврат в стартовый бассейн, выход рыб из стартового бассейна лишь в конце опыта. С другой стороны, снижение доли рыб в коридорах до 2% к концу опыта указывает на разную степень мотивации (разнокачественность поведения) рыб к перемещению по суше.
Анабас может выходить на сушу как одиночно, так и группами (≥2 экз.). Вероятность выхода особей группой повышалась при уровне воды ≤ 1 см. Групповое перемещение анабаса сохраняется и при движении в лабиринте, однако на перекрёстке коридоров число рыб в группе может сокращаться в результате индивидуальной реакции особей – избрание конкретного направления движения (в сторону бассейна № 1 или № 2). Ранее мы показали, что перемещение анабаса в водной среде также обычно происходит в группе (Павлов и др., 2020). Следовательно, рыбы этого вида способны сохранять групповое поведение как в водной среде, так и на суше. Вероятно, формирование группы на суше возможно только непосредственно при выходе анабаса из бассейна. В коридорах группа перемещающихся рыб может распадаться, но не отмечено, чтобы она увеличивалась за счёт новых членов – встречные особи не вызывали реакции следования. Отметим, что на трапе для анабаса как при одиночном перемещении, так и в группе характерен неконтролируемый спуск вниз – перекат вдоль продольной оси тела. Такое явление наблюдается и в природе при скате анабаса с крутого берега в воду с всплеском (Smith, 1945).
Поиск анабасом бассейна с водой в опытах носил случайный характер. Так, при первоначальном достижении перекрёстка коридоров рыбы примерно в равных долях поворачивали как в направлении бассейна без воды (37%), так и в направлении бассейна с водой (30%). На отсутствие конкретного ориентира указывает и смена некоторыми особями направления движения в коридорах на противоположное. Перемещение в лабиринте, как правило, происходило до тех пор, пока рыба не обнаружит бассейн с водой: большинство особей, первоначально попавших в бассейн без воды, продолжали поиск. Рыбы, попавшие в бассейн с водой, не совершали попыток его покинуть. Следовательно, именно поиск воды определял перемещения (миграцию) анабаса по суше.
Средняя скорость перемещения анабаса в лабиринте составила 4.3 см/с (0.6 TL/с), а максимальная – 10.6 см/с. В природе анабас преодолевает свыше 90 м сложного маршрута примерно за 30 мин (5 см/с) (Smith, 1945), а в лабораторном эксперименте максимальная скорость перемещения более крупных особей (TL 14.3 см) приближалась к 25.6 см/с (Davenport, Matin, 1990). Наши данные согласуются с этими результатами. Очевидно, скорость перемещений анабаса по суше во многом зависит от его физиологического состояния и характера грунта.
Повышение частоты захвата воздуха и числа прыжков, отмеченные при снижении уровня воды, указывают на увеличение стресса рыб. Рост числа подъёмов к поверхности для захвата атмосферного воздуха анабасом при снижении уровня воды указывает на повышение интенсивности дыхания – смены воздуха в наджаберной области лабиринтового органа (Касумян и др., 2021). Частота прыжков анабаса может являться и показателем повышения его миграционной активности (начальным элементом миграции по суше) (Павлов и др., 2019, 2020). При достаточном (>2 см) уровне воды прыжки в сторону трапа способствуют выходу анабаса на сушу – в коридор “сухого лабиринта”. Прыжки анабаса в сторону берега можно рассматривать как врождённый рефлекс, помогающий при выходе на сушу, например, на крутой береговой склон.
Необходимо подчеркнуть, что, несмотря на разнообразие перемещений анабаса в установке “сухой лабиринт”, перемещения прекращаются после попадания особи в бассейн с водой. Это говорит о том, что единственной причиной перемещения рыб по суше является поиск воды. Нет подтверждений, что этот поиск носит направленный характер. В настоящее время помимо информации об ориентации анабаса на суше также отсутствуют данные по его групповому поведению за пределами водной среды, по срокам и времени миграций, что и станет предметом изучения в будущем.
ВЫВОДЫ
1. Снижение уровня воды до критического (<3 см), при котором особи не в состоянии полностью погрузиться в воду, является для анабаса стимулом к выходу на сушу.
2. Выявлены два типа поведенческой реакции анабаса на снижение уровня воды до критического: пережидание неблагоприятных условий на месте часто в компактной группе рыб или перемещение (миграция) по суше в поисках оптимальных условий обитания.
3. В условиях эксперимента поиск нового водоёма носит случайный характер.
4. Перемещения рыб в лабиринте завершаются при обнаружении нового водоёма, т.е. поиск такого водоёма определяет миграцию анабаса по суше.
Список литературы
Касумян А.О., Пащенко Н.И., Оань Л.Т.К. 2021. Морфология органа обоняния анабаса Anabas testudineus (Anabantidae, Perciformes) // Зоол. журн. Т. 100. № 1. С. 40−56. https://doi.org/10.31857/S0044513420110045
Павлов Д.С., Лупандин А.И., Костин В.В. 2007. Механизмы покатной миграции молоди речных рыб. М.: Наука, 213 с.
Павлов Е.Д., Звездин А.О., Павлов Д.С. 2019. Воздействие тиомочевины на миграционную активность анабаса Anabas testudineus и потребление им корма // Вопр. ихтиологии. Т. 59. № 5. С. 606–611. https://doi.org/10.1134/S0042875219050163
Павлов Е.Д., Павлов Д.С., Ганжа Е.В. и др. 2020. Воздействие мочевины и тиомочевины на миграционную активность анабаса Anabas testudineus // Там же. Т. 60. № 6. С. 682−688. https://doi.org/10.31857/S0042875220060053
Das B.K. 1928. The bionomics of certain air-breathing fishes of India, together with an account of the development of their air-breathing organs // Phil. Trans. Roy. Soc. Ser. B. V. 216. P. 183–216. https://doi.org/10.1098/rstb.1928.0003
Datta N.C., Saha A.K., Das A. 1976. Investigation on the morphology of the olfactory apparatus of Anabas testudineus (Bloch) // J. Inland Fish. Soc. India. V. 8. P. 13–18.
Davenport J., Matin A.K.M.A. 1990. Terrestrial locomotion in the climbing perch, Anabas testudineus (Bloch) (Anabantidea, Pisces) // J. Fish Biol. V. 37. P. 175–184. https://doi.org/10.1111/j.1095-8649.1990.tb05938.x
Ferguson A., Reed T.E., Cross T.F. et al. 2019. Anadromy, potamodromy and residency in brown trout Salmo trutta: the role of genes and the environment // J. Fish Biol. V. 95. № 3. P. 692−718. https://doi.org/10.1111/jfb.14005
Graham J.B. 1997. Air-breathing fishes: evolution, diversity, and adaptation. San Diego: Acad. Press, 299 p.
Liem K.F. 1987. Functional design of the air ventilation apparatus and overland escursions by teleosts // Fieldiana Zool. V. 37. P. 1–29.
Linke H. 1992. Labyrinth fish: the bubble nest builders, their identification, care and breeding. Melle: Tetra Press, 174 p.
Olsson I.C., Greenberg L.A., Bergman E., Wysujack K. 2006. Environmentally induced migration: the importance of food // Ecol. Lett. V. 9. № 6. P. 645−651. https://doi.org/10.1111/j.1461-0248.2006.00909.x
Perera P.A.C.T., Kodithuwakku K.A.H.T., Sundarabarathy T.V., Edirisinghe U. 2013. Captive breeding of Anabas testudineus (climbing perch) under semi-artificial conditions for the mass production of fish seed for conservation and aquaculture // Insight Ecol. V. 2. № 2. P. 8–14. https://doi.org/10.5567/ECOLOGY-IK.2013.8.14
Sayer M.D.J., Davenport J. 1991. Amphibious fish: why do they leave water? // Rev. Fish Biol. Fish. V. 1. № 2. P. 159–181.
Smith H.M. 1945. The freshwater fishes of Siam, or Thailand // Bull. U.S. Nat. Mus. V. 188, 622 p. https://doi.org/10.5479/si.03629236.188.1
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии



