Вопросы ихтиологии, 2021, T. 61, № 6, стр. 680-696
Развитие искусственного гибрида между двумя глубоководными симпатрическими формами мальмы Salvelinus malma complex (Salmonidae) из Кроноцкого озера (Восточная Камчатка)
М. Ю. Пичугин *
Московский государственный университет
Москва, Россия
* E-mail: mp_icth@mail.ru
Поступила в редакцию 17.08.2020
После доработки 01.09.2020
Принята к публикации 02.09.2020
Аннотация
Исследовано развитие эмбрионов и личинок гибрида между уникальными эндемичными глубоководными формами северной мальмы Salvelinus malma complex Кроноцкого озера (самки малоротого × самцы большеротого гольцов), выращенных в лаборатории при 6°С. Гибридные эмбрионы отставали в развитии от эмбрионов малоротого гольца и имели многочисленные аномалии развития. Смертность в позднем органогенезе и при абортивном вылуплении составила 93%, вскоре после вылупления – 3.5%. У личинок имелись аномалии и частные гетерохронии в развитии элементов скелета. Их массовая гибель приходится на период закладки осевого скелета. Семь гибридных особей (0.9%) прожили более одного года, достигли малькового периода, не имели аномалий скелета и достоверно отличались от мальков малоротого гольца меньшим числом лучей и птеригиофоров в спинном плавнике. Необычную для гольцов форму vomer и glossohyale у гибридов можно рассматривать как гибридное новообразование. Обсуждаются причины замедления эмбриогенеза и его аномалий, а также аномалий скелета и высокой смертности гибридов.
В крупнейшем пресноводном водоёме Восточной Камчатки – Кроноцком озере, отрезанном системой порогов от проникновения проходных лососёвых рыб (Salmonidae), обитают нерка-кокани Oncorhynchus nerka и семь морфологически различающихся эндемичных форм северной мальмы Salvelinus malma complex (Ostberg et al., 2009; Сенчукова и др., 2012). Из них пять форм гольцов (белый (WW), длинноголовый (LL) и три формы носатых (N1, N2 и N3)) размножаются в притоках озера с разным температурным режимом, а две (малоротый (SS) и большеротый (BB) гольцы) − на глубоководных озёрных нерестилищах (Есин, Маркевич, 2017; Есин и др., 2018). Уникальные озёрные формы были впервые обнаружены в 2012−2014 гг. при обловах глубоководной зоны Кроноцкого озера (Маркевич и др., 2014, 2017а). Взрослые особи обеих форм встречались на всей акватории озера начиная с глубины 20–3011 м и до 100 м. В летний сезон молодь и взрослые BB отлавливались в придонном горизонте на глубинах 30–60 м на участках с илистым грунтом, а взрослые SS − в толще воды на глубинах 20–50 м.
Морфологически глубоководные формы (SS и BB) отличаются от эпилимнических (N1-3, LL и WW) гольцов коротким рылом (в среднем 16–17 против 18–25% длины головы (с)) и большим диаметром глаза (27–32 против 20–24% с). Между собой SS и BB достоверно и значительно отличаются длиной рыла, нижней и верхней челюстей, грудных и брюшных плавников (у SS короче), а также диаметром глаза (у SS больше) и пропорциями некоторых костей черепа (Салтыкова и др., 2015; Маркевич и др., 2017а). У особей BB длинная изогнутая нижняя челюсть, которая выступает вперёд верхней челюсти, достигая в среднем 70% с. Различия в морфологии головы BB и SS формируются в раннем онтогенезе, поскольку молодь BB длиной по Смитту (FL) 61−124 мм уже имеет выраженную удлинённую нижнюю челюсть и достоверно отличается по этому признаку и длине рыла от молоди SS (Esin et al., 2018). Поймать более мелких диких особей BB и SS пока не удавалось.
В летнем питании BB отмечен только бентос (олигохеты, двустворчатые моллюски и личинки хирономид), который, как предполагается, рыбы выкапывают из ила с помощью специализированной нижней челюсти, а у SS помимо бентоса единично встречаются планктонные рачки и гаммарусы, что позволило Маркевичу с соавторами (2017а) отнести эту форму к эврифагам. Однако отмечено, что сравнительно высокая инвазия особей SS гельминтами, связанными в своём жизненном цикле с планктоном (в частности, трематодой Diplostomum gasterostei), происходит на литорали озера ещё в мальковый период и сохраняется у них в течение жизни. Взрослые особи SS являются придонными бентофагами, собирающими пищу с донной поверхности.
Сроки нереста озёрных форм на месяц и более смещены относительно нереста эпилимнических форм и частично перекрываются между собой, а нерестилища, по имеющимся в настоящее время данным, разобщены по вертикали и горизонтали. Нерестилища SS обнаружены в юго-восточной части озера на глубинах 30–40 м. Нерест предположительно проходит в момент наступления осенней гомотермии с конца октября до середины декабря при температуре 4.5−4.8°С. Созревающие особи BB отмечены в юго-западной части Кроноцкого озера, на глубинах ~50–60 м. Нерест этой формы проходит предположительно в период ледостава в январе–феврале при температуре 3.3−3.4°С (Маркевич и др., 2017а; Есин, Маркевич, 2017). Необходимо отметить, что глубоководные нерест и эмбрионально-личиночное развитие молоди − это довольно редкая особенность биологического цикла среди экотипов гольцов в пределах вида S. malma complex, обычно характеризуемых ручьевым или речным нерестом (Armstrong, Morrow, 1980; Пичугин, 2015; Есин, Маркевич, 2017).
Ранний онтогенез WW, N1 и SS был исследован при одинаковых условиях инкубации и выращивания (Пичугин, Маркевич, 2018; Пичугин, 2019а; Пичугин, 2020). Использованная минимальная технически возможная в условиях лаборатории кафедры ихтиологии МГУ температура 5−7°С (в среднем 6°С) находится в пределах толерантности предковой формы − северной мальмы, которой в камчатских реках свойствен растянутый до 4 мес. нерест, а эмбрионально-личиночное развитие её потомства на нативных нерестилищах протекает в широком диапазоне температуры и характеризуется эвритермностью (Пичугин, 2015). Напротив, выявление стенотермности любой из кроноцких форм в течение эмбриогенеза и личиночного периода свидетельствовало бы об утрате части изменчивости по этому показателю от предкового вида. Другим отличием лабораторной инкубации и выращивания молоди глубоководных форм, таких как SS, от нативных условий является отсутствие гидростатического давления в ~304−405 кПа, имеющегося на соответствующей глубине. Эту особенность технически сложно воссоздать в лаборатории. Однако имеется опыт успешной инкубации икры и подращивания молоди до наступления малькового периода форм арктических гольцов S. alpinus complex с глубоководным (30−50 м) нерестом (Павлов, Осинов, 2008; Пичугин, 2009а, 2009б; Алексеев и др., 2019; Пичугин, Алексеев, 2019). Отсутствие в уловах дикой молоди глубоководных форм FL < < 60−70 мм не позволило провести её сравнительный анализ с полученной в лаборатории молодью и оценить влияние условий инкубации и выращивания на рост и особенности морфогенеза (возраст появления воздуха в плавательном пузыре, переход на этап смешанного питания и т.д.). Однако при сравнении лабораторных серий молоди были выявлены значительные популяционные различия в темпе роста, формировании окраски и особенностях закладки и дифференцировки элементов скелета в течение эмбрионально-личиночного периода. В ноябре 2014 г. при сборе живой икры SS (Пичугин, 2019а) была получена и гибридная (SS × BB, далее SB) (Pichugin, Markevich, 2015), проведена её инкубация и подращивание молоди.
Цель настоящей работы − описать некоторые особенности эмбриогенеза и остеогенеза личинок и мальков SB и провести сравнительный анализ с таковыми SS (Пичугин, 2019а), выращенными одновременно в одинаковых условиях.
МАТЕРИАЛ И МЕТОДИКА
Оплодотворённую икру SB (>800 яиц) получили на озёрном нерестилище 08.11.2014 г. в результате осеменения “сухим” способом икры нескольких текучих самок SS спермой текучих самцов BB. Транспортировку в Москву осуществили в течение 2 сут в изотермическом контейнере с талым льдом. Инкубацию икры и подращивание молоди проводили при средней температуре соответственно 5.5 и 6.0°С. Икру, размещённую однослойно, и свободных эмбрионов после вылупления содержали в плавучих сетчатых садках в аквариумах объёмом 20 л с аэрацией, расположенных в холодильной установке. Партии икры SS содержали в таких же аквариумах. Частичную (~1/4−1/3 объёма) смену дистиллированной воды проводили еженедельно.
Через 1 мес. после вылупления предличинок SB и SS одного возраста (число суток от вылупления) пересадили в аквариумы объёмом 10 и 20 л с плотностью 2.5−3.0 экз/л. К мальковому периоду объём воды на одну особь увеличили до 0.1−0.2 экз/л. Икру инкубировали в темноте, а молодь развивалась при естественном фотопериоде. Кормили живыми личинками хирономид, начиная с самых мелких и постепенно увеличивая их размер.
Из-за малого числа выживших гибридных личинок фиксировали и изучали только погибающих (прекративших питаться) и погибших особей. Изготовление ализариновых препаратов и оценку степени дифференцировки костей черепа, осевого скелета и скелета плавников молоди проводили по ранее описанным методикам (Пичугин, 2009б, 2015). Двух мальков SB после описания уровня морфологического развития растворили в щёлочи для выделения отдельных костей черепа. Остальные ализариновые пробы сохраняются в глицерине в коллекциях автора. Изучены рост и развитие скелета 28 экз. личинок и мальков. Для сравнительного анализа использовали ализариновые препараты 35 экз. одновозрастной молоди SS (Пичугин, 2019а).
РЕЗУЛЬТАТЫ
Особенности развития
Диаметр набухшей икры SB составил 4.1–5.3 (4.80) мм. Окраска яиц бледно-жёлтая (Пичугин, Маркевич, 2015). К 42-м сут после оплодотворения (п.о.) у эмбрионов появились эритроциты, пульсация сердечной трубки и глазные бокалы, а пигментацию глаз наблюдали после 53-х сут. У эмбрионов SS красная кровь и пигмент в глазах появились к 38−40-м сут. Массовая гибель эмбрионов SB и абортивный выклев начались на поздней стадии органогенеза − с 102-х сут п.о. Погибшие эмбрионы имели меньшие размеры по сравнению с одновозрастными развивающимися эмбрионами SS и были менее развиты. Часть особей имели изогнутый вверх или спирально закрученный хвостовой стебель. Особенно часто у погибающих эмбрионов выявлялись аномалии развития кровеносной системы, высокая изменчивость сосудов желточного мешка, кровяные сгустки из-за разрывов больших кровеносных сосудов и множественных повреждений мелких сосудов капиллярной сети. Значительное число эмбрионов погибли сразу после локального растворения оболочки и высвобождения головы физиологически не развитого эмбриона. Выживаемость эмбрионов SB в оболочке составила ~7% (против 95% SS).
Вылупление жизнеспособных эмбрионов SS абсолютной длиной (TL) 11.8−16.5 (14.7) мм было растянуто с 74 до 126 сут п.о. (Пичугин, 2019а). Вышедшие из оболочек на 115−126-е сут п.о. свободные эмбрионы SB TL 10−12 мм лежали на боку и прожили от нескольких суток до двух недель. Многие из них имели искривлённое тело, обводнённый желточный мешок, кровяные сгустки в голове, области сердца, хвостовом стебле или желточном мешке. Наблюдался значительный полиморфизм желточной кровеносной сети: 1 − полное её отсутствие; 2 − наличие капиллярной сети с очень слабой или отсутствующей циркуляцией эритроцитов при отсутствии крупной печёночно-желточной вены; 3 − активная циркуляция эритроцитов и разное расположение печёночно-желточной вены, впадающей в предсердие либо справа, либо слева.
Около 30 свободных эмбрионов SB TL 12.8−13.9 (13.46) мм, вылупившихся на 131–139-е сут п.о. (~3.5% общего числа оплодотворённых яиц) выжили. Предличинки имели очень мелкие меланофоры вдоль спины, на боках тела и наибольшую их концентрацию на дорсальной стороне головы, над головным мозгом и вдоль верхней челюсти; зёрна жёлтого пигмента концентрировались в передней и затылочной частях головы, на боках тела и заходили на прозрачную плавниковую кайму. Эластотрихии спинного и хвостового плавников также густо окрашены жёлтым пигментом (рис. 1а).
Рис. 1.
Окраска предличинок гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × × большеротый голец) Кроноцкого озера в возрасте: а − 10 сут, TL 13.9 мм; б − 50 сут, TL 16.4 мм.

Наблюдали быстрый соматический рост предличинок. К возрасту 50 сут после вылупления (п.в.) увеличилось число меланофоров на жаберных крышках, а на боках тела меланофоры увеличились в размерах и стали группироваться в мальковые пятна (рис. 1б). Особи перешли на этап смешанного питания в возрасте 62−72 сут п.в. при FL 18−21.5 мм: предпочитали самых мелких подвижных личинок хирономид при их отрыве от дна, мёртвых хирономид игнорировали. Воздух в плавательном пузыре появился у большей части личинок в возрасте 90−100 сут п.в. У особей SS переход на этап смешанного питания и появление воздуха в пузыре были растянуты: соответственно на 62–90-е и 90−155-е сут п.в. при FL 20.2–22.8 и 19.0−26.0 мм (Пичугин, 2019а).
Погибших особей SB из числа перешедших на этап смешанного питания в течение 2 мес. не было. Отставание в росте и прекращение питания части личинок SB началось в возрасте ~110 сут п.в. Особи, погибшие в возрасте 119 сут, имели FL ~ ~ 20 мм (таблица). У них сохранилось небольшое количество желтка. В черепе из исследуемых костей заложились dentale, anguloarticulare, maxillare, praemaxillare, operculum, parasphenoideum, шесть−семь пар жаберных лучей, имелись парный зачаток или единое рыхлое образование vomer, не несущее зачатков зубов, glossohyale с двумя−тремя парами зубов, слабый зачаток praeoperculum. Не заложились supraethmoideum, frontalia, жаберные тычинки и элементы жаберных дуг. У одной из особей в осевом скелете имелся единственный костный элемент − зачаток последнего хвостового (уростилярного) позвонка; в плавниках заложилась бóльшая часть лучей, в грудных сохранился непарный элемент22; не окостенели птеригиофоры спинного и анального плавников. У двух особей FL 21 и 22 мм, погибших в возрасте 131 сут, желток отсутствовал. Они имели в черепе, кроме вышеописанных зачатков костей, vomer в виде парной закладки без зачатков зубов, две и четыре жаберных тычинки и окостеневшее ceratobranchiale в нисходящей ветви жаберной дужки; полное число лучей во всех плавниках, кроме брюшных, 2-й членик в лучах спинного и анального плавников, окостеневшие птеригиофоры спинного (9 и 10) и анального (7 и 9) плавников. В осевом скелете особи FL 21 мм имелся только зачаток последнего уростилярного позвонка, а особь FL 22 мм имела зачатки тел 31 туловищного и последнего уростилярного позвонков.
Особи SB, погибшие в возрасте 160 (3), 170 (5), 179 (2), 200 (2), 215 (2), 225 (1), 240 (1) и 253 (2) сут п.в. (рис. 2), имели тёмную окраску с зёрнами меланина на нижней части головы, боках тела и в основании хвостового плавника, семь−девять овальных мальковых пятен (parr marks) (рис. 2а) и сходную степень развития скелета (таблица). У большей части личинок заложились frontalia. У одной из особей возраста 160 сут (FL 22.5 мм) сохранился желток, имелась головка supraethmoideum; у frontalia, закрывающих бóльшую часть крыши черепа, развиты боковые выступы защиты сейсмосенсорного канала, частично сомкнутые в трубку. У этой же особи обнаружена аномалия – недоразвитие одного из двух лепидотрихиев, составляющих один из лучей анального плавника. У двух других особей возраста 160 сут (FL 22 и 23 мм) в грудных плавниках сохранился непарный элемент, зачаток supraethmoideum отсутствовал, frontale представлено слаборазвитой пластинкой над орбитой глаза.
Рис. 2.
Окраска (а, б, г) и степень развития чешуйного покрова (в) молоди гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера: а − личинка FL 24 мм; б, в − ранний малёк FL 47 мм, г − малёк FL 97 мм.

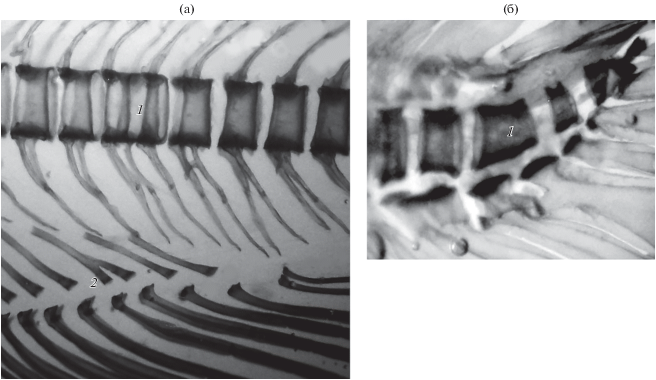
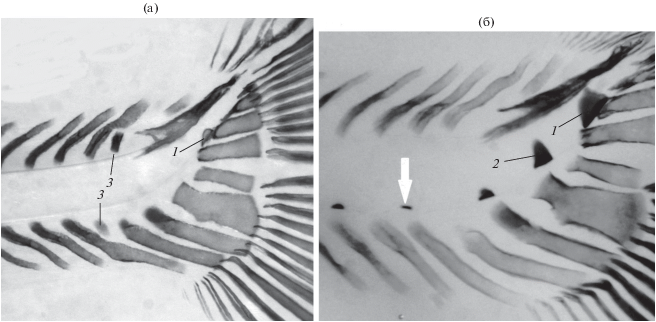
Из пяти особей, погибших в возрасте 170 сут, одна (FL 22 мм) не имела зачатков vomer, supraethmoideum, frontalia, жаберных тычинок и ceratobranchiale, окостеневших птеригиофоров спинного и анального плавников, но у неё заложились все лучи и 2-й членик в лучах спинного и анального плавников, а в осевом скелете зачатки 30 туловищных и последнего хвостового уростилярного позвонков. Эта особь имела, по-видимому, летальную аномалию − расширенной формы parasphenoideum без отверстий33. У второй особи этого возраста (FL 23.8 мм) в черепе имелись цельный зачаток vomer, головка supraethmoideum, frontalia, шесть жаберных тычинок и ceratobranchiale в жаберной дужке, более дифференцированное parasphenoideum, в осевом скелете – тела всех 32 туловищных и 18 хвостовых, в том числе последнего уростилярного, позвонков. Здесь также выявлена аномалия скелета − раздвоенные дорсально рёбра. Особь FL 21.5 мм (рис. 3) имела летальную аномалию осевого скелета (окрашивающиеся ализарином образования изогнутой червеобразной формы с двух сторон хорды вентрально от неё, над грудными плавниками), аномальную закладку уростилярного позвонка и только три нормальных зачатка тел туловищных позвонков, один из которых расположен под хордой примерно в середине вышеописанных аномальных червеобразных окостенений, а два других − вблизи вертикали первых и средних лучей спинного плавника. У этой же особи сохранился парный зачаток vomer и непарный элемент в грудных плавниках. Восходящие отростки предчелюстных костей на дорсовентральной проекции направлены вперёд, что демонстрирует загибание зубной пластинки этой кости в пасть, как у личинок SS (Пичугин, 2019а. Рис. 4).
Рис. 3.
Особенности развития скелета у личинки FL 21.5 мм гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера (ализариновый препарат, дорсовентральная проекция): 1 − аномальные окостенения клеток-предшественников тел позвонков, 2 − непарный элемент грудных плавников, 3 − верхние остистые отростки, 4 − лучи спинного плавника, 5 − зачатки рёбер, 6 − парная закладка vomer, 7 − орбитальный зачаток frontale.
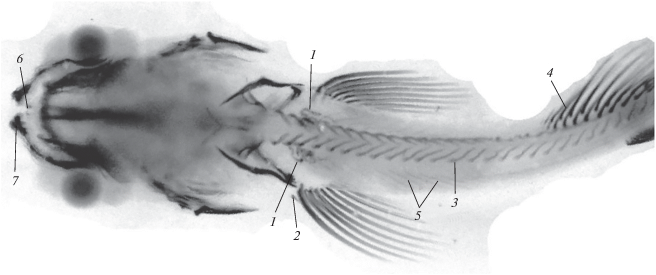
Рис. 4.
Жаберные дуги мальков гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × × большеротый голец) Кроноцкого озера: а − FL 74 мм, б − FL 97 мм.
У одной из личинок SB (FL 24.1 мм), погибших в возрасте 179 сут, полностью отсутствовал правый грудной плавник, а в осевом скелете имелись зачатки не одного, а двух тел хвостовых уростилярных позвонков. У второй особи этого возраста (FL 24.0 мм) лучи в анальном, брюшных, хвостовом плавниках и птеригиофоры анального и спинного плавников не окрашивались ализарином (т.е. в костную ткань не попали соли кальция), а в грудных плавниках сохранился непарный элемент.
У личинок, погибших в возрасте 225 и 253 сут (FL 24.0 и 22.0 мм), заложились все тела позвонков (по 65), имелось шесть и четыре жаберных тычинок и цельный vomer с тремя и двумя зубами, но отсутствовало supraethmoideum.
Следующие четыре особи, самые быстрорастущие, погибли на 2-м году жизни в возрасте 530 (FL 46.0 мм) и 540 (FL 38.5, 47.0 и 48.0) сут (рис. 2б). Они имели большую голову, пёструю спину в мелких округлых и неправильной формы чёрных пятнах, серо-жёлтые бока тела с 11−12 parr marks, молочно-белое брюшко, прозрачные грудные, брюшные и анальный плавники и мелкие зёрна меланина в основании спинного и хвостового плавников, хорошо развитые кости черепа, 13−16 жаберных тычинок и все три кости жаберной дуги (кроме рано окостеневшей ceratobranchiale, развиты epibranchiale и hypobranchiale (рис. 4, табл. 1)). У этих особей имелись 16−17 predorsalia, полный ряд (65−66) тел позвонков, замкнутых в кольцо, и по три−четыре плотно расположенных ряда чешуй выше и ниже боковой линии (рис. 1), т.е. эти особи вступили в мальковый период развития.
Оценки роста и транзитивных фенетических состояний элементов скелета у особей разного возраста гибрида малоротого и большеротого гольцов (SB) и малоротого (SS) гольца Salvelinus malma сomplex Кроноцкого озера (Восточная Камчатка) в экспериментальных условиях (6°С)
| Признак | Возраст, сут после вылупления (число особей, экз.) | |||||||
|---|---|---|---|---|---|---|---|---|
| 118−131 | 160−200 | 225−254 | 530−584 | |||||
| SB (4) | SS (9) | SB (15) | SS (8) | SB (3) | SS (1) | SB (4) | SS (3) | |
| FL, мм | $\frac{{20.0{\kern 1pt} - {\kern 1pt} 22.0}}{{20.8}}$ | $\frac{{17.8{\kern 1pt} - {\kern 1pt} 26.0}}{{21.6}}$ | $\frac{{21.5{\kern 1pt} - {\kern 1pt} 24.1}}{{22.8}}$ | $\frac{{17.6{\kern 1pt} - {\kern 1pt} 29.0}}{{22.8}}$ | $\frac{{22.0{\kern 1pt} - {\kern 1pt} 24.0}}{{23.3}}$ | 23.2 | $\frac{{38.5{\kern 1pt} - {\kern 1pt} 48.0}}{{44.9}}$ | $\frac{{37.0{\kern 1pt} - {\kern 1pt} 56.0}}{{45.7}}$ |
| P | $\frac{{8{\kern 1pt} - {\kern 1pt} 13}}{{10.8}}$ | $\frac{{6{\kern 1pt} - {\kern 1pt} 13}}{{10.4}}$ | $\frac{{8{\kern 1pt} - {\kern 1pt} 13}}{{12.1}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 14}}{{12.6}}$ | 13 | 13 | 13 | $\frac{{13{\kern 1pt} - {\kern 1pt} 14}}{{13.3}}$ |
| D | $\frac{{10{\kern 1pt} - {\kern 1pt} 14}}{{12.3}}$ | $\frac{{9{\kern 1pt} - {\kern 1pt} 16}}{{14.7}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 15}}{{{\mathbf{13}}.{\mathbf{8}}}}$ | $\frac{{12{\kern 1pt} - {\kern 1pt} 17}}{{{\mathbf{15}}.{\mathbf{1}}}}$ | $\frac{{14{\kern 1pt} - {\kern 1pt} 15}}{{14.3}}$ | 15 | $\frac{{14{\kern 1pt} - {\kern 1pt} 15}}{{{\mathbf{14}}.{\mathbf{5}}}}$ | $\frac{{16{\kern 1pt} - {\kern 1pt} 18}}{{{\mathbf{16}}.{\mathbf{7}}}}$ |
| A | $\frac{{8{\kern 1pt} - {\kern 1pt} 12}}{{10.5}}$ | $\frac{{9{\kern 1pt} - {\kern 1pt} 14}}{{11.3}}$ | $\frac{{11{\kern 1pt} - {\kern 1pt} 14}}{{12.6}}$ | $\frac{{7 - {\kern 1pt} 15}}{{12.3}}$ | $\frac{{9{\kern 1pt} - {\kern 1pt} 13}}{{11.7}}$ | 13 | $\frac{{13{\kern 1pt} - {\kern 1pt} 14}}{{13.5}}$ | 13 |
| V | $\frac{{5{\kern 1pt} - {\kern 1pt} 8}}{{7.0}}$ | $\frac{{6 - {\kern 1pt} 9}}{{8.0}}$ | $\frac{{6{\kern 1pt} - {\kern 1pt} 9}}{{8.1}}$ | $\frac{{6{\kern 1pt} - {\kern 1pt} 9}}{{8.4}}$ | 9 | 9 | 9 | 9 |
| Dn | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.5}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 4}}{{1.9}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{{\mathbf{1}}.{\mathbf{7}}}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 5}}{{{\mathbf{2}}.{\mathbf{7}}}}$ | 2 | 3 | $\frac{{7{\kern 1pt} - {\kern 1pt} 8}}{{7.8}}$ | $\frac{{5{\kern 1pt} - {\kern 1pt} 8}}{{7.0}}$ |
| Pn | 1 | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.1}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.2}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 4}}{{1.5}}$ | 1 | 1 | $\frac{{6{\kern 1pt} - {\kern 1pt} 7}}{{6.5}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 7}}{{5.7}}$ |
| An | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.5}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 4}}{{1.8}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{{\mathbf{1}}.{\mathbf{7}}}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 5}}{{{\mathbf{2}}.{\mathbf{7}}}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.7}}$ | 3 | $\frac{{6{\kern 1pt} - {\kern 1pt} 8}}{{7.3}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 9}}{{6.7}}$ |
| Vn | 1 | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.2}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{{\mathbf{1}}.{\mathbf{3}}}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 4}}{{{\mathbf{1}}.{\mathbf{8}}}}$ | 1 | 2 | $\frac{{6{\kern 1pt} - {\kern 1pt} 7}}{{6.8}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 9}}{{6.7}}$ |
| Cn | 4 | $\frac{{2{\kern 1pt} - {\kern 1pt} 5}}{{3.3}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 5}}{{4.2}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 6}}{{4.3}}$ | $\frac{{3{\kern 1pt} - {\kern 1pt} 5}}{{4.0}}$ | 4 | $\frac{{9{\kern 1pt} - {\kern 1pt} 12}}{{10.5}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 12}}{{10.0}}$ |
| sp.br. | $\frac{{0{\kern 1pt} - {\kern 1pt} 4}}{{1.5}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 5}}{{1.3}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 6}}{{3.4}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 9}}{{3.3}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 6}}{{{\mathbf{5}}.{\mathbf{0}}}}$ | 3 | $\frac{{13{\kern 1pt} - {\kern 1pt} 16}}{{14.3}}$ | $\frac{{15{\kern 1pt} - {\kern 1pt} 17}}{{15.7}}$ |
| os.br. | $\frac{{0{\kern 1pt} - {\kern 1pt} 1}}{{0.5}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 1}}{{0.8}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 1}}{{0.9}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{1.2}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.3}}$ | 1 | 3 | 3 |
| r.br. | $\frac{{6{\kern 1pt} - {\kern 1pt} 8}}{{7.0}}$ | $\frac{{5{\kern 1pt} - {\kern 1pt} 11}}{{8.3}}$ | $\frac{{8{\kern 1pt} - {\kern 1pt} 10}}{{9.3}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 12}}{{9.6}}$ | 10 | 9 | 11 | $\frac{{10{\kern 1pt} - {\kern 1pt} 11}}{{10.7}}$ |
| mx | $\frac{{7{\kern 1pt} - {\kern 1pt} 9}}{{8.0}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 12}}{{8.9}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 14}}{{{\mathbf{10}}.{\mathbf{5}}}}$ | $\frac{{6{\kern 1pt} - {\kern 1pt} 16}}{{{\mathbf{11}}.{\mathbf{8}}}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 13}}{{10.3}}$ | 6 | $\frac{{13{\kern 1pt} - {\kern 1pt} 15}}{{13.8}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 15}}{{13.0}}$ |
| pmx | $\frac{{3{\kern 1pt} - {\kern 1pt} 7}}{{4.8}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 10}}{{7.0}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 11}}{{6.7}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 12}}{{7.7}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 10}}{{8.3}}$ | 6 | $\frac{{6{\kern 1pt} - {\kern 1pt} 8}}{{7.0}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 13}}{{9.0}}$ |
| dent | 4 | $\frac{{3{\kern 1pt} - {\kern 1pt} 4}}{{3.6}}$ | 4 | $\frac{{3{\kern 1pt} - {\kern 1pt} 5}}{{{\mathbf{4}}.{\mathbf{3}}}}$ | 4 | 4 | 6 | 6 |
| thdent | $\frac{{8{\kern 1pt} - {\kern 1pt} 11}}{{10.0}}$ | $\frac{{8{\kern 1pt} - {\kern 1pt} 13}}{{10.7}}$ | $\frac{{6{\kern 1pt} - {\kern 1pt} 14}}{{10.3}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 17}}{{10.8}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 12}}{{11.0}}$ | 10 | $\frac{{9{\kern 1pt} - {\kern 1pt} 12}}{{11.0}}$ | $\frac{{11{\kern 1pt} - {\kern 1pt} 13}}{{11.7}}$ |
| ang | 2 | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{1.4}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 3}}{{2.5}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 4}}{{2.2}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 3}}{{2.3}}$ | 2 | 4 | 4 |
| pop | 1 | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.2}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.3}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.5}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.7}}$ | 2 | 3 | 3 |
| psph | $\frac{{2{\kern 1pt} - {\kern 1pt} 3}}{{2.3}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{2.2}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 4}}{{3.0}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 5}}{{3.0}}$ | $\frac{{3{\kern 1pt} - {\kern 1pt} 5}}{{3.7}}$ | 3 | 5 | 5 |
| v | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.3}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 2}}{{1.2}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 2}}{{1.9}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{1.4}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.7}}$ | 2 | 3 | 3 |
| thv | 0 | 0 | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{{\mathbf{1}}.{\mathbf{0}}}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 2}}{{{\mathbf{0}}.{\mathbf{3}}}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{2.0}}$ | 0 | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{1.8}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 5}}{{3.3}}$ |
| seth | 0 | $\frac{{0{\kern 1pt} - {\kern 1pt} 2}}{{0.4}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 1}}{{{\mathbf{0}}.{\mathbf{3}}}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 1}}{{{\mathbf{0}}.{\mathbf{1}}}}$ | 0 | 1 | 2 | 2 |
| fr | 0 | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{1.3}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{1.8}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{1.9}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 2}}{{1.7}}$ | 2 | 4 | 4 |
| gl | $\frac{{5{\kern 1pt} - {\kern 1pt} 6}}{{5.5}}$ | $\frac{{4{\kern 1pt} - {\kern 1pt} 8}}{{6.3}}$ | $\frac{{5{\kern 1pt} - {\kern 1pt} 13}}{{7.6}}$ | $\frac{{5{\kern 1pt} - {\kern 1pt} 13}}{{9.2}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 11}}{{{\mathbf{10}}.{\mathbf{7}}}}$ | 7 | $\frac{{7{\kern 1pt} - {\kern 1pt} 9}}{{8.5}}$ | $\frac{{7{\kern 1pt} - {\kern 1pt} 10}}{{8.7}}$ |
| vert.gd | $\frac{{0{\kern 1pt} - {\kern 1pt} 2}}{{1.0}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 3}}{{1.6}}$ | 2 | $\frac{{1{\kern 1pt} - {\kern 1pt} 3}}{{{\mathbf{2}}.{\mathbf{4}}}}$ | $\frac{{2{\kern 1pt} - {\kern 1pt} 3}}{{2.7}}$ | 2 | 4 | 4 |
| N vert. | $\frac{{0{\kern 1pt} - {\kern 1pt} 32}}{{8.5}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 65}}{{26.9}}$ | $\frac{{29{\kern 1pt} - {\kern 1pt} 62}}{{49.3}}$ | $\frac{{1{\kern 1pt} - {\kern 1pt} 66}}{{47.2}}$ | $\frac{{60{\kern 1pt} - {\kern 1pt} 65}}{{62.5}}$ | 63 | $\frac{{65{\kern 1pt} - {\kern 1pt} 66}}{{65.3}}$ | 65 |
| pred | 0 | 0 | 0 | 0 | 0 | 0 | $\frac{{16{\kern 1pt} - {\kern 1pt} 17}}{{16.3}}$ | $\frac{{15{\kern 1pt} - {\kern 1pt} 18}}{{16.7}}$ |
| Dpt | $\frac{{0{\kern 1pt} - {\kern 1pt} 10}}{{4.8}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 13}}{{6.6}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 11}}{{{\mathbf{9}}.{\mathbf{1}}}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 14}}{{{\mathbf{11}}.{\mathbf{0}}}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 12}}{{11.0}}$ | 11 | $\frac{{12{\kern 1pt} - {\kern 1pt} 13}}{{{\mathbf{12}}.{\mathbf{3}}}}$ | $\frac{{13{\kern 1pt} - {\kern 1pt} 14}}{{{\mathbf{13}}.{\mathbf{3}}}}$ |
| Apt | $\frac{{0{\kern 1pt} - {\kern 1pt} 8}}{{3.8}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 10}}{{4.7}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 10}}{{{\mathbf{5}}.{\mathbf{3}}}}$ | $\frac{{0{\kern 1pt} - {\kern 1pt} 11}}{{{\mathbf{8}}.{\mathbf{1}}}}$ | $\frac{{9{\kern 1pt} - {\kern 1pt} 10}}{{9.3}}$ | 10 | $\frac{{10{\kern 1pt} - {\kern 1pt} 11}}{{10.5}}$ | $\frac{{10{\kern 1pt} - {\kern 1pt} 12}}{{11.0}}$ |
Примечание. Над чертой – пределы варьирования показателя, под чертой – среднее значение. Обозначения признаков: FL − длина по Смитту; P, D, V, A – число заложившихся лучей соответственно в грудных, спинном, брюшных, анальном плавниках; Dn, Pn, Vn, An – максимальное число члеников в одном луче плавника; Cn − максимальное число члеников в луче верхней лопасти хвостового плавника; sp.br. – число окостеневших жаберных тычинок; os.br. – число окостеневших элементов на 1-й жаберной дуге; r.br. – число пар жаберных лучей; mx, pmx – maxillare и praemaxillare (n + 1 – пластинка с n приросших зубов); dent – dentale (3 – есть приросшие зубы, 4 – замкнулись отверстия вдоль нижнего края кости, 5 – есть стенки гиомандибулярного канала боковой линии, 6 – канал замкнут в трубку); thdent − число зубов на dentale; ang – anguloarticulare (1 – зачаток, 2 – есть нижний отросток, 3 – есть верхний отросток, 4 – есть канал сейсмосенсорной системы боковой линии, замкнутый в трубку); pop – praeoperculum (1 – зачаток без отверстий, 2 – есть отверстия сейсмосенсорного канала боковой линии, 3 – есть парные стенки защиты канала); psph – parasphenoideum (1 – игловидный зачаток, 2 – есть тонкие боковые отростки, 3 – булавовидная форма боковых отростков, 4 – замкнулись задние отверстия, 5 – замкнулись передние отверстия); v – vomer (0 – здесь и далее: отсутствие костной закладки данного элемента скелета, 1 – парный зачаток, 2 – единая пластинка, 3 – головка и рукоятка кости разделены); thv– число зубов на vomer; seth – supraethmoideum (1 – есть головка кости, 2 – есть задний отросток); fr – frontale (1 – зачаток орбитального отдела, 2 – есть жёлоб сейсмосенсорного канала боковой линии с отверстиями, 3 – есть боковые выступы защиты канала, 4 – канал заключён в трубку); gl – glossohyale (n + 1 – пластинка с n приросших зубов); vert.gd – степень дифференцировки осевого скелета (1 – есть 1-й зачаток тела позвонка, 2 – есть закладки тел позвонков в передней части туловища, 3 – закладка всех тел позвонков, 4 – замыкание всех закладок тел позвонков в кольца); N vert. – число тел позвонков; pred – predorsalia (общее число костей); Dpt, Apt – число окостеневших птеригиофоров спинного и анального плавников. Полужирным шрифтом выделены достоверные (tst: p < 0.05) значения попарного сравнения средних у одновозрастных личинок и мальков SB и SS.
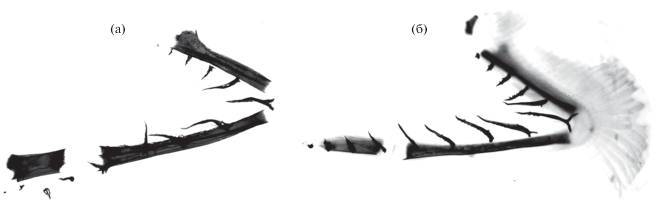
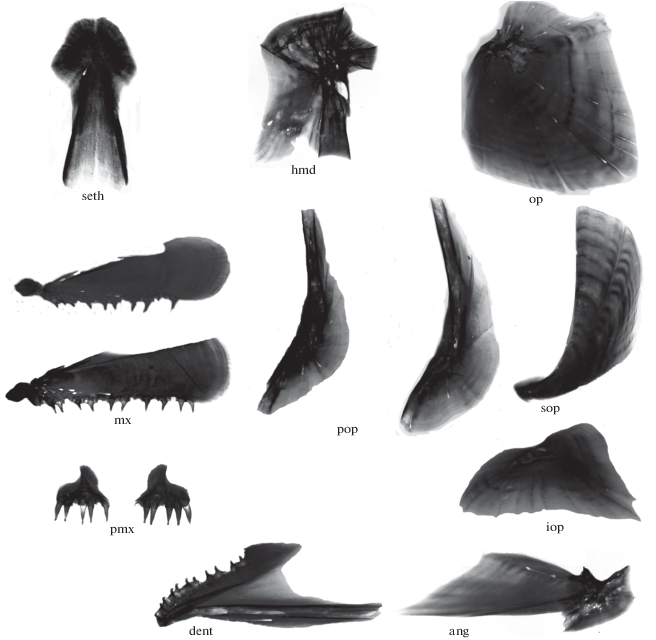
В возрасте 3 года и 2 мес. (1031 и 1034 сут) погибли два малька SB FL 74 и 88 мм. Интересную особенность представляют их сошники, имеющие восходящий костный гребень или отросток (рис. 5а, 5б), глубоко входящий снизу в этмоидный отдел хрящевого черепа. Необычна форма пластинки glossohyale, суженная в передней части и расширенная каудально, с расходящимися рядами крупных зубов (рис. 5в). Некоторые кости их черепа представлены на рис. 6.
Рис. 5.
Сошники (а, б) и glossohyale (в) мальков гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера: а, в − FL 88 мм; б − FL 74 мм; (→) − гребни на боковых проекциях vomer.
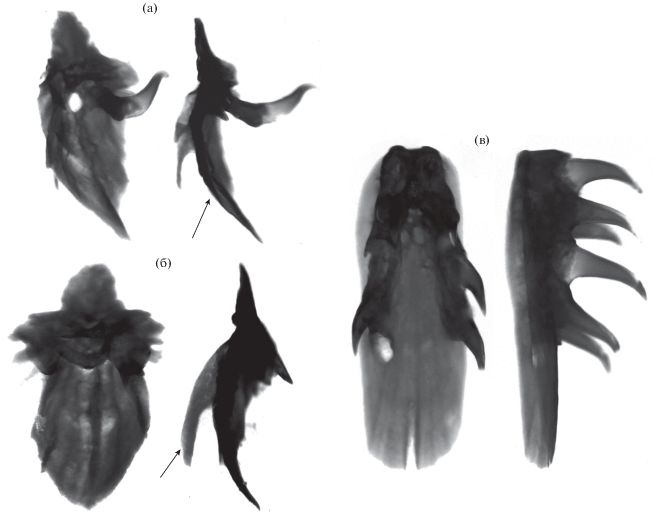
Рис. 6.
Форма костей черепа мальков FL 74 и 88 мм гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера (без соблюдения масштаба): seth – supraethmoideum, hmd – hyomandibulare, op – operculum, mx – maxillare, pop – preoperculum, sop – suboperculum, pmx – premaxillare, iop – interoperculum, dent – dentale, ang – anguloarticulare.
Последняя гибридная особь SB, самец II, прожила 4 года и 3 мес., достигнув FL 97 мм (рис. 2г). Её характеристики: P 14, D II 12, A II 11, V 9; птеригиофоров D и А 13 и 11; predorsalia 16; r.br. 10/10; sp.br. 15 (7 + 8) (рис. 4б); пилорических придатков (pc) 31; на vomer четыре зуба, расположенные в один поперечный ряд; на glossohyale два расходящихся каудально ряда крупных зубов (5 + 5), как у особи FL 88 мм (рис. 5в). Малёк был полностью покрыт чешуёй, имел жёлто-коричневую (охра) окраску тела и плавников, бледно-оранжевые пятна (<20) на боках тела, девять parr marks, сливающихся дорсально с окраской спины.
Аномалии скелета у мальков SB (7 особей старше 1 года) были обнаружены только у одной особи в возрасте 530 сут (FL 46.0 мм). Она имела по два сросшихся позвонка в туловищном и хвостовом отделах (рис. 7).
Сравнительный анализ развития молоди SB и SS
По средним значениям темпа соматического роста и остеогенеза личинки SB и SS отличались мало. На фоне высокой изменчивости этих показателей и разной степени морфологической сформированности при вылуплении эмбрионов SS (Пичугин, 2019а) гибриды отличались узкими пределами варьирования. Однако очевидно значительное отставание эмбрионов SB в росте и развитии в течение органогенеза, а личинок SB – в возрасте закладки и скорости дифференцировки отдельных костных элементов: frontale и supraethmoideum, сегментации лучей плавников, прирастании непарного элемента в грудном плавнике, а также тел позвонков (таблица). Значительны различия в скорости развития, морфологии и числе зубов vomer и glossohyale. У личинок SS до FL 32−35 мм не формировалась рукоятка vomer и долго не закладывались зубы, поэтому у мальков SS FL 41−56 мм имелась лишь короткая узкая рукоятка кости, а зубы отсутствовали или были представлены одним–тремя слабыми зачатками (Пичугин, 2019а). Форма костной пластинки glossohyale мальков SS соответствовала таковой взрослых особей SS (Маркевич и др., 2017а. Рис. 2з) с числом зубов у мальков SS FL 41−56 мм 7−10 (от 3 + 1 + 3 до 5 + 5) (Пичугин, 2019а). Выявлено достоверное (p < 0.05) уменьшение на один−три числа лучей в спинном плавнике и, соответственно, уменьшение на один элемент числа птеригиофоров спинного плавника (Dpt) (таблица).
Некоторые различия имелись в окраске личинок и мальков SB и SS: у личинок и мальков SS пятна parr были округлыми и отделялись от более тёмной окраски спины, а у личинок и мальков SB пятна были вытянутыми овальными и сливались с окраской спины.
Различия обнаружены в последовательности закладки тел хвостовых позвонков и в остеогенезе хвостового плавника. У SS первым, как и у SB, закладывается последний уростилярный позвонок (рис. 8). Затем начинается закладка тел туловищных позвонков от черепа каудально. Когда ряд закладок приближается к хвостовому отделу, у SS краниально от последнего уростилярного позвонка появляются зачатки тел 2-го и далее 3-го хвостового позвонка. Поэтому наименее развитым является 4-й со стороны хвостового плавника зачаток тела позвонка (рис. 8б). У молоди SB 2-й уростилярный позвонок, заложившийся краниально, отмечен только у одной особи. У остальных особей (n = 8) с неполным рядом зачатков осевого скелета (N vert. 48−62) 2-й уростилярный позвонок заложился бы как продолжение закладок позвонков каудально и был бы самым малоразвитым. Кроме этого у личинок SB обнаружено по одному “вставочному” недоразвитому элементу гипуралий и эпуралий (рис. 7а), по-видимому, предполагающему появление одного дополнительного, отсутствующего у SS, позвонка. Необходимо отметить, что аномалии в закладке отдельных лепидотрихиев или даже лучей спинного и анального плавников неоднократно встречались у личинок SS (Пичугин, 2019а), поэтому не являются особенностью только гибридов SB.
Рис. 8.
Хвостовой отдел личинок гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера (а) и малоротого гольца (б): 1, 2 − зачатки уростилярных позвонков, 3 − вставочные эпуралии и гипуралии, (⇩) − наименее развитый зачаток хвостового позвонка.
ОБСУЖДЕНИЕ
У высокополиморфных гольцов Salvelinus внутриозёрная симпатрическая дивергенция с образованием устойчивых морфотипов часто обусловлена освоением разных пищевых ресурсов (Hindar, Jonsson, 1982; Skulason et al., 1989; Sandlund et al., 1992; Пичугин, 2009б), а разные типы пищевых объектов индуцируют изменения в морфологии черепа (Parsons et al., 2010; Kapralova, 2014). В оз. Кроноцкое две группы морфологически уникальных форм − носатые гольцы (N1, N2 и N3) и обе глубоководные формы (SS и BB), являясь бентофагами, различаются по способу добывания пищи, но каждая их этих групп практически использует один и тот же пищевой ресурс: все формы носатых гольцов – в основном гаммарусов Gammarus lacustris (Gammaridae), а обе глубоководные − олигохет, личинок хирономид и моллюсков (Маркевич и др., 2017а, 2017б). Форма SS подбирает пищу с поверхности дна и реже из толщи воды, а форма BB использует нижнюю челюсть для выкапывания кормовых объектов из ила. На обнаруженном нерестилище SS дно составляют слабозаиленные каменные блоки (Пичугин, 2019а), на которых способ добычи пищи, используемых формой BB, не применим. Нерестовый субстрат формы BB не определён, однако известно, что 2/3 площади дна в профундали озера (глубже 30 м) покрыто илами толщиной до 12 м (Есин, Маркевич, 2017). Вероятно, BB откладывает икру на иловой субстрат44. В этом случае молодь BB может добывать корм, перекапывая ил, непосредственно при переходе к этапу смешанного питания, даже не имея воздуха в плавательном пузыре.
Скорее всего, именно способ добывания пищи привёл к столь значительным морфологическим различиям SS и BB. Наибольшие различия выявлены в длине нижней и верхней челюстей и диаметре глаза. По сравнению с предковой северной мальмой форма SS в ходе эволюции испытала замедление темпа роста и развития и педоморфоз, что привело к укорачиванию этмоидного отдела головы, нижней челюсти и увеличению диаметра глаза (Esin et al., 2018; Пичугин, 2019а). Развитие нижней челюсти BB, напротив, можно рассматривать как гиперморфоз, который сочетается с педоморфным недоразвитием этмоидного отдела головы и увеличенной длиной грудных и брюшных плавников. Результаты современных исследований раннего краниофациального морфогенеза у полиморфных видов костистых рыб, в том числе арктического гольца S. alpinus, связывают эволюционные изменения формы и степени дифференцировки элементов скелета со сдвигами относительных сроков экспрессии различных скелетных генов, вызванными генетическими изменениями регуляторных элементов (Ahi et al., 2014; Kapralova et al., 2015; Guðbrandsson et al., 2018). Причём регуляторы дифференциальной экспрессии включаются уже перед вылуплением, до закладки собственно челюстных и других костей скелета, и могут переключать уровни экспрессии во время перехода на этап смешанного питания (Kapralova, 2014). По мнению Капраловой (Kapralova, 2014), учитывая короткую эволюционную историю пресноводных озёрных форм S. alpinus в Исландии и других арктических районах, вполне вероятно, что молекулярная основа их морфологического разнообразия возникла в основном из-за различий в регуляции генов, а не из-за изменений белковых кодирующих последовательностей. Скрещивания двух морфологически контрастных симпатических форм S. alpinus из оз. Тингваллаватн (Исландия) продемонстрировали замедление эмбрионального развития гибридов и разнообразие закладывающихся краниофациальных фенотипов − от промежуточных и сходных с материнскими до трансгрессивных, выходящих за пределы изменчивости родительских форм. Существенных различий в форме головы между реципрокными скрещиваниями обнаружено не было, что позволило предположить преобладание генетических (регуляторных) эффектов над материнскими (Kapralova, 2014). К сожалению, подращивание гибридов останавливали в возрасте перехода на экзогенное питание, дальнейшее развитие морфологических модификаций, а также дифференциальная и общая смертность гибридов не оценивались.
У относительно молодых глубоководных форм Кроноцкого озера (SS и BB) различия в особенностях развития челюстных костей, как и всех элементов скелета, могут быть обусловлены преимущественно генетической регуляцией экспрессии скелетных генов, в которую вовлечены, по крайней мере, несколько генов-регуляторов. Очевидно, что возраст и последовательность закладки тел позвонков, тесно связанные с такими биологическими особенностями этих глубоководных форм, как ранний отрыв от дна, приобретение горизонтального положения тела за счёт ускоренного развития последних хвостовых позвонков (Пичугин, 2009б), необходимость подъёма личинок от дна к поверхности водоёма для заглатывания воздуха в плавательный пузырь (Макеева, 1992), также находятся под управлением системы генетических регуляторов. Так, сходное с SS встречное направление закладки тел позвонков было обнаружено при экспериментальном выращивании глубоководной карликовой формы S. alpinus из оз. Даватчан (Пичугин, 2009б).
Дивергенция SS и BB от общего глубоководного предка, сформировавшегося в условиях Кроноцкого озера, представляется маловероятной в условиях сходной кормовой базы, т.е. при отсутствии главного источника дизруптивного отбора и равновероятной частоте скрещивания. Отметим, что формы SS и BB длительное время сосуществуют в озере независимо, о чём свидетельствует их полная репродуктивная изоляция (Есин и др., 2018). Более вероятно происхождение этих форм от разных промежуточных предков, независимо пришедших к глубоководности. На основе сравнения раннего онтогенеза при сходных условиях эксперимента сделано предположение о происхождении SS не непосредственно от северной мальмы, а от более холодноводных форм (WW или N1), сформировавшихся в бассейне Кроноцкого озера и имеющих между собой наименьший уровень генетической дифференциации (Есин и др., 2018; Пичугин, 2019а, 2019б, 2020). Некоторые отличия SS от этих кроноцких форм − наименьшие размеры икры и вылупившихся предличинок, ускоренное развитие осевого скелета и позднее появление воздуха в плавательном пузыре, − по-видимому, стали следствием адаптации к глубоководным нересту и личиночному развитию и снижению уровня обмена веществ (Esin et al., 2018). Смещение нереста SS из реки в озёрное прибрежье и далее на глубину происходило постепенно, под влиянием высокой смертности икры и личинок, выедаемых многочисленной молодью озёрно-речных форм гольцов и нерки. К особенностям эмбрионального развития SS можно отнести высокую вариабельность скорости органогенеза и, как следствие, растянутые на два месяца сроки вылупления различных по степени морфологической сформированности особей. Предположительно это связано с продолжающейся экологической диверсификацией и формированием адаптивной нормы (по: Медников, 1987) к глубоководной озёрной нише придонного бентофага. Взрослые особи SS сохранили по крайней мере часть криптической речной окраски, parr marks в период размножения, красные плавники и в разной степени выраженные розовые пятна на боках тела (Маркевич и др., 2017а). Упомянутые выше глубоководные карлики S. alpinus из оз. Даватчан утрачивают появляющиеся у ранних личинок зачатки криптической окраски в течение личиночного развития, приобретают серебристую пелагическую уже к мальковому периоду (Пичугин, 2009б) и утрачивают брачную окраску (наши данные).
Уникальное направление преобразований морфогенеза нижнечелюстных костей по отношению к предковой северной мальме, подобное тому, что наблюдается у формы BB, отмечено среди других кроноцких форм только у LL (Esin et al., 2018). По моему предположению, BB сформировались от наиболее тугорослых LL (Пичугин, 2019а) либо от общего с LL промежуточного предка, который перешёл от речного к глубоководному озёрному нересту в нишу специализированого “копающего” бентофага, испытав общий педоморфоз, кроме функционально важной при новом способе добывания пищи нижней челюсти. Изучения раннего онтогенеза уникальной формы BB пока не проводилось и представляет большой интерес, особенно в свете современного интегрального подхода, объединяющего экологию, эволюцию и биологию развития (Skulason et al., 2019). В настоящее время между формами LL и BB, находящимися на противоположных полюсах экологической диверсификации, обнаружены максимальные различия генетической дифференциации (Есин и др., 2018). Однако скорость дивергенции в условиях генетического обособления от других симпатрических совокупностей может существенно различаться (Мина, 1986).
Наибольшая смертность молоди SB в ходе эксперимента произошла из-за абортивного вылупления недоразвитых эмбрионов. Как отмечалось ранее, икра SS отличается от типичной икры северной мальмы и WW Кроноцкого озера меньшими размерами и более прочной утолщённой оболочкой, из-за которой выход свободных эмбрионов SS в экспериментальных условиях был затруднён. Предполагалось, что такие преобразования обусловлены переходом от закрытых речных кладок икры к открытым озёрным и защите от выедания бокоплавами G. lacustris, а выход эмбрионов обеспечивается более интенсивной работой желёз вылупления (Пичугин, 2019а). Эмбрионы SS выходили из оболочки хвостом вперёд, что в норме происходит у всех изученных видов лососёвых рыб (Смирнов, 1975; Korwin-Kossakowski, 2012). Перед вылуплением значительно усиливаются подвижность эмбрионов, вращения внутри оболочки и постоянные движения грудных плавников, которые приводят к перемешиванию перивителлиновой жидкости и более равномерному распределению фермента вылупления – хорионазы, снижающей прочность всей оболочки яйца (Макеева, 1992). При низкой подвижности эмбриона железы вылупления, сгруппированные у лососей на голове и передневерхнем участке желточного мешка (Смирнов, 1975), растворяют оболочку локально, что, по-видимому, и имело место у эмбрионов SB, отстававших в развитии и двигательной активности от эмбрионов SS. Возможно, имела место и гетерохрония преждевременного включения желёз вылупления. Высокая концентрация фермента около головы вызвала преждевременное растворение оболочки, высвобождение головы и гибель физиологически недоразвитого эмбриона.
Первые физиологически созревшие эмбрионы SS начали выходить из оболочек примерно на 40 сут, или на 220 градусо-дней, раньше начала абортивного выклева эмбрионов SB, что демонстрирует очень медленное развитие подавляющего большинства гибридных эмбрионов. Наиболее развитые особи SB, вышедшие из оболочек самостоятельно на 131−139-е сут, не имели видимых аномалий кровеносной системы и формы тела, относительно быстро росли, перешли на этап смешанного питания, к активному плаванию и развивались без отхода в течение 119 сут до начала закладки осевого скелета − появления тела 1-го хвостового уростилярного позвонка, когда началась их массовая гибель (77% всех личинок SB).
Избирательные нарушения остеогенеза и тотальная гибель личинок при начале закладки тел позвонков после относительно нормального развития с невысокой смертностью (~15%) отмечены у другого искусственного гибрида между симпатрическими формами гольцов S. alpinus complex с глубоководным нерестом из оз. Собачье на плато Путорана − самка гольца Дрягина × самцы пучеглазки (Пичугин, 2009а). Икра и ранняя молодь этих форм развиваются на глубине соответственно 30 и > 100 м. Очевидно, значительные морфологические различия взрослых особей крупной высокотелой хищной формы гольца Дрягина и карликовой пучеглазки закладываются в раннем онтогенезе; развитие осевого скелета, тел позвонков и остистых отростков жёстко детерминировано значительно различающимися по глубине условиями нерестовых биотопов. Гибридизация привела к нарушению регуляции закладки тел позвонков, хаотической миграции остеогенных клеток-предшественников и их слипанию в окрашиваемые ализарином костные образования разной формы под хордой, над хордой и даже внутри хорды (Пичугин, 2009а. Рис. 1, 3). Важно отметить, что развитие икры этих гибридов проходило с низкой смертностью, гибель особей с оводнённым желточным мешком и нарушениями желточной кровеносной системы происходила после вылупления, а летальные аномалии затронули только элементы осевого скелета гибридов при нормальном развитии костей черепа и скелета плавников. Отмечены только гетерохронии в закладке и темпе развития сложных покровных костей черепа, praeoperculum и frontale, несущих канал сейсмосенсорной системы (Пичугин, 2009а).
Среди гибридов SB сходное летальное нарушение закладки большей части тел позвонков с образованием аномальных червеобразных изогнутых костей (рис. 3) и трёх нормальных зачатков тел туловищных позвонков обнаружено только у одной особи FL 21.5 мм в возрасте 170 сут. Здесь также очевидна миграция клеток-предшественников костной ткани тел позвонков и нарушение регулирующих механизмов. Однако особенности размножения, движения и трансформации клеток остеогенного ряда и их регуляция пока мало изучены, в значительной мере гипотетичны (Гилберт, 1994) и эти “… проблемы не подлежат в настоящее время прямому экспериментальному исследованию” (Сидорова, 2004. С. 1). Представляется, что изучение гибридов глубоководных форм гольцов может пролить свет на регуляцию, очерёдность закладки тел позвонков и протекание процесса формирования осевого скелета.
Таким образом, можно предположить, что, подобно другим молодым специализированным формам озёрных гольцов Salvelinus, SS и BB в ходе микроэволюционных преобразований раннего онтогенеза выработали различные комплексы регуляторов развития (Пичугин, 2019б), которые вступили в конфликт при гибридизации, что привело к замедлению эмбриогенеза с самых ранних его этапов (появления форменных элементов крови и развития глаз), многочисленным нарушениям морфогенеза и кровеносной системы, абортивному вылуплению, частным гетерохрониям, аномалиям развития скелета у личинок SB.
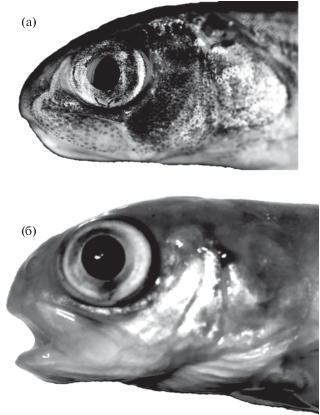
В морфологическом развитии личинок гибридов SB по сравнению с SS обнаружено уменьшение числа лучей в спинном плавнике. По данным Маркевича с соавторами (2017а), у SS ветвистых лучей D 9–11 (10), а у BB – D 8–10 (9). По-видимому, различия между SS и BB имеются и в числе коротких неветвистых лучей, т.е. тех лучей, которые закладываются в спинном плавнике последними краниально и не учитываются при морфометрии. Также у мальков SB наблюдалось уменьшение числа жаберных тычинок − 13−16 (14.3) против 15−17 (15.7) у мальков SS (таблица). У взрослых SS sp.br.15−22 (19) против 15−18 (16) у BB (Есин, Маркевич, 2017). Профиль головы мальков SB (рис. 9) также демонстрирует промежуточную между SS и BB длину рыла (этмоидного отдела черепа) (Пичугин, 2019б).
Рис. 9.
Профиль головы мальков гибрида симпатрических форм северной мальмы Salvelinus malma complex (малоротый × большеротый голец) Кроноцкого озера: а − FL 74 мм, б − FL 97 мм.
Форму сошника с верхним отростком или гребнем можно рассматривать как гибридное новообразование, не встречаемое у кроноцких форм гольцов (Салтыкова, 2016) и не описанное в литературе (Cavender, 1980). Судя по приведённым рисункам типичных glossohyale SS и BB (Маркевич и др., 2017а. Рис. 2з), у SB форма кости, суженная в передней части и расширенная каудально, также является гибридным новообразованием. Возможно, это следствие проявления трансгрессивных признаков, аналогичных упоминаемым Капраловой (Kapralova, 2014).
Массовая гибель в условиях эксперимента гибридной молоди SB продемонстрировала высокую степень постзиготической изоляции между SS и BB. В Кроноцком озере их гибридизация, как и в описываемом эксперименте, возможна за счёт рано созревающих самцов BB, которые перекрываются с последними текучими самками SS (Маркевич и др., 2017а). В озере особи с промежуточным морфотипом в уловах встречались единично и “внешне наиболее близки к всеядной форме-генералисту” (Есин, Маркевич, 2017. С. 87), т.е. к северной мальме, WW или SS. Можно допустить, что семь мальков SB (<1% числа оплодотворённой икры), погибшие в условиях эксперимента, но не имевшие выраженных аномалий скелета, могли бы выжить в естественных условиях.
Список литературы
Алексеев С.С., Пичугин М.Ю., Гордеева Н.В. и др. 2019. Репродуктивные стратегии и происхождение парапатрических и симпатрических форм арктического гольца Salvelinus alpinus (Salmonidae) в системе озер Большое и Малое Леприндо (северное Забайкалье) // Вопр. ихтиологии. Т. 59. № 4. С. 430−447 https://doi.org/10.1134/S0042875219040015
Гилберт С. 1994. Биология развития. Т. 2. М.: Мир, 235 с.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus азиатской части северной Пацифики: происхождение, эволюция, современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Есин Е.В., Бочарова Е.С., Маркевич Г.Н. 2018. Генетическая дифференциация гольцов озера Кроноцкого (Восточная Камчатка) по изменчивости микросателлитной ДНК // Матер. XIХ Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 287−291.
Макеева А.П. 1992. Эмбриология рыб. М.: Изд-во МГУ, 216 с.
Маркевич Г.Н., Анисимова Л.А., Салтыкова Е.А. и др. 2014. Разнообразие и особенности биологии эндемичных форм гольца Salvelinus malma из бассейна оз. Кроноцкого (Восточная Камчатка) // Тез. докл. XV Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 325–329.
Маркевич Г.Н., Есин Е.В., Салтыкова Е.А. и др. 2017а. Новые эндемичные формы глубоководных гольцов рода Salvelinus (Salmoniformes: Salmonidae) озера Кроноцкое (Камчатка) // Биология моря. Т. 43. № 3. С. 188−194. https://doi.org/10.1134/S1063074017030087
Маркевич Г.Н., Есин Е.В., Бусарова О.Ю. и др. 2017б. Разнообразие носатых гольцов Salvelinus malma (Salmonidae) Кроноцкого озера (Камчатка) // Вопр. ихтиологии. Т. 57. № 5. С. 521−533. https://doi.org/10.7868/S0042875217050125
Медников Б.М. 1987. Проблема видообразования и адаптивные нормы // Журн. общ. биологии. Т. 48. № 1. С. 15−26.
Мина М.В. 1986. Микроэволюция рыб. М.: Наука, 208 с.
Павлов Д.А., Осинов А.Г. 2008. Размножение и развитие карликовой формы арктического гольца Salvelinus alpinus из озера Даватчан (Забайкалье) // Вопр. ихтиологии. Т. 48. № 1. С. 102−119.
Павлов Д.А., Пичугин М.Ю., Савваитова К.А. 1990. Размножение и развитие даватчана Salvelinus alpinus erythrinus и проблема разнообразия особенностей воспроизводства у арктических гольцов // Там же. Т. 30. Вып. 6. С. 941−956.
Пичугин М.Ю. 2002а. Новый элемент в закладке лучей парных плавников лососевых рыб // Там же. Т. 42. № 4. С. 574−576.
Пичугин М.Ю. 2002б. Закладка и развитие элементов скелета в раннем онтогенезе у гольцов Salvelinus alpinus−S. malma complex: Автореф. дис. … канд. биол. наук. М.: МГУ, 24 с.
Пичугин М.Ю. 2009а. Развитие искусственного гибрида и выявление элементов репродуктивной изоляции между симпатрическими формами гольца Дрягина и пучеглазки Salvelinus alpinus complex (Salmonidae) из горного озера Собачье (Таймыр) // Вопр. ихтиологии. Т. 49. № 2. С. 240−253.
Пичугин М.Ю. 2009б. Развитие элементов скелета в эмбрионально-личиночный период у карликовой и мелкой симпатрических форм Salvelinus alpinus complex из оз. Даватчан (Забайкалье) // Там же. Т. 49. № 6. С. 763−780.
Пичугин М.Ю. 2015. Особенности роста и развития скелета ранней молоди северной мальмы Salvelinus malma malma из рек западной Камчатки в связи с температурным режимом нерестилищ // Там же. Т. 55. № 4. С. 435–452. https://doi.org/10.7868/S0042875215040128
Пичугин М.Ю. 2019а. Особенности раннего онтогенеза эндемичной озёрной формы Salvelinus malma сomplex (Salmonidae) ̶ малоротого гольца Кроноцкого озера (восточная Камчатка) // Там же. Т. 59. № 6. С. 681–692. https://doi.org/10.1134/S0042875219040155
Пичугин М.Ю. 2019б. Особенности морфогенеза черепа у гольцов симпатрических форм Salvelinus malma complex Кроноцкого озера // Матер. XIX Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 328−331.
Пичугин М.Ю. 2020. Особенности раннего онтогенеза носатого (N1) гольца − эндемичной озёрно-речной формы Salvelinus malma сomplex (Salmonidae) Кроноцкого озера (восточная Камчатка) // Вопр. ихтиологии. Т. 60. № 5. С. 562−571. https://doi.org/10.31857/S0042875220050082
Пичугин М.Ю., Алексеев С.С. 2019. Особенности раннего онтогенеза эндемичной карликовой глубоководной формы арктического гольца Salvelinus alpinus сomplex (Salmonidae) озера Большое Леприндо (Забайкалье) в экспериментальных условиях // Матер. Междунар. конф. “Современные проблемы биологии, экологии и почвоведения”. Иркутск. С. 68−71.
Пичугин М.Ю., Маркевич Г.Н. 2015. Исследование ранних стадий онтогенеза симпатрических форм гольцов Salvelinus Кроноцкого озера, выращенных в эксперименте // Матер. XVI Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 328−331.
Пичугин М.Ю., Маркевич Г.Н. 2018. Особенности раннего онтогенеза белого гольца Salvelinus malma complex (Salmonidae) Кроноцкого озера (восточная Камчатка) // Вопр. ихтиологии. Т. 58. № 5. С. 589–598. https://doi.org/10.1134/S0042875218050193
Салтыкова Е.А. 2016. Морфологическое разнообразие и дивергенция гольцов рода Salvelinus озера Кроноцкое (Восточная Камчатка): Автореф. дис. … канд. биол. наук. М.: МГУ, 25 с.
Салтыкова Е.А., Маркевич Г.Н., Есин Е.В. и др. 2015. К вопросу о структуре “пучков форм” у рыб: направления дивергенции спланхнокраниума в группе эндемичных гольцов-бентофагов (род Salvelinus, Salmonidae, Teleostei) озера Кроноцкое, Камчатка // Докл. РАН. Т. 464. № 1. С. 118–121. https://doi.org/10.7868/S0869565215250271
Сенчукова А.Л., Павлов С.Д., Мельникова М.Н., Мюге Н.С. 2012. Генетическая дифференциация гольцов (род Salvelinus) из озера Кроноцкое на основе анализа митохондриальной ДНК // Вопр. ихтиологии. Т. 52. № 4. С. 489−499.
Сидорова Е.И. 2004. Морфологическое и авторадиографическое исследование регенерирующей чешуи у Carassius auratus: Автореф. дис. … канд. биол. наук. М.: МГУ, 24 с.
Смирнов А.И. 1975. Биология, размножение и развитие тихоокеанских лососей. М.: Изд-во МГУ, 335 с.
Ahi E.P., Kapralova K.H., Palsson A. et al. 2014. Transcriptional dynamics of a conserved gene expression network associated with craniofacial divergence in Arctic charr // EvoDevo. V. 5. Article 40. https://doi.org/10.1186/2041-9139-5-40
Armstrong R.H., Morrow J.E. 1980. The Dolly Varden charr, Salvelinus malma // Charrs: salmonid fishes of the genus Salvelinus / Ed. Balon E.K. The Hague: Dr. W. Junk Publ. P. 99−140.
Cavender T.M. 1980. Systematics of Salvelinus from the North Pacific Basin // Ibid. P. 295−322.
Esin E.V., Markevich G.N., Pichugin M.Yu. 2018. Juvenile divergence in adaptive traits among seven sympatric fish eco-morfs arises before moving to different lacustrine habitats // J. Evol. Biol. V. 31. № 7. P. 1018−1034. https://doi.org/10.1111/jeb.13283
Guðbrandsson J., Franzdóttir S.R., Kristjánsson B.K. et al. 2018. Differential gene expression during early development in recently evolved and sympatric Arctic charr morphs // PeerJ. V. 6. Article e4345. https://doi.org/10.7717/peerj.4345
Hindar K., Jonsson B. 1982. Habitat and food segregation of dwarf and normal Arctic charr (Salvelinus alpinus) from Vangsvatnet Lake, Western Norway // Can. J. Fish. Aquat. Sci. V. 39. P. 1030–1045. https://doi.org/10.1139/F82-138
Kapralova K.H. 2014. Study of morphogenesis and miRNA expression associated with craniofacial diversity in Arctic charr (Salvelinus alpinus) morphs: Ph.D. Univ. Iceland, 189 p.
Kapralova K.H., Jonsson Z.O., Palsson A. et al. 2015. Bones in motion: ontogeny of craniofacial development in sympatric Arctic charr morphs // Devel. Dynamics. V. 244. P. 1168–1178. https://doi.org/10.1002/dvdy.24302
Korwin-Kossakowski M. 2012. Fish hatching strategies: a review // Rev. Fish Biol. Fish. V. 22. P. 225–240. https://doi.org/10.1007/s11160-011-9233-7
Ostberg C.O., Pavlov S.D., Hauser L. 2009. Evolutionary relationships among sympatric life history forms of Dolly Varden inhabiting the landlocked Kronotsky Lake, Kamchatka, and a neighboring anadromous population // Trans. Amer. Fish. Soc. V. 138. № 1. P. 1–14. https://doi.org/10.1577/T08-016.1
Parsons K.J., Skúlason S., Ferguson M. 2010. Morphological variation over ontogeny and environments in resource polymorphic Arctic charr (Salvelinus alpinus) // Evol. Devel. V. 12. P. 246–257.
Pichugin M.Yu., Markevich G.N. 2015. Some features of morphology diversification of Dolly Varden morphs from Lake Kronotskoe in early development // Proc. 8-th Charr Symp. Tromsø. P. 113.
Sandlund O.T., Gunnarson K., Jónasson P.M. et al. 1992. The Arctic charr Salvelinus alpinus in Thingvallavatn // Oikos. V. 64. P. 305–351.
Skulason S., Noakes D.L., Snorrason S.S. 1989. Ontogeny of trophic morphology in four sympatric morphs of Arctic charr Salvelinus alpinus in Thingvallavatn, Iceland // Biol. J. Linn. Soc. V. 38. P. 281−301. https://doi.org/10.1111/j.1095-8312.1989.tb01579.x
Skulason S., Parsons K.J., Svanback R. et al. 2019. A way forward with eco evo devo: an extended theory of resource polymorphism with postglacial fishes as model systems // Biol. Rev. Camb. Philos. Soc. V. 94. № 5. P. 1786−1808. https://doi.org/10.1111/brv.12534
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии