Вопросы ихтиологии, 2021, T. 61, № 6, стр. 669-679
Особенности оогенеза и ультраструктура сперматозоидов рыб родов Parascorpaena и Scorpaenopsis (Scorpaenidae)
Н. Г. Емельянова 1, Д. А. Павлов 1, *
1 Московский государственный университет
Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 04.09.2020
После доработки 29.09.2020
Принята к публикации 02.10.2020
Аннотация
Исследовали морфологию ооцитов и ультраструктуру сперматозоидов у представителей родов Parascorpaena и Scorpaenopsis. Ооциты P. aurita и S. cirrosa расположены на стебельках, отходящих от стромального стержня, локализующегося в центральной части яичника. Ооциты завершающих фаз вителлогенеза имеют диаметр соответственно ~450 и 500 мкм. Оогенез асинхронный и непрерывный. Сперматозоиды четырёх видов (P. aurita, P. mossambica, S. cirrosa, S. diabolus) построены по единому плану: ширина головки несколько превышает её длину. Роды Parascorpaena (три вида) и Scorpaenopsis (четыре вида) различаются по трём из четырёх индексов, характеризующих форму головки и средней части сперматозоида, по величине углубления в основании ядра (20–25 против 0–12% длины головки) и по взаимному расположению проксимальной и дистальной центриолей (соответственно коаксиальное и ортогональное). Изрезанную форму углубления в основании ядра сперматозоида P. aurita можно рассматривать как апоморфию.
Скорпеновидные рыбы (Scorpaenoidei) − одна из наименее изученных групп костистых рыб. Большинство видов являются ядовитыми. Представители подотряда – важные компоненты трофических цепей, а фармакологические свойства яда интенсивно исследуют (Smith, Wheeler, 2006; Santhanam, 2019). Эти рыбы являются объектами промышленного рыболовства (преимущественно виды рода Sebastes), локального потребления для пищевых целей и аквариумного бизнеса.
Таксономический состав подотряда неоднократно пересматривался (Ishida, 1994; Imamura, 2004; Smith, Wheeler, 2004; Smith et al., 2018). На основе проведённого недавно анализа большого числа морфологических и молекулярных признаков Synanceiidae и Scorpaenidae представляют собой монофилетические группы. Вторая группа (~370 видов), которую предложено интерпретировать как семейство (Smith et al., 2018), включает таксоны Caracanthidae, Scorpaenidae, Sebastidae и Setarchidae, обычно рассматриваемые в ранге семейств. Объединённое семейство Scorpaenidae включает рыб с контрастными морфологическими признаками и разными способами размножения: внешнее осеменение ооцитов (ovuliparity), внутреннее осеменение и выведение во внешнюю среду зигот (zygoparity), внутреннее осеменение и выведение во внешнюю среду яиц на начальных стадиях развития (embryoparity), и живорождение (viviparity) (по: Wourms et al., 1988; Wourms, 1991). При этом эволюция отдельных групп остаётся неясной. В частности, исследования строения яичников и морфологии отолитов показали, что вариабельность этих структур у разных видов сложно сопоставить с существующими филогенетическими схемами (Емельянова, Павлов, 2020; Павлов, 2021).
Для исследования адаптивной радиации видов и уточнения их таксономического положения может быть полезен анализ признаков, обычно не используемых в систематике. К таким признакам, характеризующим биологию размножения вида, относятся особенности развития половых клеток и ультраструктура гамет. До настоящего времени некоторые особенности размножения представителей подотряда Scorpaenoidei, включая строение мочеполовой системы и морфологию ооцитов, описаны у живородящих видов родов Sebastes и Sebastodes (Moser, 1967; Takahashi et al., 1991; Wourms, 1991; Shaw et al., 2012), у Helicolenus dactylopterus − вида с внутренним осеменением и вымётыванием яиц на ранних стадиях (Koya, Muñoz, 2007; Vila et al., 2007, 2010); у ряда видов с внешним осеменением: Scorpaena notata (Muñoz et al., 2002a, 2002b), Scorpaenopsis possi, Sebastapistes cyanostigma (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2018), Dendrochirus zebra (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2019), Paracentropogon longispinis, Trachicephalus uranoscopus, Synanceia horrida (Kwik, 2011), Inimicus sinensis (Емельянова, Павлов, 2020), Scorpaenopsis papuensis (Емельянова, Павлов, 2021). Ультраструктура сперматозоидов скорпеновидных рыб описана у живородящего вида Sebastiscus marmoratus (Mattei, 1991), упомянутого выше H. dactylopterus (Vila et al., 2007, 2010), а также у некоторых видов с внешним осеменением: Sc. notata (Muñoz et al., 2002a), Sc. porcus, Sc. scrofa (Sàbat et al., 2009), S. cyanostigma, Parascorpaena picta, D. zebra, S. horrida (Павлов, Емельянова, 2018), I. sinensis (Емельянова, Павлов, 2020) и S. papuensis (Емельянова, Павлов, 2021).
Объекты настоящего исследования – сравнительно редко встречающиеся виды родов Parascorpaena и Scorpaenopsis. Представители этих родов обитают в Индо-Пацифике, включают соответственно 8 и 28 валидных видов (Froese, Pauly, 2020) и согласно современной систематике входят в подсемейство Scorpaeninae семейства Scorpaenidae (Smith et al., 2018; Fricke et al., 2020). В нашей работе рассматриваются по два вида из каждого рода: P. aurita, P. mossambica, S. cirrosa и S. diabolus. Эти виды ассоциированы с рифами. Особи P. aurita и P. mossambica достигают полной длины (TL) соответственно 15.0 и 12.0 см, распространены на глубине до 18 м (Lieske, Myers, 1994; Allen, Erdmann, 2012). Обитают в мелководных прибрежных лагунах, а также на заиленных рифах и среди крупной коралловой крошки (Kuiter, Tonozuka, 2001; Froese, Pauly, 2020)11. Предельные размеры S. cirrosa и S. diabolus составляют соответственно SL 23.1 см (Randall, Eschmeyer, 2001) и TL 30.0 см (Lieske, Myers, 1994); первый вид встречается на глубине 3–91 м (Froese, Pauly, 2020), второй − 1–70 м (Masuda et al., 1984). Все четыре вида являются хищниками-засадчиками и ведут преимущественно одиночный образ жизни.
Цель работы – исследовать морфологию гонад, гистологию ооцитов и ультраструктуру сперматозоидов видов родов Parascorpaena и Scorpaenopsis.
МАТЕРИАЛ И МЕТОДИКА
Сбор материала выполнен на базе Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра (г. Нячанг, Вьетнам) в апреле 2017 г. Особей P. aurita, P. mossambica, S. cirrosa и S. diabolus дайверы отлавливали в прибрежной зоне зал. Нячанг Южно-Китайского моря и живыми доставляли в лабораторию. Рыб фотографировали в аквариуме, наркотизировали (MS-222) и идентифицировали по определителям (Carpenter, Niem, 1999; Randall, Eschmeyer, 2001). Биологический анализ проведён на свежих экземплярах. У некоторых самцов измеряли длину (K) и ширину (k) наполненного мочевого пузыря с помощью электронного штангенциркуля. Объём мочевого пузыря (V) рассчитывали по формуле для сплюснутого сфероида: V = π/6 × K2 × k.
Для анализа размерного состава ооцитов использовали фрагменты свежих гонад, помещённых в физиологический раствор. Изображения клеток получали с помощью микроскопа Nikon Eclipse E-200 и видеокамеры. Диаметр ооцитов измеряли с использованием программы ImageJ, ооциты диаметром <50 мкм не учитывали. Для световой микроскопии фрагменты яичников фиксировали в жидкости Буэна; дальнейшую гистологическую обработку проводили общепринятыми методами (Роскин, Левинсон, 1957).
Для электронной микроскопии зафиксированы фрагменты семенников самцов всех четырёх видов и фрагмент яичника самки P. aurita. Фиксатор – смесь 2.5%-ного раствора глутарового альдегида и 2%-ного параформальдегида на фосфатном буфере при pH 7.4 с добавлением хлористого натрия (2.5%). Постфиксацию осуществляли в 1%-ном растворе четырёхокиси осмия. Дальнейшую обработку для сканирующей электронной микроскопии (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ) проводили по общепринятым методам (Уикли, 1975). Объекты для СЭМ напыляли сплавом золота с палладием и исследовали в сканирующем электронном микроскопе CamScan S-4 (“Cambridge Instruments”, Великобритания) при ускоряющем напряжении 20 кВ. Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1011 (“Jeol”, Япония) при ускоряющем напряжении 80 кВ. Для получения изображений использовали цифровую камеру ES-500W (“Gatan”, СШA) и программу Digital Micrograph.
Измерения сперматозоидов проведены по их изображениям, полученным с помощью СЭМ, за исключением углубления в основании ядра (ТЭМ), с использованием программы ImageJ в соответствии со схемой, приведённой ранее (Павлов, Емельянова, 2018). За длину головки (HL) и длину средней части (MPL) принимали расстояния вдоль продольной оси сперматозоида параллельной жгутику. Ширину головки (HW) и ширину средней части (MPW) измеряли вдоль перпендикулярных осей. Для описания формы головки и средней части использовали четыре индекса: HL/HW, MPW/MPL, HL/MPL, HW/MPW. Для оценки отличия распределения значений индексов сперматозоидов представителей родов Parascorpaena и Scorpenopsis от нормального использовали критерий Д’Агостино–Пирсона. При сравнении параметров сперматозоидов в обоих родах в зависимости от характера распределения значений использовали параметрический (t-критерий Стьюдента) или непараметрический (критерий Манна−Уитни) тесты в программе GraphPad Prism 5.03.
РЕЗУЛЬТАТЫ
Биологические показатели. Рыбы обладают защитной окраской и имеют кожные выросты на теле, имитирующие обрастания (рис. 1). Эти выросты в виде колеблющейся при перемещении тела бахромы в наибольшей степени выражены у видов рода Scorpaenopsis; у S. cirrosa они распределены по всему телу (рис. 1в), а у S. diabolus находятся главным образом на голове и грудных плавниках (рис. 1г). Особи P. mossambica имеют два подвижных щупальцеобразных супраокулярных кожных придатка, очевидно используемых для тактильной рецепции (рис. 1б).
Рис. 1.
Виды родов Parascorpaena и Scorpaenopsis в аквариуме: а – P. aurita самец TL 131 мм, б – P. mossambica самец TL 123 мм, в – S. cirrosa самка TL 178 мм, г – S. diabolus самец TL 146 мм.

Особи обоих полов отловлены лишь у P. aurita и S. cirrosa, два других вида представлены только самцами. Длина и масса самцов P. aurita и S. cirrosa превышали таковые самок, что особенно отчётливо выражено у второго вида (табл. 1). Гонады самок и самцов четырёх видов находились на IV стадии зрелости. Левые и правые яичники и семенники полностью разделены, а яйцеводы, как и семяпроводы, сливаются непосредственно перед генитальным отверстием. У самцов семяпроводы лежат на поверхности гипертрофированного мочевого пузыря. Объём мочевого пузыря самцов имел следующие значения: P. mossambica TL 115 мм – 0.52 мл, S. cirrosa TL 189 и 224 мм – 0.54 и 3.97 мл, S. diabolus TL 163 мм – 2.46 мл.
Таблица 1.
Биологические показатели видов родов Parascorpaena и Scorpaenopsis
| Вид | Пол | n, экз. |
Длина, мм | Масса, г | ГСИ, % | |||
|---|---|---|---|---|---|---|---|---|
| TL | SL | W | w | g | ||||
| P. aurita | Самки | 4 | $\frac{{127{\kern 1pt} --{\kern 1pt} 139}}{{134\,(5)}}$ | $\frac{{107{\kern 1pt} --{\kern 1pt} 115}}{{111\,(3)}}$ | $\frac{{42{\kern 1pt} --{\kern 1pt} 63}}{{53\,(9)}}$ | $\frac{{36{\kern 1pt} --{\kern 1pt} 55}}{{48\,(8)}}$ | $\frac{{0.77{\kern 1pt} --{\kern 1pt} 1.53}}{{1.00\,(0.36)}}$ | $\frac{{1.47{\kern 1pt} --{\kern 1pt} 2.81}}{{2.12\,(0.65)}}$ |
| Самцы | 8 | $\frac{{131{\kern 1pt} --{\kern 1pt} 155}}{{144\,(7)}}$ | $\frac{{110{\kern 1pt} --{\kern 1pt} 126}}{{119\,(5)}}$ | $\frac{{53{\kern 1pt} --{\kern 1pt} 89}}{{70\,(11)}}$ | $\frac{{50{\kern 1pt} --{\kern 1pt} 83}}{{65\,(10)}}$ | $\frac{{0.02{\kern 1pt} --{\kern 1pt} 0.10}}{{0.06\left( {0.03} \right)}}$ | $\frac{{0.03{\kern 1pt} --{\kern 1pt} 0.15}}{{0.09{\text{ }}(0.04)}}$ | |
| P. mossambica | Самцы | 2 | $\frac{{115{\kern 1pt} --{\kern 1pt} 123}}{{119\,(6)}}$ | $\frac{{90{\kern 1pt} --{\kern 1pt} 101}}{{96\,(8)}}$ | $\frac{{36{\kern 1pt} --{\kern 1pt} 42~}}{{39\,(4)}}$ | $\frac{{33{\kern 1pt} --{\kern 1pt} 38}}{{36\,(3)}}$ | $\frac{{0.02{\kern 1pt} --{\kern 1pt} 0.04}}{{0.03\,(0.01)}}$ | $\frac{{0.06{\kern 1pt} --{\kern 1pt} 0.11}}{{0.08\,(0.03)}}$ |
| S. cirrosa | Самки | 2 | $\frac{{112{\kern 1pt} --{\kern 1pt} 178}}{{145\left( {47} \right)}}$ | $\frac{{91{\kern 1pt} --{\kern 1pt} 150}}{{121\left( {42} \right)}}$ | $\frac{{29{\kern 1pt} --{\kern 1pt} 103}}{{66\left( {53} \right)}}$ | $\frac{{26{\kern 1pt} --{\kern 1pt} 95}}{{61\left( {49} \right)}}$ | $\frac{{0.41{\kern 1pt} --{\kern 1pt} 1.11}}{{0.76\left( {0.49} \right)}}$ | $\frac{{1.17{\kern 1pt} --{\kern 1pt} 1.55}}{{1.36\left( {0.27} \right)}}$ |
| Самцы | 2 | $\frac{{189{\kern 1pt} --{\kern 1pt} 224}}{{207\left( {25} \right)}}$ | $\frac{{154{\kern 1pt} --{\kern 1pt} 185}}{{170\left( {22} \right)}}$ | $\frac{{110{\kern 1pt} --{\kern 1pt} 227}}{{169\left( {82} \right)}}$ | $\frac{{106{\kern 1pt} --{\kern 1pt} 219}}{{163\left( {80} \right)}}$ | $\frac{{0.07{\kern 1pt} --{\kern 1pt} 0.15}}{{0.11\left( {0.06} \right)}}$ | 0.07 | |
| S. diabolus | Самцы | 2 | $\frac{{146{\kern 1pt} --{\kern 1pt} 163}}{{155\,(12)}}$ | $\frac{{121{\kern 1pt} --{\kern 1pt} 134}}{{128\,(9)}}$ | $\frac{{55{\kern 1pt} --{\kern 1pt} 65}}{{~60\,(7)}}$ | $\frac{{52{\kern 1pt} --{\kern 1pt} 61}}{{56\,(7)}}$ | 0.02 | $\frac{{0.03{\kern 1pt} --{\kern 1pt} 0.04}}{{0.04{\text{ }}(0.01)}}$ |
Примечание. n − число рыб, TL − полная длина, SL − стандартная длина, W − масса тела, w − масса тела без внутренностей, g − масса гонад, ГСИ − гонадосоматический индекс (ГСИ = g/w × 100); над чертой – пределы варьирования показателя, под чертой – среднее значение, в скобках − среднее квадратическое отклонение.
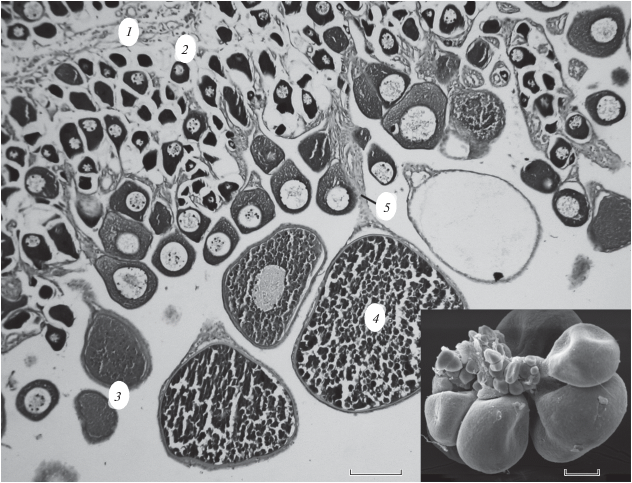
Морфология ооцитов. Размерный состав ооцитов самок P. aurita и S. cirrosa свидетельствует о численном преобладании клеток наименьшего диаметра и наличии ооцитов промежуточного размера между превителлогенными и завершающими вителлогенез (рис. 2). Наиболее крупные ооциты достигали диаметра ~ 450 (P. aurita) или 500 (S. cirrosa) мкм и находились на завершающих фазах вителлогенеза. В яичнике яйценосные пластинки отсутствуют. Ооциты находятся на стебельках, отходящих от стромального стержня, расположенного в центральной части яичника (рис. 3). Наиболее длинные стебельки имеют удалённые от стромального стержня ооциты конца периода вителлогенеза.
Рис. 2.
Распределение ооцитов по диаметру в гонадах IV стадии зрелости: а – Parascorpaena aurita TL 136 мм, гонадосоматический индекс (ГСИ) 1.47%, число ооцитов (n) = 174; б – Scorpaenopsis cirrosa TL 178 мм, ГСИ 1.17%, n = 135.
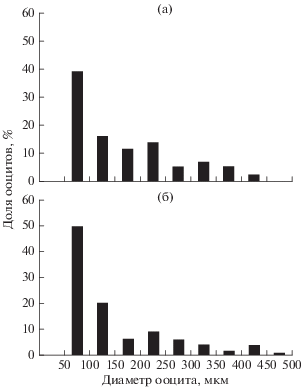
Рис. 3.
Фрагменты яичника самки Scorpaenopsis cirrosa (TL 178 мм, стадия зрелости IV, ГСИ 1.17%) и стромального стержня с ооцитами Parascorpaena aurita (на врезке, сканирующая электронная микроскопия): 1 – строма, 2 – превителлогенный ооцит, 3 – вителлогенные ооциты в процессе накопления желточных включений, 4 – заполненный желтком ооцит, 5 – стебелёк. Масштаб: 100 мкм.
Ультраструктура сперматозоидов. Абсолютные размеры сперматозоидов и четыре индекса, характеризующие их форму, приведены в табл. 2.
Таблица 2.
Морфологические параметры сперматозоидов у видов родов Parascorpaena и Scorpaenopsis
| Параметр | Вид | |||||||
|---|---|---|---|---|---|---|---|---|
| P. aurita (n = 7) |
P. mossambica (n = 12) |
S. cirrosa (n = 13) |
S. diabolus (n = 8) |
|||||
| M | σ | M | σ | M | σ | M | σ | |
| Размер, мкм: | ||||||||
| − HL | 1.73 | 0.14 | 1.86 | 0.13 | 1.73 | 0.08 | 1.67 | 0.06 |
| − HW | 2.01 | 0.11 | 2.05 | 0.04 | 1.90 | 0.07 | 1.84 | 0.07 |
| − MPL | 0.79 | 0.12 | 0.94 | 0.19 | 0.61 | 0.06 | 0.58 | 0.12 |
| − MPW | 1.43 | 0.13 | 1.85 | 0.16 | 1.42 | 0.14 | 1.30 | 0.08 |
| − FlL | 34.00 | 5.00 | 33.0 | 3.00 | 36.00 | 4.00 | ||
| Индекс: | ||||||||
| − HL/HW | 0.83 | 0.025 | 0.91 | 0.063 | 0.91 | 0.04 | 0.91 | 0.04 |
| − MPW/MPL | 1.83 | 0.24 | 2.08 | 0.62 | 2.66 | 0.51 | 2.32 | 0.49 |
| − HL/MPL | 2.22 | 0.30 | 2.04 | 0.34 | 2.87 | 0.34 | 2.79 | 0.43 |
| − HW/MPW | 1.47 | 0.07 | 1.12 | 0.097 | 1.36 | 0.16 | 1.43 | 0.12 |
Примечание. Здесь и в табл. 3: n – число измеренных сперматозоидов, M – среднее значение, σ – среднее квадратическое отклонение, HL – длина головки, HW – ширина головки, MPL – длина средней части, MPW – ширина средней части, FlL – длина жгутика.
P. aurita. Сперматозоид имеет головку округлой формы, хорошо развитую полукруглую среднюю часть и жгутик. Ширина головки, как и у трёх других видов, несколько превышает её длину (табл. 2). Хроматиновый материал головки плотно упакован, но иногда встречаются небольшие полости со светлым матриксом. Углубление в основании ядра, в цитоплазме которого находится проксимальная центриоль и, реже, часть дистальной, составляет ~ 20% HL. Оно имеет неровную, несколько изрезанную форму и расположено в цитоплазме в центре основания ядра или несколько эксцентрично (рис. 4а). Центриоли локализованы коаксиально (рис. 4б) или, значительно реже, могут находиться под углом друг к другу. Цитоплазматический канал, в котором лежит начальная часть жгутика, отходящего от дистальной центриоли (базального тельца), имеет расширение каплевидной формы. На плазмалемме этого расширения находятся электроноплотные частицы (рис. 4а, 4б). Эти частицы отсутствуют на плазмалемме остальной более узкой части канала. На продольных срезах средней части 7–12 (в среднем 9) (n = 13) сечений митохондрий. Митохондрии имеют округлую или овальную форму и матрикс средней плотности (рис. 4в). Аксонема жгутика построена по классической схеме и состоит из девяти дуплетов периферических микротрубочек и двух центральных: (9 × 2) + 2. Все микротрубочки электронопрозрачны. Аксонема окружена цитоплазматическим чехлом, имеющим неодинаковую ширину в разных участках жгутика (рис. 4г). Аналогичное строение имеют жгутики трёх остальных видов.
Рис. 4.
Ультраструктура сперматозоидов рыб родов Parascorpaena и Scorpaenopsis: а–г – P. aurita, д−е – P. mossambica, ж−з – S. cirrosa, и–л – S. diabolus; в, л – поперечные срезы средней части, г – поперечные срезы жгутиков, е – продольный срез сперматозоида, ранняя сперматида и фрагмент поперечного среза средней части, ж – поздняя сперматида, з – центриоли; 1 – проксимальная центриоль, 2 – дистальная центриоль, 3 – расширение цитоплазматического канала, 4 – митохондрия. Масштаб: 1 мкм.
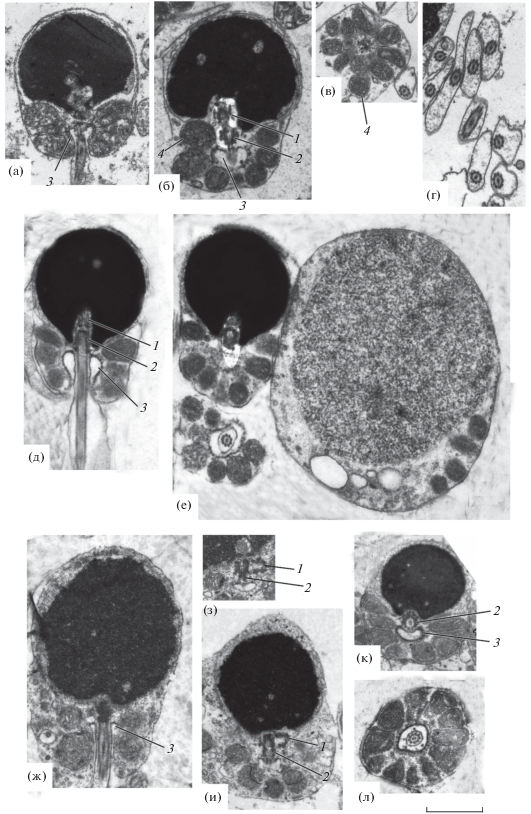
P. mossambica. Отличия от предыдущего вида состоят в следующем. Углубление в основании ядра имеет ровную овальную форму, глубина его составляет ~25% HL (рис. 4д). В цитоплазме углубления коаксиально расположены проксимальная центриоль, а также бо́льшая часть дистальной. Так же, как и у P. aurita, цитоплазматический канал в месте отхождения жгутика имеет расширение каплевидной формы с электроноплотными частицами на плазмалемме (рис. 4д, 4е). В цитоплазме средней части 7–16 (11) (n = 17) сечений митохондрий. В просветах семенных канальцев наряду со сперматозоидами присутствуют сперматиды (рис. 4е). Сперматиды обнаружены и у других трёх видов.
S. cirrosa. В плотно упакованном хроматине головки сперматозоида иногда встречаются небольшие полости со светлым матриксом. Углубление в основании ядра выражено очень слабо (~9% HL), и таким образом центриолярный комплекс лежит в цитоплазме средней части (рис. 4ж). Проксимальная и дистальная центриоли расположены ортогонально по отношению друг к другу: проксимальная центриоль торцом обращена к боковой части дистальной (рис. 4з) Цитоплазматический канал, в котором расположена начальная часть жгутика, имеет каплевидную форму, но значительно ýже, чем у описанных выше видов рода Parascorpaena (рис. 4ж). Электроноплотные частицы на плазмалемме отсутствуют. В цитоплазме средней части 5–11 (7) (n = 11) сечений митохондрий.
S. diabolus. Углубление в основании ядра выражено слабо (~12% HL). Центриоли в центриолярном комплексе расположены ортогонально (рис. 4и, 4к). Цитоплазматический канал в месте отхождения жгутика, как и у представителей рода Parascorpaena, имеет приблизительно такой же величины расширение с электроноплотными частицами на плазмалемме (рис. 4к, 4л). В цитоплазме средней части 5–13 (9) (n = 13) сечений митохондрий.
ОБСУЖДЕНИЕ
Максимальная длина самцов P. aurita и P. mossambica в наших сборах несколько превышает известные предельные размеры (Froese, Pauly, 2020): TL 15.5 против 15.0 см и 12.3 против 12.0 см. У самцов исследованных видов обнаружен гипертрофированный мочевой пузырь. Увеличенный объём мочевого пузыря, обычно содержащего сперматозоиды, отмечен у самцов ряда видов скорпеновидных рыб с внешним осеменением. Предполагается, что содержимое мочевого пузыря может использоваться в процессе осеменения (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2019; Емельянова, Павлов, 2020, 2021).
Яичники самок P. aurita и S. cirrosa имеют структуру типа II-3 (Takano, 1989 − цит. по: Koya, Muñoz, 2007): яйценосная строма находится в центре гонады, а ооциты развиваются на стебельках. В яичниках такого типа после овуляции ооциты заключаются в желеобразную массу и вымётываются в виде полых (обычно пелагических) мешковидных структур с яйцами, расположенными на периферии. Такое необычное для костистых рыб строение яичников описано у ряда видов Scorpaenidae, Sebastidae и Synanceiidae (в традиционной интерпретации этих семейств) (Koya, Muñoz, 2007; Емельянова, Павлов, 2020, 2021). На основании распределения ооцитов в яичниках половозрелых самок P. aurita и S. cirrosa (преобладание клеток меньшего диаметра и присутствие ооцитов всех промежуточных размерных классов между превителлогенными и максимальными вителлогенными) можно полагать, что для этих видов характерен непрерывный тип оогенеза и многопорционное икрометание (Götting, 1961; Овен, 2004). Тем не менее у исследованных нами самок отсутствуют как ооциты с начавшим мигрировать ядром, так и в начале процесса оводнения, что не позволяет сделать вывод о числе ооцитов в порции и диаметре овулировавших клеток. Скорее всего, эти показатели у P. aurita и S. cirrosa близки к описанным у S. possi: ≥ 1000 ооцитов диаметром 0.7–0.8 мм (Pavlov, Emel’yanova, 2010).
У четырёх анализируемых видов в просветах семенных канальцев вместе со сперматозоидами присутствовали сперматиды, что свидетельствует о полуцистном сперматогенезе, при котором разрывы стенок цист происходят до завершения спермиогенеза. Такой тип обнаружен в семействе Scorpaenidae у Sc. notata (Muñoz et al., 2002a; Sàbat et al., 2009), а также в семействах Characidae у Hemigrammus marginatus (Magalhaes et al., 2011), Opheliidae (Mattei, 1993), Malapteruridae у Malapterurus electricus (Shahin, 2006), Soleidae у Solea senegalensis (Garcıa-Lopez et al., 2005), Callichthyidae у Corydoras flaveolus, C. aeneus, Scleromystax lacerdai и Aspidoras poecilus (Spadella et al., 2007) и Bleniidae (Lahnsteiner, Patzner, 1990). В результате дозревания сперматид, вышедших из цист и уже присутствующих в семенных канальцах, может удлиняться период участия самцов в размножении.
Сперматозоиды скорпеновидных рыб с внешним осеменением, как правило, имеют округлую головку в отличие от сперматозоидов рыб с внутренним осеменением, характеризующихся удлинённой головкой (Павлов, Емельянова, 2018). У исследованных ранее видов семейств Scorpaenidae (шесть видов) и Synanceiidae (два вида) ширина головки сперматозоида превосходит её длину, а ширина средней части больше её длины (только у Sc. notata индекс MPW/MPL < 1) (Павлов, Емельянова, 2018; Емельянова, Павлов, 2020). Такая же форма сперматозоидов отмечена и у четырёх анализируемых видов. При сравнении индексов, характеризующих форму сперматозоидов рыб родов Parascorpaena (три вида) и Scorpaenopsis (четыре вида), наблюдаются статистически значимые различия между родами по трём индексам из четырёх (табл. 3).
Таблица 3.
Сравнение индексов (М ± σ), характеризующих форму сперматозоидов рыб родов Parascorpaena (P. picta, P. aurita, P. mossambica) и Scorpaenopsis (S. possi, S. papuensis, S. cirrosa, S. diabolus)
| Род (n) | HL/HW | MPW/MPL | HL/MPL | HW/MPW |
|---|---|---|---|---|
| Parascorpaena (49) | 0.86 ± 0.08a | 1.71 ± 0.44c | 1.92 ± 0.4a | 1.33 ± 0.18c |
| Scorpaenopsis (41) | 0.91 ± 0.06b | 2.22 ± 0.55d | 2.56 ± 0.59b | 1.35 ± 0.19c |
Среди четырёх исследованных нами видов максимальное число сечений митохондрий (в среднем 11) отмечено у P. mossambica. Число сечений у трёх остальных видов составляет в среднем 7–9, причём оно выше, чем у S. papuensis (2–5) (Емельянова, Павлов, 2021), а также у видов родов Scorpaena (4–6), Sebastapistes (4), Synanceia (5) (Павлов, Емельянова, 2018) и Inimicus (4–7) (Емельянова, Павлов, 2020). У представителей перечисленных выше родов митохондрии лежат в два–три ряда, но лишь у D. zebra (подсемейство Pteroinae) они лежат в одной плоскости, а число сечений в среднем составляет два (Павлов, Емельянова, 2018). Размер средней части и площадь сечения митохондрий обычно коррелируют с продолжительностью поступательных движений сперматозоидов после активации (Baccetti, Afzelius, 1976; Емельянова, Макеева, 1998). У видов семейства Scorpaenidae с внешним осеменением она составляет ~ 15 мин (Pavlov, Emel’yanova, 2010).
У двух анализируемых видов рода Parascorpaena, а также у P. picta (Павлов, Емельянова, 2018) углубление в основании ядра сперматозоида составляет 20–25% HL, в то время как у S. cirrosa и S. diabolus оно незначительно (9–12%), а у S. papuensis отсутствует; в сперматозоидах последнего вида весь центриолярный комплекс расположен в цитоплазме средней части под основанием головки (Емельянова, Павлов, 2021). Из исследованных видов скорпеновидных рыб наибольшее углубление в основании ядра (~47% HL) отмечено у Sc. porcus и Sc. scrofa (Sàbat et al., 2009). P. aurita отличается от P. mossambica и от других исследованных видов скорпеновидных рыб формой углубления в основании ядра: оно неровное с инвагинациями. Вариабельность в форме углубления описана в семействе Hypopomidae (Gymnotiformes): у Brachyhypopomus gauderio углубление с разветвлениями, в то время как у двух других видов того же рода оно имеет ровные края (Giora, Burns, 2011).
В центриолярном комплексе центриоли расположены коаксиально у P. aurita и P. mossambica и ортогонально у S. cirrosa и S. diabolus. Почти коаксиальное (под тупым углом) расположение центриолей отмечено у P. picta (Павлов, Емельянова, 2018) и ортогональное у S. papuensis (Емельянова, Павлов, 2021). Несмотря на то что представители родов Parascorpaena и Scorpaenopsis чётко различаются по взаимной локализации центриолей, аналогичная вариабельность наблюдается и в других родах скорпеновидных рыб: коаксиальное расположение у S. cyanostigma, ортогональное у D. zebra и I. sinensis и ортогональное или под острым углом друг к другу у S. horrida (Павлов, Емельянова, 2018, Емельянова, Павлов, 2020). Изменчивость во взаимной локализации центриолей у последнего вида может быть связана с тем, что в процессе формирования сперматозоида расположение центриолей становится более ортогональным, что отмечено у H. dactylopterus (Vila et al., 2010).
У исследованных до настоящего времени представителей рода Parascorpaena (P. aurita, P. mossambica, P. picta) цитоплазматический канал в месте отхождения жгутика имеет каплевидное расширение с электроноплотными частицами на плазмалемме. Следует отметить, что у S. diabolus имеется такой же канал, в то время как у S. cirrosa и S. papuensis (Емельянова, Павлов, 2021) он крайне узкий, а электроноплотные частицы на плазмалемме отсутствуют. Расширение цитоплазматического канала полностью отсутствует у исследованных видов родов Scorpaena, Sebastapistes, Dendrochirus, Synanceia и Inimicus (Павлов, Емельянова 2018; Емельянова, Павлов, 2020).
По длине жгутика (в среднем 33–36 мкм) исследованные нами виды существенно не различаются. У скорпеновидных рыб средняя длина жгутика варьирует от 27 мкм у S. possi до 40 мкм у P. picta (Павлов, Емельянова, 2018). Жгутики всех изученных видов Scorpaenoidei имеют цитоплазматические расширения, которые свойственны многим видам морских рыб и значительно реже встречаются у пресноводных (Pecio, 2003; França et al., 2009). У Eigenmannia trilineata (Gymnotiformes: Sternopygidae), представителя пресноводных слабоэлектрических рыб, такие расширения имеются, но отсутствуют у остальных пяти изученных видов семейства (Giora, Burns, 2011). Отсутствие расширений между аксонемой и плазмалеммой у Ostariophysi интерпретируется как вторичная редукция и аутапоморфный признак для этой группы (Jamieson, 1991).
Таким образом, сперматозоиды скорпеновидных рыб с внешним осеменением построены по единому плану, а различия между видами, относящимися к разным родам, по форме головки и средней части невелики. Представители родов Parascorpaena и Scorpenopsis чётко дифференцируются по величине углубления в основании ядра (соответственно 25–26 и 0–12%) и взаимному расположению центриолей (соответственно коаксиальное и ортогональное). Вместе с тем вариабельность в величине углубления в основании ядра сперматозоида и взаимном расположении центриолей отмечена в разных родах Scorpaenoidei и эти признаки не следует рассматривать как синапоморфии. Другие морфологические признаки (число митохондрий, величина и форма цитоплазматического канала в основании жгутика и длина жгутика) варьируют у разных видов и вряд ли могут быть использованы для идентификации родов. Видоспецифичность структуры сперматозоида проявляется лишь в сочетании морфологических признаков, а единственная выявленная нами апоморфия – изрезанная форма углубления в основании ядра у P. aurita. Эволюция морфологии сперматозоидов, очевидно, связана с их физиологией и спецификой соединения гамет, которые пока сложно оценить.
Список литературы
Емельянова Н.Г., Макеева А.П. 1998. Морфофизиологические особенности сперматозоидов некоторых карпообразных и сомообразных рыб // Проблемы репродуктивной биологии в трудах профессора С.И. Кулаева и его последователей. М.: Изд-во МГУ. С. 260−269.
Емельянова Н.Г., Павлов Д.А. 2020. Некоторые данные о репродуктивной биологии Inimicus sinensis (Synanceiidae) // Вопр. ихтиологии. Т. 60. № 3. С. 318−327. https://doi.org/10.31857/S0042875220030108
Емельянова Н.Г., Павлов Д.А. 2021. Особенности репродуктивной биологии Scorpaenopsis papuensis (Scorpaenidae) // Там же. Т. 61. № 1. С. 100−108. https://doi.org/10.31857/S0042875221010082
Овен Л.С. 2004. Специфика развития половых клеток морских рыб в период размножения как показатель типа нереста и реакции на условия среды обитания. М.: Изд-во ВНИРО, 186 с.
Павлов Д.А. 2021. Морфология отолитов и родственные отношения некоторых видов рыб подотряда Scorpaenoidei // Вопр. ихтиологии. Т. 61. № 1. С. 20−34. https://doi.org/10.31857/S0042875221010124
Павлов Д.А., Емельянова Н.Г. 2018. Сравнительный анализ морфологии сперматозоидов у трёх видов рыб подотряда Scorpaenoidei // Там же. Т. 58. № 2. С. 201–214. https://doi.org/10.7868/S0042875218020091
Павлов Д.А., Емельянова Н.Г. 2019. Биологическая характеристика Dendrochirus zebra (Cuvier, 1829) (Scorpaeniformes: Scorpaenidae) из залива Нячанг Южно-Китайского моря // Биология моря. Т. 45. № 2. С. 75–85. https://doi.org/10.1134/S0134347519020104
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.: Сов. наука, 467 с.
Уикли Б. 1975. Электронная микроскопия для начинающих. М.: Мир, 324 с.
Allen G.R., Erdmann M.V. 2012. Reef fishes of the East Indies. V. I–III. Tropical Reef Research. Perth: Univ. Hawaii Press, 1260 p.
Baccetti B., Afzelius B.A. 1976. The biology of the sperm cell // Monograph in developmental biology. V. 10. Basel: Karger, 254 p.
Carpenter K.E., Niem V.H. (eds.). 1999. FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. V. 4. Bony fishes. Pt. 2. Mugilidae to Carangidae. Rome: FAO. P. 2069–2790.
França G.F., Oliveira C., Quagio-Grassiotto I. 2009. Spermatic cell characteristics in Gymnotiformes (Teleostei: Ostariophysi) and their phylogenetic meaning // J. Fish Biol. V. 75. P. 2226–2243. https://doi.org/10.1111/j.1095-8649.2009.02439.x
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2020. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/catalog/ fishcatmain.asp. Version 01/2020)
Froese R., Pauly D. (eds.). 2020. FishBase. (www.fishbase.org. Version 12/2020).
Garcıa-Lopez A., Martınez-Rodrıguez G., Sarasquete C. 2005. Male reproductive system in Senegalese sole Solea senegalensis (Kaup) // Histol. Histopathol. V. 20. № 4. P. 1179–1189. https://doi.org/10.14670/HH-20.1179
Giora J., Burns J.R. 2011. Sperm ultrastructure in three different families of weakly electric fishes (Teleostei: Gymnotiformes) // Neotrop. Ichthyol. V. 9. № 4. P. 881–888.
Götting K.J. 1961. Beitrage zur Kenntnis der Grundlagen der Fortpflanzung und zur Fruchtbarkeitbestimmung bei marinen Teleosteern // Helgoländ. Wiss. Meersuntersuch. Bd. 8. № 1. S. 1–41.
Imamura H. 2004. Phylogenetic relationships and new classifcation of the superfamily Scorpaenoidea (Actinopterygii: Perciformes) // Spec. Div. V. 9. P. 1–36.
Ishida M. 1994. Phylogeny of the suborder Scorpaenoidei (Pisces: Scorpaeniformes) // Bull. Nansei Nat. Fish. Res. Inst. V. 27. P. 1–112.
Jamieson B.G.M. 1991. Fish evolution and systematics: evidence from spermatozoa. Cambridge: Cambridge Univ. Press, 319 p.
Koya Y., Muñoz M. 2007. Comparative study on ovarian structures in scorpaenids: possible evolutional process of reproductive mode // Ichthyol. Res. V. 54. P. 221–230. https://doi.org/10.1007/s10228-006-0394-7
Kuiter R.H., Tonozuka T. 2001. Pictorial guide to Indonesian reef fishes. Pt. 1. Eels–Snappers, Muraenidae–Lutjanidae. Zoonetics Australia, 302 p.
Kwik J.T.B. 2011. The biology and ecology of small tropical scorpaenoids inhabiting shallow coastal habitats in Singapore: Ph.D. Thesis. Nat. Univ. Singapore, 219 p. (http://scholarbank.nus.sg/handle/10635/31654)
Lahnsteiner F., Patzner R.A. 1990. Spermiogenesis and structure of mature spermatozoa in bleniid fishes (Pisces, Bleniidae) // J. Submicrosc. Cytol. Pathol. V. 22. P. 565–576.
Lieske E., Myers R. 1994. Collins pocket guide. Coral reef fishes. Indo-Pacific and Caribbean including the Red Sea. London: Haper Collins Publ., 400 p.
Magalhaes A.L.B., Andrade R.F., Gomes B.V.C. et al. 2011. Ultrastructure of the semicystic spermatogenesis in the South American freshwater characid Hemigrammus marginatus (Teleostei, Characiformes) // J. Appl. Ichthyol. V. 27. № 4. P. 1041–1046. https://doi.org/10.1111/j.1439-0426.2011.01747.x
Masuda H., Amaoka K., Araga C. et al. 1984. The fishes of the Japanese Archipelago. V. 1. Tokyo: Tokai Univ. Press, 437 p.
Mattei X. 1991. Spermatozoon ultrastructure and its systematic implication in fishes // Can. J. Zool. V. 69. P. 3038–3055. https://doi.org/10.1139/z91-428
Mattei X. 1993. Peculiarities in the organization of testis of Ophidion sp. (Pisces: Teleostei). Evidence for two types of spermatogenesis in teleost fish // J. Fish Biol. V. 43. № 6. P. 931–937. https://doi.org/10.1006/jfbi.1993.1196
Moser H.G. 1967. Reproduction and development of Sebastodes paucispinis and comparison with other rock fishes of Southern California // Copeia. № 4. P. 773–797.
Muñoz M., Casadevall M., Bonet S. 2002a. Testicular structure and semicystic spermatogenesis in a specialized ovuliparous species: Scorpaena notata (Pisces, Scorpaenidae) // Acta Zool. (Stockholm). V. 83. № 3. P. 213–219. https://doi.org/10.1046/j.1463-6395.2002.00114.x
Muñoz M., Casadevall M., Bonet S. 2002b. The ovarian morphology of Scorpaena notata shows a specialized mode of oviparity // J. Fish. Biol. V. 61. № 4. P. 877–887. https://doi.org/10.1111/j.1095-8649.2002.tb01849.x
Naranji M.K., Velamala G.R., Sujatha K. 2017. New record of Mozambique scorpionfish, Parascorpaena mossambica (Peters, 1855), (Actinopterygii: order, Scorpaeniformes; family, Scorpaenidae) from Indian waters // Ilmu Kelautan. Indonesian J. Mar. Sci. V. 22. № 3. P. 105–110. https://doi.org/10.14710/ik.ijms.22.3.105-110
Pavlov D.A., Emel’yanova N.G. 2010. Reproductive biology of species from the family Scorpaenidae and transition from oviparity to viviparity in the southern and northern Percomorpha // Viviparous Fishes II / Eds. Uribe M.C., Grier H.J. Homestead: New Life Publ. P. 89–105.
Pecio A. 2003. Spermiogenesis and fine structure of the spermatozoon in a headstander, Chilodus punctatus (Teleostei, Characiformes, Anostomidae) // Folia Biol. V. 51. P. 55–62.
Randall J.E., Eschmeyer W.N. 2001. Revision of the Indo-Pacific scorpionfish genus Scopaenopsis, with descriptions of eight new species // Indo-Pac. Fish. № 34. 79 p.
Sàbat M., Lo Nostro F., Casadevall M., Muñoz M. 2009. A light and electron microscopic study on the organization of the testis and the semicystic spermatogenesis of the genus Scorpaena (Teleostei, Scorpaenidae) // J. Morphol. V. 270. № 6. P. 662–672. https://doi.org/10.1002/jmor.10707
Santhanam R. 2019. Biology and ecology of venomous marine scorpionfishes. London: Acad. Press, 312 p.
Shahin A.A.B. 2006. Semicystic spermatogenesis and biflagellate spermatozoon ultrastructure in the Nile electric catfish Malapterurus electricus (Teleostei: Siluriformes: Malapteruridae) // Acta Zool. V. 87. № 3. P. 215–227. https://doi.org/10.1111/j.1463-6395.2006.00235.x
Shaw F.R., Morado J.F., Lowe V.C., McDermott S.F. 2012. An atlas of reproductive development in rockfishes, genus Sebastes // NOAA Prof. Pap. NMFS № 14. 77 p.
Smith W.L., Wheeler W.C. 2004. Polyphyly of the mail-cheeked fishes (Teleostei: Scorpaeniformes): evidence from mitochondrial and nuclear sequence data // Mol. Phylogen. Evol. V. 32. № 2. P. 627–646. https://doi.org/10.1016/j.ympev.2004.02.006
Smith W.L., Wheeler W.C. 2006. Venom evolution widespread in fishes: a phylogenetic road map for the bioprospecting of piscine venoms // J. Hered. V. 97. № 3. P. 206–217. https://doi.org/10.1093/jhered/esj034
Smith W.L., Everman E., Richardson C. 2018. Phylogeny and taxonomy of flatheads, scorpionfishes, sea robins, and stonefishes (Percomorpha: Scorpaeniformes) and the evolution of the lachrymal saber // Copeia. V. 106. № 1. P. 94–119. https://doi.org/10.1643/CG-17-669
Spadella M.A., Oliveira C., Quagio-Grassiotto I. 2007. Comparative analysis of spermiogenesis and sperm ultrastructure in Callichthyidae (Teleostei: Ostariophysi: Siluriformes) // Neotrop. Ichthyol. V. 5. № 3. P. 337–350. https://doi.org/10.1590/S1679-62252007000300014
Takahashi H., Takano K., Takemura A. 1991. Reproductive cycles of Sebastes taczanowskii, compared with those of other rockfishes of the genus Sebastes // Environ. Biol. Fish. V. 30. P. 23–30. https://doi.org/10.1007/BF02296873
Vila S., Munoz M., Sabat M., Casadevall M. 2007. Annual cycle of stored spermatozoa within the ovaries of Helicolenus dactylopterus dactylopterus (Teleostei, Scorpaenidae) // J. Fish Biol. V. 71. P. 596–609. https://doi.org/10.1111/j.1095-8649.2007.01525.x
Vila S., Sàbat M., Muñoz M., Casadevall M. 2010. Spermiogenesis particularities of a sperm storage species: Helicolenus dactylopterus (Teleostei: Scorpaenidae) // Sci. Mar. V. 74. № 4. P. 687–704. https://doi.org/10.3989/scimar.2010.74n4697
Wourms J.P. 1991. Reproduction and development of Sebastes in the context of the evolution of piscine viviparity // Environ. Biol. Fish. V. 30. P. 111–126. https://doi.org/10.1007/978-94-011-3792-8_12
Wourms J.P., Grove B.D., Lombardi J. 1988. The maternal embryonic relationships in viviparous fishes // Fish Physiology. V. 11B / Eds. Hoar W.S., Randall D.J. San Diego: Acad. Press. P. 1–134.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


