Вопросы ихтиологии, 2021, T. 61, № 6, стр. 643-655
Распределение, размерно-половой состав и питание мягкого бородавчатого бычка Malacocottus gibber (Psychrolutidae) в северо-западной части Японского моря
В. В. Панченко 1, *, О. И. Пущина 2
1 Национальный научный центр морской биологии Дальневосточного
отделения РАН − ННЦМБ ДВО РАН
Владивосток, Россия
2 Тихоокеанский филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – ТИНРО
Владивосток, Россия
* E-mail: vlad-panch@yandex.ru
Поступила в редакцию 27.10.2020
После доработки 02.11.2020
Принята к публикации 02.11.2020
Аннотация
В северо-западной части Японского моря мягкий бородавчатый бычок Malacocottus gibber, за исключением нетипичной поимки на глубине 79 м, встречается в диапазоне от 160 до 940 м (максимальная глубина тралений) при температуре воды 0.1–2.6°С. В южном районе (ниже 47°10′ с.ш.) в тёплый период года предпочитает диапазон 300−500 м, в холодный – более 400 м. В северном районе (выше 47°10′ с.ш.) в течение всего года тяготеет к 500−700 м, причём в холодный период плотность здесь повышается за счёт подхода рыб с меньших глубин. В южном районе по сравнению с северным образует более плотные концентрации, начинает встречаться на меньшей глубине, отмечен до более высоких значений температуры. Достигает длины 31 см. Созревает при достижении длины 15−18 см; в этой размерной группе доля самцов больше, чем среди молоди и в особенности взрослых рыб. В целом в популяции преобладают самки в соотношении полов 1.5 : 1.0. M. gibber является эврифагом, потребляющим в основном северную креветку, кальмаров рода Gonatopsis, полихет, гаммарид и эвфаузиид. В весенне-летний период средний суточный рацион особей длиной 11−25 см составляет 2.5% массы тела; значительной размерно-возрастной и сезонной динамики интенсивности питания не наблюдается.
Мягкий бородавчатый бычок Malacocottus gibber – эндемик Японского моря (Shinohara et al., 1992; Stevenson, 2015) и один из массовых мезобентальных видов рыб этого водоёма (Amaoka et al., 1995; Борец, 2000; Choi et al., 2003; Nakabo, 2002; Парин и др., 2014).
Во многих публикациях указывается на присутствие в Японском море двух видов рода Malacocottus: мягкого чернопёрого бычка M. zonurus и мягкого бородавчатого бычка M. gibber. Согласно проведённой японскими авторами ревизии (Shinohara et al., 1992), у западного побережья Японии обитает M. gibber. Стивенсон (Stevenson, 2015), исследовавший образцы Malacocottus из разных районов ареала рода, также пришёл к выводу о наличии в Японском море только этого вида. Имеются сведения о подтверждённых поимках у материкового побережья Японского моря подвида M. zonurus microphthalmus Popov, 1933 − 2 экз. в зал. Чосонман, КНДР и 1 экз. в зал. Владимир, Приморье (Линдберг, Красюкова, 1987); однако по современной классификации этот подвид признан младшим синонимом M. gibber (Fricke et al., 2020). Указанные особи хранятся в коллекции Зоологического института (ЗИН РАН); по нашей просьбе сотрудник ЗИН РАН Б.А. Шейко просмотрел два сохранившихся экземпляра и подтвердил, что они являются M. gibber. При подготовке настоящей работы мы совместно с А.А. Балановым (ННЦМБ ДВО РАН) определили видовую принадлежность собранных им в северной части Японского моря (у о-ва Сахалин и у материкового побережья) 17 особей рода Malacocottus, которые также оказались M. gibber. Сборы рыб выполнены случайным образом из траловых уловов во время рейса СахНИРО на НИС “Дмитрий Песков” в 2007 г. Таким образом, M. gibber является единственным представителем рода Malacocottus в Японском море.
Биология M. gibber изучена слабо. В немногочисленных иностранных публикациях приведены ограниченные данные по его батиметрическому распределению, размерам, репродуктивным характеристикам и питанию в южных районах Японского моря, а также размножению в искусственных условиях (Minami, 2000; Okiyama, 2004; Kono et al., 2008; Choi et al., 2009; Sohn et al., 2010; Tsuruwaka, Shimada, 2011). В литературе по российским водам Японского моря содержатся лишь отрывочные сведения о встречаемости, распределении и питании этого вида, фигурирующего как M. zonurus (Ким Сен Ток, 2001; Новиков и др., 2002; Пущина, 2005, 2014; Соколовский и др., 2007, 2009; Соломатов, 2008; Шунтов и др., 2014; Панченко и др., 2016).
Цель настоящей работы – охарактеризовать сезонное батиметрическое и пространственное распределение, размерно-половую структуру и питание M. gibber в северо-западной части Японского моря.
МАТЕРИАЛ И МЕТОДИКА
В работе использованы материалы донных траловых съёмок и контрольных тралений у российского материкового побережья Японского моря (рис. 1) на судах ТИНРО и СахНИРО. Проанализированы данные, в сборе которых авторы принимали участие, и архивные материалы за 1981−2016 гг. Территориально акватория побережья, расположенного выше м. Золотой (47°19′3′′ с.ш.), относится к Хабаровскому краю, ниже – к Приморскому. В последнем выделяются зал. Петра Великого и воды Северного Приморья. Так как уловы мягкого бородавчатого бычка в заливе и на большей части акватории Северного Приморья были близки, при анализе распределения они были объединены в южный район. Прилегающие к м. Золотой воды Приморского и Хабаровского краёв, в которых его распределение оказалось ближе к расположенной выше материковой акватории Татарского пролива, объединены с ней в северный район. Граница между районами проведена по 47°10′ с.ш.
Рис. 1.
Пространственное распределение мягкого бородавчатого бычка Malacocottus gibber в северо-западной части Японского моря, по данным тралений в диапазоне глубин 2−940 м.
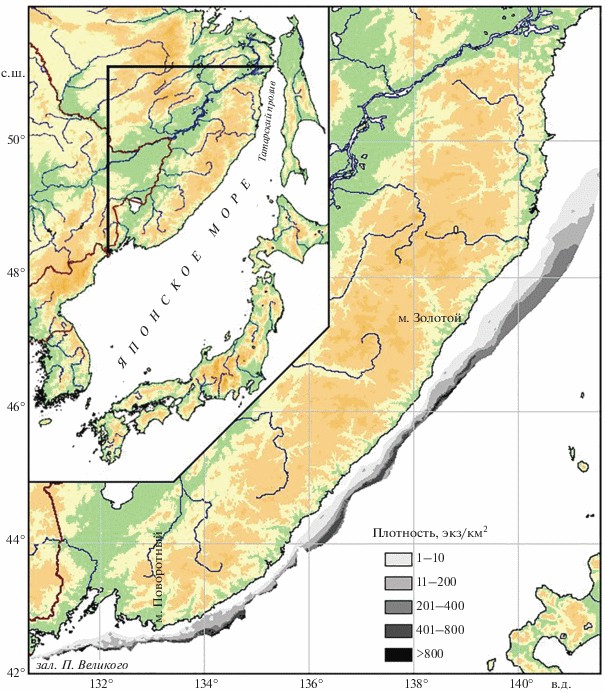
Проанализированы данные 10874 тралений на глубинах от 2 до 940 м, из них в диапазоне глубин обнаружения мягкого бородавчатого бычка – 5005 тралений. Проведено 5820 измерений придонной температуры воды. Ловы выполняли донными тралами с длиной верхней подборы от 20 до 69 м (горизонтальное раскрытие от 13 до 38 м) и ячеёй в кутце от 10 до 30 мм. Скорость тралений составляла 1.5−4.5 (2.7) узлов. Для получения сравнимых результатов при использовании тралов разных конструкций уловы рыб пересчитывали на плотность по формуле: P = B/S, где P – плотность, экз/км2; B – улов, экз.; S – площадь траления, км2. Так как вопрос о коэффициентах уловистости рыб остаётся дискуссионным, данный показатель при пересчёте на плотность не вводили. Анализ пространственного распределения выполнен с помощью программного пакета CHARTMASTER методом сплайн-аппроксимации.
Деление на гидрологические сезоны базируется на классификации Зуенко (1994): зима – январь–февраль, весна – март–апрель, лето – июнь–сентябрь, осень – ноябрь–декабрь. Поскольку батиметрическое распределение мягкого бородавчатого бычка в зимний, весенний и осенний сезоны оказалось сходным, эти сезоны были объединены в холодный период года. В тёплый же период года, помимо летнего сезона, вошли вторая половина мая (переходного месяца между весенним и летним сезонами) и первая половина октября (переходного месяца между летним и весенним сезонами). Первая половина мая и вторая половина октября отнесены к холодному периоду.
Измеряли длину по Смитту (FL), которая у мягкого бородавчатого бычка соответствует общей длине (TL), у 16 166 особей, из них 810 с определением пола. Биоанализ проведён у 100 особей. Материал по питанию (310 желудков) собран на материковом склоне Приморья (300−750 м) в марте−июле. Пробы обрабатывали в соответствии с Методическим пособием (1974). Величину суточного рациона рыб оценивали методом Новиковой (1949) в модификации Чучукало и Напазакова (1999) путём определения продолжительности переваривания исходной (восстановленной) массы пищевых объектов в зависимости от температуры придонного слоя воды. Среднее значение рациона и соотношение в нём компонентов вычислены с учётом биомасс исследованных размерных групп и их вклада в общее потребление.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В северо-западной части Японского моря мягкий бородавчатый бычок относится к мезобентальной группировке рыб, представители которой в течение года предпочитают материковый склон и лишь эпизодически заходят на глубины < 200 м (Соломатов, 2008). Ким Сен Ток (2001) при описании миграций рыб у юго-западной части Сахалина относит его к видам, достаточно равномерно распределяющимся на акватории в течение года. Поскольку мы также не выявили существенных смещений его в другие районы, при анализе пространственного распределения сезонные данные были объединены.
Скопления мягкого бородавчатого бычка формировались практически на всех обследованных участках материкового склона, хотя южнее м. Золотой их плотность была, как правило, выше. При кажущейся по представленным данным неравномерности распределения (рис. 1) в большинстве случаев это связано с разнокачественностью материала. Свал глубин, где зачастую отмечаются значительные уловы мягкого бородавчатого бычка, не удалось равномерно охватить исследованиями в связи с отсутствием на многих участках мест, пригодных для тралений. Этим можно объяснить его низкую плотность у юго-западной границы района работ, а также у 132° и 136° в.д., где с мористой стороны наиболее явственно вклиниваются уступами необследованные места.
На обследованных глубоководных участках концентрации мягкого бородавчатого бычка наиболее часто формировались в центральной части зал. Петра Великого западнее 132° в.д. (у примыкающего к нему необследованного участка крутого свала глубин), а также у побережья Северного Приморья между 133° и 135° в.д. (рис. 1), что может быть связано с особенностями гидрологического режима. В центральной области залива проходит зона раздела циркуляции вод (Зуенко, 2008). Зимой здесь продуцируется большой объём опускающейся на дно воды, которая обеспечивает вентиляцию водных масс, что, видимо, благоприятствует подходам мягкого бородавчатого бычка. На повышение же его уловов между 133° и 135° в.д., вероятно, влияет зона дивергенции, которая находится в центральной части моря и вытянута на северо-восток, но в указанном районе имеет почти широтное направление и вплотную примыкает к материковому шельфу (Яричин, Покудов, 1982).
При продвижении в северном направлении заметное понижение плотности поселений мягкого бородавчатого бычка началось у траверза м. Золотой, в районе 47°10′ с.ш. (рис. 1). Самая северная его поимка была зарегистрирована у 49°30′ с.ш. на глубине 217 м. Очевидно, что отсутствие уловов выше указанной координаты обусловлено мелководность северной части Татарского пролива. Однако в расположенной ниже глубоководной части пролива уменьшение уклона дна, напротив, расширяет площадь пригодного для жизни этого вида биотопа. Уменьшение плотности поселений мягкого бородавчатого бычка в северной области связано с тем, что в расположенных выше м. Золотой водах Татарского пролива гидрологический режим значительно отличается от такового в расположенных ниже водах северо-западной части Японского моря. В проливе, особенно с материковой стороны, формируется подповерхностный слой вод с пониженной температурой и солёностью, опускающийся за счёт зимней конвекции в придонные слои и нередко сохраняющийся даже летом (Зуенко, 2008). Влияние этого фактора проявляется и в относительно глубоководной зоне. Такие воды проникают на юг до 46° с.ш., однако южнее м. Золотой их влияние ослабевает. В связи с особенностями гидрологии материковая акватория Татарского пролива является неблагоприятной для обитания многих видов рыб, в том числе представителей близкого в систематическом отношении семейства Cottidae, в частности, для дальневосточного шлемоносца Gymnocanthus herzensteini (Калчугин и др., 2016).
Минимальная глубина обнаружения мягкого бородавчатого бычка в северо-западной части Японского моря, сведения о которой можно считать достоверными, составила 79 м и была зарегистрирована в начале апреля в периферийной области южного района – в зал. Петра Великого (Панченко и др., 2016). Глубже, согласно архивным данным, отмечалось по одной его особи в трёх тралениях на глубинах 128−140 м. Однако эти поимки нельзя считать достоверными, так как каждому из этих ловов предшествовали работы на больших глубинах, в которых присутствовали особи мягкого бородавчатого бычка. Полностью же в период съёмки очистить трал от гидробионтов до следующей его постановки удаётся далеко не всегда, поэтому остаётся вероятность нахождения особей из предыдущего улова. Достоверных поимок не наблюдалось вплоть до 160-метровой изобаты, где в конце марта, также в границах залива, была отмечена одна его особь. Единичная поимка на сходной глубине (161 м) была в июне и в центральной области южного района. Учитывая большой объём проанализированных данных, можно констатировать, что меньшие глубины не являются для вида типичными. Объективным объяснением появления особи мягкого бородавчатого бычка у 80-метровой изобаты может быть вынос с глубинными водами в результате апвеллинга, отмечаемого в этом районе наряду с упоминавшимся выше процессом опускания в зимнее время водных масс в придонные слои воды (Зуенко, 2008). В северном районе, у материкового побережья Татарского пролива, минимальная глубина обнаружения мягкого бородавчатого бычка, отмеченная в феврале, была больше – 188 м. В летний же период этот показатель здесь составил 217 м.
В тёплый период года в южном районе мягкий бородавчатый бычок до 200-метровой изобаты встречался в уловах лишь эпизодически (табл. 1). Далее, в диапазоне глубин 201−250 м, частота его встречаемости приближалась к 25%, а на 251−300 м – к 50%. Постепенно увеличивалась здесь и плотность рыб, однако основные концентрации формировались на глубинах >300 м. С ростом глубины плотность поселений бычка, как и частота встречаемости, достигла высоких значений в диапазоне 401−500 м; далее следовало снижение (в большей степени удельной численности, чем частоты встречаемости), а на глубинах >700 м – новый рост этих показателей до максимальных из отмеченных. Однако данные по последнему диапазону в этот сезон вряд ли отражают реальные тенденции, так как в нём было проведено лишь два траления, причём на близких к 700-метровой изобате глубинах (733 и 735 м) на участке зал. Петра Великого, где традиционно наблюдались высокие уловы мягкого бородавчатого бычка (рис. 1). В северном районе, на акватории материковой части Татарского пролива, летом на максимальных из исследованных глубин (>700 м) было проведено больше ловов и плотность рыб, напротив, оказалась меньшей, чем в смежном диапазоне 501−700 м (табл. 1). Здесь этот показатель был наивысшим, хотя частота встречаемости оказалась сходной с таковой на глубинах > 700 м. В северном районе, как и в южном, до 300-метровой изобаты уловы были незначительны.
Таблица 1.
Батиметрическое распределение мягкого бородавчатого бычка Malacocottus gibber в северо-западной части Японского моря, 1981−2016 гг.
| Глубины, м | Южный район | Северный район | ||||||
|---|---|---|---|---|---|---|---|---|
| Средняя плотность, экз/км2 | ЧВ, % | Средняя температура, °С | N | Средняя плотность, экз/км2 | ЧВ, % | Средняя температура, °С | N | |
| 79−100 | $\frac{0}{ + }$ | 0 + |
$\frac{{2.12}}{{0.79}}$ | $\frac{{441}}{{299}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{1.43}}{{1.00}}$ | $\frac{{77}}{{37}}$ |
| 101−150 | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{1.79}}{{1.20}}$ | $\frac{{397}}{{378}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{1.47}}{{1.32}}$ | $\frac{{91}}{{47}}$ |
| 151−200 | $\frac{{9.3}}{{1.7}}$ | $\frac{5}{4}$ | $\frac{{1.54}}{{1.20}}$ | $\frac{{139}}{{250}}$ | $\frac{0}{{1.2}}$ | $\frac{0}{3}$ | $\frac{{1.38}}{{1.09}}$ | $\frac{{64}}{{33}}$ |
| 201−250 | $\frac{{39.9}}{{48.1}}$ | $\frac{{25}}{{26}}$ | $\frac{{1.34}}{{1.16}}$ | $\frac{{\begin{array}{*{20}{l}} {175} \end{array}}}{{303}}$ | $\frac{{1.5}}{0}$ | $\frac{3}{0}$ | $\frac{{1.18}}{{1.03}}$ | $\frac{{59}}{{36}}$ |
| 251−300 | $\frac{{114.3}}{{165.2}}$ | $\frac{{49}}{{40}}$ | $\frac{{1.18}}{{0.94}}$ | $\frac{{94}}{{245}}$ | $\frac{{27.8}}{{1.0}}$ | $\frac{7}{4}$ | $\frac{{1.05}}{{0.85}}$ | $\frac{{41}}{{25}}$ |
| 301−400 | $\frac{{860.3}}{{405.5}}$ | $\frac{{86}}{{67}}$ | $\frac{{0.95}}{{0.82}}$ | $\frac{{162}}{{452}}$ | $\frac{{87.0}}{{26.9}}$ | $\frac{{34}}{{27}}$ | $\frac{{0.80}}{{0.76}}$ | $\frac{{61}}{{49}}$ |
| 401−500 | $\frac{{919.9}}{{597.4}}$ | $\frac{{96}}{{77}}$ | $\frac{{0.75}}{{0.63}}$ | $\frac{{106}}{{366}}$ | $\frac{{70.7}}{{224.0}}$ | $\frac{{47}}{{73}}$ | $\frac{{0.70}}{{0.55}}$ | $\frac{{30}}{{44}}$ |
| 501−700 | $\frac{{557.4}}{{614.7}}$ | $\frac{{83}}{{85}}$ | $\frac{{0.56}}{{0.52}}$ | $\frac{{95}}{{244}}$ | $\frac{{275.2}}{{395.7}}$ | $\frac{{84}}{{93}}$ | $\frac{{0.48}}{{0.38}}$ | $\frac{{50}}{{30}}$ |
| 701−940 | $\frac{{1581.3}}{{526.8}}$ | $\frac{{100}}{{87}}$ | $\frac{{0.51}}{{0.39}}$ | $\frac{2}{{62}}$ | $\frac{{170.3}}{{153.7}}$ | $\frac{{85}}{{88}}$ | $\frac{{0.41}}{{0.27}}$ | $\frac{{13}}{8}$ |
Примечание. Здесь и в табл. 2: над чертой – тёплый период года, под чертой – холодный; ЧВ – частота встречаемости, N – число тралений; “+” – нетипичная поимка на глубине 79 м.
Сравнивая два района обитания мягкого бородавчатого бычка в тёплый период, можно констатировать, что в южном минимальные глубины его обитания оказались меньшими, а в каждом из диапазонов глубин плотность поселений большей, чем в северном (табл. 1). Обитающие в северном районе особи тяготели к бóльшим глубинам, чем в южном. Обусловлены различия, видимо, тем, что северный район характеризуется более суровыми гидрологическими условиями. В связи с этим не случайно, что средние значения температуры в северном районе оказались ниже. Помимо температуры, негативное влияние на обитание бычка у материкового побережья Татарского пролива, по-видимому, оказывает распреснение, усиливающееся в направлении его кутовой части (Зуенко, 2008).
В холодный период года в южном районе представители вида по-прежнему концентрировались в основном на глубинах >300 м. В отличие от лета их плотность и частота встречаемости в диапазоне 501−700 м оказались выше, чем на 401−500 м (табл. 1). В северном районе в это время часть рыб, по сравнению с тёплым периодом, также была смещена несколько глубже: основные концентрации, как и летом, продолжали тяготеть к глубинам 501−700 м, однако плотность их, как и на глубинах 401−500 м, возросла. Произошло это, вероятно, за счёт подхода рыб с меньших глубин.
При сравнении распределения мягкого бородавчатого бычка в двух районах в холодный период года заметно, что, как и летом, основная масса рыб у материкового побережья Татарского пролива была относительно южного района сдвинута по склону ниже, а уловы рыб на глубинах образования концентраций меньше при близкой частоте встречаемости. Происходило это на фоне более низкой на севере придонной температуры воды (табл. 1) и, вероятно, солёности. Вместе с тем глубины образования наибольших скоплений в двух районах в холодный период оказались сходными – 501−700 м. Таким образом, различия в батиметрическом распределении мягкого бородавчатого бычка в сезонном аспекте выражены слабо. Хотя и проявляется его тяготение в холодный период к несколько большим глубинам, предпочитаемые батиметрические диапазоны в течение года значительно не меняются.
Судя по проявляющейся ниже 700-метровой изобаты тенденции уменьшения заселённости мягким бородавчатым бычком акватории, нам удалось охватить основные глубины его обитания, хотя полностью батиметрический диапазон этого вида в глубоководной части охвачен не был. Имеются сведения, что он обитает до глубин > 1000 м (Amaoka et al., 1995; Okiyama, 2004; Adachi et al., 2009; Парин и др., 2014). Между тем основные скопления приурочены к меньшим глубинам. По данным шести траловых съёмок в осенний и весенний периоды 2007−2009 гг. в япономорских водах Республики Корея на глубинах 300−900 м (Sohn et al., 2010), основные скопления M. gibber постоянно формировались ниже 300-метровой изобаты; при некоторых различиях предпочитаемых диапазонов глубин в разных съёмках в большинстве из них при приближении к 900-метровой изобате его плотность уменьшалась. У японских островов этот вид также предпочитает глубины 400−700 м (Okiyama, 2004; Tsuruwaka, Shimada, 2011).
Хотя не все траления сопровождались измерениями придонной температуры воды (в том числе и при выбивающейся поимке особи мягкого бородавчатого бычка на глубине 79 м), имеющийся массив данных (табл. 2) позволяет выявить его температурные предпочтения. Поимки мягкого бородавчатого бычка были нами отмечены при слабоположительном температурном фоне 0.1−2.6°С, тогда как в целом в проанализированном массиве данных температура в течение года варьировала от –1.9 до +22.6°С, а на глубинах охваченного нами типичного для вида диапазона обитания (от 160 м) – от 0 до 2.9°С.
Таблица 2.
Распределение мягкого бородавчатого бычка Malacocottus gibber в северо-западной части Японского моря в зависимости от придонной температуры, 1981−2016 гг.
| Придонная температура, °С |
Южный район | Северный район | ||||
|---|---|---|---|---|---|---|
| Средняя плотность, экз/км2 | ЧВ, % | N | Средняя плотность, экз/км2 | ЧВ, % | N | |
| –1.90…+0.09 | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{1}{{256}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{16}}{{27}}$ |
| 0.10–0.20 | $\frac{--}{{58.5}}$ | $\frac{--}{{18}}$ | $\frac{0}{{57}}$ | $\frac{0}{{58.5}}$ | $\frac{0}{{36}}$ | $\frac{4}{{11}}$ |
| 0.21–0.40 | $\frac{{109.9}}{{207.1}}$ | $\frac{{45}}{{51}}$ | $\frac{{11}}{{210}}$ | $\frac{{127.1}}{{157.7}}$ | $\frac{{57}}{{53}}$ | $\frac{{21}}{{36}}$ |
| 0.41–0.60 | $\frac{{606.4}}{{428.6}}$ | $\frac{{83}}{{57}}$ | $\frac{{87}}{{380}}$ | $\frac{{126.1}}{{184.1}}$ | $\frac{{49}}{{42}}$ | $\frac{{49}}{{59}}$ |
| 0.61–0.80 | $\frac{{625.1}}{{374.3}}$ | $\frac{{75}}{{56}}$ | $\frac{{126}}{{425}}$ | $\frac{{71.3}}{{63.7}}$ | $\frac{{20}}{{23}}$ | $\frac{{60}}{{47}}$ |
| 0.81–1.00 | $\frac{{665.0}}{{191.1}}$ | $\frac{{69}}{{43}}$ | $\frac{{104}}{{337}}$ | $\frac{{15.3}}{{10.0}}$ | $\frac{7}{6}$ | $\frac{{67}}{{32}}$ |
| 1.01–1.20 | $\frac{{348.5}}{{95.6}}$ | $\frac{{47}}{{30}}$ | $\frac{{100}}{{258}}$ | $\frac{{1.7}}{{2.1}}$ | $\frac{3}{3}$ | $\frac{{38}}{{34}}$ |
| 1.21–1.50 | $\frac{{70.9}}{{96.5}}$ | $\frac{{17}}{{12}}$ | $\frac{{181}}{{294}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{101}}{{40}}$ |
| 1.51–2.00 | $\frac{{11.9}}{{8.9}}$ | $\frac{5}{7}$ | $\frac{{423}}{{228}}$ | $\frac{{0.4}}{0}$ | $\frac{1}{0}$ | $\frac{{95}}{{31}}$ |
| 2.01–2.60 | $\frac{{0.1}}{{30.5}}$ | $\frac{1}{3}$ | $\frac{{274}}{{156}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{32}}{{16}}$ |
| 2.61–22.60 | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{799}}{{171}}$ | $\frac{0}{0}$ | $\frac{0}{0}$ | $\frac{{101}}{{25}}$ |
В течение года температура обитания мягкого бородавчатого бычка варьировала незначительно, что не удивительно, принимая во внимание слабую сезонную изменчивость в распределении рыб по глубинам и довольно стабильные температурные условия в предпочитаемых диапазонах (табл. 1). Сезонное отличие в обоих районах заключалось лишь в незначительном смещении бычка в холодный период года в сторону меньших значений температуры (табл. 2). Региональная изменчивость в распределении относительно температурного фактора более выражена. В южном районе температурный диапазон его обитания составил 0.1–2.6°С, тогда как в северном был 0.1–2.2°С. Относительно высокая плотность и частота встречаемости бычка в северном районе по сравнению с южным были приурочены к меньшим значениям температуры как в течение тёплого (0.2–0.6 против 0.4−1.0°С), так и холодного периода (0.2–0.6 против 0.4−0.8°С).
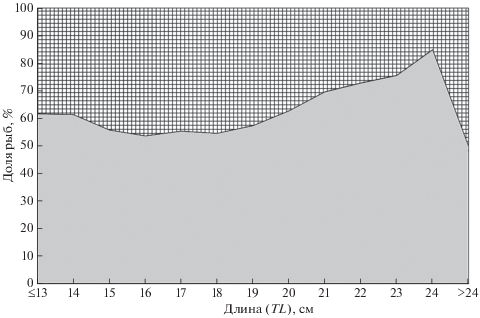
В уловах были отмечены особи мягкого бородавчатого бычка TL 4–31 см. Как минимальные, так и максимальные размеры рыб в северном районе были несколько меньше, чем на юге (рис. 2), что может быть следствием меньшего объёма выборки в первом районе (918 против 15248 экз.). Хотя относительно максимальной длины следует заметить, что, возможно, её уменьшение в северном направлении объективно. С продвижением далее на юг, в юго-восточную часть Японского моря, его наибольшая отмеченная длина оказалась ещё большей – SL 28 см (Okiyama, 2004), что близко TL 32 см.
Рис. 2.
Размерный состав мягкого бородавчатого бычка Malacocottus gibber в уловах донного трала в южном ( ) и северном (− −) районах северо-западной части Японского моря.
) и северном (− −) районах северо-западной части Японского моря.
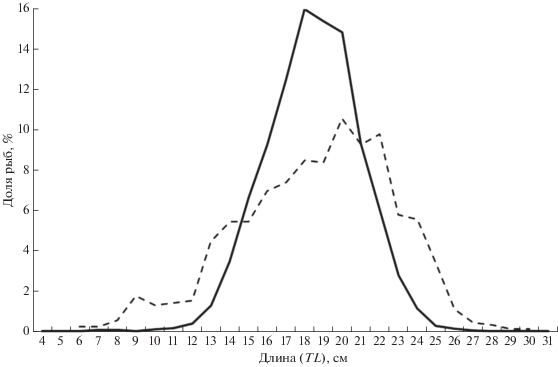
В северном районе по сравнению с южным доли молоди мягкого бородавчатого бычка TL < 15 см, как и взрослых особей TL > 20 см в уловах были больше, а доля особей среднего размера (16–20 см) − меньше (рис. 2). Несмотря на различия в размерном составе, средняя длина в обоих районах оказалась сходной – 18.0 и 18.1 см соответственно в южном и северном. По данным биоанализа, достигшие TL 18 см особи в подавляющем большинстве являются половозрелыми, а созревание в массе начинается при TL ~ 15 см. В юго-восточной части Японского моря данный вид достигает половой зрелости при сходных размерах (Okiyama, 2004).
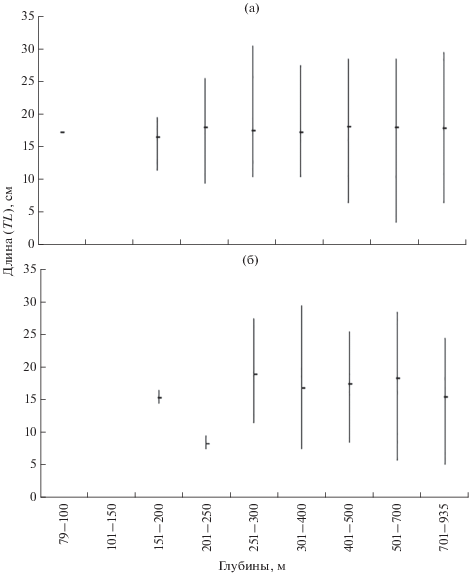
Сезонные различия размерного состава мягкого бородавчатого бычка по глубинам не прослеживаются, что позволило объединить данные по холодному и тёплому периодам (рис. 3). На глубинах ≤200 м в течение года отмечались лишь эпизодические поимки особей TL 12−20 см. В диапазоне 201−250 м в южном районе размерный ряд был довольно широк − TL 10−26 см (рис. 3а), а в северном были пойманы лишь две особи − молодь TL 8 и 10 см (рис. 3б). Ниже в обоих районах размерный состав бычка был существенно шире, в уловах присутствовали как молодь, так и взрослые особи. При этом наблюдалась тенденция уменьшения минимального размера рыб с глубиной, которая в диапазоне 251−300 м составляла 12 см, 301−400 м – 8 см, 401−500 м – 7 см, а самая мелкая особь TL 4 см была встречена ниже 600-метровой изобаты. Помимо уменьшения минимальных размеров в глубоководной зоне постепенно увеличивалась и доля мелких особей. Наиболее ярко это проявилось в северном районе, за счёт чего средний размер здесь на глубинах >700 м заметно снизился (рис. 3б). Следует отметить, что в тихоокеанских прикурильских и прикамчатских водах тенденция уменьшения размеров с возрастанием глубины характерна и для близкородственного вида M. zonurus (Токранов, Орлов, 2001), вероятно, занимающего за пределами Японского моря сходную экологическую нишу.
Рис. 3.
Размерный состав мягкого бородавчатого бычка Malacocottus gibber в уловах донного трала в разных диапазонах глубин в южном (а) и северном (б) районах северо-западной части Японского моря: (-) – среднее значение, (|) – пределы варьирования показателя.
Среди промеренных с определением пола особей мягкого бородавчатого бычка TL 7–27 см численно преобладали самки – 60%; их доля практически во всех размерных группах превышала долю самцов (рис. 4). Среди созревающих рыб TL 15–18 см преобладание самок минимальное, с увеличением длины их доля постепенно повышается – до 85% у рыб TL 24 см. Близкое к равному соотношения полов среди особей TL > 24 см, по всей видимости, обусловлено случайностью выборки малого объёма (две самки и два самца TL 25−27 см).
Рис. 4.
Соотношение самцов ( ) и самок (
) и самок (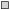 ) в разных размерных группах мягкого бородавчатого бычка Malacocottus gibber в северо-западной части Японского моря.
) в разных размерных группах мягкого бородавчатого бычка Malacocottus gibber в северо-западной части Японского моря.
Преобладание самок и возрастание их доли среди взрослых рыб при достижении обоими полами сходных размеров, вероятно, характерно для рода Malacocottus в целом. В выборке M. zonurus из северо-западной части Берингова моря преобладают самки (55%) (Глубоков и др., 2019). В популяции M. zonurus из тихоокеанских вод северных Курильских о-вов и юго-восточной части Камчатки доля самок в среднем составляет 54%, а среди наиболее крупных особей (TL 33−35 см) – 80% (Токранов, Орлов, 2001). При этом авторы указывают, что длина одновозрастных самцов и самок близка, предельная длина особей обоих полов составляет 35 см. Поэтому поступательное увеличение с ростом доли самок не может быть связано с половыми различиями темпа роста двух полов, а объяснить это можно, на наш взгляд, лишь большей смертностью самцов.
По данным литературы, в южных районах Японского моря ведущую роль в питании мягкого бородавчатого бычка играют нектобентосные, нектонные и планктонные организмы. На подводных возвышенностях Ямато и свале глубин Юго-Западного Хонсю в его желудках наиболее часто встречаются головоногие моллюски (Cep-halopoda) − кальмар-светлячок Watasenia scintillans и командорский кальмар Berryteuthis magister, десятиногие раки (Decapoda), в том числе розовая креветка Pandalus eous и японский краб-стригун Chionoecetes japonicus, а также планктонные ракообразные − гиперииды (Hyperiidea), эвфаузииды (Euphausiacea), мизиды (Mysidacea) (Minami, 2000; Okiyama, 2004; Kono et al., 2008). В южнокорейских водах основу рациона M. gibber по массе составляют декаподы, преимущественно крабы (Brachyura) – 38.5% и рыбы – 18.9% (Choi et al., 2009), однако к основной пище бычка авторы относят неидентифицированных амфипод (Amphipoda), головоногих моллюсков и крабов, имеющих наибольшие индексы относительной значимости, и при этом характеризуют его как мезопелагофага.
Результаты наших исследований показали, что на материковом склоне северо-западной части Японского моря в число ведущих компонентов корма мягкого бородавчатого бычка наряду с массовыми видами нектобентоса (северная креветка Pandalus borealis), нектона (кальмары рода Gonatopsis) и планктона (эвфаузиида Thysanoessa longipes) входят бентосные беспозвоночные – многощетинковые черви (Polychaeta) и амфиподы-гаммариды (Gammaridea) (табл. 3). Для молоди бычка TL 11−15 см эти мелкие донные гидробионты служат главной пищей, а северная креветка, гипериида Themisto japonica, эвфаузииды и брюхоногие моллюски (Gastropoda) – второстепенной. С увеличением размеров рыб доля бентоса (особенно гаммарид) в их рационе заметно сокращается, но возрастает доля креветок, кальмаров и эвфаузиид. Взрослые особи TL 21−25 см переходят на потребление в основном креветок и кальмаров, используя в качестве дополнительной пищи червей, гаммарид и рыб. Приведённые данные свидетельствуют, что мягкий бородавчатый бычок является эврифагом, формирующим свой рацион за счёт представителей разных экологических групп животных и в трофологическом отношении очень близок к M. zonurus (Чучукало, 2006).
Таблица 3.
Состав пищи мягкого бородавчатого бычка Malacocottus gibber на материковом склоне северо-западной части Японского моря (март–июль), % массы
| Компонент пищи и другие показатели | Размерная группа, см | В среднем | ||
|---|---|---|---|---|
| 11−15 | 16−20 | 21−25 | ||
| Actiniaria | 0.5 | 3.6 | 0.2 | 2.1 |
| Polychaeta: | 24.2 | 20.0 | 7.8 | 15.6 |
| Eulalia sigeformis | 3.2 | 1.9 | 1.9 | 2.0 |
| Phyllodoce groenlandica | 7.8 | 3.4 | 1.1 | 2.7 |
| Aphrodita talpa | – | 0.6 | 2.0 | 1.2 |
| Glycera capitata | 2.7 | 0.4 | – | 0.3 |
| Flabelligera affinis | 2.9 | 6.5 | 0.1 | 3.9 |
| Maldanidae gen. sp. | – | 4.1 | – | 2.3 |
| Polychaeta varia | 7.6 | 3.1 | 2.7 | 3.2 |
| Amphipoda: | 41.7 | 12.5 | 5.1 | 11.3 |
| Lilljeborgia serratoides | 5.2 | – | – | 0.3 |
| Anonyx nugax | – | 1.7 | – | 1.0 |
| Anonyx sp. | 4.3 | 3.9 | 4.6 | 4.2 |
| Opisa eschrichti | – | 1.1 | – | 0.6 |
| Nicippe tumida | 13.6 | 1.3 | + | 1.5 |
| Syrrhoe crenulata | 2.4 | 1.2 | – | 0.8 |
| Gammaridea varia | 4.8 | 2.4 | 0.2 | 1.7 |
| Themisto japonica | 11.4 | 0.9 | 0.3 | 1.2 |
| Euphausiacea: | 7.3 | 17.3 | 1.1 | 10.6 |
| Thysanoessa longipes | 3.9 | 17.2 | 0.4 | 10.1 |
| Euphausiacea varia | 3.4 | 0.1 | 0.7 | 0.5 |
| Decapoda: | 11.7 | 22.6 | 49.0 | 32.1 |
| Pandalus borealis | 11.7 | 15.3 | 43.6 | 25.9 |
| Eualus townsendi | – | 0.3 | 1.7 | 0.8 |
| Spirontocaris brevidigitata | – | 2.6 | – | 1.5 |
| Argis toyamaensis | – | – | 1.7 | 0.6 |
| Crangon communis | – | 3.0 | - | 1.7 |
| Chionoecetes opilio | – | 0.4 | 1.5 | 0.8 |
| Decapoda varia | – | 1.0 | 0.5 | 0.8 |
| Gastropoda: | 7.5 | 5.4 | + | 3.4 |
| Cryptonatica sp. | 7.3 | 0.7 | – | 0.7 |
| Gastropoda varia | 0.2 | 4.7 | + | 2.7 |
| Bivalvia: | 0.8 | 5.4 | 1.6 | 3.6 |
| Yoldia sp. | 0.8 | 4.0 | 1.1 | 2.7 |
| Bivalvia varia | - | 1.4 | 0.5 | 0.9 |
| Cephalopoda: | 0.9 | 9.3 | 25.4 | 15.0 |
| Gonatopsis sp. | 0.9 | 9.3 | 25.4 | 15.0 |
| Ophiuroidea | 1.8 | 2.0 | 1.9 | 2.0 |
| Pisces: | – | – | 6.5 | 2.5 |
| Bothrocara hollandi | – | – | 2.5 | 1.0 |
| Pisces varia | – | – | 4.0 | 1.5 |
| Прочие | 3.6 | 1.9 | 1.4 | 1.8 |
| Средний суточный рацион, % массы тела | 2.3 | 2.2 | 3.0 | 2.5 |
| Число желудков, шт. | 64 | 155 | 91 | 310 |
| Доля пустых желудков, % | 20.3 | 7.7 | 8.8 | 10.6 |
Региональная изменчивость питания M. gibber прослеживается не только при сравнении данных из южной и северо-западной части Японского моря, но и в пределах рассматриваемой нами акватории. Так, в зал. Петра Великого в его пище доминируют полихеты (28.2%) и гаммариды (20.9%), составляющие в сумме с другими донными беспозвоночными >60%, а северная креветка (10.4%) и кальмары (6.7%) имеют второстепенное значение (рис. 5а). Иная картина наблюдается в водах Северного Приморья (рис. 5б), где в рационе бычка лидируют креветка (27.9%) и кальмары (16.1%), а доля полихет (14.0%), гаммарид (8.6%), как и всего бентоса (34.4%), значительно уступает таковой в заливе. Следует также отметить различия в потреблении обыкновенного краба-стригуна Chionoecetes opilio. Этот массовый вид, обитающий в основном на глубинах <400 м, в целом не играет существенной роли в питании мягкого бородавчатого бычка, однако на материковом склоне залива его молодь составляет заметную часть содержимого желудков рыб (5.6%), тогда как в водах Северного Приморья его доля ничтожно мала (0.2%). Перечисленные различия обусловлены, по-видимому, региональными особенностями кормовой базы бычка и в первую очередь – разным уровнем обилия потребляемых им видов декапод и головоногих моллюсков. Известно, что на материковом склоне Северного Приморья удельная биомасса кальмаров рода Gonatopsis в придонном слое воды превышает таковую в зал. Петра Великого в 1.6 раза (Шунтов и др., 2014). Гораздо выше в этом районе и удельная биомасса северной креветки – в 4.4 раза, в то время как у краба-стригуна она в 3.4 раза ниже, чем в заливе (Колпаков и др., 2018).
Рис. 5.
Состав пищи (% массы) мягкого бородавчатого бычка Malacocottus gibber в весенне-летний период в зал. Петра Великого (а) и в водах Северного Приморья (б–г): а, б − весенне-летний период, в – март–май, г – июль; компоненты пищи: 1 – Polychaeta, 2 – Gammaridea, 3 – Euphausiacea, 4 – Pandalus borealis, 5 – Chionoecetes opilio, 6 – Gastropoda, 7 – Bivalvia, 8 – Cephalopoda, 9 – Pisces, 10 – прочие.
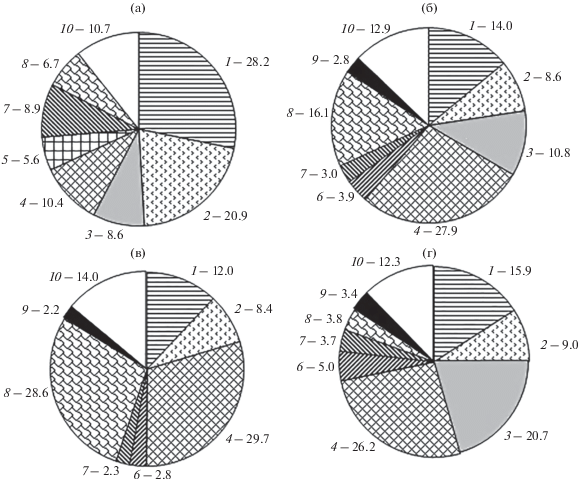
Сезонная динамика пищевого спектра M. gibber менее выражена, чем размерно-возрастная и региональная. В частности, в водах Северного Приморья значительные сезонные различия обнаружены только в потреблении кальмаров и эвфаузиид (рис. 5в, 5г). Соотношение этих компонентов в рационе бычка от весны к лету меняется в противофазе, при этом резкое падение доли кальмаров в пище (с 28.6% в марте−мае до 3.8% в июле) почти полностью компенсируется ростом доли эвфаузиид (соответственно с 0.7 до 20.7%) и отчасти бентосных беспозвоночных. Выявленные изменения являются, очевидно, следствием батиметрических различий в структуре кормовой базы бычка. Хотя рассматриваемый вид не совершает протяжённых сезонных миграций, в тёплый период года в 1.5−2.0 раза увеличивается плотность его концентрации на глубинах 300−500 м (табл. 1), где удельная биомасса кальмаров рода Gonatopsis в 5.7 раза ниже, чем в диапазоне 500−700 м (Шунтов и др., 2014). Вместе с тем в верхнем отделе материкового склона в весенне-летний период происходит массовое развитие эвфаузиид (Долганова, 2001), образующих в светлое время суток придонные скопления, доступные для демерсальных рыб.
По нашим оценкам, величина суточного рациона исследованных размерных групп мягкого бородавчатого бычка составляет 2.2−3.0% (в среднем − 2.5%) массы тела (табл. 3). Сезонные различия этого показателя не велики (2.8 и 2.2% весной и летом), что, вероятно, связано с обитанием бычка в относительно стабильных абиотических условиях материкового склона.
ВЫВОДЫ
1. В северо-западной части Японского моря мягкий бородавчатый бычок обитает в основном на глубине от 160 до 940 м. В южном районе, ниже траверза м. Золотой, начинает встречаться с меньших глубин, чем в северном, у материкового побережья Татарского пролива. Концентрации рыб в южном районе также несколько мельче, а их плотность выше.
2. В течение года повсеместно основная масса мягкого бородавчатого бычка предпочитает глубины >300 м. Сезонные различия в распределении проявляются в основном в смещении в холодный период концентраций на несколько большие глубины материкового склона. В южном районе наиболее заселёнными в тёплый период является диапазон 301−500 м, в холодный – > 400 м. В северном районе постоянно наибольшие концентрации тяготеют к глубинам 501−700 м, причём в холодный период их плотность повышается за счёт подхода рыб с меньших глубин.
3. В южном районе мягкий бородавчатый бычок встречается при температуре воды 0.1–2.6°С, в северном – при 0.1–2.2°С. В обоих районах в холодный период года он тяготеет к меньшим значениям температурного фона.
4. Мягкий бородавчатый бычок достигает TL 31 см; максимального для вида размера, вероятно, могут достигать особи обоих полов; созревает при TL 15−18 см. Средние размеры рыб в уловах в южном и северном районе северо-западной части Японского моря близки – соответственно 18.0 и 18.1 см; при этом в северном районе доля молоди, как и взрослых особей, несколько выше. В целом в популяции соотношение самки : самцы составляет 1.5 : 1.0. В период созревания доля самцов повышается, хотя и не достигает равного с самками. Среди взрослых рыб прослеживается тенденция возрастания доли самок с увеличением длины.
5. Мягкий бородавчатый бычок является эврифагом. Основу рациона молоди TL 11−15 см составляют полихеты и гаммариды, взрослых особей TL 16−20 см – полихеты, эвфаузииды и северная креветка, TL 21−25 см – креветка и кальмары рода Gonatopsis. Региональная и сезонная изменчивость состава пищи бычка обусловлена, по-видимому, особенностями кормовой базы. В весенне-летний период величина суточного рациона бычка составляет в среднем 2.5% массы тела, при этом значительной размерно-возрастной и сезонной динамики интенсивности питания не наблюдается.
Список литературы
Борец Л.А. 2000. Аннотированный список рыб дальневосточных морей. Владивосток: ТИНРО-центр, 192 с.
Глубоков А.И., Глубоковский М.К., Ковачева Н.П. 2019. Новые данные о мягком бычке Malacocottus zonurus (Psychrolutidae) из северо-западной части Берингова моря // Вопр. ихтиологии. Т. 59. № 3. С. 360–363. https://doi.org/10.1134/S0042875219030068
Долганова Н.Т. 2001. Состав, сезонная и межгодовая динамика планктона северо-западной части Японского моря // Изв. ТИНРО. Т. 128. Ч. III. С. 810−889.
Зуенко Ю.И. 1994. Типы термической стратификации вод на шельфе Приморья // Комплексные исследования морских гидробионтов и условий их обитания. Владивосток: Изд-во ТИНРО. С. 20−39.
Зуенко Ю.И. 2008. Промысловая океанография Японского моря. Владивосток: Изд-во ТИНРО-центр, 227 с.
Калчугин П.В., Бойко М.И., Соломатов С.Ф., Черниенко Э.П. 2016. Современное состояние ресурсов донных и придонных видов рыб в российских водах Японского моря // Изв. ТИНРО. Т. 184. С. 54–69.
Ким Сен Ток. 2001. Зимние миграции шельфовых рыб в зону материкового склона юго-западного Сахалина // Вопр. ихтиологии. Т. 41. № 5. С. 593−604.
Колпаков Н.В., Корнейчук И.А., Надточий В.А. 2018. Современные данные по составу и распределению тралового макрозообентоса в российских водах Японского моря // Изв. ТИНРО. Т. 193. С. 33−49. https://doi.org/10.26428/1606-9919-2018-193-33-49
Линдберг Г.У., Красюкова З.В. 1987. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 5. Л.: Наука, 526 с.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. 1974. М.: Наука, 254 с.
Новиков Н.П., Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2002. Рыбы Приморья. Владивосток: Изд-во Дальрыбвтуз, 552 с.
Новикова Н.С. 1949. О возможности определения суточного рациона рыб в естественных условиях // Вестн. МГУ. № 9. С. 107−111.
Панченко В.В., Калчугин П.В., Соломатов С.Ф. 2016. Уточнение глубин обитания и максимальных размеров донных и придонных видов рыб в российских водах Японского моря // Вопр. ихтиологии. Т. 56. № 3. С. 264–283. https://doi.org/10.7868/S0042875216030152
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Пущина О.И. 2005. Питание и пищевые взаимоотношения массовых видов донных рыб в водах Приморья в весенний период // Изв. ТИНРО. Т. 142. С. 246−269.
Пущина О.И. 2014. О питании некоторых глубоководных рыб в зал. Петра Великого (Японское море) // Тр. II Междунар. науч.-практ. конф. “Водные биоресурсы, аквакультура и экология водоемов”. Калининград: Изд-во КГТУ. С. 128−131.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. 2007. Рыбы российских вод Японского моря: аннотированный и иллюстрированный каталог. Владивосток: Дальнаука, 200 с.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2009. Рыбы залива Петра Великого. Владивосток: Дальнаука, 376 с.
Соломатов С.Ф. 2008. Состав и многолетняя динамика донных ихтиоценов северного Приморья: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр, 24 с.
Токранов А.М., Орлов А.М. 2001. Некоторые биологические особенности психролютовых рыб (Psychrolutidae) тихоокеанских вод юго-восточной Камчатки и северных Курильских островов. 2. Размерно-возрастной, половой состав и питание // Вопр. ихтиологии. Т. 41. № 5. С. 605–614.
Чучукало В.И. 2006. Питание и пищевые отношения нектона и нектобентоса в дальневосточных морях. Владивосток: Изд-во ТИНРО-центр, 483 с.
Чучукало В.И., Напазаков В.В. 1999. К методике определения суточных рационов питания и скорости переваривания пищи у хищных и бентосоядных рыб // Изв. ТИНРО. Т. 126. С. 160−171.
Шунтов В.П., Волвенко И.В., Кулик В.В., Бочаров Л.Н. 2014. Макрофауна бентали северо-западной части Японского моря: таблицы встречаемости, численности и биомассы. 1978−2010. Владивосток: Изд-во ТИНРО-центр, 748 с. https://doi.org/10.13140/2.1.3893.7287.
Яричин В.Г., Покудов В.В. 1982. Формирование структурных особенностей гидрофизических полей и течений в северной глубоководной части Японского моря // Тр. ДВНИИ. Вып. 96. С. 86–95.
Adachi T., Hagihara S., Itoh M. et al. 2009. Genetic population structure and morphological characters of Japanese psychrolutids of genus Malacocottus (Scorpaeniformes: Psychrolutidae) // Ichthyol. Res. V. 56. P. 323–329. https://doi.org/10.1007/s10228-009-0101-6
Amaoka K., Nakaya K., Yabe M. 1995. The fishes of Northern Japan. Sapporo: Kita-Nihon Kaiyo Center Co. Ltd, 391 p.
Choi J.H., Hong B.K., Jun Y.Y. et al. 2009. Feeding comparison of three deep-sea fish, Lumpenella longirostris, Malacocottus gibber and Bothrocara hollandi, in the East Sea // J. Kor. Fish. Soc. V. 42. № 2. P. 151−156.
Choi Y., Kim J.-H., Park J.-Y. 2003. Marine fishes of Korea. Seoul: Kyo–Hak Publ. Co. Ltd., 648 p.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2020. Eschmeyer’s catalog of fishes: genera, species, references. (http:// http://researcharchive.calacademy.org/research/Ichthyology/catalog/fishcatmain.asp. Version 10/2020)
Kono K., Minami T., Yamada H. et al. 2008. Bioaccumulation of tributyltin and triphenyltin compounds through the food web in deep offshore water // Coastal Mar. Sci. V. 32. № 1. P. 102−107.
Minami T. 2000. Predator-prey relationship and trophic levels of the pink shrimp, Pandalus eous, in the Yamato Bank, the Sea of Japan // J. Shellfish Res. V. 19. № 1. P. 553−554.
Nakabo T. (ed.). 2002. Fishes of Japan with pictorial keys to the species. Tokyo: Tokai Univ. Press, 1749 p.
Okiyama M. 2004. Deepest demersal fish community in the Sea of Japan: A review // Contr. Biol. Lab. Kyoto Univ. V. 29. P. 409−429.
Shinohara G., Yabe M., Amaoka K., Meguro T. 1992. A psychrolutid, Malacocottus gibber, collected from the mesopelagic zone of the Sea of Japan, with comments on its intraspecific variation // Jpn. J. Ichthyol. V. 38. № 4. P. 419–424.
Sohn M.H., Lee H., Hong B.K., Chun Y.Y. 2010. Seasonal variation of species composition by depths in deep sea ecosystem of the East Sea of Korea // J. Kor. Soc. Fish. Tech. V. 46. № 4. P. 376–391. https://doi.org/10.3796/KSFT.2010.46.4.376
Stevenson D.E. 2015. The validity of nominal species of Malacocottus (Teleostei: Cottiformes: Psychrolutidae) known from the Eastern North Pacific with a key to the species // Copeia. V. 103. № 1. P. 22−33. https://doi.org/10.1643/CI-14-074
Tsuruwaka Y., Shimada E. 2011. Rearing and spawning of the deep-sea fish Malacocottus gibber in the laboratory // Ichthyol. Res. V. 58. P. 188–190. https://doi.org/10.1007/s10228-010-0200-4
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


