Вопросы ихтиологии, 2022, T. 62, № 1, стр. 79-87
Возраст, рост, созревание и смертность бычка-травяника Zosterisessor ophiocephalus (Gobiidae) Каркинитского залива (Чёрное море)
Д. Н. Куцын 1, *, И. И. Чеснокова 1, О. Н. Данилюк 1, С. В. Статкевич 1, Э. Р. Аблязов 1, Р. Е. Белогурова 1
1 Институт биологии южный морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: makaira88@gmail.com
Поступила в редакцию 10.09.2020
После доработки 05.10.2020
Принята к публикации 15.10.2020
- EDN: CSBBPN
- DOI: 10.31857/S0042875221060114
Аннотация
Рассматривается половая и размерно-возрастная структура, рост, созревание и смертность бычка-травяника Zosterisessor ophiocephalus Каркинитского залива Чёрного моря. Соотношение самцов и самок в уловах 1.00 : 0.57; максимальная общая длина самок 23.1 см, возраст 5 лет, самцов − 24.4 см, 6 лет. Межполовые различия в росте не выявлены. Рассчитаны значения параметров уравнения Берталанфи: для обоих полов предельная длина составляет 28.7 см, масса – 199.9 г, коэффициент роста – 0.30 год–1; 50% самок созревают при длине 12.26 см, самцов – 12.99 см в возрасте 1+. Коэффициенты общей, естественной и промысловой смертности составляют соответственно 0.91, 0.61 и 0.30 год–1. Z. ophiocephalus Каркинитского залива отличается от средиземноморских популяций более высоким темпом роста, бóльшими предельными размерами, более ранними сроками созревания.
Бычок-травяник Zosterisessor ophiocephalus – эвригалинный демерсальный вид семейства бычковых (Gobiidae); представитель монотипического рода. Распространён в Средиземном море и прилегающих частях Атлантического океана. В Чёрном море зарегистрирован у берегов Крыма, Кавказа, Болгарии, Румынии и Турции, в северо-западной части моря, в Егорлыцком заливе, Тилигульском, Сухом и Днепровском лиманах, дельте Дуная, Варненском и Бургасском озерах, в западной части Азовского моря и Сиваше. В пресных водах не встречается. Средой обитания служат скопления морских трав, преимущественно рода Zostera. В Сиваше и Каркинитском заливе достигает высокой численности и является объектом местного промысла (Световидов, 1964).
Биологические особенности вида изучены слабо. Известны работы, посвящённые изучению влияния загрязнения на некоторые биохимические и морфофизиологические показатели Z. ophiocephalus из акватории Туниса (Mabrouk et al., 2014; Louiz et al., 2017) и Венецианской лагуны (Адриатическое море) (Livingstone et al., 1995). Авторы указывают, что Z. ophiocephalus может служить видом-индикатором состояния окружающей среды в связи с оседлым образом жизни и высокой чувствительностью биохимических параметров к загрязнениям. Имеются данные по размерно-возрастной структуре популяции, росту и воспроизводству бычка-травяника Измирского залива и северной части Эгейского моря (Akyol, 2003; Gurkan et al., 2010), Новиградского моря (Восточная Адриатика) (Đođo et al., 2013, 2020), зал. Габес (Центральное Средиземноморье) (Hajji et al., 2013). При этом возраст, рост, созревание и смертность Z. ophiocephalus Чёрного моря остаются неизученными.
В Каркинтском заливе бычок-травяник достигает высокой численности (Прищепа и др., 2018), в значительном количестве регистрируется в качестве прилова при промысле креветок Palaemon, но его специализированный промысел не ведётся в связи с отсутствием сведений о биологических особенностях вида. Без этих знаний невозможно рациональное промысловое использование Z. ophiocephalus, они необходимы также и для понимания экологических закономерностей изменчивости вида, его адаптации к условиям северо-западной части Чёрного моря, что особенно актуально в условиях глобальных климатических изменений.
Цель данной работы – изучить половую и размерно-возрастную структуру, рост, созревание и смертность Z. ophiocephalus Каркинитского залива, проанализировать эколого-географическую изменчивость биологических особенностей вида.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в июне 2018 г. в юго-восточной части Каркинитского залива в районе сёл Аврора (45°47′32′′ с.ш. 33°15′16′′ в.д.), Портовое (45°53′27′′ с.ш. 33°27′37′′ в.д.) и Кумово (45°54′58′′ с.ш. 33°36′9′′ в.д.) (рис. 1). В качестве орудий лова использовали вентеря с размером ячеи 7.5 мм, глубина постановки 1.0–1.5 м. Объём исследованного материала составил 375 экз.
Биологический анализ включал измерение общей длины (TL) с точностью 0.1 см, общей массы тела (W) с точностью 0.1 г. Определяли пол и стадию зрелости гонад по 5-балльной шкале (Правдин, 1966). Экземпляр считали половозрелым, если его гонады находились на III стадии зрелости и выше. Возраст определяли по отолитам. После очистки и просушки их просматривали в отражённом свете на тёмном фоне при 20-кратном увеличении. Годовым кольцом считали границу между внешним краем опаковой зоны и внутренним краем транслюцентной зоны, начинающей формироваться вскоре после сезона размножения (Granzotto et al., 2003). Радиус отолита (OR) определяли как прямую, соединяющую ядро отолита и постростральный край (рис. 2). Обратные расчисления проводили по формуле Фрейзера−Ли (Lee, 1920): Li = [Si(Lc – c)/Sc] + c, где Si – радиус годового кольца, соответствующий возрасту i; Lc – TL рыбы при поимке, Sc – радиус отолита (OR) при поимке, c – интерсепт линейной регрессии TL−OR. Для описания линейного и весового роста применяли уравнения Берталанфи (Bertalanffy, 1938; Рикер, 1979; Мина, Клевезаль, 1976): L = L∞[1 – e–k(t – to)] и W = W∞[1 – e–k(t – to)]b, где L∞ и W∞ – асимптотическая длина и масса; k – константа, характеризующая скорость приближения к L∞ или W∞; t0 – возраст рыбы, когда её длина и масса в рассматриваемой модели равна 0; b – показатель степени зависимости между длиной и массой (W = aTLb); рассчитывали индекс роста для длины и массы (Pauly et al., 1988): φ′ = lg k + + 2 lg L∞ и φ = lg k + (2 lg W∞)/3. Параметры уравнений Берталанфи рассчитывали в программе Statistica 12 методом наименьших квадратов.
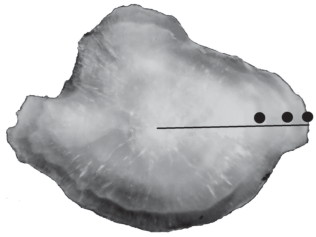
Рис. 2.
Отолит трехгодовалой самки бычка-травяника Zosterisessor ophiocephalus TL 17.4 см: (⚫) − годовые кольца, ( ) – радиус отолита.
) – радиус отолита.
При изучении созревания использовали логистическую модель: YTL = 100/[1 + exp–a(TL–b)], где YTL – доля половозрелых особей, a – угловой коэффициент, b – точка перегиба, соответствующая длине, при которой созревают 50% особей (TL50) в принятой модели (Shiraishi et al., 2010).
Для определения общей смертности (Z) строили линейную регрессию: ln Nt = a + bt, где t – возраст, Nt – численность особей в возрасте t. В данной модели Z = –b (Cadima, 2003). Естественную смертность (M) определяли по эмпирической формуле (Pauly, 1980): log M = –0.0066 – 0.279 log L∞ + + 0.6543 log k + 0.463 log T, где T – среднегодовая температура поверхности моря. Промысловую смертность (F) рассчитывали как разницу между общей и естественной смертностью: F = Z – M (Рикер, 1979).
При анализе полового состава применяли критерий χ2; для оценки различий между полами по длине, массе и возрасту использовали непараметрический U-критерий Манна−Уитни. Статистический анализ выполнен с помощью программных пакетов MS Excel и Statistica 12.
РЕЗУЛЬТАТЫ
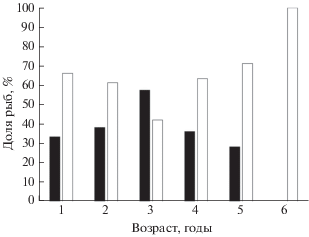
Соотношение полов (рис. 3) в уловах бычка-травяника заметно смещено в сторону самцов – 1.00 : 0.57; отличия от 1 : 1 статистически значимые (χ2 = = 26.7, df = 1, p < 0.05). Преобладание самцов наблюдается среди годовиков (χ2 = 23.2, df = 1, p = = 0.005) и 2-годовиков (χ2 = 4.85, df = 1, p = 0.028). Отличия от соотношения 1 : 1 в старших возрастных группах не являются статистически значимыми: 3-годовики − χ2 = 0.62, df = 1, p = 0.430; 4-годовики − χ2 = 3.57, df = 1, p = 0.058; 5-годовики − χ2 = 3, df = 1, p = 0.080; 6-годовики − χ2 = 1, df = 1, p = 0.320.
Рис. 3.
Соотношение самок (◼) и самцов (◻) в разных возрастных группах бычка-травяника Zosterisessor ophiocephalus Каркинитского залива.
Размерно-возрастная структура. Длина самок варьировала в пределах 7.2−23.1 (в среднем 11.8 ± 0.3) см, самцов – 6.7−24.4 (11.7 ± 0.3) см (рис. 4а). Межполовые различия распределения по длине статистически не значимы (U-критерий, nf = 128, nm = 225, p = 0.45). Для обоих полов средняя длина составила 11.8 ± 0.2 см (n = 353).
Рис. 4.
Размерно-возрастной состав самок и самцов бычка-травяника Zosterisessor ophiocephalus в уловах в Каркинитском заливе: а – длина (TL), б – масса, в – возраст; обозначения см. на рис. 3.
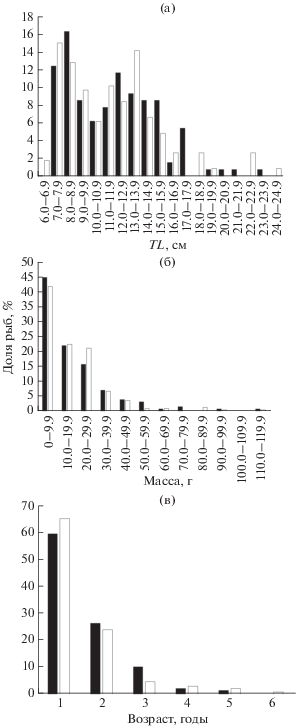
Масса самок варьировала в пределах 3.0–115.2 (19.0 ± 1.7) г, самцов – 2.5–138.2 (19.5 ± 1.4) г (рис. 4б). Межполовые различия распределения по массе не достоверны (U-критерий, nf = 128, nm = 225, p = 0.94). Для обоих полов средняя масса равна 19.3 ± 1 г (n = 353).
Максимальный возраст самок составляет 5 лет, самцов – 6 лет (рис. 4в); средний возраст соответственно – 1.60 ± 0.07 и 1.55 ± 0.06 года. Межполовые различия распределения по возрасту также не достоверны (U-критерий, nf = 128, nm = 225, p = 0.27). Для обоих полов средний возраст составил 1.57 ± 0.05 года.
Размерно-возрастной ключ составлен по результатам определения возраста у 375 особей; в связи с отсутствием достоверных различий в размерно-возрастной структуре самок и самцов данные для обоих полов объединены (табл. 1).
Таблица 1.
Размерно-возрастной ключ бычка-травяника Zosterisessor ophiocephalus Каркинитского залива (объединены оба пола)
| Длина (TL), см | Возраст, годы | Число рыб, экз. | |||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| 6.0−6.9 | 4 | 4 | |||||
| 7.0−7.9 | 55 | 55 | |||||
| 8.0−8.9 | 58 | 58 | |||||
| 9.0−9.9 | 39 | 39 | |||||
| 10.0−10.9 | 26 | 26 | |||||
| 11.0−11.9 | 28 | 7 | 35 | ||||
| 12.0−12.9 | 21 | 14 | 35 | ||||
| 13.0−13.9 | 2 | 37 | 39 | ||||
| 14.0−14.9 | 1 | 23 | 2 | 26 | |||
| 15.0−15.9 | 1 | 12 | 10 | 23 | |||
| 16.0−16.9 | 2 | 7 | 9 | ||||
| 17.0−17.9 | 1 | 5 | 6 | ||||
| 18.0−18.9 | 2 | 4 | 6 | ||||
| 19.0−19.9 | 3 | 3 | |||||
| 20.0−20.9 | 1 | 1 | |||||
| 21.0−21.9 | 1 | 1 | |||||
| 22.0−22.9 | 1 | 5 | 6 | ||||
| 23.0−23.9 | 1 | 1 | |||||
| 24.0−24.9 | 2 | 2 | |||||
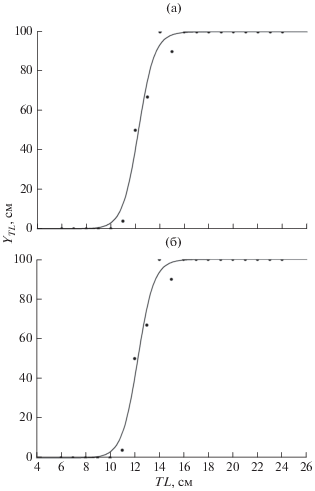
Темп роста и половое созревание. Наибольший абсолютный прирост длины Z. ophiocephalus наблюдается до полового созревания: к концу 1-го года жизни самки и самцы достигают TL 9.3 и 9.6 см (табл. 2). Половое созревание самок описывается уравнением YTL = 100/[1 + e–1.53(TL– 12.26)] (рис. 5а), самцов − YTL =100/[1 + e–0.79(TL– 12.99)] (рис. 5б); межполовые различия в динамике созревания выражены слабо. Созревание как самок, так и самцов начинается при TL 10 см в возрасте 1+ и заканчивается при TL 16 см в возрасте 3+; у самок TL50 = 12.26 ± 0.20 см, у самцов – 12.99 ± 0.30 см. После полового созревания темп роста закономерно замедляется; на 2-м году жизни прирост составляет 4.0–4.5 см, на 3–6-м снижается с 2.7 до 1.5 см.
Таблица 2.
Длина и масса (М ± SE) самцов и самок бычка-травяника Zosterisessor ophiocephalus разного возраста в уловах в Каркинитском заливе
| Возраст, годы | Самки | Самцы | ||||
|---|---|---|---|---|---|---|
| Длина (TL), см | Масса, г | n, экз. | Длина (TL), см | Масса, г | n, экз. | |
| 1 | 9.3 ± 0.2 | 8.1 ± 0.6 | 81 | 9.6 ± 0.2 | 5.35 ± 0.5 | 152 |
| 2 | 13.9 ± 0.2 | 22.5 ± 1.2 | 36 | 13.7 ± 0.2 | 25.7 ± 1.8 | 56 |
| 3 | 16.3 ± 0.3 | 43.9 ± 3.8 | 14 | 16.5 ± 0.4 | 36.6 ± 5.8 | 11 |
| 4 | 19.0 ± 0.7 | 67.2 ± 6.6 | 3 | 19.4 ± 0.6 | 65.3 ± 5.8 | 7 |
| 5 | 22.2 ± 0.9 | 104.6 ± 10.7 | 2 | 22.8 ± 0.1 | 96.5 ± 16.4 | 5 |
| 6 | 24.3 ± 0.1 | 127.5 ± 8.3 | 2 | |||
Примечание. Здесь и в табл. 3: М ± SE – среднее значение и стандартная ошибка.
Рис. 5.
Доля половозрелых (YTL) самок (а) и самцов (б) бычка-травяника Zosterisessor ophiocephalus в зависимости от длины (TL) в Каркинитском заливе.
Наибольшие ежегодные приросты массы тела (до 30–38 г) наблюдаются в возрасте 3−5 лет. Уравнения зависимости массы (W, г) от длины (TL, см) у самок, самцов и у обоих полов имеют вид соответственно: W = 0.01TL2.93 (R2 = 0.91), W = 0.01TL2.89 (R2 = 0.97), W = 0.01TL2.95 (R2 = = 0.95). Из уравнений следует, что весовой рост Z. ophiocephalus близок к изометрическому (b = 2.95, пропорции тела не меняются с увеличением размеров) (Рикер, 1979). Межполовые различия не выражены.
Обратные расчисления. Рост возрастрегистрирующих структур пропорционален увеличению размеров тела (Рикер, 1979). Это свойство позволяет использовать их для обратных расчислений длины рыбы. Связь общей длины тела (TL, см) c радиусом отолита (OR, мм) у Z. ophiocephalus описывается линейной регрессией: TL = 7.66OR – 2.34 (R2 = = 0.87, n = 223). Из табл. 3 следует, что результаты обратных расчислений в значительной степени соответствуют наблюдённым данным: во всех возрастных группах различия общей длины не достоверны (U-критерий, p > 0.20).
Таблица 3.
Эмпирические и расчисленные значения длины (TL) бычка-травяника Zosterisessor ophiocephalus Каркинитского залива (оба пола)
| Возраст, годы | Эмпирические данные | Обратные расчисления | ||
|---|---|---|---|---|
| TL, см | n, экз. | TL, см | n, экз. | |
| 1 | 9.49 ± 0.12 | 237 | 9.45 ± 0.13 | 222 |
| 2 | 13.80 ± 0.12 | 94 | 13.90 ± 0.15 | 86 |
| 3 | 16.36 ± 0.24 | 25 | 16.98 ± 0.56 | 15 |
| 4 | 19.30 ± 0.45 | 10 | 21.65 ± 0.38 | 3 |
| 5 | 22.60 ± 0.24 | 7 | 22.90 ± 0.28 | 3 |
| 6 | 24.33 ± 0.10 | 2 | 24.23 | 1 |
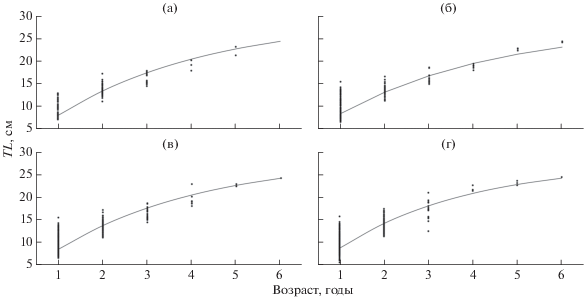
Моделирование роста. Уравнения Берталанфи, описывающие линейный и весовой рост Z. ophiocephalus Каркинитского залива, имеют следующий вид: самки − TL = 29.3[1 – e–0.29(t+ 0.11)] и W = = 218.2[1 – e–0.29(t+ 0.11)]2.93, самцы − TL = 28.0[1 – – e–0.28(t+ 0.29)] и W = 167.4[1 – e–0.28(t+ 0.29)]2.89, оба пола по наблюдённым данным − TL = 28.7[1 – – e–0.30(t+ 0.18)] и W = 199.9[1 – e–0.30(t+ 0.18)]2.95, оба пола по результатам обратных расчислений − TL = = 27.4[1 – e–0.34(t+ 0.09)] и W = 174.9[1 – e–0.34(t+ 0.18)]2.95. Из результатов моделирования следует, что разница в линейном росте самок и самцов не выражена (рис. 6а, 6б). Значения параметров уравнений, рассчитанных по наблюдённым данным, соответствуют величинам, полученным в результате обратных расчислений (рис. 6в, 6г). Высокие значения коэффициента k (0.30 год–1 для обоих полов) свидетельствуют о быстром достижении предельных размеров, что характерно для видов с коротким жизненным циклом: 50% L∞ (14.4 см) Z. ophiocephalus достигает уже к концу 2-го года жизни.
Рис. 6.
Кривые линейного роста (TL) бычка-травяника Zosterisessor ophiocephalus Каркинитского залива, описываемые уравнением Берталанфи: а – самки, б – самцы; в, г – оба пола (в − по наблюдённым данным, г – по данным обратных расчислений).
Смертность. Коэффициент общей смертности обоих полов Z. ophiocephalus в Каркинитском заливе составляет 0.91 год–1, самок − 0.93 год–1, самцов − 0.83 год–1. Коэффициент естественной смертности зависит от темпа роста и предельных размеров; межполовые различия этих показателей у Z. ophiocephalus практически отсутствуют, поэтому значения М у самок и самцов близки − соответственно 0.60 и 0.61 год–1; для обоих полов − 0.61 год–1. Коэффициент промысловой смертности для обоих полов, самок и самцов равен соответственно 0.30, 0.34 и 0.23 год–1.
ОБСУЖДЕНИЕ
Размерно-возрастная и половая структура популяции, рост, созревание и смертность являются ключевыми параметрами, характеризующими жизненный цикл рыб. Этим показателям свойственна определённая пластичность в связи с условиями обитания (Никольский, 1974). Поэтому анализ их эколого-географической изменчивости представляет интерес для понимания закономерностей эволюционного процесса.
По нашим и опубликованных данным (Akyol, 2003; Gurkan et al., 2010; Đođo et al., 2013, 2020; Hajji et al., 2013), половой диморфизм у Z. ophiocephalus на всём протяжении ареала вида практически не выражен. При этом в третичном соотношении полов преобладают самцы (со значимым отличием от 1 : 1): зал. Габес – 1 : 0.74 (χ2 = 17.5, df = 1, p < 0.05) (Hajji et al., 2013), зал. Измир – 1 : 0.71 (χ2 = 21.9, df = 1, p < 0.05) (Akyol, 2003), Каркинитский залив – 1 : 0.57 (χ2 = 26.7, df = 1, p < 0.05) (наши данные). Преобладание самцов может быть следствием дифференциальной смертности молоди или селективности орудий лова по отношению к полу (например, в связи с этологическими различиями). Вероятно, асимметрия полового состава связана со сложной тактикой размножения и заботой самцов о потомстве. Как правило, строительством гнезда и охраной кладки занимается крупный самец (TL > 15 см, старше 3 лет). При этом в оплодотворении кладки принимают участие от двух до шести мелких самцов, не строящих гнёзд самостоятельно, но характеризующихся более высоким качеством половых продуктов (Mazzoldi et al., 2000; Pastres et al., 2002). Таким образом, в процессе нереста у Z. ophiocephalus принимают участие две функционально и морфологически различные группы самцов. С одной стороны, такая стратегия обеспечивает высокую выживаемость потомства, с другой – увеличивается рекомбинация генетического материала и эволюционная пластичность. В связи с этим асимметрия в третичном половом составе обеспечивает оптимальное соотношение самцов разных функциональных групп, носит адаптивный характер и закрепляется отбором. Однако для установления действительной причины преобладания самцов необходимы дополнительные исследования.
Рост пойкилотермных животных как проявление метаболизма тесно связан с температурой окружающей среды. В пределах ареала вида снижение средней температуры воды в высокоширотном направлении в большинстве случаев сопровождается увеличением предельной длины L∞, максимального возраста и индексов роста φ′ и φ. При этом коэффициент k, пропорциональный скорости катаболизма в модели Берталанфи, как правило, снижается (Pauly, 1981). В результате наблюдается снижение темпа роста при увеличении максимальных и средних размеров, сроков созревания и продолжительности жизни в направлении к высокоширотным границам ареала. Параметры роста Z. ophiocephalus отчасти согласуются с общими закономерностями: в северном направлении закономерно увеличиваются значения L∞ и W∞ (табл. 4). Однако величина коэффициента k в Каркинитском заливе, вопреки ожидаемому снижению, выше, чем у южных границ ареала, в зал. Габес (0.30 против 0.20 год–1), т.е. увеличение максимальных размеров сопровождается не снижением темпа линейного роста, а увеличением. Это находит отражение в индексах линейного и весового роста, значения которых наибольшие в Каркинитском заливе. Продолжительность жизни при этом на всех рассматриваемых участках ареала остаётся в пределах 5–6 лет (Akyol, 2003; Hajji et al., 2013).
Таблица 4.
Параметры уравнений Берталанфи и индексы роста бычка-травяника Zosterisessor ophiocephalus из разных частей ареала
| Район (источник информации) | Пол | L∞, см | k, год–1 | W∞, г | a | b | t0, год | φ′ | φ |
|---|---|---|---|---|---|---|---|---|---|
| Чёрное море, Каркинитский залив (наши данные) | Самки | 29.3 | 0.29 | 218.2 | 0.011 | 2.93 | –0.11 | 2.40 | 1.02 |
| Самцы | 28.0 | 0.28 | 167.4 | 0.011 | 2.89 | –0.29 | 2.34 | 0.93 | |
| Оба пола | 28.7 | 0.30 | 199.9 | 0.010 | 2.95 | –0.18 | 2.39 | 1.04 | |
| Эгейское море, зал. Измир (Akyol, 2003) | Оба пола | 27.4 | 0.17 | 0.009 | 3.06 | –2.12 | 2.11 | ||
| Средиземное море, зал. Габес (Hajji et al., 2013) | Самки | 24.1 | 0.20 | 157.8 | 0.020 | 2.73 | –0.80 | 2.07 | 0.77 |
| Самцы | 24.8 | 0.19 | 150.9 | 0.025 | 2.81 | –0.91 | 2.07 | 0.73 | |
| Оба пола | 24.5 | 0.20 | 155.6 | 0.020 | 2.81 | –0.81 | 2.08 | 0.76 |
Высокий темп роста Z. ophiocephalus в Каркинитском заливе по сравнению с более южными популяциями сопровождается сокращением сроков созревания. В зал. Габес возраст полового созревания бычка-травяника составляет 2.9−3.5 лет при TL 12.7–13.9 см (Hajji et al., 2013), в то время как в Каркинитском заливе он массово созревает в возрасте 1+ при той же длине, что способствует увеличению популяционной плодовитости.
Высокие значения k и высокий темп роста Z. ophiocephalus Каркинитского залива указывают на факторы, влияние которых обратно направлено температуре. В качестве одного из них следует указать высокую продуктивность этого района, определяющую состояние кормовой базы. Так, среднегодовая первичная продукция мелководного и прогреваемого Каркинитского залива в 1998−2007 гг. составляла в среднем 188 г С/м2 в год (Финенко и др., 2010). При этом объём первичной продукции в Эгейском море в 1998−2001 гг. варьировал в пределах 125–144, а в районе зал. Габес – 158–164 г С/м2 в год (Bosc et al., 2004). Нельзя исключать влияние солёности на рост Z. ophiocephalus: в Чёрном море она в два раза ниже, чем Средиземном (15–18 против 36–38‰). Снижение солёности до 8–20‰ способствует увеличению темпа роста морских видов рыб. Чаще всего это связано с уменьшением энергетических трат на осморегуляцию (Boeuf, Payan, 2001).
В контексте глобального потепления вероятно преобразование биологических особенностей Z. ophiocephalus Каркинитского залива. Тренд изменения средней температуры поверхности Чёрного моря составляет 0.06°C в год (Sakalli, Başusta, 2018). В связи с аридизацией возможно снижение объёма пресноводного стока и осолонение Чёрного моря. Предполагается, что условия обитания в Чёрном море станут в большей степени соответствовать современным средиземноморским. В таком случае вектор изменения биологических особенностей Z. ophiocephalus будет направлен в сторону снижения предельных размеров, массы и темпа линейного и весового роста.
Результаты исследования свидетельствуют, что Z. ophiocephalus Каркинитского залива отличается от средиземноморских популяций более высоким темпом роста, бóльшими максимальными размерами и массой, ранними сроками созревания. По всей видимости, это связано с температурными условиями и продуктивностью исследуемого района. Представленные в работе сведения расширяют представления о закономерностях адаптации средиземноморских мигрантов к условиям Чёрного моря и могут послужить отправной точкой в мониторинге состояния популяции Z. ophiocephalus, что особенно важно в условиях глобальных климатических изменений.
Список литературы
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Никольский Г.В. 1974. Теория динамики стада рыб. М.: Пищ. пром-сть, 448 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 391 с.
Прищепа Р.Е., Болтачев А.Р., Карпова Е.П. 2018. Разнообразие бычковых рыб (Perciformes: Gobiidae) Каркинитского залива (Черноморское побережье Крымского полуострова) // Матер. междунар. науч.-практ. конф. “Биологическое разнообразие: изучение, сохранение, восстановление, рациональное использование”. Симферополь: Ариал. С. 259–265.
Рикер У.Е. 1979. Методы оценки и интерпретации биологических показателей популяций рыб. М.: Пищ. пром-сть, 408 с.
Световидов А.Н. 1964. Рыбы Черного моря. М.: Наука, 550 с.
Финенко З.З., Суслин В.В., Чурилова Т.Я. 2010. Оценка продуктивности фитопланктона Черного моря по спутниковым данным // ДАН. Т. 432. № 6. С. 845–848.
Akyol O. 2003. Age, growth and reproduction period of grass goby (Zosterisessor ophiocephalus Pallas 1811) in the Bay of Izmir (Aegean Sea) // Arch. Fish. Mar. Res. V. 50. № 2. P. 220–224.
Bertalanffy L., von. 1938. A quantitative theory of organic growth (Inquiries on growth laws II) // Human Biol. V. 10. P. 181−213.
Boeuf G., Payan P. 2001. How should salinity influence fish growth? // Comp. Biochem. Physiol. Pt. C: Toxicol. Pharmacol. V. 130. № 4. P. 411–423. https://doi.org/10.1016/S1532-0456(01)00268-X
Bosc E., Bricaud A., Antoine D. 2004. Seasonal and interannual variability in algal biomass and primary production in the Mediterranean Sea, as derived from 4 years of SeaWiFS observations // Global Biogeochem. Cycles. V. 18. № 1. P. 1–17. https://doi.org/10.1029/2003GB002034
Cadima E.L. 2003. Fish stock assessment manual // FAO Fish. Tech. Paper № 393. 161 p.
Đođo Ž., Dulčić J., Antolović N. 2013. Age and growth determination of the grass goby (Zosterisessor ophiocephalus Pallas, 1814) in the Novigrad Sea (Adriatic) // 48 Hrvatskii Međunarodni Simpozij Agronoma. Dubrovnik. P. 629−632.
Đođo Ž., Antolović N., Glavić N., Šprem J.S. 2020. Length-weight relationship of grass goby Zosterisessor ophiocephalus from Novigrad Sea-eastern Adriatic Sea // 55-th Croatian and 15-th Int. Symp. Agriculture. Vodice. P. 362.
Granzotto A., Franceschini G., Malavasi S. et al. 2003. Marginal increment analysis and Sr/Ca ratio in otoliths of the grass goby, Zosterisessor ophiocephalus // Ital. J. Zool. V. 70. № 1. P. 5−11. https://doi.org/10.1080/11250000309356489
Gurkan S., Bayhan B., Akcinar S.C., Taskavak E. 2010. Length-weight relationship of fish from shallow waters of Candarli Bay (North Aegean Sea, Turkey) // Pakistan J. Zool. V. 42. № 4. P. 495–498.
Hajji F., Ouannes-Ghorbel A., Ghorbel M., Jarboui O. 2013. Age and growth of the grass goby Zosterisessor ophiocephalus Pallas, 1811 in the Gulf of Gabes (Tunisia, central Mediterranean) // Acta Adriatica. V. 54. № 1. P. 27–39.
Lee R.M. 1920. A review of the methods of age and growth determinations in fishes by means of scales // Fish. Invest. London. Ser. II. V. 4. P. 1−35.
Livingstone D.R., Lemaire P., Matthews A. et al. 1995. Assessment of the impact of organic pollutants on goby (Zosterisessor ophiocephalus) and mussel (Mytilus galloprovincialis) from the Venice Lagoon, Italy: biochemical studies // Mar. Environ. Res. V. 39. P. 235−240.
Louiz I., Hassine O., Palluel O. et al. 2017. Seasonal rhythm of physiological indexes, liver protein level, and biotransformation biomarkers in Zosterisessor ophiocephalus and Gobius niger from a low contaminated lagoon (Ghar El Melh lagoon, Tunisia) // Biol. Rhythm Res. V. 48. № 6. P. 963–977. https://doi.org/10.1080/09291016.2017.1333187
Mabrouk L., Guarred T., Hamza A. et al. 2014. Fluctuating asymmetry in grass goby Zosterisessor ophiocephalus Pallas, 1811 inhabiting polluted and unpolluted area in Tunisia // Mar. Pollut. Bull. V. 85. № 1. P. 248–251.
Mazzoldi C., Scaggiante M., Ambrosin E., Rsotto M.B. 2000. Mating system and alternative male mating tactics in the grass goby Zosterisessor ophiocephalus (Teleostei: Gobiidae) // Mar. Biol. V. 137. P. 1041–1048. https://doi.org/10.1007/S002270000417
Pastres R., Pranovi F., Libralato S. et al. 2002. “Birthday effect” on the adoption of alternative mating tactics in Zosterisessor ophiocephalus: evidence from a growth mode // J. Mar. Biol. Assoc. UK. V. 82. № 2. P. 333−337. https://doi.org/10.1017/S0025315402005520
Pauly D. 1980. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish stocks // J. Cons. Int. Explor. Mer. V. 39. № 2. P. 175−192.
Pauly D. 1981. The relationships between gill surface area and growth performance in fish: a generalization of von Bertalanffy’s theory of growth // Meeresforschung. V. 28. № 4. P. 251−282.
Pauly D., Moreau J., Prein M. 1988. A comparison of overall growth performance of tilapia in open waters and aquaculture // ICLARM Conf. Proc. V. 15. P. 469–479.
Sakalli A., Başusta N. 2018. Sea surface temperature change in the Black Sea under climate change: a simulation of the sea surface temperature up to 2100 // Int. J. Climat. V. 38. № 13. P. 4687−4698. https://doi.org/10.1002/joc.5688
Shiraishi T., Tanaka H., Ohshimo S. et al. 2010. Age, growth and reproduction of two species of scad, Decapterus macrosoma and D. macarellus in the waters off southern Kyushu // Jpn. Agricult. Res. Quarterly. V. 44. № 2. P. 197−206. https://doi.org/10.6090/jarq.44.197
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии