Вопросы ихтиологии, 2022, T. 62, № 1, стр. 117-124
Состояние гонад и уровень половых стероидных гормонов у инвазивных кольчужных сомов (Loricariidae) Вьетнама
Чан Дык Зьен 1, 2, Е. Д. Павлов 3, *, Е. В. Ганжа 3, А. Г. Буш 3
1 Приморское отделение Российско-вьетнамского тропического
научно-исследовательского и технологического центра
Нячанг, Вьетнам
2 Высший научно-технический университет Вьетнамской академии
наук и технологий
Ханой, Вьетнам
3 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 31.12.2020
После доработки 11.01.2021
Принята к публикации 11.01.2021
- EDN: GOADJZ
- DOI: 10.31857/S0042875222010027
Аннотация
Представлены результаты изучения цитологического состояния гонад и содержания половых стероидных гормонов у особей кольчужного сома рода Pterygoplichthys из трёх водоёмов Центрального Вьетнама (р. Кай; ирригационный канал, сопряжённый с этой рекой, и водохранилище Суоичау). Самки из ирригационного канала по сравнению с особями из водохранилища характеризуются более развитыми яичниками и интенсивным образованием эстрадиола-17β из тестостерона. В ирригационном канале у самцов уровень эстрадиола-17β и тестостерона выше, чем в водохранилище. В строении половых желёз не обнаружены значимые аномалии, что свидетельствует об успешной адаптации кольчужного сома к новым водоёмам.
В последние десятилетия пресноводные тропические экосистемы Вьетнама испытывают быстро нарастающий антропогенный пресс (Зворыкин и др., 2014), в том числе выражающийся в зарегулировании стока и загрязнении водоёмов. Ухудшение состояния экосистем в свою очередь облегчает инвазии чужеродных видов рыб (Simberloff et al., 1997; Gibbs et al., 2008), конкурирующих с аборигенными видами за ресурсы: территорию, корм, нерестово-выростные участки (Столбунов, Чан Дык Зьен, 2019; Stolbunov et al., 2020). Это способно привести к снижению таксономического разнообразия и трансформации рыбных сообществ внутренних вод Вьетнама (Gusakov et al., 2018; Столбунов, Чан Дык Зьен, 2019).
Кольчужные сомы рода Pterygoplichthys в течение многих лет успешно заселяют внутренние водоёмы центральной части Индо-Тихоокеанского региона (Orfinger, Goodding, 2018). В водоёмах Южного Вьетнама они впервые были зарегистрированы в 2003–2004 гг. (Welcomme, Vidthayanom, 2003; Serov, 2004), а к 2010 г. обнаружены в Центральном (Zworykin, Budaev, 2013) и Северном Вьетнаме (Levin et al., 2008). В настоящее время в центральной и южной части Вьетнама кольчужные сомы встречаются в большинстве бассейнов крупных рек и обнаружены в некоторых водохранилищах (Столбунов, Чан Дык Зьен, 2019; Stolbunov et al., 2020). Принимая во внимание широкое распространение кольчужных сомов во Вьетнаме и их возможное влияние на аборигенную ихтиофауну, представляется актуальным получить сведения о репродуктивном потенциале этих инвазивных и быстро расселяющихся рыб. Это важно для понимания механизмов, обеспечивающих успешность освоения этими рыбами новых водоёмов. Сравнение репродуктивного потенциала у рыб, освоивших водоёмы, различающиеся по гидрологическим, температурным или трофическим условиям, является одним из способов выяснения адаптационных возможностей инвазивных видов (Mazzoni, Caramaschi, 1995).
Цель работы – оценить цитологическое состояние гонад, уровень половых стероидных гормонов в крови у кольчужных сомов рода Pterygoplichthys из водоёмов Центрального Вьетнама разного типа (река, ирригационный канал, водохранилище).
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена в январе 2020 г. в Приморском отделении Российско-вьетнамского тропического научно-исследовательского и технологического центра (СРВ, г. Нячанг). Объект исследования – кольчужные сомы рода Pterygoplichthys. Предположительно в Южном Вьетнаме обитают два вида − P. disjunctivus и P. pardalis − и их гибрид (Zworykin, Budaev, 2013; Столбунов, Чан Дык Зьен, 2019; Stolbunov et al., 2020). Однако таксономический статус кольчужных сомов не выяснен. Предложенные ранее (Armbruster, Page, 2006) ключи по паттернам окраски вентральной поверхности тела сомов не позволяют с уверенностью идентифицировать видовую принадлежность в связи со значительной изменчивостью окраски и ряда других морфологических признаков при обитании кольчужных сомов в различных условиях среды (Zworykin, Budaev, 2013; Stolbunov et al., 2020).
Рыб отлавливали утром (с 5 до 8 ч) сетными орудиями лова сходной конструкции в нижнем течении р. Кай (Cái) (12°15ʹ43ʹʹ с.ш. 109°05ʹ47ʹʹ в.д.); ирригационном канале, сопряжённом с р. Кай (12°17ʹ26ʹʹ с.ш. 109°06ʹ04ʹʹ в.д.); и в водохранилище Суоичау (Suối Trầu) (12°30ʹ18ʹʹ с.ш. 109°02ʹ42ʹʹ в.д.), расположенном в 27 км севернее и относящемся к бассейну р. Динь (Dinh) (Gusakov et al., 2018). Всего отловили 72 экз. кольчужных сомов.
Река Кай протекает с запада на восток, берёт начало в горах на высоте 1812 м над уровнем моря и впадает в зал. Нячанг Южно-Китайского моря, имеет длину 79 км и площадь водосборного бассейна ~1450 км2 (Serov et al., 2003). Ширина русла варьирует от 3 м в верховье до 500 м в эстуарии. В среднем течении реки глубина русла составляет 3–5 м, скорость течения на плёсах – 0.3–0.6 м/с, на перекатах – 0.7–1.1 м/с. Ирригационный канал р. Кай имеет длину 2 км, в месте отлова его ширина составляет от 6 до 12 м, глубина – 1 м; от него отходит сеть многочисленных узких каналов, снабжающих водой рисовые чеки. Площадь эвтрофного водохранилища Суоичау составляет 0.6 км2, средняя глубина – 1.5 м, максимальная – 9 м (Столбунов, 2014). В отличие от реки и канала мелководное водохранилище характеризуется температурной (разница между поверхностным и придонным слоями составляет 4–5°С) и кислородной стратификацией – постоянного перемешивания не происходит (Гусев и др., 2014). В период отбора проб температура воды в исследованных водоёмах была сходной (~29°С).
Река в нижнем течении, как и ирригационный канал, протекает в пределах населённых пунктов (г. Нячанг с пригородами) и сельскохозяйственных районов, что вносит существенный вклад в загрязнение этих вод. Река Кай, как и многие реки Центрального Вьетнама, характеризуется высоким содержанием биогенных веществ, в частности общего фосфора (Гусев и др., 2014). Накопление веществ в ирригационном канале потенциально может быть ещё выше за счёт меньшей скорости течения по сравнению с рекой. В районе водохранилища Суоичау отсутствуют крупные населённые пункты, что предполагает меньшую его загрязнённость по сравнению с рекой и каналом. Так, уровень ртути в мышечной ткани змееголова Channa striata из водохранилища в 1.4 раза ниже, чем в р. Кай (Лобус и др., 2014). Однако в период засухи может происходить обмеление водохранилища и сопутствующее повышение концентрации биогенных веществ. Степень загрязнения как речных систем, так и водохранилищ Вьетнама динамична, во многом определяется сезонностью, что затрудняет дать её точную оценку.
У пойманных рыб измеряли стандартную длину тела (SL), массу тела и гонад, определяли стадию зрелости гонад. Для оценки цитологического состояния половых желёз фрагменты их краниальной части фиксировали в нейтральном 10%-ном водном растворе формальдегида. Гистологические препараты изготавливали по стандартным методикам, срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином. Фотографии срезов гонад получали с помощью моторизованного микроскопа Keyence Biorevo BZ-9000.
Цитологическое состояние генеративной ткани оценивали по расчётным параметрам скорости оогенеза (диаметру ооцитов), толщине оболочки гонад, наличию и числу аномалий в строении яичников и семенников. Больший диаметр ооцита соответствует более интенсивному развитию яичника, а толщина оболочки гонады указывает на повторность нереста особи. Была измерена площадь 2456 ооцитов (с помощью ПО ImageJ ver. 1.51k) у рыб из трёх указанных водоёмов. Диаметр клеток определяли по формуле: D = 2√S/π, где D – диаметр ооцита, S – площадь ооцита. У самцов для выполнения корреляционного анализа (ранговая корреляция Спирмена) использовали условную 6-балльную шкалу созревания семенников по их цитологическому строению: 1 – большая часть клеток представлена сперматоцитами I порядка, сперматоциты II порядка единичны; 2 – сперматоциты I и II порядков многочисленны; 3 – помимо сперматоцитов появляются немногочисленные сперматиды и сперматозоиды; 4 – заметно увеличивается число сперматид и сперматозоидов; 5 – занимаемая площадь на срезе гонады сперматидами и сперматозоидами в генеративной ткани превалирует над площадью, занимаемой другими типами клеток; 6 – генеративная ткань преимущественно состоит из семенных канальцев, заполненных сперматозоидами.
Для оценки гормональной регуляции отобрали кровь у рыб из ирригационного канала (21 экз.) и водохранилища (22 экз.). Кровь отбирали шприцом объёмом 1 см3 из хвостовой вены и центрифугировали при 5000 об/мин. Полученную плазму замораживали при –20°C. Методом иммуноферментного анализа на приборе Mindray MR 96A в плазме определяли концентрации тестостерона (Тs) и эстрадиола-17β (E). Содержание половых стероидных гормонов совместно с цитологическим состоянием гонад отражает функционирование репродуктивной системы рыб. Каждую пробу исследовали на содержание гормонов в двух повторностях. Для оценки интенсивности образования эстрадиола из тестостерона рассчитывали показатель соотношения концентраций этих гормонов в крови (Ts/E).
Статистическая обработка данных проведена с применением непараметрического дисперсионного анализа (H-критерий Краскела−Уоллиса), t-критерия Стьюдента, критерия Стьюдента для долей, U-критерия Манна−Уитни.
РЕЗУЛЬТАТЫ
Длина и масса отловленных самок и самцов из р. Кай превышала таковые (t-критерий Стьюдента: p < 0.01) у рыб из ирригационного канала и водохранилища (табл. 1). Средняя масса гонад у самок из реки была заметно больше, чем у рыб из ирригационного канала и водохранилища; у самок из водохранилища этот показатель самый низкий.
Таблица 1.
Биологические показатели самок и самцов кольчужных сомов рода Pterygoplichthys из трёх водоёмов Центрального Вьетнама
| Место отлова | Самки | Самцы | ||||||
|---|---|---|---|---|---|---|---|---|
| Длина (SL), см |
Масса, г | n, экз. | Длина (SL), см |
Масса, г | n, экз. | |||
| тела | гонад | тела | гонад | |||||
| Р. Кай | $\frac{{20 \pm 1.0}}{{15{\kern 1pt} --{\kern 1pt} 25}}$ | $\frac{{151 \pm 20.3}}{{73{\kern 1pt} --{\kern 1pt} 282}}$ | $\frac{{4.6 \pm 2.1}}{{0.2{\kern 1pt} --{\kern 1pt} 20.8}}$ | 11 | $\frac{{24 \pm 1.8}}{{18{\kern 1pt} --{\kern 1pt} 33}}$ | $\frac{{248 \pm 49.1}}{{119{\kern 1pt} --{\kern 1pt} 528}}$ | $\frac{{0.3 \pm 0.10}}{{0.1{\kern 1pt} --{\kern 1pt} 0.8}}$ | 8 |
| Ирригационный канал р. Кай | $\frac{{17 \pm 0.8}}{{14{\kern 1pt} --{\kern 1pt} 25}}$ | $\frac{{93 \pm 14.2}}{{40{\kern 1pt} --{\kern 1pt} 255}}$ | $\frac{{1.3 \pm 0.65}}{{0.2{\kern 1pt} --{\kern 1pt} 9.5}}$ | 14 | $\frac{{16 \pm 0.5}}{{12{\kern 1pt} --{\kern 1pt} 20}}$ | $\frac{{83 \pm 6.5}}{{44{\kern 1pt} --{\kern 1pt} 143}}$ | $\frac{{0.1 \pm 0.01}}{{0.1{\kern 1pt} --{\kern 1pt} 0.2}}$ | 17 |
| Водохранилище Суоичау | $\frac{{17 \pm 1.3}}{{12{\kern 1pt} --{\kern 1pt} 22}}$ | $\frac{{72 \pm 11.9}}{{20{\kern 1pt} --{\kern 1pt} 113}}$ | $\frac{{0.3 \pm 0.08}}{{0.1{\kern 1pt} --{\kern 1pt} 0.2}}$ | 9 | $\frac{{16 \pm 0.5}}{{14{\kern 1pt} --{\kern 1pt} 26}}$ | $\frac{{69 \pm 14.1}}{{23{\kern 1pt} --{\kern 1pt} 161}}$ | $\frac{{0.1 \pm 0.01}}{{0.1{\kern 1pt} --{\kern 1pt} 0.2}}$ | 13 |
Примечание. Здесь и в табл. 2: над чертой – среднее значение и его ошибка, под чертой – пределы варьирования показателя: n – число изученных особей.
Корреляционный анализ показал, что длина, масса тела и гонад рыб умеренно зависят от места отлова – соответственно 0.55, 0.58 и 0.39 при p < 0.001. Степень созревания яичников (стадия зрелости гонад) у сомов связана (H-критерий: p = 0.025) с их обитанием в речной системе (река и канал) или в водохранилище. У самцов (по условной и стандартной шкалам зрелости гонад) такая связь не установлена (p > 0.05).
Яичники у рыб из реки и канала находились на II, III и IV стадиях зрелости. В водохранилище отловлена только одна самка с гонадами III стадии зрелости, остальные имели яичники II стадии.
На II стадии зрелости яичники небольшие, бледно-жёлтого цвета, представлены ооцитами периода превителлогенеза, которые характеризуются крупным ядром и цитоплазмой, имеющей немногочисленные вакуоли в толще (рис. 1а). В ядре клеток локализованы немногочисленные ядрышки – 6–15 штук на срезе. Средний диаметр превителлогенных ооцитов у самок из канала достоверно больше (U-критерий: p < 0.001), чем у особей из реки и водохранилища (табл. 2).
Рис. 1.
Цитологическое строение яичников кольчужного сома рода Pterygoplichthys II (а), III (б) и IV (в) стадии зрелости из водоёмов провинции Кханьхоа; 1 – строма гонады, 2 – ооцит периода превителлогенеза, 3 – ооцит периода вителлогенеза, 4 – гранулы желтка в вителлогенном ооците. Масштаб: 500 мкм.
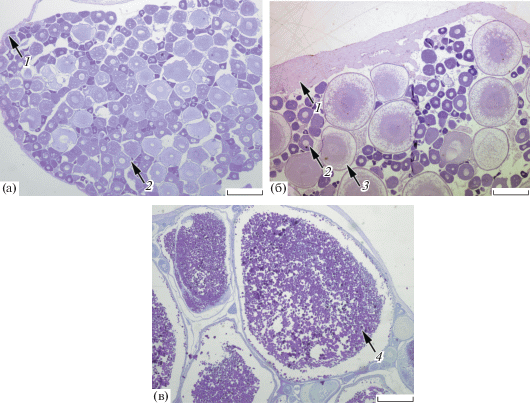
Таблица 2.
Средний диаметр превителлогенных (Dp) и вителлогенных (Dv) ооцитов периода превителлогенеза в гонадах кольчужных сомов рода Pterygoplichthys из трёх водоёмов Центрального Вьетнама
| Место отлова | II стадия зрелости гонад | III стадия зрелости гонад | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Dp, мкм | CV | n | Dp, мкм | CV | n | Dv, мкм | CV | n | |
| Р. Кай | $\frac{{122 \pm 3.3}}{{24{\kern 1pt} --{\kern 1pt} 412}}$ | 59 | 464 | $\frac{{134 \pm 5.2}}{{41{\kern 1pt} --{\kern 1pt} 369}}$ | 47 | 142 | $\frac{{565 \pm 21.0}}{{423{\kern 1pt} --{\kern 1pt} 762}}$ | 17 | 22 |
| Ирригационный канал р. Кай | $\frac{{134 \pm 3.2}}{{41{\kern 1pt} --{\kern 1pt} 390}}$ | 48 | 409 | $\frac{{154 \pm 3.1}}{{37{\kern 1pt} --{\kern 1pt} 473}}$ | 46 | 523 | $\frac{{613 \pm 14.0}}{{441{\kern 1pt} --{\kern 1pt} 803}}$ | 17 | 52 |
| Водохранилище Суоичау | $\frac{{113 \pm 2.5}}{{23{\kern 1pt} --{\kern 1pt} 499}}$ | 60 | 725 | $\frac{{144 \pm 6.1}}{{47{\kern 1pt} --{\kern 1pt} 343}}$ | 45 | 113 | $\frac{{550 \pm 41.2}}{{445{\kern 1pt} --{\kern 1pt} 742}}$ | 18 | 6 |
На III стадии зрелости гонады самок имеют жёлто-оранжевый цвет, в них невооружённым глазом видны ооциты. Яичники содержат как ооциты периода превителлогенеза, так и клетки старшей генерации – вителлогенные ооциты (рис. 1б). Бóльшая часть цитоплазмы вителлогенных ооцитов вакуолизирована, в наиболее крупных клетках появляются одиночные гранулы желтка. В яичниках рыб из реки число половых клеток периода вителлогенеза не превышает 16% всех имеющихся ооцитов на гистологическом срезе, а в гонадах особей из канала их ≤ 10%. Так же, как и в гонадах II стадии зрелости, в яичниках III стадии диаметр превителлогенных ооцитов у самок из канала заметно больше (U-критерий: p = 0.001), чем у особей из реки (табл. 2). Средние значения диаметра вителлогенных ооцитов в гонадах особей из канала несколько выше, чем у рыб из реки.
Толщина оболочек яичников варьирует в широких пределах – от 2 до 814 мкм. Заметное утолщение стромы гонады происходит после первого нереста (Макеева, 1992; Пономарёв, 2017), поэтому стадию зрелости таких гонад можно представить в виде VI–II или VI–III. Строма гонад самок SL ≤ 18.5 см относительно тонкая − 49 ± 6.3 (6–91) мкм (n = 12)11 (рис. 1а). Крупные особи SL > 19 см, имеющие утолщённую оболочку гонад − 225 ± 20.4 (106–423) мкм (n = 16) (рис. 1б), уже могли нереститься один и более раз в жизни. Исключением является одна особь SL 13.7 см из канала, у которой средняя толщина оболочки яичника достигала 229 мкм. Это может быть обусловлено как аномальным утолщением стромы яичника у молоди, так и явлением раннего полового созревания.
На IV стадии зрелости яичники занимают значительную часть полости тела, имеют оранжево-красный цвет и содержат крупные ооциты, целиком заполненные плотно лежащими гранулами желтка (рис. 1в). Вдоль половых желёз хорошо виден крупный кровеносный сосуд arteria ovarica. Самки с такими гонадами в основном встречались в р. Кай, а в ирригационном канале отловлена только одна такая особь.
Семенники у самцов из реки и канала находились на III, IV и V стадиях зрелости, у самцов из водохранилища – на III и IV стадиях. Связь между степенью развития семенников и принадлежностью рыб к конкретному водоёму не выявлена (U-критерий: p > 0.05).
В семенниках III стадии зрелости кроме сперматогониев многочисленны сперматоциты I и II порядков. У впервые созревающих самцов просветы семенных канальцев не выражены, в то время как у повторно нерестящихся рыб они хорошо заметны (рис. 2а). Как правило (за исключением 2 экз.), в исследованных водоёмах встречались самцы, которые уже нерестились. Иногда на гистологических срезах семенников таких рыб видна гипертрофия кровеносных сосудов, выражающаяся в локализации эритроцитов в разных участках генеративной ткани.
Рис. 2.
Цитологическое строение семенников кольчужного сома рода Pterygoplichthys из водоёмов провинции Кханьхоа: а – III–IV стадия зрелости, р. Кай; б − V стадия (семенные канальцы со сперматозоидами), ирригационный канал; 1 – сперматогонии, 2 – сперматоциты, 3 – сперматозоиды, 4 – скопление эритроцитов, 5 – пустой семенной каналец у повторно нерестящейся особи. Масштаб: а – 100, б – 50 мкм.
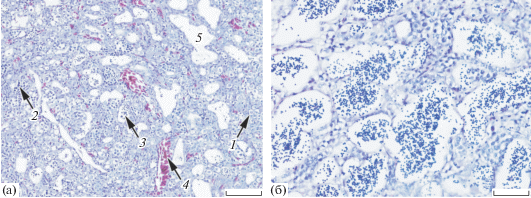
На IV стадии зрелости семенники помимо сперматоцитов содержат ещё более мелкие клетки – сперматиды, что свидетельствует о начале спермиогенеза. К концу IV стадии зрелости формируются семенные канальцы со сперматозоидами.
На V стадии зрелости большая часть генеративной ткани семенников заполнена семенными канальцами со сперматозоидами (рис. 2б) и немногочисленными половыми клетками более раннего состояния – сперматидами и сперматоцитами. Эта стадия зрелости характеризует начало нереста.
Содержание половых стероидных гормонов. Уровень эстрадиола-17β (E) и показатель Ts/E зависят от пола рыб (H-критерий: p < 0.001) и стадии зрелости гонад (E: p = 0.003, Ts/E: p = 0.004). Содержание E в крови и значения показателя Ts/E положительно коррелируют с массой гонад (ранговая корреляция Спирмена, p < 0.001: E − 0.74, Ts/E − 0.62). Концентрация Ts умеренно коррелирует с длиной и массой рыб – соответственно 0.39 и 0.49 при p < 0.001.
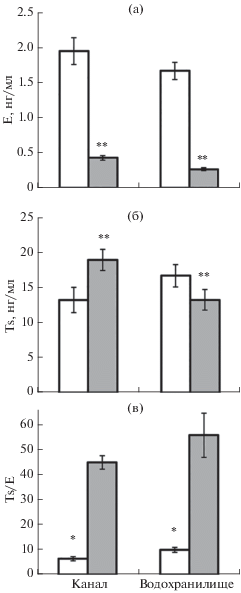
Самки из канала и водохранилища не различаются по уровню E и Ts (рис. 3а, 3б), но у первых значения Ts/E ниже (здесь и далее U-критерий: p = 0.024), чем у вторых (рис. 3в). У самцов из канала уровень E и Ts выше, чем у особей из реки (p = 0.001) и водохранилища (p = 0.008). В исследованных водоёмах содержание E у самок по сравнению с самцами выше более чем в четыре раза. В канале концентрация Ts у самцов заметно выше (p = 0.030), чем у самок, а в водохранилище половые различия по уровню Ts не выявлены.
Рис. 3.
Содержание половых стероидных гормонов в крови самок (◻) и самцов ( ) кольчужных сомов рода Pterygoplichthys из ирригационного канала р. Кай и водохранилища Суоичау: а − эстрадиол-17β (Е), б
– тестостерон (Тs), в − соотношение концентраций Ts/E; (|) – ошибка средней; различия
между рыбами из разных водоёмов достоверны (U-критерий Манна–Уитни) при p: * < 0.05, ** < 0.01.
) кольчужных сомов рода Pterygoplichthys из ирригационного канала р. Кай и водохранилища Суоичау: а − эстрадиол-17β (Е), б
– тестостерон (Тs), в − соотношение концентраций Ts/E; (|) – ошибка средней; различия
между рыбами из разных водоёмов достоверны (U-критерий Манна–Уитни) при p: * < 0.05, ** < 0.01.
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о том, что кольчужные сомы из исследованных водоёмов различаются по длине и массе тела, развитию и функционированию репродуктивной системы. В выборке из реки средняя длина и масса рыб больше, чем в выборках из канала и водохранилища. Меньшие размеры кольчужных сомов в притоках по сравнению с рыбами из основного русла, как правило, связывают с тем, что период раннего развития рыб проходит преимущественно в притоках и каналах, а позднее они расселяются в крупные водотоки (Mazzoni, Caramaschi, 1995; Liang et al., 2005). Это обусловлено низкой скоростью течения в притоках и, вероятно, большей доступностью пищи для молоди и меньшим количеством хищников (Mazzoni, Caramaschi, 1995). Не исключено, что при достижении определённого размера тела сомы из ирригационного канала мигрируют в р. Кай.
Анализ цитологического состояния стромы яичников указывает на то, что самки сомов в водоёмах Центрального Вьетнама преимущественно достигают половой зрелости при SL > 18 см. Известно, что самки P. disjunctivus становятся половозрелыми при SL > 26 (в среднем 36) см (Gibbs et al., 2008), Liposarcus multiradiatus – ≥25 см (Liang et al., 2005), а P. pardalis – ≥12 см (Samat et al., 2016). Наличие в наших выборках особей SL 13–25 см, уже нерестившихся ранее, указывает на присутствие в них P. pardalis или близкого вида/гибрида, для которого свойственно созревание при малой длине тела.
В яичниках исследованных кольчужных сомов часто наблюдались две генерации ооцитов – многочисленные крупные вителлогенные и мелкие превителлогенные, что указывает на возможность порционного нереста рыб. При этом в реке и сопряжённом с ней ирригационном канале по сравнению с водохранилищем гонады самок содержали клетки более позднего состояния, что предполагает более ранний нерест особей. В то же время при меньшем размере самок из канала скорость оогенеза у них заметно выше, чем у более крупных самок из реки. Это указывает на растянутый период нереста сомов в пределах одного бассейна, характерный для этого рода (Gibbs et al., 2008; Samat et al., 2016). Например, в р. Динь той же провинции (Кханьхоа, Центральный Вьетнам) кольчужные сомы нерестятся с октября по январь (Zworykin, Budaev, 2013), что отчасти соотносится с нашими данными по р. Кай. У P. disjunctivus в климатических условиях штата Флорида нерест, как правило, продолжается с февраля по октябрь (Gibbs et al., 2008). Авторы отмечают, что в разные годы наблюдений длительность периода нереста может заметно меняться, и предположили, что при достаточной обеспеченности пищей сомы способны нереститься практически круглый год. Такое явление, в частности, описано для Iheringichthys labrosus (Santos et al., 2019). Для инвазивного P. pardalis в одной из рек Малайзии также описан непрерывный нерест, достигающий пика в период с сентября по январь при высоком уровне воды (Samat et al., 2016). Существенные различия периодов размножения кольчужных сомов могут быть обусловлены условиями среды – температурой и уровнем воды, продолжительностью светового дня (Dei Tos et al., 1997). По всей видимости, в условиях Центрального Вьетнама нерест кольчужных сомов в реке, в канале и тем более в водохранилище (в январе яичники находились на II стадии зрелости) может продолжаться в феврале–марте. При этом сроки нереста во многом определяются комплексом факторов, свойственных конкретному водоёму. Так, замедление созревания яичников у рыб в водохранилище по сравнению с особями из реки и канала может быть связано с негативным влиянием на оогенез температурной и кислородной стратификации или низкой обеспеченностью пищей. К сожалению, основные гидрологические, гидрохимические, трофические и иные характеристики водоёмов, в которых были выловленные исследованные нами рыбы, остаются неизвестными.
У самок из разных водоёмов значимые различия по уровню тестостерона и эстрадиола-17β не выявлены. При этом показатель Ts/E у самок из канала заметно ниже, чем у самок из водохранилища. Это указывает на усиление синтеза эстрадиола-17β у самок в канале и так же, как и данные цитологического анализа, свидетельствует о более интенсивном развитии яичников по сравнению с таковыми у самок из водохранилища.
Семенники в отличие от яичников имели практически сходное цитологическое строение у рыб в трёх исследованных водоёмах. При этом уровни Ts и E у самцов из канала были выше, чем у самцов из водохранилища. Выявленные различия уровня половых стероидных гормонов у самцов, по всей видимости, отражают модификацию репродуктивной системы, обусловленную общей адаптацией организма к тем или иным условиям обитания, таким как сезонная динамика температуры воды, содержание кислорода, обеспеченность пищей, загрязнение воды (Dei Tos et al., 1997; Welcomme, Vidthayanom, 2003; Gibbs et al., 2008; Mas et al., 2019). Неоднородность видового состава изученных выборок также может являться причиной выявленных различий в состоянии репродуктивной системы самцов (Mazzoni, Caramaschi, 1995). На отсутствие выраженных изменений в скорости развития семенников указывают близкие значения Ts/E у самцов из канала и водохранилища, которые повышаются по мере созревания семенников. Отсутствие значимых различий по уровню Ts между самцами и самками в водохранилище указывает на более медленное развитие семенников у рыб этого водоёма по сравнению с самцами из канала.
Выраженные аномалии в цитологическом строении гонад ни самок, ни самцов не выявлены. Известно, что кольчужные сомы толерантны к загрязнению воды (Welcomme, Vidthayanom, 2003) и недостатку кислорода (Armbruster, 1998). Отсутствие нарушений в гаметогенезе свидетельствует о благоприятных условиях существования и объясняет успешность инвазии рыб рода Pterygoplichthys в исследованных водоёмах провинции Кханьхоа.
Список литературы
Гусев Е.С., Гусаков В.А., Чан Дык Дзьен и др. 2014. Гидрохимическая характеристика рек, озёр и водохранилищ Центрального и Южного Вьетнама // Экология внутренних вод Вьетнама / Под. ред. Павлова Д.С., Зворыкина Д.Д. М.: Т-во науч. изд. КМК. С. 23–35.
Зворыкин Д.Д., Динь Тхи Хай Йен, Во Тхи Ха. 2014. Состав и основные особенности ихтиофауны пресных и солоноватых вод региона // Там же. С. 225–240.
Лобус Н.В., Комов В.Т., Гусева Е.Е. и др. 2014. Содержание ртути в мышечной ткани пресноводных рыб // Там же. С. 63–73.
Макеева А.П. 1992. Эмбриология рыб. М.: Изд-во МГУ, 216 с.
Пономарёв С.С. 2017. Особенности стадий и шкала зрелости самок минтая // Изв. ТИНРО. Т. 190. С. 33–48. https://doi.org/10.26428/1606-9919-2017-190-33-48
Столбунов И.А. 2014. Рыбное население водохранилищ Центрального Вьетнама // Экология внутренних вод Вьетнама / Под. ред. Павлова Д.С., Зворыкина Д.Д. М.: Т-во науч. изд. КМК. С. 241–255.
Столбунов И.А., Чан Дык Зьен. 2019. Массовые чужеродные виды в рыбном населении внутренних вод Центрального Вьетнама // Биология внутр. вод. № 4-1. С. 101–104. https://doi.org/10.1134/S0320965219040351
Armbruster J.W. 1998. Modifications of the digestive tract for holding air in loricariid and scoloplacid catfishes // Copeia. № 3. P. 663–675. https://doi.org/10.2307/1447796
Armbruster J.W., Page L.M. 2006. Redescription of Pterygoplichthys punctatus and description of a new species of Pterygoplichthys (Siluriformes: Loricariidae) // Neotrop. Ichthyol. V. 4. P. 401–409. https://doi.org/10.1590/S1679-62252006000400003
Dei Tos C., Agostinho A.A., Suzuki H.I. 1997. Population structure and reproductive biology of Loricariichthys platymetopon (Siluriformes, Pisces) in the upper river Parana // Brazil. Arch. Biol. Technol. V. 40. P. 793–808. https://doi.org/10.1590/1982-0224-20140052
Gibbs M.A., Shields J.H., Lock D.W. et al. 2008. Reproduction in an invasive exotic catfish Pterygoplichthys disjunctivus in Volusia Blue Spring, Florida, USA // J. Fish Biol. V. 73. P. 1562–1572. https://doi.org/10.1111/j.1095-8649.2008.02031.x
Gusakov V.A., Stolbunov I.A., Tran Duc Dien. 2018. Modern distribution of armored catfishes (Siluriformes: Loricariidae) in Central Vietnam // Inland Water Biol. V. 11. № 2. P. 179–183. https://doi.org/10.1134/s1995082918020050
Levin B.A., Phuong P.H., Pavlov D.S. 2008. Discovery of the Amazon sailfin catfish Pterygoplichthys pardalis (Castelnau, 1855) (Teleostei: Loricariidae) in Vietnam // J. Appl. Ichthyol. V. 24. P. 715–717. https://doi.org/10.1111/j.1439-0426.2008.01185.x
Liang S.-H., Wu H.-P., Shieh B.-S. 2005. Size structure, reproductive phenology, and sex ratio of an exotic armored catfish (Liposarcus multiradiatus) in the Kaoping River of southern Taiwan // Zool. Stud. V. 44. P. 252–259.
Mas D.B., Alvarenga P.F., Scarabotti P.A. 2019. Ecological and phylogenetic determinants of life-history patterns among ten loricariid species // J. Fish. Biol. V. P. 1–13. https://doi.org/10.1111/jfb.14131
Mazzoni R., Caramaschi E.P. 1995. Size structure, sex ratio, and onset of sexual maturity of two species of Hypostomus // Ibid. V. 47. P. 841–849. https://doi.org/10.1111/j.1095-8649.1995.tb06006.x
Orfinger A.B., Goodding D.D. 2018. The global invasion of the suckermouth armored catfish genus Pterygoplichthys (Siluriformes: Loricariidae): annotated list of species, distributional summary, and assessment of impacts // Zool. Stud. V. 57. e7. https://doi.org/10.6620/ZS.2018.57-07
Samat A., Yusoff F.M., Arshad A. et al. 2016. Reproductive biology of the introduced sailfin catfish Pterygoplichthys pardalis (Pisces: Loricariidae) in Peninsular Malaysia// Indian J. Fish. V. 63. № 1. P. 35–41. https://doi.org/10.21077/IJF.2016.63.1.44937-05
Santos J.E., Marcon L., Britod M.F.G. et al. 2019. Reproductive biology of the Neotropical catfish Iheringichthys labrosus (Siluriformes: Pimelodidae), with anatomical and morphometric analysis of gonadal tissues // Anim. Reproduct. Sci. V. 209. P. 1–10. https://doi.org/10.1016/j.anireprosci.2019.106173
Serov D.V. 2004. Harnischwelse in Südostasien // Die Aquarium- und Terrariumzeitschrift. № 2. P. 18–19.
Serov D.V., Nezdoliy V.K., Pavlov D.S. 2003. Fishes of the river Cai. Vietnam; Khanh Hoa province. Moscow: GEOS, 164 p.
Simberloff D., Schmitz D.C., Brown T.C. 1997. Strangers in paradise: impact and management of nonindigenous species in Florida. Washington: Island Press, 479 p.
Stolbunov I.A., Tran Duc Dien, Armbruster J.W. 2020. Suckermouth-armored catfish (Siluriformes: Loricariidae) of Central and Southern Vietnam // Inland Water Biol. V. 13. № 4. P. 626–639. https://doi.org/10.1134/S1995082920040100
Welcomme R.L., Vidthayanom C. 2003. The impacts of introductions and stocking of exotic species in the Mekong Basin and policies for their control // MRC Tech. Pap. № 9. Mekong River Commission, Phnom Penh, 37 p.
Zworykin D.D., Budaev S.V. 2013. Non-indigenous armoured catfish in Vietnam: invasion and systematics // Ichthyol. Res. V. 60. № 4. P. 327–333. https://doi.org/10.1007/s10228-013-0356-9
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


