Вопросы ихтиологии, 2022, T. 62, № 1, стр. 39-48
Ихтиопланктон неритической зоны восточной части Охотского моря в июне 2018 г.
С. С. Григорьев 1, *, Н. А. Седова 2
1 Камчатский филиал Тихоокеанского института географии Дальневосточного
отделения РАН – КФ ТИГ РАН
Петропавловск-Камчатский, Россия
2 Камчатский государственный технический университет – КамчатГТУ
Петропавловск-Камчатский, Россия
* E-mail: sgri@inbox.ru
Поступила в редакцию 17.12.2020
После доработки 12.01.2021
Принята к публикации 14.01.2021
- EDN: KCVVKR
- DOI: 10.31857/S0042875222010076
Аннотация
По материалам съёмки, проведённой 05–09.06.2018 г. вблизи западного побережья Камчатки над глубинами 5–25 м, описан видовой состав ихтиопланктона. Идентифицированы икринки и личинки восьми видов рыб, принадлежащих к четырём отрядам и пяти семействам. По численности преобладают икринки хоботной камбалы Limanda proboscidea, звёздчатой камбалы Platichthys stellatus и малорота Стеллера Glyptocephalus stelleri. Более половины всех икринок приходится на долю хоботной камбалы, их плотность была максимальной – 246 шт/м2. Плотности икринок звёздчатой камбалы и малорота Стеллера в местах скоплений составляли 105 шт/м2. Личинки мойвы Mallotus villosus, минтая Gadus chalcogrammus, многоусой лисички Podothecus accipenserinus, полосатого липариса Liparis latifrons, охотоморской палтусовидной камбалы Hippoglossoides elassodon и хоботной камбалы отмечены единично.
Исследования морской фауны у берегов Западной Камчатки были начаты в XVIII в. (Крашенинников, 1948). Тем не менее сообщества гидробионтов верхних отделов шельфа изучены недостаточно: несмотря на многочисленные рыбопромысловые исследования восточной части Охотского моря, наиболее продуктивная мелководная часть шельфа до последнего времени оставалась вне поля зрения исследователей. Многообразие биотопов, характерное для эстуариев рек западного побережья Камчатки, во многом определяет высокую продуктивность всего западнокамчатского шельфа. Получение детальных сведений о видовом составе, количественном распределении и динамике прибрежных мелководных биоценозов особенно важно в связи с усилившимся в последнее время освоением шельфа, которое вызывает существенные изменения структуры морских экосистем. Изменениям в первую очередь подвержены биоценозы гидробионтов, обитающих на мелководье. Важной составной частью прибрежных мелководных биоценозов является меропланктон – организмы на ранних стадиях, развитие которых проходит в пелагиали. В хозяйственном отношении наибольшее значение среди таких организмов имеет ихтиопланктон – икринки и личинки рыб. Данные о сезонной динамике численности ихтиопланктона и его пространственном распределении необходимы для понимания биологии рыб.
Первой работой по ихтиопланктону морских вод у западного побережья Камчатки была статья Расса и Желтенковой (1948), положившая начало систематическому изучению ихтиопланктона восточной части Охотского моря (Полутов, Трипольская, 1954; Перцева-Остроумова, 1961; Сафронов, 1981; Сафронов, Токранов, 1984; Золотов и др., 1990; Балыкин и др., 1991; Григорьев, 1997, 2003, 2004а, 2005а, 2005б, 2011; Токранов, Сафронов, 2004; Наумова, Коломейцев, 2015).
Ихтиопланктонные исследования выполняли в основном для нужд промысла: в связи с изучением раннего морского периода жизни тихоокеанских лососей рода Oncorhynchus и при оценке численности нерестовой части популяции минтая. При этом самая мелководная продуктивная прибрежная часть шельфа, находящаяся под влиянием речного стока, оставалась неизученной из-за невозможности работы там исследовательских судов.
Цель данной работы – изучить видовой состав ихтиопланктона в неритической зоне прикамчатских вод, находящихся под влиянием стока рек западного побережья Камчатки.
МАТЕРИАЛ И МЕТОДИКА
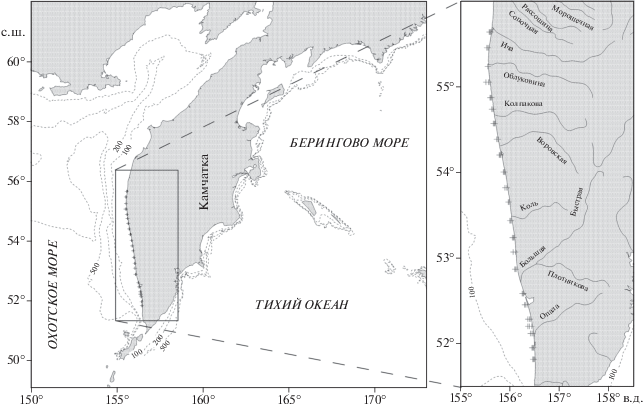
Материал собран в ходе проведения КамчатНИРО комплексных исследований условий среды раннего морского периода жизни западнокамчатских популяций лососёвых рыб. Гидрологическая и гидробиологическая съёмки проведены 05–09.06.2018 г. на маломерных судах типа МРС (малый рыболовный сейнер) в виде серии коротких мелководных (на изобатах 5–25 м) разрезов вдоль западного побережья Камчатки (рис. 1), приуроченных преимущественно к устьевым участкам рек, в которых нерестится горбуша. На каждом разрезе выполнено по три станции. На каждой станции сетью Джеди (диаметр входного отверстия 27 см, шаг ячеи фильтрующего конуса 100 мкм) сделан один вертикальный лов от дна до поверхности. Собрано 69 проб планктона. Пробы фиксировали 4%-ным формалином. Гидрологические параметры (температура и солёность воды, содержание и насыщение кислородом, концентрация хлорофилла а) измеряли с использованием зондирующего комплекса AAQ–Rinko (“JFE Advantech Co., Ltd.”, Япония). Результаты гидрологических и гидробиологических наблюдений по этим материалам опубликованы ранее (Лепская и др., 2019).
Рис. 1.
Карта-схема расположения станций (+) гидробиологической съёмки, проведённой у западного побережья Камчатки 05–09.06.2018 г.; (---) – изобаты.
В лаборатории из планктонных проб выбирали икринок и личинок рыб, видовую идентификацию которых осуществляли с использованием определителей ранних стадий развития рыб северной части Тихого океана (Matarese et al., 1989; Григорьев, 2007). Видовые названия приведены с учётом современных ихтиологических баз данных (Froese, Pauly, 2020; WoRMS, 2021). Длину (NL) личинок рыб измеряли от переднего края рыла до конца хорды. При обсуждении результатов приводится также стандартная длина (SL) – от переднего края рыла до начала основания центральных лучей хвостового плавника. Икринки разделяли по четырём стадиям развития (Расс, 1949): I – от осеменения до начала формирования зародышевой полоски, II – от начала формирования зародышевой полоски до начала обособления зачатка хвоста, III – от начала обособления зачатка хвоста до начала пигментации глаз, IV – от эмбриона с пигментированными глазами до вылупления. Виды рассматриваются в порядке их значимости в планктоне.
РЕЗУЛЬТАТЫ
Гидрологические условия в период выполнения работ были благоприятными для развития рыб ранних стадий. Насыщение кислородом на каждой станции не менее 100% даже в придонных слоях. Поверхностная температура воды на полигоне в начале июня составила в среднем 4.5 (3.8–6.2)°С и на большинстве разрезов сохранялась выше средней. В диапазоне глубин дно–0 м средняя температура воды составляла 3.7 (2.8–4.5)°С, солёность − 31.1 (30.0–32.3)‰.
В планктонных пробах идентифицированы восемь видов рыб, принадлежащих к четырём отрядам и пяти семействам (таблица). По численности доминировали (95%) икринки и личинки рыб семейства камбаловых (Pleuronectidae). Из этого семейства отмечены четыре вида: хоботная камбала Limanda proboscidea (52%), малорот Стеллера Glyptocephalus stelleri (21%), охотоморская (узкозубая) палтусовидная камбала Hippoglossoides elassodon (2%) и звёздчатая камбала Platichthys stellatus (20%).
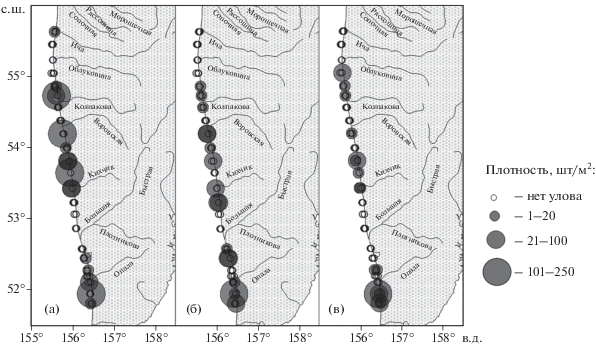
Икринки хоботной камбалы мелкие, диаметром 0.85–1.05 мм. Жировая капля отсутствует. Желток бесцветный. Перивителлиновое пространство небольшое, ~10% диаметра икринки. Оболочка тонкая, гладкая, без пигмента. Эмбрион слабо пигментирован. Пигментация эмбриона проявляется лишь на II стадии развития. Икринки хоботной камбалы от сходных икринок желтопёрой L. aspera и сахалинской камбал отличаются наличием на спине эмбриона среднего ряда из нескольких меланофоров. В пробах преобладали икринки I стадии − 89.3% (рис. 2). В большинстве случаев икринки хоботной, желтопёрой и сахалинской камбал невозможно различить на I стадии развития. Обнаруженные икринки I стадии развития, тем не менее, были отнесены к L. proboscidea, так как они были отмечены вместе с более поздними икринками, идентификация которых не вызывает сомнения, и личинкой этого вида. Икринки пойманы над глубинами от 5 до 25 м. Максимальные уловы икринок отмечены на средних и северных разрезах (рис. 3а) над глубинами 15–25 м. Наибольшая плотность (под 1 м2 поверхности моря) икринок составила 246 шт/м2.
Рис. 2.
Доля икринок хоботной камбалы Limanda proboscidea ( ), малорота Стеллера Glyptocephalus stelleri (
), малорота Стеллера Glyptocephalus stelleri ( ) и звёздчатой камбалы Platichthys stellatus (
) и звёздчатой камбалы Platichthys stellatus ( ) на разных стадиях развития в неритической зоне вблизи приустьевых участков рек западного
побережья Камчатки 05–09.06.2018 г.
) на разных стадиях развития в неритической зоне вблизи приустьевых участков рек западного
побережья Камчатки 05–09.06.2018 г.
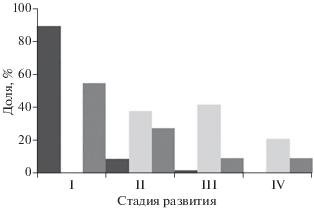
Рис. 3.
Распределение икринок хоботной камбалы Limanda proboscidea (а), малорота Стеллера Glyptocephalus stelleri (б) и звёздчатой камбалы Platichthys stellatus (в) в неритической зоне вблизи приустьевых участков рек западного побережья Камчатки 05–09.06.2018 г.
Таксономический состав ихтиопланктона в неритической зоне вблизи приустьевых участков рек западного побережья Камчатки 05–09.06.2018 г.
| Таксон | Икринки | Личинки | Глубина моря, м | |||
|---|---|---|---|---|---|---|
| число, шт. | стадия развития | диаметр, мм | число, экз. | длина (NL), мм | ||
| I. Отряд Osmeriformes | ||||||
| 1. Семейство Osmeridae | ||||||
| 1. Mallotus villosus | 3 | 6.0–15.0 | 15.0–18.0 | |||
| II. Отряд Gadiformes | ||||||
| 2. Семейство Gadidae | ||||||
| 2. Gadus chalcogrammus | 1 | 4.5 | 15.0 | |||
| III. Отряд Scorpaeniformes | ||||||
| 3. Семейство Agonidae | ||||||
| 3. Podothecus accipenserinus | 1 | 9.0 | 9.5 | |||
| 4. Семейство Liparidae | ||||||
| 4. Liparis latifrons | 1 | 4.0 | 10.7 | |||
| IV. Отряд Pleuronectiformes | ||||||
| 5. Семейство Pleuronectidae | ||||||
| 5. Glyptocephalus stelleri | 24 | II–IV | 1.40–1.50 | 5.0–25.0 | ||
| 6. Hippoglossoides elassodon | 1 | IV | 3.55 | 1 | 5.5 | 7.0–15.0 |
| 7. Limanda proboscidea | 56 | I–III | 0.85–1.05 | 3 | 2.6–2.8 | 5.0–25.0 |
| 8. Platichthys stellatus | 22 | I–IV | 1.10–1.30 | 7.5–18.0 | ||
| Всего | 103 | 10 | ||||
В центральной части района над глубинами 13, 15 и 25 м пойманы три только что вылупившиеся предличинки хоботной камбалы NL 2.6–2.8 мм. Антеанальное расстояние (aA) составляет 35% NL. Предличинки имеют двойной ряд меланофоров по нижнему краю тела в постанальной части и характерное пятно на спине в задней трети тела. По этим признакам их легко отличить от предличинок L. aspera и L. sakhalinensis (Григорьев, 2004б).
Икринки малорота Стеллера отмечены над глубинами 5–25 м. Наибольшее число икринок поймано на южных разрезах (рис. 3б) над глубиной 15 м южнее участка, на котором располагается продуктивная зона, сформированная под влиянием стока р. Большая. В этом районе плотность икринок составила 105 шт/м2, а их диаметр – 1.4–1.5 мм. Икринки прозрачные, крупные, имеют толстую оболочку с большим количеством складок. Перивителлиновое пространство узкое, ~8–9% диаметра икринки. Икринки II и III стадий развития находятся примерно в равном соотношении, а икринок IV стадии развития в два раза меньше (рис. 2). Пигментные клетки на теле эмбриона сгруппированы в виде отдельных мелких рассеянных точек. Важная особенность морфологии икринок этого вида – эмбрион лежит на одной стороне желтка и не охватывает желток по периметру.
Икринки звёздчатой камбалы разных стадий развития (рис. 2) пойманы почти на всех станциях (рис. 3в) над глубинами 7.5–18.0 м. Диаметр икринок 1.0–1.3 мм. Оболочка тонкая, гладкая, при фиксации в формалине приобретает розоватый оттенок. Перивителлиновое пространство небольшое, ~10% диаметра икринок. Пигментация раннего эмбриона в виде рассеянных точек. Ближе к вылуплению слабый пигмент в задней части эмбриона образует два ряда мелких меланофоров, расположенных латерально параллельно хорде. Икринки попадались единично, преимущественно в северной и центральной частях района съёмки, их максимальное скопление отмечено на юге (105 шт/м2).
Одна икринка охотоморской палтусовидной камбалы, близкая к вылуплению, была поймана на севере района исследования, над глубиной 15 м при температуре воды на поверхности 4.5°С и солёности 31.5‰. Икринки охотоморской палтусовидной камбалы легко идентифицировать. Икринки крупные (2.75–3.75 мм), прозрачные, оболочка тонкая, большое перивителлиновое пространство (~30% диаметра икринки). На хвосте эмбриона имеются характерные пигментные пояски. При вылуплении NL эмбриона 5.3–6.9 мм (Перцева-Остроумова, 1961; Григорьев, 2007). Пойманная икринка имеет характерные признаки этого вида.
Одна предличинка охотоморской палтусовидной камбалы NL 5.5 мм поймана на крайней северной точке района исследования над глубиной 7 м при температуре воды на поверхности 3.5°С и солёности 31.5‰. Тело предличинки окружено широкой плавниковой складкой, суживающейся к хвосту. Предличинка имеет три постанальных слабо заметных пигментных пояска, пигментные пятна на нижнем крае плавниковой складки, пигмент по верхнему, нижнему и заднему краям уростиля (вокруг конца уростиля). У пойманного экземпляра заметен желточный мешок овальной формы длиной ~ 1 мм; aA ~ 30% NL.
Личинки мойвы отмечены на трёх станциях в центральной части района исследования над глубинами 15–18 м (рис. 4). Две ранние личинки NL 6.0 и 9.5 мм пойманы над глубиной 15 м. Одна поздняя личинка NL 15.0 мм обнаружена на станции с глубиной 18 м. Все личинки имеют характерное тонкое, удлинённое тело, большое aA (77–78% NL). Пигментация личинок в виде одиночных рядов меланофоров вдоль средней линии брюха и по нижнему краю хвостового стебля.
Рис. 4.
Места единичных поимок икринок и личинок рыб в неритической зоне вблизи приустьевых
участков рек западного побережья Камчатки 05–09.06.2018 г.; икринки: ( ) – охотоморская палтусовидная камбала Hippoglossoides elassodon; личинки: (⚪) – H. elassodon, (◻) – мойва Mallotus villosus, (▽) – хоботная камбала Limanda proboscidea, (△) – минтай Gadus chalcogrammus, (◇) – многоусая лисичка Podothecus accipenserinus, (☆) – полосатый липарис Liparis latifrons.
) – охотоморская палтусовидная камбала Hippoglossoides elassodon; личинки: (⚪) – H. elassodon, (◻) – мойва Mallotus villosus, (▽) – хоботная камбала Limanda proboscidea, (△) – минтай Gadus chalcogrammus, (◇) – многоусая лисичка Podothecus accipenserinus, (☆) – полосатый липарис Liparis latifrons.
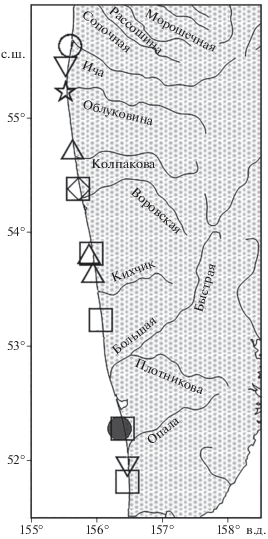
В северной части района съёмки над глубиной 15 м поймана единственная личинка минтая NL 4.5 мм, которая имеет все характерные признаки личинок этого вида: аА 40% NL, число туловищных миомеров 20, хвостовых 31, всего 51. Желточный мешок полностью резорбирован. Зачатки лучей в плавниках отсутствуют. Имеется пигмент на голове и брюшной стороне тела. Два характерных для личинок минтая пигментных пояска на хвосте хорошо выражены. На нижней стороне кишечника и в основании зачатков анального плавника присутствует ряд мелких рассеянных меланофоров. По всем морфологическим признакам личинка соответствует имеющимся описаниям (Matarese et al., 1989; Григорьев, 2007).
На севере полигона над глубиной 9.5 м поймана единственная личинка многоусой лисички Podothecus accipenserinus NL 9.0 мм. Основным отличительным признаком ранних личинок этого вида служит пигмент в области нижней челюсти (Busby, 1998; Григорьев, 2007). Тело личинки окружено плавниковой каймой, расширяющейся в области спинных и анального плавников, аА 47% NL, число туловищных миомеров 12, хвостовых 28, всего 40. Профиль брюшка состоит из двух частей. Лучи плавников не развиты. В спинном, анальном и хвостовом плавниках заметны зачатки лучей. Пигментация средней интенсивности. Заметны мелкие меланофоры на нижней челюсти и в области жаберных крышек, на боках в области кишечника, на основании грудного плавника и в постанальной части тела от ануса до хвостового стебля с распространением на анальную плавниковую кайму.
В центральной части района над глубиной 10.7 м поймана одна личинка NL 4.0 мм из семейства Liparidae, которая была идентифицирована как полосатый липарис Liparis latifrons. Личинки большинства видов этого семейства, обитающих у западного побережья Камчатки, не описаны, тем не менее ряд признаков совпадает с имеющимся описанием данного вида (Соколовский, Соколовская, 2003). В пользу правильности идентификации свидетельствует также широкое распространение и частая встречаемость этого вида у западного побережья Камчатки (Шейко, Федоров, 2000). Тело короткое, низкое, головастиковидное, заостряющееся к заднему концу, aA 35% NL. Голова выпуклая. Диаметр глаза составляет 3.4% NL или ~ 30% длины головы. Основание грудного плавника широкое, ограничено плавниковой каймой. Число миомеров: туловищных 12, хвостовых 38, всего 50. Личинка ранняя, зачатки лучей в плавниках едва заметны. Брюшной присасывательный диск зачаточный. Пигментация слабая в виде мелких рассеянных штрихов и точек.
ОБСУЖДЕНИЕ
В прибрежной мелководной эстуарной зоне в планктонных пробах были представлены икринки и личинки массовых видов рыб, распространённых у западного побережья Камчатки. Основную долю ихтиопланктона составляли икринки и личинки камбал. Прочие виды встречались единично. Ниже представлены обобщённые сведения о раннем развитии восьми видов рыб в восточной части Охотского моря с учётом новых данных по прибрежной мелководной зоне.
Наиболее массовым видом в планктонных пробах из прибрежного мелководья была хоботная камбала. Этот вид широко распространён и часто составляет большую численность в уловах. Хоботная камбала обычно держится на незначительной глубине, встречается в опреснённых участках моря вблизи устьев рек. Андрияшев (1954) указывал, что эта камбала приближается к берегам для нереста раньше других камбал и после нереста отходит от берегов позднее них. Нерестится над небольшими глубинами, где рыболовные суда работают редко. Отчасти это обстоятельство объясняет недостаток данных по нересту и раннему развитию этого вида. Нерест хоботной камбалы проходит в прибрежных водах, более мелководных, чем у других камбал, во всех районах её обитания. В Охотском море нерест длится с июня по сентябрь (Перцева-Остроумова, 1961; Григорьев, 2004б).
Существуют некоторые трудности видовой идентификации икринок хоботной камбалы, поскольку они очень сходны по морфологии и размеру с икринками близких видов камбал –желтопёрой и сахалинской, районы и сроки воспроизводства которых перекрываются. Икринки этих видов имеют одинаковый диаметр и сходную раннюю морфологию. Попытка выявить отличительные особенности икринок этих трёх видов была предпринята Николотовой (1970) на основе инкубации искусственно осеменённой икры. В этой работе взрослые особи сахалинской камбалы ошибочно идентифицированы как колючая камбала (А.В. Четвергов, КамчатНИРО, личное сообщение), что вполне вероятно, так как колючая камбала – очень редкий вид у побережья Камчатки. Несмотря на подробное описание и рисунки развивающихся икринок этих видов, надёжных признаков для видового разделения икринок выявлено не было. Наиболее полные сведения по размножению и раннему развитию хоботной камбалы приведены в публикациях Перцевой-Остроумовой (1961) и Григорьева (2004б, 2007). В настоящей работе принято, что сходные по раннему развитию виды желтопёрой и сахалинской камбал обитают и нерестятся дальше от берегов, и их икра, вероятно, распределяется вне зоны влияния эстуариев. Это обстоятельство в сочетании с некоторыми, хоть и не очень чёткими, морфологическими признаками послужило в пользу отнесения обнаруженных в пробах мелких икринок к виду хоботной камбалы.
Ранее икринки хоботной камбалы у побережья Западной Камчатки были обнаружены в июне 1999, 2001 и 2002 гг. над глубиной 30–60 м в небольшом количестве (до 30 шт/м2) (Григорьев, 2011), что, вероятно, связано с тем, что основные места развития икринок этого вида находились ближе к берегу, где съёмку не проводили. Личинки этой камбалы с июля встречались уже практически по всему шельфу Западной Камчатки (кроме самой южной его части). Наибольшие скопления личинок (~30 экз/м2) были отмечены в июне 2001 г. над глубиной 40 м в местах, совпадающих с расположением наиболее активных круговоротов водных масс, известных для шельфа Западной Камчатки и определяющих зоны повышенной продуктивности (Григорьев, 2011). Моисеев (1953) предполагал, что нерест хоботной камбалы у западного побережья Камчатки проходит с 1 июля по 5 августа. Наши данные показывают, что нерест в этом районе может начинаться значительно раньше – в конце мая–начале июня.
Малорот Стеллера – умеренно-бореальный вид, в небольшом количестве встречающийся у западных берегов Камчатки. Основной район его обитания находится южнее (Токранов, 2008). Весной для нереста малорот Стеллера подходит к берегам на глубину 20–50 м (Моисеев, 1953, Дехник, 1959). Известны случаи единичных поимок икринок и личинок малорота Стеллера в весенне-летний период (Расс, Желтенкова, 1948; Перцева-Остроумова, 1961; Григорьев, 2011). Большинство икринок этого вида ранее было поймано над глубинами менее 50 м. В первых числах июля там же отмечены личинки малорота Стеллера NL ~ 6 мм (Расс, Желтенкова, 1948; Перцева-Остроумова, 1961). Незначительные сведения по ранним стадиям развития малорота Стеллера связаны, видимо, с тем, что основная часть икринок и личинок развивается над небольшими глубинами, где суда, выполняющие планктонные съёмки, обычно не работают.
Перцева-Остроумова (1961) подробно описала эмбриональное развитие малорота Стеллера в искусственных условиях. Длительность инкубации при средней температуре 13.6°С составила 6 сут (~55 градусо-дней); вычисленный температурный порог развития − ~4.9°С. Учитывая более низкую температуру воды при развитии икринок этой камбалы у побережья Западной Камчатки (в среднем 4.5°С), длительность эмбрионального периода должна быть больше (12–14 сут), а порог развития − ниже. По предположению Перцевой-Остроумовой (1961), основанному на эмпирических данных, массовый нерест малорота Стеллера у западного побережья Камчатки проходит во второй половине июня на глубине ~50 м. Принимая во внимание поимки икры II–IV стадий развития 05–09.06.2018 г., пик нереста малорота Стеллера у западного побережья Камчатки должен приходиться на конец мая, а массовое вылупление – на середину июня.
Звёздчатая камбала – одна из наиболее распространённых и многочисленных камбал прибрежных вод северо-востока России. Держится в прибрежной полосе, заходит в эстуарии. Нерест проходит с апреля по июль в прибрежной мелководной зоне на глубинах менее 30 м (Перцева-Остроумова, 1961; Григорьев, 2007). Ранее (1999, 2001 и 2002 гг.) развивающихся икринок и ранних личинок звёздчатой камбалы у западного побережья Камчатки ловили в июле над глубиной 15–20 м (Григорьев, 2011). Число градусо-дней для инкубации икринок – 51 (Перцева-Остроумова, 1961). Длительность эмбрионального периода звёздчатой камбалы вблизи западного побережья Камчатки составит в этом случае ~12–13 сут. Перцева-Остроумова (1961) предположила, что пик нереста звёздчатой камбалы у западного побережья Камчатки проходит во второй половине мая, а нерест может быть растянут на 2–3 мес. Учитывая срок поимки и стадии развития икры в 2018 г., пик нереста звёздчатой камбалы в этой зоне должен приходиться на конец мая, а массовое вылупление – на середину июня.
Палтусовидные камбалы рода Hippoglossoides – многочисленные представители весеннего ихтиопланктона, но летом встречаются значительно реже, так как их массовый нерест проходит весной. По результатам предыдущих исследований (Григорьев, 2011, 2013), в июне–июле 1999, 2001 и 2002 гг. икринки охотоморской палтусовидной камбалы встречались единично в средней и северной частях западнокамчатского шельфа в поверхностном слое над глубинами 50–200 м. Концентрация икринок на широте эстуария р. Большая в 1984 г. достигала 450 шт/м2 над глубиной 45 м и 740 шт/м2 над глубиной 200 м. Уловы развивающейся икры ихтиопланктонной сетью имели место с марта по июль. Наибольшие уловы отмечены в мае. Встречались икринки всех стадий развития в примерно равном соотношении. Основная масса икринок локализована над глубинами 70–90 м. Ранее отмечена одна икринка этого вида на той же широте в июле над глубиной 55 м на стадии развития, близкой к вылуплению.
Личинки охотоморской палтусовидной камбалы NL 6–15 мм ранее встречались в планктоне с июля, были довольно широко распространены, отмечены по всему району съёмок, проводимых вдоль западного побережья Камчатки над глубинами от 20 до 200 м. Численность обычно не превышала 5 экз/м2, максимальная (~50 экз/м2) зафиксирована на 53°30′ с.ш. над глубиной 120 м (Григорьев, 2011, 2013). Поимка поздней икринки и ранней личинки охотоморской палтусовидной камбалы на станциях северного и южного разрезов съёмки 2018 г. показывает, что в июне эмбриональный период всё ещё продолжается по всему шельфу, но уже вступает в завершающую фазу. Поскольку основная масса икринок и личинок охотоморской палтусовидной камбалы в весенний период распределяется над значительными глубинами, единичные поимки икринок и личинок в прибрежной эстуарной зоне западного побережья Камчатки можно рассматривать как случайный занос, вызванный интенсивной циклонической активностью водных масс в этой части Охотского моря.
Мойва широко распространена как в Северной Атлантике, так и в северной части Тихого океана. Вдоль азиатского побережья она обитает от о-ва Хоккайдо до Чукотского моря. Тихоокеанская мойва нерестится в прибойной зоне на песчано-галечном грунте на глубине до 3–4 м. Нерест проходит в июне, вылупление личинок – в июне–июле (Савичева, 1982). Икринки мойвы демерсальные, слабоклейкие, в планктоне не встречаются. На ранних стадиях личинки мойвы очень похожи на личинок корюшек (речной малоротой Hypomesus olidus, морской малоротой H. japonicus и зубастой Osmerus dentex), а также на личинок тихоокеанской сельди Clupea pallasii, широко распространённых и многочисленных у западного побережья Камчатки. Нерест корюшек проходит в более ранние сроки, и их личинки на Камчатке развиваются в пресной воде, а личинки сельди отличаются большим антеанальным расстоянием (>80% NL) (Григорьев, 2007). Личинки мойвы вблизи берегов Западной Камчатки часто образуют большие скопления (>300 экз/м2 над глубинами 15–40 м) (Григорьев, 2003). Молодь этого вида развивается у поверхности, разносится течениями. Поимка личинок мойвы в мелководной прибрежной зоне подтверждает известные сведения о сроках нереста и раннего развития этого вида у западного побережья Камчатки и показывает широкий разнос течениями развивающихся в планктоне личинок.
Минтай – самая многочисленная тресковая рыба в Тихом океане, обитает в толще воды, но для нереста часто подходит к берегам, на мелководья до 50–100 м. Массовый нерест проходит весной, хотя известно, что нерест длится с января по август (Горбунова, 1954). Замечено, что интенсивность нереста минтая и число его икринок в планктоне в конце мая–июне резко падает, но возрастает численность личинок. Однако есть сведения и о массовом нересте минтая вблизи юго-западного побережья Камчатки в мае (Фадеев, 1981).
Основные нерестилища этого вида находятся вблизи западного побережья Камчатки. Нерестовые скопления минтая бывают очень плотными; численность вымётываемой плавучей икры на нерестилищах может достигать 30 тыс. шт/м2. Личинки развиваются в толще воды и переносятся течениями. Ранее (1988, 1999, 2001 и 2002 гг.) икринки и личинки минтая на шельфе Западной Камчатки попадали в планктонные пробы в июне практически над всем шельфом (15–200 м), но наибольшие плотности приходились на глубины ~100 м (Григорьев, 2005а). Поимка личинки минтая в июне 2018 г. в прибрежной эстуарной зоне, скорее всего, вызвана большой численностью личинок, их широким распределением и разносом течениями в результате активной циркуляции водных масс вблизи западного побережья Камчатки. Поимка личинки минтая подтверждает наличие нереста минтая вблизи западного побережья Камчатки в конце мая–начале июня.
Многоусая лисичка – широко распространённый вид в северной части Тихого океана, включая шельф Западной Камчатки. Взрослые особи отмечены на глубинах 18–300 м над мягким субстратом. Места и сроки нереста неизвестны. Икринки демерсальные, клейкие. Личинки пелагические (Busby, 1998). О распространении личинок сведений мало. В водах Аляски личинки многоусой лисички SL 7–19 мм присутствуют в планктонных сборах с апреля по июнь при максимальной численности 8 экз/10 м2. Личинки редки, в планктонных пробах встречаются в менее чем 5% проб за год (Matarese et al., 2003). В шельфовых водах Западной Камчатки личинки ранее встречались единично в планктонных пробах в июле 2001 г. над глубинами 15–20 м (Григорьев, 2013). Поимка личинки многоусой лисички в прибрежной мелководной зоне подтверждает распространение этого вида ранних стадий развития в восточной части Охотского моря.
Полосатый липарис – вид, широко распространённый в восточной части Охотского моря. Всего липаровых рыб описано около 20 родов и более 150 видов (Burke, 1930; Солдатов, Линдберг, 1930; Линдберг, Красюкова, 1987). В российских водах северной части Тихого океана обитают 55 видов семейства Liparidae, из них 16 относят к роду Liparis (Шейко, Федоров, 2000). Этот род представляет собой конгломерат таксонов, описания которых скудны и часто несопоставимы. Многие таксоны известны только из первоописаний. В последние годы обоснованность двух десятков видов рода Liparis была поставлена под сомнение (Chernova, 2008). Взрослые особи этого рода встречаются от приливной зоны до абиссальных глубин. Большинство видов ведут придонный образ жизни. Большой биомассы липарисы обычно не образуют, что, отчасти, служит причиной их недостаточной изученности. В умеренных и холодных водах рыбы семейства Liparidae составляют значительную долю ихтиофауны. При проведении учётных траловых съёмок на участке материкового склона уловы липаровых рыб достигают 3 т/ч траления (Токранов, 2000). В Охотском море общая биомасса липаровых рыб превышает 50 тыс. т, а доля видов рода Liparis составляет >20% (Фадеев, 2005).
Сведений о раннем развитии липарисов очень мало. Описания личинок доступны лишь для некоторых видов (Able et al., 1984; Kido, Kitagawa, 1986; Григорьев, 2002; Соколовский, Соколовская, 2003; Большакова и др., 2018). Известно, что нерест проходит в прибрежной зоне на скальных грунтах. Икринки клейкие, прикреплённые к грунту. У большинства видов вылупляются развитые личинки. Личинки пелагические или придонные. В американских водах идентифицированы личинки 18 видов рода Liparis. Личинки SL 3–15 мм (большинство SL < 10 мм) зарегистрированы в весенне-летний период с наибольшей численностью в июне, встречались редко − в небольшом количестве в течение менее половины лет исследований (Matarese et al., 2003).
В прикамчатских водах, как вблизи западного, так и восточного побережий, личинки рода Liparis нередко встречаются в планктонных пробах. В восточной части Охотского моря личинки ранее встречались единично в июле–августе (Григорьев, 2004а). Данные по распространению полосатого липариса в сочетании с известными морфологическими признаками личинок позволяют надеяться на правильность видовой идентификации личинки, несмотря на отсутствие описания раннего развития многих видов этого рода. Поимка личинки полосатого липариса в мелководной прибрежной части шельфа может свидетельствовать о весенне-летнем нересте этого вида и широком распространении его личинок в прибрежной зоне.
ЗАКЛЮЧЕНИЕ
В прибрежной мелководной зоне, находящейся под влиянием стока рек, в планктонных пробах были представлены массовые виды рыб ранних стадии развития, распространённые у западного побережья Камчатки. По численности преобладали икринки камбал: хоботной, звёздчатой и малорота Стеллера. Доля икринок хоботной камбалы составляла более половины всех отловленных икринок. Наибольшая расчётная плотность икринок хоботной камбалы составила 246 шт/м2, звёздчатой камбалы и малорота Стеллера − 105 шт/м2. Личинки мойвы, минтая, многоусой лисички, полосатого липариса, охотоморской палтусовидной камбалы и хоботной камбалы встречались единично. Районы массового развития икринок и личинок рыб находятся вблизи двух антициклонических круговоротов: у юго-западного побережья Камчатки и севернее, над впадиной ТИНРО. На периферии этих круговоротов происходит выход глубинных вод, богатых биогенными веществами, которые оказывают влияние на продуктивность прибрежной эстуарной зоны.
Собранный в 2018 г. материал, к сожалению, не позволяет достоверно оценить реальную численность ихтиопланктона на полигоне съёмки, так как использованное орудие лова с небольшим диаметром входного отверстия рассчитано на лов мелких массовых и малоподвижных планктонных организмов: фитопланктона и зоопланктона. Наиболее репрезентативными данными можно считать результаты подсчёта численности икринок хоботной камбалы. Для более полного представления об ихтиопланктоне мелководных участков прибрежной зоны необходимо применение специальных орудий лова и выполнение тралирующих (косых) ловов.
Результаты выполненных исследований позволили уточнить сроки нереста и раннего развития массовых видов камбал. Полученные данные показывают, что нерест хоботной камбалы вблизи западного побережья Камчатки может начинаться в конце мая–начале июня. Пик нереста малорота Стеллера и звёздчатой камбалы у западного побережья Камчатки, по расчётам, приходится на конец мая, а массовое вылупление – на середину июня. Эмбриональный период охотоморской палтусовидной камбалы в июне всё ещё продолжается по всему шельфу, но уже вступает в завершающую фазу.
Список литературы
Андрияшев А.П. 1954. Рыбы северных морей СССР. М.; Л.: Изд-во АН СССР, 566 с.
Балыкин П.А., Винников А.В., Максименков В.В. 1991. Ихтиопланктон восточной части Охотского моря в мае–июне 1987 г. // Вопр. ихтиологии. Т. 31. Вып. 1. С. 158–161.
Большакова Я.Ю., Евсеенко С.А., Гордеева Н.В. и др. 2018. Ихтиопланктон арктических морей России. 2. Морфология личинок морских слизней рода Liparis (Liparidae) // Там же. Т. 58. № 6. С. 635–672. https://doi.org/10.1134/S0042875218060036
Горбунова Н.Н. 1954. Размножение и развитие минтая // Тр. ИО АН СССР. Т. 11. С. 132–196.
Григорьев С.С. 1997. Летний ихтиопланктон восточной части Охотского моря // Тез. докл. I конгресса ихтиологов России. М.: Изд-во ВНИРО. С. 15.
Григорьев С.С. 2002. Описание личинок и мальков двух видов липаровых рыб – Nectoliparis pelagicus и Polypera greeni из прикамчатских вод // Вопр. ихтиологии. Т. 42. № 2. С. 215–220.
Григорьев С.С. 2003. Распределение личинок мойвы над шельфом Западной Камчатки летом 2001 г. // Матер. IV науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Изд-во КамчатНИРО. С. 191–194.
Григорьев С.С. 2004а. Летний ихтиопланктон прикамчатских вод Охотского моря // Тр. КФ ТИГ ДВО РАН. Вып. V. С. 37–46
Григорьев С.С. 2004б. Описание личинок хоботной камбалы Limanda proboscidea (Pleuronectidae) из Охотского моря // Вопр. ихтиологии. Т. 44. № 2. С. 232–238.
Григорьев С.С. 2005а. Летнее распределение икринок и личинок минтая на шельфе Западной Камчатки // Вопр. рыболовства. Т. 6. № 4 (24). С. 653–666.
Григорьев С.С. 2005б. Летнее распределение икринок и личинок камбал в восточной части Охотского моря // Матер. Всерос. конф. “Наука Северо-Востока России – начало века”. Магадан: Изд-во СВНЦ ДВО РАН. С. 376–379.
Григорьев С.С. 2007. Ранние стадии рыб северо-востока России (прибрежные морские воды и внутренние водоемы). Атлас-определитель. Владивосток: Дальнаука, 331 с.
Григорьев С.С. 2011. Распределение икринок и личинок камбал (Pisces: Pleuronectidae) на шельфе Западной Камчатки в летний период // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 20. С. 12–22.
Григорьев С.С. 2013. Раннее развитие морских рыб северо-востока России. Морфобиологическая характеристика, особенности распределения. Saarbrucken: LAP Lambert Acad. Publ., 348 с.
Дехник Т.В. 1959. Материалы по размножению и развитию некоторых дальневосточных камбал // Исследования дальневосточных морей СССР. Вып. 6. М.: Изд-во АН СССР. С. 109–131.
Золотов О.Г., Максименков В.В., Николотова Л.А. 1990. Состав личинок рыб в восточной части Охотского моря и их питание // Изв. ТИНРО. Т. 111. С. 58–66.
Крашенинников С.П. 1948. Описание земли Камчатки. М.: ОГИЗ, 292 с.
Лепская Е.В., Бонк Т.В., Сушкевич А.С. и др. 2019. Условия среды в морском прибрежье основных бассейнов воспроизводства горбуши Oncorhynchus gorbusha Западной Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 53. С. 22–33.
Линдберг Г.У., Красюкова З.В. 1987. Рыбы Японского моря и сопредельных частей Охотского и Жёлтого морей. Ч. 5. Л.: Наука, 526 с.
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Изв. ТИНРО. Т. 40. 288 с.
Наумова Т.Н., Коломейцев В.В. 2015. Некоторые данные о биологии и распределении личинок мойвы (Mallotus villosus catervarius) на шельфе Западной Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 38. С. 84–92. https://doi.org/10.15853/2072-8212.2015.38.84-92
Николотова Л.А. 1970. Материалы по эмбриональному развитию некоторых видов камбал // Тр. ТИНРО. Т. 74. С. 22–42.
Перцева-Остроумова Т.А. 1961. Размножение и развитие дальневосточных камбал. М.: Изд-во АН СССР, 484 с.
Полутов И.А., Трипольская В.Н. 1954. Пелагическая икра и личинки морских рыб у берегов Камчатки // Изв. ТИНРО. Т. 41. С. 295–308.
Расс Т.С. 1949. Икринки и личинки рыб Баренцева моря // Тр. ВНИРО. Т. 17. С. 37–38.
Расс Т.С., Желтенкова М.В. 1948. Некоторые данные об ихтиопланктоне Западной Камчатки // Изв. ТИНРО. Т. 28. С. 139–150.
Савичева Э.А. 1982. Эмбриональное развитие дальневосточной мойвы Mallotus villosus socialis (Pallas) (Osmeridae) восточной части Охотского моря // Вопр. ихтиологии. Т. 22. Вып. 2. С. 253–258.
Сафронов С.Г. 1981. О нейстоне прикамчатских вод Охотского моря // Биология моря. № 4. С. 73–74.
Сафронов С.Г., Токранов А.М. 1984. Результаты исследований ихтиопланктона приповерхностного слоя восточной части Охотского моря // Тез. докл. Всесоюз. конф. “Природная среда и проблемы изучения, освоения и охраны биологии ресурсов морей СССР и Мирового океана”. Л.: Геогр. о-во СССР. С. 157–158.
Соколовский А.С., Соколовская Т.Г. 2003. Личинки и мальки рыб рода Liparis (Pisces, Liparidae) из северо-западной части Японского моря // Биология моря. Т. 29. № 5. С. 339–350.
Солдатов В.К., Линдберг Г.У. 1930. Обзор рыб дальневосточных морей // Изв. ТИНРО. Т. 5, 576 с.
Токранов А.М. 2000. Видовой состав и пространственное распределение липаровых рыб (Liparidae) в тихоокеанских водах юго-восточной Камчатки и северных Курильских островов // Вопр. ихтиологии. Т. 40. № 2. С. 176–186.
Токранов А.М. 2008. Особенности распределения и некоторые черты биологии малорота Стеллера Glyptocephalus stelleri (Pleuronectidae) в прикамчатских водах Охотского моря // Там же. Т. 48. № 6. С. 790–801.
Токранов А.М., Сафронов С.Г. 2004. Ихтионейстон прикамчатских вод Охотского моря // Тр. КФ ТИГ ДВО РАН. Вып. 5. С. 273–285.
Фадеев Н.С. 1981. Сроки размножения и нерестовых подходов минтая // Экология запасов и промысел минтая. Владивосток: Изд-во ТИНРО. С. 3–18.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Шейко Б.А., Федоров В.В. 2000. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных животных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Able K.W., Markle D.F., Fahay M.P. 1984. Cyclopteridae: Development // Ontogeny and systematics of fishes. Lawrence: Allen Press. P. 428–437.
Burke V. 1930. Revision of the fishes of the family Liparidae // Bull. US Nat. Mus. № 150. 204 p.
Busby M.S. 1998. Guide to the identification of larval and early juvenile poachers (Scorpaeniformes: Agonidae) from the Northeastern Pacific Ocean and Bering Sea // US Dept. Comm. NOAA Tech. Rept. NMFS 137. 88 p.
Froese R., Pauly D. (eds.). 2020. FishBase. World Wide Web electronic publication. (http://www.fishbase.org. Version 12/2020)
Chernova N.V. 2008. Systematics and phylogeny of fish of the genus Liparis (Liparidae, Scorpaeniformes) // J. Ichthyol. V. 48. № 10. P. 831–852. https://doi.org/10.1134/S0032945208100020
Kido K., Kitagawa D. 1986. Development of larvae and juveniles of Rhinoliparis barbulifer (Liparididae) // Indo-Pacific Fish Biology / Eds. Uyeno T. et al. Tokyo: Ichthyol. Soc. Jpn. P. 697–702.
Matarese A.C., Kendall A.W. Jr., Blood D.M., Vinter B.M. 1989. Laboratory guide to early life history stages of Northeast Pacific fishes // US Dept. Comm. NOAA Tech. Rept. NMFS 80. 652 p.
Matarese A.C., Blood D.M., Picquelle S.J., Benson J.L. 2003. Atlas of abundance and distribution patterns of ichthyoplankton from the Northeast Pacific Ocean and Bering Sea ecosystems based on research conducted by the Alaska Fisheries Science Center (1972–1996) // NOAA Prof. Pap. NMFS 1. 288 p.
WoRMS Editorial Board. 2021. World Register of Marine Species. https://doi.org/10.14284/170
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


