Вопросы ихтиологии, 2022, T. 62, № 1, стр. 3-18
Филогенетические отношения и таксономия карповых рыб рода Hemiculter (Cyprinidae, Xenocypridinae): востробрюшки видовой группы H. leucisculus
Е. Д. Васильева 1, *, В. П. Васильев 2, Г. А. Немкова 3, С. В. Шедько 3
1 Зоологический музей Московского государственного университета
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
3 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии
Дальневосточного отделения РАН – ФНЦ биоразнообразия ДВО РАН
Владивосток, Россия
* E-mail: vas_katerina@mail.ru
Поступила в редакцию 15.12.2020
После доработки 21.12.2020
Принята к публикации 22.12.2020
- EDN: ZEJLAC
- DOI: 10.31857/S0042875222010167
Аннотация
Анализ филогенетических отношений востробрюшек из группы Hemiculter leucisculus s.l. на основе изменчивости гена цитохрома b подтвердил наличие трёх дифференцированных филетических линий, соответствующих кладам А, В, С sensu Chen et al. (2017). Линия, соответствующая кладе С, объединяет особей с областью распространения от бассейна Амура до водоёмов юга Вьетнама, включая типовое местообитание H. leucisculus s. str. Сравнительные морфологические исследования ваучерных экземпляров и материалов из коллекции Зоологического музея МГУ с обзором доступных данных литературы показали, что пригодным названием для востробрюшек из бассейна верхнего течения р. Янцзы, образующих кладу В, является H. nigromarginis. Этот вид отличается от H. leucisculus бόльшим числом жаберных тычинок: 25–28 против 13–20. Филетическая линия, объединяющая образцы из бассейна Жемчужной реки и кладу А, рассматривается в статусе нового вида, описанного в настоящей работе. По многим морфологическим характеристикам он сходен с аллопатричным H. leucisculus, отличаясь более короткими грудными плавниками, сдвинутым каудально основанием брюшных плавников, коротким подключичным выростом и более длинным вторым жёстким лучом спинного плавника. По результатам исследования филогенетических отношений видов рода Hemiculter и видов близких родов подсемейства Xenocypridinae сделан вывод: публикации молекулярно-генетического анализа групп рыб, где существуют проблемы идентификации таксонов, должны сопровождаться морфологическими описаниями ваучерных экземпляров, подтверждающими правильность их определения.
Род Hemiculter Bleeker, 1860 объединяет некрупных карповых рыб (Cyprinidae), характеризующихся длинным, не покрытым чешуёй килем на брюхе от основания грудных плавников до анального отверстия; трёхрядными глоточными зубами, двухкамерным плавательным пузырем, широкой третьей подглазничной костью, незазубренным последним неветвистым лучом спинного плавника и коротким кожным выростом с внутренней стороны основания грудного плавника (Luo, Chen, 1998; Dai, Yang, 2003). Согласно современной классификации этот род входит в состав подсемейства Xenocypridinae Günther, 1868 (Tan, Armbruster, 2018) и включает восемь валидных видов, естественный ареал которых охватывает пресные водоёмы Восточной Азии, включая воды Дальнего Востока России, Монголии, Южной и Северной Кореи, Китая и Вьетнама (Берг, 1949; Mai, 1985; Васильева, Козлова, 1988; Luo, Chen, 1998; Kottelat, 2001, 2006; Kim, Park, 2002; Dai, Yang, 2003; Serov et al., 2006; Froese, Pauly, 2019; Fricke et al., 2020). Однако структура рода, его филогенетические отношения с морфологически сходными номинальными таксонами и номенклатура видов до сих пор остаются дискуссионными. Так, несмотря на опубликованные ревизии (Bănărescu, 1968; Васильева, Козлова, 1988), в некоторых сводках (Цой, 1964; Kim, Park, 2002) приняты ошибочные представления о пригодности названий для дифференцируемых много- и малотычинковых видов и их синонимии, ведущие начало от работ Никольского (1947, 1956) и Берга (1949); до сих пор для вида из верховьев Янцзы используется название H. tchangi Fang, 1942 (Luo, Chen, 1998; Froese, Pauly, 2019; Fricke et al., 2020).
Современные результаты исследования филогеографии нативных популяций востробрюшек рода Hemiculter (Chen et al., 2017) и наши предварительные данные свидетельствуют о более сложной структуре рода, находящейся в противоречии с принятой в настоящее время таксономией. В этой связи целью наших исследований является выяснение филогенетических связей локальных групп популяций и таксономии представителей рода Hemiculter, уточнение положения рода в системе карповых рыб, родовая дифференциация близких таксонов, выявление диагностических морфологических видовых и родовых признаков и ревизия номенклатуры. Настоящая работа посвящена группе так называемых малотычинковых востробрюшек, объединённых ранее (Васильева, Козлова, 1988) в один вид H. leucisculus (Basilewsky, 1855) и характеризующихся малым числом жаберных тычинок на 1-й жаберной дуге (sp.br. 15–21, в среднем 16–18), наличием не более 14 (обычно не более 12) ветвистых лучей в анальном плавнике, началом спинного плавника, расположенным ближе к началу хвостового плавника, чем к концу рыла, и резко изгибающейся вниз у грудного плавника боковой линией, в которой 40–59 (в среднем 46–51) прободённых чешуй (Васильева, Козлова, 1988; Васильева, 2004).
МАТЕРИАЛ И МЕТОДИКА
Морфологические исследования проводили на материалах из коллекции Зоологического музея МГУ (ЗММУ). Описания даны в соответствии с этикеточными данными. В общей сложности были изучены 84 экз. H. leucisculus из разных водоёмов в пределах нативного ареала и 12 экз. востробрюшек из бассейна Жемчужной реки, отнесённых в результате проведённого исследования к новому виду, описание которого дано в настоящей работе (характеристика типового материала приведена в описании).
Бассейн р. Амур: Р-6137 − 5 экз., оз. Петропавловское, 80 км ниже Хабаровска, 15.08.1946 г., коллектор Г.В. Никольский; Р-6138 − 1 экз., озерко против Даерги, 12.08.1946 г., коллектор Г.В. Никольский; Р-6155 − 1 экз., Болонь, 29.07.1946 г., коллектор Г.В. Никольский; Р-6164 − 1 экз., озерко против Даерги, август 1946 г., коллектор Г.В. Никольский; Р-6391 − 4 экз., Болонь, протока Сий, 30.07.1947 г., коллектор Г.В. Никольский; Р-6438 − 1 экз., Амур у Елабуги, 10.06.1947 г., коллектор Г.В. Никольский; Р-6472 − 1 экз., Амур у Елабуги, оз. Медовое, коллектор Г.В. Никольский; Р-6801 − 1 экз., Болонь, лето 1947 г., коллектор М.Н. Лишев; Р-7794 − 1 экз., верхняя Елабуга, 30.07.1949 г.; Р-7795 − 2 экз., Амур у Красносельского, 01.08.1949 г.; Р-8446 − 2 экз., Амур; Р-8619 − 4 экз., Болонь, проток Серебряный, 10.07.1947 г.; Р-9724 − 2 экз., Болонь, 31.04.1945 г., коллектор Смирнов.
Бассейн оз. Ханка: Р-7601 − 9 экз., оз. Ханка, 10.07.1949 г., коллектор В.Д. Лебедев; Р-8397 − 10 экз., оз. Ханка, 20.07.1948 г., коллектор И.И. Куренков; Р-8506 − 1 экз., оз. Ханка, 16−20.08.1948 г., коллектор И.И. Куренков; Р-20035 − 10 экз. из 28 экз. молоди в пробе, р. Астраханка, 12.09.1996 г., коллектор В.П. Васильев; Р-20063 − 2 экз., каналы рисовых чеков у дер. Владимиро-Петровка, 20.09.1996 г., коллектор В.П. Васильев.
Китай: P-8158 − 1 экз., “Liang the Ha Lake, Hupel Province” (? оз. Лянцзы (Liangzi Lake), провинция Хубэй (Hubei)); P-22219 − 1 экз., р. Мансиньцзян (Manxijiang), Юнцзя, Вэньчжоу, провинция Чжэцзян (Yong Jia County, Wenzhou, Zhejiang), май 2009 г., коллектор Юнь Гао (Yun Gao); P-22220 − 4 экз., оз. Фу Сянь (Fu Xian Lake), Юйси, провинция Юньнань (Yuxi, Yunnan), сентябрь 1989 г., проба из зоологического музея в Китае; P-22221 − 5 экз., оз. Диан (Dien Chi Lake), Куньмин, провинция Юньнань (Kunming, Yunnan), проба из зоологического музея Китая; P-22264 − 1 экз., Ухань (Wuhan), провинция Хубэй (Hubei), куплен на рынке 27.10.2009 г., коллектор Е.Д. Васильева; Р-22265 − 13 экз., Пекин, куплены на утреннем продовольственном рынке 05.11.2009 г., коллектор Е.Д. Васильева.
Вьетнам: Р-9188 − 1 экз., Вьетнам, 1959 г., коллектор Дао Вань Тьен.
У всех особей измеряли стандартную длину (SL) и анализировали признаки, использовавшиеся при дифференциации и описании разных номинальных видов рода Hemiculter и близких таксонов (Bănărescu, 1968; Васильева, Козлова, 1988; Luo, Chen, 1998; Tan, Armbruster, 2018). Ранее изменчивость морфометрических признаков, традиционно используемых в исследованиях карповых рыб, мы изучили на 276 экз. H. leucisculus из популяций, акклиматизировавшихся в водоёмах Казахстана и Средней Азии (Васильева, Козлова, 1989). В связи с полученными результатами часть признаков, продемонстрировавших высокую внутрипопуляционную изменчивость, была исключена из настоящего анализа, в который также не включены материалы по акклиматизантам, поскольку в этих популяциях была выявлена направленная хронологическая изменчивость и формирование в новом ареале популяций, по ряду признаков характеризующихся фенотипом, промежуточным по отношению к много- и малотычинковым востробрюшкам; возможные причины этого обсуждались ранее (Васильева, Козлова, 1989).
В то же время в сравнительный анализ были включены новые индексы, такие как относительная длина кожного подключичного выроста (flepl − flesh slip at the pectoral fin base) (Dai, Yang, 2003. Р. 78) и отношение пектовентрального расстояния к вентроанальному (P−V/V−A). Измерения производили штангенциркулем. Статистический анализ выполнен с применением программного пакета MS Excel; значимость различий между выборками оценивали на основе критерия U (Вилкоксона–Манна–Уитни).
Секвенирование митохондриального гена цитохрома b (cyt b) проведено у 51 образца, ваучерные экземпляры которых хранятся в ЗММУ (номера проб указаны) или ФНЦ биоразнообразия ДВО РАН (пробы без номеров). H. leucisculus: Ухань, провинция Хубэй, Китай, P-22264 (n = 1); р. Мансиньцзян, Вэньчжоу, провинция Чжэцзян, Китай, P-22219 (n = 1); Пекин, Китай, Р-22265 (n = 8); оз. Ханка, РФ (n = 20); р. Сунгари, Китай (n = 1); р. Раздольная, РФ (n = 2). Экземпляры из Жемчужной реки, описанные в настоящей работе как самостоятельный вид рода Hemiculter: р. Чжуцзян (Zhujiang), провинция Гуандун, Китай, Р-22216 и Р-24429 (n = 5). H. bleekeri Warpachowski, 1888: р. Янцзы, провинция Хубэй, Китай, Р-222940 (n = 8). Pseudolaubuca engraulis (Nichols, 1925): р. Янцзы, провинция Хубэй, Китай, P-22263 (n = 1). Pseudohemiculter hainanensis (Boulenger, 1900): р. Мансиньцзян, провинция Чжэцзян, Китай, P-22217 (n = 4).
Образцы для выделения ДНК представляли собой кусочки грудных плавников, фиксированные в 96%-ном спирте. Тотальная ДНК была выделена солевым способом (Aljanabi, Martinez, 1997) с использованием протеиназы K. Полноразмерная последовательность гена cyt b была амплифицирована с помощью праймеров FishcytB-F и THR-Fish-R (Sevilla et al., 2007). Амплификацию проводили на термоциклере Biometra Tprofessional (“Biometra”, Германия) в 25 мкл реакционной смеси, включавшей 0.1–0.2 мкг тотальной ДНК, 2.5 мкл буфера (60 мМ Трис-HCl, pH 8.5; 1.5 мМ MgCl2, 25 мM KCl, 10 мM 2-меркаптоэтанол, 0.1% Тритон X-100), 0.5 мкл суммы дезокситрифосфатов из 10 мМ раствора, по 2.5 мкл обоих праймеров (“Синтол”, Москва) из их 2 мкМ растворов, 1 Е Taq-полимеразы (“СибЭнзим”, Новосибирск) и деионизированную воду.
Полимеразную цепную реакцию проводили по следующей схеме: начальная денатурация (94°C – 120 с), 30 циклов амплификации (94° – 45 с, 50° – 30 с, 72° – 60 с) и достройка цепей (72° – 480 с). Продукты амплификации очищали этаноловым переосаждением и секвенировали с помощью набора Big Dye Terminator версии 3.1 (“Applied Biosystems”, США) при использовании праймеров FishcytB-F, THR-Fish-R, CytBI-1F и CytBI-3R (Sevilla et al., 2007). Продукты реакции разгоняли на автоматическом анализаторе ABI Prizm 3130 (“Applied Biosystems”, США/“Hitachi”, Япония) из приборной базы ЦКП “Биотехнология и генетическая инженерия” ФНЦ биоразнообразия ДВО РАН (Владивосток). ABI-хроматограммы собирали в контиги с помощью программ из пакета Staden (Staden et al., 2000). Различные манипуляции с нуклеотидными последовательностями проводили с помощью пакетов программ Seaview (Gouy et al., 2010) и FaBox (Villesen, 2007).
Кроме собственных материалов, в работе использованы данные по последовательностям гена cyt b у ряда видов, взятые из Генетического банка (Genbank) − Anabarilius andersoni (Regan, 1904) (MH797120); Pseudolaubuca engraulis (KC429670, MH797110, MH797111); P. sinensis Bleeker, 1864 (KP410284, KY471356, MH797112, MH797113); Pseudohemiculter hainanensis (MH797096); P. dispar (Peters, 1881) (KC306507, KF029700, MH797094); Hemiculterella sauvagei Warpachowski, 1888 (KP316066, MH797092, MH797093); H. macrolepis Chen, 1989 (EF151094, MH688200); Hainania serrata Koller, 1927 (KF029692); Hemiculter krempfi Pellegrin et Chevey, 1938 (KF029694); H. leucisulus из Кореи (KF760455–KF760460), Вьетнама (DQ464973) и малотычинковых востробрюшек из Китая, которые представлены последовательностями гена cyt b серий KY292XXX и KF02XXXX, вошедшими в три клады – А, B, C – из работы Чена с соавторами (Chen et al., 2017. Table S1 ). В настоящей работе использовали только уникальные варианты гаплотипов: из клады А – все 26 уникальных гаплотипов серии KY292XXX из Жемчужной реки (Pearl), из клады B – все 22 уникальных гаплотипа серии KF02XXXX из верхнего течения р. Янцзы (Yangtze), из клады C – 119 уникальных гаплотипов серий KY292XXX и KF02XXXX из среднего и нижнего течения Янцзы, три гаплотипа из бассейна Меконга (Lancangjiang R.) и пять гаплотипов из Жемчужной реки.
Филогенетическое дерево строили методом максимального правдоподобия с помощью программы IQ-TREE v. 1.6.12 (Nguyen et al., 2015; Chernomor et al., 2016) с активированной опцией “spp” при использовании оптимальных моделей нуклеотидных замещений (TN+F+I+G4 и TIM2+F+G4), подобранных в указанной программе для двух подразделений нуклеотидных последовательностей гена cyt b: 1) первой и второй, а также 2) третьей позиции в кодонах. Для поиска филогенетически оптимального дерева всего было произведено 20 независимых запусков программы с последующим отбором наилучшего дерева исходя из полученных значений ln L. Устойчивость ветвлений филогенетического дерева оценивали в 2000 псевдослучайных репликах сверхбыстрого бутстрепа (Hoang et al., 2018). На полученном дереве (рис. 1), как и на дереве из работы Чена с соавторами (Chen et al., 2017. Fig. 2a), не приведены обозначения гаплотипов, отнесённых в цитируемой работе к трём кладам H. leucisulus, поскольку главной задачей анализа была оценка положения полученных новых образцов и ряда гаплотипов из Генетического банка по отношению к этим кладам, а также гаплотипам, представлявшим другие виды рода Hemiculter и виды близких к нему родов.
Рис. 1.
Оптимальное ML-дерево (ln L = –7358.70), построенное для последовательностей гена cyt b востробрюшек рода Hemiculter и представителей близких родов. Цифры у основания клад – оценки бутстреп-поддержки (в % от 2000 циклов; показаны только для основных клад и только превышающие уровень 70%); A, B, C − три клады малотычинковых востробрюшек, выявленные ранее (Chen et al., 2017), названия гаплотипов из-за экономии места не приведены; полужирным шрифтом выделены последовательности, полученные в настоящей работе.
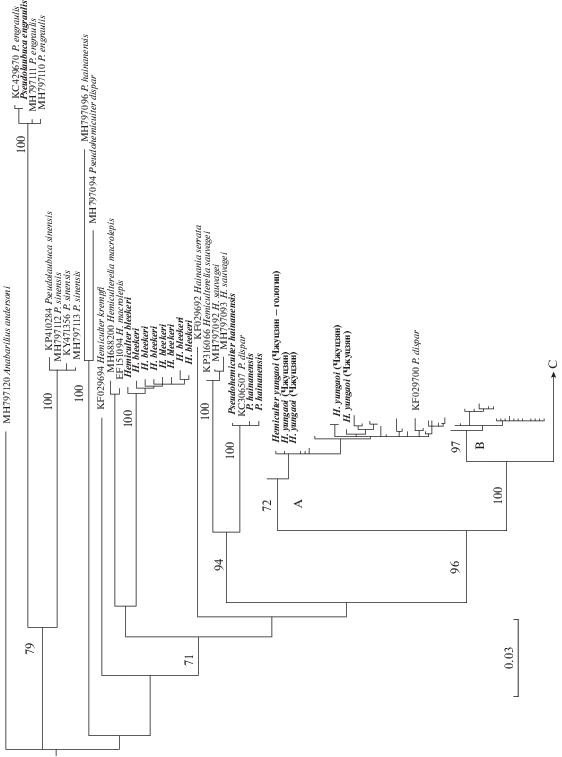
Рис. 1.
Окончание.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Филогеография востробрюшек группы H. leucisculus и филетические отношения представителей близких родов Xenocypridinae на основе анализа митохондриального гена cyt b
Нуклеотидные последовательности гена cyt b были определены у 51 образца (депонированы в Genbank под номерами доступа MW367248−MW367298). Всего выявлено 33 уникальных гаплотипа, которые были использованы в последующем анализе. Вместе с последовательностями cyt b, взятыми из Genbank, размерность выровненной матрицы данных составила 234 нуклеотидных последовательности на 1141 пар нуклеотидов (п.н.). Филогенетическое дерево, построенное на базе этой матрицы методом максимального правдоподобия, приведено на рис. 1.
Исследованные представители рода Hemiculter и близких к нему родов (Hainania Koller, 1927, Hemiculterella Warpachowski, 1888, а также часть образцов, относимых к роду Pseudohemiculter Nichols et Pope, 1927) на ML-дереве образовали общую кладу с поддержкой на уровне 71%. Внутри этой клады на межвидовом уровне лишь две клады получили существенную (94–96%) поддержку: 1 − H. sauvagei плюс наши образцы P. hainanaensis, 2 − линия малотычинковых Hemiculter, распадающаяся в свою очередь на три клады (A, B, C) с поддержкой в 72–100%. Причиной слабой поддержки остальных ветвлений, вероятно, является то, что предковые для вышеуказанных клад линии, а также линии, ведущие к H. krempfi, H. macrolepis, H. bleekeri, H. serrata, разделились почти одномоментно в сравнительно короткий промежуток времени.
Согласно полученному дереву, в отличие от Pseudolaubuca Bleeker, 1864, роды Hemiculter, Hemiculterella и Pseudohemiculter являются парафилетическими. Проверка гипотез моно/парафилии этих родов оказывается невозможной, так как имеются все основания полагать, что часть из рассмотренных образцов могли быть определены неправильно. Особенно наглядно это проявляется в ситуации с образцами, относимыми к роду Pseudohemiculter. Образцы P. hainanensis располагаются в двух разных частях дерева, а образцы P. dispar – в трёх. В отношении последовательности KF029700 (рис. 1) можно предполагать либо ошибочную идентификацию особи, либо межвидовую гибридизацию, сопровождающуюся переносом материнской мтДНК от Hemiculter. О правильности определения остальных образцов Pseudohemiculter (последовательности MH797094, MH797096, KC306507), не имея возможности исследовать их ваучерные экземпляры, сказать что-либо определённое не представляется возможным.
В связи с упомянутыми проблемами правильной видовой идентификации образцов, используемых для молекулярно-генетических исследований представителей ряда родов подсемейства Xenocypridinae, следует отметить, что на основе морфологических исследований было показано, что роды Hainania, Hemiculter, Hemiculterella, Pseudohemiculter, Pseudolaubuca, а также Toxabramis Günther, 1873 образуют группу морфологически сходных таксонов, дифференцируемую от остальных представителей подсемейства по совокупности трёх признаков: 1) двухкамерный плавательный пузырь с маленьким отростком на конце второй камеры, 2) 3-я окологлазничная кость заметно увеличена и существенно шире четвертой окологлазничной кости, 3) наличие двух рядов чешуй между боковой линией и основанием брюшного плавника (Dai, Yang, 2003). К числу морфологических признаков, дифференцирующих указанные роды, относятся число рядов зубов на глоточных костях (2 или 3), число глоточных зубов (12–14 или 21–22), число ветвистых лучей в анальном плавнике (больше или меньше 17), степень развития киля на брюхе (развит от istmus до анального отверстия, от основания грудных плавников до anus или только между брюшными плавниками и анальным отверстием), степень развития кожного подключичного выроста (меньше или больше диаметра глаза), длина кишечника (>SL, <SL или равна SL), форма последнего неветвистого луча спинного плавника (мягкий, жёсткий гладкий или жёсткий зазубренный) (Luo, Chen, 1998; Dai, Yang, 2003). Большинство этих признаков встречаются мозаично у известных видов, отличным от всех других родов является лишь род Toxabramis c двухрядными глоточными зубами.
Бόльшая часть номинальных видов, включаемых в род Pseudohemiculter в качестве валидных таксонов или синонимов, изначально были описаны в роде Hemiculter, а Pseudohemiculter ранее считался его подродом (Fricke et al., 2020). В отличие от видов рода Hemiculter s. str. у видов Pseudohemiculter не выражен киль между грудными и брюшными плавниками (Warpachowski, 1887; Bănărescu, 1968; Luo, Chen, 1998; Dai, Yang, 2003). В настоящее время к роду Pseudohemiculter относят четыре вида (Fricke et al., 2020), три из которых встречаются в Китае и дифференцируются по числу чешуй в боковой линии, ветвистых лучей в анальном плавнике, относительной длине колючки спинного плавника и высоте тела (Luo, Chen, 1998). Для подтверждения правильности идентификации образцов P. hainanensis, использованных нами при анализе изменчивости cyt b, мы считаем необходимым дать ниже их описание, а также с той же целью описание ваучерного экземпляра Pseudolaubuca engraulis.
P. hainanensis ЗММУ P-22217 − 8 экз. SL 84.0–168.0 мм (рис. 2). D II 7, A III 14–15, P I 13–15, V I 7, ll 50–54, sp.br. 9–11. Брюхо в передней части закруглённое, киль развит только в задней части, за брюшными плавниками; на нижней челюсти имеется вырост, входящий в вырезку верхней челюсти; спинной плавник отнесён в заднюю часть тела, начинается заметно ближе к началу хвостового плавника, чем к концу рыла; последний неветвистый луч спинного плавника представляет собой утолщённую колючку, незазубренную по заднему краю, длина которой меньше длины задней части головы, измеренной от переднего края глаза; боковая линия круто опускается вниз в передней части тела; высота тела существенно меньше длины головы. У P. kweichowensis (Tang, 1942) ll 60, а у P. dispar в анальном плавнике 15–17 ветвистых лучей, колючка спинного шипа обычно длиннее задней части головы, высота тела больше длины головы (Luo, Chen, 1998).
P. engraulis ЗММУ P-22263 − 1 экз. SL 67.5 мм (рис. 3). D II 7, A III 18, P I 14, V I 7, ll 46, sp.br. 14. Киль развит от анального отверстия до конца межжаберного промежутка; рот косой, на нижней челюсти имеется вырост, входящий в вырезку верхней челюсти; спинной плавник отнесён в заднюю часть тела, начинается заметно ближе к началу хвостового плавника, чем к концу рыла; последний неветвистый луч спинного плавника неутолщён, мягкий; боковая линия полого опускается вниз в передней части тела. У второго вида рода − P. sinensis Bleeker, 1864 − в боковой линии более 60 чешуй, а в анальном плавнике 21−26 ветвистых лучей (Luo, Chen, 1998).
Наши образцы малотычинковых востробрюшек рода Hemiculter из Жемчужной реки (на рис. 1 приведены с названием нового вида, описанного в настоящей работе) объединились с кладой А в понимании Чена с соавторами (Chen et al., 2017), а из других районов Китая (Ухань, Пекин, реки Мансиньцзян и Сунгари) и России (оз. Ханка и р. Раздольная) – с кладой С. В последнюю кладу вошли также образцы из Генбанка с Корейского п-ова (Kim et al., 2014; Genbank: KF760455−KF760460) и севера Вьетнама (Thai et al., 2007; Genbank: DQ464973). Отметим, что ещё один образец с юга Вьетнама по баркодовому фрагменту митохондриального гена COI (Quyen et al., 2018: Genbank: MK116335), согласно проведённому нами экспресс-анализу, также входит в состав клады С.
Полученные результаты подтверждают генетическую дифференциацию H. leucisculus на три филетические линии, одна из которых – клада B (sensu Chen et al., 2017) – в нашем материале не представлена. Клада А является сестринской по отношению к объединённым с поддержкой на уровне 100% кладам В и С. По данным Чена с соавторами (Chen et al., 2017), эта клада отделилась от общего ствола около 2.38 млн лет назад, тогда как разделение клад В и С произошло около 1.61 млн лет назад. Последовательности, объединённые в кладу С, принадлежат особям из широкой области распространения − от бассейна Амура до устья р. Меконг, включая экземпляры с типового местообитания H. leucisculus – реки, впадающие в зал. Бохай, Пекин (Basilewsky, 1855). Соответственно, клада С соответствует H. leucisculus s. str.
Таксономические и номенклатурные заключения
Популяции верхнего течения р. Янцзы. Гаплотипы, образующие на филетическом дереве из работы Чена с соавторами (Chen et al., 2017) кладу В, наиболее близкую по изученным генетическим маркерам к широко распространённому H. leucisculus s. str., были обнаружены у рыб из бассейна р. Янцзы в провинции Сычуань (Sichuan): Лучжоу (Luzhou), 28°51′42′′ с.ш. 105°24′25′′ в.д.; Хэцзян (Hejiang), Лучжоу, 28°49′13′′ с.ш. 105°49′49′′ в.д.; Мудонг, Чунцин (Mudong, Chongqing), 29°34′51′′ с.ш. 106°50′34′′ в.д.11 (Chen et al., 2017). Ранее из р. Янцзы в провинции Сычуань (“Se-tchuan” sensu Fang, 1942. P. 110) был описан вид H. tchangi Fang, 1942. Описание составлено по одному экземпляру, относительно которого указано, что Чанг (Tchang, 1930 − цит. по: Fang, 1942) относил рыб из этих сборов к виду “Barilius alhurnops Regan” (правильное валидное название − Anabarilius alburnops (Regan, 1914)). Фанг посчитал, что определение Чанга ошибочно, и изученный им экземпляр относится к новому виду рода Hemiculter, для которого, по мнению Фанга, характерно (как и для его подрода Pseudohemiculter) наличие на брюхе короткого киля, тянущегося от брюшных плавников до анального отверстия (une carène située entre les nageoires ventrales et l’anus (Fang, 1942. P. 110)). Для типового экземпляра нового вида приводятся также D III 7, A III 11, ll 8/50, sp.br. 6−1−19; брюшина тёмно-коричневая; плавательный пузырь состоит из двух частей, вторая усилена узкой полосой соединительной ткани, образующей несколько витков спирали, его заострённый конец почти достигает анального отверстия и ряд других признаков (Fang, 1942). Позднее из притоков Янцзы Мудонг (Mu-dung = Mudong) и Вудонг (Wu-dung) в Сычуане по 19 синтипам был описан вид H. nigromarginis Yih et Wu, 1964, который рассматривается в качестве младшего синонима H. tchangi (Luo, Chen, 1998; Froese, Pauly, 2019; Fricke et al., 2020).
Бэнэреску, проводивший ревизию рода Hemiculter (Bănărescu, 1968), изучил 4 экз. востробрюшек из Сычуаня, хранившихся в коллекциях Университета Мичигана (1 экз., UMMZ 158509) и Национального музея естественной истории США (3 экз., USNM 91767, 91623 и 130172), которых он идентифицировал как H. nigromarginis. Для изученных экземпляров он указывает: D III 7, A III 11–12, ll 49–53, sp.br. 25−28, формула глоточных зубов 5.4.2–2.4.4, 4.3.2−2.4.5 или 4.4.2–2.4.4. От H. leucisculus Бэнэреску дифференцирует этот вид по бόльшему числу жаберных тычинок (для H. leucisculus он приводит sp.br. 15–21) и менее высокому телу − 18.5–22.5% SL (19.6–23.3% согласно первоописанию) против диапазона варьирования средних значений высоты тела у H. leucisculus от 20.47 до 25.29% (Bănărescu, 1968). Бэнэреску отмечает, что ареал H. nigromarginis ограничен верхним течением Янцзы, где он встречается симпатрично с H. leucisculus. В работе приводится фотография UMMZ 158509, у которого начало спинного плавника заметно ближе к основанию хвостового плавника, чем к концу рыла, а высота тела существенно меньше, чем на фотографиях типовых экземпляров других видов рода Hemiculter.
Бэнэреску изучил и голотип H. tchangi, хранящийся в Музее естественной истории в Париже (MNHN-IC-1934-0101). Он подтвердил основные характеристики, данные в первоописании (Fang, 1942): D III 7, A III 11, ll 49–50, sp.br. 25, киль развит только позади брюшных плавников (Bănărescu, 1968). На основе такого сочетания признаков Бэнэреску пришёл к выводу, что данный экземпляр является гибридом между признанным им валидным H. nigromarginis и H. dispar hunanensis Tchang, 1930, который в настоящее время считается синонимом P. hainanensis (Boulenger, 1900) (Froese, Pauly, 2019; Fricke et al., 2020). Исходя из морфологических характеристик изученных им голотипа H. hunanensis (MNHN-1934-0135) из бассейна Янцзы в провинции Хунань и конспецифичных экземпляров из провинции Фуцзянь, а также с о-ва Хайнань (типовое местонахождение Barilius hainanensis Boulenger, 1900) из коллекции Американского музея естественной истории, Бэнэреску считал, что гибрид близок к H. nigromarginis по числу лучей в анальном плавнике и числу жаберных тычинок (у P. hainanens A III (12) 13–15 (16), sp.br. 10–13), а ко второму родительскому виду наличием киля только после брюшных плавников (Bănărescu, 1968).
На основе вышеизложенного с учётом современных данных по морфологии известных родов и видов подсемейства Xenocypridinae вывод Бэнэреску о гибридном происхождении единственного типового экземпляра H. tchangi представляется абсолютно обоснованным. Соответственно к названию tchangi не применяются положения Международного кодекса зоологической номенклатуры (ст. 1.3.3 МКЗН, 2000), и оно не может употребляться как валидное ни для одного из родительских видов этого гибрида (ст. 23.8 МКЗН, 2000). Поэтому валидным названием для вида рода Hemiculter, участвовавшего в гибридизации, является предложенное позже пригодное название nigromarginis (Yih, Wu, 1964).
Молекулярно-генетические исследования (Chen et al., 2017; настоящая работа) подтверждают глубокую генетическую дифференциацию обитающего в верхнем течении Янцзы H. nigromarginis (клада В) и широко распространённого в Восточной Азии (от Вьетнама до российского Дальнего Востока) H. leucisculus s. str. (клада С). Однако Чен с соавторами (Chen et al., 2017) ошибочно распространяли на эту пару понятие криптических видов, утверждая отсутствие выявленных существенных морфологических отличий со ссылкой на Луо и Чена (Luo, Chen, 1998). На самом деле в ключах для рода Hemiculter цитируемые авторы отмечают существенные различия по числу жаберных тычинок: <20 у H. leucisculus, широко распространённого в водах Китая, и > 20 − у H. tchangi из верховьев Янцзы в Сычуане.
К сожалению, мы не располагаем собственным материалом по H. nigromarginis и не нашли других описаний этого вида в литературе после Бэнэреску (Bănărescu, 1968), исключение составляют работа Луо и Чена (Luo, Chen, 1998) и данные по некоторым пропорциям тела в выборке из верховьев Янцзы в районе Мудонга (Li et al., 2020). Однако мы изучили значительный материал по виду H. leucisculus s. str., что позволяет оценить выявленные Бэнэреску межвидовые различия. У изученных нами 84 экз. H. leucisculus, представляющих природные популяции от бассейна Амура до вод Вьетнама, sp.br. 13–22 (в среднем 16.6) (наибольшее число жаберных тычинок обнаружено у единственного экземпляра из Вьетнама); A III 10–14 (12.0), ll 47−56 (51.8), наибольшая высота тела (Н) 18.7–28.6 (23.0)% SL. Сходные результаты мы получили ранее для 276 особей из популяций, акклиматизировавшихся в водоёмах Средней Азии (Васильева, Козлова, 1989): sp.br. 16–19, в разных выборках в среднем 16.3–18.3; A III 10–13 (11.0–12.0), ll 40–56 (45.0–50.6), Н 18.8–26.9 (21.5–24.5)% SL. Изменчивость числа зубов на глоточных костях была изучена на 23 экз. из р. Амударья близ Нукуса: наиболее часто встречалось соотношение 4 + 4 + 2 (33.3% для левой кости и 45.8% – для правой), 5 + 4 + 2 (25 и 16.7%) и 5 + 4 + 1 (20.8 и 12.5%), к числу редких вариантов относятся 5 + 3 + 2, 4 + 4 + 3, 5 + 4 + 3, 4 + 3 + 2 и 4 + 3 + 3. На основе этих данных можно уверенно утверждать, что H. nigromarginis с хиатусом отличается от H. leucisculus по числу жаберных тычинок, которых у первого вида 25–28 (Bănărescu, 1968; Luo, Chen, 1998), а у второго – не более 22, как правило, менее 20. По высоте тела эти виды не различаются: Ли с соавторами (Li et al., 2020) приводят для изученной ими выборки в 29 экз. из Мудонга среднее значение Н 23.3% SL.
На основе генетических данных можно полагать, что вид H. nigromarginis возник и сформировался в бассейне верховьев Янцзы (Chen et al., 2017); географическое видообразование с вторичным контактом Бэнэреску (1968) предполагал для видов H. leucisculus и H. nigromarginis. Выявленный между видами поток генов не настолько высок, чтобы препятствовать их дивергенции (Chen et al., 2017). По-видимому, изоляция данных видов, обладающих клейкой икрой (Васильева, Козлова, 1988; Li et al., 2020), обеспечивается за счёт приуроченности к географически разобщённым нерестилищам с разным температурным и водным режимом.
Симпатрично с H. nigromarginis в верховьях Янцзы встречаются востробрюшки из группы глубоко дивергировавших многотычинковых видов (sp.br. 23–29), характеризующихся пелагической икрой, которых в китайской литературе относят к виду H. bleekeri. Различия в экологии нереста и, соответственно, в характеристиках эмбрионального развития обеспечивают репродуктивную изоляцию этой пары видов. Морфологически они чётко дифференцируются относительным положением спинного плавника: у H. nigromarginis начало плавника заметно ближе к хвостовому плавнику, а у H. bleekeri – к концу рыла (Li et al., 2020). У последнего вида также меньше чешуй в боковой линии: ll 42–48 (Luo, Chen, 1998) против 49–53 у H. nigromarginis (Bănărescu, 1968). Небольшие различия отмечаются в условиях симпатрии и по некоторым пропорциям тела, что связывают с расхождением по экологическим нишам (Li et al., 2020).
Популяции Жемчужной реки и о-ва Хайнань. Гаплотипы, образующие на филетическом дереве из работы Чена с соавторами (Chen et al., 2017) кладу А, сестринскую по отношению к кладам B и C, представляющим виды H. leucisculus и H. nigromarginis, были обнаружены у рыб из бассейна среднего и нижнего течения Жемчужной реки (Гуанси-Чжуанский автономный район: Циньцзян (Qinjiang); Хэнсянь, Наньнин (Hengxian, Nanning); Линшань, Циньчжоу (Lingshan, Qinzhou); Бобай, Юлин (Bobai, Yulin)) и водоёмов о-ва Хайнань. Выявленный сравнительно высокий уровень потока генов в направлении от клады C к кладе А, тем не менее, не размывает последнюю, и на протяжении периода циклических плейстоценовых оледенений линия A характеризуется собственным трендом динамики эффективной численности видовой популяции (Chen et al., 2017). Здесь следует отметить, что глубокая генетическая дифференциация между популяциями бассейна Жемчужной реки и остальными популяциями Китая отмечается для многих видов карповых рыб: Acheilognathus macropterus (Bleeker, 1871), Ctenopharyngodon idella (Valenciennes, 1844), Hypophthalmichthys molitrix (Valenciennes, 1844), Culter alburnus Basilewsky, 1855 и Chanodichthys mongolicus (Basilewsky, 1855) (Zhu, Liu, 2007; Ji et al., 2009; Fu et al., 2015; Xiong et al., 2020). Ключевым фактором в дивергенции анализируемых групп популяций, рассматриваемых в статусе криптических видов/подвидов, считается географическая изоляция, в частности, в случае C. alburnus и Ch. mongolicus в качестве географического барьера предполагаются Южно-Китайские горы (Nanling Mountains) (Xiong et al., 2020).
Сравнительный морфологический анализ особей из бассейна Жемчужной реки в провинции Гуандун, гаплотипы которых объединяются вместе с гаплотипами клады А (sensu Chen et al., 2017), и представителей H. leucisculus из нативных популяций России, Китая и Вьетнама (включая особей с генетически подтверждённым статусом) позволил выявить небольшие различия между двумя аллопатричными, в данном случае действительно криптическими, видами. Репродуктивная изоляция этих морфологически очень сходных видов и их стабильность в качестве самостоятельных эволюционных единиц с собственной популяционной структурой подтверждаются генетическими данными (Chen et al., 2017; настоящая работа) и поддерживаются географической изоляцией, благодаря которой у близких видов могут не сформироваться чёткие различия по внешним признакам.
Описание H. leucisculus, составленное на основе исследования особей из водоёмов Дальнего Востока России и популяций, акклиматизировавшихся в Средней Азии, было опубликовано ранее (Васильева, Козлова, 1988), как и подробный анализ морфологической и краниологической изменчивости этого вида (Васильева, Козлова, 1989). Поэтому в настоящей работе для H. leucisculus приводятся данные лишь по характеристикам, дифференцирующим новый вид востробрюшек из бассейна Жемчужной реки и о-ва Хайнань, описание которого приводится ниже.
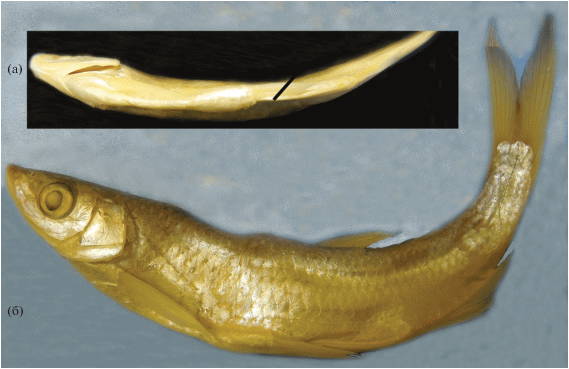
Hemiculter yungaoi Vasil’eva, Vasil’ev et Shedko sp. nova – южнокитайская востробрюшка
Рис. 5.
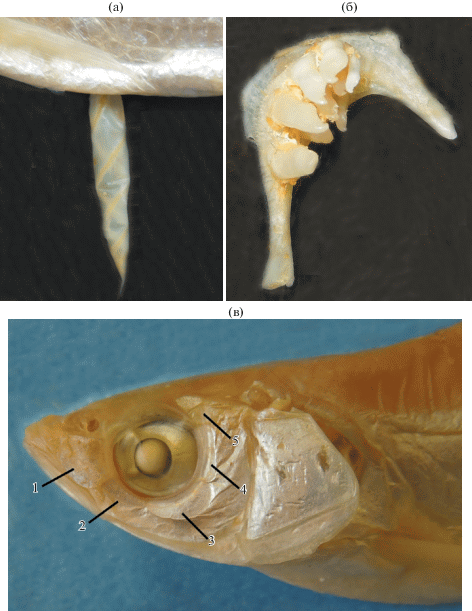
Вторая камера плавательного пузыря паратипа Hemiculter yungaoi sp. nova ЗММУ Р-22216 SL 98.5 мм (а); левая глоточная кость голотипа H. yungaoi sp. nova ЗММУ Р-24429 (б) и голова паратипа ЗММУ Р-22216 с отмеченными пятью infraorbitalia (в).
Hemiculter leucisculus (non Basilewsky, 1855): Luo, Chen, 1998. Р. 164 (Китай − partim); Wei et al., 2009. Р. 191 (реки Лю (Liu) и Хуншуй (Hongshui), провинция Гуанси (Guangxi)); Zhang, Zhao, 2016. Р. 57 (Китай − partim); Chen et al., 2017. P. 2 (partim: Жемчужная река (Pearl River)).
Hemiculter leucisxulus (sic) (non Basilewsky, 1855): Li et al., 2009. Р. 559 (р. Сицзян (Xijiang), провинция Гуандун (Guangdong)).
Голотип. ЗММУ Р-24429 − SL 138 мм, Жемчужная река, провинция Гуандун, округ Чжаоцин (Zhujiang River (Чжуцзян), Guangdong prov., Zhaoqing region), Китай, май 2001 г., коллектор Юнь Гао.
Паратипы. ЗММУ Р-22216 − 4 экз. SL 96.0−107.3 мм, собраны вместе с голотипом; ЗММУ Р-22218 − 7 экз. SL 40.5−56.0 мм, р. Сицзян (Xijiang), бассейн Жемчужной реки, Фэнкай (Fengkai), провинция Гуандун, Китай, май 2005 г., коллектор Юнь Гао. Нуклеотидные последовательности гена cyt b депонированы в Генетическом банке под номерами доступа MW367261 (голотип) и MW367262−MW367265 (паратипы).
Диагноз. A III 11−13, ll 49−56, sp.br. 15−20; на брюхе не покрытый чешуёй киль от конца основания грудных плавников до анального отверстия; начало спинного плавника ближе к основанию хвостового плавника, чем к концу рыла; грудные плавники относительно короткие, никогда не доходят до основания брюшных плавников, у особей SL > 50 мм длина грудного плавника < 80% P−V; основание брюшных плавников ненамного впереди основания спинного плавника: у особей SL > 50 мм антевентральное расстояние составляет > 92% антедорсального; P−V > V−A, реже равно; длина 2-го жёсткого луча спинного плавника превышает 50% длины 3-го жёсткого луча; кожный подключичный вырост очень маленький, в длину не превышает диаметр зрачка и не виден за грудным плавником, у особей SL > 50 мм длина выроста < 40% горизонтального диаметра глаза.
Описание. D III 7, P I 13−14, V II 8. Тело прогонистое, покрыто легко опадающей чешуёй среднего размера; наибольшая высота тела обычно укладывается более четырёх раз в SL. Боковая линия круто спускается вниз и от уровня окончания грудных плавников идёт параллельно боковому профилю тела, за окончанием анального плавника загибается вверх и далее идёт посредине хвостового стебля. Антедорсальное расстояние существенно более 1/2 SL; спинной плавник короткий и высокий: его высота в 1.5−2.0 раза больше длины основания; 3-й колючий луч гладкий. Голова небольшая, её длина соизмерима с наибольшей высотой тела; рот конечный, верхняя челюсть с маленькой вырезкой, в которую входит небольшой вырост в средней части нижней челюсти; глаз большой, его горизонтальный диаметр содержится менее четырёх раз в длине головы; длина рыла у особей SL > 50 мм равна или превышает величину горизонтального диаметра глаза (рис. 4; табл. 1). Брюшина светлая; плавательный пузырь двухкамерный, вторая камера удлинённая, с узкой полосой соединительной ткани, образующей несколько витков спирали; задний конец второй камеры заострён, с коротким отростком (рис. 5а). Глоточные зубы трёхрядные у голотипа (4 + 4 + 1)–(2 + 5 + 5), у одного из паратипов – (5 + 5 + 2)–(2 + 4 + 4); более крупные зубы наружного ряда с небольшим крючком на конце (рис. 5б). На каждой стороне головы по пять infraorbitalia, 3-я подглазничная кость широкая, 4-я – удлинённая и узкая, её ширина более чем в два раза меньше длины (рис. 5в). Остальные характеристики представлены в диагнозе. Морфометрические признаки даны в табл. 1. Цвет тела в спирте: спина выше уровня верхнего края operculum и верхняя часть головы светло коричневые (или песочного цвета у всех мелких рыб из пробы Р-22218), остальная часть тела серебристая; продольной полосы на теле нет; все плавники светлые, без пятен (рис. 4).
Таблица 1.
Морфометрические характеристики типовых экземпляров Hemiculter yungaoi (n = 12 экз.)
| Признак | Предел изменчивости | М ± m |
|---|---|---|
| SL, мм | 40.5–138.0 | 71.3 ± 10.02 |
| В % SL | ||
| aV | 47.9–51.1 | 50.3 ± 0.27 |
| P–V | 23.6–27.7 | 25.9 ± 0.39 |
| lP | 20.8–23.9* | 22.1 ± 0.41 |
| V–A | 22.7–26.8 | 24.4 ± 0.31 |
| hD | 16.1–19.8* | 17.5 ± 0.49 |
| aD | 52.4–54.7 | 53.9 ± 0.22 |
| aA | 69.9–75.3 | 72.8 ± 0.50 |
| lpc | 16.3–19.5 | 17.6 ± 0.27 |
| H | 21.4–25.3 | 23.0 ± 0.34 |
| lA | 11.5–14.5 | 13.0 ± 0.30 |
| c | 22.6–25.9 | 24.4 ± 0.30 |
| В % с | ||
| o | 23.4–30.9 | 28.0 ± 0.74 |
| ao | 26.7–29.3 | 28.0 ± 0.24 |
| Индекс, % | ||
| P–V/V–A | 100.0–115.9 | 106.0 ± 1.48 |
| aV/aD | 91.5–95.0 | 93.2 ± 0.30 |
| flepl/o | 17.7–42.4 | 31.4 ± 1.90 |
| o/ao | 82.4–114.8 | 100.1 ± 3.09 |
| lP/P−V | 73.8–96.1* | 82.6 ± 2.69 |
| hsp2/hsp3 | 50.4–80.3 | 61.4 ± 2.89 |
Примечание. Здесь и в табл. 2: M ± m – среднее значение и его ошибка; SL – стандартная длина; aD, aV, aA, P−V, V–A – антедорсальное, антевентральное, антеанальное, пектовентральное, вентроанальное расстояния; lpc – длина хвостового стебля, lP – длина грудного плавника, H – наибольшая высота тела у начала спинного плавника, hD – высота спинного плавника, lA – длина основания спинного плавника, c – длина головы, o – горизонтальный диаметр глаза, ao – длина рыла, flepl – длина кожного подключичного выроста; hsp2, hsp3 – длина 2-го и 3-го жёсткого луча спинного плавника; * число особей меньше n.
Этимология. Название вида происходит от имени сборщика материала – Юнь Гао, сотрудника Института зоологии г. Куньмин в Китае (Yun Gao, Kunming Institute of Zoology).
Распространение. H. yungaoi в настоящее время известен из бассейна среднего и нижнего течения Жемчужной реки и из водоёмов о-ва Хайнань, где его присутствие подтверждено результатами молекулярно-генетического анализа. Выше отмечалось, что на полученном филогенетическом дереве в состав клады, представленной гаплотипами клады А (Chen et al., 2017) и образцами из бассейна Жемчужной реки и рассматриваемой в статусе нового самостоятельного вида H. yungaoi, оказался включённым гаплотип KF029700 (рис. 1). Из публикации, на основе которой эта последовательность была депонирована в Genbank, следует, что образец принадлежит виду P. dispar из Красной реки в Таиланде (Tang et al., 2013). Независимо от того, является ли эта особь ошибочно идентифицированным экземпляром H. yungaoi или его гибридом, как отмечалось выше, следует отметить, что в Таиланде рыбы рода Hemiculter никогда не отмечались (Kottelat, 2001; Tan, Armbruster, 2018), и, более того, бассейн Красной реки ограничен территориями Южного Китая и Северного Вьетнама. Поэтому понятно, что ареал вида нуждается в уточнении.
Сравнительные замечания. От видов группы многотычинковых востробрюшек (H. bleekeri, H. lucidus (Dybowski, 1872) и H. varpachovskii A. Nikolski, 1903) H. yungaoi отличается меньшим числом жаберных тычинок (15–20 против 18−30, чаще 22–24), бόльшим числом чешуй в боковой линии (49–56 против 40–53, чаще 42−47) и сдвинутым в заднюю часть тела спинным плавником: начало спинного плавника ближе к основанию хвостового плавника у H. yungaoi и ближе к концу головы у отмеченных многотычинковых видов (Bănărescu, 1968; Васильева, Козлова, 1989; настоящая работа). От обитающего в верховьях Янцзы H. nigromarginis новый вид отличается меньшим числом жаберных тычинок: у H. nigromarginis их не менее 25 (Bănărescu, 1968). По сравнению с известным из вод Центрального Вьетнама H. krempfi у H. yungaoi существенно меньше ветвистых лучей в анальном плавнике, больше жаберных тычинок и меньше диаметр глаза: у H. krempfi А 16–18, sp.br. 14–17 и диаметр глаза всегда больше длины рыла (Serov et al., 2006).
Из водоёмов Северного Вьетнама были описаны два вида малотычинковых востробрюшек, сведения о морфологии которых очень ограничены. Тем не менее описанный из р. Ки Кунг (Sông Ky Cùng) в провинции Ланг Сон северо-восточной части Вьетнама H. elongatus Hảo et Vân, 2001 существенно отличается от H. yungaoi меньшим числом чешуй в боковой линии, жаберных тычинок и ветвистых лучей в грудном плавнике, меньшей высотой тела и бóльшим антедорсальным расстоянием: соответственно 43–48, 10–15, 11–12, 17.8–18.3 и 57.5–60.9% SL22 (Hảo, Vân, 2001; Tuấn et al., 2009) против 49–56, 15–20, 13–14, 21.4–25.3 и 52.4–54.7% SL. В отличие от H. elongatus у H. yungaoi нет тёмной полосы, которая разделяет тёмно-зелёную верхнюю часть тела и светлое брюхо, указанной в описании первого вида (Hảo, Vân, 2001).
H. songhongensis Hảo et Nghia in Hảo, Vân, 2001 был описан из Красной реки в Ханое, откуда ранее был описан Culter balnei Sauvage, 1884. Описание последнего таксона (Sauvage, 1884) основано на единственном экземпляре; набор приведённых характеристик, пригодных для дифференциации видов, достаточно скуден, следует отметить лишь большое число чешуй в боковой линии (ll 57, ранее не отмечавшееся у малотычинковых востробрюшек) и высоту тела, превышающую длину головы. Голотип C. balnei был изучен Бэнэреску (Bănărescu, 1968), который включил его в синонимы H. leucisculus, что было принято в последующих работах (Kottelat, 2001, 2006; Serov et al., 2006; Froese, Pauly, 2019; Fricke et al., 2020). H. songhongensis рассматривается в качестве валидного вида (Tuấn et al., 2009; Froese, Pauly, 2019; Fricke et al., 2020) и для Красной реки принимается его симпатрия с H. leucisculus (Duc et al., 2015), от которого авторы описания дифференцировали новый вид по следующему набору признаков: P−V < V−A, формула глоточных зубов (5 + 4 + 2)–(2 + 3 + 4), sp.br. 16−17, спина коричневого цвета, отолиты с гладкой поверхностью и двумя вогнутыми сторонами; для H. leucisculus они указывали P−V > V−A, формула глоточных зубов (5 + 4 + 2)–(2 + 4 + 5), sp.br. 18–20, спина тёмно-зелёного цвета, поверхность отолитов с радиальными лучами, обе стороны плоские (Hảo, Vân, 2001). Следует отметить, что, судя по фотографии, приведённой в работе Бэнэреску (Bănărescu, 1968. Fig. 1), у голотипа Culter balnei P−V чуть больше V−A (примерно 1.1 : 1.0), а по рисунку из первоописания (Sauvage, 1884. Pl. 8, Fig. 4) эти расстояния практически равны, что подтверждает синонимию C. balnei и H. leucisculus.
Судя по скудным данным литературы (Hảo, Vân, 2001; Tuấn et al., 2009), H. yungaoi отличается от H. songhongensis бόльшим числом ветвистых лучей в грудном плавнике (13–14 против 10–13) и жаберных тычинок (15–20, чаще не менее 18 (58.3%) против 16−17), меньшим числом ветвистых лучей в брюшном плавнике (8 против 8–9), серебристой окраской тела (у вьетнамского вида коричневая спина и белое брюхо) и расстоянием P−V, бόльшим (редко равным) V–A (табл. 1). Кроме этого у изученных особей H. yungaoi, в отличие от H. songhongensis, не встречалось три зуба во 2-м ряду на глоточных костях (как отмечено выше, три зуба очень редко встречаются у H. leucisculus), однако формула глоточных зубов у востробрюшек достаточно изменчива.
Для оценки пригодности соотношения P−V/V−A при дифференциации видов Hemiculter мы определили его значения у изученных особей из водоёмов Китая и Вьетнама. У единственного экземпляра из Вьетнама (Р-9188) этот показатель составил 1.05, в выборках из провинции Юньнань (Р-22220 и Р-22221) он варьировал от 0.92 до 1.15: у 2 экз. (22.2%) расстояние P−V было меньше V−А (у этих рыб sp.br. 14−15). У востробрюшек из Пекина (Р-22265, sp.br. 14−18), чья принадлежность к виду H. leucisculus подтверждена результатами молекулярного анализа, величина индекса P−V/V−A варьировала в пределах 0.92–1.30, у 2 экз. (15.4%) P−V < V−А. В отличие от указанных проб P−V было заметно меньше V−A (0.875) у экземпляра из провинции Хубэй (Р-22264), его конспецифичность с H. leucisculus также подтверждена молекулярным анализом, sp.br. 18 и формулой глоточных зубов (4 + 4 + 1)–(2 + 4 + 5), что не соответствует видовым характеристикам H. songhongensis. Полученные результаты свидетельствуют об изменчивости индекса P−V/V−A у H. leucisculus и вызывают сомнения в обособленном видовом статусе востробрюшек, идентифицируемых как H. songhongensis. На данный момент среди эндемичных вьетнамских видов только для H. krempfi подтверждена валидность с помощью молекулярно-генетического анализа (Tang et al., 2013; настоящая работа). Единичные изученные особи из Вьетнама, не принадлежащие к H. krempfi, на филогенетическом дереве группируются вместе с H. leucisculus (рис. 1), как и малотычинковые востробрюшки из соседнего с Вьетнамом района Юньнань, охватывающего верховья Красной реки (Chen et al., 2017).
По всем отмеченным выше морфологическим характеристикам, как и по большинству остальных пропорций тела и меристических признаков, H. yungaoi близок к широко распространённому в Восточной Азии H. leucisculus. От этого вида особи H. yungaoi SL > 50 мм отличаются по совокупности четырёх морфометрических характеристик (табл. 2).
Таблица 2.
Морфометрические характеристики, дифференцирующие Hemiculter leucisculus и H. yungaoi (SL > 50 мм)
| Признак | H. yungaoi (n = 6) | H. leucisculus (n = 84) | ||
|---|---|---|---|---|
| Предел изменчивости | М | Предел изменчивости | М ± m | |
| SL, мм | 56.0–138.0 | 99.8 | 53.0–179.0 | 108.0 ± 3.36 |
| lP/P−V | 73.8–79.1 | 77.4 | 76.6–107.5 | 90.7 ± 0.68 |
| aV/aD | 92.5–95.0 | 93.6 | 83.5–96.1 | 90.5 ± 0.27 |
| hsp2/hsp3 | 50.4–80.3 | 58.8 | 27.8–69.9 | 51.2 ± 0.71 |
| flepl/o | 27.9–37.8 | 32.8 | 21.6–76.4 | 42.2 ± 1.22 |
1. У H. yungaoi короче грудные плавники: никогда не доходят до основания брюшных плавников, их длина < 80% P−V; у H. leucisculus грудные плавники нередко почти доходят до брюшных плавников, а иногда заходят за их основание; длина грудного плавника обычно (97.4%) > 80% P−V. Различия значимы с р ≤ 0.002 (U = 4).
2. У H. yungaoi брюшные плавники сильнее сдвинуты каудально: aV > 92% aD; у H. leucisculus обычно (77.9%) aV < 92% aD. Различия значимы с р ≤ 0.002 (U = 47).
3. Кожный подключичный вырост у H. yungaoi слабо развит и плохо заметен, длина выроста < 40% о; у H. leucisculus длина выроста чаще (53.3%) > 40% о, нередко (9.1%) превышает 60%, и удлинённый отросток хорошо виден над грудным плавником (рис. 6). Различия значимы с р ≤ 0.01 (U = 91).
Рис. 6.
Hemiculter leucisculus из Вьетнама ЗММУ Р-9188 SL 118.5 мм; показан кожный подключичный вырост.

4. У H. yungaoi hsp2 > 50% hsp3, а у многих особей H. leucisculus (41.6%) hsp2 < 50% hsp3. Различия значимы с р ≤ 0.05 (U = 142). По трём первым признакам различия достигают значительной величины: средние выборочные значения H. leucisculus лежат вне диапазона изменчивости признака у H. yungaoi (табл. 2). По совокупности любых двух из перечисленных четырёх характеристик особи двух видов легко дифференцируются. Cудя по рисунку (Sauvage, 1884. Pl. 8. Fig. 4), голотип Culter balnei, у которого lP/P−V 83.3%, aV/aD 91.7%, hsp2/hsp3 46.3%, однозначно идентифицируется по этим характеристикам как H. leucisculus (грудной плавник на рисунке поднят и закрывает место положения подключичного выроста).
Следует отметить, что изученные нами мелкие особи H. yungaoi из пробы Р-22218, имеющие SL < 50 мм, обнаруживали бόльшую вариабельность отмеченных параметров и отсутствие чёткой дифференциации от H. leucisculus, среди которых мелкие экземпляры отсутствовали (табл. 1, 2). Это обусловлено размерной изменчивостью признаков. Ранее для H. leucisculus мы показали, что у мелких рыб по сравнению с более крупными больше aV, o, меньше hsp3, меняются с ростом и другие характеристики (Васильева, Козлова, 1989).
В заключение необходимо отметить, что проведённые нами исследования позволили решить проблему таксономических и филогенетических отношений в группе Hemiculter leucisculus s. l. Но по-прежнему остаются неясными филогенетические отношения близких родов подсемейства Xenocypridinae и нерешёнными проблемы их моно/парафилии. Необходимость специальных исследований в этой области отмечалась и ранее (Tang et al., 2013), однако, как показывает настоящая работа, молекулярно-генетические исследования в группах рыб, где существуют проблемы идентификации видов, должны сопровождаться морфологическими описаниями ваучерных экземпляров, подтверждающими правильность определения родового и видового статуса.
Список литературы
Берг Л.С. 1949. Рыбы пресных вод СССР и сопредельных стран. Ч. 2. М.; Л.: Изд-во АН СССР. С. 469–926.
Васильева Е.Д. 2004. Популярный атлас-определитель. Рыбы. М.: Дрофа, 399 с.
Васильева Е.Д., Козлова M.C. 1988. О таксономии востробрюшек рода Hemiculter (Cyprinidae) Советского Союза // Вопр. ихтиологии. Т. 28. Вып. 6. С. 883–895.
Васильева Е.Д., Козлова М.С. 1989. К морфологической характеристике обыкновенной востробрюшки Hemiculter leucisculus (Basilewsky) (Pisces, Cyprinidae) // Бюл. МОИП. Т. 94. Вып. 3. С. 36–46.
Международный кодекс зоологической номенклатуры (МКЗН). 2000. СПб.: Изд-во ЗИН РАН, 221 с.
Никольский Г.В. 1947. О роде Hemiculter (Pisces, Cyprinidae) в бассейне Амура // Докл. АН СССР. Т. 56. № 7. С. 773–777.
Никольский Г.В. 1956. Рыбы бассейна Амура. Итоги Амурской ихтиологической экспедиции 1945−1949 гг. М.: Изд-во АН СССР, 551 с.
Цой Е.Г. 1964. Рыбы Кореи. 375 с.
Aljanabi S.M., Martinez I. 1997. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques // Nucleic Acids Res. V. 25. № 22. P. 4692–4693. https://doi.org/10.1093/nar/25.22.4692
Bănărescu P. 1968. Revision of the genus Hemiculter (Pisces, Cyprinidae) // Travaux Mus. D’Hist. Natur. “Grigore Antipa”. V. 8. P. 523−529.
Basilewsky S. 1855. Ichthyographia Chinae borealis // Nouv. Mem. Soc. Imp. Naturalist. V. 10. P. 215−263.
Chen W., Zhong Z., Dai W. et al. 2017. Phylogeographic structure, cryptic speciation and demographic history of the sharpbelly (Hemiculter leucisculus), a freshwater habitat generalist from southern China // BMC Evol. Biol. V. 17. № 1. Article 216. 6 p. https://doi.org/10.1186/s12862-017-1058-0
Chernomor O., von Haeseler A., Minh B.Q. 2016. Terrace aware data structure for phylogenomic inference from supermatrices // Syst. Biol. V. 65. № 6. P. 997–1008. https://doi.org/10.1093/sysbio/syw037
Dai Y.-G., Yang J.-X. 2003. Phylogeny and zoogeography of the cyprinid hemicultrine group (Cyprinidae: Cultrinae) // Zool. Stud. V. 42. № 1. P. 73−92.
Duc N.H., Hau T.D., Hai H.T.T. 2015. Fish species composition in the Red River and its tributaries in the Yen Bai Province, Vietnam // J. Sci. HNUE. Chem. Biol. Sci. V. 60. № 9. P. 97−103. https://doi.org/10.18173/2354-1059.2015-00084
Fang P.-W. 1942. Un Cyprinidé nouveau Hemiculter tchangi, de Chine // Bull. Mus. Nat. Hist. Natur. Ser. 2. V. 14. № 2. P. 110−111.
Fricke R., Eschmeyer W.N., Van der Laan R. (eds.). 2020. Eschmeyer’s Catalog of Fishes: Genera, Species, References (http://researcharchive.calacademy.org/research/ichthyology/ catalog/fishcatmain.asp. Version 11/ 2020)
Froese R., Pauly D. (eds.). 2019. FishBase. World Wide Web electronic publication. (www.fishbase.org. Version 12/2019).
Fu J.J., Wang R.Q., Shen Y.B. et al. 2015. Genetic variation analysis based on D-loop sequences of wild populations of grass carp (Ctenopharyngodon idella) in China // Acta Hydrobiol. Sinica. V. 39. № 2. P. 349−357. https://doi.org/10.7541/2015.46
Gouy M., Guindon S., Gascuel O. 2010. SeaView version 4: A multiplatform graphical user interface for sequence alignment and phylogenetic tree building // Mol. Biol. Evol. V. 27. № 2. P. 221–224. https://doi.org/10.1093/molbev/msp259
Hảo N.V., Vân N.S. 2001. Cá nựớc ngọt Việt Nam. Tập I. Họ cá chép (Cyprinidae). Hà Nội: NXB Nông Nghiệp, 622 pp.
Hoang D.T., Chernomor O., von Haeseler A. et al. 2018. UFBoot2: Improving the ultrafast bootstrap approximation // Mol. Biol. Evol. V. 35. № 2. P. 518–522. https://doi.org/10.1093/molbev/msx281
Ji C.H., Gu J.J., Mao R.X. et al. 2009. Analysis of genetic diversity among wild silver carp (Hypophthalmichthys molitrix) populations in the Yangtze, Heilongjiang and Pearl Rivers using microsatellite markers // J. Fish. China. V. 33. № 3. P. 364−371.
Kim I.-S., Park J.-Y. 2002. Freshwater fishes of Korea. Seoul: Kyo-Hak Publ. Co., Ltd., 467 p.
Kim M.J., Lee J.-S., Song C.B. 2014. Molecular phylogenetic status of Korean Hemiculter species // Korean J. Fish. Aquat. Sci. V. 47. № 1. P. 72–78. https://doi.org/10.5657/KFAS.2014.0072
Kottelat M. 2001. Freshwater fishes of northern Vietnam. A preliminary check-list of the fishes known or expected to occur in northern Vietnam with comments on systematics and nomenclature. Washington: World Bank, 123 + 18 p.
Kottelat M. 2006. Fishes of Mongolia. A check-list of the fishes known to occur in Mongolia with comments on systematics and nomenclature. Washington: World Bank, 103 p.
Li J., Li X., Tan X. et al. 2009. Species diversity of fish community of Provincial Xijiang River Rare fishes natural reserve in Zhaoqing City, Guangdong Province // J. Lake Sci. V. 21. № 4. P. 556−562.
Li W.J., Gao X., Liu H.Z., Cao W.X. 2020. Coexistence of two closely related cyprinid fishes (Hemiculter bleekeri and Hemiculter leucisculus) in the Upper Yangtze River, China // Diversity. V. 12. № 284. 15 p. https://doi.org/10.3390/d12070284
Luo Y., Chen Y. 1998. Cultrinae // Fauna Sinica. Osteichthyes. Cypriniformes II / Eds. Chen Y.-Y. et al. Beijing: Sci. Press. P. 112−207.
Mai D.Y. 1985. Species composition and distribution of the freshwater fish fauna of the North of Vietnam // Hydrobiologia. V. 121. P. 281−286.
Nguyen L.-T., Schmidt H.A., von Haeseler A., Minh B.Q. 2015. Q-TREE: A fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies // Mol. Biol. Evol. V. 32. № 1. P. 268–274. https://doi.org/10.1093/molbev/msu300
Quyen V., Oanh T., Thuoc T.L., Binh T.D. 2018. Molecular phylogeny of Cyprinidae and Cobitidae (Teleostei: Cypriniformes) – implication for Mekong Fish // Proc. ISER 169-th Int. Conference. Bangkok, Thailand. P. 11–16.
Sauvage H.-E. 1884. Contribution à la faune ichthyologique du Tonkin // Bull. Soc. Zool. France. V. 9. P. 209−215. Pls. 7−8.
Serov D.V., Nezdoliy V.K., Pavlov D.S. 2006. The freshwater fishes of Central Vietnam. Moscow: KMK Sci. Press Ltd, 364 p.
Sevilla R.G., Diez A., Noren M. et al. 2007. Primers and polymerase chain reaction conditions for DNA barcoding teleost fish based on the mitochondrial cytochrome b and nuclear rhodopsin genes // Mol. Ecol. Notes. V. 7. № 5. P. 730–734. https://doi.org/10.1111/j.1471-8286.2007.01863.x
Staden R., Beal K.F., Bonfield J.K. 2000. The Staden Package, 1998 // Bioinformatics Methods and Protocols. Methods in Molecular Biology. V. 132 / Eds. Misener S., Krawetz S.A. Totowa: Humana Press. P. 115–130. https://doi.org/10.1385/1-59259-192-2:115.
Tan M., Armbruster J.W. 2018. Phylogenetic classification of extant genera of fishes of the order Cypriniformes (Teleostei: Ostariophysi) // Zootaxa. V. 4476. № 1. P. 006–039.https://doi.org/10.11646/zootaxa.4476.1.4
Tang K.L., Agnew M.K., Hirt M.V. et al. 2013. Limits and phylogenetic relationships of East Asian fishes in the subfamily Oxygastrinae (Teleostei: Cypriniformes: Cyprinidae) // Ibid. V. 3681. № 2. P. 101–135. https://doi.org/10.11646/zootaxa.3681.2.1
Thai B.T., Si V.N., Phan P.D., Austin C.M. 2007. Phylogenetic evaluation of subfamily classification of the Cyprinidae focusing on Vietnamese species // Aquat. Liv. Resour. V. 20. № 2. P. 143–153. https://doi.org/10.1051/alr:2007025
Tuấn A., Giang V., Phuơng T., Quang X. 2009. Bổ sung dẫn liệu về đặc điểm hình thái phân lqại các loài trong giống cá mựơng − Hemiculter Bleeker, 1859 ở khu vực Bắc Trung bộ // Vinh Tạp chí khoa học. Tập XXXVIII. Số 4A. P. 64–73.
Villesen P. 2007. FaBox: an online toolbox for fasta sequences // Mol. Ecol. Notes. V. 7. № 6. P. 965–968. https://doi.org/10.1111/j.1471-8286.2007.01821.x
Warpachowski N. 1887. Die gattung Hemiculter Bleek. und über eine neue gattung Hemiculterella // Bull. Acad. Imper. Sci. V. 32. P. 13–24.
Wei R., Zheng L., Chen X., Yang J. 2009. Investigation of fish resources in Hechi Prefecture of Guangxi Province, with comparison of fish biodiversity between two tributaries // Zool. Res. V. 30. № 2. P. 185–194. https://doi.org/10.3724/SP.J.1141.2009.02185
Xiong Y., Li W., Yuan J. et al. 2020. Genetic structure and demographic histories of two sympatric Culter species in eastern China // J. Oceanol. Limnol. V. 38. № 2. P. 408–426. https://doi.org/10.1007/s00343-019-9036-6.
Yih P.-L., Wu C.-K. 1964. Abramidinae // Zhongguo like yulei zhi. [The cyprinid fishes of China] V. 1 / Ed. Wu H.-W. Shanghai: Sci. Press. P. 63–120.
Zhang C.-G., Zhao Y.-H. 2016. Species diversity and distribution of inland fishes in China. Beijing: Sci. Press, 284 p.
Zhu Y.R., Liu H.Z. 2007. Genetic diversity and biogeographical process of Acheilognathus macropterus revealed by sequence variations of mitochondrial cytochrome b gene // Acta Hydrobiol. Sinica. V. 30. № 2. P. 134–140. https://doi.org/10.1007/s11515-007-0069-4
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии