Вопросы ихтиологии, 2022, T. 62, № 2, стр. 244-248
Состав лейкоцитов периферической крови горбуши Oncorhynchus gorbuscha и кеты O. keta (Salmonidae) в морской период жизни
И. И. Гордеев 1, 2, *, Л. В. Балабанова 3, Т. А. Суворова 3, Д. В. Микряков 3
1 Всероссийский научно-исследовательский институт рыбного
хозяйства и океанографии − ВНИРО
Москва, Россия
2 Московский государственный университет
Москва, Россия
3 Институт биологии внутренних вод РАН – ИБВВ РАН
пос. Борок, Ярославская область, Россия
* E-mail: gordeev_ilya@bk.ru
Поступила в редакцию 09.03.2021
После доработки 08.04.2021
Принята к публикации 09.04.2021
- EDN: QNLLBC
- DOI: 10.31857/S0042875222020084
Аннотация
У горбуши Onchorhynchus gorbuscha и кеты O. keta в морской период жизни среди лейкоцитов преобладают лимфоциты и отсутствуют эозинофилы, а у горбуши отсутствуют также и базофилы. У кеты по сравнению с горбушей меньше доля сегментоядерных нейтрофилов и размеры лимфоцитов, моноцитов и палочкоядерных нейтрофилов.
Жизненный цикл горбуши Oncorhynchus gorbuscha и кеты O. keta, как и других анадромных рыб, сопряжён со сменой среды обитания. После нереста в ручьях, реках и озёрах они скатываются в море и нагуливаются в океанических водах северной части Пацифики. При этом горбуша и кета существенно отличаются друг от друга по продолжительности жизненного цикла и времени, проведённом в океане. Горбуша относится к короткоцикловым видам и совершает преднерестовую миграцию к устьям рек на следующий год после ската молоди, а кета проводит в море от двух до пяти лет (Промысловые рыбы …, 2006; Гордеев, Кловач, 2019).
Исследование лейкоцитов рыб позволяет судить о физиологическом и иммунологическом состоянии организма и влиянии на него среды обитания (Серпунин, 2002; Кузина, 2011; Королева, 2016). Лейкоцитарная формула является важным информативным показателем оценки физиологического состояния организма при комплексных исследованиях популяций рыб в естественных условиях и в аквакультуре (Иванова, 1983; Головина, Тромбицкий, 1989; Яхненко, Клименков, 2009; Изергина и др., 2014; Басова, 2017; Gordeev et al., 2017; Головина, 2018; Суворова, Герман, 2021). Изменения в соотношении лейкоцитов обнаруживаются задолго до появления клинических признаков заболевания и патологий. Сдвиги в лейкоцитарной формуле рыб при нормальном физиологическом состоянии незначительны (Житенева и др., 2004), что позволяет использовать их в качестве маркеров разных физиологических и патологических процессов, происходящих в организме. У лососей (Salmonidae) гематологические показатели в основном исследуют на рыбоводных заводах у производителей и молоди в ранние периоды онтогенеза, до ската в море (Ciereszko et al., 2007; Изергина и др., 2014; Lulijwa et al., 2019). Имеются данные о гематологических показателях лососей, выращиваемых в сетчатых загонах в морских условиях (Sandnes et al., 1988; Dessen et al., 2020), но нет сведений о соотношении лейкоцитов во время морского нагульного периода жизни. Проведение таких исследований необходимо для понимания адаптивных возможностей лососей, мониторинга их физиологического состояния и оценки выживаемости, что важно для расчёта прогноза возврата лососёвых рыб.
Цель работы – изучить лейкоцитарный состав крови горбуши и кеты в морской период жизни.
МАТЕРИАЛ И МЕТОДИКА
Половозрелых особей горбуши и кеты (по 12 экз.) средней массой соответственно 844.91 ± 27.60 и 1592.00 ± 105.50 г и полной длиной (TL) 441.25 ± ± 5.44 и 547.66 ± 9.46 мм отловили 06.06–01.07.2018 г. эпипелагическим тралом в открытых водах северо-западной части Тихого океана (к востоку от Курильской гряды) с борта НИС “Профессор Кагановский” в ходе траловой съёмки тихоокеанских лососей в морской период жизни.
Кровь отбирали из хвостовой вены спустя 90 мин после отлова и передержки рыб в проточной воде. Мазки крови делали на обезжиренное предметное стекло, фиксировали в 96%-ном этаноле в течение 30 мин, окрашивали по Романовскому−Гимза и исследовали под световым микроскопом Биомед-6ПР1-ФК (увел. ×360). В каждом препарате анализировали 200 лейкоцитов, которые идентифицировали по Ивановой (1983). Фотографии клеток и их измерения выполняли на Digital Microscope EVENCE VHX-1000. Для определения индекса обилия лейкоцитов, или частоты встречаемости клеток белой крови, в мазке периферической крови просматривали 100 полей зрения на разных участках препарата при увеличении ×400. В каждом поле зрения подсчитывали число лейкоцитов, полученные данные суммировали и делили на 100, получая среднее число в одном поле зрения (Микряков, Лапирова, 1997).
Статистическую обработку результатов исследования проводили по стандартным алгоритмам, реализованным в пакете программ Statistica v. 6.0, с использованием t-теста. Различия считали значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В мазках периферической крови исследуемых особей обнаружены характерные для большинства видов рыб типы лейкоцитов (таблица). В лейкограмме горбуши и кеты преобладают лимфоциты (соответственно 88.40 и 89.71%) при незначительном содержании других типов клеток: моноцитов (0.90 и 0.42), палочко- (1.80 и 1.45) и сегментоядерных нейтрофилов (5.00 и 2.57), базофилов (0 и 1.00), бластных форм (3.90 и 4.85); эозинофилы отсутствуют. Лейкограммы горбуши и кеты достоверно различаются содержанием сегментоядерных нейтрофилов и отсутствием базофилов у горбуши. Многие исследователи также отмечают весьма редкую встречаемость базофилов и эозинофилов в крови дальневосточных лососей (Хованский, Хованская, 1994; Калинина, 1997; Пустовит, Пустовит, 2005; Изергина и др., 2014).
Состав и размеры лейкоцитов периферической крови горбуши Onchorhynchus gorbuscha и кеты O. keta
| Тип клеток | Доля клеток, % | Диаметр, мкм | ||
|---|---|---|---|---|
| Горбуша | Кета | Горбуша | Кета | |
| Лимфоциты | 88.40 ± 0.97 | 89.71 ± 1.01 | $\frac{{8.02 \pm 0.19}}{{7.03 \pm 0.23}}$ | $\frac{{7.08 \pm 0.12{\kern 1pt} *}}{{6.09 \pm 0.10{\kern 1pt} *}}$ |
| Моноциты | 0.90 ± 0.23 | 0.42 ± 0.20 | $\frac{{17.70 \pm 0.95}}{{12.76 \pm 0.63}}$ | $\frac{{14.72 \pm 0.47{\kern 1pt} *}}{{14.02 \pm 0.38}}$ |
| Нейтрофилы: | ||||
| – палочкоядерные | 1.80 ± 0.24 | 1.45 ± 0.22 | $\frac{{12.18 \pm 0.24}}{{11.27 \pm 0.38}}$ | $\frac{{11.61 \pm 0.32}}{{10.36 \pm 0.22{\kern 1pt} *}}$ |
| – сегментоядерные | 5.00 ± 0.86 | 2.57 ± 0.29* | $\frac{{13.92 \pm 0.17}}{{12.37 \pm 0.36}}$ | $\frac{{13.47 \pm 0.21}}{{12.02 \pm 0.34}}$ |
| Базофилы | 0 | 1.00 ± 0.30 | 0 | $\frac{{15.00{\text{ }} \pm 0.40}}{{11.90 \pm 0.40}}$ |
| Бластные формы | 3.90 ± 0.27 | 4.85 ± 0.40 | $\frac{{14.80 \pm 0.63}}{{12.30 \pm 0.43}}$ | $\frac{{13.72 \pm 0.21}}{{12.68 \pm 0.37}}$ |
При сравнении соотношения разных форм лейкоцитов горбуши и кеты с данными литературы (Сергеенко, 2007; Изергина и др., 2014) обнаружены сходства и различия. От переходящей на экзогенное питание молоди лейкограммы половозрелых особей в период морского нагула отличаются низкой долей агранулоцитов и высоким содержанием гранулоцитов, тогда как уровень лимфоцитов, моноцитов и нейтрофилов имеет сходство с показателями молодых особей, закончивших процесс смолтификации в морской воде. При этом у молоди горбуши преобладают юные формы нейтрофилов. Наблюдаемое увеличение доли нейтрофилов и снижение числа лимфоцитов у молоди лососёвых во время смолтификации (Калинина, 1997; Izergina et al., 2006) связывают с изменением направления процесса лейкопоэза (Кондратьева, Киташова, 2002).
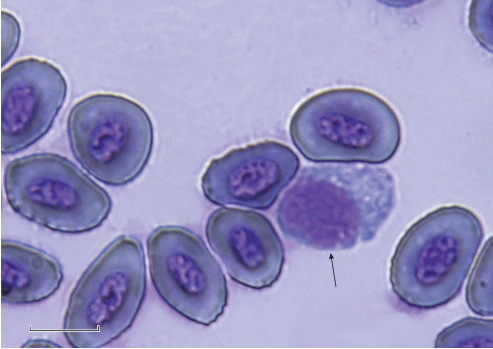
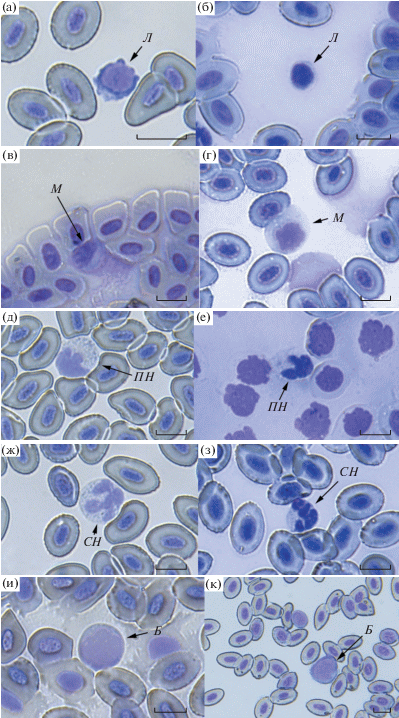
У горбуши по сравнению с кетой одноимённые клетки лейкоцитов, как правило, крупнее (таблица). Средний размер лимфоцитов горбуши достоверно больше, чем у кеты (рис. 1). Эти клетки небольшого размера и обычно с псевдоподиями имеют типичное округлое строение – бóльшую часть занимает ядро, окружённое тонким кольцом цитоплазмы (рис. 1а, 1б). Лимфоциты – центральные клетки иммунной системы, которые подразделяются на две основные субпопуляции: Т- и В-лимфоциты. T-лимфоциты выполняют функции распознавания чужеродных тел, разрушения антигена, формирования специфического иммунитета и адаптации рыб к паразитам и токсическим факторам, а В-лимфоциты − функции синтеза антител, образования предшественников антителообразующих клеток и формирования клеток памяти (Микряков, 1991). В отличие от лимфоцитов моноциты – крупные клетки с эксцентрично расположенным ядром бобовидной или овальной формы; в их цитоплазме часто содержатся вакуоли и части других клеток. Исследуемые виды достоверно различаются размерами, а также формой этих агранулоцитов: у горбуши они овальные, а у кеты – круглые (рис. 1в, 1г). Гранулоциты – клетки с эксцентрично расположенным ядром; содержащиеся в цитоплазме гранулы у нейтрофилов мелкие (рис. 1д−1з), а у базофилов – крупные (рис. 2). У горбуши сегментоядерные нейтрофилы достоверно крупнее, чем у кеты. Обнаруженные в крови кеты базофилы по форме и размерам отличаются от нейтрофилов. У бластных клеток бóльшую часть занимает ядро, окружённое узким слоем цитоплазмы (рис. 1и, 1к). Размеры лимфоцитов, моноцитов и нейтрофилов в основном соответствуют опубликованным данным (Изергина и др., 2014).
Рис. 1.
Клетки крови горбуши Onchorhynchus gorbuscha (а, в, д, ж, и) и кеты O. keta (б, г, е, з, к): а, б – лимфоциты (Л); в, г – моноциты (М); д, е − палочкоядерные нейтрофилы (ПН); ж, з − сегментоядерные нейтрофилы (СН); и, к – бластные клетки (Б). Масштаб: 10 мкм.
Индекс обилия лейкоцитов характеризует интенсивность лейкопоэза и уровень содержания лейкоцитов в единице объёма крови (Микряков, Лапирова, 1997; Яхненко, Клименков, 2009). Значимые различия этого индекса у горбуши (8.96 ± 1.61) и кеты (10.0 ± 1.28) не выявлены.
Таким образом, в морской период жизни в периферической крови горбуши и кеты преобладают лимфоциты и отсутствуют эозинофилы, а у горбуши также отсутствуют и базофилы. У кеты по сравнению с горбушей меньше доля сегментоядерных нейтрофилов и размеры лимфоцитов, моноцитов и палочкоядерных нейтрофилов.
Список литературы
Басова М.М. 2017. Лейкоцитарная формула морского ерша Scorpaena porcus как биомаркер антропогенного загрязнения прибрежных вод Чёрного моря // Вопр. ихтиологии. Т. 57. № 3. С. 347–352. https://doi.org/10.7868/S004287521703002X
Головина Н.А. 2018. Гематологические исследования и их использование для оценки здоровья рыб // Рыбоводство и рыб. хоз-во. № 5(148). С. 72–74.
Головина Н.А., Тромбицкий И.Д. 1989. Гематология прудовых рыб. Кишинев: Штиинца, 156 с.
Гордеев И.И., Кловач Н.В. 2019. Вольный лосось: трудности прогнозирования уловов тихоокеанских лососей // Природа. Т. 3. С. 22–27. https://doi.org/10.7868/S0032874X19030049
Житенева Л.Д., Макаров Э.В., Рудницкая О.А. 2004. Основы ихтиогематологии (в сравнительном аспекте). Ростов н/Д.: Эверест, 311 с.
Иванова Н.Т. 1983. Атлас клеток крови рыб. М.: Лег. и пищ. пром-сть, 184 с.
Изергина Е.Е., Изергин И.Л., Изергин Л.И. 2014. Атлас клеток крови лососевых рыб материкового побережья северной части Охотского моря. Магадан: Кордис, 127 с.
Калинина М.В. 1997. Гемограммы молоди тихоокеанских лососей в онтогенезе: Автореф. дис. … канд. биол. наук. Владивосток: ВГМУ, 20 с.
Кондратьева И.А., Киташова А.А. 2002. Функционирование и регуляция иммунной системы рыб // Иммунология. № 2. С. 97–101.
Королева И.М. 2016. Гематологические показатели сига обыкновенного Coregonus lavaretus L. в водоемах Кольского севера // Тр. ВНИРО. Т. 162. С. 36–45.
Кузина Т.В. 2011. Цитофизиологические особенности крови промысловых рыб Волго-Каспийского канала: Автореф. дис. … канд. биол. наук. Астрахань: АГУ, 25 с.
Микряков В.Р. 1991. Закономерности формирования приобретенного иммунитета у рыб. Рыбинск: Изд-во ИБВВ РАН, 153 с.
Микряков В.Р., Лапирова Т.Б. 1997. Влияние солей некоторых тяжелых металлов на состав белой крови молоди ленского осетра Acipenser baeri // Вопр. ихтиологии. Т. 37. № 4. С. 538–542.
Промысловые рыбы России. В 2 томах. 2006 / Под ред. Гриценко О.Ф. м и др. Т. 1. М.: Изд-во ВНИРО, 656 с.
Пустовит Н.С., Пустовит О.П. 2005. Некоторые гематологические показатели камчатской микижи Parasalmo mykiss // Вопр. ихтиологии. Т. 45. № 5. С. 680–687.
Сергеенко Т.М. 2007. Морфофизиологическая характеристика молоди кеты (Oncorhynchus keta Walbaum) при ее воспроизводстве на лососевых рыбоводных заводах Сахалина: Автореф. дис. … канд. биол. наук. Рыбное: ВНИИПРХ, 25 с.
Серпунин Г.Г. 2002. Гематологические показатели адаптаций рыб: Автореф. дис. … докт. биол. наук. Калининград: КГТУ, 42 с.
Суворова Т.А., Герман А.В. 2021. Состав лейкоцитов леща Саратовского водохранилища // Рыбоводство и рыб. хоз-во. № 2. С. 44–51. https://doi.org/10.33920/sel-09-2102-04
Хованский И.Е., Хованская Л.Л. 1994. Роль гематологических показателей в определении физиологической полноценности заводской молоди лососевых // Сб. науч. тр. ГосНИИОРХ. Вып. 308. С. 171–184.
Яхненко В.М., Клименков И.В. 2009. Особенности состава и структуры клеток крови рыб пелагиали и прибрежья озера Байкал // Изв. РАН. Сер. биол. № 1. С. 46–54.
Ciereszko A., Liu L., Dabrowski K. 2007. Optimal conditions for determination of aspartate aminotransferase activity in rainbow trout and whitefish // J. Appl. Ichthyol. V. 14. № 1−2. P. 57–63. https://doi.org/10.1111/j.1439-0426.1998.tb00614.x
Dessen J.-E., Østbye T.K., Ruyter B. et al. 2020. Sudden increased mortality in large seemingly healthy farmed Atlantic salmon (Salmo salar L.) was associated with environmental and dietary changes // J. Appl. Aquacult. https://doi.org/10.1080/10454438.2020.1726237
Gordeev I.I., Mikryakov D.V., Balabanova L.V., Mikryakov V.R. 2017. Composition of leucocytes in peripheral blood of Patagonian toothfish (Dissostichus eleginoides Smitt, 1898) (Nototheniidae) // Polar Res. V. 36. № 1. Article 1374126. https://doi.org/10.1080/17518369.2017.1374126
Izergina E., Izergin I., Volobyev V. 2006. Influence of water salinity on the physiological status and distribution of juvenile chum salmon in the estuary of the Ola River of the northeast coast of the Okhotsk Sea // 2-nd NPAFC Int. Workshop “Factors affecting production of juvenile salmon”. Sapporo, Japan, 9 p.
Lulijwa R., Andrea C., Fabrice M. et al. 2019. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit // Fish Shellfish Immunol. V. 88. P. 179–188. https://doi.org/10.1016/j.fsi.2019.02.059
Sandnes K., Lie Ø., Waagbø R. 1988. Normal ranges of some blood chemistry parameters in adult farmed Atlantic salmon, Salmo salar // J. Fish Biol. V. 32. № 1. P. 129–136. https://doi.org/10.1111/j.1095-8649.1988.tb05341.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии