Вопросы ихтиологии, 2022, T. 62, № 3, стр. 303-312
Пространственно-временнóе распределение и размерный состав личинок инвазивного бычка-кругляка Neogobius melanostomus и аборигенного бычка малого Pomatoschistus minutus (Gobiidae) в ихтиопланктоне Юго-Восточной Балтики
1 Атлантический филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии “ВНИРО” (“АтлантНИРО”)
Калининград, Россия
2 Институт океанологии РАН – ИО РАН
Москва, Россия
* E-mail: karasiova@rambler.ru
Поступила в редакцию 19.03.2021
После доработки 07.09.2021
Принята к публикации 15.10.2021
- EDN: BXZNOD
- DOI: 10.31857/S0042875222030080
Аннотация
По материалам ихтиопланктонных съёмок 1999–2020 гг. представлены данные о первом обнаружении в 2004 г. и распределении в последующие годы личинок понто-каспийского вселенца – бычка-кругляка Neogobius melanostomus – в прибрежных водах российского сектора Юго-Восточной Балтики. Личинок бычка-кругляка отмечали исключительно в ночное время суток в узком батиметрическом диапазоне (10–17 м); личинок бычка малого Pomatoschistus minutus (аборигенного доминирующего вида семейства Gobiidae) – круглосуточно в широком диапазоне глубин (1–50 м). Выявлены значительные различия в массе тела личинок бычка-кругляка и бычка малого одного размерного диапазона (7–8 мм) – 5.69 против 2.52 мг. Отмечена тенденция к снижению численности и массы тела бычка малого за рассматриваемый период.
Бычок-кругляк Neogobius melanostomus относится к фаунистическому комплексу солоноватоводных понтических реликтов и в южных морях России образует наиболее многочисленные популяции бычковых по сравнению с другими видами из семейства Gobiidae (Калинина, 1976). В Азово-Черноморском регионе обитает на каменистых, ракушечно-песчаных и даже илистых грунтах; в Каспийском море встречается также среди донной растительности (Атлас пресноводных рыб …, 2002). В 1970–1980-е гг. началось его проникновение в другие водоёмы Европы, по-видимому, осуществлявшееся через балластные воды, а также по рекам и сети каналов (Leppäkoski, Olenin, 2000). Вселение шло по нескольким направлениям и включало в том числе водохранилища Волги (Гавлена, 1970; Шемонаев, Кириленко, 2009), р. Москва (Соколов и др., 1994), верхнюю часть бассейна р. Дунай (Jurajda et al., 2005), а также Великие озёра Америки (Kornis et al., 2012). В Балтийском регионе бычок-кругляк впервые был обнаружен у побережья Хельской косы, в юго-западной части Гданьского залива (Skóra, Stolarski, 1993). По-видимому, он появился там в 1987 г., учитывая, что первые пойманные в 1990 г. экземпляры имели возраст 3–4 года. Предполагалось, что он проник в Гданьский залив с балластными водами. В российской части Юго-Восточной Балтики бычок-кругляк был впервые зарегистрирован в 2000 г. возле порта Балтийск (Тылик, Закревский, 2003). Начиная с 2011 г. этот вид массово встречался в научно-исследовательских ловах Института океанологии РАН в районе Вислинской косы (Кодухова и др., 2017). Бычок-кругляк успешно адаптировался как к солёным (Балтийское море), так и к пресным водоёмам (реки и озера) Польши (Бониславская и др., 2014). В последние годы этот вид быстро распространялся вдоль северо-восточного побережья Балтийского моря (Ojaveer et al., 2002; Ojaveer, 2006), продвинувшись к 2002 г. до побережья Эстонии (Shpilev, Ojaveer, 2003), а к 2012 г. до Ботнического залива у берегов Финляндии (Kotta et al., 2016). В водах Латвии бычок-кругляк стал промысловым видом (Knospina, Putnis, 2014). В этой стране промышленный вылов бычка-кругляка возрос с 6.3 кг в 2006 г. до 26 т в 2013 г., в то время как его уловы в научных целях увеличились за эти же годы с 0.9 до 500 кг (Knospina, Putnis, 2014).
Однако, несмотря на тридцатилетнее присутствие этого вида в Балтийском регионе, до сих пор отсутствуют сведения о поимке его на ранних стадиях онтогенеза в прибрежных водах моря за исключением российского сектора Юго-Восточной Балтики (Карасева и др., 2020). Большинство описаний ранних стадий онтогенеза бычка-кругляка основаны на результатах инкубации икры и выращивания потомства в экспериментальных условиях (Москалькова, 1967, 1996; Логачев, Мордвинов, 1979; Бониславская и др., 2014). Как впервые было показано Крыжановским и Пчелиной (1941), а позднее Москальковой (1967) и Калининой (1976), сразу после выклева из икры особи кругляка характеризовались наличием остатков желточного мешка, полностью сформированными плавниками и отсутствием чешуи. Москалькова (1996) полагала, что потомство этого вида выклёвывается на стадии малька вследствие “эмбрионизации” развития, то есть прохождения стадии предличинки и начальных этапов личиночного развития под оболочкой икринки. Некогда предложенный Рассом (1972) термин “личинкомалёк” не нашёл широкого применения. В современных исследованиях (Hensler, Jude, 2007; Бониславская и др., 2014) принято считать, что после выклева происходит личиночное развитие.
В состав ихтиопланктонного комплекса рассматриваемого района входят личинки следующих видов аборигенных гобиид: бычок малый Pomatoschistus minutus, бычок обыкновенный P. microps и бычок чёрный Gobius niger (Казанова, 1954). Доминирующим видом летнего ихтиопланктона по численности и площади распределения является бычок малый (Карасева и др., 2020). Кроме того, в июле в ихтиопланктоне встречаются личинки других демерсальных видов, в том числе европейской малопозвонковой песчанки Ammodytes tobianus, саргана Belone belone, липариса Liparis liparis, длиннорылой морской иглы Syngnathus typhle (Karasiova, 2016).
Цель работы – выяснить суточную динамику встречаемости личинок бычка-кругляка, описать их батиметрическое распределение, размер и массу, оценить численность; сравнить вышеуказанные показатели с аналогичными для личинок аборигенного бычка малого.
МАТЕРИАЛ И МЕТОДИКА
Материал собран у российского побережья Юго-Восточной Балтики на глубинах 8–50 м в июле 1999–2020 гг. Схема станций, на которых чаще всего выполняли ловы, представлена на рис. 1. Сбор ихтиопланктона осуществляли вертикальным обловом слоя дно–поверхность ихтиопланктонной конусной сетью ИКС-80 с фильтрующим конусом из сита № 21 на судах СЧС “Балтика” (2000–2004), МРТК-1071 (2015), НИС “Академик Николай Страхов” (2017) и НИС “Академик Борис Петров” (2019.). Отлов на двух первых судах проводили в течение суток почти непрерывно; на двух других (суда РАН) – с перерывами для иных видов работ. В 2005–2014 гг., когда ночные ловы не проводили, сборы выполняли на НИС “Профессор Штокман” и СТМ “АтлантНИРО”, а также на судах типа МРТК.
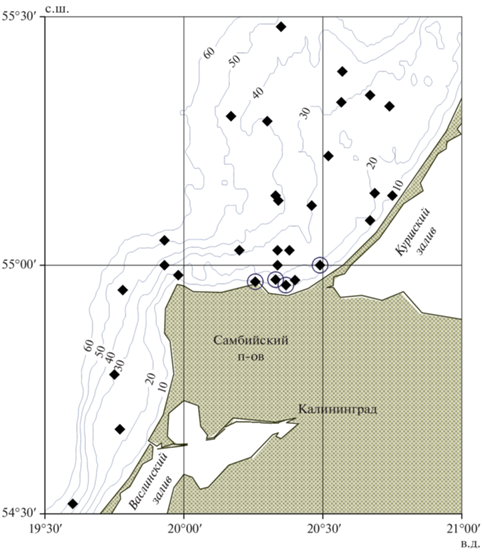
Рис. 1.
Карта-схема расположения ихтиологических станций (◆), на которых наиболее часто выполняли ловы, и мест поимки (⚪) личинок бычка-кругляка Neogobius melanostomus; (—) – изобаты.
В 2000–2002, 2004, 2015, 2017 и 2019 гг. лов проводили как в светлое время суток (147 проб), так и в тёмное (59) (табл. 1); в другие годы – только в светлое. Всего собрано 386 проб. Собранный материал фиксировали 4%-ным раствором формальдегида.
Таблица 1.
Число ихтиопланктонных ловов, выполненных в тёмное и светлое время суток у российского побережья Юго-Восточной Балтики в отдельные годы (2000–2019)
| Время суток | Год | Итого | ||||||
|---|---|---|---|---|---|---|---|---|
| 2000 | 2001 | 2002 | 2004 | 2015 | 2017 | 2019 | ||
| Тёмное (21:30–03:30) | 16 | 13 | 7 | 5 | 4 | 6 | 8 | 59 |
| Светлое (03:30–21:30) | 23 | 30 | 45 | 13 | 11 | 10 | 15 | 147 |
| Всего | 39 | 43 | 52 | 18 | 15 | 16 | 23 | 206 |
Таблица 2.
Результативные ловы личинок бычка-кругляка Neogobius melanostomus у российского побережья Юго-Восточной Балтики
| Дата | Время | Координаты | Глубина, м | Численность, экз/м2 | Общая длина (TL), мм |
|---|---|---|---|---|---|
| 28.07.2004 | 23:50–24:00 | 54°57′ с.ш. 20°22′ в.д. | 10 | 2 | 6.5 (1) |
| 15.07.2015 | 00:45–01:20 | 55°00′ с.ш. 20°34′ в.д. | 12 | 2 | 8.0 (1) |
| 14.07.2017 | 22:00–22:15 | 54°58′ с.ш. 20°16′ в.д. | 10 | 14 | 7.4–8.2 (7) |
| 23:30–23:45 | 54°57′ с.ш. 20°22′ в.д. | 11 | 10 | 7.0–8.0 (5) | |
| 19.07.2019 | 23.08–23.30 | 54°58′ с.ш. 20°20′ в.д. | 17 | 8 | 7.0–8.2 (4) |
Примечание. Здесь и в табл. 3 в круглых скобках указано число личинок, экз.
Идентификацию бычка-кругляка проводили по диагностическим признакам, указанным в публикациях Москальковой (1967, 1996); личинок бычка малого – по определителю Казановой (1954). Всех личинок измеряли индивидуально под бинокуляром МБС-10 с точностью до 0.1 мм. Затем личинок бычка малого группировали по размерным классам через интервал 0.5 мм и взвешивали групповым методом на торсионных весах типа ВТ. Личинок бычка-кругляка взвешивали индивидуально, затем (для контроля) групповым методом по размерным классам. Численность особей оценивали в экз/м2. Значения коэффициента корреляции при различных уровнях значимости рассчитывали согласно общепринятой методике (Рокицкий, 1973).
РЕЗУЛЬТАТЫ
Впервые личинка бычка-кругляка была обнаружена в 2004 г. в ночной пробе ихтиопланктона, затем личинки этого вида были пойманы в 2015, 2017 и 2019 гг. в ходе целенаправленных ночных сборов (табл. 2). Результативные ловы были проведены между 22:00 и 01:20 ч.
Личинки были выловлены на глубинах 10–17 м в центральной части мелководья между полуостровом Самбийский и Куршской косой (рис. 1) в узком диапазоне координат: 54°56′–55°01′ с.ш. и 20°16′–20°34′ в.д. На небольших участках мелководья к северу (55°02′–55°14′ с.ш.) и к югу (54°55′–54°45′ с.ш.), также обловленных в ночные часы, личинки вселенца обнаружены не были. Все выловленные особи общей длиной (TL) 6.5–8.2 (в среднем 7.8) мм имели сформированные плавники, но желточный мешок и пигментные клетки на теле отсутствовали.
В ихтиопланктонном комплексе в июле на протяжении всех лет наблюдения доминировали по численности личинки бычка малого, обнаруженные на 299 станциях из 386. В небольшом количестве встречались также личинки бычка обыкновенного (лысуна), единично – личинки бычка чёрного. Длина личинок бычка малого вскоре после выклева составляла 2.4–2.7 мм. Плавники отсутствовали, тело окаймлено плавниковой складкой. В целом длина личинок этого вида в июле охватывала широкий диапазон – 2.4–12.1 мм, наиболее многочисленны были особи TL 3–5 мм.
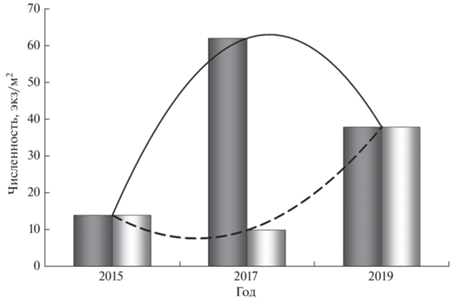
Личинки бычка-кругляка отмечены в ихтиопланктоне исключительно в ночное время суток, в то время как личинки бычка малого встречались круглосуточно, но с пиком численности, приходящимся также на ночные часы (рис. 2). Средняя численность личинок аборигенного бычка малого в ночное время на тех же станциях, где были отловлены личинки бычка-кругляка, значительно различалась по годам. (рис. 3). Максимальная численность (184 экз/м2) была отмечена в 2004 г., минимальная – в 2017 г., составив в среднем по двум станциям 5 экз/м2 (соответственно 10 и 0 экз/м2). Численность личинок бычка-кругляка в ночных ловах варьировала от минимальных 2 экз/м2 в 2004 и 2015 гг. до 14 экз/м2 в 2017 г. Межгодовая вариабельность размерного диапазона личинок бычка малого (от 2–9 мм в 2004 г. до 3–6 мм в 2017 г.) была значительно шире, чем у бычка-кругляка. Размерный диапазон личинок кругляка был очень узок (7–8 мм) даже в 2017 г., когда его численность превышала таковую у бычка малого (12 экз/м2 против 5 экз/м2 в среднем по двум станциям).
Рис. 2.
Суточная динамика численности (% суммарной численности) личинок бычка-кругляка Neogobius melanostomus (−⚫−) и бычка малого Pomatoschistus minutus (−◇−) на станциях совместной встречаемости у российского побережья Юго-Восточной Балтики.
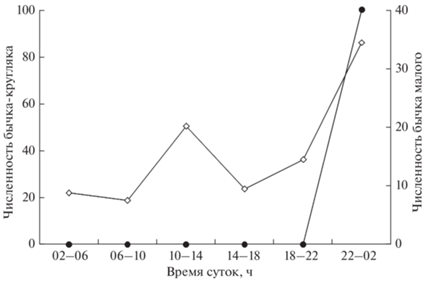
Рис. 3.
Распределение по размерам (общая длина TL) личинок бычка-кругляка Neogobius melanostomus (◼) и бычка малого Pomatoschistus minutus (◻) в пробах ночных ловов в годы поимки личинок бычка-кругляка у российского побережья Юго-Восточной Балтики.
Масса мелких личинок бычка малого TL 3–4 мм в целом за исследованный период снизилась почти в 1.4 раза: с 2004–2009 по 2010–2015 гг. в 1.3 раза и незначительно (в 1.1 раза) с 2010–2015 по 2017–2019 гг. (табл. 3). Масса крупных личинок TL 7–8 мм снизилась только в 1.15 раза с 2004–2009 по 2010–2015 гг. Масса личинок бычка-кругляка TL 7–8 мм вскоре после их выклева из икринок более чем в 20 раз превышала таковую у недавно выклюнувшихся личинок аборигенного вида-доминанта TL 3–4 мм. В одинаковом диапазоне длин (TL 7–8 мм) масса личинок бычка-кругляка превышала таковую личинок бычка малого в 2.3 раза.
Таблица 3.
Средняя масса личинок в зависимости от общей длины (TL) бычка малого Pomatoschistus minutus и бычка-кругляка Neogobius melanostomus из проб у российского побережья Юго-Восточной Балтики, мг
| Годы | P. minutus | N. melanostomus | |
|---|---|---|---|
| TL 3–4 мм | TL 7–8 мм | TL 7–8 мм | |
| 2004–2009 | 0.318 (124) | 2.696 (28) | |
| 2010–2015 | 0.245 (105) | 2.340 (33) | |
| 2017–2019 | 0.231 (72) | 5.690 (16) | |
| 2004–2019 | 0.265 (301) | 2.518 (61) | 5.690 (16) |
Средняя численность личинок бычка-кругляка заметно выросла (в четыре–шесть раз) в 2017 и 2019 гг. по сравнению с годами его первых обнаружений. В зоне глубин 10–17 м его доля в ихтиопланктонном комплексе среди демерсальных видов (по численности) варьировала от крайне низкого значения (0.8%) в первый год его обнаружения до максимума в 2017 г. (>60%). Однако его доля в суммарной численности личинок демерсальных видов по всей акватории съёмки была незначительной: от минимума в 2004 (0.4%) до максимума в 2017 г. (21.9%) (табл. 4).
Таблица 4.
Численность личинок бычка-кругляка Neogobius melanostomus в ихтиопланктоне у российского побережья Юго-Восточной Балтики
| Дата | На станциях поимки (глубина 10–17 м) | В районе съёмки (глубина 10–50 м) | ||
|---|---|---|---|---|
| NM | NR | NM | NR | |
| 28.07.2004 | 2 | 0.83 | 0.11 | 0.36 |
| 15.07.2015 | 2 | 22.22 | 0.18 | 6.25 |
| 14.07.2017 | 12 | 66.67 | 1.5 | 21.93 |
| 19.07.2019 | 8 | 16.00 | 0.40 | 5.56 |
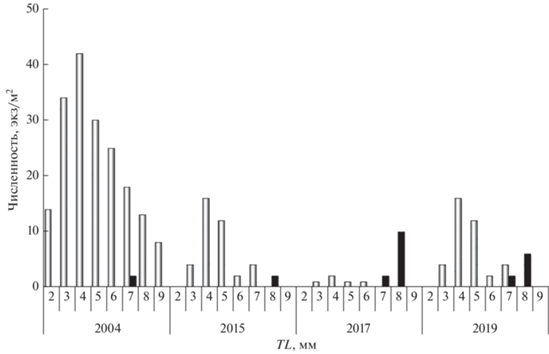
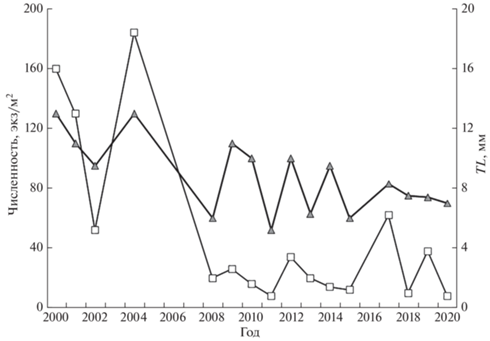
За исследованный период помимо снижения массы тела недавно выклюнувшихся личинок бычка малого отмечены тенденции снижения их максимальной численности в скоплениях и уменьшения их максимальной длины (рис. 4). Первый показатель отражает снижение средней численности личинок этого вида за рассматриваемый период, второй, возможно, свидетельствует о снижении скорости их роста. Между временнóй динамикой этих показателей за 20 лет прослеживается значимая положительная корреляционная связь (r = 0.775, p < 0.01). Изменения численности и размерного состава личинок бычка малого совпали по времени с обнаружением личинок бычка-кругляка в прибрежной зоне.
Рис. 4.
Динамика максимальных численности (−◻−) и общей длины TL (− −) личинок бычка малого Pomatoschistus minutus в 2000–2019 гг. у российского побережья Юго-Восточной Балтики.
−) личинок бычка малого Pomatoschistus minutus в 2000–2019 гг. у российского побережья Юго-Восточной Балтики.
В 2015 и 2019 гг., когда основные агрегации личинок бычка малого были приурочены к глубинам <20 м, прослеживалось совпадение распределения максимальных скоплений его личинок с личинками бычка-кругляка (рис. 5). Однако в 2017 г. максимальная численность личинок бычка малого (62 экз/м2) была отмечена за пределами батиметрической зоны распределения бычка-кругляка – на глубине 27 м. На глубине 10–11 м, где были обнаружены личинки кругляка, численность личинок бычка малого не превышала 10 экз/м2.
ОБСУЖДЕНИЕ
Бычок-кругляк характеризуется как солоноватоводная, донная, малоподвижная, оседлая рыба (Тылик, 2003, 2007), совершающая миграции на расстояние нескольких сот метров летом и до нескольких километров поздней осенью и ранней весной (Olenin et al., 2017). Глубины, на которых обитает бычок-кругляк в российской части Юго-Восточной Балтики, не превышают 15 м (Тылик, 2003, 2007). Учитывая относительно короткий срок, за который этот вид освоил всё побережье Балтийского моря, представлялось вероятным, что его распространение внутри этого водоёма также было связано с балластными водами (Olenin et al., 2017). Однако в совокупности вертикальная ночная миграция личинок в поверхностный слой и северное направление поверхностного течения у восточных берегов Балтики в значительной степени могли содействовать его расселению.
Впервые массовое появление личинок кругляка в поверхностном слое в ночное время при почти полном их отсутствии днём (209 против 2 экз.) было обнаружено Хенслером и Джуде (Hensler, Jude, 2007) в результате ихтиопланктонных исследований летом 2000–2005 гг. в районе Великих Американских озёр. Дневные ловы в июне 2005 г. проводили в 09:30 и 18:00, ночные – в 23:00 и 02:30. Была высказана гипотеза о том, что ночное появление личинок кругляка в поверхностном слое является их суточной вертикальной миграцией, обеспечивающей дисперсию и расселение особей, а также способствующей поиску кормовых организмов или избеганию ими хищников. По мнению указанных выше авторов, длина выловленных особей (6.5–8.9 мм) могла быть оптимальной для ночного подъёма к поверхности личинок рыб, лишённых плавательного пузыря. В качестве подтверждения этого вывода они привели ссылку на лабораторные исследования поведения личинок кругляка (Логачев, Мордвинов, 1979), согласно которым скорость плавания личинок кругляка резко возрастала (почти в два раза) при достижении TL 6.0–6.2 мм. Данные настоящего исследования по длине личинок бычка-кругляка и ночному времени их поимки у побережья Юго-Восточной Балтики практически идентичны результатам, ранее полученным Хенслером и Джуде (Hensler, Jude, 2007).
Согласно экспериментам по инкубации икры бычка-кругляка балтийской популяции (Бониславская и др., 2014), длина личинок в момент выклева составляет ~ 5.0 мм, а после резорбции желточного мешка – 8.5–11.4 мм. Таким образом в случае способности личинок кругляка всех размеров подниматься ночью в толщу воды диапазон длины отловленных особей составлял бы от 5 до 11–12 мм, чего зарегистрировано не было. Поэтому можно полагать, что число личинок кругляка, вылавливаемых в ночные часы, не является показателем численности потомства этого вида. Однако их присутствие является доказательством его размножения, и отсюда – наличия самовоспроизводящейся популяции этого вида в юго-восточной части Балтийского моря.
Для выяснения вопроса о наличии или отсутствии влияния инвазивного вида на аборигенных гобиид ранних стадий развития необходимо выяснить, насколько перекрывается батиметрическое распределение их личинок. Для этого материалы настоящего исследования дополнены ранее опубликованными данными (Karasiova, 2016) за июль 2014 г. по горизонтальным обловам прибрежных глубин 1.0–1.5 м. Установлено, что личинок бычка обыкновенного и бычка чёрного в большом количестве отлавливали у самого берега и очень редко – на глубинах >10 м. Личинки доминантного бычка малого были многочисленны на всей акватории съёмки; их отлавливали на глубинах от 1.0–1.5 до 40–50 м. Таким образом, личинки этого вида имели наибольшую площадь распространения, причём пик их численности в разные годы фиксировался на разных глубинах (смещаясь с 10–20 м до 20–30 м).
Личинки кругляка были обнаружены в довольно узком диапазоне глубин – 10–17 м. Только при первой поимке его личинки в 2004 г. (глубина 10 м) одновременно на этой же глубине была зафиксирована самая высокая численность личинок бычка-малого (184 экз/м2). В 2017 г. глубины с максимальной численностью этих видов не совпадали (14 экз/м2 на глубине 10 м у кругляка и 62 экз/м2 на глубине 27 м у бычка малого).
Колебания численности личинок бычка малого могли зависеть от нередкого для исследованного района чередования процессов апвеллинга и даунвеллинга. Особенностью термического режима Балтики является существование летом холодного промежуточного слоя между поверхностными и придонными водами (Гидрометеорология и гидрохимия морей, 1994). В годы активизации прибрежного апвеллинга воды холодного промежуточного слоя из открытой части моря могли проникать на глубины 50–20 м, что типично для российской зоны Юго-Восточной Балтики (Голенко, Голенко, 2012). Эти процессы снижают температуру воды в придонном слое, задерживая созревание половозрелых особей и замедляя развитие выметанной икры местных видов бычковых (Karasiova, 2016). Последствием проникновения вод из этого слоя в прибрежную мелководную зону могло быть сокращение площади с благоприятным для размножения бычка малого температурным режимом. Значительная роль температурного фактора в колебаниях численности и площади распределения личинок бычка малого была прослежена ранее (Karasiova et al., 2002) по материалам июльских съёмок 1999 и 2000 гг., когда личинки бычка-кругляка ещё не были обнаружены. В связи с тем что распределение личинок бычка-кругляка либо не совпадало с распределением бычка малого, либо совпадало лишь в малой части зоны обитания последнего (глубины 10–17 м), конкуренция между личинками бычка малого и бычка-кругляка за кормовые ресурсы их местообитаний представляется маловероятной.
Глубины более 25–30 м могут рассматриваться как зона риска для размножения бычка малого из-за возможности проникновения из промежуточного слоя холодных вод, температура которых зависит от суровости предшествующей зимы. Даже небольшое понижение температуры воды на этих глубинах могло быть причиной снижения скорости роста личинок, что и наблюдалось в рассматриваемые годы. Ещё в большей степени уязвимы нерестовые биотопы гобиид у берега на глубинах 1–2 м. Они могут функционировать только в условиях длительного сохранения маловетреной погоды и разрушаются даже при слабом шторме. Оптимальной зоной глубин, защищённой как от проникновения холодных вод промежуточного слоя, так и от воздействия штормов, в зоне РФ, по-видимому, является батиметрический диапазон от 10 до 20–25 м. Личинки бычка-кругляка в рассматриваемые годы были выловлены в пределах этих глубин.
Инвазию чужеродных видов-аквабионтов принято рассматривать как важный фактор, способствующий трансформации водных экосистем (Carlton, 1996; Olenin, Leppäkoski, 1999). Исследования в Пуцкой бухте Гданьского залива показали, что половозрелый бычок-кругляк способен вытеснять аборигенные виды гобиид – бычка чёрного, бычка обыкновенного и бычка малого (Skóra, Reznik, 2001) – и даже конкурировать с речной камбалой Platichthys flesus за кормовые ресурсы Гданьского залива (Karlson et al., 2006). Это может быть связано с высокой численностью бычка-кругляка TL > 8 см в польских водах, достигавшей более 350 экз/100 м2 (Sapota, Skóra, 2005). Максимальная длина половозрелого бычка-кругляка значительно превышает таковую у P. minutus и P. microps: соответственно 25.9 и 6.0 см (Тылик, 2007). Отсутствие данных по численности вселенца в зоне РФ пока не позволяет сделать выводы о возможности конкуренции между этими видами за нерестовые участки в мелководной зоне.
Изменения численности как аборигенных гобиид, так и вселенца могли определяться воздействием комплекса факторов. В последние десятилетия происходило усиление процессов эвтрофикации в Гданьском заливе и его прибрежной зоне (Lysiak-Pastuszak et al., 2004). По-видимому, эвтрофикация способствовала изменениям видового состава макрофитов, биомассы и продукции зообентоса (Kruk-Dowgiallo, Szaniawska, 2008; Горбунова, Есюкова, 2020; Гусев, 2020). Эти изменения могли прямо или косвенно повлиять на состав пищи бычка-кругляка, в диету которого входят разнообразные виды беспозвоночных: от амфипод (Amphipoda) до двустворчатых моллюсков (Bivalvia, Dreissenidae) (Corkum et al., 2004; Cooper, Ruetz, 2009). При этом установлено, что кругляк после метаморфоза уже сам становится значимым компонентом питания морских птиц, в основном цапель Ardea cinerea и бакланов Phalacrocorax carbo, а также таких рыб, как судак Sander lucioperca и окунь Perca fluviatilis (Jakubas, Mioduszewska, 2005; Rakauskas et al., 2013).
При планировании новых исследований необходима организация комплексных работ, включающих изучение распределения и оценку численности половозрелой части популяции кругляка, проведение ночных ихтиопланктонных сборов его личинок с целью определить продолжительность сезона размножения и местоположения нерестовых биотопов, а также ведение мониторинга основных абиотических факторов среды (температура, солёность).
ВЫВОДЫ
1. В ихтиопланктоне Юго-Восточной Балтики в июле 2004 г. впервые обнаружена личинка бычка-кругляка – инвазивного вида понто-каспийского происхождения. Личинки этого вида были также выловлены в 2015, 2017 и 2019 гг., их максимальная численность (14 экз/м2) отмечена в 2017 г.
2. Все случаи поимки бычка-кругляка были отмечены только в ночное время суток – между 22:00 и 01:20.
3. Батиметрическое распределение личинок бычка-кругляка было ограничено глубинами 10–17 м, в то время как личинки доминантного бычка малого встречались в широком диапазоне глубин – 1–50 м.
4. Отмечено снижение численности и массы тела бычка малого за последние годы.
5. Ввиду расхождения в пространственном распределении личинок инвазивного и аборигенного бычков конкуренция между ними за кормовые ресурсы, по-видимому, маловероятна.
Список литературы
Атлас пресноводных рыб России. 2002. Т. 2. М.: Наука, 253с.
Бониславская М., Таньский А., Брисевич А. и др. 2014. Особенности эмбрионального развития бычка-кругляка Neogobius melanostomus (Gobiidae) в пресной воде // Вопр. ихтиологии. Т. 54. № 5. С. 591–598. https://doi.org/10.7868/S0042875214050026
Гавлена Ф.К. 1970. Каспийский бычок-кругляк Neogobius melanostomus affinis (Eichwald.) – новый элемент ихтиофауны Средней Волги // Биология внутр. вод. Информ. бюл. № 6. С. 44–45.
Гидрометеорология и гидрохимия морей. 1994. Т. III. Балтийское море. Вып. 2. Гидрохимические условия и океанологические основы формирования биологической продуктивности. СПб.: Гидрометеоиздат, 435с.
Голенко М.Н., Голенко Н.Н. 2012. О структуре динамических полей в Юго-Восточной Балтике при ветровых воздействиях, приводящих к апвеллингу и даунвеллингу // Океанология. Т. 52. № 5. С. 654–667.
Горбунова Ю.А., Есюкова Е.Е. 2020. Выбросы макроводорослей и морских трав на российской части юго-восточного побережья Балтийского моря // Изв. КГТУ. № 59. С. 24–33.
Гусев А.А. 2020. Многолетняя динамика макрозообентоса в юго-восточной части Балтийского моря: Автореф. дис. … канд. биол. наук. Борок: ИБВВ, 26 с.
Казанова И.И. 1954. Определитель икры и личинок рыб Балтийского моря и его заливов // Тр. ВНИРО. Т. 26. С. 221–265.
Калинина Э.М. 1976. Размножение и развитие азово-черноморских бычков. Киев: Наукова думка, 120 с.
Карасева Е.М., Архипов А.Г., Ежова Е.Е. 2020. Ихтиопланктон Юго-Восточной Балтики в летний сезон: современные изменения в распределении и численности икры и личинок массовых видов рыб // Тр. ВНИРО. Т. 181. С. 165–177.
Кодухова Ю.В., Боровикова Е.А., Ежова Е.Е., Гущин А.В. 2017. Особенности морфологии вселенца бычка-кругляка (Neogobius melanostomus) Юго-Восточной Балтики // Рег. экология. № 3 (49). С. 7–16.
Крыжановский С.Г., Пчелина З.М. 1941. О принципе построения системы бычков сем. Gobiidae // Зоол. журн. Т. 20. Вып. 3. С. 446–455.
Логачев В.С., Мордвинов Ю.Е. 1979. Скорость плавания и активность личинок бычка-кругляка и некоторых хищных ракообразных Черного моря // Биология моря. № 3. С. 77–80.
Москалькова К.И. 1967. Эколого-морфологические особенности развития бычка-кругляка Neogobius melanostomus (Pallas) // Морфо-экологический анализ развития рыб. М.: Наука. С. 48–75.
Москалькова К.И. 1996. Экологические и мофо-физиологические предпосылки к расширению ареала у бычка-кругляка Neogobius melanostomus в условиях антропогенного загрязнения водоемов // Вопр. ихтиологии. Т. 36. № 5. С. 615–621.
Расс Т.С. 1972. Систематика плавучих икринок и личинок морских рыб (ихтиопланктона) // Бюл. МОИП. Отд. биол. Т. 77. № 5. С. 5–18.
Рокицкий П.Ф. 1973. Биологическая статистика. Минск: Высш. шк., 320 с.
Соколов Л.И., Соколова Е.Л., Пегасов В.А. и др. 1994. Ихтиофауна реки Москвы в черте г. Москва и некоторые данные о ее состоянии // Вопр. ихтиологии. Т. 34. № 5. С. 634–641.
Шемонаев Е.В., Кириленко Е.В. 2009. Некоторые черты биологии бычка-кругляка Neogobius melanostomus (Perciformes, Gobiidae) в водах Куйбышевского водохранилища // Там же. Т. 49. № 4. С. 483–487.
Тылик К.В. 2003. Ихтиофауна Калининградской области. Калининград: Изд-во КГТУ, 128 с.
Тылик К.В. 2007. Рыбы трансграничных водоемов России и Литвы. Калининград: Изд-во КГТУ, 126 с.
Тылик К.В., Закревский Е.Д. 2003. Натурализация вселенца бычка-кругляка Neogobius melanostomus (Pallas, 1814) в Вислинском заливе Балтийского моря // Тез. докл. Междунар. конф. “Инновации в науке и образовании–2003”. Калининград: Изд-во КГТУ. С. 39–40.
Carlton J.T. 1996. Pattern, process, and prediction in marine invasion ecology // Biol. Conserv. V. 78. P. 97–106.
Cooper M.J., Ruetz C.R., III, Uzarski D.G., Shafer B.M. 2009. Habitat use and diet of the round goby (Neogobius melanostomus) in coastal areas of Lake Michigan and Lake Huron // J. Freshw. Ecol. V. 24. P. 477–488. https://doi.org/10.1080/02705060.2009.9664321
Corkum L.D., Sapota M., Skóra K.E. 2004. The round goby, Neogobius melanostomus, a fish invader on both sides of the Atlantic Ocean // Biol. Invasions. V. 6. P. 173–181. https://doi.org/10.1023/B:BINV.0000022136.43502.db
Hensler S.R., Jude D.J. 2007. Diel vertical migration of round goby larvae in the Great Lakes // J. Great Lakes Res. V. 33. P. 295–302.
Jakubas D., Mioduszewska A. 2005. Diet composition and food consumption of the grey heron (Ardea cinerea) from breeding colonies in northern Poland // Eur. J. Wildl. Res. V. 51. P. 191–198. https://doi.org/10.1007/s10344-005-0096-x
Jurajda D., Černý J., Polačik M. et al. 2005. The recent distribution and abundance of non-native Neogobius fishes in the Slovak section of the river Danube // J. Appl. Ichthyol. V. 21. P. 319–323.
Karasiova E.M. 2016. Ichthyoplankton biodiversity in the deep water and coastal part of the South-Eastern Baltic. Consequences of environmental changes // Baltic and Black Sea: Ecological Perspectives, Biodiversity and Management. N.Y.: Nova Sci. Publ. P. 23–46.
Karasiova E.M., Gribov E.A., Andreeva V.M. 2002. Fish larvae assemblages in the coastal shallow zone of the south-eastern Baltic Sea: environmental factors driving environmental variability // ICES CM 2002/O:11. 10 p.
Karlson A.M.L., Almqvist G., Skóra K.E., Appelberg M. 2006. Diet overlap and preferences of non-indigenous round goby and native flounder in the Baltic Sea indicate competition, global challenges facing oceanography and limnology. ASLO Summer Meeting. Victoria, British Columbia, 62 p.
Knospina E., Putnis I. 2014. Round goby – Increasingly guest in the Latvian Coastal Area (Apaļais jūrasgrundulis – aizvien biežāks viesis Latvijas piekrastē) // Latvijas zivsaimniecība. Ozolnieki: LRATC. P. 46–51.
Kornis M.S., Mercado-Silva H., Vander Zanden M.J. 2012. Twenty years of invasion: a review of round goby Neogobius melanostomus biology, spread and ecological implications // J. Fish Biol. V. 80. № 2. P. 235–285. https://doi.org/10.1111/j.1095-8649.2011.03157.x
Kotta J., Nurkse K., Puntila R., Ojaveer H. 2016. Shipping and natural environmental conditions determine the distribution of the invasive non-indigenous round goby Neogobius melanostomus in a regional sea // Estuar. Coast. Shelf Sci. V. 169. P. 12–24.
Kruk-Dowgiałło L., Szaniawska A. 2008. Gulf of Gdansk and Puck Bay in the Polish coastal zone // Ecological Studies (Analysis and Synthesis). V. 197. Ecology of Baltic Coastal Waters. Berlin; Heidelberg: Springer. P. 139–165.
Leppäkoski E., Olenin S. 2000. Non-native species and rates of spread: lessons from the brackish Baltic Sea // Biol. Invasions. V. 2. № 2. P. 151–163. https://doi.org/10.1023/A:1010052809567
Lysiak-Pastuszak E., Dragas N., Piatkowska Z. 2004. Eutrophication on the Polish coastal zone: the past, present status and future scenarios // Mar. Pollut. Bull. V. 49. № 3. P. 186–195.
Ojaveer H. 2006. The round goby Neogobius melanostomus is colonizing the NE Baltic Sea // Aquat. Invasions. V. 1. № 1. P. 44–45.
Ojaveer H., Leppäkoski E., Olenin S., Riccardi A. 2002. Ecological impacts of Ponto-Caspian invaders in the Baltic Sea, European inland waters and the Great Lakes: an inter-ecosystem comparison // Invasive aquatic species of Europe: distribution, impacts and management. Dorthrecht: Kluwer Acad. Pub. P. 412–425.
Olenin S., Leppäkoski E. 1999. Non-native animals in the Baltic Sea: alteration of benthic habitats in coastal inlets and lagoons // Hydrobiologia. V. 393. P. 233–243.
Olenin S., Gollasch S., Lehtiniemi M. et al. 2017. Biological Invasions // Biological Oceanography of the Baltic Sea. Dordrecht: Springer. P. 193-228. https://doi.org/10.1007/978-94-007-0668-2_5
Rakauskas V., Pūtys Ž., Dainys J. et al. 2013. Increasing population of the invader round goby Neogobius melanostomus (Actinopterygii: Perciformes: Gobiidae) and its trophic role in the Curonian Lagoon, SE Baltic Sea // Acta Ichthyol. Piscat. V. 43. P. 95–108. https://doi.org/10.3750/AIP2013.43.2.02
Sapota M.R., Skóra K.T. 2005. Spreading of alien (non-indigenous) fish species Neogobius melanostomus in the Gulf of Gdansk (South Baltic) // Biol. Invasions. V. 7. P. 157–164.
Shpilev H., Ojaveer E. 2003. Round goby, Neogobius melanostomus (Pallas) // Fishes of Estonia. Tallinn: Est. Acad. Publ. P. 336–337.
Skóra K.T., Rzeznik J. 2001. Observations on diet composition of Neogobius melanostomus Pallas 1811 (Gobiidae, Pisces) in the Gulf of Gdansk (Baltic Sea) // J. Great Lakes Res. V. 27. № 3. P. 290–299.
Skóra K.T., Stolarski E.J. 1993. New fish species in the Gulf of Gdansk: Neogobius sp. (cf. Neogobius melanostomus) (Pallas 1811) // Bull. Sea Fish. Inst. V. 1. № 128. P. 83.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии