Вопросы ихтиологии, 2022, T. 62, № 3, стр. 282-293
Морфология и вентиляция органа обоняния у шестиполосой рыбы-сержанта Abudefduf sexfasciatus (Pomacentridae)
Н. И. Пащенко 1, *, Л. Т. К. Оань 2, А. О. Касумян 1
1 Московский государственный университет
Москва, Россия
2 Приморское отделение Российско-вьетнамского тропического научно-исследовательского
и технологического центра
Нячанг, Вьетнам
* E-mail: visitgrusha@gmail.com
Поступила в редакцию 28.06.2021
После доработки 20.09.2021
Принята к публикации 24.09.2021
- EDN: FERLAN
- DOI: 10.31857/S0042875222030158
Аннотация
Исследовано строение органа обоняния у шестиполосой рыбы-сержанта Abudefduf sexfasciatus. У небольших по размеру особей общей длиной <30–35 мм имеются две ноздри, у более крупных рыб сохраняется только задняя. Обонятельная розетка стреловидная, овальная по форме; общее число складок, лишённых вторичной складчатости, по мере роста рыб увеличивается, но не превышает 15 (при общей длине особей 145 мм). К обонятельной полости примыкают два вентиляционных мешка – крупный лакримальный, состоящий из двух неравных по размеру отсеков, и значительно уступающий ему по объёму этмоидальный. Предложена схема вентиляции обонятельной полости. Сравнение макроморфологии и вентиляции органа обоняния A. sexfasciatus и ранее исследованного A. vaigiensis вместе с очевидным сходством обнаруживает и различия, причины которых могут иметь отношение к строению скелета головы и особенностям питания этих рыб.
Исследования сенсорных систем и поведения тропических рыб, особенно населяющих коралловые рифы, в последние годы претерпевают быстрое развитие (Losey et al., 2003; Siebeck, 2004; Gerlach et al., 2007; Siebeck et al., 2008; Colleye, Parmentier, 2012; Berenshtein et al., 2014). Большое внимание привлекают рыбы, составляющие основу ихтиофауны этих сложных и многокомпонентных сообществ и имеющие в своём жизненном цикле океаническую фазу. Икра и личинки таких рыб выносятся в открытый океан, где молодь проводит от нескольких недель до нескольких месяцев, а затем мигрирует в прибрежные воды (Shanks, 2009). К таким рыбам принадлежат многочисленные помацентровые (Pomacentridae) – одни из массовых рыб коралловых рифов (Allen, 1991). Каким образом молодь определяет направление миграции к прибрежью и выбирает то место на рифе, где произойдёт её переход к оседлости, до сих пор остаётся малопонятным. Однако совершенно очевидно, что ориентация молоди и выбор территории не может происходить без участия дистантных сенсорных систем, прежде всего обоняния (Atema et al., 2002; Gerlach, Atema, 2012).
Выполненные в последние годы исследования показывают важную роль запахов в поведении помацентровых рыб. Выяснено, что для молоди, только что ставшей оседлой, более привлекателен запах воды своего, но не чужого для неё рифа или воды, взятой на удалении от берега (Dixson et al., 2008). Избирание проявляет дикая и искусственно выращенная молодь. Врождённость этой реакции, как полагают, помогает молоди не только ориентироваться в открытом океане, но и не удаляться далеко от родного рифа (Dixson et al., 2011). В лабораторных экспериментах показана способность молоди амфиприонов Amphiprion находить определённые виды актиний и поселяться на них (Elliot et al., 1995; Arvedlund et al., 1999), а также импринтировать различные природные запахи (Dixson et al., 2014). Полагают, что обоняние имеет важное значение для хоминга, который проявляют строго территориальные взрослые особи зебровидного дасцилла Dascyllus aruanus и леопольдиты Pomacentrus moluccensis (Booth, 2016). Помацентровые рыбы дифференцируют запахи коралловых колоний, находящихся в разном состоянии, и избегают запаха питающейся кораллами морской звезды терновый венец Acanthaster planci (Cappock et al., 2016). На примере помацентровых продемонстрировано наличие у рыб коралловых рифов феромона тревоги – химического сигнала опасности, регулирующего взаимоотношение между хищниками и их жертвами (Lönnstedt, McCormick, 2011; Manassa et al., 2013). Обнаружена способность помацентровых запоминать и распознавать запахи других рыб коралловых рифов (Mitchell et al., 2011, 2013; Sundin et al., 2017). Чувствительность помацентровых рыб к различным обонятельным стимулам подтверждается электрофизиологическими экспериментами (Wright et al., 2005).
Устройство органа обоняния у помацентровых рыб изучено слабо. Исследованные виды, число которых крайне невелико, имеют обонятельную розетку стреловидного типа с относительно небольшим числом складок без вторичной складчатости. Сенсорные участки на складках хаотично разделены зонами несенсорного эпителия, образованного мерцательными клетками (Yamamoto, Ueda, 1979). Как и у других рыб, обонятельная система у помацентровых начинает формироваться в раннем онтогенезе, и к моменту перехода молоди к оседлому образу жизни в органе обоняния присутствуют морфологические и цитологические структуры, присущие взрослым рыбам (Arvedlund et al., 2000, 2003). Отмечается, что темп развития органа обоняния у разных видов различается (Kavanagh, Alford, 2003).
Макроморфология органа обоняния наиболее детально изучена у индо-тихоокеанской рыбы-сержанта Abudefduf vaigiensis. Выяснено, что обонятельные складки у этих рыб имеют своеобразную форму, благодаря которой упорядочиваются потоки воды, вентилирующие обонятельную полость. В органе обоняния впервые для помацентровых рыб обнаружены дополнительные мешки – лакримальный и этмоидальный, участвующие в вентиляции обонятельной полости. Прослежено изменение основных морфологических структур органа обоняния у особей, размерный диапазон которых включает ювенильных и половозрелых рыб (Пащенко, Касумян, 2019).
Помацентровые, общее число которых достигает 423 вида, весьма разнообразны по биологии (Fricke et al., 2021; Froese, Pauly, 2021). Несмотря на известный консерватизм строения органа обоняния у рыб (Yamamoto, 1982; Kasumyan, 2004), биологическое разнообразие помацентровых рыб может проявляться и в морфологии этого органа, так же как это наблюдается у филогенетически близких губановых (Labridae) – другой титульной группы рыб коралловых рифов, столь же многочисленной и разнообразной, что и помацентровые (Lara, 2008; Пащенко и др., 2021). Так, взрослые особи большинства видов рода Chromis имеют переднюю и заднюю ноздри, тогда как у других видов, например у Chromis lepidolepis и A. vaigiensis, ноздря только одна (Randall et al., 1981; Murphy et al., 2007; Пащенко, Касумян, 2019).
Цель настоящей работы – сравнительное изучение макроморфологии органа обоняния у шестиполосой рыбы-сержанта A. sexfasciatus, которая, как и исследованный нами ранее A. vaigiensis, является типичным представителем ихтиофауны коралловых рифов Южного Вьетнама (Южно-Китайское море). В задачи работы входило получение данных о строении, размерах и расположении основных структур органа обоняния у A. sexfasciatus разной длины тела.
МАТЕРИАЛ И МЕТОДИКА
Особи A. sexfasciatus были отловлены сетными орудиями на коралловых рифах зал. Нячанг (Южно-Китайское море) и доставлены в Приморское отделение Российско-вьетнамского тропического научно-исследовательского и технологического центра (г. Нячанг, СРВ). После измерения общей длины тела (TL) рыб фиксировали в 10%-ном формалине, затем переводили в 70%-ный этанол. Препарирование и исследование морфологии органа обоняния выполняли под бинокулярным микроскопом МБС-1. Для измерений использовали окулярный микрометр, для получения фотографий – цифровую фотокамеру Levenhuk M500 Base (“Levenhuk, Inc.”, КНР). Наблюдения за потоками воды в органе обоняния проводили при механической имитации движения челюстей на фиксированных препаратах с использованием взвеси чёрной китайской туши. Всего морфологическому исследованию подвергнута 51 ювенильная и половозрелая особь TL 29–145 мм.
РЕЗУЛЬТАТЫ
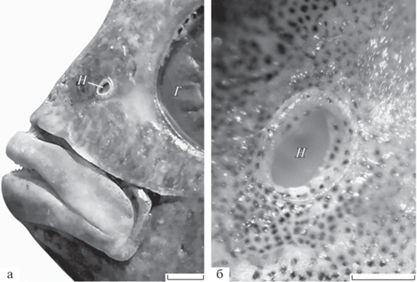
Морфология органа обоняния. У рыб TL > 35 мм ноздря одна, занимает ростромедиальное положение относительно глаза, овальная по форме и небольшая по размерам – длина чуть более 1 мм у наиболее крупных особей TL 145 мм (таблица). Выступающие над окружающей поверхностью тонкие края ноздри образуют короткую трубку (рис. 1).
Рис. 1.
Расположение и форма ноздри у шестиполосой рыбы-сержанта Abudefduf sexfasciatus TL 120 мм: а – голова рыбы, вид с латеральной стороны; ноздря (Н) и глаз (Г). Масштаб: а – 2, б – 1 мм.
Некоторые морфологические показатели особей шестиполосой рыбы-сержанта Abudefduf sexfasciatus разного размера
| Длина (TL), мм | Nof, шт. | с | o | Loo | Lon | Won | Lor | Lor, в % Loo | Число рыб, экз. |
|---|---|---|---|---|---|---|---|---|---|
| мм | |||||||||
| 29 | 3 | 6.8 | 2.9 | 0.6 | 0.20 | 0.20 | 0.50 | 83.33 | 1 |
| 31–40 | 5–7 | 9.4 | 3.9 | 0.8 | 0.38 | 0.28 | 0.73 | 89.15 | 4 |
| 41–50 | 8 | 13.0 | 4.7 | 1.1 | 0.50 | 0.30 | 0.90 | 81.82 | 1 |
| 80–85 | 9–14 | 19.4 | 6.1 | 1.5 | 0.69 | 0.56 | 1.40 | 91.13 | 9 |
| 90–95 | 11–15 | 20.4 | 6.9 | 1.7 | 0.79 | 0.53 | 1.50 | 88.33 | 11 |
| 96–100 | 12–14 | 20.9 | 6.9 | 1.7 | 0.90 | 0.63 | 1.55 | 92.67 | 4 |
| 101–105 | 11–15 | 22.8 | 6.8 | 1.8 | 0.77 | 0.60 | 1.67 | 92.73 | 3 |
| 110–115 | 12–14 | 23.3 | 7.2 | 1.9 | 0.88 | 0.64 | 1.70 | 90.37 | 8 |
| 120–125 | 13–14 | 26.0 | 7.9 | 2.1 | 1.10 | 0.68 | 1.90 | 89.77 | 5 |
| 130–135 | 11–15 | 29.0 | 8.1 | 2.4 | 1.15 | 0.85 | 2.00 | 84.66 | 2 |
| 140–145 | 14–15 | 31.3 | 8.9 | 2.1 | 1.13 | 0.87 | 1.93 | 90.58 | 3 |
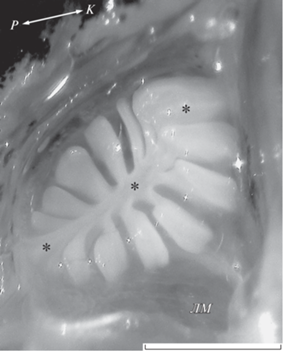
Под ноздрёй на медиальной стороне округлой обонятельной полости лежит обонятельная розетка стреловидного типа (рис. 2). Боковые складки не имеют вторичной складчатости, они отходят от центральной складки (септы), расположенной рострокаудально. Число боковых складок у одной и той же особи по разные стороны септы и общее число складок в левом и правом органе обоняния могут различаться на одну−две. Такие несовпадения встречаются у 5–7% особей. Септа утолщена в средней части и соединена со стенкой обонятельной полости в ростральной части. У одной из рыб соединение отсутствовало, ростральный конец септы был приподнят и похож по форме на боковые складки. Длина розетки слегка превосходит её ширину (таблица), форма розетки овальная, у некоторых особей круглая. Розетка занимает почти весь объём обонятельной полости.
Рис. 2.
Обонятельная розетка у шестиполосой рыбы-сержанта Abudefduf sexfasciatus TL 110 мм; ЛМ – лакримальный вентиляционный мешок, вход; (↔) – рострокаудальное направление (РК), (*) – центральная складка (септа). Масштаб: 1 мм.
Наиболее ростральные складки в розетке самые мелкие и почти прямоугольные. Чем каудальнее расположены складки, тем они крупнее и тем сильнее развита и изогнута к септе их дистальная часть. Толщина складок ~75–80 мкм, но у одной из рыб толщина дистального края сладок в каудальной части розетки была в несколько раз больше (~240–300 мкм).
Вентиляционные мешки и вентиляция обонятельной полости. От обонятельной полости отходят два вентиляционных мешка – лакримальный и этмоидальный, располагающиеся между костями черепа и выстланные плотной соединительной тканью. Крупное отверстие, ведущее в лакримальный мешок, расположено вентральнее обонятельной розетки, по размерам оно соизмеримо с размерами розетки и больше ноздри в 1.2–1.5 раза (рис. 3). Лакримальный мешок имеет два отсека, один из которых вытянут в ростромедиальном направлении и по длине и объёму примерно равен обонятельной полости. Второй отсек уходит далеко в вентральном направлении, по длине и объёму он примерно в три раза больше, чем ростромедиальный отсек. Отверстие, ведущее в этмоидальный мешок, расположено дорсальнее обонятельной розетки, размер его составляет около половины длины розетки. Мешок тянется в медиальном направлении, его объём близок к объёму обонятельной полости. Крупные входные отверстия обоих мешков располагаются близко к обонятельной розетке с дорсальной и вентральной сторон из-за чего розетка выглядит изогнутой – боковые складки располагаются ниже септы с небольшим уклоном в сторону отверстий вентиляционных мешков.
Рис. 3.
Расположение и соотношение размеров обонятельной розетки и вентиляционных мешков у шестиполосой рыбы-сержанта Abudefduf sexfasciatus разной длины тела (TL): а – 80, б – 100 мм. ЭМ – этмоидальный вентиляционный мешок, ЛМ-1 и ЛМ-2 – вентральная и ростральная части лакримального мешка; (→) – ростральная часть центральной складки (септы); ост. обозначения см. на рис. 1. Масштаб: 1 мм.

При раскрывании рта у фиксированных препаратов головы рыб вода через ноздрю входит внутрь обонятельной полости, при смыкании челюстей рыбы вода из обонятельной полости выходит наружу.
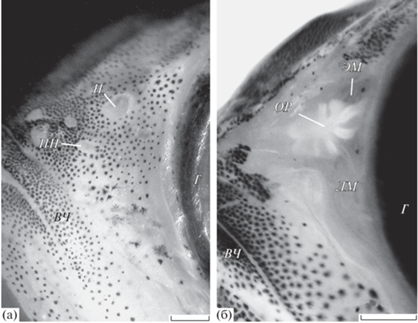
Онтогенетические изменения. У наиболее мелких из исследованных особей (TL 34 мм) имеются две ноздри – большая задняя и небольшая передняя (рис. 4) либо только задняя (TL 29 мм), но место, где находилась передняя ноздря, всё ещё хорошо различимо из-за отсутствия здесь пигментных клеток. У более крупных рыб имеется только одна ноздря, её размеры увеличиваются с ростом рыб (таблица), форма ноздри постепенно изменяется от круглой к овальной и слегка расширенной в каудальной части, более заметными становятся выступающие края отверстия.
Рис. 4.
Орган обоняния у молоди шестиполосой рыбы-сержанта Abudefduf sexfasciatus: а – особь TL 34 мм, два обонятельных отверстия; б – особь TL 39 мм, вскрытый орган обоняния с обонятельной розеткой. ПН – передняя ноздря, ОР – обонятельная розетка, ВЧ – верхняя челюсть; ост. обозначения см. на рис. 1–3. Масштаб: 0.5 мм.
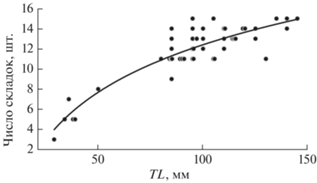
Чем крупнее рыбы, тем больше складок в обонятельной розетке (рис. 5). У самой мелкой из исследованных особей всего три веерообразно расположенных складки, у наиболее крупных рыб число складок достигает 15, включая центральную складку (септу), а розетка становится стреловидной. Новые складки закладываются, как правило, парами, симметрично относительно септы в ростральной части розетки, т.е. перед уже имеющимися в ней складками. В результате участок перед розеткой, свободный от складок у наиболее мелких особей, становится полностью заполненный складками у рыб TL 41–45 мм. Розетка, первоначально расположенная вентромедиально, постепенно занимает типичное для неё медиальное положение.
Рис. 5.
Зависимость числа складок в обонятельной розетке от длины (TL) особи у шестиполосой рыбы-сержанта Abudefduf sexfasciatus.
Лакримальный мешок становится различимым у рыб TL 29 мм, этмоидальный – у рыб TL > 35 мм (рис. 4б). Оба мешка приобретают дефинитивную форму у рыб TL 55–65 мм.
ОБСУЖДЕНИЕ
Орган обоняния у двух близкородственных помацентровых рыб – A. sexfasciatus и A. vaigiensis – устроен сходным образом. У половозрелых особей, как у многих представителей Pomacentridae, обонятельная полость открывается наружу одним, но довольно крупным отверстием – ноздрёй. У некоторых из помацентровых рыб (Chromis, Dascyllus) сохраняются две ноздри, одна из которых, выходная, у ряда видов небольшая по размерам относительно размеров входной ноздри и поэтому трудноразличима (Randall et al., 1981; Nelson et al., 2016). У A. sexfasciatus ноздря слегка вытянута в длину и слабо расширена в каудальной части, у A. vaigiensis – в ростральной. Обонятельная розетка у обоих видов стреловидного типа (тип G – по: Yamamoto, 1982), располагается одинаковым образом – на медиальной стороне обонятельной полости, напротив ноздри. Розетка овальная, вытянутая в рострокаудальном направлении, в ней сходное число обонятельных складок, симметрично прикреплённых к септе, закономерно увеличивающихся в размерах и меняющихся по форме к каудальному краю розетки. На складках отсутствует вторичная складчатость. У обоих видов имеются два вентиляционных мешка, причём лакримальный мешок значительно крупнее этмоидального. Сходство общего плана строения органа обоняния у двух близкородственных видов рыб подтверждает существующие данные о структурном консерватизме обонятельной системы рыб (Yamamoto, 1982; Zeiske et al., 1992; Пащенко, Касумян, 2017; Kasumyan, 2018).
A. sexfasciatus и A. vaigiensis не только близки филогенетически, но и похожи по биологии (Frédérich et al., 2013, 2016). Эти виды, как и многие другие помацентровые, относятся к стайным рыбам (Frédérich et al., 2016). Их особи держатся в пелагиали вблизи колоний кораллов, причём A. vaigiensis перемещается по всей толще воды, и поэтому его относят к бентопелагическим рыбам, тогда как A. sexfasciatus включают в группу типичных пелагических представителей рода Abudefduf (Aguilar-Medrano, Barber, 2016).
Несмотря на общее сходство органа обоняния, у сравниваемых видов имеются и очевидные различия в его строении. У A. vaigiensis обонятельная розетка занимает лишь часть обонятельной полости, значительный её объём остаётся свободным. У A. sexfasciatus розетка заполняет почти всю обонятельную полость. Абсолютные размеры обонятельной розетки – длина и ширина – мало различаются у рыб обоих видов, сходных по длине тела (рис. 6). Мало различается и длина обонятельных складок, хотя их измерений мы не проводили. Более тесное расположение обонятельной розетки у A. sexfasciatus достигается главным образом за счёт относительно меньшего размера обонятельной полости по сравнению с A. vaigiensis. Такая особенность рассматривается в качестве адаптации, повышающей сенсорные возможности органа (Zeiske, 1973, 1974). Она характерна для многих рыб с хорошо развитым обонянием – карповых (Cyprinidae), сомовых (Siluridae), угрёвых (Anguillidae), ящероголовых (Synodontidae) и других (Kapoor, Ojha, 1972; Theisen, 1982; Bianchi et al., 1978; Goel, 1978; Пащенко, Касумян, 1983, 2015, 2017; Девицина, Эль-Аттар Эль-Саиед, 1987; Zeiske et al., 1994; Fishelson, 1995; Fishelson et al., 2010; Hansen, Zeiske, 1998; Ghosh, Chakrabarti, 2010, 2013, 2014; Ghosh, 2018).
Рис. 6.
Сравнительная схема строения органа обоняния шестиполосой рыбы-сержанта Abudefduf sexfasciatus (а, в, д, е) и индо-тихоокеанской рыбы-сержанта A. vaigiensis (б, г, ж, з): а, б – обонятельная розетка, общий вид, фото; в, г – обонятельная розетка, вид сбоку; д, ж – обонятельная полость и вентиляционные мешки, вид сверху; е, з – то же, вид сбоку. Обозначения см. на рис. 2, 3. Масштаб: а, б – 0.5 мм.
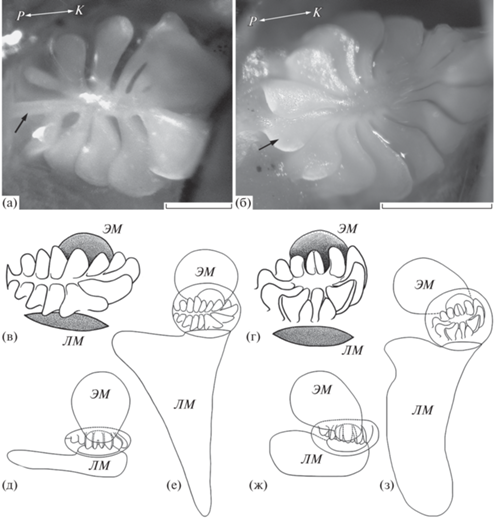
Однако разное соотношение между размерами обонятельной полости и розетки вызвано скорее всего особенностями вентиляции органа обоняния. Несмотря на то что оба вида относятся к циклосматам, т.е. к рыбам, обладающим вентиляционными мешками, процесс водообмена в органе обоняния у них различается в том числе из-за разной роли в этом процессе обонятельных складок. У A. vaigiensis форма обонятельных складок крайне своеобразная, не встречающаяся у других рыб. Дистальная часть наиболее крупных складок устроена так, что под действием воды, входящей в орган, складки раздвигаются, а при выходе её наружу складываются к центру розетки, подобно зонтику. Это упорядочивает потоки и благоприятствует водообмену в обонятельной полости, но требует дополнительного пространства (Пащенко, Касумян, 2019). У A. sexfasciatus обонятельные складки плоские.
Прямое отношение к водообмену в обонятельной полости имеют вентиляционные мешки. Согласно наблюдениям, проведённым на молоди Apogon spp. (Apogonidae), также обладающей вентиляционными мешками, вода попадает в орган обоняния и выбрасывается наружу синхронно с ритмичными дыхательными движениями челюстей и жаберных крышек (Atema et al., 2002). Входные отверстия мешков у сравниваемых видов Abudefduf располагаются одинаково, совпадает также размерное соотношение самих мешков – лакримальный значительно крупнее не только этмоидального, но и обонятельной полости (рис. 6д–6з). Однако форма мешков и их пространственное расположение различается, особенного лакримального, который у A. sexfasciatus меньше по объёму, чем у A. vaigiensis, и состоит из двух хорошо выраженных и по-разному ориентированных отсеков. Вентиляционные мешки располагаются между костями головы, поэтому размеры, форма и пространственное положение мешков зависят от анатомии и морфологии головы и челюстных костей. У помацентровых эти признаки, в свою очередь, тесно связаны с питанием и образом жизни (Cooper, Westneat, 2009; Frédérich et al., 2013, 2016). Несмотря на то что в пище у обоих видов обычно преобладает зоопланктон, в питании A. vaigiensis в некоторых случаях доминируют бентосные объекты (водоросли, икра демерсальных рыб и др.) (Kuo, Shao, 1991; Frédérich et al., 2009, 2016; Wyatt et al., 2012). Некоторые из авторов относят A. vaigiensis к бентосным рыбам, тогда как A. sexfasciatus рассматривают в качестве типичной пелагической рыбы (Pratchett et al., 2016). Различия в питании A. sexfasciatus и A. vaigiensis приводят к анатомическим и морфологическим изменениям костных структур челюстей и черепа (Aguilar-Medrano, Barber, 2016), что в свою очередь может обусловить наблюдаемые различия в размерах и в расположении вентиляционных мешков у этих рыб.
К процессу вентиляции имеет отношение и форма септы (центральная складка), которая у A. sexfasciatus лишена значительного расширения в средней части. У A. vaigiensis такое расширение имеется, оно принимает входящий в орган обоняния поток воды и направляет его между складками розетки к лопастям и далее в вентиляционные мешки (Пащенко, Касумян, 2019). Форма обонятельных складок и септы влияет на направление микропотоков воды в органе обоняния (рис. 7). По-видимому, с вентиляцией связано и то, что ростральный конец септы у A. sexfasciatus соединяется со стенкой обонятельной полости, как, например, у карповых (Пащенко, Касумян, 2017). У A. vaigiensis ростральный конец септы свободный, как и у боковых складок. Интересно, что у A. vaigiensis среди исследованных особей был встречен экземпляр, у которого септа в ростральной части соединялась со стенкой обонятельной полости (Пащенко, Касумян, 2019) так же, как и у всех изученных нами A. sexfasciatus. Вероятно, что исследованный экземпляр – гибрид между A. vaigiensis и A. sexfasciatus. Гибридизация между этими и другими симпатрическими и биотопически сходными помацентровыми рыбами возможна (Maruska, Peyton, 2007; Hobbs, Allen, 2014; Bertrand et al., 2017). Описания морфологии органа обоняния у гибридных особей рыб в литературе мы не нашли.
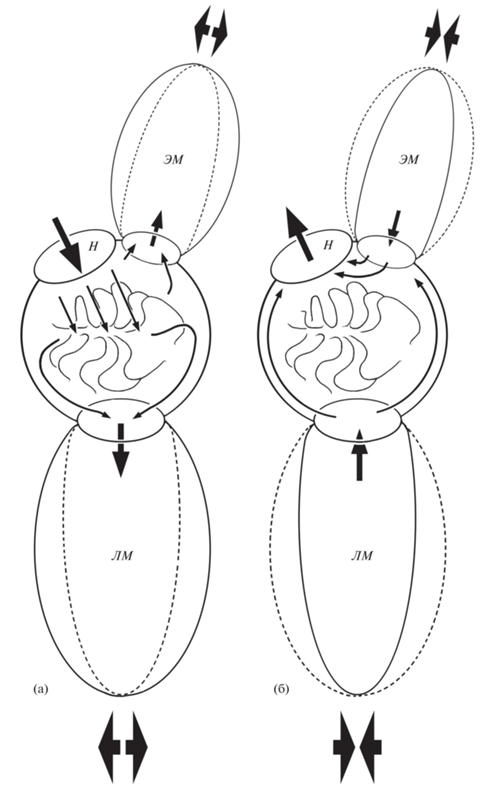
Рис. 7.
Схема вентиляции обонятельной полости шестиполосой рыбы-сержанта Abudefduf sexfasciatus при поступлении воды в обонятельную полость на вдохе (а) и выходе из неё наружу на
выдохе (б); ( ) – потоки воды в обонятельную полость, в вентиляционные мешки и выход из них; (→)
– направление движения воды в обонятельной полости; (---), (
) – потоки воды в обонятельную полость, в вентиляционные мешки и выход из них; (→)
– направление движения воды в обонятельной полости; (---), ( ) – расширение и сжатие полости вентиляционных носовых мешков; ост. обозначения см.
на рис. 1–3.
) – расширение и сжатие полости вентиляционных носовых мешков; ост. обозначения см.
на рис. 1–3.
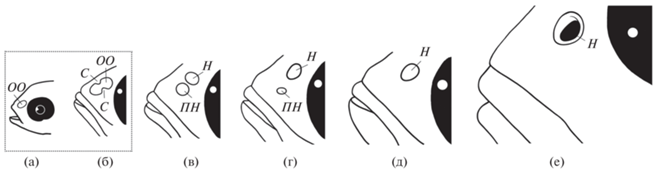
У рыб структуры органа обоняния претерпевают существенные морфологические изменения в онтогенезе (Пащенко, Касумян, 2015; Døving, Kasumyan, 2008). У ранней молоди помацентровых, как у многих рыб, формируется вначале единое обонятельное отверстие, которое затем разделяется на переднюю и заднюю ноздри (Kavanagh, Alford, 2003; Lara, 2008; Roux et al. 2019). У некоторых видов одна из сформировавшихся ноздрей вскоре зарастает: у Pomacentrus amboinensis – передняя (Murphy et al., 2007). Такая же последовательность, по-видимому, характерна и для A. sexfasciatus, поскольку среди самых мелких исследованных особей были такие, у которых передняя ноздря ещё присутствовала либо хорошо выделялось место, где она располагалась ранее (рис. 4а). Процесс приобретения органом обоняния внешне дефинитивного состояния завершается у A. sexfasciatus при TL 30–35 мм. Полученные результаты позволяют предложить схему, отражающую происходящий в онтогенезе A. sexfasciatus переход исходно монотремного органа обоняния к дитремному и затем вновь к монотремному (рис. 8). Первые этапы этого процесса (рис. 8а, 8б) на настоящий момент остаются гипотетическими.
Рис. 8.
Схема формирования ноздрей в онтогенезе рыб-сержантов Abudefduf sp.: a – отверстие обонятельной капсулы, б – образование суперфициальных выростов, в – дитремные ноздри личинки, г – дитремные ноздри малька TL < 29 мм, д – монотремная ноздря малька TL > 35 мм, е – дефинитивная монотремная ноздря. ОО – обонятельное отверстие, С – суперфициальный вырост; (····) – гипотетическое состояние органа обоняния; ост. обозначения см. на рис. 1, 4.
Одно обонятельное отверстие имеют многие помацентровые рыбы (Nelson et al., 2016). Пока неизвестно, у каких видов рыб орган обоняния становится монотремным в результате элиминации передней ноздри и есть ли виды, у которых это происходит при потере задней ноздри, а также при каких размерах и в каком возрасте этот процесс завершается. Известно, что темп формирования органа обоняния у разных помацентровых различается в онтогенезе (Kavanagh, Alford, 2003; Kavanagh, Frédérich, 2016). Процесс образования вентиляционных носовых мешков в онтогенезе Pomacentridae не изучен. По нашим данным, зачатки крупного лакримального мешка заметны уже у самых мелких особей (TL 29 мм), тогда как этмоидального видны позднее (TL > 35 мм), т.е. после того, как орган обоняния становится монотремным. Вентиляционные мешки приобретают дефинитивную форму у рыб, достигших TL 55–65 мм.
ЗАКЛЮЧЕНИЕ
Несмотря на консерватизм макроморфологии органа обоняния у близкородственных видов рыб многих крупных систематических групп, таких как Pomacentridae и Labridae (Пащенко и др., 2021), вместе с очевидным сходством в строении органа наблюдаются и существенные различия. У сравниваемых видов рода Abudefduf большинство выявленных различий имеют отношение к вентиляции обонятельной полости, благодаря которой молекулы сигнальных веществ, находящиеся в окружающем пространстве, попадают в орган обоняния, взаимодействуют с обонятельными рецепторами и инициируют каскад преобразований, завершающихся проявлением рыбами соответствующего поведения.
Структурные различия органа обоняния у близкородственных рыб могут быть, скорее всего, следствием особенностей их питания и вызванных этим различиями в анатомии и морфологии костных элементов, окружающих орган обоняния. Выяснение того, насколько выражена связь между расхождением рыб по пищевой специализации и выраженностью структурных различий их органа обоняния, проявляется ли эта связь у рыб, не имеющих вентиляционных мешков, требует дальнейших исследований. Рыбы коралловых рифов, такие как Pomacentridae, Labridae и другие, благодаря большому биологическому разнообразию, в том числе по трофической специализации (Frédérich et al., 2016; Eurich et al., 2019; Gajdzik et al., 2019), являются наиболее подходящими объектами для таких работ.
Список литературы
Девицина Г.В., Эль-Аттар Эль-Саиед А.Б. 1987. Морфометрическое исследование обонятельного и зрительного анализаторов у трех видов карповых рыб // Вестн. МГУ. Сер. 16. Биология. С. 9–16.
Пащенко Н.И., Касумян А.О. 1983. Некоторые морфофункциональные особенности развития органа обоняния в онтогенезе гольяна // Зоол. журн. Т. 62. Вып. 3. С. 367–377.
Пащенко Н.И., Касумян А.О. 1986. Морфофункциональные особенности развития органа обоняния карповых рыб (Cypriniformes, Cyprinidae). I. Развитие морфологии и функции органа обоняния в онтогенезе белого амура Ctenopharyngodon idella (Val.) // Вопр. ихтиологии. Т. 26. № 2. С. 303–317.
Пащенко Н.И., Касумян А.О. 2015. Исследование формирования органа обоняния в онтогенезе белого амура Ctenopharyngodon idella с помощью сканирующей электронной микроскопии // Там же. Том 55. № 6. С. 692–712. https://doi.org/10.7868/S004287521506017X
Пащенко Н.И., Касумян А.О. 2017. Развитие органа обоняния в онтогенезе карповых рыб (Cyprinidae, Teleostei) // Там же. Т. 57. № 1. С. 96–111. https://doi.org/10.7868/S0042875217010106
Пащенко Н.И., Касумян А.О. 2019. Морфология и вентиляция органа обоняния у индо-тихоокеанской рыбы-сержанта Abudefduf vaigiensis (Pomacentridae) // Там же. Т. 59. № 2. С. 154–161. https://doi.org/10.1134/S0042875219010132
Пащенко Н.И., Касумян А.О., Оань Л.Т.К. 2021. Необычное строение органа обоняния у лунной Thalassoma lunare и шестиполосой T. hardwicke талассом (Labridae) // Там же. Т. 61. № 3. С. 273–286. https://doi.org/10.31857/S0042875221030103
Aguilar-Medrano R., Barber P.H. 2016. Ecomorphological diversification in reef fish of the genus Abudefduf (Perciformes, Pomacentridae) // Zoomorphology. V. 135. № 1. P. 103–114. https://doi.org/10.1007/s00435-015-0291-6
Allen G.R. 1991. Damselfishes of the world. Melle: Mergus, 271 p.
Arvedlund M., McCormick M.I., Fautin D.G., Bildsøe M. 1999. Host recognition and possible imprinting in the anemonefish Amphiprion melanopus (Pisces: Pomacentridae) // Mar. Ecol. Prog. Ser. V. 188. P. 207–218. https://doi.org/10.3354/meps188207
Arvedlund M., Larsen K., Winsor H. 2000. The embryonic development of the olfactory system in Amphiprion melanopus (Perciformes: Pomacentridae) related to the host imprinting hypothesis // J. Mar. Biol. Assoc. UK. V. 80. № 6. P. 1103–1109. https://doi.org/10.1017/S0025315400003179
Arvedlund M., Brolund T.M., Nielsen L.E. 2003. Morphology and cytology of the olfactory organs in small juvenile Dascyllus aruanus and Amphiprion ocellaris (Pisces: Pomacentridae) // Ibid. V. 83. № 6. P. 1321–1326. https://doi.org/10.1017/S0025315403008762
Atema J., Kingsford M.J., Gerlach G. 2002. Larval reef fish could use odour for detection, retention and orientation to reefs // Mar. Ecol. Prog. Ser. V. 241. P. 151–160. https://doi.org/10.3354/meps241151
Berenshtein I., Kiflawi M., Shashar N. et al. 2014. Polarized light sensitivity and orientation in coral reef fish post-larvae // PLoS ONE. V. 9. № 2. Article e88468. https://doi.org/10.1371/journal.pone.0088468
Booth D.J. 2016. Ability to home in small site-attached coral reef fishes // J. Fish Biol. V. 89. № 2. P. 1501–1506. https://doi.org/10.1111/jfb.13043
Bertrand J.A.M., Borsa P., Chen W.-J. 2017. Phylogeography of the sergeants Abudefduf sexfasciatus and A. vaigiensis reveals complex introgression patterns between two widespread and sympatric Indo-West Pacific reef fishes // Mol. Ecol. V. 26. № 9. P. 2527–2542. https://doi.org/10.1111/mec.14044
Bianchi S., Delfino G., Ercolini A. 1978. Morphology and fine structure of the olfactory organ in Uegitglanis zammaranoi Gianferrari (Claridae Siluriformes), anophthalmic phreatic fish from Somalia // Monit. Zool. Ital. V. 10. № 1. P. 157–171. https://doi.org/10.1080/03749444.1978.10736866
Cappock A.G., Gardiner N.M., Jones G.P. 2016. Olfactory responses of coral-reef fishes to coral degradation and crown-of-thorns (Acanthaster planci) // Mar. Freshw. Res. V. 67. № 5. P. 605–611. https://doi.org/10.1071/MF14424
Colleye O., Parmentier E. 2012. Overview on the diversity of sounds produced by clownfishes (Pomacentridae): importance of acoustic signals in their peculiar way of life // PLoS ONE. V. 7. № 11. Article e49179. https://doi.org/10.1371/journal.pone.0049179
Cooper W.J., Westneat M.W. 2009. Form and function of damselfish skulls: rapid and repeated evolution into a limited number of trophic niches // BMC Evol. Biol. № 9. Article 24. https://doi.org/10.1186/1471-2148-9-24
Dixson D.L., Jones G.P., Munday P.L. et al. 2008. Coral reef fish smell leaves to find island homes // Proc. R. Soc. B: Biol. Sci. V. 275. № 1653. P. 2831−2839. https://doi.org/10.1098/rspb.2008.0876
Dixson D.L., Munday P.L., Pratchett M.S., Jones G.P. 2011. Ontogenetic changes in responses to settlement cues by Anemonefish // Coral Reefs. V. 30. № 4. P. 903–910. https://doi.org/10.1007/s00338-011-0776-9
Dixson D.L., Jones G.P., Munday P.L. et al. 2014. Experimental evaluation of imprinting and the role innate preference plays in habitat selection in a coral reef fish // Oecologia. V. 174. № 1. P. 99–107. https://doi.org/10.1007/s00442-013-2755-z
Døving K.B., Kasumyan A.O. 2008. Chemoreception // Fish Larval Physiology / Eds. Finn R.N., Kapoor B.G. Enfield: Sci. Publ. P. 331–394. https://doi.org/10.1201/9780429061608-15
Elliot J., Elliot J.M., Mariscal R.N. 1995. Host selection, location, and association behaviors of anemonefishes in field settlement experiments // Mar. Biol. V. 122. № 3. P. 377–389. https://doi.org/10.1007/BF00350870
Eurich J.G., Matley J.K., Baker R. et al. 2019. Stable isotope analysis reveals trophic diversity and partitioning in territorial damselfishes on a low‑latitude coral reef // Ibid. V. 166. № 17. https://doi.org/10.1007/s00227-018-3463-3
Fishelson L. 1995. Comparative morphology and cytology of the olfactory organs in moray eels with remarks on their foraging behavior // Anat. Rec. V. 243. № 4. P. 403–412. https://doi.org/10.1002/ar.1092430402
Fishelson L., Golani D., Galil B., Goren M. 2010. Comparison of the nasal olfactory organs of various species of lizardfishes (Teleostei, Aulopiformes, Synodontidae), with additional remarks on the brain // Int. J. Zool. V. 2010. Article 807913. https://doi.org/10.1155/2010/807913
Frédérich B., Fabri G., Lepoint G. et al. 2009. Trophic niches of thirteen damselfishes (Pomacentridae) at the Grand Récif of Toliara, Madagascar // Ichthyol. Res. V. 56. № 1. P. 10–17. https://doi.org/10.1007/s10228-008-0053-2
Frédérich B., Sorenson L., Santini F. et al. 2013. Iterative ecological radiation and convergence during the evolutionary history of damselfishes (Pomacentridae) // Am. Nat. V. 181. № 1. P. 94–113. https://doi.org/10.1086/668599
Frédérich B., Olivier D., Gajdzik L., Parmentier E. 2016. Trophic ecology of damselfishes // Biology of damselfishes / Eds. Frédérich B., Parmentier E. Boca Raton: CRC Press. P. 152–167. Available: http://hdl.handle.net/2268/190309
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2021. Eschmeyer’s catalog of fishes: genera, species, references (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp. Version 08/2021).
Froese R., Pauly D. (eds.). 2021. FishBase. World Wide Web electronic publication. (www.fishbase.org. Version 08/2021).
Gajdzik L., Aguilar-Medrano R., Frédérich B. 2019. Diversification and functional evolution of reef fish feeding guilds // Ecol. Lett. V. 22. № 4. P. 572–582. https://doi.org/10.1111/ele.13219
Gerlach G., Atema J. 2012. The use of chemical cues in habitat recognition and settlement // Chemical ecology in aquatic systems / Eds. Brönmark C., Hansson L.-A. Oxford: Oxford Univ. Press. P. 72–81. https://doi.org/10.1093/acprof:osobl/9780199583096.003.0006
Gerlach G., Atema J., Kingsford M.J. et al. 2007. Smelling home can prevent dispersal of reef fish larvae // Proc. Natl. Acad. Sci. USA. V. 104. № 3. P. 858–863. https://doi.org/10.1073/pnas.0606777104
Ghosh S.K. 2018. Cellular organization of the olfactory epithelium during growth, maturation, spawning and post-spawning phases of freshwater catfish, Eutropiichthys vacha (Hamilton, 1822) (Teleostei: Siluriformes) // Iran. J. Ichthyol. V. 5. № 2. P. 126–138. https://doi.org/10.22034/iji.v5i2.278
Ghosh S.K., Chakrabarti P. 2010. Histological and scanning electron microscopic organization and functional aspects of the surface olfactory epithelium of the freshwater minor carp, Puntius sophore (Hamilton) // Proc. Zool. Soc. V. 63. № 2. P. 115–119. https://doi.org/10.1007/s12595-010-0016-2
Ghosh S.K., Chakrabarti P. 2013. Studies on the morphology of the olfactory organ in the freshwater teleost, Labeo bata (Hamilton) // Mesopot. J. Mar. Sci. V. 28. № 2. P. 163–174.
Ghosh S.K., Chakrabarti P. 2014. Structural characterization of the olfactory epithelium of freshwater olive barb, Puntius sarana (Hamilton, 1822) // Int. J. Aquat. Biol. V. 2. № 3. P. 147–154. https://doi.org/10.22034/ijab.v2i3.78
Goel H.R. 1978. Functional anatomy of the olfactory organ in the fresh water teleost, Heteropneustes fossilis (BL.) // Okajimas Folia Anat. Jpn. V. 55. № 5. P. 289–300.
Hansen A., Zeiske E. 1998. The peripheral olfactory organ of the zebrafish, Danio rerio: an ultrastructural study // Chem. Senses. V. 23. № 1. P. 39–48. https://doi.org/10.1093/chemse/23.1.39
Hobbs J.-P.A., Allen G.R. 2014. Hybridisation among coral reef fishes at Christmas island and the Cocos (Keeling) islands // Raffles Bull. Zool. V. 30. P. 220–226. (http://hdl.handle.net/20.500.11937/26586)
Kapoor A.S., Ojha P.P. 1972. Functional anatomy of the olfactory organs in the moray, Muraena undulata // Jpn. J. Ichthyol. V. 19. № 2. P. 82–88. https://doi.org/10.11369/jji1950.19.82
Kasumyan A.O. 2004. The olfactory system in fish: structure, function, and role in behavior // J. Ichthyol. V. 44. Suppl. 2. P. S180–S223.
Kasumyan A. 2018. Olfaction and gustation in Acipenseridae, with special references to the Siberian sturgeon, Acipenser baerii // The Siberian sturgeon (Acipenser baerii, Brandt, 1869). V. 1. Biology / Eds. Williot P. et al. Cham: Springer. P. 173–205. https://doi.org/10.1007/978-3-319-61664-3_10
Kavanagh K.D., Alford R.A. 2003. Sensory and skeletal development and growth in relation to the duration of the embryonic and larval stages in damselfishes (Pomacentridae) // Biol. J. Linn. Soc. V. 80. № 2. P. 187–206. https://doi.org/10.1046/j.1095-8312.2003.00229.x
Kavanagh K.D., Frédérich B. 2016. Ontogeny and early life stages of damselfishes // Biology of damselfishes / Eds. Frédérich B., Parmentier E. Boca Raton: CRC Press. P. 168–182. (http://hdl.handle.net/2268/190305)
Kuo S.-R., Shao K.-T. 1991. Feeding habits of damselfishes (Pomacentridae) from the southern part of Taiwan // J. Fish. Soc. Taiwan. V. 18. P. 165–176. https://doi.org/10.29822/JFST.199109.0001
Lara M.R. 2008. Development of the nasal olfactory organs in the larvae, settlement-stages and some adults of 14 species of Caribbean reef fishes (Labridae, Scaridae, Pomacentridae) // Mar. Biol. V. 154. № 1. P. 51−64. https://doi.org/10.1007/s00227-007-0899-2
Lönnstedt O.M., McCormick M.I. 2011. Chemical alarm cues inform prey of predation threat: the importance of ontogeny and concentration in a coral reef fish // Anim. Behav. V. 82. № 2. P. 213–218. https://doi.org/10.1016/j.anbehav.2011.04.015
Losey G.S., McFarland W.N., Loew E.R. et al. 2003. Visual biology of Hawaiian coral reef fishes. I. Ocular transmission and visual pigments // Copeia. V. 3. № 3. P. 433–454. https://doi.org/10.1643/01-053
Manassa R.P., Dixson D.L., McCormick M.I., Chivers D.P. 2013. Coral reef fish incorporate multiple sources of visual and chemical information to mediate predation risk // Anim. Behav. V. 86. № 4. P. 717–722. https://doi.org/10.1016/j.anbehav.2013.07.003
Maruska K.P., Peyton K.A. 2007. Interspecific spawning between a recent immigrant and an endemic damselfish (Pisces: Pomacentridae) in the Hawaiian Islands // Pac. Sci. V. 61. № 2. P. 211–221. https://doi.org/10.2984/1534-6188(2007)61[211:ISBARI]2.0.CO;2
Mitchell M.D., McCormick M.I., Ferrari M.C.O., Chivers D.P. 2011. Coral reef fish rapidly learn to identify multiple unknown predators upon recruitment to the reef // PLoS ONE. V. 6. № 1. Article e15764. https://doi.org/10.1371/journal.pone.0015764
Mitchell M.D., McCormick M.I., Chivers D.P., Ferrari M.C.O. 2013. Generalization of learned predator recognition in coral reef ecosystems: how cautious are damselfish? // Funct. Ecol. V. 27. № 2. P. 299–304. https://doi.org/10.1111/1365-2435.12043
Murphy B.F., Leis J.M., Kavanagh K.D. 2007. Larval development of the ambon damselfish Pomacentrus amboinensis, with a summary of pomacentrid development // J. Fish Biol. V. 71. № 2. P. 569–584. https://doi.org/10.1111/j.1095-8649.2007.01524.x
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken: John Wiley and Sons, 752 p. https://doi.org/10.1002/9781119174844
Pratchett M.S., Hoey A.S., Wilson S.K. et al. 2016. Habitat-use and specialization among coral reef damselfishes // Biology of damselfishes / Eds. Frédérich B., Parmentier E. Boca Raton: CRC Press. P. 84–121. (http://hdl.handle.net/20.500.11937/70865).
Randall J.E., Ida H., Moyer J.T. 1981. A review of the damselfishes of the genus Chromis from Japan and Taiwan, with description of a new species // Jpn. J. Ichthyol. V. 28. №. 3. P. 203–243. https://doi.org/10.11369/jji1950.28.203
Roux N., Salis P., Lambert A. et al. 2019. Staging and normal table of postembryonic development of the clownfish (Amphiprion ocellaris) // Devel. Dyn. V. 248. № 7. P. 545–568. https://doi.org/10.1002/dvdy.46
Shanks A.L. 2009. Pelagic larval duration and dispersal distance revisited // Biol. Bull. V. 216. № 3. P. 373–385. https://doi.org/10.1086/BBLv216n3p373
Siebeck U.E. 2004. Communication in coral reef fish: the role of ultraviolet colour patterns in damselfish territorial behaviour // Anim. Behav. V. 68. № 2. P. 273–282. https://doi.org/10.1016/j.anbehav.2003.11.010
Siebeck U.E., Wallis G.M., Litherland L. 2008. Colour vision in coral reef fish // J. Exp. Biol. V. 211. P. 354–360. https://doi.org/10.1242/jeb.012880
Sundin J., Amcoff M., Mateos-González F. et al. 2017. Long-term exposure to elevated carbon dioxide does not alter activity levels of a coral reef fish in response to predator chemical cues // Behav. Ecol. Sociobiol. V. 71. № 8. Article 108. https://doi.org/10.1007/s00265-017-2337-x
Theisen B. 1982. Functional morphology of the olfactory organ in Spinachia spinachia (L.) (Teleostei, Gasterosteidae) // Acta Zool. V. 63. № 4. P. 247–254. https://doi.org/10.1111/j.1463-6395.1982.tb00784.x
Wright K.J., Higgs D.M., Belanger A.J., Leis J.M. 2005. Auditory and olfactory abilities of pre-settlement larvae and post-settlement juveniles of a coral reef damselfish (Pisces: Pomacentridae) // Mar. Biol. V. 147. № 6. P. 1425–1434. https://doi.org/10.1007/s00227-005-0028-z
Wyatt A.S.J., Waite A.M., Humphries S. 2012. Stable isotope analysis reveals community-level variation in fish trophodynamics across a fringing coral reef // Coral Reefs. V. 31. № 4. P. 1029–1044. https://doi.org/10.1007/s00338-012-0923-y
Yamamoto M. 1982. Comparative morphology of fish olfactory organ in teleosts // Chemoreception in fishes / Ed. Hara T.J. N.Y.: Elsevier. P. 39–59.
Yamamoto M., Ueda K. 1979. Comparative morphology of fish olfactory epithelium. X. Perciformes, Beryciformes, Scorpaeniformes, and Pleuronectiformes // J. Fac. Sci. Univ. Tokyo. V. 14. P. 273–297.
Zeiske E. 1973. Morphologische untersuchungen am Geruchsorgan von Zahnkarpfen (Pisces, Cyprinodontoidea) // Z. Morph. Tiere. V. 74. № 1. P. 1–16. https://doi.org/10.1007/BF00291793
Zeiske E. 1974. Morphologische und Morphometrische untersuchungen am Geruchsorgan, oviparer Zahnkarpfen (Pisces) // Ibid. V. 77. № 1. P. 19–50. https://doi.org/10.1007/BF00284625
Zeiske E., Theisen B., Breucker H. 1992. Structure, development, and evolutionary aspects of the peripheral olfactory system // Fish chemoreception / Ed. Hara T.J. London: Chapman and Hall. P. 13–39.
Zeiske E., Theisen H., Breucker B. 1994. Olfactory organ of the hardhead sea catfish, Arius felis (L.): gross morphology and fine structure // Acta Zool. V. 75. № 2. P. 115–123. https://doi.org/10.1111/j.1463-6395.1994.tb01116.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


