Вопросы ихтиологии, 2022, T. 62, № 3, стр. 345-355
Качественная оценка состояния запаса леща Abramis brama (Cyprinidae) уральского стада на основе метода LB-SPR
И. А. Сафаралиев 1, *, Н. Н. Попов 2
1 Волжско-Каспийский филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – КаспНИРХ
Астрахань, Россия
2 Специализированная научно-исследовательская и проектная компания – Казэкопроект
Алма-Ата, Республика Казахстан
* E-mail: safaraliev.i.a@mail.ru
Поступила в редакцию 24.05.2021
После доработки 15.06.2021
Принята к публикации 21.06.2021
- EDN: UFWFRM
- DOI: 10.31857/S0042875222030171
Аннотация
На основе размерного состава леща Abramis brama в промысловых уловах р. Урал оценивали состояние запаса уральского стада северокаспийской популяции с применением метода LB-SPR. Для леща уральского стада впервые рассчитаны значения параметров уравнения Берталанфи: асимптотическая длина особи составляет 47.0 см, константа роста – 0.13, гипотетический возраст, при котором длина рыбы равнялась бы нулю, равна –2.17; 50% особей созревают при длине 23.2 см, а 95% − при длине 28.7 см. Полученная оценка коэффициента нерестового потенциала (0.26) меньше биологического целевого ориентира (0.40) и формально свидетельствует о состоянии перелова запаса.
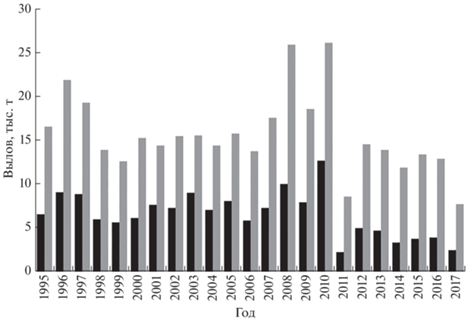
В Урало-Каспийском бассейне добывается >1/3 объёма коммерческого вылова рыб Республики Казахстан. В р. Урал и его взморье обитают 17 промысловых видов пяти семейств, в том числе и лещ Abramis brama, уловы которого могут достигать 60% общего вылова полупроходных и речных рыб (Кузьменко, 2011).
На формирование запасов леща и на колебание его численности оказывают влияние многочисленные факторы внешней среды в период размножения и нагула в Северном Каспии, а также интенсивность промысла (Левашина, Попов, 2012). В Урало-Каспийском бассейне в 1995–2009 гг. уловы леща колебались в пределах 6−10 тыс. т (38–57% общего вылова), а в 2012–2017 гг. в среднем составляли 3.84 тыс. т (рис. 1). В некоторых случаях колебания уловов леща обусловлены организацией промысла, в том числе локализацией промысловых участков. Например, снижение объёма вылова с 2011 г. связано с введением запрета на промысел в р. Урал в весенний период, лов возможен только в открытом море в нескольких десятках километров от устья Урала, чтобы не мешать рыбе заходить на нерест. В этой связи приобретают актуальность исследования, базирующиеся на модельном анализе размерного ряда уловов, которые позволяют качественно оценить режим эксплуатации уральского стада леща и ответить на вопросы: происходит ли перелов запаса по размерному ряду и как его изъятие из популяции влияет на воспроизводительный потенциал (коэффициент нерестового потенциала) запаса?
Цель работы − оценка качественного состояния запаса уральского стада леща с помощью характеристики размерного ряда уловов на промысловых участках Урало-Каспийского бассейна.
МАТЕРИАЛ И МЕТОДИКА
Обитающий в северной части Каспийского моря лещ представляет собой единую северокаспийскую популяцию, которая подразделяется на три локальные стада: волжское, уральское и терское. Во время нагула в море чёткой границы между распределением волжского и уральского стада нет, а в многоводные годы они могут смешиваться (Танасийчук, 1959; Левашина, Попов, 2012). Наш материал собран в р. Урал, т.е. все результаты исследования касаются леща уральского стада.
Для качественной оценки эксплуатации промыслового стада леща материал собирали в нижнем течении р. Урал на стационарных промысловых участках (тонях) на протяжении всей промысловой компании в 2009–2017 гг. из промысловых уловов закидных неводов с ячеёй 28 × 36 × 40 и 48 × 50 × 56 мм. Сбор и обработку материала проводили согласно общепринятым методикам (Правдин, 1966; Судаков и др., 2011). Определяли стандартную длину (SL), массу тела и стадию зрелости гонад. Возраст рыб определяли с помощью бинокуляра МБС 10 по чешуе, взятой выше боковой линии под спинным плавником (Чугунова, 1959). Всего проанализировали 4120 экз. леща.
Параметры линейного роста уравнения Берталанфи (Bertalanffy, 1964) для леща уральского стада получены с использованием пакета FSA ver. 0.8.32 (Ogle et al., 2021) программной среды R. Данный пакет позволяет оценить значения параметров асимптотической длины рыбы (L∞), коэффициента Броуди (константа роста k) и гипотетического возраста, при котором длина рыбы равнялась бы нулю (t0).
Огива созревания леща построена на предположении о логистической форме распределения доли зрелых и незрелых рыб в зависимости от их длины. Процедура расчётов для построения данной кривой реализована в пакете FSA ver. 0.8.32 (Ogle, 2013; Ogle et al., 2021). Входными данными служили длина и состояние половой зрелости (зрелая или незрелая) каждой особи.
Мгновенный коэффициент естественной смертности (М) леща рассчитывали эмпирическими методами, основанными на биологических показателях (Рихтер, Ефанов, 1977; Roff, 1984; Jensen, 1996; Hewitt, Hoenig, 2005; Zhang, Megrey, 2006; Then et al., 2015). Полученные значения колебались в зависимости от метода, окончательная оценка коэффициента получена путём их осреднения.
Анализ состояния запаса уральского стада леща выполнен с помощью метода оценки коэффициента нерестового потенциала, основанного на анализе размерных рядов уловов (LB-SPR – length based spawning potential ratio) (Hordyk et al., 2015a). Известно, что истощение запаса происходит, когда чрезмерный промысел приводит к снижению улова из-за нехватки пополнения промысловой части популяции (Maceina, Pereira, 2007; Haddon, 2011). Отсюда встаёт вопрос: в какой степени эксплуатация запаса может повлиять на её воспроизводительную способность? Для решения этой задачи был разработан подход, позволяющий оценить теоретическую потенциальную плодовитость перед выловом и коэффициент нерестового потенциала (SPR – spawning potential ratio) в условиях промыслового изъятия (Goodyear, 1993). Потенциальная плодовитость (P) – это “количество икры, которое может произвести средняя особь при отсутствии зависимости от плотности популяции” (Maceina, Pereira, 2007. P. 177). Потенциальная плодовитость рассчитывается следующим образом (Ogle, 2016):
где n – максимальный возраст, μi – доля зрелых самок в возрасте i, Ei – средняя плодовитость (количество произведённой икры) при отсутствии влияния популяционной плотности на рост, зрелость или плодовитость зрелых самок в возрасте i, Si – кумулятивное произведение коэффициентов выживания самок с момента вылупления до возраста i, вычисляется по формуле: где Sij – коэффициент годового выживания самок c возраста j до возраста i; Sij = ${{e}^{{ - ~\left( {{{F}_{{ij}}} + {{M}_{{ij}}}} \right)}}}$, где F – мгновенная промысловая смертность c возраста j до возраста i, M – мгновенная естественная смертность c возраста j до возраста i.Таким образом, SPR представляет собой отношение величины потенциальной плодовитости обловленного запаса (Pfished) к величине потенциальной плодовитости необловленного запаса (Punfished) (Goodyear, 1993; Hordyk et al., 2015а):
Как было представлено выше, для проведения оценки SPR необходимы известные оценки F и M, плодовитости и селективности при соответствующих возрастах. Оценка каждого из этих параметров сложна, особенно для запасов с дефицитом информации. Тем не менее, основываясь на некоторых упрощённых допущениях о моделируемом запасе и биологических постоянных Бевертона−Холта (M/k и Lm/L∞) (Hordyk et al., 2015a; Prince et al., 2015a), уравнение (3) можно представить в следующем виде (Hordyk et al., 2015a):
(4)
${\text{SPR}} = \frac{{\sum {{{\left( {1 - {{{\tilde {L}}}_{t}}} \right)}}^{{\left( {M{\text{/}}k\left[ {\left( {F{\text{/}}M} \right) + 1} \right]} \right)}}}{\kern 1pt} \tilde {L}_{t}^{b}}}{{\sum {{{\left( {1 - {{{\tilde {L}}}_{t}}} \right)}}^{{M{\text{/}}k}}}{\kern 1pt} \tilde {L}_{t}^{b}}},$Уравнение (4) реализовано в методе LB-SPR (Hordyk et al., 2015a). Данный метод позволяет на основе информации о размерном составе уловов, значениях длины, при которых 50 и 95% (SLm50 и SLm95) составляют зрелые особи, величинах L∞ и отношения M/k рассчитать значение SPR, соотношение F/M (интенсивность промысла) и построить селективную кривую уловов относительно огивы полового созревания. При реализации метода LB-SPR необходимо учитывать ряд допущений о состоянии запаса (Hordyk et al., 2015b; Prince et al., 2019): 1) селективность орудий лова описывается логистической кривой, 2) рост гидробионтов описывается уравнением Берталанфи, 3) кривая и темп роста одинаковы для обоих полов, 4) длина особей в возрасте t имеет нормальное распределение, 5) коэффициент естественной смертности постоянен для всех возрастных и размерных классов, 6) пополнение является постоянной величиной, 7) распределение размерного ряда улов должно быть одновершинным.
В зарубежной практике регулирования рыболовства значение SPR часто используется как целевой и граничный ориентиры (Restrepo, Powers, 1999; Clark, 2002). Значение, равное 0.4 (или 40%), используется как альтернатива целевым ориентирам максимального устойчивого улова MSY (maximum sustainable yield) и биомассе запаса, обеспечивающей максимальный устойчивый улов BMSY. При SPR > 0.4 считается, что запас недооблавливается, а при SPR ≈ 1 промысловая нагрузка крайне низка, состояние запаса близко к девственному. В диапазоне SPR 0.39−0.20 качественная оценка запаса приравнивается к состоянию перелова, но сохраняет способность к восстановлению. Значение SPR = 0.2 является граничным ориентиром, ниже которого состояние запаса и его эксплуатация вызывают тревогу, ожидается снижение пополнения. При SPR ≤ 0.1 считается, что нерестовый потенциал подорван и, если своевременно не предпринять меры по управлению промыслом, ситуация может привести к исчезновению запаса (Mace, Sissenwine, 1993; Clark, 2002; Brooks et al., 2010; Prince et al., 2019).
Процедура расчётов методом LB-SPR, построение графиков и имитационное моделирование запаса на основе полученных результатов реализованы в пакете LBSPR программной среды R (Hordyk, 2019).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка биологических параметров жизненного цикла леща уральского стада
Несмотря на достаточно большое число работ, посвящённых лещу северной части Каспийского моря (Волжско-Каспийский и Урало-Каспийский районы), исследователи уделяли мало внимания теме зависимости линейно-весовых параметров от возраста по уравнению Берталанфи. По данным научно-исследовательских уловов волжского стада леща в северо-западной части Каспийского моря, параметры линейного роста уравнения Берталанфи для периода 1986–2004 гг. оказались следующими: L∞ = 59.0 см, k = 0.11, t0 = = −1.72; для более позднего периода (2005–2016 гг.) – L∞ = 55.0 см, k = 0.10, t0 = −1.78 (Левашина, 2013, 2020). Уменьшение значения L∞ в сравниваемых двух периодах является следствием замедления темпа роста и снижения наблюдаемых максимальных размеров леща к настоящему времени. Замедление темпа роста, в свою очередь, вызвано ухудшением условий нагула в северо-западной части Каспийского моря (неблагоприятный гидролого-гидрохимический режим и снижение биомассы кормового бентоса в море).
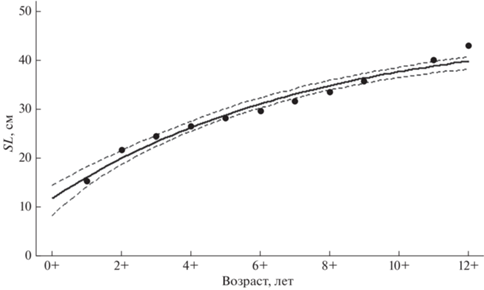
Параметры уравнения Берталанфи, описывающего рост леща уральского стада, рассчитанные по данным 2009–2017 гг., составили: L∞ = 47.0 ± ± 5.72 см, k = 0.133 ± 0.046 год–1, t0 = −2.165 ± 0.911; доверительный интервал (при р = 0.95) − соответственно 13.19, 0.11 и 2.10; уровень значимости (α) − 0.00004, 0.021 и 0.045. Значения α найденных параметров уравнения не превышают критический уровень 0.05, что вполне достаточно для биологических исследований и, следовательно, величины L∞, k и t0 допустимо использовать для дальнейшей работы. Эмпирические данные хорошо описываются теоретической кривой (рис. 2).
Рис. 2.
Зависимость длины (SL) леща Abramis brama уральского стада от возраста: (⚫) – эмпирические данные, (—) – кривая линейного роста по Берталанфи, (- -) – 95%-ный доверительный интервал (L∞ = 47.0 см, k = 0.13 год–1, t0 = –2.17).
Различия значений L∞ у уральского (настоящая работа) и волжского леща (Левашина, 2013, 2020) указывают, что с возрастом темп роста уральского леща замедляется быстрее, чем волжского. По данным Левашиной и Попова (2012), начиная с 7-летнего возраста средняя длина уральского леща несколько меньше, чем волжского.
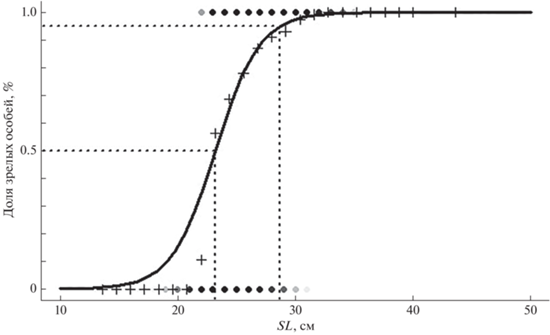
Моделирование темпа созревания уральского леща в зависимости от длины на основе предположения об их логистической зависимости показало, что 50% особей (SLm50) созревают при SL 23.2 (95%‑ный доверительный интервал 23.0–23.4) см, а 95% (SLm95) – 28.7 (28.4–29.1) см (рис. 3). Согласно уравнению роста Берталанфи для леща уральского стада SLm50 = 23.2 см соответствует возрасту 3.06 лет. Найденный возраст полового созревания соответствует данным предыдущих исследований: в 1938−1953 гг. в возрасте 3 лет доля половозрелых особей составляла 40%, а в возрасте 4 лет – 60% (Танасийчук, 1959). В 2000-е гг. темп созревания леща как волжского, так и уральского стада остался прежним: ~ 50% особей в зависимости от рассматриваемого года и условий нагула созревают в возрасте 3 или 4 года (Левашина, Попов, 2012).
Рис. 3.
Огива полового созревания леща Abramis brama уральского стада: (+) – данные, сгруппированные по размерным классам; цветная тональность точек сверху означает представительность данных о половозрелых особях, снизу – о неполовозрелых.
Величина М уральского леща, рассчитанная разными эмпирическими методами на основе найденных значений параметров роста и биологических данных, варьирует в пределах 0.123−0.572 год–1 (табл. 1). Итоговая (средняя) оценка (0.301 ± 0.13 год–1) оказалась в пределах значений из немногочисленных источников литературы. По данным Левашиной (2020), естественная смертность для волжского стада в среднем составила 30%, что в пересчёте в единицы мгновенной смертности составляет 0.357 год–1; по данным Зыкова (2005), М = 0.546 год–1. У леща Вислинского (Калининградского) залива Балтийского моря М = 0.150 год–1 при его максимальном возрасте 19 лет (Шибаев и др., 2012). Модельные расчёты, реализованные в пакете FishLife (Thorson et al., 2017; Thorson, 2019), основанные на данных Fishbase (Froese, Pauly, 2019) по росту, размеру, смертности и температуры обитания с использованием подхода многомерного процесса случайного блуждания на таксономическом дереве A. brama, указывают на среднее значение 0.242 год–1. Различия значений М из упомянутых источников объясняются биологическими особенностями отдельных популяций леща (северокаспийского и Вислинского залива) и разными методами оценки.
Таблица 1.
Результаты расчёта коэффициента мгновенной естественной смертности леща Abramis brama уральского стада разными эмпирическими методами
| № | Формула | Полученная оценка | Авторы метода |
|---|---|---|---|
| 1 | М = 1.65/tm50 | 0.413 | Jensen, 1996 |
| 2 | M = 1.5k | 0.195 | То же |
| 3 | M = (1.521/$t_{{m{\text{70}}}}^{{{\text{0}}{\text{.720}}}}{\text{ }}$) – 0.155 | 0.322 | Рихтер, Ефанов, 1977 |
| 4 | M = (3k)/(exp (k(0.44tmax) – t0)) – 1) | 0.123 | Zhang, Megrey, 2006 |
| 5 | М = 4.2/tmax | 0.210 | Hewitt, Hoenig, 2005 |
| 6 | M = (3k)/(exp (ktm50) – 1) | 0.572 | Roff, 1984 |
| 7 | M = 4.889$t_{{{\text{max}}}}^{{ - 0.916}}$ | 0.314 | Then et al., 2015 |
| 8 | M = 4.118k0.73$L_{\infty }^{{ - 0.33}}$ | 0.261 | То же |
| Среднее значение (М ± σ) | 0.301 ± 0.13 |
Примечание. L∞ − теоретическая предельная длина, k − коэффициент роста, M –коэффициент мгновенной естественной смертности; tm50, tm70 – возраст, при котором половой зрелости достигают 50 и 70% особей; tmax – максимальный возраст (20 лет, по: Митрофанова и др., 1988), t0 − возраст, при котором длина рыбы равнялась бы нулю.
Оценка состояния запаса
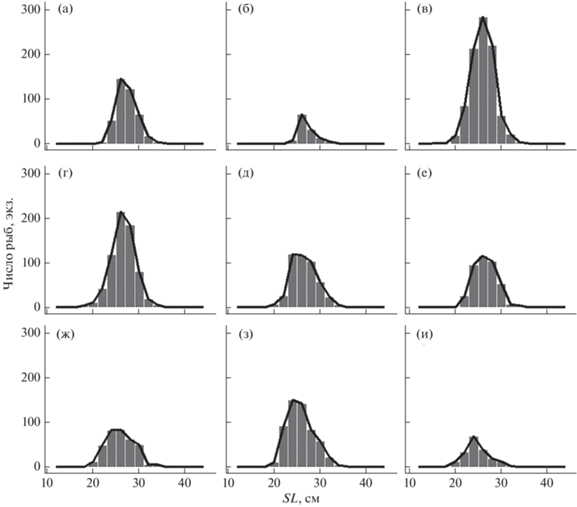
В 2009–2017 гг. уловы леща уральского стада были представлены особями SL 13–43 см, преобладали рыбы SL 25–29 см (рис. 4). Во все анализируемые годы наблюдается одновершинное распределение размерного ряда, что позволяет использовать данные всего периода в качестве входной информации в методе LB-SPR.
Рис. 4.
Размерный состав уловов леща Abramis brama уральского стада в разные годы: а – 2009, б – 2010, в – 2011, г – 2012, д – 2013, е – 2014, ж – 2015, з – 2016, и – 2017.
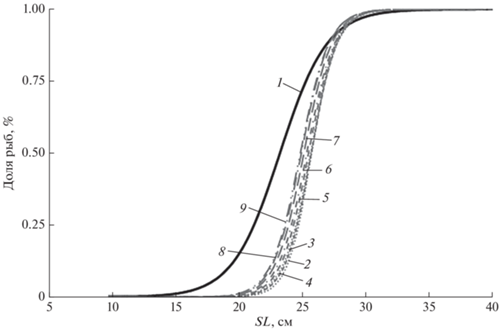
Для сравнения темпа полового созревания и размерного ряда леща в уловах были построены огива созревания и кривые селективности орудий лова, применяемых при промысле этого вида (рис. 5). Расположение этих кривых правее огивы созревания свидетельствует, что промыслом изымаются главным образом рыбы, достигшие половой зрелости.
Рис. 5.
Огива полового созревания леща Abramis brama уральского стада (1) и кривые селективности орудий лова по годам: 2 – 2009−2010, 3 – 2011, 4 – 2012, 5 – 2013, 6 – 2014, 7 – 2015, 8 – 2016, 9 – 2017.
Метод LB-SPR чувствителен к задаваемым значениям M, k и L∞ (Hordyk et al., 2015b). Наибольшую неопределённость представляет параметр М, значения которого, полученные разными методами, варьируют в диапазоне 0.123–0.572 год–1 (табл. 1). Результаты тестирования метода LB-SPR с использованием разных значений М представлены в табл. 2. Все девять значений длины, при которой доступными для орудий лова являются 50% облавливаемого скопления рыб (SL50), оказались выше SLm50. Значение SL50 не опускалось ниже точечной оценки 23.88 см. Оценка SPR в восьми из девяти вариантов ниже целевого ориентира (0.4); исключение составляет вариант с наиболее высоким значением M/k = 4.40, при котором SPR > 0.4.
Таблица 2.
Оценки индикаторов состояния запаса леща Abramis brama уральского стада, полученные на основе разных значений коэффициента мгновенной естественной смертности
| Метод расчёта М | М | M/k | $S_{{L{\text{50}}}}^{{\text{*}}}$ | $S_{{L{\text{95}}}}^{{\text{*}}}$ | F/M* | SPR* |
|---|---|---|---|---|---|---|
| 1 | 0.413 | 3.18 | $\frac{{24.01 \pm 0.96}}{{24.91}}$ | $\frac{{27.79 \pm 1.49}}{{28.19}}$ | $\frac{{2.21 \pm 0.85}}{{2.04}}$ | $\frac{{0.28 \pm 0.06}}{{0.35}}$ |
| 2 | 0.195 | 1.50 | $\frac{{23.92 \pm 0.98}}{{24.83}}$ | $\frac{{27.93 \pm 1.60}}{{28.30}}$ | $\frac{{5.73 \pm 1.83}}{{5.33}}$ | $\frac{{0.09 \pm 0.03}}{{0.13}}$ |
| 3 | 0.322 | 2.48 | $\frac{{23.97 \pm 0.96}}{{24.88}}$ | $\frac{{27.85 \pm 1.53}}{{28.24}}$ | $\frac{{3.10 \pm 1.10}}{{2.87}}$ | $\frac{{0.19 \pm 0.05}}{{0.25}}$ |
| 4 | 0.123 | 0.95 | $\frac{{23.88 \pm 0.98}}{{24.80}}$ | $\frac{{27.98 \pm 1.64}}{{28.34}}$ | $\frac{{9.58 \pm 2.91}}{{8.92}}$ | $\frac{{0.05 \pm 0.01}}{{0.07}}$ |
| 5 | 0.210 | 1.62 | $\frac{{23.93 \pm 0.98}}{{24.84}}$ | $\frac{{27.92 \pm 1.59}}{{28.29}}$ | $\frac{{5.24 \pm 1.69}}{{4.86}}$ | $\frac{{0.10 \pm 0.03}}{{0.14}}$ |
| 6 | 0.572 | 4.40 | $\frac{{24.07 \pm 0.94}}{{24.97}}$ | $\frac{{27.70 \pm 1.42}}{{28.12}}$ | $\frac{{1.34 \pm 0.61}}{{1.22}}$ | $\frac{{0.43 \pm 0.09}}{{0.52}}$ |
| 7 | 0.314 | 2.42 | $\frac{{23.97 \pm 0.97}}{{24.88}}$ | $\frac{{27.85 \pm 1.54}}{{28.24}}$ | $\frac{{3.20 \pm 1.12}}{{2.96}}$ | $\frac{{0.19 \pm 0.05}}{{0.24}}$ |
| 8 | 0.261 | 2.01 | $\frac{{23.95 \pm 0.97}}{{24.86}}$ | $\frac{{27.88 \pm 1.56}}{{28.26}}$ | $\frac{{4.04 \pm 1.36}}{{3.75}}$ | $\frac{{0.14 \pm 0.04}}{{0.19}}$ |
| Среднее значение | 0.301 | 2.32 | $\frac{{23.93 \pm 0.97}}{{24.72}}$ | $\frac{{28.0 \pm 1.56}}{{28.16}}$ | $\frac{{3.40 \pm 1.22}}{{3.08}}$ | $\frac{{0.21 \pm 0.05}}{{0.26}}$ |
Примечание. SL50, SL95 – длина тела, при которой доступными для орудий лова являются соответственно 50 и 95% рыб; F – мгновенный коэффициент промысловой смертности, SPR – коэффициент нерестового потенциала; *приведены значения за 2017 г.: над чертой – точечные оценки и их доверительный интервал (р = 0.95), под чертой − оценки, сглаженные с помощью фильтра Калмана; нумерация методов и ост. обозначения см. в табл. 1.
В нашей работе впервые за многие годы исследования запасов леща уральского стада рассматривается оценка отношения M/k, поэтому невозможно провести сравнительный анализ полученного значения с другими данными. Но на основе теоретических положений, заложенных в отношение M/k, и проведённого модельно-имитационного исследования можно сделать вывод о полученной величине M/k для леща уральского стада.
Отношение M/k характеризует размерно-возрастную динамику биомассы одного отдельно взятого поколения. Виды с низким значением M/k (<1) достигают максимальной длины и индивидуальной массы в раннем возрасте, когда численность поколения ещё велика. Следовательно, пик биомассы наблюдается в относительно раннем периоде жизни поколения, после чего в результате естественной смертности численность и биомасса поколения сокращаются. Например, у Scorpis aequipinnis, самки которого достигают наибольшей длины в возрасте 15 лет и в последующие 50 лет не растут, M/k = 0.33 (Coulson et al., 2012). Высокое значение M/k (>2) свойственно видам с постоянным темпом роста в течение всего жизненного цикла, т.е. максимальную длину и массу имеют особи старших возрастных групп. Поэтому пик биомассы у необловленной популяции формируется позже, чем у быстро растущих рыб (Hordyk et al., 2015a, 2015b). Например, у Scarus rivulatus M/k = 2.39, особи этого вида доживают до 8 лет, а линейно-весовой рост прослеживается в течение всей жизни (Choat et al., 1996; Choat, Robertson, 2002; Prince et al., 2015b).
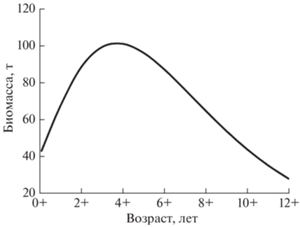
У леща уральского стада при всех значениях M, за исключением наименьшего (0.123 год–1), величины отношения M/k варьируют в пределах 1.5–4.4 (табл. 2), т.е. соответствуют видам, чей рост постоянен в течение всего жизненного цикла, а максимум биомассы формируют средние возрастные группы. Данные литературы (Левашина, Попов, 2012; Левашина, 2020) и представленные в настоящей работе оценки свидетельствуют, что темп роста леша постоянен в течение всей жизни с замедлением в старшем возрасте. Имитационное моделирование динамики биомассы виртуальной необлавливаемой популяции леща уральского стада, выполненное при входных значениях M (0.301 год–1), найденных параметров уравнения Берталанфи и соотношения масса−длина (W = = 0.05657SL2.67), показало, что максимум биомассы популяции достигается в 4-летнем возрасте (рис. 6). Таким образом, результаты этого моделирования подтверждают, что осреднённая величина M и рассчитанное на её основе отношение M/k являются приемлемыми оценками.
Рис. 6.
Имитационное моделирование динамики биомассы виртуальной популяции леща Abramis brama уральского стада.
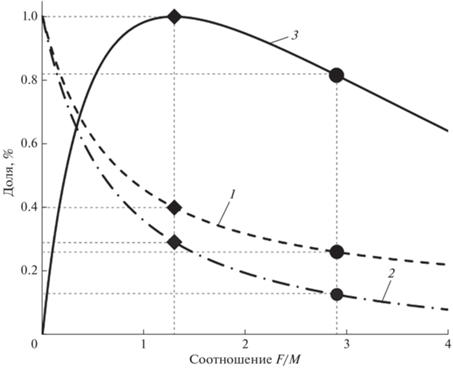
Исходя из этого для окончательной оценки индикаторов состояния запаса леща уральского стада (SL50, SL95, F/M и SPR) в модели LB-SPR использовали M/k = 2.32. Для последующего анализа результатов модели использовали значения индикаторов, сглаженные фильтром Кальмана (рис. 7). На протяжении всего временнóго ряда (2009–2017) величины SPR были ниже целевого значения (0.4) с незначительным отрицательным трендом: снизились с 0.29 в 2009-м до 0.26 в 2017-м. (рис. 7в). На первый взгляд, низкое значение SPR противоречит полученным индикаторам селективности промысла леща. Индикатор SL50 во все анализируемые годы был выше значения параметра SLm50 = 23.2 см (рис. 7а), а кривые селективности орудий лова расположены значительно правее огивы созревания (рис. 5), т. е. условия промысла должны были быть удовлетворительными для поддержания нерестового потенциала запаса на приемлемом уровне (~0.4).
Рис. 7.
Результаты оценок индикаторов состояния запаса леща Abramis brama уральского стада методом LB-SPR – точечные оценки и значения, сглаженные фильтром Кальмана: а − длина тела, при которой доступными для орудий лова являются 50 (◆, 1) и 95 (▲, 2) % рыб; б – промысловая нагрузка (F/M), в − коэффициент нерестового потенциала (SPR); (│) – доверительный интервал точечных оценок (р = 0.95).
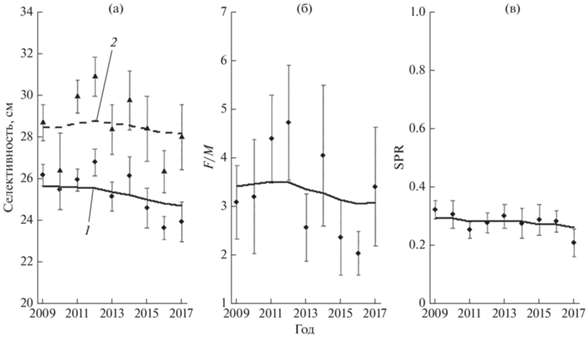
Данное противоречие объясняют высокие значения индикатора F/M (рис. 7б). Уолтерс и Мартел (Walters, Martell, 2004), а также Хордик с соавторами (Hordyk et al., 2015а) указывают, что высокое значение F/M может являться следствием селективности промысла, нацеленного на определённый размерный ряд. Например, если высокоселективный промысел изымает из запаса главным образом старшие возрастные классы, то величина F/M будет исключительно высокой, промысел, вероятно, будет устойчивым, но улов – очень низким. И, наоборот, даже при относительно низком значении F/M может резко сократиться пополнение, если промысел вылавливает бóльшую часть неполовозрелых особей. Данное объяснение вполне соответствует полученным результатам модели LB-SPR запаса леща. Эксплуатация уральского стада леща (преимущественно особей SL ≥ 25 см) ведётся на довольно высоком уровне (F/M ≥ 3.05). Высокий промысловый прессинг половозрелых рыб, ведущий к перелову этой части популяции, подрывает нерестовый потенциал запаса и ведёт к низкой величине SPR.
Для нахождения оптимальных условий эксплуатации запаса леща уральского стада было проведено имитационное моделирование зависимости SPR, отношения нерестовой биомассы к девственной (SSB/SSB0) и относительного улова от F/M. В качестве входных параметров использовали следующие величины: M/k = 2.32, L∞ = 47.0 см, SLm50 = 23.2 см, SLm95 = 28.7 см, SL50= 24.72 см, SL95 = 28.16 см. Результаты моделирования свидетельствуют, что значение SPR = 0.26 не обеспечивает максимальный возможный вылов при достаточно высокой промысловой нагрузке (F/M = 2.9) и формирующейся низкой биомассе нерестового запаса (SSB/SSB0 = 0.13) (рис. 8). В этом режиме эксплуатации запаса можно получить только 82% биомассы улова от максимально возможного. Для оптимизации промысла до целевого ориентира SPR = 0.4 и, следовательно, получения наибольшего возможного улова необходимо сократить промысловую нагрузку более чем в два раза − до F/M = 1.3. В этом случае сокращение F/M приведёт к восстановлению и возрастанию биомассы половозрелой части запаса леща, способствующей получению максимальных уловов.
ЗАКЛЮЧЕНИЕ
Представленная работа содержит несколько позиций, которые были впервые оценены для популяции леща уральского стада. Это − биологические параметры линейного роста уравнения Берталанфи, величина естественной смертности и построение модели запаса методом LB-SPR. Метод LB-SPR, как и другие аналогичные, основанные на анализе размерных рядов уловов (LBI – length based indicators, LCA – length-cohort analysis и т.д.), применяется для оценки запасов с ограниченной информацией. При использовании таких методов вводится допущение о постоянстве условий и равновесном состоянии запаса, что, конечно же, может приводить к недооценке или переоценке получаемых результатов моделирования. Немаловажную роль в этих методах также играет репрезентативность размерного ряда, отражающая действительный размерный состав популяции, и верное предположение или знание значений их биологических параметров (биологические постоянные Бевертона−Холта) (Gerritsen, McGrath, 2007; Hordyk et al., 2015b).
В целом проведённое исследование показало, что запас леща уральского стада, оценивая в качественных показателях, находится в состоянии перелова его половозрелой части, представленной преимущественно особями SL ≥ 25 см. Поскольку вылову подвержена взрослая часть популяции при промысловой нагрузке не более F/M = 3.51, такой режим промысла позволяет достаточно долго эксплуатировать запас, но с относительно низкими уловами. Важную роль в поддержании запаса, несомненно, играют введённые ограничительные меры: запрет промысла в р. Урал в весенний период 2011 г. (это был разовый запрет); с 2012 г. дата окончания весенней путины перенесена с 20 мая на 25 апреля; с 1 июля 2021 г. вводится запрет лова ставными сетями в прибрежной части Каспийского моря Атырауской области. Снижение промысловой нагрузки на облавливаемую часть запаса до F/M = 1.3, как показали наши расчёты, в совокупности с ограничительными мерами коммерческого промысла будут способствовать в перспективе увеличению уловов леща. Однако следует отметить, что сделанные выводы о состоянии запаса леща и рекомендации по регулированию промысла необходимо рассматривать как предварительные. Представленные в настоящей работе величины темпа роста, естественной смертности и других показателей можно использовать в дальнейших исследованиях с применением более сложных аналитических моделей, которые позволяют более точно оценить запас и на их основе дать рекомендации к его эксплуатации.
В настоящее время по результатам отечественных рыбохозяйственных исследований опубликованы только две работы, посвящённые модели LB-SPR (Бабаян и др., 2018; Петухова, 2020); в первой даются методические рекомендации и процедура расчётов, а во второй – реализация этого метода на основе отечественных данных уловов атлантической пеламиды Sarda sarda. Представленная работа добавляет опыт применения метода LB-SPR в модельной оценке запасов и в последующем поможет ввести его в практику рыбохозяйственных исследований для запасов с ограниченной информацией.
Список литературы
Бабаян В.К., Бобырев А.Е., Булгакова Т.И. и др. 2018. Методические рекомендации по оценке запасов приоритетных видов водных биологических ресурсов. М.: Изд-во ВНИРО, 312 с.
Зыков Л.А. 2005. Биоэкологические аспекты теории естественной смертности рыб. Астрахань: Изд-во АГУ, 373 с.
Кузьменко С.В. 2011. Промысел и качественная характеристика леща р. Урал // Матер. докл. I Всерос. конф. “Современное состояние биоресурсов внутренних водоемов”. Т. 1. М.: Акварос. С. 448–453.
Левашина Н.В. 2013. Особенности распределения леща Abramis brama (Linnaeus, 1758) в северной части Каспийского моря в современный период // Естеств. науки. № 3. С. 33–51.
Левашина Н.В. 2020. Формирование популяции леща Abramis brama (Linnaeus, 1758) и промысловое использование его запасов в волжско-каспийском бассейне: Автореф. дис. … канд. биол. наук. Астрахань: АГТУ, 26 с.
Левашина Н.В., Попов Н.Н. 2012. Современная промыслово-биологическая характеристика леща Abramis brama в реках Волга и Урал // Вопр. рыболовства. Т. 13. № 4 (52). С. 805–819.
Митрофанов В.П., Дукравец Г.М., Мельников В.А. и др. 1988. Рыбы Казахстана. Т. 3. Карповые (продолжение). Алма-Ата: Наука, 304 с.
Петухова Н.Г. 2020. Предварительная оценка состояния запаса атлантической пеламиды Sarda sarda северо-восточной части Атлантического океана // Вопр. ихтиологии. Т. 60. № 5. С. 552–561. https://doi.org/10.31857/S0042875220050070
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 323 с.
Рихтер В.А., Ефанов В.Н. 1977. Об одном из подходов к оценке естественной смертности рыбных популяций // Тр. АнтлантНИРО. Вып. 73. С.75–77.
Судаков Г.А., Власенко А.Д., Ходоревская Р.П. и др. 2011. Инструкции по сбору и первичной обработке материалов водных биоресурсов Каспийского бассейна и среды их обитания. Астрахань: Изд-во КаспНИРХ, 193 с.
Танасийчук Н.П. 1959. Лещ Северного Каспия (распределение, изменение возрастного состава, влияние промысла на состав популяции) // Тр. КаспНИРО. Т. 15. С. 3–37.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. М.: Изд-во АН СССР, 164 с.
Шибаев С.В., Голубкова Т.А., Рябчун В.А. 2012. Когортный анализ динамики численности леща (Аbramis brama L.) Вислинского (Калининградского) залива Балтийского моря // Изв. КГТУ. № 24. С. 95–102.
Bertalanffy L. 1964. Basic concepts in quantitative biology of metabolism // Helgoländ. Wiss. Meeresunter. V. 9. P. 5–37. https://doi.org/10.1007/BF01610024
Brooks E.N., Powers J.E., Cortés E. 2010. Analytical reference points for age-structured models: application to data-poor fisheries // ICES J. Mar. Sci. V. 67. № 1. P. 165–175. https://doi.org/10.1093/icesjms/fsp225
Choat J.H., Robertson D.R. 2002. Age-based studies on coral reef fishes // Coral reef fishes: dynamic and diversity in a complex ecosystem / Ed. Sale P.F. San Diego: Acad. Press. P. 57–80
Choat J., Axe L., Lou D. 1996. Growth and longevity in fishes of the family Scaridae // Mar. Ecol. Progr. Ser. V. 145. P. 33–41. https://doi.org/10.3354/meps145033
Clark W.G.W. 2002. F 35% revisited ten years later // N. Amer. J. Fish. Management. V. 22. P. 251–257. https://doi.org/10.1577/1548-8675(2002)022<0251:FRTYL> 2.0.CO;2
Coulson P.G., Potter I.C., Hall N.G. 2012. The biological characteristics of Scorpis aequipinnis (Kyphosidae), including relevant comparisons with those of other species and particularly of a heavily exploited congener // Fish. Res. V. 125–126. P. 272–282. https://doi.org/10.1016/j.fishres.2012.02.031
Froese R., Pauly D. (eds.). 2019. Fish Base. (www.fishbase.org. Version 12/2019)
Gerritsen H.D., McGrath D. 2007. Precision estimates and suggested sample sizes for length-frequency data // Fish. Bull. V. 106. P. 116–120.
Goodyear C.P. 1993. Spawning stock biomass per recruit in fisheries management: Foundation and current use // Can. Spec. Publ. Fish. Aquat. Sci. V. 120. P. 67–81.
Haddon M.J. 2011. Modelling and quantitative methods in fisheries. N.Y.: Chapman and Hall/CRC, 465 p. https://doi.org/10.1201/9781439894170.
Hewitt D.A., Hoenig J.M. 2005. Comparison of two approaches for estimating natural mortality based on longevity // Fish. Bull. V. 103. P. 433−437.
Hordyk A.R. 2019. LBSPR: Length-Based Spawning Potential Ratio. R package version 0.1.5. https://CRAN.R-project.org/package=LBSPR.
Hordyk A.R., Ono K., Sainsbury K.J. et al. 2015a. Some explorations of the life history ratios to describe length composition, spawning-per-recruit, and the spawning potential ratio // ICES J. Mar. Sci. V. 72. № 1. P. 204−216. https://doi.org/10.1093/icesjms/fst235
Hordyk A.R., Ono K., Valencia S.R. et al. 2015b. A novel length-based empirical estimation method of spawning potential ratio (SPR), and tests of its performance, for small-scale, data-poor fisheries // Ibid. V. 72. № 1. P. 217–231. https://doi.org/10.1093/icesjms/fsu004
Jensen A.L. 1996. Beverton and Holt life history invariants result from optimal trade-off of reproduction and survival // Can. J. Fish. Aquat. Sci. V. 53. P. 820−822. https://doi.org/10.1139/f95-233
Mace P., Sissenwine M. 1993. How much spawning is enough? Risk evaluation and biological reference points for fisheries management // Can. Spec. Publ. Fish. Aquat. Sci. V. 120. P. 101–118.
Maceina M.J., Pereira D.L. 2007. Recruitment // Analysis and interpretation of freshwater fisheries data / Eds. Guy C.S., Brown M.L. Maryland: Amer. Fish. Soc. P. 121–185. https://doi.org/10.47886/9781888569773.ch4.
Ogle D.H. 2013. FishR vignette – maturity schedules. (www.derekogle.com/fishR/examples/oldFishRVignettes/ Maturity.pdf)
Ogle D.H. 2016. Introductory fisheries analyses with R. Boca Raton: CRC Press; Taylor Andrancis Group, 337 p. https://doi.org/10.1201/9781315371986.
Ogle D.H., Wheeler P., Dinno A. 2021. FSA: Fisheries Stock Analysis. R package version (0.8.32. https:// github.com/droglenc/FSA).
Prince J.D., Hordyk A.R., Valencia S. R. et al. 2015a. Revisiting the concept of Beverton–Holt life-history invariants with the aim of informing data-poor fisheries assessment // ICES J. Mar. Sci. V. 72. № 1. P. 194– 203. https://doi.org/10.1093/icesjms/fsu011
Prince J. D., Victor S., Kloulchad V. et al. 2015b. Length based SPR assessment of eleven Indo-Pacific coral reef fish populations in Palau // Fish. Res. V. 171. P. 42–58. https://doi.org/10.1016/j.fishres.2017.12.012
Prince J.D., Lalavanua W., Tamanitoakula J. et al. 2019. Spawning potential surveys reveal an urgent need for effective management // Fish. Newsletter. V. 158. P. 28–36.
Restrepo V., Powers J. 1999. Precautionary control rules in US fisheries management: specification and performance // ICES J. Mar. Sci. V. 56. P. 846–852.
Roff D.A. 1984. The evolution of life history parameters in teleosts // Can. J. Fish. Aquat. Sci. V. 41. P. 989–1000.
Then A.Y., Honeig J.M., Hall N.G., Hewitt D.A. 2015. Evaluating the predictive performance of empirical estimators of natural mortality rate using information on over 200 fish species // ICES J. Mar. Sci. V.72. № 1. P. 82–92. https://doi.org/10.1093/icesjms/fsu136
Thorson J. 2019. FishLife: Predict life history parameters for any fish. R package version 2.0.0. (http://github.com/James-Thorson/FishLife).
Thorson J.T., Munch S.B., Cope J.M., Gao J. 2017. Predicting life history parameters for all fishes worldwide // Ecol. Appl. V. 27. № 8. P. 2262–2276. (http://onlinelibrary.wiley.com/doi/10.1002/eap.1606/full).
Walters C.J., Martell S.J.D. 2004. Fisheries ecology and management. Princeton: Princeton Univ. Press, 399 p.
Zhang C.I., Megrey B.A. 2006. A revised Alverson and Carney model for estimating the instantaneous rate of natural mortality // Trans. Amer. Fish. Soc. V. 135. № 3. P. 620−633. https://doi.org/10.1577/T04-173.1
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии