Вопросы ихтиологии, 2022, T. 62, № 4, стр. 422-439
Видовой состав икры и личинок рыб у Юго-Восточного Сахалина в динамичных условиях прибрежья
О. Н. Мухаметова 1, *, И. Н. Мухаметов 1
1 Сахалинский филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – СахНИРО
Южно-Сахалинск, Россия
* E-mail: olga.sakhniro@gmail.com
Поступила в редакцию 30.07.2021
После доработки 05.10.2021
Принята к публикации 09.10.2021
- EDN: IXGOCC
- DOI: 10.31857/S004287522204021X
Аннотация
Изучены особенности среды обитания и сезонные изменения видового состава и численности ихтиопланктона на четырёх участках у побережья Юго-Восточного Сахалина. Минимальные значения температуры воды отмечены в мае: от 2.2°С вблизи оз. Птичье до 5.5°С (в среднем) в северной части акватории; наибольший прогрев прибрежной зоны (в среднем до 13–17°С) приходился на август–октябрь. Солёность воды была минимальной в районе впадения рек Дудинка и Долинка (в среднем ~ 30‰), максимальной – в районе оз. Птичье (31.7‰). В ихтиопланктоне представлены икра и личинки 37 видов рыб из 14 семейств. На всех участках преобладают представители камбаловых (Pleuronectidae), их доля возрастает с юга на север с 38 до 71%. Высокие концентрации пелагической икры рыб (24.3–31.1 шт/м3 в среднем за полевой сезон) зарегистрированы только к северу от 47°30′ с.ш., южнее они не превышали 1.5–6.3 шт/м3. На северных участках максимальная численность икры и личинок рыб формировалась в мае–июне, на южном участке – в августе. Зависимость между численностью икры рыб и условиями среды отсутствовала или была слабо выражена. По результату факторного анализа сходные по срокам размножения и районам нереста виды были сгруппированы попарно – минтай Gadus chalcogrammus и палтусовидная камбала Hippoglossoides robustus, желтопёрая Limanda aspera и длиннорылая Myzopsetta punctatissima камбалы, звёздчатая Platichthys stellatus и желтополосая Pseudopleuronectes herzensteini камбалы.
Исследования ихтиопланктона важны для определения нерестовых запасов промысловых рыб, имеющих пелагическую икру (Авдеев, Овсянников, 2006; Овсянников, Пономарев, 2014), оценки эффективности их воспроизводства и понимания репродуктивного значения того или иного участка в условиях нарастающего антропогенного пресса (Архипов, 2015; Селифонова, 2016). Структура ихтиопланктона зависит от подходов и стратегии воспроизводства рыб (Azeiteiro et al., 2006), состав которых даже на одном участке может сильно меняться по сезонам и годам. Кроме того, на видовое разнообразие и количественные показатели ихтиопланктона в прибрежной зоне существенное влияние оказывают колебания температуры и солёности, активная ветровая деятельность, вызывающая волнение разной интенсивности и часто приводящая к образованию апвеллингов и даунвеллингов (Olivar, 1990; Johnson-Colegrove et al., 2015).
В силу высокой чувствительности икры и личинок рыб к изменениям условий среды и формирования на воздействие негативных факторов быстрого отклика в виде увеличения смертности, снижения видового разнообразия и численности (Климова, 2005), ихтиопланктонные исследования в прибрежной зоне остаются актуальными как в дальневосточном регионе (Соколовская и др., 2010; Федорец, 2010; Епур, Баланов, 2015; Саушкина, 2019), так и в морях европейской части России (Иванович, 2006; Карасева, 2013; Селифонова, 2016; Карасева и др., 2020). С этой точки зрения прибрежные воды Юго-Восточного Сахалина остаются слабо изученными. До последних лет изучение ихтиопланктона проводили преимущественно в лагунах и озёрах лагунного типа (Мухаметова, Баланов, 2013; Мухаметова, 2014; Moukhametova, 2016), в то время как на прилегающих участках моря такие работы носили эпизодический характер (Мухаметова, Мухаметов, 2013; Мухаметова, 2020а).
Цель работы – проанализировать сезонные и пространственные изменения структуры ихтиопланктона в прибрежье Юго-Восточного Сахалина в связи с динамикой параметров среды (течения, температура и солёность воды).
МАТЕРИАЛ И МЕТОДИКА
Материал собран с мая по октябрь–ноябрь в 2012, 2016 и 2019–2020 гг. в прибрежных водах Юго-Восточного Сахалина от 47°50′ до 48°20′ с.ш. на четырёх локальных полигонах вблизи мест впадения рек и проток озёр: 1 – р. Дудинка, 2 − р. Долинка, 3 − оз. Тунайча (зал. Мордвинова), 4 − оз. Птичье (рис. 1). В диапазоне изобат 5–20 м пробы отбирали с маломерного плавсредства ихтиопланктонной конусной сетью ИКС-50 (площадь входного отверстия 0.2 м2), облавливая слой от дна до поверхности (Расс, Казанова, 1966); в литоральной зоне через сеть проливали 100 л морской воды (Руководство …, 1983). Всего собрано и обработано 335 проб ихтиопланктона (табл. 1).
Рис. 1.
Район проведения работ и схемы отбора проб в 2012–2020 гг.: (⚫) – места впадения рек Дудинка (участок 1) и Долинка (2), проток оз. Тунайча (3) и оз. Птичье (4); (⚪) – гидрометеорологические станции (ГМС), (‒ ‒) – изобаты. Здесь и на рис. 3−5: (⚫) – точки отбора проб на участках 1–4.
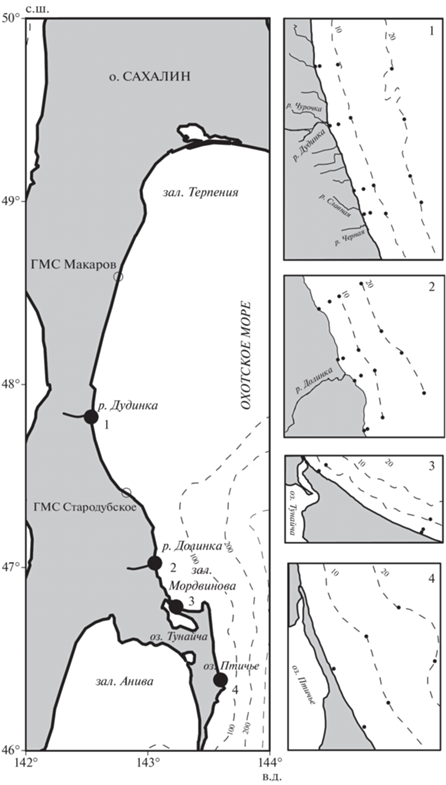
Таблица 1.
Число проб ихтиопланктона, собранных в четырёх районах морской прибрежной зоны Юго-Восточного Сахалина
| № | Район | Год | Глубины отбора проб, м | Месяц | Итого | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| V | VI | VII | VIII | IX | X | XI | |||||
| 1 | Р. Дудинка | 2020 | 0, 5, 10, 20 | 24 | 24 | 24 | 8 | 8 | 16 | – | 104 |
| 2 | Р. Долинка | 2019 | 0, 5, 10, 20 | 32 | 24 | 24 | 8 | 8 | 16 | – | 112 |
| 3 | Оз. Тунайча | 2016 | 3, 5, 10 | 12 | – | 12 | 6 | – | – | – | 30 |
| 4 | Оз. Птичье | 2012 | 5, 10, 15 | 14 | 12 | 12 | 12 | 14 | 12 | 13 | 89 |
| Всего | 82 | 60 | 72 | 34 | 30 | 44 | 13 | 335 | |||
Камеральную обработку проб осуществляли под бинокуляром Olympus SZX10 (Япония), оснащённом нижней и верхней подсветкой и окуляр-микрометром. Икру и личинок измеряли с точностью до 0.1 мм. Для видовой идентификации использовали ключи и описания, приводимые в атласах и определителях ихтиопланктона дальневосточных морей и сопредельных акваторий (An atlas…, 1988; Matarese et al., 1989; Григорьев, 2007; Соколовский, Соколовская, 2008). Индекс сходства (S) рассчитывали по формуле Сёренсена (Одум, 1986), используемой в частности для сравнения видовых составов ихтиоценов (Терехов, 1994): S = 2c/(a + b), где a, b – число видов в сравниваемых выборках, с – число общих видов.
Список видов приведён в соответствии с каталогом рыб Эшмайера (Fricke et al., 2021). Зоогеографическая и биотопическая характеристика видов дана по “Каталогу позвоночных …” (2000). Для оценки статистических различий применяли критерий Стьюдента. Факторный анализ выполнен в программе Statistica 10 методом главных компонент с вращением переменных (Боровиков, 2003; Стукач, 2011; StatSoft, 2012). Роль факторов устанавливали по собственным значениям, вкладу в общую дисперсию и точке замедления падения собственных значений на графике Кэттеля (Cattell, 1966; Самсонова, 2005). Для характеристики условий среды использовали данные 2021 г. (направление и скорость ветра, температура поверхностного слоя воды) гидрометеорологических станций (ГМС) Стародубское и Макаров (https://rp5.ru) (рис. 1), а также результаты измерений многопараметрическим зондом YSI-85 (США) температуры и солёности по всей толще воды с интервалом 1 м на каждой ихтиопланктонной станции при проведении съёмок. Дополнительно использовали данные из работ Шевченко с соавторами (2018, 2020).
РЕЗУЛЬТАТЫ
Условия среды. Значительная протяжённость района исследований предполагает существенные различия синоптических и гидрологических процессов на разных участках прибрежной акватории. Подтверждением этому являются результаты анализа ветровой деятельности на двух ГМС Юго-Восточного Сахалина. На ГМС Макаров в период гидрологической (биологической) весны (май–июнь) (Пищальник, Бобков, 2000), характеризующейся максимальной концентрацией ихтиопланктона, высокую повторяемость имели ветры противоположных направлений – северные (23.0–28.5%) и южные (19–28%). Доля штилевой погоды достигала 10–14 (в среднем 12.3)%. В июле–августе безветренная погода составляла 20–50% времени. Средняя скорость ветра за период май–ноябрь изменялась по годам от 1.4 до 1.8 м/с. На ГМС Стародубское преобладали нагонные восточные (21%) и южные (19%) ветры с более высокими скоростями – 3.8–4.3 м/с. Доля безветренной погоды не превышала 0.9–1.7 (в среднем 1.4)%. В южной части района исследований в летний период высокую повторяемость имели отжимные южные и юго-западные ветры, приводившие к образованию апвеллингов (Шевченко и др., 2018).
В сезонном прогреве поверхности моря в районе г. Макаров и с. Стародубское внутри- и межгодовые статистически значимые различия не выявлены. В мае–октябре 2019–2020 гг. средние значения температуры поверхности моря в районе г. Макаров изменялись от 12.0 ± 2.9 до 12.3 ± ± 3.2°С, вблизи с. Стародубское – от 12.2 ± 2.8 до 12.4 ± 3.2°С. Наибольшие вариации суточных значений в пределах каждого месяца наблюдались с мая по июль (до 5.5°С) и в октябре–ноябре (до 6.7°С). Стабилизация температуры была отмечена в период максимального прогрева (август–сентябрь) – размах колебаний в основном не превышал 1.5–2.8°С, редко достигая 4°С (рис. 2). На юге района среднемноголетняя температура поверхности моря была на ~ 0.5–1.0°С ниже, солёность, напротив, на 0.5‰ выше, чем в северной части акватории (Шевченко и др., 2020). На глубине 20 м различия термогалинных характеристик сглаживались. Для июня–августа были характерны существенные колебания температуры воды – от отрицательных значений до 13–14°С (Шевченко и др., 2018).
Рис. 2.
Температура поверхности моря в районе г. Макаров и с. Стародубское по данным гидрометеорологических станций 2021 г. (https://rp5.ru.): (1, 3) – г. Макаров, соответственно 2019 и 2020 гг., (2, 4) – с. Стародубское, 2019 и 2020 гг.

По результатам наших измерений в мае наиболее высокие значения температуры воды отмечены в северной части акватории (участки 1 и 2) – в среднем до 5.5°С, минимальные – 2.2°С – на юге вблизи оз. Птичье (рис. 3). Наибольший прогрев прибрежной зоны приходился на август–октябрь: на севере акватории (участки 1 и 2) – в среднем до 13°С, вблизи оз. Тунайча – до 17°С и вблизи оз. Птичье 15°С. Осреднённые для периода май–август значения температуры были наименьшими вблизи р. Долинка, наибольшими – вблизи оз. Тунайча (8.7 против 11.4°С); вблизи р. Дудинка и оз. Птичье средние за период значения составили соответственно 9.5 и 8.6°С. Минимальные значения солёности, определяемые паводками и береговым стоком в результате таяния льдов, на всех участках, кроме 2-го (р. Долинка), были отмечены в мае. Рост данного параметра происходил к августу. В осенние месяцы в результате активизации циклонической деятельности и увеличения дождевого стока наблюдалось снижение солёности на участках 1–3. На юге (участок 4) береговой сток был минимальным, и определяющее значение имели морские воды. Осреднённая для периода май–октябрь солёность имела минимальные значения на участках 1 (29.7‰) и 3 (30.3‰), промежуточное – на участке 2 (31.2‰), максимум – на участке 4 (31.7‰).
Рис. 3.
Температура (а) и солёность (б) воды на исследованных участках у юго-восточного побережья о‑ва Сахалин по данным съёмок 2012–2020 гг.: (‒ ‒) – участок 1, (---) – 2, (—) – 3, (⚫) – 4.

Видовой состав и сезонные изменения ихтиопланктона. Ихтиопланктон прибрежных вод Юго-Восточного Сахалина представлен икрой и личинками 37 видов рыб из 14 семейств (табл. 2)11. Наибольшее число видов зарегистрировано в районе оз. Птичье (21) и вблизи места впадения р. Долинка (20), наименьшее − в зал. Мордвинова (11).
Таблица 2.
Видовой состав и численность икры (шт/м3) и личинок (экз/м3) на четырёх участках морской прибрежной зоны Юго-Восточного Сахалина, май–ноябрь 2012–2020 гг.
| № | Таксон | Категория вида | Район | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| р. Дудинка | р. Долинка | оз. Тунайча | оз. Птичье | |||||||
| Икра | Личинки | Икра | Личинки | Икра | Личинки | Икра | Личинки | |||
| I | Clupeidae | |||||||||
| 1 | Clupea pallasii Valenciennes, 1847 – тихоокеанская сельдь | Н/АБ | $\frac{{120.00}}{{1.250}}$ | $\frac{{0.50}}{{0.005}}$ | $\frac{{2590.00}}{{23.195}}$ | $\frac{{0.05}}{{0.002}}$ | ||||
| II | Engraulidae | |||||||||
| 2 | Engraulis japonicus Temminck et Schlegel, 1846 – японский анчоус | Н/СТПА | $\frac{{1.67}}{{0.956}}$ | $\frac{{27.14}}{{0.554}}$ | $\frac{{1.67}}{{0.045}}$ | |||||
| III | Osmeridae | |||||||||
| 3 | Hypomesus japonicus (Brevoort, 1856) – морская малоротая корюшка | Н/ШБПА | $\frac{{1.11}}{{0.012}}$ | |||||||
| 4 | Mallotus villosus (Müller 1776) – дальневосточная мойва | Н/АБ | $\frac{{0.01}}{{ < {\kern 1pt} 0.001}}$ | |||||||
| IV | Gadidae | |||||||||
| 5 | Eleginus gracilis (Tilesius,1810) – дальневосточная навага | Э/АБ | $\frac{{0.20}}{{0.002}}$ | |||||||
| 6 | Gadus chalcogrammus Pallas,1814 – минтай | Э/ШБТО | $\frac{{900.00}}{{11.321}}$ | $\frac{{5.25}}{{0.234}}$ | $\frac{{0.25}}{{0.012}}$ | $\frac{{0.25}}{{0.002}}$ | $\frac{{0.26}}{{0.006}}$ | |||
| V | Cottidae | |||||||||
| 7 | Bero elegans (Steindachner, 1881) – элегантный бычок | СЛ/НБПА | $\frac{{1.00}}{{0.010}}$ | |||||||
| 8 | Gymnocanthus herzensteini Jordan et Starks, 1904 – шлемоносец Герценштейна | Э/ШБПА | – | $\frac{{0.63}}{{0.007}}$ | ||||||
| 9 | Gymnocanthus pistilliger (Pallas, 1814) – нитчатый шлемоносец | Э/АБ | $\frac{{0.25}}{{0.002}}$ | $\frac{{0.19}}{{0.002}}$ | ||||||
| 10 | Hemilepidotus papilio (Bean, 1880) – бычок–бабочка | Э/ШБПА | $\frac{{0.50}}{{0.006}}$ | |||||||
| 11 | Megalocottus platycephalus (Pallas, 1814) – дальневосточная широколобка | СЛ/АБ | $\frac{{0.50}}{{0.027}}$ | |||||||
| 12 | Myoxocephalus stelleri Tilesius, 1811 – мраморный керчак (керчак Стеллера) | СЛ/АБ | $\frac{{0.50}}{{0.006}}$ | |||||||
| 13 | Myoxocephalus sp. – керчак | СЛ/НБПА | $\frac{{1.00}}{{0.021}}$ | |||||||
| VI | Hemitripteridae | |||||||||
| 14 | Blepsias cirrhosus (Pallas, 1814) – усатый бычок | $\frac{{0.50}}{{0.017}}$ | ||||||||
| VII | Hexagrammidae | |||||||||
| 15 | Hexagrammos octogrammus (Pallas, 1814) – восьмилинейный терпуг | СЛ/ШБТО | $\frac{{0.50}}{{0.007}}$ | |||||||
| 16 | Hexagrammos stelleri Tilesius, 1810 – пятнистый терпуг | СЛ/ШБТО | $\frac{{0.50}}{{0.006}}$ | |||||||
| VIII | Agonidae | |||||||||
| 17 | Tilesina gibbosa Schmidt, 1904 – горбатая лисичка | СЛ/НБПА | $\frac{{0.22}}{{0.002}}$ | |||||||
| IX | Liparidae | |||||||||
| 18 | Liparis latifrons Schmidt, 1950 – продольно-полосатый липарис | Э/ШБТО | $\frac{{0.25}}{{0.002}}$ | |||||||
| X | Bathymasteridae | |||||||||
| 19 | Bathymaster derjugini Lindberg, 1930 – батимастер Дерюгина | СЛ/НБПА | $\frac{{0.20}}{{0.002}}$ | |||||||
| XI | Stichaeidae | |||||||||
| 20 | Alectrias benjamini Jordan et Snyder, 1902 – зеленобрюхий морской петушок | СЛ/НБПА | $\frac{{0.50}}{{0.007}}$ | |||||||
| 21 | Chirolophis snyderi (Taranetz, 1938) – северная мохоголовая собачка | СЛ/ШБПА | $\frac{{0.50}}{{0.006}}$ | |||||||
| 22 | Stichaeus nozawae Jordan et Snyder, 1902 – стихей Нозавы | СЛ/НБПА | $\frac{{0.50}}{{0.017}}$ | |||||||
| XI | Pholidae | |||||||||
| 23 | Rhodymenichthys dolichogaster (Pallas, 1814) – длиннобрюхий маслюк | Л/АБ | $\frac{{0.50}}{{0.006}}$ | |||||||
| XIII | Ammodytidae | |||||||||
| 24 | Ammodytes hexapterus Pallas, 1814 – тихоокеанская песчанка | Э/АБ | $\frac{{0.50}}{{0.007}}$ | |||||||
| XIV | Pleuronectidae | |||||||||
| 25 | Acanthopsetta nadeshnyi Schmidt, 1904 – колючая камбала Надёжного | Э/ШБПА | $\frac{{0.25}}{{0.002}}$ | |||||||
| 26 | Glyptocephalus stelleri (Schmidt, 1904) – дальневосточная длинная камбала | Э/ШБПА | $\frac{{2.00}}{{0.115}}$ | $\frac{{0.50}}{{0.005}}$ | $\frac{{1.00}}{{0.026}}$ | |||||
| 27 | Hippoglossoides robustus Gill et Townsend, 1897 – северная палтусовидная камбала | Э /АБ | $\frac{{115.83}}{{3.684}}$ | $\frac{{4.00}}{{0.146}}$ | $\frac{{1.25}}{{0.079}}$ | $\frac{{1.00}}{{0.030}}$ | $\frac{{3.50}}{{0.212}}$ | $\frac{{0.85}}{{0.057}}$ | ||
| 28 | Limanda aspera (Pallas, 1814) – желтопёрая камбала | Э/ШБПА | $\frac{{18.50}}{{1.538}}$ | $\frac{{15.00}}{{0.442}}$ | $\frac{{1.67}}{{0.068}}$ | $\frac{{1.11}}{{0.017}}$ | $\frac{{1.15}}{{0.117}}$ | $\frac{{1.00}}{{0.034}}$ | ||
| 29 | Limanda sakhalinensis Hubbs, 1915 – сахалинская лиманда | Э/ШБПА | $\frac{{7.50}}{{0.296}}$ | $\frac{{1.00}}{{0.094}}$ | $\frac{{0.10}}{{0.003}}$ | $\frac{{0.94}}{{0.018}}$ | $\frac{{0.33}}{{0.004}}$ | |||
| 30 | Liopsetta pinnifasciata (Kner, 1870) – полосатая камбала | СЛ/ШБПА | $\frac{{0.25}}{{0.005}}$ | $\frac{{0.24}}{{0.004}}$ | ||||||
| 31 | Myzopsetta punctatissima (Steindachner, 1879) – длиннорылая камбала | СЛ/НБПА | $\frac{{79.00}}{{3.707}}$ | $\frac{{6.00}}{{0.216}}$ | $\frac{{5.00}}{{0.149}}$ | $\frac{{52.00}}{{5.005}}$ | $\frac{{0.10}}{{0.003}}$ | $\frac{{2.39}}{{0.085}}$ | ||
| 32 | Myzopsetta proboscidea (Gilbert, 1896) – хоботная камбала | СЛ/ВБПА | $\frac{{11.50}}{{0.305}}$ | $\frac{{0.25}}{{0.002}}$ | $\frac{{7.27}}{{0.119}}$ | |||||
| 33 | Platichthys stellatus (Pallas, 1787) – звёздчатая камбала | СЛ /АБ | $\frac{{3.00}}{{0.203}}$ | $\frac{{1.00}}{{0.038}}$ | $\frac{{0.50}}{{0.004}}$ | $\frac{{0.50}}{{0.030}}$ | $\frac{{4.58}}{{0.078}}$ | $\frac{{0.50}}{{0.006}}$ | ||
| 34 | Pleuronectes quadrituberculatus Pallas, 1814 – четырёхбугорчатая камбала | Э/ШБТО | $\frac{{8.00}}{{0.183}}$ | $\frac{{0.20}}{{0.002}}$ | $\frac{{0.50}}{{0.006}}$ | |||||
| 35 | Pseudopleuronectes herzensteini (Jordan et Snyder, 1901) – желтополосая камбала | СЛ/НБПА | $\frac{{5.50}}{{0.195}}$ | $\frac{{0.50}}{{0.012}}$ | $\frac{{1.00}}{{0.027}}$ | $\frac{{0.20}}{{0.033}}$ | $\frac{{0.56}}{{0.006}}$ | |||
| 36 | Pseudopleuronectes obscurus (Herzenstein, 1890) – тёмная камбала | СЛ/НБПА | $\frac{{4.00}}{{0.058}}$ | $\frac{{1.00}}{{0.009}}$ | $\frac{{0.56}}{{0.006}}$ | |||||
| 37 | Pseudopleuronectes schrenki (Schmidt, 1904) – камбала Шренка | СЛ/НБПА | $\frac{{8.00}}{{0.115}}$ | $\frac{{1.00}}{{0.014}}$ | $\frac{{0.83}}{{0.007}}$ | $\frac{{3.00}}{{0.036}}$ | ||||
| Всего | 17 | 20 | 11 | 21 | ||||||
Примечание. Над чертой – максимальная численность, под чертой – среднее значение за весь период исследований. Категория вида: до черты – биотопическая (Н – неритический, Л – литоральный, СЛ – сублиторальный, ЭЛ – элиторальный), после черты – зоогеографическая (АБ – арктическо-бореальный, ВБПА – высокобореальный приазиатский, ШБПА – широкобореальный приазиатский, ШБТО – широкобореальный тихоокеанский, НБПА – низкобореальный приазиатский, СТПА – субтропический приазиатский).
На всех исследованных участках прибрежной зоны Юго-Восточного Сахалина отмечено близкое соотношение различных зоогеографических группировок. Основу видового состава формировали приазиатские и тихоокеанские широкобореальные виды, доля которых в сумме составила 40.5% общего числа видов. Кроме того, высокий вклад вносили теплолюбивые низкобореальные и субтропические виды (суммарная доля > 30%), что сближает прибрежный ихтиопланктонный комплекс Юго-Восточного Сахалина с зал. Анива, где доля видов этих групп составляет 33–40% (Мухаметова, Мухаметов, 2013). Наибольшее число теплолюбивых видов (54.5%) было отмечено вблизи оз. Тунайча. Доля арктическо-бореальных и высокобореальных видов была близка на всех участках – 24–30%. Число низкобореальных и субтропических видов в ихтиопланктоне Юго-Восточного Сахалина (11) сопоставимо с таковым Татарского пролива (10–12) (Moukhametova, 2014; Шелехов и др., 2020). Закономерное расширение видового состава этих групп происходит в южных районах российской части Японского моря – до 37 (Федорец, 2010). Из мигрантов общим для Юго-Восточного Сахалина, зал. Анива и Татарского пролива является японский анчоус Engraulis japonicus, из резидентных представителей – стихей Нозавы Stichaeus nozawae, усатый бычок Blepsias cirrhosus, длиннорылая Myzopsetta punctatissima и тёмная Pseudopleuronectes obscurus камбалы и некоторые другие виды.
Из биотопических группировок в составе ихтиопланктона на всей исследованной акватории Юго-Восточного Сахалина наиболее обширно была представлена сублиторальная (43–55% общего числа видов). В северной части района, вблизи рек Долинка и Дудинка, отмечено значительное увеличение элиторальных видов – до 45–47%, что характерно для северных районов Восточного Сахалина и связано с доминированием этой группы в ихтиоцене, заносом икры и личинок с более глубоководных участков и активным смещением нерестующих особей от бóльших глубин к меньшим по мере прогрева прибрежных акваторий (Ким Сен Ток, 2014; Мухаметов, Мухаметова, 2017).
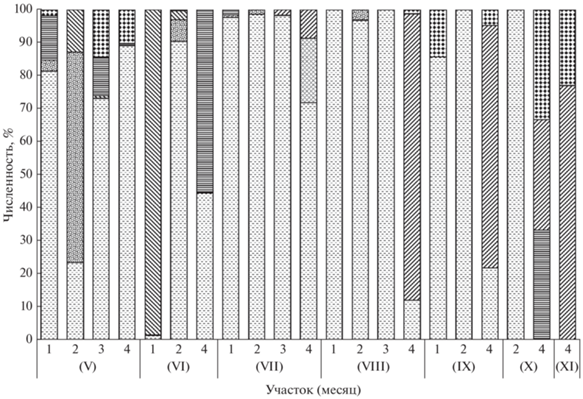
Максимальное сходство видового состава ихтиопланктона отмечено для районов впадения рек Долинка и Дудинка – 87%. На всех участках преобладали представители камбаловых (Pleuronectidae), число видов которых варьировало от 6 до 13, их доля составляла от 38 (оз. Птичье) до 71% (р. Дудинка). С юга на север в ихтиопланктоне был отмечен рост видового разнообразия камбаловых, что обусловлено максимальным развитием шельфа (наличием трёх зон шельфа и значительной удалённости его края от береговой линии) в районе зал. Терпения, увеличением числа представителей этого семейства в ихтиоцене данного района и формированием благоприятных условий для нагула, нереста и последующего развития икры и личинок в замкнутых циркуляциях (Тарасюк, Пушников, 1982; Ким Сен Ток, Шепелева, 2001; Ким Сен Ток, 2002). Икра и личинки шести массовых видов камбал – северной палтусовидной Hippoglossoides robustus, желтопёрой Limanda aspera, сахалинской Limanda sakhalinensis, длиннорылой, звёздчатой Platichthys stellatus и желтополосой Pseudopleuronectes herzensteini – встречались на всех участках. Доля представителей рогатковых (Cottidae) на разных участках составляла 9–14%. По численности повсеместно превалировали камбаловые, за исключением отдельных периодов, когда в число доминантов попадали тресковые (Gadidae), сельдевые (Clupeidae), анчоусовые (Engraulidae) (рис. 4).
Рис. 4.
Численность доминирующих семейств рыб в ихтиопланктоне исследованных участков у юго-восточного
побережья о-ва Сахалин в разные сезоны 2012–2020 гг.: ( ) – Pleuronectidae, (
) – Pleuronectidae, ( ) – Gadidae, (
) – Gadidae, ( ) – Clupeidae, (
) – Clupeidae, ( ) – Cottidae, (
) – Cottidae, ( ) – Osmeridae, (
) – Osmeridae, ( ) – Engraulidae, (
) – Engraulidae, ( ) – прочие.
) – прочие.
Высокая концентрация икры пелагофилов зарегистрирована только севернее 47°30′ с.ш. (в районе впадения рек Дудинка и Долинка), южнее значения этого показателя были существенно ниже (24.3–31.1 против 1.5–6.3 шт/м3 в среднем за период исследований). Время образования наиболее плотных скоплений на севере по сравнению с югом смещено с гидрологической весны (май–июнь) на гидрологическое лето (август). В районе впадения р. Долинка максимальная концентрация ихтиопланктона была отмечена в июне (рис. 5). Локальный кратковременный пик численности обеспечивали личинки сельди (до 300 экз/м3) в I декаде июня. Увеличение численности личинок сельди было обусловлено ростом в присахалинских водах нерестового запаса данного вида (Состояние промысловых ресурсов …, 2020). В районе впадения р. Дудинка личинок сельди находили только в мае; их среднемесячная численность не превышала 0.02 экз/м3, что может быть связано со сложностью регистрации максимумов из-за быстрого перераспределения личинок по обширной морской акватории (Гриценко, Шилин, 1979). Икру сельди на данном участке отмечали как в мае (1.3 шт/м3), так и в июне (15 шт/м3).
Рис. 5.
Сезонная динамика численности ихтиопланктона на исследованных участках. у юго-восточного побережья о‑ва Сахалин в 2012–2020 гг.: (—) – участок 1, (···) – 2, (⚫) – 3, (---) – 4.
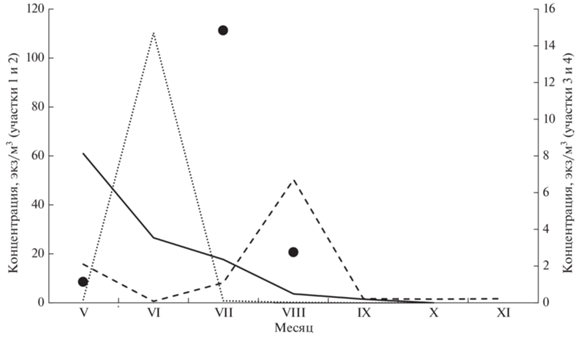
На севере района (р. Дудинка) повышенные значения концентрации ихтиопланктона приходились на май. Основу численности формировали типичные для гидрологической весны пелагические формы – икра минтая (62% суммарной численности, 36 шт/м3) и северной палтусовидной камбалы (21%, 12.5 шт/м3), что сближало данный участок с водами Северо-Восточного Сахалина (Мухаметов, Мухаметова, 2017). Вблизи р. Долинка в мае икра минтая и северной палтусовидной камбалы также входила в состав ихтиопланктона, но соотношение этих видов в уловах было противоположным – соответственно 2.5 и 55%; средняя численность была значительно ниже, составляя соответственно 0.26 и 0.01 шт/м3. Рост численности икры и личинок минтая и палтусовидной камбалы в северной части района исследований, вероятно, был связан с особенностями динамики вод и увеличением плотности икры в районах основного воспроизводства минтая (Шунтов и др., 1993), находящихся в зал. Терпения, если принимать его границы не по лоции (Лоция Охотского моря …, 1998), а по строению береговой линии (Микишин, 1991), и севернее. В последующие периоды численность ихтиопланктона на участках 1 и 2 снижалась, достигая минимума в осенние месяцы. В летние месяцы основу численности ихтиопланктона формировала икра разных видов камбал. В районе р. Дудинка в июле был отмечен рост численности икры длиннорылой камбалы (до 72%), в августе–сентябре – желтопёрой камбалы (до 75–92%). Вблизи р. Долинка в июле преобладала икра сахалинской камбалы (66%), в августе–сентябре – дальневосточной длинной камбалы Glyptocephalus stelleri (67–86%), в октябре – желтопёрой камбалы (100%).
В мае–июне как вблизи оз. Тунайча, так и вблизи оз. Птичье по численности доминировала икра камбал с весенним типом нереста. В зал. Мордвинова 70% суммарной численности приходилось на икру северной палтусовидной камбалы. Вблизи оз. Птичье доля икры этого вида снижалась до 24%, но до 44% возрастала доля икры звёздчатой камбалы. Смена доминантов была связана с сужением в районе оз. Птичье морского шельфа, пригодного для икрометания палтусовидной камбалы (Тарасюк, Пушников, 1982), и расширением сублиторальных нерестилищ, используемых звёздчатой камбалой, за счёт акватории оз. Птичье, где проходил её основной нерест (Мухаметова, 2014). Увеличение численности ихтиопланктона на юге района происходило позже. Значения его концентрации даже в периоды максимумов были ниже, чем на севере. Вблизи оз. Тунайча пик численности ихтиопланктона (15.4 экз/м3) приходился на июль. Рост численности обеспечивала икра длиннорылой камбалы (14.8 шт/м3), составляя 96% суммарной величины. В августе при доминировании икры этого же вида (90% суммарной численности), её концентрация сократилась до 4 шт/м3. Вблизи оз. Птичье небольшое увеличение концентрации ихтиопланктона (до 7.5 экз/м3) было зарегистрировано в августе. Почти 85% суммарной величины (6.7 шт/м3) приходилось на икру мигранта – японского анчоуса, в то время как доля икры и личинок резидентных видов сильно снизилась. Личинки анчоуса доминировали в сентябре (73%) и в ноябре (77%). Суммарная численность ихтиопланктона с сентября по ноябрь держалась на уровне 0.25–0.32 экз/м3.
Факторный анализ. Для выяснения основных причин, влияющих на численность икры в ихтиопланктоне, выполнен факторный анализ. Для анализа были выбраны четыре независимые (месяц, участок, температура и солёность) и шесть зависимых переменных по числу массовых видов ихтиопланктона (табл. 3). Температура воды, несмотря на существенные внутримесячные колебания, демонстрирует зависимость средней степени от периода исследований (r = 0.54). Солёность слабо зависит от региональных особенностей (r = 0.38), определяющихся объёмом и направлением переноса пресноводного стока, течениями, сгонно-нагонными явлениями. Связь между численностью икры рыб и условиями среды (температура, солёность) отсутствует или слабо выражена (r ≤ 0.5); небольшая величина коэффициента корреляции, возможно, обусловлена чрезвычайно изменчивыми условиями среды. Проникающие в прибрежье морские воды быстро смешиваются с опреснёнными прибрежными и береговым стоком, в результате чего связи между температурой, солёностью и численностью икры рыб могут ослабевать.
Таблица 3.
Корреляционная матрица для икры массовых видов рыб в ихтиопланктоне прибрежной зоны Юго-Восточного Сахалина
| Переменная | Переменная | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| независимая | зависимая | |||||||||
| месяц | участок | T | S | 1 | 2 | 3 | 4 | 5 | 6 | |
| Месяц | 1.00 | 0.22 | 0.54 | 0 | –0.22 | –0.26 | –0.06 | –0.08 | –0.38 | –0.15 |
| Участок | 0.22 | 1.00 | –0.05 | 0.38 | –0.21 | –0.21 | –0.43 | –0.24 | –0.12 | –0.23 |
| T | 0.54 | –0.05 | 1.00 | 0.03 | –0.24 | –0.27 | 0.23 | 0.33 | –0.34 | –0.06 |
| S | 0 | 0.38 | 0.03 | 1.00 | –0.49 | –0.50 | –0.17 | –0.35 | –0.21 | –0.08 |
| 1 | –0.22 | –0.21 | –0.24 | –0.49 | 1.00 | 1.00 | –0.08 | –0.07 | 0.09 | –0.03 |
| 2 | –0.26 | –0.21 | –0.27 | –0.50 | 1.00 | 1.00 | –0.10 | –0.08 | 0.09 | –0.06 |
| 3 | –0.06 | –0.43 | 0.23 | –0.17 | –0.08 | –0.10 | 1.00 | 0.37 | 0.10 | 0.34 |
| 4 | –0.08 | –0.24 | 0.33 | –0.35 | –0.07 | –0.08 | 0.37 | 1.00 | 0.10 | 0.08 |
| 5 | –0.38 | –0.12 | –0.34 | –0.21 | 0.09 | 0.09 | 0.10 | 0.10 | 1.00 | 0.50 |
| 6 | –0.15 | –0.23 | –0.06 | –0.08 | –0.03 | –0.06 | 0.34 | 0.08 | 0.50 | 1.00 |
Примечание. Здесь и в табл. 5: Т – температура поверхности моря, S – солёность; 1 – Gadus chalcogrammus, 2 – Hippoglossoides robustus, 3 – Limanda aspera, 4 – Myzopsetta punctatissima, 5 – Platichthys stellatus, 6 – Pseudopleuronectes herzensteini.
При оценке влияния факторов установлена ведущая роль четырёх из них. Первые три фактора имеют значения > 1 и объясняют 67% дисперсии (табл. 4). Точка замедления падения собственных значений на графике Кэттеля соответствует фактору 4.
Таблица 4.
Результаты факторного анализа
| Фактор | Собственное значение | Общая дисперсия, % |
|---|---|---|
| 1 | 2.828 | 28.282 |
| 2 | 2.130 | 21.304 |
| 3 | 1.737 | 17.369 |
| 4 | 0.896 | 8.960 |
| 5 | 0.835 | 8.346 |
| 6 | 0.555 | 5.552 |
| 7 | 0.455 | 4.552 |
| 8 | 0.349 | 3.493 |
| 9 | 0.212 | 2.116 |
| 10 | 0.003 | 0.026 |
В факторе 1 высокий модуль имеют факторные нагрузки для переменных, характеризующих численность икры минтая (0.98) и северной палтусовидной камбалы (0.97), которые являются основными компонентами весеннего ихтиопланктонного комплекса (табл. 5). В факторе 2 выделяется региональная составляющая (0.94), в факторе 3 – сезонная (0.95). В факторе 4 высокий модуль отмечен для икры желтополосой камбалы (0.95). Для остальных переменных значения факторных нагрузок также достаточно высокие, что указывает на сложные взаимодействия в прибрежном ихтиопланктонном комплексе. Его структуру в основном определяют биологические особенности массовых видов. У Юго-Восточного Сахалина к ним относятся северная палтусовидная камбала и минтай, весной дающие максимальную численность икры. Численность икры остальных видов рыб, в том числе прибрежных камбал, которая, казалось бы, должна быть структурообразующей в ихтиопланктонном комплексе, играет меньшую роль и значима только в четвёртом и последующих факторах (в табл. 5 не приведены).
Таблица 5.
Матрица факторных нагрузок после вращения
| Переменная | Фактор | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| Месяц | 0.1467 | –0.1099 | –0.9240 | 0.0529 |
| Участок | 0.1289 | –0.9416 | –0.1026 | 0.0983 |
| T | 0.1473 | 0.0408 | –0.2957 | 0.0185 |
| S | 0.3693 | –0.1811 | 0.0660 | 0.0238 |
| 1 | –0.9801 | 0.0724 | 0.0676 | 0.0090 |
| 2 | –0.9707 | 0.0715 | 0.1020 | 0.0338 |
| 3 | 0.0670 | 0.2117 | 0.0255 | –0.1651 |
| 4 | 0.0625 | 0.0922 | 0.0616 | –0.0163 |
| 5 | –0.0363 | 0.0274 | 0.1685 | –0.2667 |
| 6 | 0.0388 | 0.0968 | 0.0472 | –0.9480 |
| Дисперсия | 2.1103 | 1.0069 | 1.0062 | 1.0120 |
| Доля дисперсии | 0.2110 | 0.1007 | 0.1006 | 0.1012 |
Немаловажное значение имеет географическое положение полигона и его биотопические особенности, влияющие на состав видов рыб, которые тяготеют в период нереста к определённым глубинам и грунтам и отличаются сезонностью икрометания. Результатом анализа сложных взаимодействий факторов стала попарная группировка сходных по биологии видов и отражение связи температуры с периодом исследований и солёности с месторасположением полигона (рис. 6).
ОБСУЖДЕНИЕ
Синоптическая ситуация на ГМС Стародубское в весенние и летние месяцы 2012–2020 гг. отличалась от среднемноголетних данных (Хузеева, Като, 2011) меньшей повторяемостью ветров юго-западного направления (12 против 40–50%) и большей долей нагонных ветров восточного направления (20–34 против 10–20%) и южного направления (16–18 против 7–9%). На ГМС Макаров было отмечено увеличение доли ветров северного направления весной и западного осенью, тогда как в летний период повторяемость ветров разных румбов была близка к среднемноголетней. Низкая доля безветренной погоды на участках 2 и 3 (ГМС Стародубское) была обусловлена прохождением циклонов, выходящих со стороны Японского моря весной, летом и осенью, тогда как участки 1 и 4 находились за пределами их траекторий (Шевченко и др., 1994).
Прибрежная зона Юго-Восточного Сахалина весной и летом характеризуется максимальным для западной части Охотского моря прогревом. В период исследований локальные термогалинные характеристики на всех участках соответствовали типовой ситуации. Накопление более прогретых опреснённых вод в зал. Мордвинова (Шевченко и др., 2020), дополняемых стоком оз. Тунайча, обеспечило минимальные значения солёности и более высокую температуру на участке 3. Увеличение температуры и снижение солёности на севере в районе р. Дудинка было вызвано действием движущихся с севера вод, опресняемых р. Поронай. Их сток усиливался в результате увеличения повторяемости северных ветров. Следствием наибольшего опреснения морской акватории вблизи оз. Тунайча могло стать снижение видового разнообразия ихтиопланктона, достигающего максимума на юге. На состояние ихтиопланктона участков 2 и 3 в большей степени должен был оказывать влияние перенос икры и личинок с юга и востока с преобладающими ветрами и с севера с преобладающими течениями (Шевченко и др., 2020). Опреснение не затрагивало только южный участок вблизи оз. Птичье с узким шельфом и наиболее выраженным действием холодных морских вод с высокой солёностью (рис. 3). Сложная гидродинамика, включающая ослабление в летний период Восточно-Сахалинского течения, преобладание северного движения наносов, высокую повторяемость юго-восточных течений и наличие разнонаправленных вихрей на свале глубин (Радченко и др., 2002; Горбунов и др., 2010; Шевченко и др., 2018; Дзен и др., 2021), могла приводить к обогащению района икрой и личинками видов рыб с прилежащих акваторий.
В северной части района (участки у рек Долинка и Дудинка) суммарную численность икры и личинок рыб формировали в основном типично морские формы – икра минтая и северной палтусовидной камбалы, массовый нерест которых проходит в период гидрологической весны (Тарасюк, Пушников, 1982; Шунтов и др., 1993; Зверькова, 2003). Соответственно на этих участках максимальные концентрации ихтиопланктона регистрировали в мае–июне. В присахалинских водах основной район воспроизводства минтая находится у северо-восточного побережья острова (Овсянников, 2004; Овсянников и др., 2013; Овсянников, Пономарев, 2014; Мухаметов, Мухаметова, 2017). Интенсивность нереста снижается в южном направлении. В зал. Анива и у юго-восточного побережья Сахалина значимых мест икрометания не обнаружено (Шунтов и др., 1993; Зверькова, 2003). Локализация основных нерестилищ минтая объясняет распределение икры в прибрежье. Средняя за период исследований концентрация снижалась с севера на юг – с 11.3 (вблизи р. Дудинка) до 0.01 шт/м3 (вблизи впадения р. Долинка) и до 0.006 шт/м3 (у оз. Птичье). В районе оз. Тунайча и икру, и личинок минтая в уловах не находили. Нерест северной палтусовидной камбалы проходит вдоль всего восточного побережья Сахалина (Тарасюк, Пушников, 1982; Moukhametov, Chastikov, 2015). В районах расположения нерестилищ у северо-восточного побережья Сахалина, в зал. Терпения и в зал. Анива концентрации икры возрастают как на глубинах 50–70 м, так и на мелководьях (Мухаметова, Мухаметов, 2013; Moukhametova, 2013; Мухаметов, Мухаметова, 2017; Мухаметова, 2020а). В прибрежье Юго-Восточного Сахалина икра палтусовидной камбалы встречалась на всех участках с мая по июль. Наиболее высокая численность, осреднённая для всего периода исследований (3.68 шт/м3), была зарегистрирована на севере района (р. Дудинка). На остальных участках отмечены близкие значения – 0.08 шт/м3 вблизи р. Долинка, 0.21 шт/м3 на акватории, прилежащей к оз. Тунайча, и 0.06 шт/м3 в районе оз. Птичье. Между численностью икры минтая и северной палтусовидной камбалы выявлена максимальная корреляция (r = 1) (табл. 3), что объясняется совпадением массового нереста этих видов во времени и в пространстве (Тарасюк, Пушников, 1982; Шунтов и др., 1993; Зверькова, 2003; Овсянников, Пономарев, 2014; Мухаметов, Мухаметова, 2017). Объединение в результате факторного анализа икры минтая и палтусовидной камбалы в одну группу за пределами районов массового икрометания подтверждает близость расположения их нерестилищ и единое направление транспорта их икры на мелководные участки.
По мере прогрева вод активизировался нерест рыб на морских мелководьях. В летние месяцы различия в структуре ихтиопланктона на разных участках становились более заметными. По результатам факторного анализа икра камбал, доминирующих в прибрежном ихтиопланктонном комплексе в тёплый период года, объединяется на основе сезонности появления максимальных концентраций. Для звёздчатой и желтополосой камбал характерен более ранний и менее протяжённый нерест: икра первого вида встречалась преимущественно в мае–июне, второго – в июне–июле. Из-за различий сроков массового нереста на графике факторных нагрузок эти виды максимально удалены друг от друга. Длиннорылая камбала нерестится с июня по август, желтопёрая – с июня по сентябрь. Максимальные концентрации икры этих двух видов смещены относительно предыдущей пары (звёздчатая–желтополосая камбалы) на более поздние сроки – на июль–август.
В динамичных условиях морского прибрежья значительные вспышки численности ихтиопланктона возможны во время роста запасов короткоцикловых видов, нерестящихся на литорали (сельдь, мойва, корюшки рода Hypomesus). С 2015–2016 гг. в присахалинских водах повсеместно регистрируют увеличение запасов мойвы и сельди (Великанов, 2018; Состояние промысловых ресурсов …, 2020), концентрации их икры на литоральных нерестилищах и личинок в прибрежной зоне (Мухаметова, 2019, 2020б) сопоставимы с показателями предыдущих высокочисленных периодов (Фридлянд, 1950; Великанов, 1988; Радченко и др., 2002). На некоторых участках Юго-Восточного Сахалина икра и личинки прибрежных короткоцикловых видов и мигрантов вносили основной вклад в суммарную численность ихтиопланктона. В районе впадения р. Долинка заметный рост концентрации, значительно превышающий численность икры и личинок других видов, обеспечили личинки сельди. Скопления икры высокой плотности также могут наблюдаться при нерестовых подходах южных мигрантов, таких как анчоус и скумбрия Scomber japonicus (Дехник, 1959; Мухаметова, Мухаметов, 2013). В наших сборах икра и личинки анчоуса были отмечены только на юге района − вблизи оз. Птичье и единично в зал. Мордвинова. На северных участках в прибрежье нерест анчоуса не отмечен, вероятно, из-за снижения численности мигрирующих популяций (Nakayama et al., 2018). Ранее нерест анчоуса вдоль восточных берегов Сахалина наблюдали в зал. Терпения и севернее (Великанов, 2006; Шунтов, 2016).
ЗАКЛЮЧЕНИЕ
В прибрежной зоне на структуру ихтиопланктонного сообщества оказывает влияние множество естественных факторов, определяющих гидрологическую обстановку: направление и сила ветра, инсоляция, пресноводный сток, периодические и непериодические течения, а также характер биотопа, влияющий на состав размножающихся рыб. К общим чертам условий обитания на исследованных участках можно отнести значительные перепады температуры и солёности воды в период максимальной численности ихтиопланктона – в мае–июле. В то же время между разными участками отмечены существенные различия: лучший весенний прогрев на севере района вблизи впадения рек Дудинка и Долинка, значительное опреснение вблизи оз. Тунайча, узость шельфа и воздействие глубинных морских вод вблизи оз. Птичье.
Более устойчивые погодные условия в районе впадения р. Дудинка, а также близкое расположение крупных элиторальных нерестилищ минтая и палтусовидной камбалы способствовали формированию на данном участке высокой численности икры этих видов. Участки р. Долинка и оз. Тунайча отличались преобладанием икры и личинок типичных для прибрежного комплекса видов. Вблизи р. Долинка максимальные концентрации ихтиопланктона обеспечивали личинки сельди, находящейся на высоком уровне численности, а в районе оз. Тунайча – икра длиннорылой камбалы, в последние годы образующая в присахалинских водах основу численности прибрежных ихтиопланктонных сообществ. Структура ихтиопланктона вблизи оз. Птичье определялась южным положением участка, что обеспечивало возможность проникновения субтропического мигранта – японского анчоуса. Разнонаправленный транспорт икры и личинок рыб способствовал увеличению разнообразия видов в целом. В то же время узкий шельф и воздействие холодных глубинных вод снижали репродуктивное значение участка: численность ихтиопланктона, особенно резидентных видов, здесь была минимальной.
Факторный анализ позволил выделить ряд основных составляющих, оказывающих воздействие на структуру ихтиопланктона. Из абиотических факторов это –местоположение участков, различающихся морфологическим строением, особенностями метеорологического и гидрологического режимов. Но основное значение имеют биологические особенности видов, формирующих ихтиопланктонный комплекс: сезонность нереста и расположение нерестилищ доминирующих видов рыб.
Список литературы
Авдеев Г.В., Овсянников Е.Е. 2006. Результаты оценки запаса североохотоморского минтая по ихтиопланктонной съемке в 2005 г. // Изв. ТИНРО. Т. 145. С. 120–145.
Архипов А.Г. 2015. Применение результатов изучения раннего онтогенеза морских промысловых рыб в рыбохозяйственной деятельности // Тр. ВНИРО. Т. 156. С. 16–37.
Боровиков В.П. 2003. Statistica. Искусство анализа данных на компьютере: Для профессионалов. СПб.: Питер, 688 с.
Великанов А.Я. 1988. Данные об икринках и личинках дальневосточной мойвы Mallotus villosus socialis у берегов южного Сахалина // Вопр. ихтиологии. Т. 24. Вып. 3. С. 425–430.
Великанов А.Я. 2006. Новая волна миграций рыб южных широт к берегам Сахалина // Вестн. Сахалин. музея. № 13. С. 265–278.
Великанов А.Я. 2018. Дальневосточная мойва: распределение, особенности биологии, динамика биомассы, проблемы и перспективы промыслового освоения // Вопр. рыболовства. Т. 19. № 3. С. 300–326.
Горбунов А.О., Шевченко Г.В., Ковалев П.Д. и др. 2010. Природные условия замывания протоки озера Изменчивое (юго-восточное побережье острова Сахалин) // Вестн. ДВО РАН. № 3. С. 93–102.
Григорьев С.С. 2007. Ранние стадии рыб северо-востока России (прибрежные морские воды и внутренние водоемы). Атлас-определитель. Владивосток: Дальнаука, 331 с.
Гриценко О.Ф., Шилин Н.И. 1979. Экология размножения сельди Ныйского залива (Сахалин) // Биология моря. № 1. С. 58–65.
Дехник Т.В. 1959. Размножение и развитие японской скумбрии Pneumatophorus japonicus (Houttuyn) у берегов Южного Сахалина // Исследования дальневосточных морей СССР. Вып. VI. М.: Изд-во АН СССР. С. 97–108.
Дзен Г.Н., Бровко П.Ф., Лабай В.С. 2021. Лагунное озеро Птичье (остров Сахалин) как объект туризма // Вестн. ДВО РАН. № 2. С. 83–88. https://doi.org/10.37102/0869-7698_2021_216_02_09
Епур И.В., Баланов А.А. 2015. Видовой состав и сезонная динамика ихтиопланктона прибрежной зоны западной части залива Петра Великого Японского моря в 2007–2010 гг. // Вопр. ихтиологии. Т. 55. № 4. С. 397–410. https://doi.org/10.7868/S0042875215030030
Зверькова Л.М. 2003. Минтай. Биология, состояние запасов. Владивосток: Изд-во ТИНРО-центр, 248 с.
Иванович В.М. 2006. Ихтиопланктон прибрежной зоны Юго-Восточной части Балтийского моря: Автореф. дис. … канд. биол. наук. Калининград: АтлантНИРО, 24 с.
Карасева Е.М. 2013. Влияние соленостного фактора на пространственно-временную динамику ихтиопланктона Балтийского моря // Тр. ЗИН РАН. Приложение № 3. С. 225–228.
Карасева Е.М., Архипов А.Г., Ежова Е.Е. 2020. Ихтиопланктон Юго-Восточной Балтики в летний сезон: современные изменения в распределении и численности икры и личинок массовых видов рыб // Тр. ВНИРО. Т. 181. С. 165–177. https://doi.org/10.36038/2307-3497-2020-181-165-177
Каталог позвоночных Камчатки и сопредельных морских акваторий. 2000. Петропавловск–Камчатский: Камчат. печат. двор, 166 с.
Ким Сен Ток. 2002. Ресурсы донных рыб заливов Анива и Терпения // Рыб. хоз-во. № 1. С. 39–41.
Ким Сен Ток. 2014. Пространственное распределение и многолетняя динамика биомассы демерсальных рыб в зоне Восточно-Сахалинского течения (Охотское море) // Вопр. ихтиологии. Т. 54. № 6. С. 672–681. https://doi.org/10.7868/S0042875214060083
Ким Сен Ток, Шепелева О.Н. 2001. Структура шельфовых ихтиоценов северо-восточного Сахалина и залива Терпения // Там же. Т. 41. № 6. С. 750–760.
Климова Т.Н. 2005. Ихтиопланктон Черного моря как индикатор экологического состояния шельфовых вод Украины: Автореф. дис. … канд. биол. наук. М.: ИО РАН, 25 с.
Лоция Охотского моря. 1998. Вып. 1. Южная часть моря. СПб.: Изд-во ГУНиО, 390 с.
Микишин Ю.А. 1991. Геоморфология берегов залива Терпения (о. Сахалин) // Береговая зона дальневосточных морей. Л.: Изд-во ГО СССР. С. 69–84.
Мухаметов И.Н., Мухаметова О.Н. 2017. Видовой состав и распределение ихтиопланктона в водах северо-восточного Сахалина // Вопр. ихтиологии. Т. 57. № 6. С. 675–688. https://doi.org/10.7868/S0042875217050150
Мухаметова О.Н. 2014. Особенности формирования лагунных ихтиопланктонных комплексов на примере озера Птичьего (юго-восточный Сахалин) // Чтения памяти В.Я. Леванидова. Вып. 6. С. 453–463.
Мухаметова О.Н. 2019. Состояние ихтиопланктонного комплекса в заливе Невельского (юго-западный Сахалин) после аварийного разлива нефтепродуктов с танкера “Надежда” // Тр. СахНИРО. Т. 15. С. 202–223.
Мухаметова О.Н. 2020а. Ихтиопланктон прибрежных вод восточной части залива Анива в 2018 г. // Там же. Т. 16. С. 39–60.
Мухаметова О.Н. 2020б. Состояние нерестилищ дальневосточной мойвы Mallotus catervarius (Müller 1776) и морской малоротой корюшки Hypomesus japonicus (Brevoort, 1856) (сем. Osmeridae) на западном побережье о. Сахалин и в заливе Анива в 2017 г. // Там же. Т. 16. С. 61–83.
Мухаметова О.Н., Баланов А.А. 2013. Ихтиопланктон лагунных озер юго-восточной части острова Сахалин. Южно-Сахалинск: Изд-во СахНИРО, 188 с.
Мухаметова О.Н., Мухаметов И.Н. 2013. Ихтиопланктон прибрежной зоны залива Анива // Тр. СахНИРО. Вып. 14. С. 185–202.
Овсянников Е.Е. 2004. Размерный состав пелагической икры минтая Theragra chalcogramma на нерестилищах северной части Охотского моря // Биология моря. Т. 30. № 6. С. 479–482.
Овсянников Е.Е., Пономарёв С.С. 2014. Оценка состояния запасов минтая в Охотском море весной 2013 г. // Изв. ТИНРО. Т. 177. С. 114–124.
Овсянников Е.Е., Овсянникова С.Л., Шейбак А.Ю. 2013. Динамика и структура запасов минтая в северной части Охотского моря в 2000-е гг. // Там же. Т. 172. С. 133–148.
Одум Ю. 1986. Экология. Т. 2. М.: Мир, 376 с.
Пищальник В.М., Бобков А.О. 2000. Океанографический атлас шельфовой зоны острова Сахалин. Ч. 1. Южно-Сахалинск: Изд-во СахГУ, 174 с.
Радченко В.И., Кантаков Г.А., Шубин А.О. и др. 2002. Ихтиоцены и физические условия верхней эпипелагиали шельфа Юго-Восточного Сахалина в период после ската молоди лососей // Тр. СахНИРО. Т. 4. С. 70–92.
Расс Т.С., Казанова И.И. 1966. Методическое руководство по сбору икринок, личинок и мальков рыб. М.: Пищ. пром-сть, 42 с.
Руководство по методам гидробиологического анализа поверхностных вод и донных отложений. 1983. Л.: Гидрометеоиздат, 239 с.
Самсонова А.В. 2005. Факторный анализ. Направления применения и неиспользованные возможности // Вестн. Балт. педакадемии. Вып. 62. С. 67–75.
Саушкина Д.Я. 2019. Ихтиопланктон Авачинской губы в 2014–2017 гг. // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 55. С. 126–137. https://doi.org/10.15853/2072-8212.2019.55.126-137
Селифонова Ж.П. 2016. Структурно-функциональная организация экосистем заливов и бухт Черного и Азовского морей (российский сектор): Автореф. дис. … докт. биол. наук. Мурманск: ММБИ КНЦ РАН, 52 с.
Соколовская Т.Г., Соколовский А.С., Епур И.В. 2010. Видовой состав и сезонная изменчивость ихтиопланктона прибрежной зоны залива Восток (залив Петра Великого, Японское море), собранного на световых станциях // Биология моря. Т. 36. № 2. С. 124–131.
Соколовский А.С., Соколовская Т.Г. 2008. Атлас икры, личинок и мальков рыб российских вод Японского моря. Владивосток: Дальнаука, 223 с.
Состояние промысловых ресурсов Дальневосточного рыбохозяйственного бассейна: материалы к прогнозу общего вылова гидробионтов на 2020 г. 2020. Владивосток: Изд-во ТИНРО, 180 с.
Стукач О.В. 2011. Программный комплекс Statistica в решении задач управления качеством. Томск: Изд-во ТПУ, 163 с.
Тарасюк С.Н., Пушников В.В. 1982. Экология нереста палтусовидной камбалы Hippoglossoides elassodon robustus в заливах Анива и Терпения // Экология и условия воспроизводства рыб и беспозвоночных дальневосточных морей и северо-западной части Тихого океана. Владивосток: Изд-во ТИНРО. С. 58–62.
Терехов А.Ю. 1994. Применение различных индексов видового сходства при изучении ихтиоценозов // Изв. ТИНРО. Т. 115. С. 154–157.
Федорец Ю.В. 2010. Экология ихтиопланктонных сообществ морского мелководья и эстуариев рек северной части залива Петра Великого: Автореф. дис. … канд. биол. наук. Владивосток: ТОИ ДВО РАН, 24 с.
Фридлянд И.Г. 1950. Личинки и мальки сельди в водах юго-западного побережья о. Сахалин // Изв. ТИНРО. Т. 32. С. 157–158.
Хузеева М.О., Като Э. 2011. Характеристики ветрового волнения на побережье о. Сахалин по данным наблюдений береговых гидрометеорологических станций // Избран. докл. III науч.-техн. конф. “Мореходство и морские науки – 2011”. Южно-Сахалинск: Изд-во СахГУ. С. 195–204.
Шевченко Г.В., Любицкий Ю.В., Като Л.Н. 1994. Проявления штормовых нагонов в южной части острова Сахалин. Южно-Сахалинск: ИМГиГ ДВО РАН, 44 с.
Шевченко Г.В., Частиков В.Н., Кириллов К.В., Кусайло О.В. 2018. Особенности гидрофизических процессов в районе мыса Свободный (юго-восточное побережье о. Сахалин) по данным инструментальных измерений // Геосистемы переходных зон. Т. 2. № 2. С. 81–91. https://doi.org/10.30730/2541-8912.2018.2.2.081-091
Шевченко Г.В., Цхай Ж.Р., Частиков В.Н. 2020. Океанологические условия на юго-восточном шельфе о. Сахалин по данным съемок на стандартных разрезах и спутниковых наблюдений // Океанол. исследования. Т. 48. № 2. С. 51–68. https://doi.org/10.29006/1564-2291.JOR-2020.48(2).4
Шелехов В.А., Епур И.В., Баланов А.А. 2020. Видовой состав и структура ихтиопланктона северной части Японского моря в летний период 2017 г. // Вопр. ихтиологии. Т. 60. № 1. С. 40–51. https://doi.org/10.31857/S0042875220010178
Шунтов В.П. 2016. Биология дальневосточных морей России. Т. 2. Владивосток: Изд-во ТИНРО-центр, 604 с.
Шунтов В.П., Волков А.Ф., Темных О.С., Дулепова Е.П. 1993. Минтай в экосистемах дальневосточных морей. Владивосток: Изд-во ТИНРО, 426 с.
An atlas of the early stage fishes in Japan. 1988. Tokyo: Tokai Univ. Press, 1160 p.
Azeiteiro U.M., Bacelar-Nicolau L., Resende P. et al. 2006. Larval fish distribution in shallow coastal waters off North Western Iberia (NE Atlantic) // Estuar. Coast. Shelf Sci. V. 69. P. 554–566.
Cattell R.B. 1966. The scree test for the number of factors // Multivar. Behav. Res. V. 1. № 2. P. 245–276. https://doi.org/10.1016/j.ecss.2006.05.023
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2021. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/ catalog/fishcatmain.asp. Version 08/2021).
Johnson-Colegrove A., Ciannelli L., Brodeur R. 2015. Ichthyoplankton distribution and abundance in relation to nearshore dissolved oxygen levels and other environmental variables within the Northern California Current System // Fish. Oceanogr. V. 24. № 6. P. 495–507. https://doi.org/10.1111/fog.12124
Matarese A.C., Kendall A.W. Jr., Blood D.M., Vinter B.M. 1989. Laboratory guide to early life history stages of Northeast Pacific fishes // US Dept. Comm. NOAA Tech. Rept. NMFS 80, 652 p.
Moukhametov I.N., Chastikov V.N. 2015. Peculiarities of spatial distribution of Alaska pollock and Bering flounder eggs off eastern Sakhalin in 2012 and 2014 years // Proc. 30-th Int. Symp. on Okhotsk Sea and Sea Ice. Mombetsu: OSCORA. P. 227–230.
Moukhametova O.N. 2013. Seasonal formation of ichthyoplankton complexes in Aniva Bay (Southern Sakhalin) // Proc. 28-th Int. Symp. on Okhotsk Sea and Sea Ice. Mombetsu: OSCORA. P. 62–65.
Moukhametova O.N. 2014. Reproductive and nursery potential of nearshore area in the East of Tatarskyi Strait // Proc. 29-th Int. Symp. on Okhotsk Sea and Sea Ice. Mombetsu: OSCORA. P. 288–291.
Moukhametova O.N. 2016. General features of ichthyoplankton structure in Busse Lagoon (Aniva Bay, South Sakhalin) // Proc. 31-st Int. Symp. on Okhotsk Sea and Sea Ice. Mombetsu: OSCORA. P. 293–296.
Nakayama Sh.-I., Takasuka A., Ichinokawa M., Okamura H. 2018. Climate change and interspecific interactions drive species alternations between anchovy and sardine in the western North Pacific: Detection of causality by convergent cross mapping // Fish. Oceanogr. V. 27. № 4. P. 312–322. https://doi.org/10.1111/fog.12254
Olivar M.P. 1990. Spatial patterns in relation of ichthyoplankton distribution to hydrographic features in the Northern Benguela region // Mar. Biol. V. 106. № 1. P. 39–48. https://doi.org/10.1007/BF02114672
StatSoft. 2012. Электронный учебник по статистике. М.: StatSoft. Available: http://www.statsoft.ru/home/textbook/default.htm
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии



