Вопросы ихтиологии, 2022, T. 62, № 6, стр. 688-698
Видовой состав и питание личинок рыб в северной части Чёрного моря в июле–августе 2019 г.
Ю. А. Загородняя 1, И. В. Вдодович 1, *, П. С. Подрезова 1, Т. Н. Климова 1
1 Институт биологии южных морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: vdodovich@mail.ru
Поступила в редакцию 24.11.2021
После доработки 01.02.2022
Принята к публикации 02.02.2022
- EDN: DZFUAV
- DOI: 10.31857/S0042875222060406
Аннотация
Представлены видовая структура, численность, размерный состав и трофические показатели личинок рыб из северной части Чёрного моря в пределах экономической зоны России в июле–августе 2019 г. В ихтиопланктоне идентифицированы личинки 21 вида рыб, принадлежащих 14 семействам. Средняя численность личинок варьировала от 17 экз/м2 в глубоководных районах исследований до 38 экз/м2 на шельфе. Доминировал массовый промысловый вид – хамса Engraulis encrasicolus, на долю которой приходилось 77.4% всех пойманных личинок. Максимальная численность личинок отмечена у берегов Кавказа (148 экз/м2), высокие величины (116 экз/м2) зарегистрированы в северо-западном секторе. Обилие личинок совпало с районами повышенных показателей численности кормового зоопланктона – 3305 экз/м3 у берегов Кавказа и 13913 экз/м3 в северо-западной части моря. Высокая численность, широкий размерный диапазон личинок рыб и обилие кормовых организмов в кишечниках свидетельствовали о хорошей кормовой базе, как важнейшем факторе для их развития и выживания.
Питание и пищевые взаимоотношения личинок рыб чрезвычайно важны для функционирования пелагических сообществ. Условия обитания наряду с благоприятными кормовыми факторами влияют на выживаемость личинок рыб, определяющую численность будущих поколений (Андреева, Шебанова, 2010; Baltazar-Soares et al., 2018). На протяжении 1990-х и в начале 2000-х гг. происходили существенные изменения состава зоопланктона, в частности, из-за развития гребневика-вселенца мнемиопсиса Mnemiopsis leidyi исчезла массовая мелкая циклопоида Oithona nana и сократилась численность других видов мелких ракообразных, являющихся основной пищей рыб и их личинок, в результате усилилась конкуренция за пищу между разными звеньями трофической цепи в планктоне. Появились новые виды копепод-вселенцев (Acartia tonsa, Oithona davisae). Всё перечисленное выше отразилось на структуре зоопланктона. В результате снижения доли мелких организмов возросли средние размеры зоопланктёров и снизилась доступность корма для личинок рыб (Ковалев и др., 1995).
Питание личинок черноморских рыб детально изучено в 1960-х гг., в этот же период рассчитаны рационы хамсы Engraulis encrasicolus Linnaeus, 1758 и ставриды Trachurus mediterraneus (Steindachner, 1868) (Синюкова, 1964; Дука, Синюкова, 1970). Однако данные об изменении пищевых спектров и рационов личинок рыб в связи с произошедшими изменениями в зоопланктоне отсутствуют.
Цель работы – получить современные представления о видовой структуре, численности, размерных характеристиках, массе и питании личинок рыб в летний период в северной части Чёрного моря; оценить изменения в пищевом спектре на примере личинок массового промыслового вида – ставриды – в связи с произошедшей трансформацией структуры зоопланктона.
МАТЕРИАЛ И МЕТОДИКА
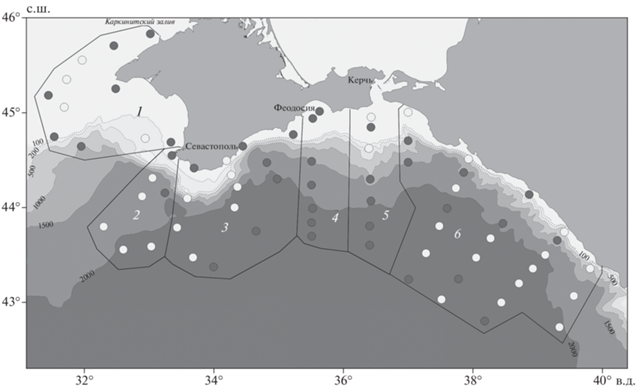
Материал собран на шельфе (глубины < 200 м) и в глубоководных районах (глубины ≥ 200 м) Чёрного моря в пределах экономической зоны России у Крымского п-ова и берегов Кавказа 11.07–03.08.2019 г. (108-й рейс НИС “Профессор Водяницкий”). Пробы ихтиопланктона отобраны обратноконической сетью БР-80/113 (площадь входного отверстия 0.5 м2, ячея сита 400 мкм) на 67 станциях, зоопланктона – большой сетью Джеди (площадь входного отверстия 0.1 м2, ячея сита 150 мкм) на 38 станциях. В соответствии с географическим положением все станции сгруппированы в шесть секторов (рис. 1): северо-западный (включает часть Каркинитского залива), Вековой разрез11, Южный берег Крыма (ЮБК) – от бух. Ласпи до Алушты, Феодосийский, Керченский и Кавказский. Большинство станций отбора проб зоопланктона и личинок рыб совпадали. Все пробы отобраны вертикальными тотальными ловами: на глубоководных станциях от нижней границы кислородного слоя (изопикна δt = 16.2 по данным CTD-зонда SeaBird 911 Plus (“Sea-Bird Electronics”, США)) до поверхности и на мелководных – от дна до поверхности. Положение изопикны непостоянно, поэтому протяжённость слоёв облова разнилась по станциям. Глубину погружения сети контролировали по счётчику палубной лебёдки. В дальнейшем эти данные использованы при определении объёма профильтрованной морской воды. Все пробы зафиксированы 4%-ным раствором нейтрального формальдегида и обработаны в условиях стационарной лаборатории. Идентификацию ихтиопланктона проводили по монографии Дехник (1973) и определителю (Russell, 1976). Видовые названия гидробионтов даны по Всемирному реестру морских видов (WoRMS …, 2021). Численность личинок рыб приведена под 1 м2 поверхности, зоопланктона – в 1 м3 обловленного слоя. Зоопланктон определяли до вида, копепод разделяли по стадиям развития. Биомассу зоопланктона рассчитали, используя индивидуальные массы, приведённые в работах Петипа (1957) и Численко (1968). Зоопланктон, которым питаются рыбы, мы называем кормовым в соответствии с работой Кусморской (1950).
Рис. 1.
Схема станций одновременного отбора зоо- и ихтиопланктона ( ) и только ихтиопланктона (⚪), выполненных в Чёрном море в июне–августе 2019 г. (108-й
рейс НИС “Профессор Водяницкий”). Сектор: 1 – северо-западный, 2 – Вековой разрез, 3 – Южный берег Крыма, 4 – Феодосийский, 5 – Керченский, 6 – Кавказский.
) и только ихтиопланктона (⚪), выполненных в Чёрном море в июне–августе 2019 г. (108-й
рейс НИС “Профессор Водяницкий”). Сектор: 1 – северо-западный, 2 – Вековой разрез, 3 – Южный берег Крыма, 4 – Феодосийский, 5 – Керченский, 6 – Кавказский.
Питание личинок рыб изучали по методике Дуки и Синюковой (1976). Личинки ставриды по морфологическим показателям были разделены на четыре размерные группы: 1) общая длина (TL) < 2.2 мм, желточный тип питания; 2) TL 2.3–3.5 мм, смешанный тип питания; 3) TL 3.6–5.5 мм, смешанное питание с преобладанием экзогенного; 4) TL 5.6–10 мм, экзогенное питание (Синюкова, 1964). Личинки хамсы были разделены на три размерные группы: 1) TL ≤ 3.5 мм, желточный тип питания; 2) TL 3.6–6.0 мм, смешанный тип питания; 3) TL 6.1–12.0 мм, экзогенное питание (Дука, Синюкова, 1976).
При исследовании питания личинок вскрывали под микроскопом МБС-9, извлекали содержимое кишечников, идентифицировали пищевые объекты, затем их просчитывали и измеряли под микроскопом Nikon Eclipse 200 при увеличении ×40. Массу тела личинок рыб измеряли на торсионных весах, более крупную молодь взвешивали на электронных весах AXIS ADG500C (“AXIS”, Польша). Индексы потребления и рационы рассчитывали по восстановленной массе извлечённых кормовых организмов, которую определяли по таблицам средних весов (Петипа, 1957). Суточные рационы рассчитывали по формуле (Сушкина, 1940): R = M(T–v)/v, где R – суточный рацион, мг; M – восстановленная масса пищи, мг; T – время пребывания пищи в кишечнике (18 ч); v – продолжительность переваривания пищи (3 ч). Время нахождения пищи в кишечнике и продолжительность переваривания взяты из работы Синюковой (1964).
РЕЗУЛЬТАТЫ
В период исследований у берегов Крыма и Кавказа собрано и идентифицировано 837 личинок рыб, принадлежащих 21 виду из 14 семейств (табл. 1). Видовой состав личинок был богаче на шельфе, где обнаружено 18 видов из 13 семейств, тогда как в глубоководных районах моря 12 видов из 9 семейств. Средняя численность личинок рыб на шельфе была 37.1 экз/м2 – вдвое выше, чем в глубоководье, где она составила 18.3 экз/м2. Личинки хамсы доминировали как на шельфе, так и в глубоководных районах, составляя в среднем 76.4% численности всех личинок. Доля второго массового пелагического вида, ставриды, была существенно ниже – 13.2%.
Таблица 1.
Видовая структура (%) и средняя численность личинок рыб в разных акваториях Чёрного моря в 2019 г.
| Вид, численность | Сектор у Крымского полуострова | Кавказский сектор, 26–31.07 |
||||
|---|---|---|---|---|---|---|
| северо-западный, 01–03.08 |
Вековой разрез, 11–14.07 |
Южный берег Крыма, 15–18.07 |
Феодо-
сийский, 20.07 |
Керчен-
ский, 22–23.07 |
||
| Engraulis encrasicolus Linnaeus, 1758 | 88.6 | 70.6 | 71.5 | 79.2 | 13.4 | 73.9 |
| Clupeonella cultriventris (Nordmann, 1840) | 0.6 | |||||
| Trisopterus luscus (Linnaeus 1758) | 11.7 | 2.2 | ||||
| Mugil sp. | 0.5 | |||||
| Syngnathus schmidti Popov, 1928 | 0.5 | 3.1 | 4.0 | 35.2 | 2.6 | |
| Lepadogaster candollii Risso, 1810 | 1.1 | |||||
| Diplecogaster bimaculata (Bonnaterre, 1788) | 2.2 | |||||
| Parablennius tentacularis (Brünnich, 1768) | 0.9 | |||||
| Blennius sp. | 0.2 | |||||
| Gobius niger Linnaeus, 1758 | 1.9 | 5.9 | 2.7 | |||
| Pomatoschistus marmoratus (Risso, 1810) | 13.4 | 0.2 | ||||
| P. minutus (Pallas, 1770) | 0.5 | 9.2 | 2.9 | 0.2 | ||
| P. pictus (Malm, 1865) | 0.5 | |||||
| Aphia minuta (Risso, 1810) | 0.2 | |||||
| Symphodus cinereus (Bonnaterre, 1788) | 1.1 | |||||
| Symphodus ocellatus (Linnaeus, 1758) | 1.1 | |||||
| Trachurus mediterraneus (Steindachner, 1868) | 7.2 | 5.4 | 12.7 | 12.0 | 38.0 | 17.5 |
| Mullus barbatus Linnaeus, 1758 | 1.3 | 0.7 | ||||
| Diplodus annularis (Linnaeus, 1758) | 1.1 | 0.5 | ||||
| Thunnus thynnus (Linnaeus, 1758) | 1.1 | |||||
| Arnoglossus kessleri Schmidt, 1915 | 0.7 | |||||
| Средняя численность, экз/м2 | 56.8 | 7.3 | 14.0 | 9.5 | 2.5 | 32.0 |
| Число видов | 8 | 5 | 11 | 4 | 4 | 12 |
На шельфе хамса составляла 79.3%, ставрида – 10.5% от всех проб. Здесь обнаружены личинки рыб семейств Labridae, Scombridae и умеренноводной французской тресочки Trisopterus luscus (Linnaeus, 1758) из семейства Gadidae, на долю которых в сумме приходилось 1.3%, личинки других видов рыб встречались единично.
Все обнаруженные в глубоководных районах личинки относились к тепловодным видам рыб. Среди них доминировала хамса, доля которой была ниже, чем на шельфе, и составляла 75.9% численности всех личинок. Субдоминантным видом была ставрида – 16.2%. Другие виды, в том числе личинки пяти видов рыб семейств Gobiidae и Gobiesocidae, имеющих демерсальную икру, встречались единично. Вероятно, они были вынесены в глубоководье с шельфа, где являются обычными представителями ихтиопланктона. Личинки умеренноводных видов в пробах отсутствовали.
Средняя численность личинок в исследованных акваториях различалась – от 2.5 (сектор Керчи) до 56.8 экз/м2 в северо-западном секторе (табл. 1). Максимальное число видов обнаружено в двух секторах – ЮБК и Кавказском. Во всех районах исследований, кроме Керченского сектора, в пробах доминировали личинки хамсы, чья доля в общей численности личинок варьировала от 70.6% на Вековом разрезе до 88.6% в северо-западном секторе у берегов Крыма. Максимальная численность личинок отмечена в северо-западном секторе, вторым по обилию был Кавказский сектор. В этих акваториях ихтиопланктон отбирали в конце июля–начале августа, когда температура воды у поверхности на отдельных станциях превысила 26°С, что положительно отразилось на нересте тепловодных хамсы и ставриды и, соответственно, на обилии их личинок.
В Феодосийском секторе обнаружены личинки четырёх тепловодных видов рыб. Средняя численность личинок была 9.5 экз/м2. Как и в других районах моря, доминировали личинки хамсы, составляя 79.2% численности всех обнаруженных в этом секторе личинок (табл. 1). В районе Керченского п-ова, как и в Феодосийском секторе, видовой состав личинок был бедным (4 вида), их численность была минимальной – 2.5 экз/м2. На долю личинок хамсы приходилось 13.4%, здесь в отличие от других исследованных акваторий преобладали личинки ставриды и иглы-рыбы Syngnathus schmidti, которые в сумме составили 73.2% общей численности личинок в пробах.
У Кавказского побережья ихтиопланктон отбирали в последней декаде июля, что сказалось на его видовом составе. Здесь зарегистрированы личинки 12 тепловодных видов рыб. В сборах встречались мальки тюльки Clupeonella cultriventris, личинки бычка- бланкета Aphia minuta и арноглосса Кесслера Arnoglossus kessleri, которые у Крымского п-ова отсутствовали. Средняя численность личинок была 32 экз/м2, максимальная – 148 экз/м2 – зарегистрирована на траверзе c. Ольгинка (глубина 90 м). Среди личинок доминировала (73.9%) хамса (табл. 1).
В северо-западном секторе зарегистрировано восемь видов из семи семейств. Встречались не обнаруженные в других районах личинки лысуна узорчатого Pomatoschistus pictus и длиннощупальцевой морской собачки Parablennius tentacularis. Доминировала хамса, составляя 88.6% численности личинок в этом секторе. Здесь зарегистрирована максимальная средняя численность личинок – 56.8 экз/м2 (табл. 1).
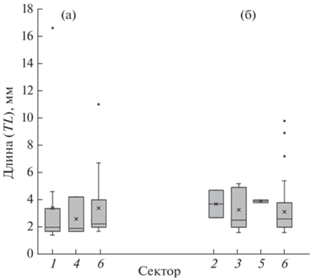
Большинство пойманных на шельфе личинок хамсы находились на желточном типе питания, их средняя длина была 3.2 мм (рис. 2). Наиболее широкий размерный ряд личинок хамсы отмечен на шельфе северо-западного сектора, где их максимальная длина достигала 12.4 мм. Крупные личинки с внешним типом питания встречались единично и только в ночных сборах.
Рис. 2.
Размерные ряды личинок хамсы Engraulis encrasicolus, пойманных в Чёрном море в июле–августе 2019 г.: а – на шельфе (<200 м), б – в глубоководной части (≥200 м). Число личинок по секторам (см. на рис. 1), экз.: 1 – 187, 2 – 18; 3 – 21 (шельф), 28 (глубоководная часть); 4 – 13; 6 – 32 (шельф), 223 (глубоководная часть). Каждый бокс включает 5 горизонтальных линий, которые обозначают 10, 25, 50 (медиана), 75 и 90% данных (от 25 до 75% данных заключены в прямоугольник); (⚪) – значения за пределами 90% данных, (×) – среднее значение.

На глубоководных станциях наиболее широкий размерный диапазон личинок хамсы отмечен в Кавказском секторе, при этом доминирование мелких личинок, находящихся на желточном типе питания, сохранилось (рис. 2). Одновременно здесь встречались особи с экзогенным питанием длиной немногим более 14 мм. Средняя длина личинок хамсы на глубоководных станциях в районах ЮБК и Векового разреза была несколько выше (TL 4.1 мм) по сравнению с величинами, полученными на шельфе.
Преобладание в июле–августе 2019 г. в сборах на шельфе и в глубоководных районах моря мелкоразмерных личинок хамсы свидетельствовало об её интенсивном нересте.
Доля личинок ставриды TL < 2.2 мм в глубоководье и на шельфе в июле составляла соответственно 40 и 50% (рис. 3) и была выше, чем в 1960-е гг. (Дехник, 1970). В августе личинки ставриды отмечены только на мелководных станциях. Доля мелкоразмерных личинок на шельфе возросла до 69%, крупные особи были единичными. В 1960-х гг. длина личинок ставриды варьировала от 1.6 до 10.0 мм, при этом преобладали мелкоразмерные особи: в июне–июле – 2–3, в августе – 3–5 мм (Дехник, 1970).
Рис. 3.
Размерные ряды личинок ставриды Trachurus mediterraneus в июле–августе 2019 г.: а – на шельфе (<200 м), б – в глубоководной части (≥200 м). Число личинок по секторам (см. на рис. 1), экз.: 1 – 13, 2 – 2, 3 – 5, 4 – 3, 5 – 2; 6 – 16 (шельф), 51 (глубоководная часть). Ост. обозначения см. на рис. 2.
В пищевом комке десяти личинок хамсы, находившихся на внешнем типе питания, обнаружена только переваренная аморфная масса, ещё у четырёх (TL 6.3–14.2 мм) найдены науплиусы копепод (Calanoida) – 1–3 экз/кишечник в размерном диапазоне 0.100–0.175 мм. Отсутствие оформленных пищевых остатков в кишечнике личинок хамсы характерно для этого вида и отражает особенности её питания (Дука, Синюкова, 1970, 1976).
Питание личинок ставриды изучено на 35 экз. TL 2.5–11.4 мм. У личинок 2-й размерной группы (TL 2.3–3.5 мм), пойманных в районе Кавказа, в кишечниках обнаружены копеподы (преимущественно Calanoida) ювенильных стадий, на долю которых приходилось 95% общего количества потреблённых организмов. Среди них доминировали мелкие рачки длиной до 0.2 мм, доля которых составила 63%. В кишечниках личинок ставриды указанной размерной группы длина пищевых объектов варьировала от 0.15 до 0.35 мм. Синюкова (1964) показала ранее, что личинки ставриды 2-й размерной группы наряду с имеющим большое значение желточным типом питания потребляли науплиусов копепод и мелких копеподитов циклопоиды Oithona minuta (позднее идентифицирована как O. nana). Размеры потреблённых пищевых объектов варьировали в пределах 0.14–0.18 мм, тогда как у личинок ставриды, пойманных у берегов Кавказа в июле–августе 2019 г., пищевые объекты были крупнее. Потребление личинками ставриды кормовых объектов большего размера связано с изменениями структуры кормового зоопланктона в результате исчезновения массовой O. nana, что обусловило существенное сокращение мелкоразмерной фракции мезопланктона (Ковалев и др., 1995). Летом 2019 г. в зоопланктоне по численности среди копепод доминировали более крупные виды – Acartia (tonsa + clausi) (29%), Centropages ponticus и Pseudocalanus elongatus (по 9% каждый); среди кладоцер – Penilia avirostris (98%).
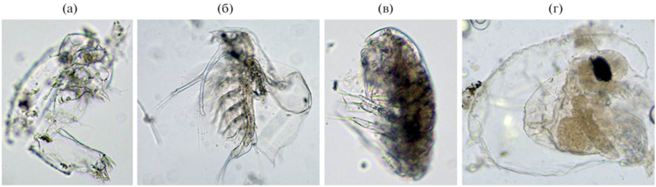
У личинок ставриды 3-й размерной группы (TL 3.6–5.5 мм), отловленных на станциях Векового разреза, в кишечниках обнаружены копеподы (Calanoida) науплиальных и копеподитных стадий; у личинок из района Керчи – сильно переваренные науплиусы и яйца гидробионтов (подразумеваются яйца Cladocera, Copepoda и неидентифицированные мелкие яйца). В кишечниках личинок из района Каркинитского залива (северо-западный сектор) встречались только рачки, среди них существенное значение имели кладоцеры, доля которых составила 45% потреблённых пищевых объектов при доминировании P. avirostris. Рачки были сильно переваренными (рис. 4), средняя длина потреблённых кладоцер составила 0.31 мм, копепод – 0.26 мм, вклад мелких копепод (<0.2 мм) достигал 50%, что согласуется с данными Синюковой (1964) об активном экзогенном питании и невысоком значении желточного питания личинок данной размерной группы. У личинок ставриды из Кавказского прибрежья в пищевом комке доминировали копеподы (Calanoida и Cyclopoida) ювенильных стадий, составлявшие 66% общей численности потреблённых организмов. На долю каланоид приходилось 83%, среди которых доминировали акарции. Длина потреблённых копепод варьировала от 0.1 до 0.5 мм. Доля мелкоразмерных копепод (<0.2 мм) в питании личинок 3-й группы снизилась почти в два раза по сравнению со 2-й группой и составила 36%. Кладоцеры, представленные в основном P. avirostris, составляли в пищевом комке 34%. Их длина варьировала от 0.20 до 0.65 мм, все они были сильно переваренными. Кроме того, единично в кишечниках встречались яйца гидробионтов и мелкие диатомовые водоросли.
Рис. 4.
Пищевые объекты из кишечника личинок ставриды Trachurus mediterraneus TL 4 мм, фото авторов: а – науплиус Copepoda (Calanidae) 0.425 мм; б – Penilia avirostris 0.4 мм; в – копеподит Oithona davisae 0.275 мм; г – Cladocera (Podonidae) 0.3 мм.
Личинки, отнесённые к 4-й размерной группе, имели размеры (TL) 6.7–10.0 мм и встречались только у берегов Кавказа. В анализ питания личинок этой группы включён 1 экз. TL 11.4 мм со сходным составом заглоченных организмов. В пищевом комке личинок доминировали копеподы (Calanoida и Cyclopoida). Ювенильные стадии Calanoida достигали 71% и значительно превосходили долю Cyclopoida, представленных в основном копеподитами (V стадия) Oithona davisae. Среди кладоцер доминировали P. avirostris, размерный диапазон которых варьировал от 0.25 до 0.55 мм. В кишечниках личинок этой размерной группы доля мелкоразмерных копепод (<0.2 мм) значительно снизилась по сравнению с 3-й размерной группой и составила 6%. Размеры потреблённых копепод были выше и варьировали от 0.2 до 0.9 мм.
Таким образом, в питании личинок ставриды, находящихся на смешанном и внешнем типах питания, доминировали копеподы ювенильных стадий, в основном Calanoida, среди них преобладали Acartiidae. Существенное значение в отдельных акваториях имели кладоцеры. Фотографии разных пищевых объектов из кишечников личинок ставриды приведены на рис. 4. Большинство из них были сильно деформированы в результате переваривания.
В секторе ЮБК мелкие личинки рыб не найдены, а у всех крупных личинок разных видов (ставрида, хамса, игла-рыба и бычок чёрный Gobius niger Linnaeus, 1758), пойманных у м. Форос (над глубиной 1335 м), в кишечниках пищевые объекты не обнаружены. Обычно крупные личинки этих видов, за исключением хамсы, крайне редко бывают с пустыми кишечниками (Дука, Синюкова, 1970). Возможно, это связано с плохими кормовыми условиями в этом районе из-за низкой численности копепод ювенильных стадий и кормового зоопланктона в целом (табл. 2).
Таблица 2.
Средние показатели основных таксономических групп кормового зоопланктона и численность личинок рыб в разных акваториях Чёрного моря в июле–августе 2019 г.
| Основные таксономические группы | Сектор у Крымского полуострова | Кавказский сектор |
||||
|---|---|---|---|---|---|---|
| северо-западный | Вековой разрез | Южный берег Крыма | Феодосийский | Керченский | ||
| Копеподы | $\frac{{10{\kern 1pt} 190.4}}{{80.2}}$ | $\frac{{975.7}}{{29.3}}$ | $\frac{{652.7}}{{27.0}}$ | $\frac{{1116.1}}{{46.1}}$ | $\frac{{802.4}}{{43.4}}$ | $\frac{{2254.0}}{{40.4}}$ |
| В том числе науплиусы, экз/м3 | 1293 | 6.3 | 24.6 | 30.6 | 16.8 | 467 |
| Кладоцеры | $\frac{{1693.0}}{{40.4}}$ | $\frac{{24.6}}{{0.9}}$ | $\frac{{64.2}}{{1.6}}$ | $\frac{{70.4}}{{1.8}}$ | $\frac{{50.3}}{{0.8}}$ | $\frac{{600.1}}{{18.6}}$ |
| Oikopleura dioica | $\frac{{122.2}}{{1.4}}$ | $\frac{{120.4}}{{0.3}}$ | $\frac{{58.7}}{{0.04}}$ | $\frac{{247.7}}{{0.8}}$ | $\frac{{53.3}}{{0.2}}$ | $\frac{{112.4}}{{0.9}}$ |
| Parasagitta setosa | $\frac{{82.3}}{{6.0}}$ | $\frac{{0.8}}{{0.9}}$ | $\frac{{16.6}}{{16.36}}$ | $\frac{{49.7}}{{48.2}}$ | $\frac{{51.3}}{{38.5}}$ | $\frac{{60.4}}{{36.5}}$ |
| Личинки донных животных | $\frac{{1783.5}}{{5.4}}$ | $\frac{{3.8}}{{0.14}}$ | $\frac{{27.5}}{{5.7}}$ | $\frac{{212.4}}{{2.0}}$ | $\frac{{130.3}}{{0.14}}$ | $\frac{{221.4}}{{0.5}}$ |
| Кормовой зоопланктон в целом | $\frac{{13{\kern 1pt} 913.2}}{{134.2}}$ | $\frac{{1125.3}}{{31.5}}$ | $\frac{{819.8}}{{50.7}}$ | $\frac{{1697.1}}{{98.9}}$ | $\frac{{1098.1}}{{82.4}}$ | $\frac{{3305.0}}{{97.0}}$ |
| Средняя масса кормового организма, мг/экз | 0.0096 | 0.0280 | 0.0619 | 0.0583 | 0.0751 | 0.0293 |
| Средняя численность личинок рыб, экз/м2 |
56.8 | 7.3 | 14.0 | 9.5 | 2.5 | 32 |
При относительно высоком количестве потреблённых пищевых организмов средние индексы потребления у личинок ставриды в районе Кавказа были: у 2-й размерной группы – 327 (20–1055), у 3-й – 400 (20–1500), 4-й – 190 (51–469)‱. Суточные исследования в период рейса не проводили. Для сравнения полученных индексов потребления с данными литературы (Синюкова, 1964) мы ранжировали личинок по времени их поимки в море вне зависимости от района сборов (рис. 5). Интенсивность питания изменялась в течение суток.
Рис. 5.
Суточный ритм питания личинок ставриды Trachurus mediterraneus разных размерных групп в июле–августе 2019 г.; ( ) – 2-я (TL 2.3–3.5 мм), (
) – 2-я (TL 2.3–3.5 мм), ( ) – 3-я (3.6–5.5), (◼) – 4-я (6.7–11.4).
) – 3-я (3.6–5.5), (◼) – 4-я (6.7–11.4).
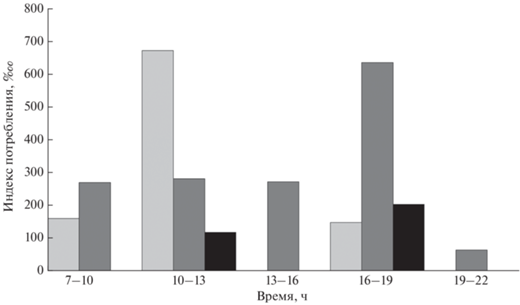
В утренней пробе обнаружен 1 экз. ставриды (TL 16.6 мм). В его пищевом комке найдено 16 кормовых объектов (Copepoda и Cladocera), средний размер которых составил 0.55 мм. Все находившиеся в кишечнике пищевые объекты были сильно деформированы, особенно науплиусы копепод и P. avirostris. Рассчитанный индекс потребления был низким и составил 60‱, хотя обычно в утренние часы наблюдается максимум питания (Синюкова, 1964).
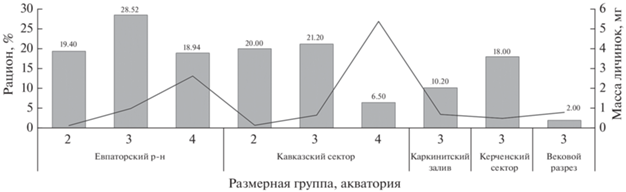
Рацион является важнейшим показателем питания, позволяющим оценить количество пищи, потребляемое за единицу времени. На основании данных о питании личинок ставриды в море летом 2019 г. и сведений литературы о продолжительности питания и времени переваривания пищи рассчитали суточные рационы (рис. 6). В Каркинитском заливе личинки 2-й и 4-й размерных групп отсутствовали, среднесуточный рацион личинок 3-й группы был невысоким – 10.2% массы тела личинок. На Вековом разрезе в пробах были личинки только 3-й размерной группы, их рацион оказался минимальным. У берегов Кавказа присутствовали личинки всех размерных групп. Рационы личинок 2-й и 3-й размерных групп были соответственно 20 и 21.2% массы тела и близки между собой. Рацион 4-й группы был ниже – 6.5% массы тела. Снижение интенсивности питания с ростом личинок ставриды отмечала и Синюкова (1964). Рацион малька ставриды составлял 3% массы тела.
Рис. 6.
Суточные рационы и масса тела личинок ставриды Trachurus mediterraneus размерных групп (см. на рис. 5) в разных акваториях северной части Чёрного моря в 1957 г. (Евпаторийский р-н – по:
Синюкова, 1964) и в июле–августе 2019 г.: ( ) – рацион, % массы личинок; (─) – средняя масса личинок, мг.
) – рацион, % массы личинок; (─) – средняя масса личинок, мг.
Исследовали спектры питания личинок и мальков других обнаруженных в пробах видов рыб. В кишечнике личинок малого бычка-бубыря Pomatoschistus minutus обнаружены остатки науплиусов копепод отряда Calanoida – у личинки TL 3.7 мм, массой 0.1 мг длина пищевых объектов варьировала от 0.250 до 0.275 мм; у личинок TL 5.3–8.5 мм, массой 0.3–1.3 мг длина потреблённых копепод составляла 0.175–0.575 мм. У тюльки (2 экз. TL 47 и 48 мм, масса 154 и 216 мг, пойманные в Кавказском секторе над глубиной 1700 м) в кишечниках обнаружены мелкие ракообразные (Copepoda: A. tonsa, P. parvus и Cladocera: Pseudevadne tergestina, P. avirostris, Pleopis polyphemoides), яйца гидробионтов, микроводоросли (Peridinium sp.). Размеры обнаруженных рачков варьировали от 0.40 до 0.95 мм. В кишечниках иглы–рыбы доминировали науплиусы и копеподиты Calanoida (0.200–0.375 мм), также отмечены сильно переваренные кладоцеры, в основном P. avirostris (0.3–0.6 мм).
Совокупность абиотических и биотических факторов наряду с обеспеченностью пищей определяет выживание личинок рыб (Архипов, 2015). Основной их пищей являются мелкие ракообразные – копеподы и кладоцеры, в меньшей степени пелагические личинки донных животных. В период исследований зоопланктон был обычным по составу для летнего периода. Пелагические копеподы были представлены девятью видами, из которых массовые: A. clausi, Calanus euxinus, P. elongatus, P. parvus, C. ponticus, Oithona similis и O. davisae; кладоцеры – четырьмя видами: P. avirostris, P. polyphemoides, P. tergestina, Evadne spinifera. На шельфе многочисленными были личинки двустворчатых (Bivalvia) и брюхоногих (Gastropoda) моллюсков, полихет (Рolychaeta) и циррипедий (Cirripedia).
Количественные показатели кормового зоопланктона и основных его таксономических групп по секторам исследованной акватории существенно различались. Наиболее высокими численность и биомасса кормового зоопланктона были в северо-западном секторе. Минимальные величины численности зарегистрированы у ЮБК, биомассы – на Вековом разрезе (табл. 2).
Копеподы – важнейшая и массовая группа морского планктона – являются промежуточным звеном в пищевой цепи пелагиали между первичной продукцией и личинками большинства видов рыб. В среднем копеподы составили 81% численности кормового зоопланктона. Их численность сильно разнилась по станциям от максимума (16.4 тыс. экз/м3) на мелководной станции в Каркинитском заливе до минимума (195 экз/м3) на свале глубин у северо-восточного побережья Крыма. По численности, независимо от района исследований, доминировали акарции, представленные в основном A. clausi. Другой вид A. tonsa встречался на мелководном шельфе в небольшом количестве. Доля акарций в суммарной численности копепод изменялась от 29% у берегов Кавказа до 49% в северо-западном секторе. Структура доминирования различалась по акваториям: в северо-западном секторе субдоминантным видом была O. davisae, составлявшая 17% численности копепод, за ней следовали науплиусы копепод (13%). На станциях Векового разреза, у ЮБК и в Феодосийском секторе субдоминантом была O. similis, составлявшая соответственно 24, 26 и 15%. В Керченском секторе субдоминантом была O. davisae – 15%, у берегов Кавказа – науплиусы копепод (21%) и O. davisae. Копеподы ювенильных стадий (науплиусы и копеподиты) являются основой рациона личинок рыб. Высокая численность науплиусов отмечена в северо-западном секторе и у берегов Кавказа, где сложились благоприятные для личинок рыб трофические условия (табл. 2). В глубоководной зоне Векового разреза и вдоль ЮБК до Керчи численности копепод и науплиусов оказались невысокими, вероятно, условия питания здесь были хуже.
Кладоцеры были вторыми по значимости в питании личинок рыб. Их доля в суммарной численности кормового зоопланктона была существенно ниже по сравнению с копеподами и обычно не превышала нескольких процентов, увеличиваясь до 10–15% на отдельных станциях шельфа; максимальной (30%) она была у берегов Кавказа. У ЮБК, в секторах северо-западном и Феодосийском в суммарной численности кладоцер доминировали два вида – P. avirostris и P. polyphemoides – с близкими величинами. В других акваториях доминировал какой-то один вид: на вековом разрезе – E. spinifera (60%), в секторе Керчи – P. polyphemoides (77%), у берегов Кавказа – P. avirostris (98%).
ОБСУЖДЕНИЕ
В Чёрном море у берегов Крыма в конце первой декады 2000-х гг. отмечено увеличение количества видов и численности личинок рыб после катастрофического падения этих показателей в первой половине 1990-х гг. (Климова и др., 2019а). По сравнению с 1990-ми гг. отмечено увеличение доли личинок промысловых видов-мигрантов: хамсы и ставриды (Климова и др., 2019б, 2021). Постепенное увеличение видового богатства и численности личинок рыб связано с улучшением их кормовой базы. Действительно, на протяжении 2000-х гг. зарегистрировано постепенное увеличение численности кормового зоопланктона (Загородняя, Морякова, 2011; Arashkevich et al., 2014). Летом 2019 г. численность и биомасса зоопланктона в Каркинитском заливе стали соизмеримы с величинами конца 1950-х гг., когда были выполнены основополагающие работы по питанию личинок черноморских рыб (Дука, Синюкова, 1970). Авторы подробно описали спектры питания личинок рыб и рассчитали индексы потребления, продолжительность переваривания пищи, суточные ритмы питания и рационы.
Климатические изменения, а именно быстрый прогрев поверхностного слоя воды моря, вероятно, способствуют более раннему началу результативного нереста летненерестующих видов рыб (Климова и др., 2019в). В конце 1950-х гг. летняя температура поверхностного слоя воды при исследовании питания личинок рыб у берегов Крыма варьировала от 21.2 до 23.0°С (Синюкова, 1964). В июле–августе 2019 г. температура поверхности моря была выше и достигала у Керчи 24.6°С, в Каркинитском заливе – 26.1°С, в районе Кавказа – 26.6°С. Температурный режим вод влияет на динамику гонадосоматического индекса (ГСИ) рыб (Мельникова, Кузьминова, 2020). При повышении среднемесячной температуры до 25.5°С ГСИ увеличивается. При среднегодовой июньской температуре 21.5°С могут нереститься как старшие, так и младшие возрастные группы ставриды (Мельникова, Кузьминова, 2020). Хорошие кормовые и температурные условия, вероятно, удлиняют период размножения, а нерест ставриды младших возрастных групп приводит к увеличению доли более мелких личинок. Можно предположить, что с этим связаны меньшие, чем в 1960-е гг., размеры вылупившихся личинок ставриды и высокий процент мелкоразмерных личинок летом 2019 г.
Суточные рационы личинок ставриды 3-й размерной группы в середине прошлого века составляли 28.5–33.5% массы тела (Синюкова, 1964) и были выше рассчитанных нами. Летом 2019 г. в северо-западном секторе рацион составил 10.2% массы тела, в Керченском – 18%. Максимальный рацион отмечен у берегов Кавказа – 21.2%, минимальный – на станциях Векового разреза: 2%. Численность кормового зоопланктона летом 2019 г. была в два–три раза ниже, и только в северо-западном секторе (13 913 экз/м3) соизмерима с показателями тех лет.
Максимальные суточные рационы у личинок ставриды отмечены при переходе от смешанного к экзогенному типу питания (3-я размерная группа). В дальнейшем с ростом личинок рационы снижались. Аналогичную закономерность выявила Синюкова (1964). Однако по её данным величины рационов не зависели от количества кормовых организмов. Наши исследования показали, что более высокие рационы были у личинок из северо-западного и Кавказского секторов, в которых отмечено обилие копепод ранних стадий развития. В секторе ЮБК при низкой численности копепод личинок рыб обнаружено мало и все они, включая ставриду, имели пустые кишечники, что не характерно для этого вида (Дука, Синюкова, 1970).
Величины суточного рациона связаны с индексами потребления, а последние напрямую зависят от количества потреблённых пищевых организмов. В конце 1980-х гг. средние индексы потребления у личинок ставриды в районе Крыма составляли 130–140, у побережья Кавказа – 75–90‱ (Ткач, 1995). Летом 2019 г. индексы потребления существенно выросли относительно конца 1980-х гг. и варьировали, например у Кавказа, от 190 до 400‱, оставаясь при этом ниже показателей середины прошлого века. В свою очередь невысокие индексы потребления не всегда являются показателями плохих кормовых условий. Липская (1959) на примере султанки установила, что летом процесс переваривания пищи происходит быстрее, пища не накапливается в кишечнике. Вероятно, невысокие значения индекса потребления, полученные нами, обусловлены высокой температурой воды.
Синюкова (1964) отмечала чётко выраженную избирательность (два–три вида пищевых объектов) в питании личинок ставриды. Летом 2019 г. при отсутствии в море O. nana личинки 3-й размерной группы потребляли кладоцер и массовых в планктоне акарций, тогда как, по данным Синюковой (1964), акарций отмечали в питании личинок ставриды 4-й группы. Экологически близкий с O. nana вид O. davisae впервые зарегистрирован в Севастопольской бухте (Чёрном море) в начале 2000-х гг. (Загородняя, 2002), позже он появился в открытом море (Темных и др., 2012). Летом 2019 г. повышенная численность O. davisae отмечена только на нескольких прибрежных станциях, тогда как в открытом море она была низкой по сравнению с ранее массовой O. nana. В кишечниках личинок ставриды O. davisae встречалась только в Кавказском секторе. Личинки ставриды в основном потребляли массовые виды – акарций, науплиусов других каланоид и кладоцер, находящихся на ранних стадиях развития.
Исследования суточного ритма питания личинок ставриды (рис. 5) показали, что интенсивность питания разных возрастных групп может различаться, что совпадает с результатами, полученными Синюковой (1964).
Таким образом, в северной части Чёрного моря в июле–августе 2019 г. сложились благоприятные условия для развития личинок рыб: отмечена их высокая численность при доминировании промысловых видов – хамсы и ставриды. Личинки представлены широким размерным диапазоном, что в совокупности с обилием кормовых организмов в кишечниках указывает на хорошие условия для их развития и выживания и подтверждает результаты наших исследований на протяжении последних лет (Климова и др., 2019а, 2019б, 2019в, 2021).
ВЫВОДЫ
1. В Чёрном море в июле–августе 2019 г. идентифицированы личинки 21 вида рыб из 14 семейств. Средняя численность личинок варьировала от 2.5 экз/м2 на траверзе Керченского п-ова до 56.8 экз/м2 в северо-западном секторе исследований. Доминировали личинки хамсы: на шельфе они составили 79.3%, в глубоководных районах – 75.9% общей численности личинок рыб в этих акваториях. Вторыми по обилию были личинки ставриды, на долю которых приходилось соответственно 10.5 и 16.2%.
2. При отсутствии O. nana и невысокой численности О. davisae в открытом море личинки ставриды потребляли науплиусов акарции. Циклопоида О. davisae пополнила спектр питания личинок ставриды, однако встречалась в их кишечниках только в акваториях с высокой численностью рачка, например, у берегов Кавказа. В пищевом комке личинок хамсы TL 6.3–14.2 мм отмечены науплиальные стадии копепод (Calanoida) длиной 0.100–0.175 мм. В пищевом комке личинок ставриды доминировали Cladocera и Copepoda (Calanoida), в то время как в 1960-е гг. преобладали Copepoda (Cyclopoida). Летом 2019 г. средние размеры, индексы потребления (190–400‱) и рационы (2.0–21.2% массы тела) личинок ставриды оказались ниже величин, зафиксированных в середине прошлого столетия, что может быть связано с относительно невысокой численностью зоопланктона.
3. В зоопланктоне доминировали копеподы, более высокие численности которых зарегистрированы в северо-западном (10.2 тыс. экз/м3) и в Кавказском (2.2 тыс. экз/м3) секторах, отличавшихся обилием науплиусов копепод – основной пищей личинок рыб. В обоих секторах рационы личинок ставриды были выше, чем в остальной исследованной акватории. Летом 2019 г. циклопоида-вселенец O. davisae из-за низкой численности в море не имела существенного значения в питании личинок ставриды.
4. Обилие мелкого зоопланктона и данные по питанию личинок рыб подтверждают относительно хорошие кормовые условия летом 2019 г. по сравнению с 1990-ми гг., когда в Чёрном море регистрировали массовое развитие мнемиопсиса и резкое сокращение численности зоопланктона. Видовое разнообразие личинок рыб, их высокая численность, широкий размерный диапазон, обилие кормовых объектов в кишечниках личинок, среди которых преобладали копеподы и кладоцеры ранних стадий развития, свидетельствовали о благоприятных условиях питания, что является одним из важнейших факторов, определяющих выживание личинок.
Список литературы
Андреева Е.Н., Шебанова М.А. 2010. Видовой состав, распределение и особенности питания личинок и мальков рыб в Охотском море в октябре–декабре 2007 // Вопр. ихтиологии. Т. 50. № 1. С. 109–119.
Архипов А.Г. 2015. Применение результатов изучения раннего онтогенеза морских промысловых рыб в рыбохозяйственной деятельности // Тр. ВНИРО. Т. 156. С. 16–37.
Дехник Т.В. 1970. Распределение и численность пелагических икринок и личинок // Размножение и экология массовых рыб Чёрного моря на ранних стадиях онтогенеза. Киев: Наук. думка. С. 59–88.
Дехник Т.В. 1973. Ихтиопланктон Чёрного моря. Киев: Наук. думка, 234 с.
Дука Л.А., Синюкова В.И. 1970. Питание и пищевые взаимоотношения личинок массовых рыб Чёрного моря // Размножение и экология массовых рыб Чёрного моря на ранних стадиях онтогенеза. Киев: Наук. думка. С. 111–162.
Дука Л.А., Синюкова В.И. 1976. Руководство по изучению питания личинок и мальков морских рыб в естественных и экспериментальных условиях. Киев: Наук. думка, 134 с.
Загородняя Ю.А. 2002. Oithona brevicornis в Севастопольской бухте – случайность или новый вселенец в Черное море? // Экология моря. Вып. 61. С. 43.
Загородняя Ю.А., Морякова В.К. 2011. Зоопланктон как кормовая база промысловых пелагических рыб // Промысловые биоресурсы Черного и Азовского морей. Севастополь: ЭКОСИ-Гидрофизика. С. 257–269.
Ковалев А.В., Островская Н.А., Скрябин В.А., Загородняя Ю.А. 1995. Состояние зоопланктона, как кормовой базы рыб в Чёрном море // Современное состояние ихтиофауны Чёрного моря. Севастополь: Изд-во ИнБЮМ НАН Украины. С. 131–152.
Климова Т.Н., Вдодович И.В., Загородняя Ю.А. и др. 2019а. Ихтиопланктон и трофические взаимоотношения в планктонных сообществах прибрежной акватории юго-западного Крыма (Чёрное море) в летний сезон 2013 // Мор. биол. журн. Т. 4. № 2. С. 23–33. https://doi.org/10.33075/2220-5861-2019-1-97-105
Климова Т.Н., Мельников В.В., Серебренников А.Н. и др. 2019б. Особенности видового разнообразия и распределения ихтиопланктона у берегов Крыма в июле–августе 2017 г. // Системы контроля окружающей среды. № 1 (35). Севастополь: ЭКОСИ-Гидрофизика. С. 97–105. https://doi.org/10.33075/2220-5861-2019-1-97-105
Климова Т.Н., Субботин А.А., Мельников В.В. и др. 2019в. Пространственное распределение ихтиопланктона у Крымского полуострова в летний сезон 2013 г. // Мор. биол. журн. Т. 4. № 1. С. 63–80. https://doi.org/10.21072/mbj.2019.04.1.06
Климова Т.Н., Вдодович И.В., Субботин А.А. и др. 2021. Распределение ихтиопланктона в связи с особенностями гидрологического режима у берегов Крыма (Чёрное море) в весенне-летний сезон 2017 г. // Вопр. ихтиологии. Т. 61. № 2. С. 194–204. https://doi.org/10.31857/S0042875221020119
Кусморская А.П. 1950. О зоопланктоне Чёрного моря // Тр. АзЧерНИРО. Вып. 14. С. 177–214.
Липская Н.Я. 1959. Суточный и сезонный ход питания барабули (Mullus barbatus ponticus Essipov) // Тр. Севастоп. биостанции. Т. 11. С. 213–228.
Мельникова Е.Б., Кузьминова Н.С. 2020. Влияние температурного фактора на межгодовую динамику гонадосоматического индекса у средиземноморской ставриды (Trachurus mediterraneus) в прибрежных водах Крыма // Уч. зап. КФУ. Сер. Биология. Химия. Т. 6 (72). № 1. С. 97–109.
Петипа Т.С. 1957. О среднем весе основных форм зоопланктона Чёрного моря // Тр. Севастоп. биостанции. Т. 9. С. 39–57.
Синюкова В.И. 1964. Питание личинок черноморской ставриды // Там же. Т. 15. С. 302–325.
Сушкина А.П. 1940. Питание личинок проходных сельдей в р. Волге // Тр. ВНИРО. Т. 14. С. 171–210.
Темных А.В., Токарев Ю.Н., Мельников В.В., Загородняя Ю.А. 2012. Суточная динамика и вертикальное распределение пелагических Copepoda в открытых водах у юго-западного Крыма (Чёрное море) осенью 2010 г. // Мор. экол. журн. Т. 11. № 2. С. 75–84.
Ткач А.В. 1995. Питание личинок черноморских рыб // Современное состояние ихтиофауны Чёрного моря. Севастополь: Изд-во ИнБЮМ НАН Украины. С. 153–165.
Arashkevich E.G., Stefanova K., Bandelj V. et al. 2014. Mesozooplankton in the open Black Sea: Regional and seasonal characteristics // J. Mar. Syst. V. 135. P. 81–96. https://doi.org/10.1016/j.jmarsys.2013.07.011
Baltazar-Soares M., Hinrichsen H-H, Eizaquirre C. 2018. Integrating population genomics and biophysical models towards evolutionary based fisheries management // ICES J. Mar. Sci. V. 75. № 4. P. 1245–1257. https://doi.org/10.1093/icesjms/fsx244
Russell F.S. 1976. Family Gadidae // The eggs and planktonic stages of British marine fishes. London et al.: Acad. Press. P. 115–119.
WoRMS. 2022. World register of marine species. (https:www.marinespecies.org/index.php. Version 02/2022)
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


