Вопросы ихтиологии, 2023, T. 63, № 4, стр. 472-477
Структура агрессивного поведения сеголеток микижи Oncorhynchus mykiss (Salmonidae) меняется под влиянием паразитов Diplostomum pseudospathaceum (Trematoda)
В. Н. Михеев 1, *, А. Ф. Пастернак 2
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Институт океанологии РАН – ИО РАН
Москва, Россия
* E-mail: vicnikmik@gmail.com
Поступила в редакцию 26.09.2022
После доработки 11.10.2022
Принята к публикации 14.10.2022
- EDN: ROEVVP
- DOI: 10.31857/S0042875223040203
Аннотация
Представлены результаты изучения в течение 48 суток в экспериментальной гетерогенной среде динамики агрессивного поведения сеголеток микижи Oncorhynchus mykiss, заражённых метацеркариями трематод Diplostomum pseudospathaceum. За тёмный участок дна рыбы конкурировали, используя броски, укусы, преследования и демонстрации. Резко возросшая агрессивность рыб в период, когда паразиты стали инвазионными (1.0–1.5 мес. после заражения), то есть способными заражать окончательного хозяина (рыбоядные птицы), проявлялась в повышенной частоте укусов (более чем в 20 раз по сравнению с контролем) и бросков (почти в три раза) и сопровождалась быстрыми движениями, резкими манёврами и низкой способностью конкурировать за убежище. Вклад сравнительно медленных демонстраций и преследований был значительно меньше. Стратегия манипулирования D. pseudospathaceum поведением рыбы состоит из двух этапов: 1) защита хозяина от хищников, 2) повышение уязвимости хозяина. На первом этапе резко снижается общий уровень агрессии; на втором агрессивность стремительно возрастает, но меняется соотношение разных категорий агрессии. Повышается доля категорий, делающих хозяина более заметными для хищника. Высокая активность и низкая конкурентоспособность заражённых рыб способствуют их быстрому истреблению хищниками или перемещению в другой биотоп. Такая кочёвка/миграция рыб может повышать приспособленность паразита, способствуя его расселению в водоёме.
Конкуренция за ресурсы (пищу, убежище, полового партнёра) у многих животных сопровождается агонистическим поведением, включающим различные проявления агрессии и подчинения (Huntingford, Turner, 1987; Arnott, Elwood, 2009). Рыбы при захвате и защите территории используют разнообразный арсенал агрессивных действий (Keenleyside, Yamamoto, 1962). Агрессивное поведение требует больших трат времени и энергии (Katano, Iguchi, 1996), что может приводить к замедлению роста, снижению выживаемости и репродуктивного успеха у особей с высоким уровнем агрессии (Cutts et al., 1998; Grantner, Taborsky, 1998; Vøllestad, Quinn, 2003). Агрессивность обычно оценивают суммарным числом актов агрессии в единицу времени (Kalleberg, 1958; Metcalfe, 1986), но при более детальном анализе учитывают отдельные категории агрессии, формирующие структуру комплекса такого поведения: демонстрации (frontal and lateral displays), броски (charges), преследование (chasing), укусы (biting, nipping) (Keenleyside, Yamamoto, 1962; Mikheev et al., 2005).
В исследованиях абиотических и биотических внешних факторов, влияющих на агрессивное поведение рыб (Grant, 1997; Михеев, 2006; Earley, Hsu, 2013), сравнительно недавно обратили внимание на макропаразитов, модифицирующих поведение рыб-хозяев (Mikheev et al., 2010; Сливко и др., 2021). Сеголетки микижи Oncorhynchus mykiss, заражённые метацеркариями трематод Diplostomum pseudospathaceum, проявляли возрастающую агрессивность по мере того, как паразиты развивались в хрусталиках глаз рыбы (Mikheev et al., 2010). В указанной выше работе мы регистрировали общее число актов агрессии рыб за стандартный отрезок времени, не выделяя отдельные категории агрессивного поведения. В другом исследовании (Сливко и др., 2021) мы обнаружили, что молодь речного окуня Perca fluviatilis с разной заражённостью плероцеркоидами цестод Triaenophorus nodulosus проявляла не только разный уровень агрессии, но и демонстрировала разные виды агрессивных действий. Резко возросшую агрессивность заражённых инвазионными метацеркариями сеголеток микижи (Mikheev et al., 2010) мы интерпретировали как пример манипулирования поведением хозяина (Parker et al., 2009; Poulin, 2010), которое способствует успеху передачи паразита.
Мы предполагаем, что агрессивность заражённых рыб контролируют как сами рыбы, так и паразиты, цели которых противоположны. Если паразиту необходимо попасть вместе с рыбой в окончательного хозяина, то рыбе важно избежать этой участи. Повышенная агрессивность рыб с инвазионными метацеркариями трематод может быть выгодна паразиту, делая хозяина более заметным для хищника. С другой стороны, если такое поведение помогает рыбе более успешно захватывать убежище, то она становится менее доступной для хищника, что противоречит интересам паразита. Рассаживая парами заражённых и контрольных рыб, мы установили, что, несмотря на повышенную агрессивность, заражённые рыбы почти всегда проигрывали борьбу за убежище, что подтверждает гипотезу о манипулировании (Mikheev et al., 2010).
Столь неожиданный результат может быть связан не только с повышением общего числа актов агрессии у заражённых рыб, но и с изменениями в структуре их агрессивного поведения, т.е. соотношении частоты проявления отдельных категорий агрессии. Возможны следующие варианты модификации структуры поведения рыб, вызванные паразитами по мере их развития в глазах рыб: 1) частота проявления всех категорий агрессивного поведения повышается в равной степени, 2) у заражённых рыб появляются новые категории агрессивного поведения; 3) возрастает доля энергетически более затратных категорий (броски, укусы), сопровождающихся повышенной двигательной активностью. Недостаток ресурсов, связанный с вызванным паразитом ухудшением пищевого поведения (Crowden, Broom, 1980), может работать против этой гипотезы; 4) возрастает доля менее затратных категорий (демонстрации, преследование), что позволяет рыбе экономнее расходовать ресурсы.
Цель работы – исследовать динамику различных категорий агрессивного поведения сеголеток микижи, заражённых D. pseudospathaceum. В нашей рабочей гипотезе наиболее вероятными представляются следующие варианты модификации агрессивного поведения заражённых рыб: 1) повышение вклада категорий агрессии с высоким уровнем активности, что может резко повысить заметность (уязвимость) рыб для хищников; 2) напротив, преобладание категорий с низким уровнем активности делает рыб не столь заметными для хищников, но может продолжаться длительное время, таким образом увеличивая “окно уязвимости” для хищников.
МАТЕРИАЛ И МЕТОДИКА
Эксперименты проводили на биологической станции Конневеси университета Ювяскюля (Финляндия) в июле–сентябре 2005 г. Изменения структуры агрессивного поведения (соотношение различных актов агрессии) наблюдали у сеголеток микижи (средняя общая длина тела ± стандартная ошибка (SE) 89.1 ± 1.6 мм), заражённых метацеркариями D. pseudospathaceum. Контролем служили рыбы из той же выборки (получены с рыбной фермы) с невысоким уровнем естественного заражения D. pseudospathaceum (среднее ± SE 5.6 ± 0.6 метацеркарий на рыбу). Сравнение агрессивного поведения этих рыб с поведением сеголеток микижи близкого размера, полностью лишённых паразитов, показало, что при невысокой интенсивности заражения поведение рыб не меняется (Mikheev et al., 2010). Интенсивность заражения экспериментальной группы составляла (в среднем ± SE) 87.9 ± 5.8 метацеркарий на рыбу. Методика оценки интенсивности заражения рыб D. pseudospathaceum в экспериментальных исследованиях подробно изложена ранее (Seppälä et al., 2005a; Mikheev et al., 2010).
Организация эксперимента
Рыб (всего 280 особей) заражали в четырёх 150-литровых аквариумах в течение 30 мин при концентрации церкарий в воде 200 экз. на рыбу. После заражения рыб содержали в 1000-литровом проточном бассейне при температуре 15–16°С и естественном фотопериоде, где их кормили гранулированным кормом соответствующего размера. Такое же число контрольных рыб содержали в сходных условиях. Церкарии D. pseudospathaceum были получены от восьми заражённых прудовиков Lymnaea peregra, содержавшихся в холодильнике в темноте. За 4 ч до заражения рыб прудовиков поместили в банки объёмом 600 мл с профильтрованной озёрной водой, где их содержали при температуре 20°С и освещённости ~500 лк, что стимулировало выделение церкарий. Все церкарии были объединены в одной ёмкости, из которой брали 10 проб по 1 мл для оценки концентрации. Наблюдения за поведением экспериментально заражённых и контрольных рыб продолжали в течение 48 сут после заражения. Группы из пяти случайно выбранных особей (заражённых или контрольных) выпускали в средний отсек прямоугольного непрозрачного аквариума из коричневого пластика длиной 170 см и объёмом 180 л. Из среднего отсека длиной 30 см, шириной 30 см и высотой 40 см рыбы могли перемещаться в концевые отсеки (70 × 30 × 40 см) через прямоугольные отверстия у дна (5 × 3 см), снабжённые поднимающимися дверцами. Дно среднего и одного из концевых отсеков было покрыто белым пластиком, а дно другого концевого отсека было тёмно-коричневым. Молодь лососёвых предпочитает тёмное дно (Mikheev et al., 1996; Seppälä et al., 2005a), поэтому после периода обследования всего аквариума (от 0.5 до 1.0 ч) рыбы предпочитали держаться в отсеке с тёмным дном, что приводило к агрессивным взаимодействиям.
Экспериментальные процедуры
В начале каждого эксперимента рыб помещали в средний отсек с закрытыми дверцами, где они 15 мин привыкали к обстановке. Температуру поддерживали в пределах 15–16°С, освещённость – 150 лк. После акклимации дверцы поднимали, и рыбы могли свободно перемещаться по всему аквариуму в течение 3 ч. Подсчитывали число актов агрессии в группе из пяти рыб за 30 мин отдельно по категориям: броски, преследования, демонстрации и укусы (Keenleyside, Yamamoto, 1962). Двое наблюдателей из-за ширм с прорезями подсчитывали акты агрессии в группе два раза: 15 мин через 1.0 ч и 15 мин через 2.5 ч после акклимации. Для каждой повторности данные двух подсчётов суммировали. За два дня было выполнено по 12 наблюдений за группами заражённых и контрольных рыб. Наблюдения за поведением проводили четыре раза: через 1, 7, 30 и 48 сут после заражения. После каждого эксперимента рыб отсаживали в отдельные ёмкости и в дальнейшем в поведенческих экспериментах не использовали. В конце экспериментального периода рыб взвешивали и измеряли их длину. Интенсивность заражения (число метацеркарий в глазах рыбы) оценивали через 7 и 48 сут после заражения.
Статистическая обработка
Влияние интенсивности заражения и времени, прошедшего после заражения, на частоту актов агрессии оценивали для каждой категории агрессивного поведения с применением двухфакторного дисперсионного анализа. Для этого данные подвергали трансформации lg(x + 1). Для попарных апостериорных сравнений применяли тест Тьюки. Различия в массе тела и размерах между контрольными и заражёнными рыбами оценивали с помощью U-теста Манна–Уитни.
РЕЗУЛЬТАТЫ
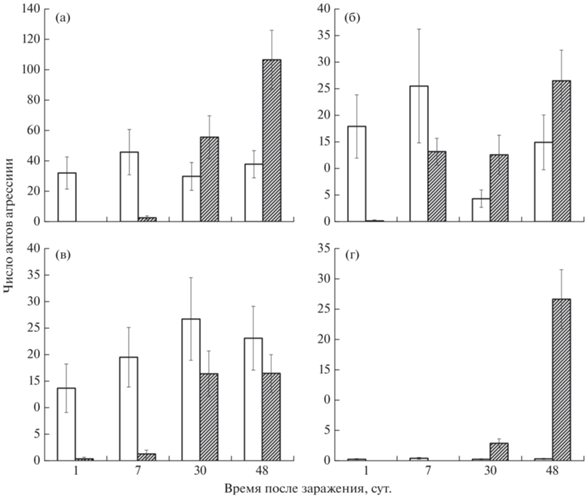
Динамика числа агрессивных взаимодействий (ЧА) в группах заражённых и контрольных рыб существенно различалась на протяжении 1.5 мес. после заражения церкариями D. pseudospathaceum (рисунок). При этом характер различий в первую неделю после заражения и к концу периода наблюдений был разнонаправленным. Дисперсионный анализ показал высоко достоверный эффект фактора заражённости для всех категорий агрессивного поведения (броски: F = 19.5, df = 1, p < 0.001; демонстрации: F = 33.28, df = 1, p < 0.001; укусы: F = 124.9, df = 1, p < 0.001), кроме преследований (F = 0.15, df = 1, p = 0.703). Достоверное влияние времени после заражения отмечено для всех категорий поведения (p < 0.001). Взаимодействие между факторами также было высоко достоверным для всех категорий (p < 0.001). В контроле ЧА менялось мало во всех категориях агрессивного поведения. Во всех попарных сравнениях в контроле (кроме одного) в четырёх временных срезах ЧА не различалось (тест Тьюки: p > 0.05). У заражённых рыб значительное снижение агрессивности относительно контроля в начальный период после заражения сменялось резким возрастанием числа бросков и укусов к концу наблюдений (тест Тьюки: p < 0.001) (рисунок, а, г). Число преследований (рисунок, б) и демонстраций (рисунок, в), хотя и выросло по сравнению с контролем в первую неделю после заражения, в конце периода наблюдений не превышало уровень контроля (тест Тьюки: p > 0.05). Средние значения длины и массы заражённых (118.7 ± 2.4 мм, 20.9 ± 1.28 г) и контрольных (119.0 ± 1.7 мм, 21.3 ± 0.92 г) рыб после 48 сут эксперимента достоверно не различались (U-тест Манна–Уитни соответственно: p = 0.97 и 0.95).
Динамика среднего числа (12 наблюдений) актов агрессии за 30 мин в группах из пяти
сеголеток Oncorhynchus mykiss в течение 48 сут после заражения рыб церкариями Diplostomum pseudospathaceum: a – броски, б – преследования, в – демонстрации, г – укусы; (◻) – контроль, ( ) – заражённые особи, (
) – заражённые особи, ( ) – стандартное отклонение.
) – стандартное отклонение.
ОБСУЖДЕНИЕ
Детальный анализ динамики (в течение 48 сут после заражения) агрессивного поведения заражённых D. pseudospathaceum сеголеток микижи показал, что резко возросшая агрессивность рыб с инвазионными метацеркариями проявлялась в повышении вклада бросков и укусов, сопровождающихся быстрыми движениями и резкими манёврами. Вклад гораздо более спокойных по проявлению демонстраций и преследований был значительно меньше и не отличался от контроля.
В первую неделю после заражения агрессивность рыб резко снижалась по сравнению с контролем. Такое изменение поведения хорошо согласуется с гипотезой “защиты хозяина от хищника” (predation suppression), предсказанной теоретически (Parker et al., 2009), и подкреплённой эмпирическими данными (Dianne et al., 2011; Weinreich et al., 2013). Не готовые к заражению окончательного хозяина (рыбоядной птицы) паразиты “не заинтересованы” в преждевременном поедании второго промежуточного хозяина (рыбы) хищниками. Манипулирование поведением хозяина в этот период направлено на минимизацию любых видов активности, делающих рыбу заметной и уязвимой для хищников. Инвазионной зрелости, т.е. способности заражать окончательного хозяина (рыбоядную птицу), метацеркарии D. pseudospathaceum достигают за 29–47 сут при температуре 18–22°С (Sweeting, 1974; Шигин, 1986; Voutilainen et al., 2010).
С этого времени (30 сут после заражения) мы наблюдали увеличение числа актов агрессии почти во всех категориях агрессивного поведения. Наиболее выражена эта тенденция была в случаях бросков и укусов, частота проявления которых к концу периода наблюдений значительно превышала уровень контроля. Напротив, частота преследований оставалась на уровне контроля, а частота демонстраций была даже несколько ниже. В целом тенденция возрастания агрессивности рыб при достижении паразитами инвазионного состояния подкрепляет основное положение гипотезы адаптивного манипулирования поведением хозяина – повышение уязвимости промежуточного хозяина для хищника (predation enhancement) (Lafferty, 1999; Parker et al., 2009).
На фоне общего повышения агрессии рыб в период достижения паразитами инвазионного состояния особый интерес представляет дифференцированное изменение разных категорий агрессивного поведения. В контроле на протяжении всего периода наблюдений (около 1.5 мес.) соотношение числа бросков, преследований и демонстраций было близким и мало менялось со временем. Укусы наблюдались крайне редко. У заражённых рыб самое значительное увеличение по сравнению с контролем отмечено для укусов (более чем в 20 раз) и бросков (почти в три раза) – наиболее энергетически затратных категорий поведения. Расход энергии при этом повышается за счёт резких манёвров и ускорений (Katano, Iguchi, 1996; Cutts et al., 1998). Вклад менее затратного поведения (демонстрации и преследование) в этот период был гораздо ниже. Несмотря на повышенную агрессивность заражённых инвазионными паразитами рыб, они почти всегда проигрывали конкуренцию за убежище менее агрессивным контрольным рыбам (Mikheev et al., 2010).
Нарушение зрения и пищевого поведения заражённых рыб (Crowden, Broom, 1980; Seppälä et al., 2005b) может снижать их рацион и ограничивать ресурсы, особенно необходимые в периоды интенсивного роста и двигательной активности. Однако в наших экспериментах, где рыбы получали корм в избытке, мы не наблюдали снижения массы тела у заражённых рыб по сравнению с контрольными, что указывает на высокую эффективность пищевого поведения у заражённых рыб.
Резкое возрастание доли быстрых поведенческих актов в комплексе агрессивного поведения может повышать заметность второго промежуточного хозяина для хищника в тот период, когда развившийся в нём паразит готов к заражению окончательного хозяина. Мы предполагаем, что быстрые и энергозатратные акты, такие как броски и укусы, делают заражённых рыб особенно хорошо заметными для окончательных хозяев – рыбоядных птиц, атакующих их с воздуха (Barber et al., 2000). Медленные и более продолжительные демонстрации и преследование, вероятно, делают заражённых рыб более уязвимыми для рыб-ихтиофагов, что паразиту невыгодно, поскольку его жизненный цикл при этом прерывается.
Анализ изменений агрессивного поведения сеголеток микижи, заражённых метацеркариями D. pseudospathaceum, и сравнение с поведением контрольных рыб показали, что стратегия манипулирования поведением второго промежуточного хозяина состоит из двух этапов: 1) защита хозяина от хищников, 2) повышение уязвимости хозяина. На первом этапе паразит резко снижает интенсивность всех категорий агрессивного поведения; на втором уровень агрессивности стремительно возрастает, но частота проявления разных категорий агрессии различна. Повышается доля тех категорий, которые делают хозяина более заметными для хищника.
Несмотря на высокий уровень агрессии и преобладание наиболее интенсивных актов агрессии, таких как броски и укусы, заражённые рыбы проигрывают незаражённым конкуренцию за территорию и убежища. В подобной ситуации их высокая двигательная активность способствует или их быстрому поеданию хищниками, или перемещению в другой биотоп. Такая кочёвка или миграция также может повышать приспособленность паразита, способствуя его расселению в водоёме. Какой вариант в этой дилемме: привязанность к биотопу или перемещение в новый биотоп (movers или stayers – по: Grant and Noakes, 1987) – предпочитает заражённая D. pseudospathaceum молодь лососёвых рыб? Для ответа на этот вопрос нужны специальные экспериментальные исследования.
ЗАКЛЮЧЕНИЕ
Что даёт рыбам способность использовать разные типы агрессивного поведения? Вероятно, это помогает им решать жизненно важные задачи в различных ситуациях, с которыми рыбы сталкиваются в неоднородной и изменчивой среде. Разнообразие и физиологические механизмы агрессии у животных давно привлекали исследователей (Moyer, 1968), но исследования этих аспектов поведения на рыбах сравнительно редки. Это довольно странно, поскольку одна из очень цитируемых статей по территориальному поведению атлантического лосося Salmo salar, где подробно исследованы и выделены категории агрессивного поведения (Keenleyside, Yamamoto, 1962), появилась более полувека назад. Ещё меньше внимания уделялось роли паразитов в регуляции агрессивного поведения, хотя их влияние как существенного фактора на другие аспекты поведения рыб уже давно признано (Moore, 1995; Barber et al., 2000; Poulin, 2010).
Известно, что склонные к агрессии рыбы не всегда используют свои максимальные возможности, а довольно тонко регулируют характер и интенсивность поведения в зависимости от ситуации. Так, в начальный период взаимодействий, например в борьбе за территорию, интенсивные акты агрессии в виде прямых атак на соперников наблюдаются часто; со временем, когда рыбы оценили обстановку и социальные роли определены, преобладают менее рискованные и энергетически затратные акты, такие как демонстрации (Noleto-Filho et al., 2017).
Поселившемуся в рыбе паразиту для решения своих задач (они принципиально иные, чем у рыб), вероятно, нет необходимости добавлять к весьма богатому поведенческому репертуару хозяина какие-то новые варианты агрессивного поведения. Достаточно регулировать интенсивность уже имеющихся категорий – от полного их выключения (неинвазионными паразитами) в период защиты от хищников до дифференцированной активизации (инвазионными паразитами) тех категорий поведения, которые делают хозяев гиперактивными и агрессивными. Такое поведение на фоне прочих рыб с обычной активностью значительно повышает их заметность (Landeau, Terborgh, 1986) для окончательного хозяина.
Список литературы
Михеев В.Н. 2006. Неоднородность среды и трофические отношения у рыб. М.: Наука, 191 с.
Сливко В.М., Жохов А.Е., Гопко М.В., Михеев В.Н. 2021. Агонистическое поведение молоди окуня Perca fluviatilis: влияние размеров рыб и заражённости макропаразитами // Вопр. ихтиологии. Т. 61. № 3. С. 356–361. https://doi.org/10.31857/S0042875221030164
Шигин А.А. 1986. Трематоды фауны СССР. Род Diplostomum. Метацеркарии. М.: Наука, 253 с.
Arnott G., Elwood R.W. 2009. Assessment of fighting ability in animal contests // Anim. Behav. V. 77. № 5. P. 991–1004. https://doi.org/10.1016/j.anbehav.2009.02.010
Barber I., Hoare D., Krause J. 2000. Effects of parasites on fish behaviour: a review and evolutionary perspective // Rev. Fish Biol. Fish. V. 10. № 2. P. 131–165. https://doi.org/10.1023/A:1016658224470
Crowden A.E., Broom D.M. 1980. Effects of eyefluke, Diplostomum spathaceum, on the behaviour of dace (Leuciscus leuciscus) // Anim. Behav. V. 28. № 1. P. 287–294. https://doi.org/10.1016/S0003-3472(80)80031-5
Cutts C., Metcalfe N.B., Taylor A.C. 1998. Aggression and growth depression in juvenile Atlantic salmon: the consequences of individual variation in standard metabolic rate // J. Fish Biol. V. 52. № 5. P. 1026–1037. https://doi.org/10.1111/j.1095-8649.1998.tb00601.x
Dianne L., Perrot-Minnot M-J., Bauer A. et al. 2011. Protection first then facilitation: a manipulative parasite modulates the vulnerability to predation of its intermediate host according to its own developmental stage // Evolution. V. 65. № 9. P. 2692–2698. https://doi.org/10.1111/j.1558-5646.2011.01330.x
Earley R.L., Hsu Y. 2013. Contest behaviour in fishes // Animal contests. Cambridge: Cambridge Univ. Press. P. 199–227. https://doi.org/10.1017/CBO9781139051248.012
Grant J.W.A. 1997. Territoriality // Behavioural ecology of teleost fishes. Oxford: Oxford Univ. Press. P. 81–103.
Grant J.W.A., Noakes D.L.G. 1987. Movers and stayers: Foraging tactics of young-of-the-year brook charr, Salvelinus fontinalis // J. Anim. Ecol. V. 56. № 3. P. 1001–1013. https://doi.org/10.2307/4962
Grantner A., Taborsky M. 1998. The metabolic rates associated with resting, and with the performance of agonistic, submissive and digging behaviours in the cichlid fish Neolamprologus pulcher (Pisces: Cichlidae) // J. Comp. Physiol. B. V. 168. № 6. P. 427–433. https://doi.org/10.1007/s003600050162
Huntingford F.A., Turner A.K. 1987. Animal conflict. London: Chapman and Hall, 448 p. https://doi.org/10.1007/978-94-009-3145-9
Kalleberg V. 1958. Observations in a stream tank of territoriality and competition in juvenile salmon and trout (Salmo salar L. and S. trutta L.) // Rep. Inst. Freshw. Res., Drottingholm. V. 39. P. 55–98.
Katano O., Iguchi K. 1996. Individual differences in territory and growth of ayu, Plecoglossus altivelis (Osmeridae) // Can. J. Zool. V. 74. № 12. P. 2170–2177. https://doi.org/10.1139/z96-245
Keenleyside M.H.A., Yamamoto F.T. 1962. Territorial behaviour of juvenile Atlantic salmon (Salmo salar L.) // Behaviour. V. 19. № 1–2. P. 139–168. https://doi.org/10.1163/156853961X00231
Lafferty K.D. 1999. The evolution of trophic transmission // Parasitol. Today. V. 15. № 3. P. 111–115. https://doi.org/10.1016/S0169-4758(99)01397-6
Landeau L., Terborgh J. 1986. Oddity and the “confusion effect” in predation // Anim. Behav. V. 34. № 5. P. 1372–1380. https://doi.org/10.1016/S0003-3472(86)80208-1
Metcalfe N.B. 1986. Intraspecific variation in competitive ability and food intake in salmonids: consequences for energy budgets and growth rates // J. Fish Biol. V. 28. № 5. P. 525–531. https://doi.org/10.1111/j.1095-8649.1986.tb05190.x
Mikheev V.N., Adams C.E., Huntingford F.A., Thorpe J.E. 1996. Behavioural responses of benthic and pelagic Arctic charr to substratum heterogeneity // Ibid. V. 49. № 2. P. 494–500. https://doi.org/10.1111/j.1095-8649.1996.tb00044.x
Mikheev V.N., Pasternak A.F., Tischler G., Wanzenböck J. 2005. Contestable shelters provoke aggression among 0+ perch, Perca fluviatilis // Environ. Biol. Fish. V. 73. № 2. P. 227–231. https://doi.org/10.1007/s10641-005-0558-8
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2010. Parasite-induced aggression and impaired contest ability in a fish host // Parasites Vectors. V. 3. Article 17. https://doi.org/10.1186/1756-3305-3-17
Moore J. 1995. The behaviour of parasitized animals // BioScience. V. 45. P. 89–96. https://doi.org/10.2307/1312610
Moyer K.E. 1968. Kinds of aggression and their physiological basis // Commun. Behav. Biol. Pt. A. V. 2. № 2. P. 65–87.
Noleto-Filho E.M., dos Santos Gauy A.C., Pennino M.G., Goncalves-de-Freitas E. 2017. Bayesian analysis improves experimental studies about temporal patterning of aggressive fish // Behav. Proc. V. 145. P. 18–26. https://doi.org/10.1016/j.beproc.2017.09.017
Parker G.A., Ball M.A., Chubb J.C. et al. 2009. When should a trophically transmitted parasite manipulate its host? // Evolution. V. 63. № 2. P. 448–458. https://doi.org/10.1111/j.1558-5646.2008.00565.x
Poulin R. 2010. Parasite manipulation of host behaviour: an update and frequently asked questions // Adv. Stud. Behav. V. 41. P. 151–186. https://doi.org/10.1016/S0065-3454(10)41005-0
Seppälä O., Karvonen A., Valtonen E.T. 2005a. Impaired crypsis of fish infected with a trophically transmitted parasite // Anim. Behav. V. 70. № 4. P. 895–900. https://doi.org/10.1016/j.anbehav.2005.01.021
Seppälä O., Karvonen A., Valtonen E.T. 2005b. Manipulation of fish host by eye flukes in relation to cataract formation and parasite infectivity // Ibid. V. 70. № 4. P. 889–894. https://doi.org/10.1016/j.anbehav.2005.01.020
Sweeting R. 1974. Investigations into natural and experimental infections of freshwater fish by the common eye-fluke Diplostomum spathaceum Rud. // Parasitology. V. 69. № 3. P. 291–300. https://doi.org/10.1017/s0031182000062995
Vøllestad L.A., Quinn T.P. 2003. Trade-off between growth rate and aggression in juvenile coho salmon, Oncorhynchus kisutch // Anim. Behav. V. 66. № 3. P. 561–568. https://doi.org/10.1006/anbe.2003.2237
Voutilainen A., Taskinen J., Huuskonen H. 2010. Temperature-dependent effect of the trematode eye flukes Diplostomum spp. on the growth of Arctic charr Salvelinus alpinus (L.) // Bull. Eur. Ass. Fish Pathol. V. 30. № 3. P. 106–113.
Weinreich F., Benesh D.P., Milinski M. 2013. Suppression of predation on the intermediate host by two trophically-transmitted parasites when uninfective // Parasitology. V. 140. № 1. P. 129–135. https://doi.org/10.1017/S0031182012001266
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


