Известия РАН. Серия биологическая, 2019, № 1, стр. 81-89
Роль канонического Wnt-сигналинга в морфогенезе и регенерации коркового вещества надпочечников крыс, подвергавшихся воздействию эндокринного дисраптора дихлордифенилтрихлорэтана в пренатальном и постнатальном периодах онтогенеза
Н. В. Яглова a, *, Д. А. Цомартова a, С. С. Обернихин a, С. В. Назимова a
a Научно-исследовательский институт морфологии человека
117418 Москва, ул. Цюрупы, 3, Россия
* E-mail: yaglova@mail.ru
Поступила в редакцию 05.09.2017
После доработки 08.06.2018
Принята к публикации 02.04.2018
Аннотация
Определена роль канонического Wnt-сигналинга в изменениях морфогенеза и регенерации коркового вещества надпочечников крыс пубертатного возраста, подвергавшихся воздействию эндокринного дисраптора дихлордифенилтрихлорэтана (ДДТ) в пренатальном и постнатальном периодах онтогенеза. Выявлены гипоплазия клубочковой и сетчатой зон коркового вещества и подавление в них активации канонического Wnt, особенно в сетчатой зоне, что указывает на важность роли этого сигнального пути в ее морфогенезе. Обнаружены нарушения гемоциркуляции в корковом веществе, приводящие к гибели участков пучковой зоны, активация пролиферации и регенерации, сопровождающаяся подавлением в ней канонического Wnt. Предположено, что нарушение активации канонического Wnt-сигналинга – один из механизмов дисрапторного действия ДДТ.
Развитие желез внутренней секреции в условиях ежедневного воздействия эндокринных дисрапторов – малоизученная область как с общебиологических, так и с медицинских позиций. Ее актуальность обусловлена увеличивающимся воздействием эндокринных дисрапторов на организм человека и животных и одновременным увеличением в последние десятилетия заболеваемости эндокринопатиями (ВОЗ, 2013). Эндокринные дисрапторы – органические соединения преимущественно антропогенного происхождения, способные нарушать гомеостатические механизмы регуляции метаболических процессов эндогенными гормонами, действуя в низких дозах, аналогичных дозам гормонов (Colborn et al., 1993). Наиболее распространенный дисраптор – пестицид дихлордифенилтрихлорэтан (ДДТ), фоновое содержание которого регистрируется во всех экосистемах планеты (Turusov et al., 2002; World…, 2012). ДДТ отличается не только высокой стойкостью к разложению, но и способностью к биоаккумуляции в пищевой цепи, вследствие чего его наибольшему воздействию подвергаются млекопитающие животные и человек (Diamanti-Kandarakis et al., 2002). Низкая молекулярная масса и высокая липофильность обусловливают способность ДДТ преодолевать гистогематические барьеры, в том числе плацентарный барьер, и оказывать действие на развитие органов и систем плода, в первую очередь эндокринной системы (Lopez-Espinosa et al., 2007; Kezios et al., 2013). Эндокриноциты коркового вещества надпочечников, отличающиеся высоким содержанием липидов, наиболее подвержены воздействию ДДТ. Известно, что большие дозы ДДТ способны вызывать селективный некроз клеток пучковой зоны (Asp et al., 2010). Однако роль низких доз ДДТ, механизмов их дисрапторного действия, а также их влияние на основные морфогенетические процессы (пролиферацию, миграцию, дифференцировку и апоптоз) мало исследованы. Один из ключевых путей, регулирующих деление, рост и дифференцировку клеток, – канонический Wnt-сигналинг (Logan, Nusse, 2004). Главным компонентом каскада канонического Wnt является β-катенин, трансдукция которого в ядро необходима для активации этого сигнального пути (Moon еt al., 2002). Известна роль канонического Wnt в формировании клубочковой зоны коркового вещества (Mandel et al., 2008; El Wakil, Lalli, 2011; Berthon et al., 2012; Drelon et al., 2015), появляются данные об участии Wnt в развитии пучковой зоны (Walczak et al., 2014).
Цель работы – изучение роли канонического Wnt/β-катенин-сигналинга в морфогенезе и регенерации коркового вещества надпочечников крыс пубертатного возраста, подвергавшихся воздействию эндокринного дисраптора ДДТ в пре- и постнатальном периодах онтогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент выполнен на самцах крыс Вистар (n = 24) (филиал “Столбовая” Научного центра биомедицинских технологий). За животными, содержавшимися в виварии, осуществлялся уход по нормам и правилам обращения с лабораторными животными в соответствии с Международными рекомендациями по проведению медико-биологических исследований с использованием животных (1985 г.), правилами лабораторной практики в Российской Федерации (Приказ МЗ РФ от 19.06.2003 г. № 267) и законом “О защите животных от жестокого обращения” (гл. V, ст. 10, 4679-ГД от 01.12.1999 г.).
Крысы опытной группы (ДДТ Е0-Р42) были получены от самок, которые с первого дня ссаживания с самцами до достижения потомством трехнедельного возраста вместо воды получали раствор о,п-ДДТ (концентрация 20 мкг/л). С 22-х сут потомство самостоятельно потребляло аналогичный раствор ДДТ до достижения ими пубертатного периода (42-е сут). Потребляемые дозы ДДТ учитывались ежедневно. Самостоятельное потребление ДДТ крысами составило 2.90 ± 0.12 мкг/(кг сут). Это кинетически обоснованная доза, соответствующая потреблению ДДТ человеком с продуктами питания в развитых странах (Yamazaki et al., 2010). Потребляемую дозу ДДТ рассчитывали с учетом требований к определению низких доз (Vandenberg et al., 2012) и нормативов содержания ДДТ в продуктах питания в Российской Федерации (Технический регламент Таможенного союза ТР ТС 021/2011, 2015). Крысы контрольной группы потребляли водопроводную воду. Отсутствие ДДТ и его метаболитов, а также родственных хлорорганических соединений в лабораторном корме и водопроводной воде было подтверждено методом газожидкостной хроматографии. Животных опытной и контрольной групп выводили из эксперимента передозировкой золетила.
Надпочечники фиксировали в жидкости Буэна. Изготавливали препараты экваториальных срезов надпочечников, которые окрашивали гематоксилином и эозином (Биовитрум, Россия). Гистологические препараты изучали методом световой микроскопии с использованием микроскопа Leica DM2500 (Leica Microsystems, Gmbh, Германия)
Морфометрическое исследование препаратов надпочечников проводили с помощью программы ImageScope (Leica Microsystems). Определяли общую площадь коркового вещества, а также площади клубочковой, промежуточной, пучковой и сетчатой зон. В сетчатой зоне подсчитывали число эндокриноцитов в 1 мм2 среза.
Иммуногистохимическое выявление β-катенина в эндокриноцитах коркового вещества надпочечников проводили с помощью моноклональных антител (Cell Marque, США). Для проявления иммунопероксидазной реакции использовали набор реактивов UltraVision LP detection system (ThermoFisher Scientific, США). Срезы докрашивали гематоксилином Майера. Подсчитывали число клеток с мембранной, цитоплазматической и ядерной локализациями β-катенина и выражали в виде процентов от общего числа клеток в пучковом и сетчатом слоях и в виде абсолютного числа иммунопозитивных клеток в 1 мм2 среза клубочковой зоны в связи с ее сложной трехмерной организацией. Активацию канонического Wnt/β-катенин-сигналинга оценивали по накоплению β-катенина в цитоплазме и транслокации его в ядро (Berthon et al., 2012; Kim et al., 2013).
Пролиферативную активность эндокриноцитов коркового вещества надпочечников определяли с помощью поликлональных антител к Ki-67 (Cell Marque, США). Число Ki-67-позитивных клеток выражали в процентах в пучковой и сетчатой зонах и в количестве клеток в 1 мм2 среза клубочковой зоны.
Полученные данные подвергали статистическому анализу с помощью программы Statistica 7.0 (Statsoft Inc., США). Для описания количественных признаков проводили анализ соответствия вида распределения признака закону нормального распределения с использованием критериев Колмогорова–Смирнова, Лиллиефорса, Шапиро–Уилка. Для описания центральных тенденций и рассеяния количественных признаков, имеющих приближенно нормальное распределение, использовали среднее значение и стандартную ошибку среднего значения (М ± m). Сравнение независимых групп по количественному признаку проводили с помощью t-критерия Стьюдента с учетом значений критерия Левена о равенстве дисперсий, по качественному признаку – с помощью χ2. Cтатистически значимыми различия считались при р < 0.01.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологическая характеристика надпочечников крыс. У крыс контрольной группы пубертатного возраста надпочечник представлял собой округлой формы орган, покрытый соединительно-тканной капсулой. При исследовании гистологических препаратов экваториальных срезов в корковом веществе надпочечников хорошо различались три зоны: клубочковая, пучковая и сетчатая.
Клубочковая зона располагалась под капсулой в виде непрерывного слоя равномерной толщины. Она была представлена эндокриноцитами удлиненной формы с круглыми и овальными ядрами и просветленной цитоплазмой, образующими клубочкоподобные структуры, между которыми выявлялись тонкие прослойки рыхлой соединительной ткани (рис. 1а). Просветы капилляров были очень малы и, как правило, заполнены плазмой. Между клубочковой и пучковой зонами у крыс контрольной группы выявлялись участки промежуточной зоны, представленной скоплениями клеток с небольшого размера гиперхромными ядрами овальной формы и резко оксифильной цитоплазмой.
Рис. 1.
Морфологические изменения клубочковой и пучковой зон коркового вещества надпочечников крыс, подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах развития. Окраска гематоксилином и эозином. Ув. 400. а – клубочковая и пучковая зоны надпочечника крыс контрольной группы; б – участок коркового вещества с отсутствием клубочковой зоны, расширением капилляров, стазом эритроцитов, дистрофией клеток пучковой зоны у крыс, подвергавшихся воздействию ДДТ; в – кровоизлияние и гибель эндокриноцитов в верхней части пучковой зоны; г – участок дискомплексации клеток и формирования трабекул в пучковой зоне коркового вещества надпочечника крыс, подвергавшихся воздействию ДДТ.
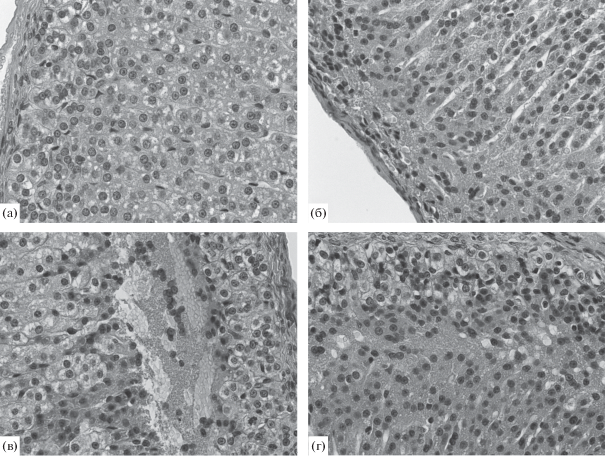
Площадь пучковой зоны составляла половину площади коркового вещества надпочечников (рис. 2а). Эта зона была представлена компактно расположенными радиальными тяжами более крупных эндокриноцитов округлой и кубической форм с оксифильной цитоплазмой и округлыми ядрами с центрально расположенным ядрышком. В цитоплазме большинства клеток были видны липидные капли. Между тяжами эндокриноцитов располагались сосуды микроциркуляторного русла, выстланные эндотелиоцитами с крупными удлиненной формы ядрами и хорошо различимым просветом, заполненным плазмой (рис. 1а).
Рис. 2.
Структура коркового вещества (а) и численности эндокриноцитов в единице площади среза сетчатой зоны (б) надпочечников у крыс контрольной группы (1) и подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах развитии (2) (M ± m). * – статистически значимые отличия от значений контрольной группы (р < 0.01); для рис. 2–4.
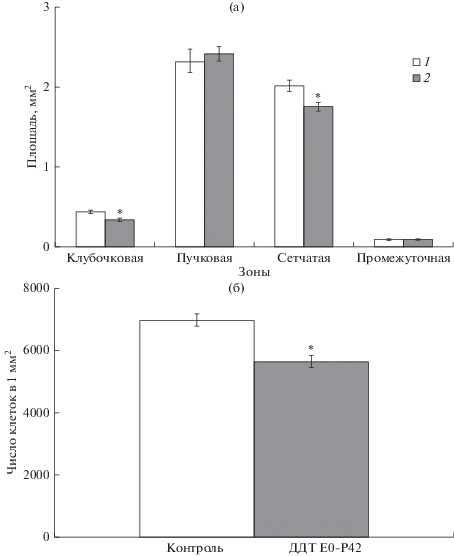
Сетчатая зона коркового вещества также была хорошо выражена (рис. 2а). Цитоплазма клеток имела ярко выраженные оксифильные свойства, в ней встречались липидные включения. Просветы сосудов микроциркуляторного русла характеризовались неравномерным кровенаполнением. В основном они были свободны, в остальных находилась плазма, реже единичные эритроциты.
В надпочечнике крыс, подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах развития, корковое и мозговое вещества также имели четкую границу. В структуре коркового вещества был выявлен ряд изменений. Площадь клубочковой зоны была меньше, чем в контрольной группе, что было следствием как уменьшения ее ширины, так и дефрагментации (рис. 1б, 2а). Встречались клетки с пикнотически измененными ядрами. В участках отсутствия клубочковой зоны непосредственно под капсулой располагались клетки промежуточной зоны. Наблюдались выраженные изменения в микроциркуляторном русле: сосуды были расширены, заполнены плазмой, отмечался стаз эритроцитов (рис. 1б).
Площадь пучковой зоны соответствовала таковой в контрольной группе (рис. 2а). У 40% животных в наружной части пучковой зоны выявлялись различающиеся по размерам участки кровоизлияний, дистрофии и гибели эндокринных клеток (рис. 1в). У 60% животных в наружной части пучковой зоны были участки, не имеющие характерной трабекулярной структуры и представляющие собой скопления клеток со слабооксифильной цитоплазмой и ядрами, идентичными по строению ядрам эндокриноцитов пучковой зоны, у 40% крыс отмечалось нарушение радиальной ориентации трабекул в пучковой зоне (рис. 1г). Сосуды микроциркуляторного русла не были расширены, но у некоторых животных в просветах наблюдались стаз и сладж эритроцитов.
Сетчатая зона была менее развита, чем у животных контрольной группы. Площадь сетчатой зоны и число клеток в 1 мм2 ее среза были меньше (рис. 2а, б), вследствие чего общее число клеток сетчатой зоны в экваториальном срезе надпочечника было существенно меньше контрольных значений. Клетки имели более оксифильную цитоплазму. Просветы сосудов, как правило, были свободны.
Экспрессия β-катенина эндокриноцитами надпочечников. У крыс контрольной группы в пубертатном периоде клубочковая зона коркового вещества характеризовалась высокой экспрессией β-катенина эндокриноцитами (рис. 3а). β-катенин локализовался преимущественно на цитоплазматических мембранах. Накопление β-катенина в цитоплазме было крайне слабо выражено, но клетки с транслоцированным в ядро β-катенином составляли четверть иммунопозитивных эндокриноцитов.
Рис. 3.
Экспрессия β-катенина эндокриноцитами клубочковой (а), пучковой (б) и сетчатой (в) зон коркового вещества надпочечников крыс контрольной группы и крыс, подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах развития (M ± m). 1–3 – мембрана, цитоплазма и ядро соответственно.
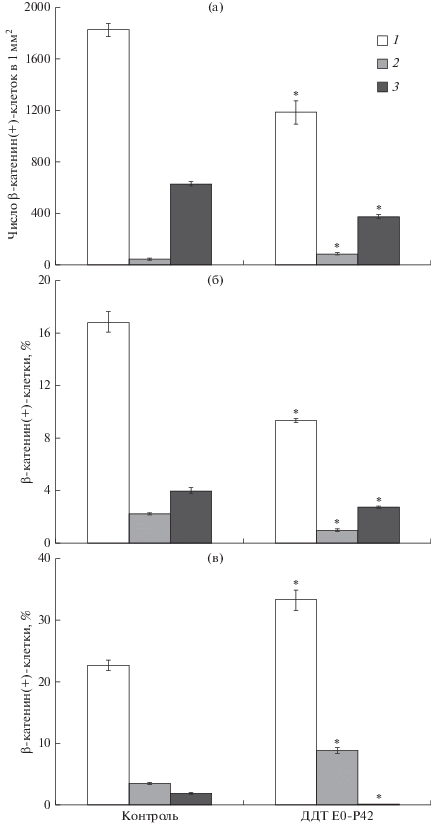
В пучковой зоне экспрессия β-катенина отличалась неоднородностью. Встречались участки с низким и повышенным числами β-катенин-позитивных клеток. По сравнению с клубочковой в пучковой зоне находилось больше клеток с накоплением β-катенина в цитоплазме, но меньшее число клеток с транслокацией его в ядро (рис. 3б).
В сетчатой зоне доля β-катенин-позитивных эндокриноцитов была близка к значениям пучковой зоны. У подавляющего большинства иммунопозитивных клеток β-катенин выявлялся в цитоплазматической мембране. Доля клеток с цитоплазматическим накоплением была аналогичной таковой в пучковой зоне, а доля клеток с ядерной локализацией β-катенина была наименьшей в корковом веществе (рис. 3в).
У крыс, подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах онтогенеза, число эндокриноцитов клубочковой зоны с мембранной локализацией β-катенина было в 1.5 раза меньше, чем в контрольной группе, но доля клеток с накоплением β-катенина в цитоплазме превышалa контрольные значения. Транслокация β-катенина в ядро была существенно снижена (рис. 3а).
В пучковой зоне доля β-катенин-позитивных клеток была статистически значимо меньше таковой в контрольной группе, отмечалось пропорциональное уменьшение числа клеток с ядерной, цитоплазматической и мембранной локализацией β‑катенина. В участках дискомплексации встречались единичные клетки либо с мембранной, либо с цитоплазматической локализацией β‑катенина (рис. 3б).
Эндокриноциты сетчатой зоны характеризовались повышенной экспрессией β-катенина по сравнению с клетками пучковой зоны. Доля клеток с мембранной локализацией β-катенина превышала соответствующие значения контрольной группы в 1.5 раза, с накоплением в цитоплазме – в 2.5 раза, однако доля клеток с ядерной локализацией β-катенина была статистически значимо меньшей (рис. 3в).
Пролиферативная активность эндокриноцитов коркового вещества надпочечников. У контрольных животных в пубертатном периоде число Ki-67-позитивных клеток было наибольшим в клубочковой зоне. В пучковой зоне пролиферирующие клетки располагались диффузно. В сетчатой зоне доля делящихся клеток была наименьшей (рис. 4).
Рис. 4.
Соотношение Ki-67-позитивных эндокриноцитов в клубочковой (а), пучковой (б) и сетчатой (в) зонах коркового вещества надпочечников у крыс контрольной группы и крыс, подвергавшихся воздействию низких доз ДДТ в пре- и постнатальном периодах развития (M ± m).
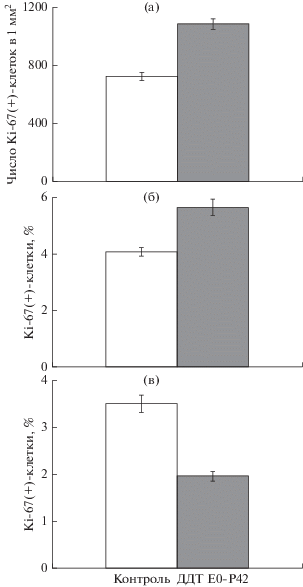
У крыс, подвергавшихся воздействию ДДТ, в клубочковой зоне было выявлено 1.5-кратное увеличение числа Ki-67-позитивных эндокриноцитов (рис. 4а). В пучковой зоне также отмечалось увеличение этого показателя в среднем на 40% (рис. 4б). Клетки в различных фазах митоза располагались диффузно, также встречались тяжи пролиферирующих эндокриноцитов. В участках с дискомлексацией эндокриноцитов Ki-67-позитивные клетки не выявлялись. В сетчатой зоне, напротив, доля пролиферирующих клеток была уменьшена почти вдвое (рис. 4в).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В пубертатном периоде надпочечники крыс характеризуются интенсивным развитием и усилением функциональной активности (Pignatelli еt al., 2006). Результаты морфологического исследования показывают, что пре- и постнатальное воздействия эндокринного дисраптора приводили к нарушениям морфогенеза коркового вещества, выраженным изменениями гемоциркуляции, гибели эндокриноцитов, и развитию репаративных процессов к пубертатному периоду.
Канонический Wnt/β-катенин-сигналинг – основной регулятор формирования зональности в корковом веществе и развития клубочковой зоны (Berthon et al., 2012). Его подавление приводит не только к нарушению развития, но и к функциональной незрелости эндокриноцитов клубочковой зоны, так как он индуцирует экспрессию рецепторов ангиотензина II (Walczak et al., 2014). Снижение активации β-катенина в постнатальном развитии обусловливало фрагментарность клубочкового слоя, а уменьшение числа клеток с локализацией β-катенина в плазмолемме свидетельствовало о повышении их пролиферативного потенциала, что подтверждали результаты исследования экспрессии маркера пролиферации Ki-67.
В наружных слоях пучковой зоны наблюдались репаративные процессы, которые развивались вследствие трофических нарушений, обусловленных дисциркуляторными расстройствами. В корковом и мозговом веществах надпочечников имеются собственные системы кровоснабжения, соединенные анастомозами. Венозная кровь из коркового и мозгового веществ оттекает в систему нижней полой вены, а из верхних слоев коркового вещества – в воротную вену (Яглов, Яглова, 2011). Благодаря анастомозам венозный кровоток мозгового вещества может быть перенаправлен в корковое, что приводит к гиперемии и стазам. У крыс, подвергавшихся воздействию ДДТ, опустошение венозных синусоидов мозгового вещества и резкое переполнение кровью сосудов микроциркуляторного русла наружной части коркового вещества указывало на значительный сброс крови в систему воротной вены, что приводило не только к венозному застою, но и к кровоизлияниям. Снижение числа клеток с мембранной локализацией β-катенина и ингибирование канонического Wnt-пути в пучковой зоне сочетались с повышением пролиферативной активности эндокриноцитов и появлением участков с несформировавшейся трабекулярной структурой.
Из литературных данных известно, что активация канонического Wnt/β-катенин-сигналинга подавляет дифференцировку эндокриноцитов пучковой зоны, но при этом не обнаруживается в пролиферирующих клетках (Berthon et al., 2010). В нашем исследовании эти данные нашли свое подтверждение, так как в участках регенерирующей пучковой зоны число β-катенин-позитивных клеток было крайне малым, а подавление активации β-катенина в пучковой зоне сопровождалось повышением пролиферации эндокриноцитов.
Роль канонического Wnt/β-катенин-сигналинга в развитии и обновлении клеточной популяции сетчатой зоны наименее изучена. Наше исследование показывает, что длительное воздействие низких доз ДДТ вызывает отставание в развитии сетчатой зоны на 42-е сут постнатального развития – период, когда фактически она является основным продуцентом андрогенов, поскольку активация стероидогенеза в семенниках у крыс начинается с 50-х сут (Pignatelli et al., 2006). Гипоплазия сетчатой зоны в отличие от таковой в клубочковой зоне сопровождалась увеличением доли клеток с мембранной локализацией β-катенина, а следовательно, с усилением формирования межклеточных контактов и пониженной пролиферативной активностью ее эндокриноцитов. Тем не менее, несмотря на ингибирование транслокации β-катенина в ядра, отмечалось увеличение доли клеток, накапливающих этот протеин в цитоплазме, т.е. отмечалось начало активации β-катенина как в сетчатой, так и в клубочковой зонах.
ЗАКЛЮЧЕНИЕ
Изменения активации канонического Wnt/β-катенин-сигналинга играют непосредственную роль в нарушениях постнатального морфогенеза коркового вещества надпочечников, обусловленных действием эндокринного дисраптора ДДТ. Подавление активации канонического Wnt вызывает гипоплазию клубочковой и сетчатой зон к пубертатному периоду развития. Наиболее длительное подавление канонического Wnt и, соответственно, пролиферативных процессов наблюдается в сетчатой зоне, что свидетельствует о важной роли этого сигнального пути в ее морфогенезе. Воздействие эндокринного дисраптора не влияет на развитие пучковой зоны коркового вещества, но обусловливает гибель ее клеток вследствие нарушений гемоциркуляции. Подавление канонического Wnt в пубертатном периоде способствует регенерации ткани.
Таким образом, нарушение активации канонического Wnt/β-катенин-сигналинга можно рассматривать как один из механизмов дисрапторного действия ДДТ в постнатальном периоде онтогенеза.
Работа выполнена по государственному заданию (Рег. номер АААА-А17-117013050048-6).
Список литературы
ВОЗ. Мировая статистика здравоохранения, 2013 г. Женева, 2014. 170 с.
Технический регламент Таможенного союза ТР ТС 021/2011 “О безопасности пищевой продукции”. СПб.: ГИОРД, 2015. 176 с.
Яглов В.В., Яглова Н.В. Основы частной гистологии. М.: КолосС, 2011. 431 с.
Asp V., Ulleras E., Lindstrom V., Bergstrom U., Oskarsson A., Brandt I. Biphasic hormonal responses to the adrenocorticolytic DDT metabolite 3-methylsulfonyl-DDE in human cells // Toxicol. Appl. Pharmacol. 2010. V. 242. P. 281–289.
Berthon A., Martinez A., Bertherat J., Val P. Wnt/b-catenin signalling in adrenal physiology and tumour development // Mol. Cell. Endocrinol. 2012. V. 351. P. 87–95.
Berthon A., Sahut-Barnola I., Lambert-Langlais S., de Joussineau C., Damon-Soubeyrand C., Louiset E., Taketo M.M., Tissier F., Bertherat J., Lefrancois-Martinez A.M., Martinez A., Val P. Constitutive {beta}-catenin activation induces adrenal hyperplasia and promotes adrenal cancer development // Hum. Mol. Genet. 2010. V. 19. P. 1561–1576.
Colborn T., vom Saal F.S., Soto A.M. Development effects of endocrine-disrupting chemicals in wildlife and humans // Environ. Health Perspect. 1993. V. 101. № 5. P. 378–384.
Diamanti-Kandarakis E., Bourguignon J.P., Giudice L.C., Hauser R., Prins G.S., Soto A.M., Zoeller R.T., Gore A.C. Endocrine-disrupting chemicals: an endocrine society scientific statement // Endocrine Rev. 2009. V. 30. P. 293–342.
Drelon C., Berthon A., Mathieu M., Martinez A., Val P. Adrenal cortex tissue homeostasis and zonation: A WNT perspective // Mol. Cell. Endocrinol. 2015. V. 408. P. 156–164.
El Wakil A., Lalli E. The Wnt/beta-catenin pathway in adrenocortical development and cancer // Mol. Cell. Endocrinol. 2011. V. 332. P. 32–37.
Gavert N., Ben-Ze’ev A. Beta-catenin signaling in biological control and cancer // J. Cell Biochem. 2007. V. 102. P. 820–828.
Kezios K.L., Liu X., Cirillo P.M., Cohn B.A., Kalantzi O.I., Wang Y., Petreas M.X., Park J.S., Factor-Litvak P. Dichlorodiphenyltrichloroethane (DDT), DDT Metabolites and Pregnancy Outcomes // Reprod. Toxicol. 2013. V. 35. P. 156–164.
Kim W., Kim M., Jho E.-H. Wnt/β-catenin signaling: from membrane to nucleus // Biochem. J. 2013. V. 450. P. 9–21.
Kohn A.D., Moon R.T. Wnt and calcium signaling: β-catenin-independent pathways // Cell Calcium. 2005. V. 38. P. 439–446.
Logan C.Y., Nusse R. The Wnt signaling pathway in development and disease // Ann. Rev. Cell Develop. Biol. 2004. V. 20. P. 781–810.
Lopez-Espinosa M.J., Granada A., Carreno J., Savatoerra M., Olea-Serrano F., Olea N. Organochlorine pesticides in placentas from Southern Spain and some related factors // Placenta. 2007. V. 28. P. 631–638.
Mandel H., Shemer R., Borochowitz Z.U., Okopnik M., Knopf C., Indelman M., Drugan A., Tiosano D., Gershoni-Baruch R., Choder M., Sprecher E. SERKAL syndrome: an autosomal-recessive disorder caused by a loss-offunction mutation in WNT4 // Am. J. Hum. Genet. 2008. V. 82. P. 39–47.
Moon R.T., Bowerman B., Boutros M., Perrimon N. The promise and perils of Wnt signaling through beta-catenin // Science. 2002. V. 296. P. 1644–1646.
Pignatelli D., Xiao F., Gouvtia A., Ferreira J., Vinson G. Adrenarche in the rat // J. Endocrinol. 2006. V. 191. № 1. P. 301–308.
Seifert J.R., Mlodzik M. Frizzled/PCP signalling: a conserved mechanism regulating cell polarity and directed motility // Nat. Rev. Genet. 2007. V. 8. P. 126–138.
Turusov V., Rakitsky V., Toamtis L. Dichlorodiphenyltrichloroethane (DDT): ubiquity, persistence, and risks // Environ. Health Perspect. 2002. V. 110. P. 125–128.
Vandenberg L., Colborn T., Hayes T., Heindel J., Jacobs Jr. D., Lee D., Shioda T., Soto A., vom Saal F., Welshons W., Zoeller R., Myers J. Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses // Endocrine Rev. 2012. V. 33. P. 378–455.
Walczak E.M., Kuick R., Finco I., Bohin N., Hrycaj S.M., Wellik D.M., Hammer G.D. Wnt signaling inhibits adrenal steroidogenesis by cell-autonomous and non-cell-autonomous mechanisms // Mol. Endocrinol. 2014. V. 28. № 9. P. 1471–1486.
World Health Organization. State of the Science of Endocrine-Disrupting Chemicals. Geneva: International Programme on Chemical Safety, 2012. 180 p.
Yamazaki H., Takano R., Shimizu M., Muruayama N., Kitajima M., Shono F. Human blood concentrations of dichlorodiphenyltrichloroethane (DDT) extrapolated from metabolism in rats and humans and physiologically based pharmacokinetic modeling // J. Health Sci. 2010. V. 56. № 5. P. 566–575.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


