Известия РАН. Серия биологическая, 2019, № 1, стр. 19-30
Участие канонического сигнального пути Wnt в определении полярности тела и клеточной идентичности у Metazoa: новые данные о развитии губок и аннелид
В. В. Козин a, *, И. Е. Борисенко a, Р. П. Костюченко a
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: v.kozin@spbu.ru
Поступила в редакцию 14.05.2018
После доработки 31.07.2018
Принята к публикации 31.07.2018
Аннотация
Проанализирована роль Wnt/β-катенинового пути межклеточной коммуникации в формировании плана строения тела у многоклеточных животных. Выявлено, что Wnt-каскад на разных этапах развития участвует в нескольких не связанных напрямую процессах: спецификации внутренних зародышевых листков, разметке переднезадней оси и терминальном росте. В результате биоинформационного анализа установлены независимая дивергенция Wnt-лигандов базальных Metazoa и консерватизм подсемейств Wnt в кладе Cnidaria+Bilateria. У личинок губок и аннелид обнаружена поляризованная экспрессия лигандов Wnt, подтверждающая применимость существующей модели паттернирования главной оси тела еще у двух таксонов. На основе выявления локализации β-катенина и проведенного ингибиторного анализа признано, что роль Wnt-пути в определении энтомезодермальной идентичности у нереидных полихет незначительна. Отмечена эволюционная тенденция создавать альтернативные механизмы даже для таких ключевых событий, как сегрегация зародышевых листков, если имеется усиление детерминативности и преобладание автономной спецификации, как происходит при гетероквадрантном спиральном типе развития.
ФОРМИРОВАНИЕ ЭМБРИОНАЛЬНЫХ И ДЕФИНИТИВНЫХ ОСЕЙ ТЕЛА В ОНТОГЕНЕЗЕ
Полярность и симметрия тела были и сейчас остаются центральными вопросами эволюционной морфологии и эмбриологии (Беклемишев, 1964; Иванова-Казас, 1995; Martindale, 2005; Wanninger, 2015a; Озернюк, Исаева, 2016; Genikhovich, Technau, 2017). Складывающиеся в ходе проэмбрионального и раннего эмбрионального периода осевые отношения создают основу плана строения и являются важнейшим признаком для сравнения таксонов высокого ранга. Полученные при таком анализе морфологические и онтогенетические ряды широко используются для объяснения эволюции морфотипа. Несомненно, перестройки дефинитивных осей в филогенезе сопряжены с изменениями на самых ранних этапах индивидуального развития, начиная с гаметогенеза и оплодотворения.
Традиционно в яйцах и ранних зародышах выделяют анимально-вегетативную полярность, которая изначально определялась эмбриологами по проспективному значению соответствующих частей ооплазмы (Иванова-Казас, 1995). Создаваемая в ходе оогенеза и ооплазматической сегрегации неравномерность в распределении материнских детерминантов предопределяет в большинстве случаев и дефинитивные оси тела (Isaeva, 2014). Однако пространственное и временно́е соотношения этих систем позиционной информации сильно варьируют у разных видов. Как правило, протаксонию – совпадение первичной полярности яйца (и соответствующей анизoтропии гаструлы) с главной (продольной) осью тела – отмечают у базальных типов Metazoa (губки, гребневики и книдарии) и у наименее дивергировавших представителей Bilateria, таких как некоторые турбеллярии, полихеты, ракообразные, личинки иглокожих (Беклемишев, 1964; Светлов, 1967; Иванова-Казас, 1995). Для остальных животных постулируется гетераксония, т.е. перекрещивание осей раннего зародыша и взрослого организма. Основная причина появления подобных проморфологических отношений состоит в преобразовании гаструляционных морфогенезов, которые нацелены на наиболее быстрое и эффективное создание плана строения (рационализацию процесса) (Иванова-Казас, 1995; Мамкаев, 2004).
На множестве филогенетически удаленных видов показано, что Wnt/β-катениновый путь межклеточной коммуникации может быть ключевым регулятором как эмбриональной, так и дефинитивной полярности тела (Petersen, Reddien, 2009). Реализуясь в сигнальных центрах типа губа бластопора у актинии Nematostella (Kraus et al., 2016) и позвоночных (Kiecker et al., 2015), гипостом у гидры (Broun et al., 2005), наиболее вегетативные клетки ранних эмбрионов эхинодермат (Kumburegama, Wikramanayake, 2008) и полухордовых (Darras et al., 2018), каудальный конец эмбрионов и регенератов планарий (Almuedo-Castillo et al., 2012), он участвует в спецификации зародышевых листков, терминальном росте и паттернировании переднезадней оси. Наиболее очевидная и общая для различных представителей Metazoa роль β‑катенина в развитии заключается в определении анимально-вегетативной оси зародыша. Асимметричное накопление β-катенина в ядрах бластомеров вегетативного полюса на самых ранних стадиях эмбриогенеза необходимо и достаточно для спецификации энтодермы/энтомезодермы и имеет решающее значение для создания переднезадней аксиализации эктодермы (Loh et al., 2016). Последние исследования на представителях Deuterostomia уверенно показали, что при паттернировании главной оси тела Wnt-сигналинг не столько определяет судьбу задних эктодермальных территорий, сколько вовлечен в подавление передних зачатков (Darras et al., 2018). Положительные инструктирующие стимулы канонического Wnt-пути критически важны как минимум для развития средней части тела, которая у позвоночных соответствует области заднего мозга и переднего конца спинного мозга.
Помимо переднезадней полярности принципиально важна дорсовентральная разметка зачатков. У билатерий исключительно консервативную роль в этом процессе играют противоположно направленные градиенты секретируемых лигандов Bmp/dpp и их антагонистов – Chordin/Short-gastrulation (Martindale, 2005; Genikhovich, Technau, 2017). У позвоночных эмбриональный организатор (дорсальная губа бластопора) секретирует разнообразные ингибиторы каскадов TGF-β (прежде всего блокирующие BMP) и Wnt – белки Chordin, Noggin, Cerebrus, Frizby, а также оказывающийся инактивированным BMP2 (De Robertis, 2009). Распространяясь вентрально, эти молекулы ограничивают активность лигандов BMP, которые в наибольшей концентрации определяют судьбу вентральной мезодермы и эктодермы. Дорсально расположенные клетки гаструлы детерминируются организатором как хордомезодерма и нейроэктодерма.
Яркие работы последних лет, выполненные в основном на книдариях и вторичноротых, показали существование относительно консервативной молекулярно-генетической программы осевой спецификации за счет Wnt (Holstein, 2012; Kraus et al., 2016; Loh et al., 2016; Darras et al., 2018). В связи с очевидным пробелом в понимании роли Wnt-пути у базальных Metazoa, а также у первичноротых из группы Spiralia возникает вопрос об эволюционном источнике и пластичности данной программы. Богатый материал для анализа поставленной проблемы предоставляют губки и аннелиды, послужившие центральными объектами данного исследования.
Идентификация оси симметрии у губок не вызывает сложности лишь в исключительных случаях – у некоторых однооскулюмных представителей Calcarea и Hexactinellida, а также у всех личинок. У взрослых губок данных таксонов можно обозначить морфологическую апикобазальную ось, соединяющую оскулюм с местом прикрепления губки к субстрату, образованным специализированными клетками – базопинакоцитами. У личинок же переднезадняя ось проявляется в их форме, анизотропии клеточного состава и направлении плавания. Гомология плана строения тела губок с таковым у Eumetazoa не вызывала сомнения у Геккеля (Haeckel, 1870). Однако одним из ключевых доказательств общности происхождения должно служить наличие сходной генной регуляторной сети. В современных работах у губок были описаны паттерны экспрессии многих генов, вовлеченных в спецификацию осей тела и энтомезодермы у билатерий (Adamska et al., 2007, 2010; Fortunato et al., 2014, 2015; Borisenko et al., 2016). Ленинджер с соавт. (Leininger et al., 2014) продемонстрировали, что ряд участников сигнальных путей Wnt и TGF-β экспрессируются в задней части личинки, а после метаморфоза – в оскулюме взрослой губки. В то же время для многих Bilateria и стрекающих показана активация Wnt-пути в области бластопора/гипостома на оральном полюсе. Сравнивая профили экспрессии гомологичных генов, авторы предполагают, что задний конец личинки и оскулюм губок гомологичны оральному полюсу Cnidaria. Радикальные изменения, происходящие в ходе метаморфоза Porifera на клеточном уровне, позволяют усомниться в преемственности осей между личинкой и рагоном (молодой губкой).
Рассматривая систему осей в онтогенезе губок, стоит обратить внимание на один из классов стрекающих – Anthozoa. Несмотря на отсутствие дорсовентральной оси, они все же обладают осью, залегающей перпендикулярно первичной, орально-аборальной – так называемой директивной осью. Директивная ось задается направлением, в котором уплощена гастральная полость, а также положением сифоноглифа и мышечных валиков в мезентериях. Подобно дорсовентральной оси билатерий, директивная ось специфицируется за счет сигнального пути BMP (лигандов суперсемейства TGF-β и их ингибиторов) (Genikhovich, Technau, 2017). Любопытно, что лиганды TGF-β экспрессируются у губки Amphimedon queenslandica (класс Demospongiae) в передней и средней частях личинки, а белки Wnt – на заднем полюсе личинки (Adamska et al., 2007). У представителя кальциевых губок Sycon ciliatum лиганды Wnt и TGF-β экспрессируются в одних и тех же клетках – макромерах, расположенных на заднем полюсе амфибластулы (Leininger et al., 2014). Филогенетический анализ этих сигнальных молекул показывает их диффузную экспансию в разных классах губок (Leininger et al., 2014; Borisenko et al., 2016; Genikhovich, Technau, 2017), но при этом очевидно, что путь TGF-β был у губок задействован в спецификации по крайней мере переднезадней оси личинки, а затем у стрекающих переключился на директивную ось.
Таким образом, имеются доказательства гомологии дефинитивных осей между Bilateria и представителем одного из классов губок Calcarea, тогда как для других представителей, например Demospongiae, молекулярные механизмы спецификации осей еще недостаточно изучены. В то же время преемственность осей между личинкой и взрослой губкой находится под вопросом, равно как и само наличие оси у многооскулюмных губок. Кроме того, если учитывать истинное значение анимально-вегетативной полярности в предопределении зародышевых листков, которые у губок отсутствуют (Ereskovsky, Dondua, 2006; Дондуа, Костюченко, 2013; Nakanishi et al., 2014), возникает вопрос: корректно ли гомологизировать проморфологию их ооцитов/зигот с таковой у других животных?
МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ Wnt-СИГНАЛИНГА И ЕГО РЕПЕРТУАР У Metazoa
Канонический Wnt/β-катениновый сигналинг осуществляет межклеточную коммуникацию путем секреции лигандов, белков семейства Wnt, и рецепции их компетентной клеткой (рис. 1). Ключевой цитоплазматический белок – β-катенин – играет роль в клеточной адгезии и активации генов-мишеней в ядре. В отсутствие лиганда пул β-катенина в цитоплазме разделен на две части. Одна из них вместе с α-катенином обеспечивает связь актиновых микрофиламентов с внутриклеточным доменом Е-кадгерина, т.е. β-катенин контролирует взаимодействие адгезивных контактов с цитоскелетом. Другая часть пула связана с аксином, мультидоменным белком, входящим вместе с киназами GSK3β и CK1 и белком АРС в состав разрушающего комплекса. Находясь в комплексе, СК1 и GSK3β последовательно фосфорилируют консервативные остатки серина и треонина на N-конце связанного β-катенина, формируя сайт распознавания для убиквитинлигазы β-Trcp (Aberle et al., 1997; Zeng et al., 2005). Убиквитинилированный β-катенин подвергается быстрой деградации в протеасомах. Таким образом, в отсутствие Wnt-лиганда в цитоплазме поддерживается низкий уровень β-катенина.
Рис. 1.
Схема канонического Wnt-пути. Слева неактивное состояние: в отсутствие лиганда Wnt многокомпонентный разрушающий комплекс (destruction complex) обеспечивает фосфорилирование и деградацию β-катенина. Справа активированное состояние: после связывания лиганда с рецепторами и диссоциации разрушающего комплекса происходит накопление β-катенина в цитоплазме и ядре клетки, где запускается транскрипция генов-мишеней.
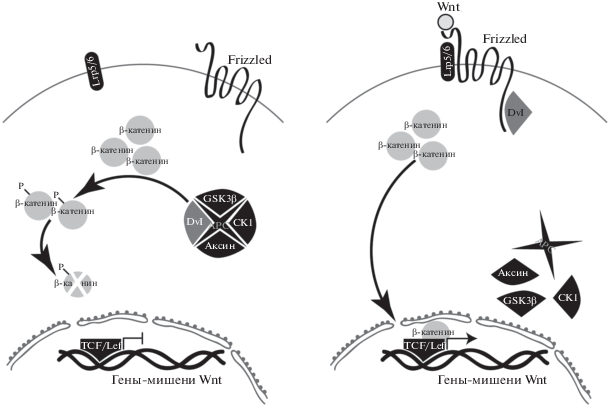
Вне зависимости от Wnt-сигналинга транскрипционный фактор Tcf/Lef связывается в ядре с энхансерами и промоторами генов-мишеней. В отсутствие в ядре β-катенина Tcf функционирует как репрессор транскрипции генов-мишеней путем привлечения кофакторных белков семейства Groucho/TLE (Cavallo et al., 1998; Roose et al., 1998).
Секретированный Wnt-лиганд связывается с рецептором Frizzled (Fzd) и корецептором LRP5/6. Тримерный комплекс Wnt–Fzd–LRP5/6 рекрутирует к мембране цитоплазматический аксин из разрушающего комплекса и белок Dishevelled, что ведет к подавлению фосфорилирования β-катенина и обеспечивает его стабилизацию. β-катенин накапливается в цитоплазме и входит в ядро, где связывается с N-концом Tcf, смещает ингибитор Groucho/TLE и привлекает активаторы транскрипции (например, гистоновые ацетилазы), запуская экспрессию генов-мишеней (Behrens et al., 1996). В геноме млекопитающих идентифицировано >400 генов-мишеней комплекса Tcf/β-катенин. Лишь небольшая их часть может быть активирована в данный момент в данной клетке. Это ограничивает потенциальный эффект активации сигнального каскада наиболее актуальными потребностями самой клетки (Clevers, 2006).
Во время диффузии между клетками лиганд может быть блокирован секретируемой формой рецептора secreted Frizzled-related protein (sFRP), что предотвращает активацию цитоплазматического рецептора. Также ингибирование пути происходит при связывании белка Dickkopf с рецептором Frizzled. Два этих антагониста Wnt-каскада, sFRP и Dickkopf, выполняют модулирующую функцию (Cruciat, Niehrs, 2013).
Все Wnt представляют собой секретируемые гликопротеины, особенность которых – наличие 22 почти инвариантно расположенных остатков цистеина. Они формируют внутримолекулярные дисульфидные связи, поддерживающие глобулярную вторичную структуру лиганда (Miller, 2002). За счет цистеиновых остатков Wnt связывается с цистеин-богатым доменом (CRD), расположенным во внеклеточной части рецептора Frizzled. Рецептор имеет обширный N-концевой CRD, семь трансмембранных доменов и короткий C-концевой участок, обращенный в цитоплазму. Взаимодействие с Dishevelled происходит за счет консервативных аминокислотных мотивов KTxxxW, расположенных в цитоплазматических участках Frizzled между трансмембранными доменами. Вторичный мессенджер Dishevelled связывается с этими участками высококонсервативным PDZ-доменом, расположенным в центральной части молекулы. N-терминальный домен DIX обеспечивает полимеризацию Dishevelled по принципу “голова к хвосту”, С-терминальный домен DEP несет сильный положительный заряд и отвечает за рекрутирование Dishevelled к плазмалемме. Полимеризация Dishevelled позволяет использовать его как динамичную платформу для сборки белковых комплексов с низкой авидностью (Dishevelled/аксин, например). Аксин представляет собой крупный мультидоменный белок, взаимодействующий с Dishevelled за счет своего С-концевого домена, а также непосредственно с β-катенином и с входящими в состав разрушающего комплекса белками GSK3β, CK1 и АРС. Рекрутирование аксина к мембране за счет связанного с ним Dishevelled ведет к разборке комплекса и стабилизации β-катенина (MacDonald, He, 2013).
Сигнальный путь Wnt играет важную роль в различных процессах развития, но доминирующим среди них считается процесс спецификации осей. Участие Wnt в спецификации осей в развитии показано у многих Metazoa, начиная с Cnidaria (Holstein et al., 2011). Несмотря на то что элементы внутриклеточного каскада передачи сигнала идентифицированы у одноклеточных эукариот (например, гомологи β-катенина, киназы GSK3β, рецепторов Frizzled), гены wnt появляются в эволюции только у Metazoa, включая губок. Чем больше видов губок подвергаются филогенетическому анализу в разрезе репертуара лигандов, в том числе Wnt, тем очевиднее становится, что эволюция Wnt-пути шла по отдельному сценарию с дупликациями и утратами отдельных сигнальных молекул в каждом из классов губок – Demospongiae, Hexactinellida, Calcarea и Homoscleromorpha. Так, у кальциевых губок число лигандов близко к таковому у позвоночных из-за дупликации генома, а у стеклянных губок лиганды Wnt отсутствуют, хотя имеются многие другие участники Wnt-пути (вероятно, вследствие синцитиальной природы губок данного класса) (Leininger et al., 2014; Schenkelaars et al., 2017).
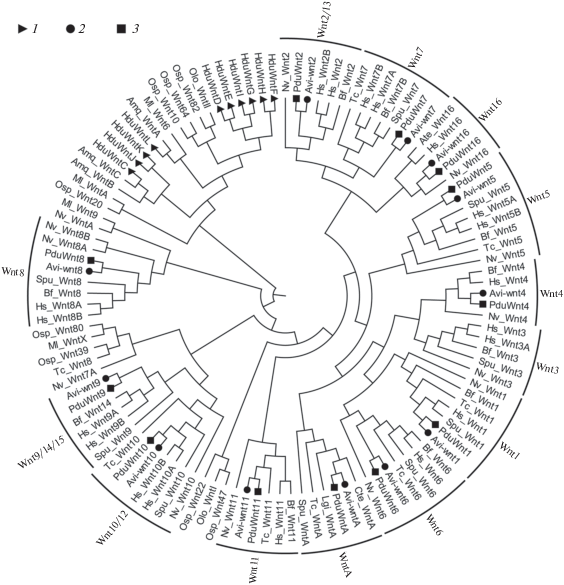
На основании филогенетического анализа лиганды Eumetazoa (Cnidaria+Bilateria) группируют в 13 подсемейств: от Wnt1 до Wnt11, Wnt16 и WntA. Все первичноротые лишены wnt3, тогда как wnt1, wnt5 и wntA высококонсервативны у большинства Protostomia (Holstein et al., 2011). Остается открытым вопрос о числе первых wnt-генов и их происхождении.
По проведенному нами анализу in silico можно судить о сохранении анцестрального для билатерий состава участников Wnt у нереидных полихет Alitta virens и Platynereis dumerilii. Напротив, у губок отсутствуют некоторые внеклеточные модуляторы (DKK, WIF, Wise/SOST), а набор лигандов Wnt неповторим в разных филогенетических линиях, что может свидетельствовать об альтернативных путях создания отличающихся регуляторных состояний на единой основе Wnt-сигналинга (рис. 2). Дендрограмма (рис. 2) демонстрирует, что гены нереид хорошо укладываются в семейства, образованные известными wnt билатерий, тогда как сиквенсы демоспонгии Halisarca dujardini кластеризуются вместе или (с низкой поддержкой) с последовательностями других губок и ктенофор, не показывая аффинность к какому-либо из описанных семейств.
Рис. 2.
Филогенетическое древо (алгоритм Neighbor-Joining), отражающее положение последовательностей wnt у губки Halisarca dujardini и аннелид Alitta virens и Platynereis dumerilii среди остальных Metazoa. Amq – Amphimedon queenslandica; Bf – Branchiostoma floridae; Hs – Homo sapiens; Ml – Mnemiopsis leidyi; Nv – Nematostella vectensis; Ol – Oscarella lobularis; Osp – Oscarella sp.; Sp – Strongylocentrotus purpuratus; Tc – Tribolium castaneum. 1 – гены H. dujardini, 2 – A. virens, 3 – P. dumerilii.
ЛОКАЛИЗАЦИЯ И ИНДУКТИВНЫЙ ПОТЕНЦИАЛ КОМПОНЕНТОВ Wnt В РАЗВИТИИ Porifera
В качестве аргументов в пользу участия сигнального пути Wnt в спецификации осей у губок рассматриваются две группы результатов. Первая группа включает в себя данные по пространственной экспрессии участников сигнального пути – лигандов, рецепторов, внутриклеточных мессенджеров. Так, у губок Oscarella lobularis (Homoscleromorpha), S. ciliatum (Calcarea) и H. dujardini (Demospongiae) показана экспрессия некоторых Wnt-лигандов в оскулюме взрослой губки и на заднем полюсе личинки (Lapébie et al., 2009; Leininger et al., 2014; Borisenko et al., 2016). Однако у пресноводной демоспонгии Ephydatia muelleri экспрессия wnt была показана в отдельных клетках мезохила, но не в районе оскулюма.
Вторая группа результатов получена в ходе экспериментов с фармакологическими агентами, нарушающими (блокирующими или активирующими) сигнальный путь Wnt. Для O. lobularis была показана зависимость между искусственной активацией сигналинга и формированием эктопических остий – приносящих отверстий водоносной системы (Lapébie et al., 2009). У пресноводной E. muelleri такая же зависимость была описана в отношении формирующихся de novo оскулюмов (Windsor, Leys, 2010). Однако авторы признают, что фармакологические ингибиторы не являются абсолютно специфичными, имеют побочные эффекты, а результаты их действия не всегда поддаются однозначной интерпретации (Windsor Reid et al., 2018).
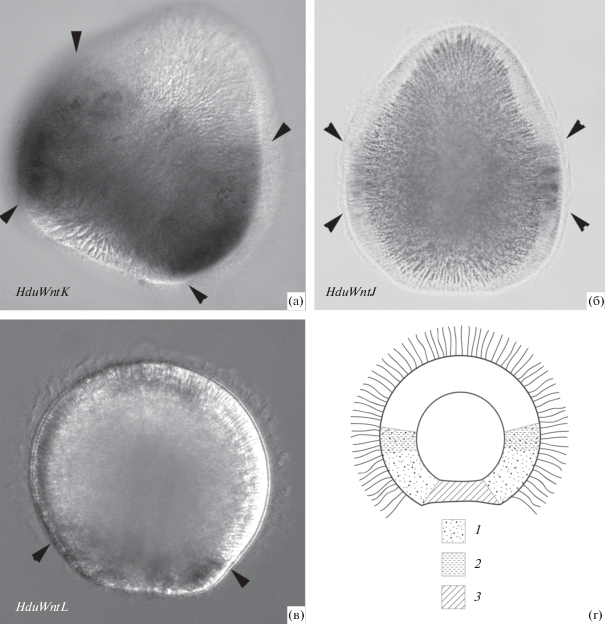
Хотя Виндзор Рейд с соавт. (Windsor Reid et al., 2018) критически относятся к участию Wnt-пути в спецификации осей у губок и считают совпадением экспрессию лигандов в оскулюме и на заднем полюсе личинки, у демоспонгии со слабо выраженной аксиализацией – морского вида-космополита H. dujardini – был показан комплексный паттерн экспрессии различных wnt. Так, HduWntD и HduWntE экспрессируются в оскулюме, HduWntG – в экзопинакоцитах, за исключением клеток оскулюма, а HduWntH – на границе экзо- и базопинакодермы (Borisenko et al., 2016). По нашим новым результатам, у личинки H. dujardini гены wnt экспрессируются перекрывающимися доменами в заднем полушарии: HduWntJ – полосой по экватору, HduWntK – в задней половине тела личинки (за исключением клеток заднего полюса), HduWntL – только в клетках заднего полюса (рис. 3). Полученная картина напоминает проявление Wnt-кода у стрекающих, который позволил рассматривать Wnt-сигналинг механизмом спецификации переднезадней оси, предшествующим появлению системы Hox-генов (Guder et al., 2006). Впрочем, в последних работах на стрекающих показано, что, хотя их система Hox-генов гораздо скуднее таковой у Bilateria, они все же принимают участие в разметке орально-аборальной оси, а Wnt-сигналинг опосредует взаимодействие между оральным и аборальным сигнальными центрами (DuBuc et al., 2018).
Рис. 3.
Экспрессия генов wnt у личинки губки Halisarca dujardini. Передний полюс направлен вверх. а–в – гибридизация in situ, локализация транскриптов показана стрелками. а – экспрессия HduWntK (1), поверхностный фокус; б – экспрессия HduWntJ (2), фокусировка в глубине; в – экспрессия HduWntL (3), фокусировка в глубине; г – схема взаимного расположения доменов экспрессии у личинки (продольный срез).
Таким образом, имеются две точки зрения, одна из которых постулирует гомологию между орально-аборальной осью Cnidaria и апикобазальной осью губок (по крайней мере, у Calcarea), имея основным доводом участие Wnt-сигналинга в определении этих осей (Leininger et al., 2014). Авторы, придерживающиеся противоположных взглядов, отрицают участие Wnt в спецификации осей у губок (Windsor Reid et al., 2018), опираясь на эксперименты с ингибиторами и результаты гибридизации in situ на одном виде. Мы поддерживаем возможность участия Wnt-пути в спецификации осей у губок: даже у взрослой H. dujardini экспрессия различных лигандов задает подобие оси. Вместе с тем следует признать, что более фундаментальный вопрос наличия поляризованных осей у дефинитивных особей остается недостаточно проработанным и дискуссионным. Дальнейшее исследование представителей всех классов губок, а также других механизмов межклеточной коммуникации, поможет решить эту задачу.
РОЛЬ Wnt В ОСЕВОМ ПАТТЕРНИРОВАНИИ И СПЕЦИФИКАЦИИ МЕЗЭНТОДЕРМЫ У Spiralia
Среди животных, традиционно относимых к группе Spiralia, исключительной ценностью для теоретического обобщения роли Wnt в обеспечении переднезадней полярности обладают свободноживущие плоские черви – планарии. Во взрослом состоянии задний конец тела планарий является источником сигнальных молекул, в том числе нескольких лигандов семейства Wnt (Almuedo-Castillo et al., 2012). Нокдаун соответствующих генов ведет к развитию по всей периферии червя головных структур: церебральных ганглиев и глаз. Подобный антериоризованный фенотип получают и при подавлении ортологов β-катенина, что подтверждает необходимость постоянно работающего сигнального центра у взрослых животных (Cebrià et al., 2015). Двухголовые планарии образуются и в случае регенерации из передних фрагментов тела, если подавлен канонический Wnt-сигналинг. При этом отмечается дозозависимый эффект экспериментального воздействия: от умеренной антериоризации до замещения срединных участков туловища, содержащих глотку, и далее вплоть до полной утраты главной оси, т.е. радиализации. На противоположном (переднем) конце тела активно экспрессируются антагонисты Wnt, такие как sFRP и Notum. Без них, равно как при подавлении APC и аксина, наблюдается обратный феномен – постериоризация. Все эти данные убеждают в существовании градиента морфогенов – компонентов функционирующего канонического Wnt-пути, определяющих переднезаднюю полярность, начиная с поздних стадий эмбриогенеза (Martín-Durán et al., 2012; Cebrià et al., 2015).
Хотя данных о работе Wnt в развитии других представителей Spiralia совсем немного, определенный консерватизм экспрессии лигандов ближе к заднему концу тела наблюдается у аннелид (Cho et al., 2010; Janssen et al., 2010; Pruitt et al., 2014) и брахиопод (Vellutini, Hejnol, 2016), а по предварительным сообщениям – у моллюсков и немертин (Wanninger, 2015b). Следует, однако, отметить, что указанные опубликованные работы преимущественно носят описательный характер, т.е. выполнены без функционального теста. Единственное исключение – недавнее исследование Wnt-сигналинга у зародышей двух видов дальнеродственных брахиопод (Vellutini, Hejnol, 2016). Авторы уверенно продемонстрировали как консерватизм экспрессии wnt1 на заднем полюсе (в дорсальной губе бластопора), так и эффект постериоризации в условиях ингибирования антагонистов каскада, т.е. при его гиперактивации.
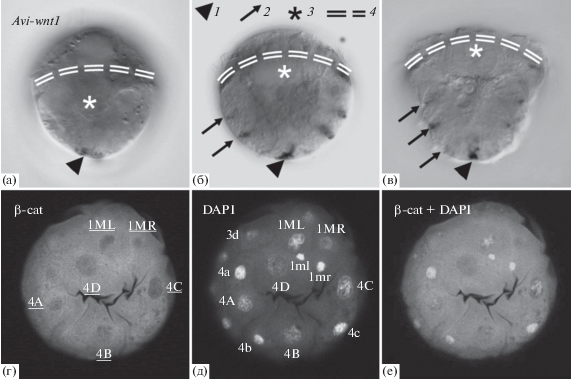
Наиболее подробно локализацию транскриптов компонентов Wnt изучали у нереидной полихеты P. dumerilii (Prud’homme et al., 2003; Janssen et al., 2010; Pruitt et al., 2014; Bastin et al., 2015). Примечательно, что самые ранние домены экспрессии нескольких wnt приурочены к дорсальной стороне в протяженной экваториальной и анимальной областях зародыша (Pruitt et al., 2014). Ближе к анимальному/переднему полюсу обнаруживаются транскрипты рецепторов Frizzled и растворимых блокаторов (sFRP), что укладывается в общую для билатерий модель встречно-направленных градиентов морфогенов, размечающих переднезаднюю ось тела. На более поздних стадиях, начиная с ранней трохофорной личинки P. dumerilii, сигнал мРНК большинства паралогов wnt появляется на заднем полюсе тела. По нашим данным, wnt1 сходным образом экспрессируется у личинок и ювенильных особей нереиды A. virens (рис. 4а–в). До стадии поздней трохофоры транскрипты Avi-wnt1 выявляются в области проктодеума в поверхностных клетках. У метатрохофор появляются дополнительные посегментно организованные полосы экспрессии, а терминально сигнал Avi-wnt1 маркирует развивающуюся заднюю кишку. На несколько более продвинутой стадии, чем у нереид, начинает экспрессироваться wnt1 в анальной области седентарной полихеты Capitella teleta (Seaver, Kaneshige, 2006).
Рис. 4.
Распределение компонентов Wnt-сигналинга в развитии аннелиды Alitta virens. а–в – экспрессия гомолога wnt1/wg у личинок, гибридизация in situ. 1 – каудальный домен экспрессии, 2 – домены вдоль задних границ зачатков сегментов, 3 – стомодеум, 4 – прототрох. а – ранняя трохофора; б – средняя трохофора; в – ранняя метатрохофора; г–е – выявление β-катенина моноклональными антителами PY489 (DSHB) на стадии ранней гаструлы, конфокальная проекция нескольких поверхностных срезов, вид с вегетативного полюса одного и того же зародыша; г – канал флуоресцентных антител, подчеркнуты бластомеры с пониженным содержанием ядерного белка; д – канал красителя ДНК DAPI, подписаны все идентифицированные клетки; е – совмещение каналов антител и DAPI.
Пожалуй, наиболее модифицированный паттерн активности wnt демонстрируют зародыши пиявки Helobdella (Cho et al., 2010). Транскрипты почти всех паралогов wnt запасаются в ходе оогенеза и специфически сегрегируются по мере дробления в определенные клеточные линии. Интересно, что экспрессия wnt не затрагивает у пиявки задние отделы кишечника, тогда как у полихет и моллюсков именно зачаток ануса (а также заднюю часть стомодеума и соединяющую их вентральную срединную линию), по нашему мнению, можно рассматривать сигнальным центром, сходным с губами бластопора. Эта идея подтверждается экспрессией в месте замыкания бластопора таких консервативных мишеней канонического Wnt-пути, как FoxA и Brachyury у нереид (Arendt et al., 2001; Kostyuchenko et al., 2018), седентарных полихет Hydroides elegans (Arenas-Mena, 2006, 2013) и C. teleta (Boyle, Seaver, 2008; Boyle et al., 2014), а также моллюсков (Lartillot et al., 2002a, b; Le Gouar et al., 2004; Kin et al., 2009; Tan et al., 2017). Сопоставимым с другими Spiralia каудальным доменом экспрессии лигандов Wnt у пиявки является популяция эмбриональных стволовых клеток (телобластов). Таким образом, у Spiralia клетки заднего конца тела (независимо от тканевой принадлежности и происхождения) как в эмбриогенезе, так и в дефинитивном состоянии – важнейший элемент разметки осей билатеральной симметрии с помощью системы Wnt.
Совершенно иначе проявляется участие элементов Wnt-пути в самом начале эмбрионального развития, еще до гаструляции. Как правило, после оплодотворения яйца устанавливается закономерная локализация внутриклеточных регуляторов, которая приводит к полярному распределению β-катенина, причем собственно лиганды Wnt в этом процессе не задействованы. Во время дробления молекулярная разметка вдоль анимально-вегетативной оси показана у единственного представителя Spiralia – немертины Cerebratulus lacteus (Henry et al., 2008). Ядерный β-катенин необходим здесь для развития наиболее вегетативных клеток, дающих энтодерму. При манипуляциях с этим эффектором Wnt-пути авторам удалось добиться двух противоположных фенотипов: анимализованного с отсутствием кишечной ткани в случае разрушения β-катенина и при его стабилизации – вегетализованного, при котором кишечные маркеры выявлялись практически во всех клетках (Henry et al., 2008).
Сходной функцией определения судьбы вегетативных территорий зародыша обладает β-катенин у брюхоногого моллюска Crepidula fornicata (Henry et al., 2010). Однако если у немертины происходит последовательная сегрегация этого белка в вегетативные бластомеры в каждом цикле дробления, то у гастроподы отмечен единовременный переход от экспрессии во всех клетках к специфической локализации в мезэнтобласте 4d. По мере развития мезодермальной полоски белок подвергается деградации от ее заднего конца к переднему (Henry et al., 2010). Все экспериментальные результаты приводят авторов к выводу об участии β-катенина в спецификации и паттернировании мезэнтодермальных клеток моллюска.
Своеобразное поведение β-катенина описано в ходе дробления полихеты P. dumerilii, при котором почти все бластомеры от деления к делению демонстрируют повторяющийся паттерн накопления белка в ядрах (Schneider, Bowerman, 2007). Независимо от аксиальной локализации клетки во время прохождения митоза за разрушением ядерной оболочки следует примерно равномерное распределение β-катенина на оба полюса веретена. В поздней телофазе отмечается самая ранняя асимметрия накопления β-катенина, так что в ядре анимальной сестринской клетки остается меньшее количество белка, а в вегетативной клетке происходит аккумуляция ядерного β-катенина. На протяжении интерфазы эта начальная асимметрия постепенно усиливается. Анализируя результаты функциональных тестов, Шнайдер и Боверман (Schneider, Bowerman, 2007) приходят к выводу об участии β-катенина P. dumerilii в механизме бинарной спецификации клеточной судьбы, описанном в раннем развитии еще двух модельных организмов (Bertrand, 2016). Предполагается, что в каждом митозе происходит определение одного из двух альтернативных путей развития дочерних клеток.
Наши предварительные данные по иммуноцитохимическому выявлению β-катенина и модуляции канонического Wnt-сигналинга в ходе дробления зародышей нереиды A. virens не подтверждают обнаруженные для P. dumerilii закономерности. При использовании четырех различных антител к β‑катенину, специфичность одного из которых идентична указанной в работе американских коллег (Schneider, Bowerman, 2007), мы обнаружили в вегетативных бластомерах (как линии 4d, так и макромерах) пониженное содержание этого белка в интерфазных ядрах по сравнению с цитоплазмой (рис. 4г–е). Хотя антитела не всегда успешно выявляют ядерные антигены, наши данные свидетельствуют о том, что избирательной стабилизации β-катенина в наиболее вегетативных бластомерах – предшественниках мезодермы и энтодермы – не происходит, т.е. на проанализированных стадиях (от 8 клеток до начала гаструляции) канонический путь на вегетативном полюсе не задействован. Применение негативных регуляторов endo-IWR-1 (10 мкМ) и PNU-74654 (5 и 25 мкM) в период дробления незначительно повлияло на спецификацию и морфогенез мезодермальных полосок. Однако гиперактивация Wnt-пути с помощью агентов Azakenpaullone-1 (2 и 5 мкМ) и BIO (1 и 5 мкM) вела к масштабным нарушениям развития. Многие ткани оставались малоклеточными образованиями, нарушалась организация ресничных шнуров, но у подопытных личинок сохранялись признаки билатеральной симметрии и дифференциации туловищной мезодермы (например, присутствовала экспрессия гена-маркера Avi-twist (Козин, Костюченко, 2016; Kozin et al., 2016), с помощью меченого фаллоидина выявлялись мышечные элементы). Таким образом, в противоположность результатам на видах с гомоквадрантным спиральным дроблением (немертина C. lacteus и моллюск C. fornicata) необходимость канонического Wnt-сигналинга для формирования и дифференциации вегетативных производных (мезэнтодермы) у зародышей аннелид остается недоказанной. По-видимому, эмбриональный организатор мезэнтодермальной природы, описанный у некоторых Spiralia (Lambert, 2008; Козин и др., 2013; Козин, Костюченко, 2016), при гетероквадрантном дроблении имеет совершенно особые (независимые в разных таксонах) механизмы развития, в большей степени использующие автономную спецификацию.
Исследования проведены при финансовой поддержке РФФИ (грант 18-04-01335 (анализ механизмов развития мезодермы аннелид)) и РНФ (грант 17-14-01089 (биоинформационный анализ)) с использованием оборудования ресурсных центров “Развитие молекулярных и клеточных технологий”, “Центр микроскопии и микроанализа” и Учебно-научной базы “Беломорская” Санкт-Петербургского государственного университета.
Список литературы
Беклемишев В.Н. Основы сравнительной анатомии беспозвоночных. Т. 1. Проморфология. М.: Наука, 1964. 432 с.
Дондуа А.К., Костюченко Р.П. Об одной устаревшей традиции: существует ли гаструляция у губок? // Онтогенез. 2013. Т. 44. № 5. С. 357–363.
Иванова-Казас О.М. Эволюционная эмбриология животных. СПб.: Наука, 1995. 565 с.
Козин B.B., Костюченко Р.П. Эволюционный консерватизм и вариабельность развития мезодермы у Spiralia: неповторимый паттерн нереидных полихет // Изв. РАН. Сер. биол. 2016. № 3. С. 265–275.
Козин В.В., Бабаханова Р.А., Костюченко Р.П. Участие МАР-киназного сигналинга в спецификации клеточных линий и дорсовентральной оси у примитивной гастроподы Testudinalia testudinalis (Patellogastropoda, Mollusca) // Онтогенез. 2013. Т. 44. № 1. С. 42–56.
Мамкаев Ю.В. Эволюционное значение морфогенетических механизмов // Биология моря. 2004. Т. 30. № 6. С. 415–422.
Озернюк Н.Д., Исаева В.В. Эволюция онтогенеза. М.: КМК, 2016. 407 с.
Светлов П.Г. Соотношения морфологических осей в онто- и филогенезе разных групп животных // Журн. общ. биологии. 1967. Т. 28. № 5. С. 567–578.
Aberle H., Bauer A., Stappert J., Kispert A., Kemler R. β-catenin is a target for the ubiquitin-proteasome pathway // Embo J. 1997. V. 16. № 13. P. 3797–3804.
Adamska M., Degnan S.M., Green K.M., Adamski M., Craigie A., Larroux C., Degnan B.M. Wnt and TGF-beta expression in the sponge Amphimedon queenslandica and the origin of metazoan embryonic patterning // PLoS One. 2007. V. 2. P. e1031.
Adamska M., Larroux C., Adamski M., Green K., Lovas E., Koop D., Richards G.S., Zwafink C., Degnan B.M. Structure and expression of conserved Wnt pathway components in the demosponge Amphimedon queenslandica // Evol. Dev. 2010. V. 12. P. 494–518.
Almuedo-Castillo M., Sureda-Gómez M., Adell T. Wnt signaling in planarians: new answers to old questions // Int. J. Dev. Biol. 2012. V. 56. № 1–3. P. 53–65.
Arenas-Mena C. Embryonic expression of HeFoxA1 and HeFoxA2 in an indirectly developing polychaete // Dev. Genes Evol. 2006. V. 216. № 11. P. 727–736.
Arenas-Mena C. Brachyury, Tbx2/3 and sall expression during embryogenesis of the indirectly developing polychaete Hydroides elegans // Int. J. Dev. Biol. 2013. V. 57. № 1. P. 73–83.
Arendt D., Technau U., Wittbrodt J. Evolution of the bilaterian larval foregut // Nature. 2001. V. 409. № 6816. P. 81–85.
Bastin B.R., Chou H.-C., Pruitt M.M., Schneider S.Q. Structure, phylogeny, and expression of the frizzled-related gene family in the lophotrochozoan annelid Platynereis dumerilii // EvoDevo. 2015. V. 6. P. 37.
Behrens J., von Kries J.P., Kühl M., Bruhn L., Wedlich D., Grosschedl R., Birchmeier W. Functional interaction of beta-catenin with the transcription factor LEF-1 // Nature. 1996. V. 382. № 6592. P. 638–642.
Bertrand V. β-catenin-driven binary cell fate decisions in animal development // WIREs Dev. Biol. 2016. V. 5. № 3. P. 377–388.
Borisenko I., Adamski M., Ereskovsky A., Adamska M. Surprisingly rich repertoire of Wnt genes in the demosponge Halisarca dujardini // BMC Evol. Biol. 2016. V. 16. P. 123.
Boyle M.J., Seaver E.C. Developmental expression of foxA and gata genes during gut formation in the polychaete annelid, Capitella sp. I // Evol. Dev. 2008. V. 10. № 1. P. 89–105.
Boyle M.J., Yamaguchi E., Seaver E.C. Molecular conservation of metazoan gut formation: evidence from expression of endomesoderm genes in Capitella teleta (Annelida) // EvoDevo. 2014. V. 5. № 1. P. 39.
Broun M., Gee L., Reinhardt B., Bode H.R. Formation of the head organizer in hydra involves the canonical Wnt pathway // Development. 2005. V. 132. № 12. P. 2907–2916.
Cavallo R.A., Cox R.T., Moline M.M., Roose J., Polevoy G.A., Clevers H., Peifer M., Bejsovec A. Drosophila Tcf and Groucho interact to repress Wingless signalling activity // Nature. 1998. V. 395. № 6702. P. 604–608.
Cebrià F., Saló E., Adell T. Regeneration and growth as modes of adult development: the platyhelminthes as a case study // Evolutionary Developmental Biology of Invertebrates 2 / Ed. Wanninger A. Vienna: Springer, 2015. P. 41–78.
Cho S.-J., Valles Y., Giani V.C., Seaver E.C., Weisblat D.A. Evolutionary dynamics of the wnt gene family: a lophotrochozoan perspective // Mol. Biol. Evol. 2010. V. 27. № 7. P. 1645–1658.
Clevers H. Wnt/β-catenin signaling in development and disease // Cell. 2006. V. 127. № 3. P. 469–480.
Cruciat C.M., Niehrs C. Secreted and transmembrane Wnt inhibitors and activators // Cold Spring Harb. Perspect. Med. 2013. V. 3. № 3. P. a015081.
Darras S., Fritzenwanker J.H., Uhlinger K.R., Farrelly E., Pani A.M., Hurley I.A., Norris R.P., Osovitz M., Terasaki M., Wu M., Aronowicz J., Kirschner M., Gerhart J.C., Lowe C.J. Anteroposterior axis patterning by early canonical Wnt signaling during hemichordate development // PLoS Biol. 2018. V. 16. № 1. P. e2003698.
De Robertis E.M. Spemann’s organizer and the self-regulation of embryonic fields // Mech. Dev. 2009. V. 126. № 11–12. P. 925–941.
DuBuc T.Q., Stephenson T.B., Rock A.N., Martindale M.Q. Hox and Wnt pattern the primary body axis of an anthozoan cnidarian before gastrulation // Nat. Comm. 2018. V. 9. № 1. P. 2007.
Ereskovsky A.V., Dondua A.K. The problem of germ layers in sponges (Porifera) and some issues concerning early metazoan evolution // Zool. Anz. 2006. V. 245. № 2. P. 65–76.
Fortunato S.A., Adamski M., Adamska M. Comparative analyses of developmental transcription factor repertoires in sponges reveal unexpected complexity of the earliest animals // Mar. Genom. 2015. V. 24. № 2. P. 121–129.
Fortunato S.A., Adamski M., Ramos O.M., Leininger S., Liu J., Ferrier D.E., Adamska M. Calcisponges have a ParaHox gene and dynamic expression of dispersed NK homeobox genes // Nature. 2014. V. 30. № 514(7524). P. 620–623.
Genikhovich G., Technau U. On the evolution of bilaterality // Development. 2017. V. 144. № 19. P. 3392–3404.
Guder C., Philipp I., Lengfeld T., Watanabe H., Hobmayer B., Holstein T.W. The Wnt code: cnidarians signal the way // Oncogene. 2006. V. 25. P. 7450–7460.
Haeckel E. On the organization of sponges and their relationship to the corals // Ann. Mag. Nat. Hist. 1870. V. 5. P. 1–13.
Henry J.Q., Perry K.J., Martindale M.Q. β-catenin and Early Development in the Gastropod, Crepidula fornicata // Integr. Comp. Biol. 2010. V. 50. № 5. P. 707–719.
Henry J.Q., Perry K.J., Wever J., Seaver E., Martindale M.Q. β-Catenin is required for the establishment of vegetal embryonic fates in the nemertean, Cerebratulus lacteus // Dev. Biol. 2008. V. 317. № 1. P. 368–379.
Holstein T.W. The evolution of the Wnt pathway // Cold Spring Harb. Perspect. Biol. 2012. V. 4. № 7. P. a007922.
Holstein T.W., Watanabe H., Özbek S. Signaling pathways and axis formation in the lower Metazoa // Curr. Top. Dev. Biol. 2011. V. 97. P. 137–177.
Isaeva V.V. Symmetry transformations in ontogeny and evolution // Paleontol. J. 2014. V. 48. № 11. P. 1127–1136.
Janssen R., Gouar M.L., Pechmann M., Poulin F., Bolognesi R., Schwager E.E., Hopfen C., Colbourne J.K., Budd G.E., Brown S.J., Prpic N.-M., Kosiol C., Vervoort M., Damen W.G., Balavoine G., McGregor A.P. Conservation, loss, and redeployment of Wnt ligands in protostomes: implications for understanding the evolution of segment formation // BMC Evol. Biol. 2010. V. 10. № 1. P. 374.
Kiecker C., Bates T., Bell E. Molecular specification of germ layers in vertebrate embryos // Cell. Mol. Life Sci. 2015. V. 73. № 5. P. 923–947.
Kin K., Kakoi S., Wada H. A novel role for dpp in the shaping of bivalve shells revealed in a conserved molluscan developmental program // Dev. Biol. 2009. V. 329. № 1. P. 152–166.
Kostyuchenko R.P., Kozin V.V., Filippova N.A., Sorokina E.V. FoxA expression pattern in two polychaete species, Alitta virens and Platynereis dumerilii: examination of the conserved key regulator of the gut development from cleavage through larval life, post-larval growth and regeneration // Dev. Dyn. 2018. In press.
Kozin V.V., Filimonova D.A., Kupriashova E.E., Kostyuchenko R.P. Mesoderm patterning and morphogenesis in the polychaete Alitta virens (Spiralia, Annelida): Expression of mesodermal markers Twist, Mox, Evx and functional role for MAP kinase signaling // Mech. Dev. 2016. V. 140. P. 1–11.
Kraus Y., Aman A., Technau U., Genikhovich G. Pre-bilaterian origin of the blastoporal axial organizer // Nat. Comm. 2016. V. 7. P. 11694.
Kumburegama S., Wikramanayake A.H. Wnt signaling in the early sea urchin embryo // Wnt Signaling Methods in Molecular Biology. Totowa, N.J.: Humana Press, 2008. P. 187–199.
Lambert J.D. Mesoderm in spiralians: the organizer and the 4d cell // J. Exp. Zool. 2008. V. 310B. № 1. P. 15–23.
Lapébie P., Gazave E., Ereskovsky A., Derelle R., Bézac C., Renard E., Houliston E., Borchiellini C. WNT/β-catenin signalling and epithelial patterning in the homoscleromorph sponge Oscarella // PLoS One. 2009. V. 4. № 6. P. e5823.
Lartillot N., Gouar M.L., Adoutte A. Expression patterns of fork head and goosecoid homologues in the mollusc Patella vulgata supports the ancestry of the anterior mesendoderm across Bilateria // Dev. Genes Evol. 2002a. V. 212. № 11. P. 551–561.
Lartillot N., Lespinet O., Vervoort M., Adoutte A. Expression pattern of Brachyury in the mollusc Patella vulgata suggests a conserved role in the establishment of the AP axis in Bilateria // Development. 2002b. V. 129. № 6. P. 1411–1421.
Le Gouar M., Guillou A., Vervoort M. Expression of a SoxB and a Wnt2/13 gene during the development of the mollusc Patella vulgata // Dev. Genes Evol. 2004. V. 214. № 5. P. 250–256.
Leininger S., Adamski M., Bergum B., Guder C., Liu J., Laplante M., Bråte J., Hoffmann F., Fortunato S., Jordal S., Rapp H.T., Adamska M. Developmental gene expression provides clues to relationships between sponge and eumetazoan body plans // Nat. Comm. 2014. V. 3905. № 5. P. 3905.
Loh K.M., van Amerongen R., Nusse R. Generating cellular diversity and spatial form: Wnt signaling and the evolution of multicellular animals // Dev. Cell. 2016. V. 38. № 6. P. 643–655.
MacDonald B.T., He X. Frizzled and LRP5/6 receptors for Wnt/β-catenin signaling // Cold Spring Harb. Perspect. Biol. 2013. V. 4. P. a007880.
Martindale M.Q. The evolution of metazoan axial properties // Nat. Rev. Genet. 2005. V. 6. № 12. P. 917–927.
Martín-Durán J.M., Monjo F., Romero R. Planarian embryology in the era of comparative developmental biology // Int. J. Dev. Biol. 2012. V. 56. № 1–3. P. 39–48.
Miller J.R. The Wnts // Genome Biol. 2002. V. 3. №1. P. REVIEWS3001.
Nakanishi N., Sogabe S., Degnan B.M. Evolutionary origin of gastrulation: insights from sponge development // BMC Biol. 2014. V. 12. P. 26.
Petersen C.P., Reddien P.W. Wnt signaling and the polarity of the primary body axis // Cell. 2009. V. 139. № 6. P. 1056–1068.
Prud’homme B., de Rosa R., Arendt D., Julien J.-F., Pajaziti R., Dorresteijn A.W.C., Adoutte A., Wittbrodt J., Balavoine G. Arthropod-like expression patterns of engrailed and wingless in the annelid Platynereis dumerilii suggest a role in segment formation // Curr. Biol. 2003. V. 13. № 21. P. 1876–1881.
Pruitt M.M., Letcher E.J., Chou H.-C., Bastin B.R., Schneider S.Q. Expression of the wnt gene complement in a spiral-cleaving embryo and trochophore larva // Int. J. Dev. Biol. 2014. V. 58. P. 563–573.
Roose J., Molenaar M., Peterson J., Hurenkamp J., Brantjes H., Moerer P., van de Wetering M., Destree O., Clevers H. The Xenopus Wnt effector XTcf-3 interacts with Groucho-related transcriptional repressors // Nature. 1998. V. 395. № 6702. P. 608–612.
Schenkelaars Q., Pratlong M., Kodjabachian L., Fierro-Constain L., Vacelet J., Bivic A.L., Renard E., Borchiellini C. Animal multicellularity and polarity without Wnt signaling // Sci. Rep. 2017. V. 7. P. 15383.
Schneider S.Q., Bowerman B. β-catenin asymmetries after all animal/vegetal- oriented cell divisions in Platynereis dumerilii embryos mediate binary cell-fate specification // Dev. Cell. 2007. V. 13. № 1. P. 73–86.
Seaver E.C., Kaneshige L.M. Expression of ‘segmentation’ genes during larval and juvenile development in the polychaetes Capitella sp. I and H. elegans // Dev. Biol. 2006. V. 289. № 1. P. 179–194.
Tan S., Huan P., Liu B. Expression patterns indicate that BMP2/4 and Chordin, not BMP5-8 and Gremlin, mediate dorsal-ventral patterning in the mollusk Crassostrea gigas // Dev. Genes Evol. 2017. V. 227. № 2. P. 75–84.
Vellutini B.C., Hejnol A. Expression of segment polarity genes in brachiopods supports a non-segmental ancestral role of engrailed for bilaterians // Sci. Rep. 2016. V. 6. P. 32387.
Wanninger A. Evolutionary Developmental Biology of Invertebrates 1: Introduction, Non-Bilateria, Acoelomorpha, Xenoturbellida, Chaetognatha. Vienna: Springer Vienna, 2015a. 251 p.
Wanninger A. Evolutionary Developmental Biology of Invertebrates 2: Lophotrochozoa (Spiralia). Vienna: Springer Vienna, 2015b. 289 p.
Windsor P.J., Leys S.P. Wnt signaling and induction in the sponge aquiferous system: evidence for an ancient origin of the organizer: Polarity in sponges // Evol. Dev. 2010. V. 12. P. 484–493.
Windsor Reid P.J., Matveev E., McClymont A., Posfai D., Hill A.L., Leys S.P. Wnt signaling and polarity in freshwater sponges // BMC Evol. Biol. 2018. P. 18.
Zeng X., Tamai K., Doble B., Li S., Huang H., Habas R., Okamura H., Woodgett J., He X. A dual-kinase mechanism for Wnt co-receptor phosphorylation and activation // Nature. 2005. V. 438. № 7069. P. 873–877.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


