Известия РАН. Серия биологическая, 2019, № 1, стр. 38-42
Влияние сезона рождения и трансплантации тимуса на продолжительность жизни экспериментальных животных
А. В. Куликов a, *, Л. В. Архипова a, П. А. Куликова b, А. А. Глазков b, Е. Ю. Мндлян a, В. Б. Гаврилюк a, Д. А. Куликов b
a Институт теоретической и экспериментальной биофизики РАН,
Россия, 142290 Московская обл., Пущино, Институтская ул., 3
b Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского,
Россия, 129110 Москва, ул. Щепкина, 61/2
* E-mail: 29.04.55@mail.ru
Поступила в редакцию 14.05.2018
После доработки 31.07.2018
Принята к публикации 31.07.2018
Аннотация
Установлено, что снижение темпа необратимой возрастной атрофии тимуса влияет на продолжительность жизни животных. Отмечено, что продолжительность жизни крыс можно увеличить за счет трансплантации тимуса от молодых животных в иммунопривилегированные зоны стареющим крысам. Обнаружено, что сезон рождения влияет на продолжительность жизни животных: крысы, рожденные в весенне-летний период, живут меньше, чем крысы, рожденные в осенне-зимнее время.
Известно, что в процессе онтогенетического развития у всех млекопитающих, за исключением зимнеспящих, происходит необратимая возрастная атрофия тимуса. Существует мнение, что инволюция тимуса – важный фактор, управляющий старением и влияющий на продолжительность жизни (Анисимов, 2008; Пальцев, Кветной, 2008; Csaba, 2016a, b). Следовательно, можно предположить, что замедление инволюции тимуса способствует увеличению продолжительности жизни.
Склонность к определенным заболеваниям и возрастная смертность людей в определенной степени зависят от особенностей их раннего (пре- и неонатального) онтогенеза, в частности от питания и сезонно-обусловленных климатических условий раннего развития (Vaiserman et al., 2002; Загуба и др., 2013). Склонность к возрастным заболеваниям различается у людей, рожденных в разные месяцы года. Рассмотрим данные, полученные двумя коллективами, работавшими в двух климатически разных регионах постсоветского пространства. Это данные эпидемиологических исследований, проведенных в Киеве (101 631 чел.) и Кемерово (35 397 чел.). В Киеве максимальная продолжительность жизни отмечается у мужчин, рожденных в осенне-зимний период, а в Кемерово максимум немного смещен в зимний период (декабрь–январь), при этом меньше жили люди, рожденные в весенне-летний период (Vaiserman et al., 2002; Вайсерман, 2004; Алтарев и др., 2012).
Несмотря на то что крысы – частый объект экспериментальных исследований в геронтологии, в литературе встречаются единичные данные, косвенно подтверждающие наличие взаимосвязи месяца рождения животных и возраста их смерти. Ранее была показана взаимосвязь месяца рождения животных, содержащихся в условиях естественного освещения Карелии, с частотой и временем развития злокачественных опухолей, а также влияние разных режимов освещения на канцерогенез (Виноградова и др., 2013). На лабораторных крысах также было показано, что на разных этапах постнатального онтогенеза избыточное освещение воздействует по-разному на продолжительность жизни (Хилков и др., 2013). Подробное освещение данной темы необходимо, чтобы понять, возможно ли использовать крыс в качестве модельных животных для изучения влияния сезона рождения на продолжительность жизни человека.
Уже в конце XIX в., несмотря на то что многие иммунологические закономерности не были еще открыты, возникла одна из ветвей экспериментальной трансплантологии – пересадка тканей в относительно иммунопривилегированные участки организма. В этом направлении работало много исследователей. К настоящему времени доказана возможность длительного переживания трансплантированной ткани в некоторых участках мозга, передней камере глаза (ПКГ) и в тестусах экспериментальных животных без применения иммунодепрессантов, так как эти области относительно иммунопривилегированные (Thompson, 1890; Кирпатовский, Дендеберов, 1994; Лосева и др., 2011; Куликов и др., 2014; Сухинич и др., 2015;). С учетом этих особенностей мы разработали ряд экспериментальных моделей компенсации некоторых патологических состояний (Куликов и др., 2010, 2011; Машков и др., 2011). В частности, нами была показана возможность увеличения средней и максимальной продолжительности жизни за счет трансплантации ткани тимуса в ПКГ (Kulikov et al., 2014). Наиболее вероятный механизм данного эффекта – замедление возрастной инволюции собственного тимуса у животных после трансплантации. На данном этапе нами была поставлена цель – совместная оценка двух факторов, потенциально влияющих на продолжительность жизни экспериментальных животных (месяц рождения и транспирация тимуса в ПКГ).
МАТЕРИАЛЫ И МЕТОДЫ
Были использованы крысы Wistar. Животные были поделены на 4 группы: крысы, рожденные в конце ноября–начале декабря, которым проводилась трансплантация тимуса в переднюю камеру глаза (n = 12); крысы, рожденные в конце ноября–начале декабря, которым не проводилась трансплантация (n = 8); крысы, рожденные в апреле, которым проводилась трансплантация тимуса в переднюю камеру глаза (n = 21); крысы, рожденные в апреле, которым не проводилась трансплантация (n = 45). На момент начала эксперимента возраст животных составил 17–18 мес. Трансплантация проводилась по следующей методике: ткань тимуса для трансплантации в ПКГ реципиента получали от 1–1.5-месячных крыс–самцов массой 110–130 г. В чашке Петри со средой Игла ткань тимуса измельчали до фрагментов объемом 1 мм3. Операция проводилась под общей анестезией (золетил + ксилазин), премедикация – введение атропиносульфата в дозе 0.04 мг/кг подкожно за 15 мин до начала вмешательства. Крысам-реципиентам на глаз наносили по одной капле 0.1%-ного раствора атропина, чтобы уменьшилась площадь радужной оболочки. Эта манипуляция помогает избежать повреждений богатых капиллярами структур. Через 5 мин на глаз наносили одну каплю 0.5%-ного раствора дикаина. На роговице делали разрез длиной 1.5–2 мм на “13 : 00” по “воображаемому циферблату” в 1–2 мм от края роговицы. Ткань тимуса забирали из чашки Петри и помещали в переднюю камеру глаза модернизированной микропипеткой с регулируемым объемом (общий объем трансплантата составлял 3–5 мм3).
Процессы, возникающие вследствие количественно или качественно неполноценного питания на ранних стадиях развития животных, играют важную роль в последующей жизни индивида и могут в значительной степени влиять на его склонность к тем или иным возрастзависимым заболеваниям, а также на продолжительность его жизни (Flouris et al., 2009; Gagnon, 2012). Чтобы исключить подобного рода влияния, мы работали только с животными, круглогодично находящимися на сбалансированной, полноценной стандартной диете. Крыс содержали в стандартных условиях вивария при 21–23°C. Они получали сбалансированный гранулированный корм; доступ к питьевой воде был свободным; питательная ценность комбикорма была не менее 295 ккал/100 г (Декларация о соответствии № РОСС RU. ПТ 62. Д 00405).
Работа выполнена с соблюдением принципов Хельсинкской декларации о гуманном отношении к животным, принципов гуманности, изложенных в Директиве Европейского сообщества (2010/63/ЕU), в ГОСТ Р 53434-2009 “Национальный стандарт Российской Федерации. Принципы надлежащей лабораторной практики”.
Статистический анализ данных проводили с использованием программы STATISTICA 10 (StatSoft, Inc.). Выживаемость в группах оценивали с помощью построения кривых Каплана–Мейера. Группы сравнивали с помощью F-теста Кокса (Cox’s F-test).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Нами обобщены некоторые данные, представленные на конференции “Морфогенез в индивидуальном и историческом развитии: онтогенез и формирования биологического разнообразия”. Известно, что на продолжительность жизни влияют не только время рождения, но и температурный режим, пищевой рацион матери, длина светового дня (Анисимов, 2008; Flouris et al., 2009; Алтарев, 2012; Gagnon, 2012).
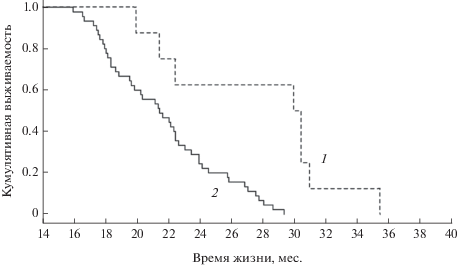
Из кривых кумулятивной выживаемости Каплана–Майера (рис. 1а и б) видно, что крысятам, родившимся весной, и животным осенне-зимнего помета удалось увеличить продолжительность жизни за счeт трансплантации клеток тимуса от молодых животных. Мы связываем эти результаты с тем, что, как удалось показать в наших предыдущих исследованиях, после пересадки тимуса от молодых животных в иммунопривилегированные зоны организма возрастным крысам у последних достоверно увеличивается количество клеток тимуса – тимоцитов. В условиях естественного старения количество этих клеток необратимо уменьшается (Kulikov et al., 2014). Следовательно, животные становятся “моложе” своих сверстников из интактной группы по иммунологическому статусу. Естественно было предположить, что такие животные будут жить дольше, что и удалось показать в данной серии экспериментов. У животных, родившихся весной и дополнительно получивших в возрасте 17–18 мес. молодые иммунокомпетентные клетки тимуса, средняя продолжительность жизни была больше по сравнению с интактными животными, рожденными в то же время, на 23.4, минимальная – на 24.6, а максимальная – на 28.9% (рис. 1а). У крыс осенне-зимнего помета средняя продолжительность жизни была больше по сравнению с животными без трансплантации на 18.4%, минимальная – на 35%, а максимальная осталось неизменной (рис. 1б).
Рис. 1.
Кривые кумулятивной выживаемости Каплана–Майера крыс весеннего (а) и осенне-зимнего помета (б) без и после трансплантации тимуса от молодых животным стареющим. 1 – экспериментальные группы (n = 21 (a) и 12 (б)); 2 – контрольные группы (n = 45 (а) и 8 (б)); p < 0.001 (a) и p = 0.056, тест Кокса (Cox’s F-test).
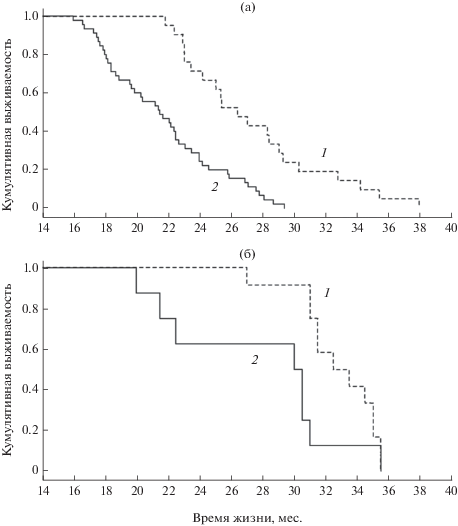
Если из двух выборок взять данные динамики выживаемости только контрольных животных, не подвергшихся трансплантации (рис. 2), то отчетливо видна разница. Средняя продолжительность жизни крыс осенне-зимнего помета была больше аналогичного показателя у животных помета весеннего на 24.8, минимальная – на 14.3, а максимальная – на 20.7%.
ЗАКЛЮЧЕНИЕ
Экспериментально исследовано влияние двух факторов (сезон рождения и трансплантация тимуса) на продолжительность жизни лабораторных животных. Показано что, как месяц рождения, так и трансплантация тимуса от молодых крыс в ПКГ стареющих особей оказывают влияние на продолжительность жизни крыс Wistar. При этом влияние этих факторов не зависит от того, воздействуют они совместно или по отдельности, но совместное воздействие дает больший эффект. В условиях северного умеренного пояса освещенности (центрально-европейская часть России, Московская обл.) животные, рожденные в ноябре, живут значимо дольше животных, рожденных в апреле. Лабораторные грызуны могут быть использованы в качестве модели для изучения влияния сезона рождения на продолжительность жизни.
Трансплантация ткани тимуса в переднюю камеру глаза – фактор, увеличивающий продолжительность жизни как крыс, рожденных в ноябре, так и крыс, рожденных в апреле.
Работа выполнена в рамках государственного задания ИТЭБ РАН №007-00-94-18-00.
Список литературы
Алтарев С.С., Барбараш О.Л. Взаимосвязь сезона рождения и продолжительности жизни // Клин. геронтология. 2012. Т. 18. №7–8. С. 27–30.
Анисимов В.Н. Молекулярные и физиологические механизмы старения. Т. 1. СПб.: Наука, 2008. 481 с.
Вайсерман А.М. Влияние средовых факторов в раннем онтогенезе на продолжительность жизни // Онтогенез. 2004. Т. 35. № 5. С. 325–335.
Виноградова И.А., Матвеева Ю.С., Лотош Т.А., Юнаш В.Д., Анисимов В.Н., Забежинский М.А., Семенченко А.В. Естественное освещение в условиях севера – вдохновитель поэтов и раковых клеток // Световой режим, старение и рак. Сб. науч. тр. II Рос. симпоз. Киров: МЦНИП, 2013. С. 32–40.
Забуга О.Г., Ахаладзе Н.Г., Вайсерман А.М. Метаболическое программирование: теоретические концепции и экспериментальные доказательства // Успехи геронтологии. 2013. Т. 26. № 2. С. 347–354.
Кирпатовский И.Д., Дендеберов Е.С. Аллотрансплантация культуральных неонатальных андрогенпродуцирующих клеток Лейдига // Вестн. РАМН. 1994. № 4. С. 42–46.
Куликов А.В., Архипова Л.В., Смирнова Г.Н., Куликов Д.А. Наумов А.Н., Сухонос Ю.А., Куликова П.А. Возможно ли компенсировать сахарный диабет с помощью трансплантации инсулинпродуцирующей ткани в иммунопривилегированные зоны организма? // Биозащита и биобезопасность. 2011. Т. 8. № 3. С. 18–23.
Куликов А.В., Архипова Л.В., Смирнова Г.Н., Новоселова Е.Г., Шпурова Н.А., Шишова Н.В., Сухих Г.Т. Замедление темпа необратимой возрастной атрофии вилочковой железы с помощью атопической аутотрансплантации длительно криоконсервированной ее ткани // Успехи геронтологии. 2010. Т. 23. № 1. С. 76–80.
Куликов Д.А., Куликов А.В., Архипова Л.В., Смирнова Г.Н., Древаль А.В., Тихонова Л.П., Гайворонский И.В., Сухих Г.Т. Влияние пересадки аллогенной ткани фетальной поджелудочной железы на регенерацию островковых клеток крысы-реципиента с аллоксановым сахарным диабетом // Бюл. эксперим. биологии и медицины. 2014. Т. 158. С. 349–351.
Лосева Е.В., Подгорный О.В., Полтавцева Р.А., Марей М.В., Логинова Н.А., Курская О.В., Сухих Г.Т., Чайлахян Р.К., Александрова М.А. Эффекты нейротрансплантации культивируемых нейральных и мезенхимальных стволовых клеток человека на обучение и состояние мозга крыс после гипоксии // Рос. физиол. журн. 2011. Т. 97. С. 155–168.
Машков А.Е., Куликов А.В., Шумский В.И., Филюшкин Ю.Н., Куликов Д.А., Слесарев В.В., Пыхтеев Д.А., Полянская Л.И., Ермилова Е.А., Рогаткин Д.А., Литвинова К.С. Опыт лечения анальной недостаточности с применением костномозговой трансплантации в эксперименте и клинике // Альманах клин. медицины. 2011. № 25. С. 13–16.
Пальцев М.А., Кветной И.М. Руководство по нейроиммуноэндокринологии. М.: Медицина, 2008. 512 с.
Сухинич К.К., Косых А.В., Александрова М.А. Эффекты нейротрансплантации культивируемых нейральных и мезенхимальных стволовых клеток человека на обучение и состояние мозга крыс после гипоксии // Клеточные технологии в биологии и медицине. 2015. №3. С. 139–148.
Хилков Т.Н., Матвеева Ю.П., Айзиков Д.Л., Виноградова И.А. Влияние нарушения светового режима в антенатальный и постнатальный периоды на продолжительность жизни самок крыс // Световой режим, старение и рак. Сб. науч. тр. II Рос. симпоз. Киров: МЦНИП, 2013. С. 308–312.
Csaba G. The immunoendocrine thymus as a pacemaker of lifespan // Acta Microbiol. Immunol. Hungarica. 2016a. V. 63. № 2. P. 139–158.
Csaba G. The role of the pineal-thymus system in the regulation of autoimmunity, aging and lifespan // Orvosi Hetilap. 2016b. V. 157. № 27. P. 1065.
Flouris A.D., Spiropoulos Y., Sakellariou G.J., Koutedakis Y. Effect of seasonal programming on fetal development and longevity: links with environmental temperature // Am. J. Hum. Biol. 2009. V. 21. № 2. P. 214–216.
Gagnon A. Effect of birth season on longevity: thrifty and hopeful phenotypes in historical Quebec // Am. J. Hum. Biol. 2012. V. 24. № 5. P. 654–660.
Kulikov A.V., Arkhipova L.V., Kulikov D.A., Kulikov P.A. The increase of the average and maximum span of life by the allogenic thymic cells transplantation in the animals’ anterior chamber of eye // Adv. Gerontol. 2014. V. 4. № 3. P. 197–200.
Thompson W.G. Successful brain grafting // N.Y. Med. J. 1890. V. 51. P. 701–702.
Vaiserman A.M., Collinson A.C., Koshel N.M., Belaja I.I., Voitenko V.P. Seasonal programming of adult longevity in Ukraine // Int. J. Biometeorol. 2002. V. 47. № 1. P. 49–52.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая