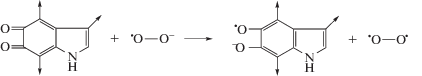Известия РАН. Серия биологическая, 2019, № 1, стр. 95-108
Меланосомы глаза позвоночных и оммохромы глаза беспозвоночных как антиоксидантные клеточные органеллы. Ч. 2
М. А. Островский a, *, А. Е. Донцов a
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
* E-mail: ostrovsky3535@mail.ru
Поступила в редакцию 04.06.2018
После доработки 13.06.2018
Принята к публикации 13.06.2018
Аннотация
Представлен обзор собственных и литературных данных об экранирующих пигментах глаза позвоночных и беспозвоночных животных и глаза человека – меланосомах и оммохромах. Рассматривается роль этих пигментов в зрении позвоночных и беспозвоночных как антиоксидантных органелл, а также роль меланосом в физиологии, старении и патологии глаза человека.
Во всех органах зрения как беспозвоночных, так и позвоночных животных наряду со светочувствительными ретинальсодержащими зрительными пигментами присутствуют и несветочувствительные экранирующие пигменты. Их важные функции в глазах обоих типов – светофильтрующая и светопоглощающая. Наряду с оптической экранирующие пигменты выполняют также защитную антиоксидантную функцию. Эта защита необходима в связи с тем, что кванты света, особенно в фиолетовой и синей областях спектра, высокоэнергетичны. Вследствие этого они представляют потенциальную опасность для структур глаза, особенно для фоторецепторных клеток сетчатки (так называемый blue light hazard). Повреждающее действие света связано главным образом с процессами свободнорадикального фотоокисления. Эффективность реакции фотоокисления определяется тремя основными факторами – присутствием в структурах глаза фотосенсибилизаторов, а также высоких концентраций кислорода и субстратов окисления. В ходе эволюции в органах зрения беспозвоночных и позвоночных сформировалась эффективная система защиты клеточных структур от потенциальной опасности повреждающего действия различных прооксидантных факторов, в первую очередь света. Эта система защиты включает в себя:
постоянное обновление фоторецепторных мембран, которые могут содержать поврежденные и окисленные белки и липиды;
комплекс эндогенных жиро- и водорастворимых антиоксидантов;
экранирующие пигменты как антиоксиданты;
механизм быстрого обезвреживания (нейтрализации) активного свободного альдегида полностью транс-ретиналя, который может участвовать в процессах фотоповреждения и модификации белков и липидов;
систему отсекающих оптических фильтров глаза, состоящую из роговицы, радужки, хрусталика, стекловидного тела, каротиноидов и экранирующих пигментов.
ЭКРАНИРУЮЩИЕ ПИГМЕНТЫ КАК АНТИОКСИДАНТЫ
В экспериментах были использованы меланины глаз человека, крупного рогатого скота, кролика, лягушки Rana temporaria, чернильного мешка каракатицы Sepia officinalis, кутикулы мухи Hermetia illucens и жука Tenebrionidae Latreille, а также синтетический (ДОФА)-меланин и оммохромы глаза ракообразных (креветки Mysis relicta и Pandalus latirostris) и насекомых (муха H. illucens, бабочка Pieris brassicae и стрекоза Calopteryx splendens). Все эксперименты выполняли в соответствии с международными рекомендациями по проведению медико-биологических исследований с использованием экспериментальных животных (International…, 1985). Антиоксидантную активность оценивали по тушению хемилюминесценции люминола, инициированной пероксидом водорода в присутствии гемоглобина, а также по ингибированию реакции пероксидации липидов, индуцированной различными прооксидантными факторами. Было показано, что все изученные экранирующие пигменты (меланины и оммохромы) эффективно тушили хемилюминесценцию люминола, индуцированную пероксидом водорода. Добавка пигментов к реакционной среде приводила как к уменьшению амплитуды хемилюминесценции, так и к увеличению латентного периода достижения максимальной флуоресценции. Обработка полученных результатов в координатах Штерн–Фольмера (Смирнов и др., 2011) позволила оценить степень антиоксидантной (антирадикальной) активности экранирующих пигментов глаза.
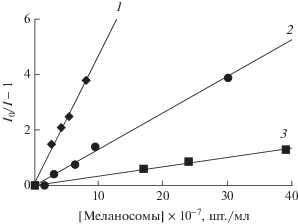
На рис. 1 представлена зависимость уменьшения интенсивности свечения люминола от концентрации нативных меланосом, выделенных из клеток ретинального пигментного эпителия (РПЭ) быка, лягушки и человека. Видно, что все меланосомы эффективно тушат хемилюминесценцию. При этом меланосомы глаза быка и лягушки были значительно активнее в отношении их способности тушить хемилюминесценцию люминола, чем меланосомы человека. Это означает, что меланосомы из РПЭ человека имеют меньшую антиоксидантную активность. Вероятно, это может быть связано с двумя основными причинами: либо с более высокой плотностью упаковки пигмента меланина в меланосомах быка и лягушки, либо с особенностями молекулярной структуры самих молекул меланина как полимера.
Рис. 1.
Сравнение антирадикальной активности ретинального пигментного эпителия меланосом из разных источников. По оси ординат – уменьшение амплитуды люминесценции люминола (I0 – интенсивность хемилюминесценции в контроле, I – хемилюминесценция в присутствии меланосом). По оси абсцисс – число добавленных гранул. 1–3 – меланосомы быка, лягушки и человека соответственно.
Аналогичные эксперименты, проведенные с оммохромами из различных источников, показали, что экранирующие пигменты глаза беспозвоночных также проявляют выраженную антиоксидантную активность. На рис. 2 представлена кинетика хемилюминесценции люминола в присутствии различных концентраций оммохромов креветки P. latirostris. Хорошо видно, что оммохромы сложного глаза, как и меланосомы, вызывают уменьшение амплитуды хемилюминесценции и увеличивают латентный период достижения максимума люминесценции. Способность эффективно тушить хемилюминесценцию люминола проявляли оммохромы из всех используемых нами источников. Антиоксидантную активность экранирующих пигментов беспозвоночных можно было оценить для некоторых оммохромов с известной молекулярной массой. Была измерена константа тушения хемилюминесценции люминола оммохромами глаза мухи “черная львинка” (black soldier) H. Illucens (рис. 3). Экранирующие пигменты этого насекомого представлены ксантомматином, молекулярная масса которого известна. Сравнение латентного периода индукции хемилюминесценции в присутствии аскорбата и оммохромов позволило определить константу тушения хемилюминесценции оммохромами глаза мухи. Она составляла (0.65 ± 0.15) × 104 М–1.
Рис. 2.
Кинетика хемилюминесценции люминола в присутствии различных концентраций оммохромов глаза креветки Pandalus latirostris. 1 – контроль, без добавления оммохромов: 2, 3, 4 – добавлено 40, 60 и 100 мкг/мл оммохромов глаза креветки соответственно.
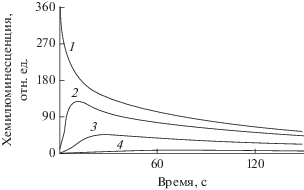
Рис. 3.
Сравнение антирадикальной активности оммохромов глаза мухи Hermetia illucens с аскорбиновой кислотой. 1 – аскорбат, 2 – оммохромы.

Экранирующие пигменты глаза позвоночных и беспозвоночных животных эффективно подавляют также процессы пероксидации липидов, индуцированные различными прооксидантными системами (Донцов и др., 1980; Островский и др., 1980, 1987; Сакина и др., 1980, 1986, 1987; Ostrovsky et al., 1987; Пустынников, Донцов, 1988). К основным факторам окислительного стресса (прооксидантным факторам) относят кислород и его активные формы (супероксидный радикал, синглетный кислород, пероксид водорода, гидроксильный радикал, гидропероксиды липидов и их радикалы, радикалы оксидов азота и др.), ионы металлов переменной валентности (особенно широко распространенные в организме ионы двухвалентного железа (Fe2+), катализирующие свободнорадикальные процессы), карбонильные соединения, накапливающиеся при оксидации липидов и при реакции Майяра, а также различные виды электромагнитного излучения (видимый свет, ультрафиолет (УФ), γ-излучение) и фотосенсибилизаторы. При этом эндогенные оксиданты в основном образуются в результате функционирования митохондриальной электрон-транспортной цепи, NO- оксидазной реакции, реакции Фентона, метаболизма аргинина, микросомальной детоксикации, пероксисомального β-окисления, процессов фагоцитоза, воспаления, гликирования и др.
Источники экзогенных оксидантов – УФ-облучение, рентгеновское и γ-облучение, видимый свет в присутствии фотосенсибилизаторов, ультразвук, наночастицы, пестициды, гербициды, ионы металлов переменной валентности, озон, ксенобиотики. В наших экспериментах были применены следующие прооксидантные факторы: гидропероксиды, супероксидные радикалы, синглетный кислород, Fe2+, облучение видимым светом в присутствии сенсибилизаторов, гипероксия, УФ- и рентгеновское облучение. На рис. 4 показано ингибирующее действие меланинов на пероксидацию липидов, индуцированную Fe2+ в присутствии аскорбиновой кислоты. Cубстратами окисления служили мембраны наружных сегментов фоторецепторных клеток или гомогенаты тканей мозга, содержащие большие количества полиненасыщенных жирно-кислотных остатков. Результаты показывают хорошую ингибирующую активность меланинов в отношении процесса пероксидации липидов. Уже при концентрации меланинов 30 мкг/мл скорость пероксидации липидов замедляется в 6–10 раз. Оммохромы, как и меланины, проявляют хорошую ингибирующую активность в отношении процесса пероксидации липидов. При концентрации оммохромов креветки P. latirostris 150 мкг/мл скорость пероксидации липидов замедляется 6–10 раз (Донцов, 1981; Ostrovsky et al., 1987; Dontsov, Ostrovsky, 2005).
ОСНОВНЫЕ МЕХАНИЗМЫ АНТИОКСИДАНТНОГО ДЕЙСТВИЯ ЭКРАНИРУЮЩИХ ПИГМЕНТОВ
Способность меланинов и оммохромов взаимодействовать с радикалами супероксида может быть одним из механизмов антиоксидантного действия этих экранирующих пигментов. Действительно, как мы показали ранее, синтетические и природные меланины, меланосомы и оммохромы глаза взаимодействуют с радикалами супероксида, существенно ускоряя их гибель, как в водной, так и в безводной средах (Донцов и др., 1984; Лапина и др., 1984; Ostrovsky et al., 1987). Прямое взаимодействие пигментов с супероксидными радикалами кислорода легко наблюдать в безводных средах, например в растворе супероксида в диметилформамиде. Радикалы супероксида получали путем электролитического восстановления кислорода на ртутном катоде в 0.01 М растворе тетрабутиламмония бромида в диметилформамиде. Концентрацию супероксида в реакционной среде измеряли с помощью реакции восстановления нитросинего тетразолиевого в формазан при длине волны поглощения λ = 560 нм, принимая коэффициент молярной экстинкции последнего равным 2.3 × 103 М–1 см–1. Результаты показали, что как меланины, так и оммохромы резко ускоряют гибель супероксида в безводной среде (Dontsov, Ostrovsky, 2005).
Поскольку белоксодержащие меланосомы нестабильны в диметилформамиде и, следовательно, наблюдать их взаимодействие в этих условиях невозможно, то нами было также исследовано взаимодействие меланосом, ДОФА-меланина и оммохромов с радикалами супероксида в водной среде методом конкурентного ингибирования (Лапина и др., 1984). В этих опытах радикалы супероксида генерировались в ходе ксантиноксидазной реакции, а их концентрация измерялась либо с помощью нитросинего тетразолиевого, либо с помощью адреналина (окисление адреналина в адренохром, λmax = 485 нм) или цитохрома с (восстановление цитохрома c Fe3+ в цитохром c Fe2+, λmax = 550 нм). При расчете констант взаимодействия пигментов с супероксидными радикалами использовались данные, приведенные в табл.1. Результаты показывают (табл. 2), что меланины глаза позвоночных животных и оммохромы глаза беспозвоночных животных легко вступают в реакцию с супероксидными радикалами и могут, следовательно, функционировать в качестве достаточно эффективной ловушки этого цитотоксического свободного радикала.
Таблица 1.
Данные, использованные для расчетов констант взаимодействия радикалов супероксида с экранирующими пигментами
| Расчетные данные | Источник |
|---|---|
| Константа реакции супероксида с адреналином – 4 × 104 М–1 с–1 | (Asada et al., 1976) |
| Константа реакции супероксида с цитохромом с – 2.5 × 105 М–1 с–1 | (Yamashita, 1982) |
| Молекулярная масса мономерного звена меланина – 170 Да | (Егоров и др., 1987) |
| Молекулярная масса ДОФА-меланина – 400 кДа | (Bull, 1970) |
| Молекулярная масса оммохромов креветки – 800 Да | (Лапина и др., 1984) |
Механизмы взаимодействия оммохромов с радикалами супероксида практически не изучены. В то же время хорошо известно, что взаимодействие меланина меланосом с радикалами супероксида может быть обусловлено их реакцией с мономерным звеном полимерной цепи пигмента – индол-5,6-хиноном. Предположительно меланин реагирует с супероксидом в форме гидрохинона с промежуточным образованием семихинона по схеме, приведенной на рис. 5 (Донцов, 2006). В результате супероксид переходит в пероксид водорода, который может быть инактивирован каталазой и пероксидазой. Меланин при этом переходит в окисленную форму, которая может быть в дальнейшем восстановлена в исходную с помощью различных восстановителей, например НАДН или НАДФН. Однако наиболее интересен процесс обратного восстановления окисленной формы меланина самими же супероксидными радикалами. Хорошо известно, что супероксидные радикалы могут действовать и как окисляющие, и как восстанавливающие агенты, в связи с чем ранее (Korytowski et al., 1986) была предположена возможность взаимодействия меланина в форме индолхинона с супероксидом, в результате чего образуются радикал меланина и свободный кислород. Реакция может протекать по схеме, приведенной на рис. 6 (Донцов, 2006).
Рис. 5.
Схема реакции меланина в восстановленной форме с радикалом супероксида. 1 – гидрохинонная форма мономерного звена меланина, 2 – семихинон, 3 – хинонная форма (индол-5,6-хинон).
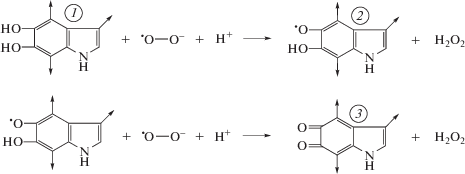
Ранее (Korytowski et al., 1987) было подсчитано, что ~30% реакции между супероксидными анионами и ДОФА-меланином происходит по пути восстановления супероксида в пероксид водорода, а ~70% реакции идет через окисление супероксида в молекулярный кислород. В этом случае меланин будет катализировать распад супероксида, сам не изменяясь химически, по схеме: ${\text{2O}}_{{\text{2}}}^{--}$ + 2Н+→ Н2О2 + + О2. Это свидетельствует о том, что меланин как в окисленной, так и в восстановленной формах способен взаимодействовать с радикалами супероксида, переводя их в нерадикальные продукты. Однако, что важно, при относительно высоких концентрациях супероксида происходит разрушение меланинового полимера.
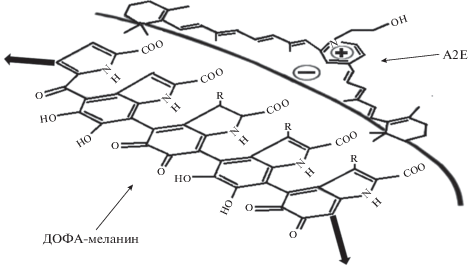
Другим возможным механизмом антиоксидантного действия экранирующих пигментов может быть их способность связывать ксенобиотики, фотосенсибилизаторы и прооксидантные ионы металлов переменной валентности в неактивные комплексы. Известно, что флуорофор липофусциновых гранул глаза человека бис-ретинилиденэтаноламин (А2Е) способен оказывать повреждающее действие на клетки ретинального пигментного эпителия. При этом повреждающее действие может проявлять как сам А2Е в условиях освещения, так и продукты его окисления и фотоокисления в темновых условиях. Повреждающее действие А2Е связано как с усилением фотоокислительных процессов, так и с накоплением в клетках токсичных продуктов фотоокисления самого А2Е. Ранее нами было показано, что А2Е при фотоокислении теряет свою строгую гидрофобность, причем гидрофильные продукты его фотоокисления могут мигрировать внутри клетки (Sokolov et al., 2007; Донцов и др., 2009), проникая в различные клеточные органеллы. Как сами молекулы А2Е, так и продукты их окисления были найдены во внутриклеточных органеллах РПЭ человека (липофусциновые гранулы, лизосомы, митохондрии) in vivo, причем их концентрация значительно возрастала при различных патологиях сетчатки (Sparrow, 2010). Продукты фотоокисления А2Е были найдены не только в свободном виде в цитоплазме клеток РПЭ, но даже и вне клеток (Yoon et al., 2012). Это были чрезвычайно токсичные низкомолекулярные альдегиды. Следовательно, связывание и детоксикация А2Е и продуктов его фотоокисления приобретают для выживаемости клетки очень важное значение.
Нами было установлено, что ДОФА-меланин и меланосомы РПЭ глаза человека, быка и лягушки прочно связывают как сами молекулы А2Е, так и те молекулы, которые образуются после облучения А2Е видимым светом, в неактивные комплексы (Сакина и др., 2013). При этом одна меланосома в зависимости от вида животного может связать до 0.08 фмоль А2Е. Связанный меланосомами А2Е полностью теряет свою прооксидантную активность. Более того, комплексы меланосом со связанным флуорофором А2Е проявляют практически такое же антиоксидантное действие, как и свободные меланосомы. Комплексы меланосом с А2Е, содержащие до 0.025 фмоль флуорофора на одну гранулу, ингибировали УФ-индуцированную пероксидацию фоторецепторных клеток с той же эффективностью, что и меланосомы, не содержащие А2Е (Сакина и др., 2013). Причина этого не ясна. Возможно, она связана с тем, что в комплексе с меланином меланосом А2Е по каким-то причинам теряет свою сенсибилизирующую способность. Возможная структура комплекса меланина и А2Е приведена на рис. 7.
Можно предполагать, что избыток флуорофора А2Е в клетках РПЭ глаза способен эффективно сорбироваться меланином меланосом и терять свои токсические и фототоксические свойства. Следует подчеркнуть, что связывание А2Е меланосомами в клетках РПЭ глаза, по всей видимости, является их основной функцией защиты этой клетки от повреждающего действия света фиолетово-синего диапазона.
С возрастом меланосомы РПЭ практически полностью исчезают из клетки, заменяясь меланолипофусциновыми гранулами. При этом содержание липофусциновых гранул и флуорофора А2Е, напротив, растет. Возможно, с этими процессами – исчезновением меланосом и накоплением липофусциновых и меланолипофусциновых гранул – связано развитие многих возрастных патологий глаза.
Другой возможный механизм антиоксидантного действия экранирующих пигментов – их способность связывать прооксидантные ионы железа в неактивные комплексы. Хорошо известно, что меланины, содержащиеся в меланосомах, – прекрасный хелатор ионов металлов (Potts, Au, 1976). Нами было показано, что как меланины, так и оммохромы глаза – хорошие хелаторы прооксидантных Fe2+ (Багиров и др., 1986а, б). Исследование способности связывать ионы железа меланосомами и оммохромами было проведено методами абсорбционной и γ-резонансной спектроскопии (табл. 3).
ПИГМЕНТИРОВАННЫЕ КЛЕТКИ ЗНАЧИТЕЛЬНО УСТОЙЧИВЕЕ К ДЕЙСТВИЮ ПРООКСИДАНТОВ
Хорошо известно, что животные-альбиносы, у которых в клетках глаза отсутствуют экранирующие пигменты, проявляют повышенную светочувствительность (фотофобия) и плохо видят при ярком дневном свете (дневная слепота). Так, например, для развития дегенеративных процессов в сетчатке крыс-альбиносов достаточно в 60 раз меньшей интенсивности света, чем для пигментированных особей того же вида (Lavail et al., 1975; Rapp, Williams, 1980). Это связано с тем, что структуры глаза чрезвычайно чувствительны к различным прооксидантным факторам. Высокая чувствительность фоторецепторных клеток при окислительном стрессе обусловлена, как указано выше, светом, высоким парциальным давлением кислорода и высокими концентрациями легкоокисляемых липидов. Действительно, сочетание света и кислорода, будучи необходимым условием осуществления нормального фоторецепторного процесса, одновременно способствует возникновению и развитию в структурах глаза деструктивных химических реакций. Чувствительность фоторецепторных клеток к фотоповреждению связана с присутствием в них всех вышеперечисленных факторов, необходимых для свободнорадикальной реакции фотоокисления. Это, во-первых, эффективно поглощающие свет хромофоры (главным образом ретиналь и его производные – бис-ретиноиды, например А2Е), во-вторых, высокое парциальное давление кислорода, в-третьих, наличие субстратов, способных окисляться с большой легкостью.
Молекулярные компоненты фоторецепторной мембраны представляют собой идеальные субстраты для реакции свободнорадикального окисления. Три основных фосфолипида фоторецепторной мембраны – фосфатидилхолин, фосфатидилэтаноламин и фосфатидилсерин. Уникален состав этих фосфолипидов: >60% – это легкоокисляемые полиненасыщенные жирные кислоты, причем на долю докозагексаеновой кислоты, содержащей 22 углеродных атома и 6 двойных связей (С22:6), приходится ~75% всех жирных кислот. Все эти факторы способствуют чрезвычайной уязвимости фоторецепторных клеток к окислительному повреждению. Однако все эти факторы существенны в основном для клеток глаза животных-альбиносов или для слабопигментированных особей. Напротив, пигментированные животные крайне устойчивы к действию различного рода прооксидантов (Донцов и др., 1980; Ostrovsky et al., 1987; Сакина и др., 1990; Scalia et al., 1990; Bilgihan et al., 1995; Corsaro et al., 1995; Zemel et al., 1995; Dontsov et al., 1999; Safa, Osborne, 2000; Sundelin et al., 2001; Dontsov, Ostrovsky, 2005; Wang et al., 2006; Фельдман и др., 2008; Insausti et al., 2013).
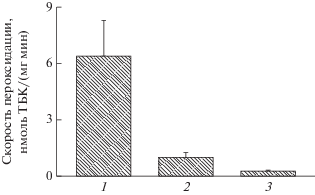
В наших экспериментах проведено сравнение устойчивости структур глаза пигментированных и непигментированных или слабопигментированных животных к действию различных прооксидантов. Мы установили (Dontsov, Ostrovsky, 2005), что скорость пероксидации липидов сетчатки и РПЭ, индуцированной Fe2+, была значительно выше у кроликов-альбиносов.
Дополнительные эксперименты показали, что активности других антиоксидантных систем в клетках РПЭ пигментированных животных и альбиносов существенно не различаются. Поэтому можно предположить, что если удалить из пигментированной ткани экранирующие пигменты, то эта ткань станет чувствительной к действию прооксидантов. Подобный эксперимент был выполнен на сильнопигментированной ткани РПЭ травяной лягушки R. temporaria. В этом случае в качестве прооксидантной системы были использованы супероксидные радикалы, генерируемые в ходе ксантиноксидазной реакции. Результаты показали, что эта система окисления не вызывает сколько-нибудь заметного накопления продуктов пероксидации липидов, т.е. в пигментированной ткани этот процесс практически полностью отсутствует. Удаление же меланосом из гомогената пигментированного РПЭ приводило к значительному усилению процесса пероксидации (Донцов, 2014). Этим подтверждается наше предположение о том, что основной вклад в ингибирование процесса пероксидации вносят именно экранирующие пигменты, в данном случае меланосомы.
Пигментированные животные проявляют более высокую устойчивость и к действию ионизирующей радиации. Было исследовано развитие пероксидации липидов в сетчатке и РПЭ мышей при рентгеновском облучении и была определена роль меланина в этих процессах. Опыты проводили на темнопигментированных мышах линии С57ВL/6 и белых мышах колонии SNK массой 18–20 г. Общее рентгеновское облучение проводили на аппарате РУТ-200 (Россия) при напряжении 200 кВ, силе тока 10 мА, фильтре Cu 0.5 см, мощности дозы 48.5 мК/кг. Животных облучали однократно в дозах 6 и 12 Гр или фракционированно в дозе 1.5 Гр × 4 (1 раз в неделю, общая доза 6 Гр). Продукты пероксидации определяли в гомогенате смеси тканей нейральной сетчатки и РПЭ. Было показано, что при интенсивном однократном общем облучении дозой 12 Гр, приводящем к гибели всех мышей на 7–8-е сут, наблюдается резкое возрастание содержания ТБК-активных продуктов в структурах глаза мышей-альбиносов через 24 ч после облучения (Сакина и др., 1990). Максимальное увеличение содержания ТБК-активных продуктов достигало 65–75%, а в отдельных опытах – 100% по сравнению с таковым у необлученных животных. В то же время пигментированные мыши оказались по этому критерию гораздо менее чувствительными к облучению в этих же дозах – содержание продуктов пероксидации у них возрастало на 20–30% (Сакина и др., 1990).
Аналогичная закономерность прослеживается и для беспозвоночных животных – животные с большим содержанием экранирующих пигментов менее чувствительны к прооксидантным факторам (Dontsov et al., 1999; Фельдман и др., 2008; Insausti et al., 2013). В этих экспериментах мы исследовали две генетически подобные популяции балтийской креветки вида M. relicta. Оказалось, что озерная популяция намного чувствительнее к световому воздействию по сравнению с морской популяцией: даже умеренное освещение животных, например, на поверхности воды вечером в отсутствие солнца приводит к полной потере зрения (Lindstrom, Nilsson, 1988). Анализ содержания экранирующих пигментов в глазах этих животных показал, что у креветок морской популяции оммохромов почти в 3 раза больше, чем у креветок озерной популяции (Dontsov et al., 1999). Мы сравнили антиоксидантную активность пигментных и ретинулярных клеток в глазах двух популяций креветок M. relicta. Cравнительная кинетика накопления липидных гидропероксидов при окислении гомогенатов глаз обоих типов популяций креветок показала, что гомогенат глаз морской популяции значительно устойчивее к пероксидации, чем гомогенат озерной популяции (Dontsov et al., 1999). Нами было установлено (Фельдман и др., 2008), что эффект низкой чувствительности клеток сложного глаза креветок морской популяции к действию прооксидантов не связан с более высоким содержанием в них низкомолекулярных антиоксидантов и антиоксидантных ферментов, а обусловлен именно наличием множества оммохромных гранул.
В целом полученные результаты свидетельствуют о том, что скорость пероксидного окисления липидов, индуцированного такими прооксидантными системами, как УФ, интенсивный видимый свет, Fe2+, гидропероксиды, гипероксия, супероксидные радикалы кислорода, значительно ниже в тканях глаза сильнопигментированных животных, по сравнению со слабопигментированными тканями или тканями животных-альбиносов. Все это позволяет сделать вывод об антиоксидантной роли экранирующих пигментов (меланосом и оммохромов) в пигментированных тканях глаза позвоночных и беспозвоночных животных.
Защитное действие гранул меланосом позвоночных и оммохромов беспозвоночных может осуществляться по крайней мере двумя путями. Первый путь – регуляция внутриклеточной концентрации прооксидантов. Экранирующие пигменты выполняют свою физиологическую функцию, будучи частицей, гранулой. Молекулы прооксидантов, такие как ионы многовалентных металлов (особенно двухвалентного железа), экзогенные и эндогенные фотосенсибилизаторы, ксенобиотики, могут взаимодействовать с поверхностью гранул экранирующих пигментов, сорбируясь на них. Такие гетерогенные реакции характерны для частиц, имеющих поры, и хорошо известны для меланиновых полимеров (Zeise et al., 1992a, б; Bridelli et al., 2006). Важно, как это было показано в экспериментах по связыванию многих экзогенных фотосенсибилизаторов меланинами, что их адсорбция физическая по свой природе и что химические свойства связанных прооксидантных молекул радикально меняются (Crippa et al., 2004). Меланосомы и оммохромные гранулы, выступая как внутриклеточные сорбенты, могут регулировать c помощью такого механизма как темновые (индуцированные, например, ионами металлов), так и фотосенсибилизированные эндогенными и экзогенными сенсибилизаторами процессы пероксидации липидов.
Второй путь защитного действия гранул меланосом позвоночных и оммохромов беспозвоночных – это их слияние в пигментных, а возможно, и в ретинулярных клетках сложного глаза беспозвоночных с “проблемными” органеллами, в которых велика вероятность развития свободнорадикальных процессов окисления. Такими “проблемными” органеллами, например, в клетках РПЭ являются, во-первых, фагосомы, содержащие огромное количество материала, легко подверженного процессу пероксидации как в темноте, так и при освещении, и, во-вторых, липофусциновые гранулы, содержащие токсичные бис-ретиноиды – флуорофоры липофусциновых гранул. Слияние меланосом с липофусциновыми гранулами и образование сложных меланолипофусциновых гранул – давно установленный факт (Feeney-Burns et al., 1980, 1984). Находясь в непосредственном контакте с объектом, в котором протекают реакции свободнорадикального окисления, меланосомы могут легко ингибировать их. Они могут их ингибировать, например, путем взаимодействия с радикалами супероксида и гидропероксидов, а также с нерадикальными активными продуктами процесса пероксидации, например с альдегидами. Таким образом, меланосомы способны предотвратить развитие в клетке процессов свободнорадикального окисления.
РОЛЬ ЭКРАНИРУЮЩИХ ПИГМЕНТОВ – МЕЛАНОСОМ В ПРОЦЕССАХ СТАРЕНИЯ
Процесс старения приводит к значительным изменениям в клетках ретинального пигментного эпителия человека (Boulton, 1998). Кроме различных биохимических и морфологических изменений в этих неделящихся постмитотических клетках с возрастом накапливаются “пигмент старости” липофусцин и сложные пигментные гранулы, такие как меланолипофусцин; существенно, что при этом одновременно уменьшается количество меланинсодержащих меланосом (Feeney-Burns, 1980). Показано, что с возрастом (после 40 лет) в клетках РПЭ происходит значительное уменьшение концентрации меланина (Feeney-Burns et al., 1984; Weiter et al., 1986). Морфологические измерения и ЭПР-измерения показали, что в РПЭ человека в возрастной группе 20–30 лет содержится на 36% больше меланина, чем в возрастной группе 60–90 лет (Rozanowski et al., 2008). При этом наблюдается значительное уменьшение числа гранул меланосом в клетке РПЭ. Если в возрастной группе до 20 лет меланосомы занимают ~8% объема клетки РПЭ, то в возрастной группе 41–90 лет этот объем постепенно уменьшается до 3.5% (Feeney-Burns et al., 1984). В возрастной группе 90–101 год меланосомы практически полностью заменяются смешанными меланолипофусциновыми гранулами (Feeney-Burns et al., 1990). Это свидетельствует о процессах возрастной биодеградации меланосом в клетках РПЭ. В то же время конкретные механизмы, приводящие к возрастной биодеградации меланосом в клетках РПЭ, до сих пор не известны.
Анализ опубликованных данных позволяет предполагать, что деградация меланина меланосом не связана с энзиматическими реакциями. Вероятнее всего, при старении происходит химическая деструкция меланина, вызванная или квантами света, или окислительными (фотоокислительными) процессами. Действительно, было показано, что с возрастом происходит окислительная дезинтеграция меланина в меланосомах, которая выявляется по увеличению флуоресценции и по возрастанию поглощения кислорода меланосомами у людей пожилого и старческого возрастов (Rozanowska et al., 2002; Sarna et al., 2003). Известно, что в ходе деструкции меланина, вызванной действием УФ-облучения и/или пероксида водорода, образуются флуоресцирующие продукты распада полимера (Elleder, Borovansky, 2001; Kayatz et al., 2001; Borovansky, Elleder, 2003).
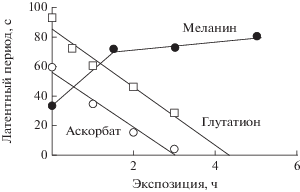
Как показали эксперименты (Коржова и др., 1989; Zadlo et al., 2006; Донцов и др., 2015), облучение меланина интенсивным видимым светом и УФ приводит к разрушению пигмента. Однако для достижения такого эффекта необходимо чрезвычайно длительное облучение меланина. На рис. 8 показано изменение антиоксидантной активности ДОФА-меланина, аскорбата и глутатиона при их облучении УФ-видимым светом. Отмечено, что антиоксидантная активность аскорбата и глутатиона резко уменьшается, в то время как способность меланина тушить хемилюминесценцию люминола даже несколько возрастает. Эти результаты свидетельствуют о том, что не слишком длительное (до 5 ч) УФ-облучение меланина не приводит к сколько-нибудь значительным разрушениям полимера. Это подтверждается экспериментальными результатами сравнительного измерения антиоксидантной активности нативных и УФ-облученных меланинов.
Рис. 8.
Уменьшение антиоксидантной активности аскорбата и глутатиона, но не меланина при действии УФ-облучения. По оси ординат – латентный период задержки хемилюминесценции люминола; по оси абсцисс – время облучения дуговой ртутно-кварцевой лампой.
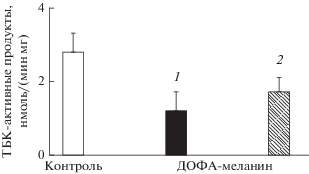
На рис. 9 показана кинетика накопления ТБК-активных продуктов при Fe2+-индуцированной пероксидации кардиолипиновых липосом (контроль). Меланосомы, выделенные из РПЭ глаза быка, эффективно ингибировали этот процесс. При этом меланосомы, подвергнутые УФ-облучению в течение 3.5 ч, оказались столь же эффективными ингибиторами, что и нативные необлученные меланосомы (кривые 2 и 3). И только намного более длительное облучение ДОФА-меланина и меланосом полным УФ-видимым светом приводит к уменьшению их антирадикальной активности, определяемой по степени тушения хемилюминесценции люминола (рис. 10). Если 7-часовое облучение вызывает лишь небольшое уменьшение способности тушить хемилюминесценцию люминола, то 32-часовое облучение приводит к значительному, хотя и не катастрофическому падению антирадикальной активности ДОФА-меланина. Экспериментально подтверждается высокая устойчивость меланинов к деструктивному действию света. Даже жесткое и длительное УФ-облучение (длина волн от 190 нм и выше) ДОФА-меланина не приводило к значительному уменьшению способности пигмента проявлять антиоксидантное действие. УФ-облучение пигмента в течение 32 ч приводило всего лишь к примерно 1.5-кратному уменьшению ингибирующей способности ДОФА-меланина в отношении пероксидации кардиолипиновых липосом (рис. 11).
Рис. 9.
Влияние меланосом из клеток ретинального пигментного эпителия глаза быка на кинетику накопления продуктов пероксидации кардиолипиновых липосом. Облученные (2) и необлученные (3) меланосомы добавлены в равных концентрациях – 3 × × 107 гранул/мл. Контроль (1) – накопление продуктов, реагирующих с тиобарбитуровой кислотой (ТБК), в отсутствие меланосом.
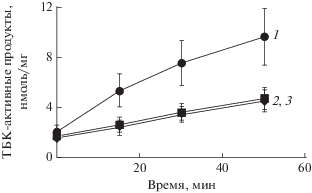
Рис. 10.
Зависимость продолжительности латентного периода инициации хемилюминесценции люминола от концентрации темнового (контроль) и подвергнутого УФ-облучению в течение 7, 16.5, 26, 32 ч ДОФА-меланина (1–5 соответственно).
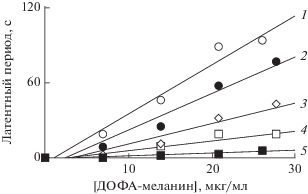
Рис. 11.
Влияние нативного и УФ-облученного ДОФА-меланина на скорость УФ-индуцированной пероксидации кардиолипиновых липосом. Контроль – скорость накопления продуктов, реагирующих с тиобарбитуровой кислотой при УФ-облучении в отсутствие меланина. 1 – без облучения, 2 – 32 ч УФ- облучения. В опытных пробах добавлено по 25 мкг/мл исходного и облученного ДОФА-меланина.
Таким образом, разрушение меланина УФ или интенсивным видимым светом требует слишком больших энергий облучения и слишком длительных экспозиций. Следует отметить, что структуры глаза – роговица, хрусталик и стекловидное тело – практически не пропускают коротковолновый УФ к клеткам РПЭ, содержащим меланин. Маловероятно также, чтобы видимый свет такой большой интенсивности и длительности, который используется для разрушения меланина в эксперименте, когда-либо воздействовал на сетчатку глаза в условиях in vivo. Поэтому разрушение меланина РПЭ меланосом светом исключено для глаза, но возможно для меланина волос и кожных покровов, подвергающихся непосредственному воздействию солнечного света.
Напротив, сильные окислители, такие как пероксид водорода или супероксидные радикалы, довольно легко приводят к деструкции меланина и потере им своих антиоксидантных свойств (Донцов и др., 2015, 2017). Было показано, например, что супероксидные радикалы приводят одновременно как к уменьшению численности меланосом, так и к уменьшению в них концентрации парамагнитных центров. Полная деградация меланосом приводит к образованию прозрачного раствора, исчезновению сигнала ЭПР и полной потере антиоксидантных свойств пигмента (Донцов и др., 2017). На рис. 12 показана зависимость уменьшения концентрации меланосом из РПЭ человека в зависимости от концентрации супероксида калия (Донцов и др., 2017).
Рис. 12.
Деградация меланосом ретинального пигментного эпителия человека супероксидом калия. Инкубация в течение 2 ч меланосом с супероксидом приводит к уменьшению их числа. Начальная концентрация меланосом составляла 2.7 × 108 гранул/мл.
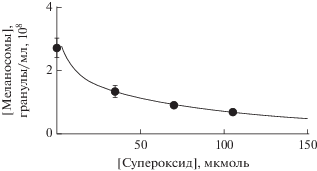
При концентрации супероксида 100 мМ через 2 ч инкубации наблюдается почти трехкратное уменьшение числа меланосом в образце. Повышая концентрацию супероксида до 170–180 мМ, можно добиться полной деградации всех изначально присутствующих в суспензии меланосом. При этом суспензия становится абсолютно прозрачной и микроскопический контроль показывает полное отсутствие видимых гранул. В этих условиях наблюдается также исчезновение первоначального сигнала ЭПР меланина, что свидетельствует о полном разрушении полимера.
Полученные данные о зависимости уменьшения числа меланосомных гранул из клеток РПЭ человека от концентрации супероксида позволяют приблизительно оценить число молекул супероксида, необходимое для полной деградации одной меланосомы. В наших экспериментах для полного разрушения 2.7 × 108 меланосом требовалось в среднем 175 ± 25 мкмоль супероксида. Для полной деградации одной меланосомы необходимо, таким образом, 650 ± 100 фмоль супероксида. Известно (Boulton et al., 1993), что в клетке РПЭ пожилого здорового человека, содержится ~700 липофусциновых гранул. При относительно слабом облучении клетки синим светом (1.5 мВт/см2) образуется 0.56 фмоль супероксида в 1 мин. Отсюда следует, что при такой активности липофусциновых гранул требуется ~19 ч для генерации 650 фмоль супероксида, необходимых, согласно нашим расчетам, для полной деструкции одной меланосомы.
Как отмечено выше, в процессе старения происходит слияние меланосом с липофусциновыми гранулами и образование меланолипофусциновых гранул, количество которых увеличивается с возрастом (Feeney-Burns, 1980; Feeney-Burns et al., 1984). В возрастной группе 90–101 год меланосомы практически полностью заменяются смешанными меланолипофусциновыми гранулами (Feeney-Burns et al., 1990). Мы предположили, что возможная причина возрастного уменьшения содержания меланина в клетках РПЭ человека – уменьшение числа меланосом вследствие их слияния с липофусциновыми гранулами и дальнейшей фотоиндуцированной деструкции меланинового пигмента супероксидными радикалами, образующимися при поглощении света флуорофорами липофусцина.
Полученные результаты позволяют с большой долей вероятности предполагать, что возрастное исчезновение меланина в клетке РПЭ в значительной степени обусловлено деструкцией пигмента, находящегося в составе меланолипофусциновых гранул, супероксидными радикалами, генерируемыми флуорофорами липофусцина при действии на клетку видимого света физиологических интенсивностей (Донцов и др., 2017).
Уменьшение в клетках РПЭ с возрастом количества меланосом, выполняющих в них и экранирующую, и антиокислительную функции, при одновременном накоплении в этих клетках меланолипофусциновых и липофусциновых гранул может привести к возникновению в клетке РПЭ фотоокислительного стресса, который прямо связан с развитием таких серьезных патологий глаза, как возрастная макулярная дегенерация сетчатки и пигментный ретинит.
ЗАКЛЮЧЕНИЕ
Таким образом, можно констатировать, что внутриклеточные органеллы (меланосомы и оммохромы) как экранирующие пигменты глаза позвоночных и беспозвоночных животных и глаза человека выполняют одновременно две важные, дополняющие одна другую физиологические функции. Во-первых, они служат отсекающими светофильтрами, защищающими фоточувствительные клетки от опасности повреждения слишком ярким светом. Во-вторых, экранирующие пигменты, обладая выраженной антиоксидантной активностью, эффективно защищают клетку от опасности окислительного стресса, в том числе и в первую очередь фотоокислительного стресса.
Роль меланосом в клетках РПЭ глаза человека трудно переоценить. Их исчезновение в процессе старения с одновременным накоплением в клетке РПЭ “пигмента старости” – липофусциновых гранул как источника фотоиндуцированных активных форм кислорода – повышает опасность окислительного стресса. Действительно, избыточное накопление в клетках РПЭ липофусциновых гранул, приводящее, в том числе, к их ускоренному слиянию с меланосомами и образованию смешанных меланолипофусциновых гранул, может рассматриваться как существенный патогенетический фактор (дегенеративные заболевания сетчатки, например болезнь Штаргардта). Деградация же меланина в составе меланолипофусциновых гранул, приводящая в конечном счете к исчезновению меланосом как экранирующих светофильтров и антиоксидантов, существенно повышает опасность развития окислительного и особенно фотоокислительного стрессов в структурах глаза.
Список литературы
Багиров Р.М., Стукан Р.А., Донцов А.Е., Островский М.А., Лапина В.А. Исследование связывания ионов железа меланопротеиновыми гранулами пигментного эпителия глаза методом гамма-резонансной спектроскопии // Биофизика. 1986а. Т. 31. № 3. С. 469–474.
Багиров Р.М., Стукан Р.А., Донцов А.Е., Островский М.А., Лапина В.А. Исследование методом гамма-резонансной спектроскопии связывания ионов железа оммохромами глаза беспозвоночных // Биофизика. 1986б. Т. 31. № 6. С. 1017–1022.
Донцов А.Е. Антиоксидантная функция оммохромов креветки Pandalus latirostris // Журн. эволюц. биохимии и физиологии. 1981. Т. 17. С. 53–56.
Донцов А.Е. Физико-химические свойства и биологические функции пигментных гранул глаза позвоночных и беспозвоночных животных: Автореф. дис. докт. биол. наук. М.: ИБХФ РАН, 2006. 48 с.
Донцов А. Защитное действие меланинов при окислительном стрессе. Saarbrucken, Deutschland: Lambert Acad. Publ., 2014. 165 с.
Донцов А.Е., Лапина В.А., Островский М.А. Фотогенерация супероксида оммохромами и их роль в системе антиоксидантной защиты клеток глаза беспозвоночных // Биофизика. 1984. Т. 29. № 5. С. 878–882.
Донцов А.Е., Сакина Н.Л., Островский М.А. Сравнительное исследование перекисного окисления липидов в пигментном эпителии глаза пигментированных животных и альбиносов // Биохимия. 1980. Т. 45. № 5. С. 923–928.
Донцов А.Е., Сакина Н.Л., Островский М.А. Потеря меланина клетками ретинального пигментного эпителия глаза связано с его окислительной деструкцией в составе меланолипофусциновых гранул // Биохимия. 2017. Т. 82. № 8. С. 916–924.
Донцов А.Е., Сакина Н.Л., Голубков А.М., Островский М.А. Светоиндуцированное высвобождение из липофусциновых гранул ретинального пигментного эпителия глаза человека токсичных продуктов фотоокисления флуорофора А2Е // Докл. РАН. 2009. Т. 425. № 5. С. 683–687.
Донцов А.Е., Сакина Н.Л., Коромыслова А.Д., Островский М.А. Эффект УФ-облучения и пероксида водорода на антирадикальную и антиоксидантную активность ДОФА-меланина и меланосом из клеток ретинального пигментного эпителия // Изв. РАН. Сер. химическая. 2015. № 7. С. 1623–1628.
Егоров С.Ю., Красновский А.А., Донцов А.Е., Островский М.А. Тушение синглетного молекулярного кислорода экранирующими пигментами – меланинами и оммохромами // Биофизика. 1987. Т. 32. № 4. С. 685–686.
Коржова Л.П., Фролова Е.В., Романов Ю.А., Кузнецова И.А. Фотоиндуцированная деструкция ДОФА-меланина // Биохимия. 1989. Т. 54. С. 992–998.
Лапина В.А., Донцов А.Е., Островский М.А., Эмануэль Н.М. Взаимодействие анион-радикалов кислорода с меланинами и оммохромами глаз // Докл. АН СССР. 1984. Т. 280. № 6. С. 1463–1465.
Островский М.А., Сакина Н.Л., Донцов А.Е. Антиоксидантная функция экранирующих пигментов глаза // Докл. АН СССР. 1980. Т. 255. № 3. С. 749–751.
Островский М.А., Сакина Н.Л., Донцов А.Е. Система защиты структур глаза от фотоповреждения. Экранирующие пигменты позвоночных – меланосомы как ингибиторы процессов фотоокисления // Журн. эволюц. биохимии и физиологии. 1987. Т. 23. № 5. С. 575–581.
Пустынников М.Г., Донцов А.Е. Ингибирование УФ-индуцированной аккумуляции липидных гидропероксидов меланинами и оммохромами // Биохимия. 1988. Т. 53. № 7. С. 1117–1120.
Сакина Н.Л., Донцов А.Е., Островский М.А. Ингибирование меланином процесса фотоокисления липидов // Биохимия. 1986. Т. 51. № 5. С. 864–868.
Сакина Н.Л., Донцов А.Е., Лапина В.А., Островский М.А. Система защиты структур глаза от фотоповреждения. II. Экранирующие пигменты членистоногих – оммохромы – как ингибиторы процессов фотоокисления // Журн. эволюц. биохимии физиологии. 1987. Т. 23. № 6. С. 702–706.
Сакина Н.Л., Коромыслова А.Д., Донцов А.Е., Островский М.А. РПЭ меланосомы связывают флуорофор липофусциновых гранул А2Е и продукты его фотоокисления // Рос. физиол. журнал им. И.Н. Сеченова. 2013. Т. 99. № 5. С. 642–653.
Сакина Н.Л., Донцов А.Е., Афанасьев Г.Г., Островский М.А., Пелевина И.И. Аккумуляция продуктов перекисного окисления липидов в структурах глаза мышей, подвергнутых рентгеновскому облучению // Радиобиология. 1990. Т. 30. № 1. С. 28–31.
Сакина Н.Л., Донцов А.Е., Кузнецова Г.П., Островский М.А., Арчаков А.И. Ингибирование перекисного окисления липидов меланопротеиновыми гранулами // Биохимия. 1980. Т. 45. № 8. С. 1476–1480.
Смирнов Л.Д., Кузнецов Ю.В., Проскуряков С.Я., Скворцов В.Г., Носко Т.Н., Донцов А.Е. Антирадикальная и NO-ингибирующая активность β-гидрокси(этокси)производных азотистых гетероциклов // Биофизика. 2011. Т. 56. № 2. С. 316–321.
Фельдман Т.Б., Донцов А.Е., Яковлева М.А., Федорович И.Б., Линдстрем М., Доннер К., Островский М.А. Сравнение антиоксидантных систем в глазах двух популяций Mysis relicta (Crustacea: Mysidacea) с различной устойчивостью к световому повреждению // Сенсор. системы. 2008. Т. 22. № 4. С. 309–316.
Asada K., Takahashi M., Nagate M. Reactivity of tiols with superoxide radicals // Agr. Biol. Chem. 1976. V. 40. P. 1891–1892.
Bilgihan A., Bilgihan M.K., Akata R.F., Aricioglu A., Hasanreisoglu B. Antioxidative role of ocular melanin pigment in the model of lenz induced uveitis // Free Radic. Biol. Med. 1995. V. 19. P. 883–885.
Borovansky J., Elleder M. Melanosomes degradation: fact or fiction // Pigment Cell Res. 2003. V. 16. P. 280–286.
Boulton M. Melanin and the retinal pigment epithelium // The retinal pigment epithelium: Function and Disease / Eds Marmor M.F., Wolfensberger T.J. N.Y.: Oxford Univ. Press, 1998. P. 65–85.
Boulton M., Dontsov A., Jarvis-Evans J., Ostrovsky M., Svistunenko D. Lipofuscin is a photoinducible free radical generator // J. Photochem. Photobiol. B. Biol. 1993. V. 19. P. 201–204.
Bridelli M.G., Ciati A., Crippa P.R. Binding of chemicals to melanins reexamined: adsorption of some drugs to the surface of melanin particles // Biophys. Chem. 2006. V. 119. P. 137–145.
Bull A.T. Kinetics of cellulase inactivation by melanin // Enzymologia. 1970. V. 39. P. 333–347.
Corsaro C., Scalia M., Blanco A.R., Aiello I., Sichel G. Melanins in physiological conditions protect against lipo-peroxidation. A study on albino and pigmented Xenopus // Pigment Cell Res. 1995. V. 8. P. 279–282.
Crippa P.R., Fornes J.A., Ito A.S. Photophysical properties of pyrene in interaction with the surface of melanin particles // Coll. Surfaces B. Biointerfaces. 2004. V. 35. P. 137–141.
Dontsov A.E., Ostrovsky M.A. The antioxidant role of shielding eye pigments – melanins and ommochromes, and physicochemical mechanism of their action // Chem. Biol. Kinet. New Horizons / Eds Varfolomeev S.D., Burlakova E.B., Danvers, MA 0193, USA, 2005. V. 2. P. 133–150.
Dontsov A.E., Fedorovich I.B., Lindström M., Ostrovsky M.A. Comparative study of spectral and antioxidant properties of pigments from the eyes of two Mysis relicta (Crustacea, Mysidacea) populations, with the different light damage resistance // J. Comp. Physiol. B. 1999. V. 169. P. 157–164.
Elleder M., Borovansky J. Autofluorescence of melanin induced by ultraviolet radiation and near ultraviolet light. A histochemical and biochemical study // Histochem. J. 2001. V. 33. P. 273–281.
Feeney-Burns L. The pigments of the retinal pigment epithelium // Curr. Top. Eye Res. 1980. V. 2. P. 119–178.
Feeney-Burns L., Berman E.R., Rothman H. Lipofuscin of human retinal pigment epithelium // Am. J. Ophthalmol. 1980. V. 90. P. 783–791.
Feeney-Burns L., Burns R.P., Gao C.L. Age-related macular changes in humans over 90 years old // Am. J. Ophthalmol. 1990. V. 109. P. 265–278.
Feeney-Burns L., Hilderbrand E.S., Eldridge S. Aging human RPE: morphometric analysis of macular, equatorial, and peripheral cells // Invest. Ophthalmol. Vis. Sci. 1984. V. 25. P. 195–200.
Insausti T.C., Le Gall M., Lazzari C.R. Oxidative stress, photodamage and role of screening pigment in insect eyes // J. Exp. Biol. 2013. V. 216. P. 3200–3207.
International guiding principles for biomedical research involving animals. CIOMS & ICLAS // Altern. Lab. Anim. (ATLA). 1985. V. 12. № 4. P. 1–4.
Kayatz P., Thumann G., Luther T.T., Jordan J.F., Bartz-Schmidt K.V., Esser P.J., Schraermeyer U. Oxidation causes melanin fluorescence // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. P. 241–246.
Korytowski W., Pilas B., Sarna T., Kalyanaraman I.A. Photoinduced generation of hydrogen peroxide and hydroxyl radicals in melanins // Photochem. Photobiol. 1987. V. 45. P. 185–190.
Korytowski W., Kalyanaraman I.A., Menon I.A., Sarna T., Sealy R.C. Reaction of superoxide anions with melanins: electron spin resonance and spin trapping studies // Biochim. Biophys. Acta. 1986. V. 882. P. 145–153.
Lavail M.M., Sidman R.L., Gerhardt C.O. Congenic strains of RCS rats with inherited retinal dystrophy // J. Hered. 1975. V. 66. P. 242–244.
Lindstrom M., Nilsson H.L. Eye function of Mysis relicta (Loven, Crustacea) from two photic environments. Spectral sensitivity and light tolerance // J. Exp. Mar. Biol. Ecol. 1988. V. 120. P. 23–37.
Ostrovsky M.A., Sakina N.L., Dontsov A.E. An antioxidative role of ocular screening pigments // Visi. Res. 1987. V. 27. P. 893–899.
Potts A.M., Au P.C. The affinity of melanin for inorganic ions // Exp. Eye Res. 1976. V. 22. P. 487–491.
Rapp L.M., Williams T.P. The role of ocular pigmentation in protecting against retinal light damage // Vis. Res. 1980. V. 20. P. 1127–1131.
Rozanowska M., Korytowski W., Rozanowski B., Skumatz C.M., Boulton M., Burke J.M., Sarna T. Photoreactivity of aged human RPE melanosomes: a comparison with lipofuscin // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 2088–2096.
Rozanowski B., Cuenco J., Davies S., Shamsi F.A., Zadlo A., Dayhaw-Barker P., Rozanowska M., Sarna T., Boulton M. The phototoxicity of aged human retinal melanosomes // Photochem. Photobiol. 2008. V. 84. P. 650–657.
Safa R., Osborne N.N. Retinas from albino rats are more susceptible to ischemic damage than age-matched pigmented animals // Brain Res. 2000. V. 862. P. 36–42.
Sarna T., Burke J.M., Korytowski W., Rozanowska M., Skumatz C.M., Zareba A., Zareba M. Loss of melanin from human RPE with aging: possible role of melanin photooxidation // Exp. Eye Res. 2003. V. 76. P. 89–98.
Scalia M., Geremia E., Corsaro C., Santoro C., Baratta D., Sichel G. Lipid peroxidation in pigmented and unpigmented liver tissues: protective role of melanin // Pigment Cell Res. 1990. V. 3. P. 115–119.
Sokolov V.S., Sokolenko E.A., Sokolov A.V., Dontsov A.E., Chizmadzhev Yu.A., Ostrovsky M.A. Interaction of pyridinium bis-retinoid (A2E) with bilayer lipid membranes // J. Photochem. Photobiol. B. 2007. V. 86. P. 177–185.
Sparrow J.R., Kim C.Y., Zhou J. Phospholipid meets all-trans-retinal: the making of RPE bisretinoids // J. Lipid. Res. 2010. V. 51. P. 247–261.
Sundelin S.P., Nilsson S.E., Brunk U.T. Lipofuscin-formation in cultured retinal pigment epithelial cells is related to their melanin content // Free Radic. Biol. Med. 2001. V. 30. P. 74–81.
Wang Z., Dillon J., Gaillard E.R. Antioxidant properties of melanin in retinal pigment epithelial cells // Photochem. Photobiol. 2006. V. 82. P. 474–479.
Weiter J.J., Delori F.C., Wing G.L., Fitch K.A. Retinal pigment epithelial lipofuscin and melanin and choroidal melanin in human eyes // Invest. Ophthalmol. Vis. Sci. 1986. V. 27. P. 145–152.
Yamashita T. Selective inhibition by the sulfhydryl reagent maleimide of zymosan particle phagocytosis by neutrophils // FEBS Lett. 1982. V. 141. P. 68–73.
Yoon K.D., Yamamoto K., Ueda K., Zhou J., Sparrow J.R. A novel source of methylglyoxal and glyoxal in retina: implications for age-related macular degeneration // PLoS One. 2012. V. 7. E41309.
Zadlo A., Rozanowska M.B., Burke J.M., Sarna T.J. Photobleaching of retinal pigment epithelium melanosomes reduces their ability to inhibit iron-induced peroxidation of lipids // Pigment Cell Res. 2006. V. 20. P. 52–60.
Zeise L., Addison R.B., Chedekel M.R. Bio-analytical studies of eumelanins. I. Characterizations of melanin the particle // Pigment Cell Res. 1992a. V. 5 (suppl. 2). P. 48–53.
Zeise L., Murr B.L., Chedekel M.R. Melanin standard method – particle description // Pigment Cell Res. 1992б. V. 5. P. 132–142.
Zemel E., Loewenstein A., Lei B., Lazar M., Periman I. Ocular pigmentation protects the rabbit retina from gentamicin-induced toxicity // Invest. Ophthalmol. Vis. Sci. 1995. V. 36. P. 1875–1884.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая