Известия РАН. Серия биологическая, 2019, № 1, стр. 90-94
Изменение реореакции молоди радужной форели Oncorhynchus mykiss в первые дни после инъекции сурфагона
Д. С. Павлов a, Е. Д. Павлов a, *, Е. В. Ганжа a, П. И. Зарипов a, М. А. Ручьев a
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 27.02.2018
После доработки 23.04.2018
Принята к публикации 10.04.2018
Аннотация
Исследовано краткосрочное (до 10 сут после инъекции) действие сурфагона на реореакцию радужной форели Parasalmo mykiss (=Oncorhynchus mykiss) в возрасте 3 мес. Показано, что на 7-е сут после инъекции препарата не регистрировалась реакция рыб на манипуляционный стресс, а реакция на инъекцию препарата проявлялась через 10 сут, при этом рыбы двигались в основном вниз по течению.
Отношение рыб к течению (реореакция) и его динамика – сложная поведенческая реакция (Павлов, 1970), зависящая как от внешних факторов (среды обитания), так и от внутренних (физиологического состояния организма). Реореакция имеет врожденный характер и проявляется как направленное движение особи в потоке. Другие особенности поведения рыб в потоке воды, в том числе и их миграции, проявляются на фоне этой специфической реакции. Так, миграционное поведение рыб находится в большой зависимости от реореакции – во многих случаях поведенческого механизма этого процесса (Павлов, 1979).
Есть данные (Plate et al., 2003), что гонадотропный рилизинг-гормон (ГнРГ) влияет на реореакцию половозрелых лососей, мотивируя их на преодоление потока и водных препятствий (водопадов и порогов) во время нерестовой миграции путем повышения нейромоторной функции. Ранее (Павлов Д.С. и др., 2016) нами было оценено влияние сурфагона на реореакцию молоди радужной форели Oncorhynchus mykiss (=Parasalmo mykiss) на 30–40-е сут после инъекции. Было показано, что однократная инъекция препарата приводит к изменению соотношения типов реореакции у рыб. Инъецированные особи предпочитают двигаться против течения, в то время как интактные рыбы двигаются преимущественно вниз по течению. Показано (Павлов Д.С. и др., 2016; Павлов и др., 2018), что сурфагон в применяемой концентрации (15 мкг действующего вещества на 1 кг рыбы) в целом положительно влияет на физиологическое состояние и адаптационные возможности молоди радужной форели.
Указанный эффект от инъекции сурфагона мы связываем с гормональным импринтингом – отсроченной гормональной реакцией организма на ранее введенное экзогенное вещество. Известно, что сурфагон в течение ~5 ч распадается на аминокислоты и выводится из организма. При этом эффект от короткого воздействия гормона на ранних этапах развития молоди проявляется по прошествии длительного времени. В связи с тем что оценку эффекта мы проводили только через 30 сут после инъекции препарата, остался неясным вопрос: в течение какого времени после инъекции сурфагона проявляются первичные изменения реореакции рыб, индуцированные гормональными перестройками в организме? Очевидно, что знание сроков поведенческих изменений при влиянии сурфагона позволят лучше понимать механизм этого процесса.
Цель работы – исследовать раннее (до 10 сут после инъекции) влияние инъекции сурфагона на реореакцию молоди радужной форели.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент был проведен в августе 2017 г. в рыборазводном хозяйстве ООО “Янисъярви” (Республика Карелия, пос. Суйстамо). Объект исследования – молодь радужной форели в возрасте 3 мес. Средние длина (L) и масса рыб составляли 4.5 см и 2.9 г соответственно. Все исследованные рыбы – самки.
Молодь радужной форели содержали в трех проточных бассейнах размером 2 × 2 × 0.75 м при уровне воды 0.5 м и плотности посадки 40 экз./м3 воды. Вода в бассейны поступала по трубам из р. Улмосенйоки. Температура воды в бассейнах составляла 12–16°C. Кормление осуществляли 3 раза в сутки гранулированным кормом Биомар “Иницио плюс” с размером гранул 1.1 мм. В дни проведения инъекций и экспериментов (4, 7 и 10-е сут после инъекции) кормление не проводили.
Молодь разделили на три группы рыб: не подвергавшихся инъекции (К-1), инъецированных физиологическим раствором (К-2), инъецированных физиологическим раствором с сурфагоном (опыт). Каждую группу по 80 экз. продолжали содержать в бассейнах указанного объема. Две контрольные группы рыб использованы для оценки длительности проявления стресса от инъекции физиологического раствора и препарата. Всех особей до инъекции выдерживали 1–2 мин в растворе анестетика лидокаина (100–150 мг/л воды). Показателем его действия было снижение двигательной активности особей. Рыб из К-1 сразу помещали в чистую воду, а молодь из других групп (К-2, опыт) – после инъецирования (в течение 10–15 с) физиологического раствора (К-2) или сурфагона (опыт).
Сурфагон, находящийся в растворе (5 мкг действующего вещества в 1 мл раствора хлорида натрия и других вспомогательных веществ), дополнительно разбавляли водным раствором хлорида натрия в целях достижения удобного для инъекции объема. Чтобы повысить “гормональный ответ” препарат рыбам (Опыт) инъецировали двукратно (Чебанов и др., 2004) с интервалом 48 ч инсулиновым шприцом внутримышечно под грудной плавник. Таким же образом (двукратно с тем же интервалом) инъецировали физиологический раствор особям из К-2. Концентрация сурфагона при первой инъекции составляла 10 мкг/кг рыбы, а вторая – 15 мкг/кг рыбы. Сурфагон применяли в дозировке, которая находится в диапазоне действия на радужную форель (Павлов Д.С. и др., 2016; Павлов и др., 2018).
Соотношение типов реореакции и его изменение у молоди радужной форели из трех групп оценивали на 4, 7 и 10-е сут после инъекции. Тип реореакции определяли, основываясь на направлении движения рыб в гидродинамической установке “рыбоход” (Pavlov et al., 2010), представляющей собой лоток длиной 1.5 и шириной 0.6 м, разделенный на 9 отсеков с длиной поперечных стенок 0.56 м и шириной проходов между отсеками 7 см (рис. 1).
Рис. 1.
Схема гидродинамической установки “рыбоход” для определения типа реореакции. а – стартовый отсек, б – заградительные решетки. Стрелками обозначены направления течения, 1–9 – нумерация отсеков установки.
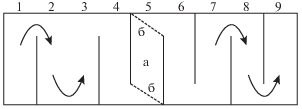
Скорость течения в проходах между отсеками составляла 20–25 см/c (4–5 длин тел исследуемых рыб в секунду). Эксперименты проводили при освещенности 10–100 лк. Контрольных и подопытных рыб поочередно по 10 экз. помещали в стартовый отсек, расположенный в центре установки. Через 20 мин акклимации решетки, ограждающие стартовый отсек, убирали и еще через 20 мин фиксировали число особей в каждом отсеке “рыбохода”. Рыб, поднявшихся против течения в отсеки 1–4, считали показавшими положительный тип реореакции (ПТР), рыб, оставшихся в стартовом отсеке – компенсаторный тип реореакции (КТР), а особей, сместившихся в нижние по течению отсеки 5–9 – отрицательный тип реореакции (ОТР) (Павлов и др., 2010; Pavlov et al., 2010). Для контрольных и подопытных особей выполняли по шесть опытов. В каждом опыте использовали новых особей. При расчетах распределения рыб по отсекам установки число особей суммировали по результатам всех проведенных опытов.
По результатам распределения рыб в “рыбоходе” рассчитывали индекс контранатантности (Ik), который указывает, в каком направлении относительно течения в среднем сместилась одна рыба. Он изменяется от 1 (все рыбы поднялись из стартовой камеры в верхний отсек 1) до –1 (все рыбы опустились из стартовой камеры в нижний отсек 9). Этот индекс рассчитывали по формуле
Обработка материала выполнена с использованием дисперсионного анализа (оценка различий по распределению рыб в гидродинамической установке) и критерия Стьюдента для долей (оценка различий по соотношению типов реореакции).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В течение акклимации (20 мин) молодь радужной форели свободно плавала в толще воды стартового отсека рыбохода. После снятия заградительных решеток одни особи уходили в верхние по течению отсеки, а другие – в нижние отсеки или оставались в стартовом.
Дисперсионный анализ по всем группам рыб показал, что распределение особей в рыбоходе различается у контрольных и подопытных рыб (p = 0.0477 для К-1, p = 0.0123 для К-2). Отдельный анализ только двух контрольных групп не обнаружил достоверных различий распределения рыб по отсекам рыбохода (р = 0.9648).
В некоторых случаях различия оказались достоверными и по критерию Стьюдента для долей (табл. 1). На 4-е сут после инъекции по реореакции достоверно различаются между собой только особи из К-2 и Опыта по КТР – в опытной группе бóльшая доля рыб проявляла данный тип реореакции. На 7-е сут группы не различаются. К 10-м сут рыбы исследованных групп максимально различаются по соотношению типов реореакции. Различия по движению молоди контрольных групп относительно течения выявлены лишь на 10-е сут.
Таблица 1.
Уровни значимости различий соотношения типов реореакции по критерию Стьюдента для долей
| Сутки | К-1–К-2 | Опыт–К-1 | Опыт–К-2 |
|---|---|---|---|
| 4-е | – | – | p = 0.0471 (КТР) |
| 10-е | p = 0.0258 (КТР) | p = 0.0105 (ПТР) | p = 0.0005 (ПТР) |
| p = 0.0213 (ОТР) | p = 0.0093 (КТР) |
На 4-е сут после инъекции в трех группах рыб Ik > 0 (рис. 2), а в К-1 Ik на 0.1 выше, чем в группах, в которых особи были подвергнуты инъекции. Во всех группах на 7-е сут после инъекции отмечены минимальные значения Ik. На 10-е сут в контрольных группах значения индекса возвращаются в положительную зону, в то время как в подопытной группе они остаются отрицательными.
Рис. 2.
Изменение индекса контранатантности Ik у молоди радужной форели. 1 – рыбы, не подвергавшиеся инъецированию (К-1); 2 – особи, инъецированные физиологическим раствором (К-2); 3 – рыбы, инъецированные сурфагоном (опыт).
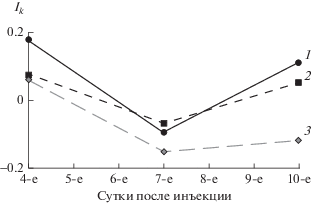
Экспериментальные результаты свидетельствуют о том, что начальное изменение реореакции у молоди радужной форели, подвергшейся инъецированию, обусловлено манипуляционным стрессом. И лишь по прошествии определенного времени детектируются изменения соотношений типов реореакции, свидетельствующие о гормональном влиянии препарата.
Определим манипуляционный стресс в контрольных группах рыб. Молодь в К-2 подвергалась большему манипуляционному стрессу, чем в К-1, так как была подвергнута инъекции физиологического раствора. Об этом, в частности, свидетельствуют близкие значения Ik в опыте и К-2. Однако за все время проведения эксперимента в наименьшей степени различались по соотношениям типов реореакции именно две контрольные группы – достоверные различия обнаружены только по числу рыб, проявляющих КТР на 10-е сут после инъекции. Это заметно по динамике Ik. В то же время повышенная доля рыб из группы К-2, скатывающихся на 4-е сут, и близкие значения Ik в К‑1 и К-2 в этот период указывают на сохранение стресса, обусловленного инъекцией физиологического раствора. Полученные результаты свидетельствуют о том, что на 4-е сут все изменения в поведении особей обусловлены стрессом, непосредственно вызванным проводимыми манипуляциями. На 7-е сут после инъекции не отмечены различия между исследованными группами по реореакции, рыбы из всех групп преимущественно движутся по течению (Ik < 0). Такое поведение в потоке воды характерно для молоди радужной форели в период продолжительного голодания (Павлов Е.Д. и др., 2016). В нашем эксперименте голодание особей было кратковременным, поэтому снижение Ik обусловлено, по-видимому, неизвестными нам фоновыми факторами, связанными с изменением поступающей из реки воды. Сходное поведение рыб из разных групп в потоке указывает на то, что манипуляционный стресс к 7-м сут ослабевает и не оказывает выраженного влияния на реореакцию молоди.
Первые признаки изменения реореакции рыб вследствие гормонального импринтинга регистрируются на 10-е сут после инъекции препарата. В этот период подопытные особи значительно отличаются от контрольных как по динамическим типам (ПТР, ОТР), так и по компенсаторному. Это происходит на фоне в целом аналогичного поведения (реореакции) контрольных групп рыб между собой. В то время как значения Ik у контрольных особей снова становятся положительными, у подопытной молоди значение Ik остается в отрицательной зоне. В целом суммарные показатели реореакции (в том числе Ik) у рыб опытной группы фактически не изменились с 7-х сут после инъекции. Следовательно, на 10-е сут после инъекции сурфагона происходят гормональные изменения, модифицирующие реореакцию.
Отметим, что у рыб, инъецированных сурфагоном, на 10-е сут преобладает отрицательный тип реореакции. При этом ранее нами установлено (Павлов Д.С. и др., 2016), что на 30–40-е сут после инъекции препарата молодь форели проявляет преимущественно положительный тип реореакции. Очевидно, что гормональный импринтинг тесно связан со сроками, прошедшими после инъекции препарата. Начальные изменения гормональной регуляции в организме приводят к движению подопытных рыб преимущественно по течению, что, вероятно, связано с гормональным “всплеском”, обусловленным инъекцией сурфагона. И только в процессе развития механизма гормонального импринтинга закладываются функционально противоположные (обратные) триггеры поведения молоди в потоке воды – молодь движется преимущественно против течения. На основании вышеизложенного можно заключить, что зарегистрирован начальный эффект, вызванный инъекцией сурфагона, но направленность реакции организма со временем меняется. Стоит обратить внимание на то, что сурфагон полностью выводится из организма в течение 5 ч, но этого периода воздействия (при двукратной инъекции) достаточно для формирования гормонального “ответа”, проявляющегося как в начальный период (на 10-е сут после инъекции), так и по прошествии продолжительного времени (30–40 сут после инъекции).
На основе полученных результатов можно выделить три периода изменения соотношения типов реореакции у рыб в первое время инъекции сурфагона: период проявления манипуляционного стресса (0–4-е сут после инъекции), период отсутствия последствий манипуляционного стресса (4–7-е сут после инъекции), период влияния сурфагона на поведение рыб (7–10-е сут после инъекции).
Авторы благодарны директору рыборазводного хозяйства “Янисъярви” Д.А. Ручьеву за предоставленную возможность проведения работы.
Работа выполнена при финансовой поддержке РНФ (№ 14-14-01171-П).
Список литературы
Павлов Д.С. Оптомоторная реакция и особенности ориентации рыб в потоке воды. М.: Наука, 1970. 148 с.
Павлов Д.С. Биологические основы управления поведением рыб в потоке воды. М.: Наука, 1979. 319 с.
Павлов Д.С., Костин В.В., Пономарева В.Ю. Поведенческая дифференциация сеголеток черноморской кумжи Salmo trutta labrax: реореакция в год, предшествующий смолтификации Варзуга // Вопр. ихтиологии. 2010. Т. 50. № 2. С. 251–261.
Павлов Д.С., Павлов Е.Д., Костин В.В., Ганжа Е.В. Реореакция молоди радужной форели при воздействии сурфагона // Онтогенез. 2016. Т. 47. № 2. С. 110–116.
Павлов Е.Д., Ганжа Е.В., Во Тхи Ха, Нгуен Ан Тиен, Павлов Д.С. Состояние половых желез у сеголеток радужной форели при инъекции сурфагона // Онтогенез. 2018. Т. 49. № 2. С. 58–66.
Павлов Е.Д., Ганжа Е.В., Пономарева В.Ю., Костин В.В., Павлов Д.С., Во Тхи Ха. Влияние метилтестостерона на физиологическое состояние и реореакцию радужной форели Parasalmo mykiss (=Oncorhynchus mykiss) при неблагоприятных условиях содержания // Вопр. ихтиологии. 2016. Т. 56. № 6. С. 740–752.
Чебанов М.С., Галич Е.В., Чмырь Ю.Н. Руководство по разведению и выращиванию осетровых рыб. М.: Росинформагротех, 2004. 148 с.
Pavlov D.S., Kostin V.V., Zvezdin A.O., Ponomareva V.Yu. On methods of determination of the rheoreaction type in fish // J. Ichthyol. 2010. V. 50. № 11. P. 977–984.
Plate E.M., Wood C.C., Hawryshyn C.W. GnRH affects activity and jumping frequency in adult sockeye salmon, Oncorhynchus nerka // Fish Physiol. Biochem. 2003. V. 28. P. 245–248.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


