Известия РАН. Серия биологическая, 2019, № 1, стр. 62-71
Роль гетерохроний в эволюции пигментного рисунка американских цихлид (Teleostei: Cichlidae: Cichlasomatinae): экспериментальный подход
Д. В. Праздников a, *, Ф. Н. Шкиль a, b
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН,
Россия, 119071 Москва, Ленинский проспект, 33
b Институт биологии развития им. Н.К. Кольцова РАН,
Россия, 119334 Москва, ул. Вавилова, 26
* E-mail: pdvfish3409@rambler.ru
Поступила в редакцию 14.05.2018
После доработки 31.07.2018
Принята к публикации 31.07.2018
Аннотация
Отмечено, что цихлиды (Teleostei; Cichlidae) отличаются большим разнообразием пигментного рисунка – морфологической характеристики, играющей важнейшую роль в жизнедеятельности и эволюции рыб. Предполагается, что один из ключевых механизмов эволюционных преобразований окраски цихлид – гетерохронии. Представлены экспериментальные свидетельства участия гетерохроний в эволюции рисунка американских цихлид, полученные на модельном объекте акаре бирюзовой, Andinoacara rivulatus (Cichlidae: Cichlasomatinae). Гетерохронии индуцировались за счет искусственного изменения уровня тиреоидных гормонов, важнейших регуляторов сроков и темпов онтогенеза низших позвоночных. Показано, что взрослая окраска акары в значительной степени определяется временны́ми характеристиками онтогенеза, изменения сроков и темпов которого приводят к формированию признаков, свойственных другим видам Cichlasomatinae. С помощью полученных данных подтверждается гипотетическая роль гетерохроний в эволюции пигментного рисунка американских цихлид.
Цихлиды (Teleostei; Cichlidae) – одна из наиболее разнообразных групп пресноводных рыб и позвоночных животных в целом. В настоящее время насчитывается >1700 видов цихлид, населяющих Азию, Африку, Южную и Центральную Америку (Koblmüller et al., 2017). Вследствие огромного экологического и морфологического разнообразия, а также множественных случаев симпатрического видообразования (Barluenga et al., 2006; Piálek et al., 2012; Martin et al., 2015) цихловые рыбы стали популярным объектом современной эволюционной биологии. К настоящему моменту детально исследованы филогенетические взаимоотношения большинства групп цихлид (Hulsey et al., 2010; López-Fernández et al., 2010; Meyer et al., 2015; Musilová et al., 2015; Schwarzer et al., 2015), а также некоторые генетические и онтогенетические механизмы, лежащие в основе их эволюционных преобразований (Salzburger, 2009; Brawand et al., 2014; Elmer et al., 2014; Powder et al., 2015; Le Pabic et al., 2016). В частности, показана значимая эволюционная роль гетерохроний – относительных изменений сроков и темпов онтогенетических событий. Экспериментально установлено, что гетерохронии лежат в основе морфологической диверсификации ротового аппарата ряда симпатрических форм американских и африканских цихлид (Meyer, 1987; Parsons et al., 2014), обеспечивают разнообразие морфологии окологлазничных костей (Bird, Webb, 2014) и морфологии головы в целом у африканских цихлид оз. Малави (Powder et al., 2015), а также определяют различия в их цветовом зрении (O’Quin et al., 2011).
Кроме того, предполагается, что гетерохронии – один из ведущих механизмов эволюции окраски американских цихлид (Říčan et al., 2016). Данная гипотеза появилась в ходе сравнительного анализа онтогенеза пигментного рисунка цихлид, относящихся к группе Cichlasomatinae. В ее основу легло наличие у Cichlasomatinae нескольких типов онтогенеза рисунка, отличающихся один от другого темпами и сроками онтогенетических событий, а также степенью выраженности меланофорной продольной полосы в личиночной окраске. Различают четыре типа онтогенеза окраски Cichlasomatinae: L-тип наиболее продолжительный, с ярко выраженной полосой; типы Li и I характеризуются средней скоростью развития рисунка и полосой, представленной в виде прерывистой линии; B‑тип – наиболее быстрый тип развития окраски, в ходе которого полоса не формируется. Ришан с соавт. предположили, что не только личиночная, но и взрослая окраска Cichlasomatinae зависит от сроков и темпов онтогенеза (Říčan et al., 2005, 2016). Однако экспериментальных доказательств данной гипотезы получено не было.
Цель работы – получить экспериментальные свидетельства зависимости взрослого пигментного рисунка цихлид от сроков и темпов его развития. Для этого были индуцированы экспериментальные гетерохронии в развитии окраски акары бирюзовой, Andinoacara rivulatus (Günther, 1860), а также были проведены сравнительно-морфологический анализ последствий экспериментальных гетерохроний и сопоставление взрослых фенотипов экспериментальных рыб с фенотипами других видов цихлид, входящих в состав Cichlasomatinae.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве экспериментальной модели была использована акара бирюзовая Andinoacara rivulatus (Günther, 1860) (Perciformes; Cichlidae; Cichlasomatinae). Данный вид цихлид – один из излюбленных объектов аквариумистики, что обусловлено его яркой окраской, неприхотливостью в содержании и простотой разведения.
Экспериментальные гетерохронии в развитии пигментного рисунка акар индуцировались за счет искусственного изменения уровня гормонов щитовидной железы, тиреоидных гормонов (ТГ). ТГ – важнейшиe регуляторы сроков и темпов различных онтогенетических процессов костистых рыб (Brown, 1997; Power et al., 2001; Blanton, Specker, 2007; Shkil et al., 2012; McMenamin, Parichy, 2013; McMenamin et al., 2017; Bolotovskiy et al., 2018) участвуют в регуляции развития пигментного рисунка (Yoo et al., 2000; Jegstrup, Rosenkilde, 2003; McMenamin et al., 2014; Guillot et al., 2016; Prazdnikov, Shkil, 2016). Основным механизмом действия ТГ считается определение сроков и активности экспрессии генов-мишеней, осуществляемой посредством взаимодействия ТГ со специфическими ТГ-рецепторами (транскрипционными факторами, входящими в группу ядерных рецепторов) (Basset et al., 2003; Cheng et al., 2010). ТГ характеризуются ярко выраженным плейотропным эффектом (Viguerie, Langin, 2003; Rastorguev et al., 2016). В большинстве случаев гипертиреоидизм – повышенный уровень ТГ – вызывает преждевременное начало и ускорение онтогенетических процессов. В то же время гипотиреодизм, дефицит ТГ, приводит к их более позднему началу и снижению темпов онтогенеза (Hulbert, 2000; Aranda, Pascual, 2001; Sabet, Yen, 2009; Brent, 2012). Благодаря этому манипуляции с уровнем ТГ – один из наиболее часто применяемых методов, позволяющих индуцировать экспериментальные гетерохронии у костистых рыб (Brown, 1997; de Jesus et al., 1998; Levin, 2010; Shkil et al., 2012; McMenamin et al., 2014; Rastorguev et al., 2016; McMenamin et al., 2017; Bolotovskiy, Levin, 2018; Bolotovskiy et al., 2018).
В эксперименте была использована кладка оплодотворенной икры, полученная в результате естественного нереста пары акар. Кладка была разделена на три группы, различающиеся по гормональному статусу: естественный уровень, гипер- и гипотиреоидизм. Изменения гормонального статуса были достигнуты традиционными методами (Brown, 1997; Levin, 2010; Shkil et al., 2012; Bolotovskiy et al., 2018). Так, гипертиреоидизм был индуцирован в результате добавления в воду активной формы ТГ – 3,5,3'-трийод-L-тиронина (T3) (Sigma, США) – до концентрации 0.1 мкг/мл. Гипотиреоидизм достигался подавлением активности синтеза эндогенных ТГ за счет растворения в аквариумной воде гойтрогена – тиомочевины (CS (NH2)2) (Компонент-Реагент, Россия), конечная концентрация 0.02%. Концентрации T3 и тиомочевины были подобраны таким образом, чтобы спровоцировать гетерохронии в развитии, но не вызывать значимого повышения смертности в опытных группах. Другие условия эксперимента (температура, плотность посадки рыб (40–45 особей на 50-литровый аквариум), кормление, аэрация, световой режим, фон дна и боковых стенок, наличие растений и укрытий) были одинаковыми для всех групп. Каждые два дня в каждом из аквариумов проводилась замена одной трети воды с добавлением активных веществ (T3 и тиомочевины) в нужных концентрациях в подменяемую воду.
Онтогенез пигментного рисунка был описан, начиная с эмбриональной стадии развития до формирования рисунка взрослого типа. Для этого ежедневно фотографировали по 2–3 особи из каждой группы, которые отбирались случайным образом. Фотографии и измерения стандартной длины (SL, мм) личинок и ранних мальков были сделаны с помощью стереомикроскопа Leica MS5 (Германия), оборудованного окулярным микрометром и цифровой камерой Samsung PL210 (КНР). Взрослые рыбы были сфотографированы фотокамерой Canon EOS100D (Япония) в аквариуме, оборудованном линейкой (деление 1 мм). SL взрослых рыб определяли по фотографиям. После фотографирования рыбы возвращались в экспериментальные аквариумы. При описании онтогенеза пигментного рисунка мы обращали внимание на развитие разных линий пигментных клеток (хроматофоров). Тип хроматофоров определялся по цвету пигмента: серебристо-белый – иридофоры, желто-оранжевый – ксантофоры, красный – эритрофоры, черно-коричневый – меланофоры.
Поскольку изменения уровня ТГ в раннем онтогенезе часто приводят к серьезным аномалиям в формировании позвоночного столба рыб (Shkil et al., 2012; Bolotovskiy et al., 2018) и, как следствие, к изменениям темпов их линейного роста, для сопоставления сроков и темпов онтогенеза в разных экспериментальных группах мы использовали два критерия. В качестве основного критерия использовались стадии развития A. rivulatus: эмбрион – от оплодотворения до вылупления; ранняя личинка – от вылупления до полной резорбции желточного мешка; поздняя личинка – от перехода на внешнее питание до формирования брюшных плавников; малек – до появления полового диморфизма; взрослая рыба. В качестве дополнительной време́нной характеристики онтогенеза мы использовали сутки после оплодотворения (сут п. о.).
Для сопоставления фенотипов экспериментальных рыб с фенотипами видов, входящих в состав Cichlasomatinae, были использованы описания Ришана с соавт. (Říčan et al., 2005, 2016), Мусиловой с соавт. (Musilová et al., 2009), Уиджкмарк с соавт. (Wijkmark et al., 2012) и фотографии с www.fishbase.org.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В контрольной группе, характеризующейся естественным уровнем ТГ, первые пигментные клетки – меланофоры – появляются у эмбриона во время органогенеза, в конце периода сегментации на 2-е сут п. о. Меланофоры располагаются вдоль нотохорда и образуют скопления на желточном мешке (рис. 1а).
Рис. 1.
Развитие эмбрионального (а) и раннего личиночного (б, в) пигментного рисунка в контрольной группе Andinoacara rivulatus. Масштаб: 0.5 мм.
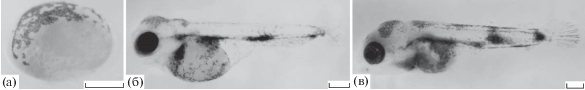
Ранний личиночный рисунок (3–16-е сут п. о.; SL = 4.8–5.7 мм) A. rivulatus состоит из меланофорных пятен округлой формы, расположенных у основания хвостового плавника и в средней боковой части тела над будущим анальным плавником. Также скопления меланофоров присутствуют на голове и в виде прерывистых горизонтальных полос в дорсально-вентральной части корпуса (рис. 1б, в). На этой же стадии развития появляются первые ксантофоры, расположенные преимущественно на дорсальной части тела. Одновременно на вентральной части тела и в районе жаберных крышек появляются первые иридофоры.
На стадии поздней личинки (17–39-е сут п. о.; SL = 5.7–10.7 мм) скопления меланофоров на дорсальной и вентральной частях корпуса начинают расширяться по направлению к боковой линии, образуя зачатки будущих вертикальных полос (рис. 2а). Происходит увеличение популяции иридофоров, скопления которых появляются в основании хвостового и спинного плавников. Кроме того, на туловище четко видны отдельные хаотично разбросанные иридофоры. К концу стадии поздней личинки (34–39-е сут п. о.; SL = = 10.1–10.7 мм) становятся заметны скопления меланофоров в районе подглазничной полосы (рис. 2б). На лучах непарных плавников начинается формирование пигментного комплекса, состоящего из меланофоров и ксантофоров.
Рис. 2.
Развитие пигментного рисунка у экспериментальных Andinoacara rivulatus: а, б – стадия поздней личинки в контрольной группе; в, г – мальковая стадия в контрольной группе; д, е – стадия поздней личинки в гипертиреоидной группе; ж, з – мальковая стадия в гипертиреоидной группе; и, к – стадия поздней личинки в гипотиреоидной группе; л, м – мальковая стадия в гипотиреоидной группе. Цифры – номера вертикальных полос. Масштаб: 2 мм.

В начале мальковой стадии (40–60-е сут п. о.; SL = 10.7–18.5 мм) на теле акар развиваются вертикальные меланофорные полосы: 1-я и 2-я на хвостовом стебле; 3-я и 4-я над анальным плавником, которые, как правило, затем сливаются в одну полосу, иногда образуют Y-образный рисунок в дорсальной части; 5-я и 6-я между анальным и брюшными плавниками; 7-я – от передних лучей спинного плавника; 8-я полоса перед спинным плавником (рис. 2в). На голове формируются два скопления меланофоров: нечеткое пятно над глазом и подглазничной полосой. К 90–100-м сут п. о. (SL = 20.5–24.8 мм) на голове и туловище начинают появляться иридофорные полосы. Одновременно происходит утолщение 5-й меланофорной полосы (рис. 2г), а на краях спинного и хвостового плавников образуется красно-оранжевая окантовка, состоящая из ксантофоров и эритрофоров.
В контрольной группе взрослый пигментный рисунок полностью формируется к 210-м сут п. о. (рис. 3а, б). У взрослых рыб хорошо выражен половой диморфизм. У самцов (SL ≥ 54 мм) на рыле и жаберных крышках рисунок состоит из перламутрово-бирюзовых линий и пятен, образованных иридофорами. Тело покрыто пятнистым рисунком. Каждая из чешуй имеет темный центр, занимаемый меланофорами, и светлые края, образованные иридофорами и ксантофорами. Вертикальные полосы на теле, пятно в основании хвостового плавника и подглазничная полоса просматриваются, но менее выражены, чем у самок. В районе 5-й полосы в центре корпуса образуется яркое меланофорное пятно неправильной формы (рис. 3а). На лучах плавников расположены короткие полосы, состоящие из иридофоров, ксантофоров и эритрофоров. Края спинного и хвостового плавников имеют широкую оранжевую окантовку. Между собой самцы по признакам окраски различаются слабо.
Рис. 3.
Половой дихроматизм у взрослых Andinoacara rivulatus. а – самец; б – самка из контрольной группы; в, д, ж, и – самцы; г, е, з, к – самки из гипертиреоидной группы. Масштаб: 10 мм.

У самок контрольной группы (SL ≥ 52 мм) взрослый пигментный рисунок состоит из четко выраженных вертикальных полос на корпусе с меланофорным пятном на 5-й полосе (рис. 3б). Иридофорные пятна на корпусе и короткие полосы на лучах плавников менее выражены по сравнению с рисунком самцов, что связано с преобладанием в интегументе меланофоров. На краях спинного и хвостового плавников расположена узкая оранжевая окантовка. Значимых различий в окраске между самками не обнаружено.
Согласно классификации типов онтогенеза пигментного рисунка Cichlasomatinae (Říčan et al., 2005, 2016) нормальное развитие пигментного рисунка A. rivulatus можно отнести к типам Li или I, характеризующимся средней скоростью развития и наличием на туловище ранних личинок прерывистой меланофорной продольной полосы. Наиболее яркие изменения в онтогенезе пигментного рисунка A. rivulatus обнаружены при переходе от личиночной к мальковой окраске.
В гипертиреоидной группе развитие эмбрионального и раннего личиночного пигментного рисунка протекает аналогично контрольной группе. Первые межгрупповые различия отмечены на стадии поздней личинки. У рыб гипертиреоидной группы скопления меланофоров на дорсальной и вентральной части корпуса не формируют вертикальных полос к 30–37-м сут п. о. (SL = 7.1–10.6 мм). Меланофоры расположены на корпусе хаотично (рис. 2е). Плотность скоплений иридофоров в районе жаберных крышек выше, чем в контрольной группе. Хроматофорный комплекс на лучах непарных плавников, состоящий из меланофоров и эритрофоров на спинном плавнике, а также меланофоров и ксантофоров на хвостовом и анальном плавниках, начинает формироваться к 34-м сут п. о. (SL = 8.3 мм). Одновременно с этим появляются скопления меланофоров в районе подглазничной полосы.
В начале мальковой стадии развития (38–60-е сут п. о.; SL = 10.8–12.9 мм) начинает развиваться меланофорное пятно в центре корпуса. На краях спинного и хвостового плавников образуются скопления ксантофоров и эритрофоров. С 70-х сут п. о. (SL = 14.1 мм) у многих особей гипертиреоидной группы A. rivulatus (54.5%) формируются слабо выраженные участки из шести вертикальных полос, с меланофорным пятном на 4-й полосе (рис. 2ж). Впоследствии было установлено, что меланофорные вертикальные полосы формируются только у самок. Затем у всех рыб гипертиреоидной группы появляются иридофорные линии (80-е сут п. о.; SL = 17.5 мм), идущие от середины корпуса до конца хвостового стебля. К середине мальковой стадии у большинства гипертиреоидных рыб (90-е сут п. о.; SL = 19.8 мм) из пигментного рисунка исчезает подглазничная полоса, происходит увеличение клеточных популяций иридофоров, ксантофоров и эритрофоров на теле и плавниках (рис. 2з). В это же время у некоторых особей на концах лучей спинного и хвостового плавников наблюдается увеличение популяции иридофоров, что приводит к появлению белой окантовки.
Взрослый пигментный рисунок в гипертиреоидной группе формируется к 180-м сут п. о. (SL ≥ 64 мм). Половой диморфизм выражен хорошо, но в отличие от контрольной группы у самцов и самок присутствует полиморфизм окраски (рис. 3в–к). Окраска головы самцов состоит из красных пятен на затылке, образованных скоплениями эритрофоров, а также из полос и пятен на рыле и жаберных крышках, образованных иридофорами (рис. 3в, д, ж, и). В центре корпуса у одних самцов (27.2%) присутствует меланофорное пятно (рис. 3и) или скопление меланофоров в виде вертикальной полосы, отделенной линией иридофоров (рис. 3ж). У других рыб (18.2%) эти элементы рисунка отсутствуют (рис. 3в, д). По бокам тела образуется сетчатый рисунок. Чешуи имеют светлый центр, окраска которого определяется иридофорами, ксантофорами и эритрофорами, и темные края за счет концентрации на них меланофоров (рис. 3в, д, ж, и). На лучах непарных плавников формируется рисунок из коротких полос и пятен, образованных сочетанием иридофоров, ксантофоров и эритрофоров. Края спинного и хвостового плавников имеют красно-оранжевую окантовку различной ширины (рис. 3в, д, ж, и).
Взрослый пигментный рисунок гипертиреоидных самок состоит из иридофорных линий и пятен на рыле и жаберных крышках, из меланофорной подглазничной полосы или пятна с разной степенью выраженности (рис. 3г, е, з, к). В центре корпуса у некоторых самок (36.4%) присутствует меланофорное пятно или полоса (рис. 3г, з, к). Тело, как и у самцов, покрыто сетчатым рисунком. В основании хвостового плавника расположено вытянутое меланофорное пятно. По краям спинного и хвостового плавников проходит красно-оранжевая окантовка, ширина которой варьирует (рис. 3г, е, к). У нескольких гипертиреоидных самок (18.2%) окантовка края спинного и хвостового плавников образована комбинацией иридофоров и ксантофоров, что делает ее значительно светлее по сравнению с таковой у других рыб (рис. 3з).
В целом онтогенез пигментного рисунка в гипертиреоидной группе можно считать ускоренным относительно контрольной группы. Многие поздние личиночные и мальковые элементы окраски у гипертиреоидных рыб выражены слабо или не формируются вообще. При этом взрослые элементы рисунка появляются преждевременно. Согласно классификации типов онтогенеза пигментного рисунка Cichlasomatinae (Říčan et al., 2005, 2016) развитие окраски у гипертиреоидных групп можно отнести к ускоренному B-типу.
В гипотиреоидной группе A. rivulatus развитие пигментного рисунка не отличалось от такового в контрольной группе до конца стадии поздней личинки (рис. 2и). К 50–60-м сут п. о. (SL = 10.3–12.8 мм) у гипотиреоидных рыб развиваются вертикальные полосы на теле и подглазничная полоса на голове (рис. 2к). Скопления ксантофоров и эритрофоров на спинном плавнике начинают формировать красно-оранжевую окантовку к 90-м сут п. о. (SL = 18.5 мм) (рис. 2л). При этом на хвостовом плавнике ксантофорно-эритрофорная окантовка не развивается. Одновременно с формированием окантовки на спинном плавнике, происходит увеличение плотности популяции меланофоров в фоновой окраске тела. К 120-м сут п. о. (SL = 23.5 мм) из-за высокой численности меланофоров пропадают четкие границы элементов пигментного рисунка (рис. 2м). Вследствие этого окраска головы и корпуса становится черно-коричневой, единичные клетки ксантофоров и эритрофоров присутствуют только на лучах непарных плавников. В результате у гипотиреоидных рыб не развивается взрослый тип пигментного рисунка и половой диморфизм, свойственный рыбам контрольной и гипертиреоидной групп.
Таким образом, онтогенез пигментного рисунка у гипотиреоидных рыб заметно отличается от развития пигментного рисунка в контрольной группе. В частности, появление мальковых элементов окраски происходит значительно позднее, а некоторые линии пигментных клеток, свойственные мальковой и взрослой окраске контрольной группы, отсутствуют. Гипертрофированная по сравнению с контрольной группой меланофорная продольная полоса у поздних личинок гипотиреоидной группы и общее замедление развития позволяют отнести онтогенез их пигментного рисунка к L-типу.
Полученные результаты свидетельствуют о том, что флуктуации уровня ТГ приводят к изменениям последовательности и сроков онтогенетических событий в пигментном рисунке бирюзовых акар (рис. 4), т.е. вызывают экспериментальные гетерохронии. Эмбриональное и раннее личиночное развитие во всех экспериментальных группах происходит одинаково. Выраженные различия появляются на стадии поздней личинки.
Рис. 4.
Последовательность появления элементов в пигментном рисунке у экспериментальных Andinoacara rivulatus: контрольная, гипертиреоидная и гипотиреоидная группы. Мел. полосы – вертикальные меланофорные полосы; подгл. полоса – меланофорная подглазничная полоса; кс.-эр. окант. – ксантофорно-эритрофорная окантовка спинного и хвостового плавников; иридоф. линии – иридофорные линии; * – вертикальные меланофорные полосы частично развиваются в гипертиреоидизме только у самок; сут п. о. – сутки после оплодотворения.
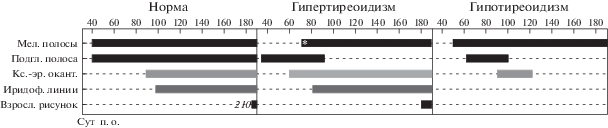
Так, у гипертиреоидных акар в онтогенезе отсутствует свойственный рыбам контрольной группы этап развития пигментного рисунка с выраженными меланофорными полосами. Вместо этого у мальков гипертиреоидной группы происходит преждевременное формирование взрослых элементов окраски. Данные экспериментальные гетерохронии приводят к выраженным морфологическим последствиям и росту фенотипической изменчивости цихлид (рис. 3).
У гипотиреоидных A. rivulatus происходит замедление темпов развития пигментного рисунка. Мальковые элементы рисунка появляются значительно позже, чем в контрольной группе (рис. 4). При этом не происходит формирования характерных для взрослых акар красно-оранжевой окантовки на непарных плавниках и иридофорных линий на корпусе (рис. 2м).
Наблюдаемые в гипер- и гипотиреоидной группах изменения хода онтогенеза пигментного рисунка указывают на высокую степень зависимости процесса перехода от личиночного к мальковому типу окраски от уровня ТГ. Согласно определению метаморфоза рыб (McMenamin, Parichy, 2013) такая зависимость позволяет рассматривать переход от личиночного к мальковому типу окраски у бирюзовой акары в качестве метаморфных преобразований, и как следствие, считать, что экспериментальные изменения гормонального статуса привели к гетерохронным сдвигам метаморфных преобразований пигментного рисунка A. rivulatus: раннему метаморфозу в гипертиреоидной группе и позднему неполному метаморфозу в гипотиреоидной.
Сравнительно-морфологический анализ взрослого пигментного рисунка экспериментальных рыб и видов, относящихся к группе Cichlasomatinae, показал, что у особей из гипертиреоидной группы встречаются признаки, свойственные другим видам рода Andinoacara: A. biseriatus, A. blombergi, A. sapayensis, A. stalsbergi (рис. 5). Эти виды различаются между собой по композиции рисунка чешуй (светлый центр и темный край, либо темный центр и светлые края), представленности пигментных линий на корпусе, а также по цвету окантовки спинного и хвостового плавников (Musilová et al., 2009; Wijkmark et al., 2012). Гипотиреоидные A. rivulatus формируют признаки окраски цихлид, относящихся к роду Amphilophus, для которых характерен L-тип онтогенеза (Říčan et al., 2016), в частности признаки A. astorquii и A. zaliosus, видов с гипертрофированно развитыми меланистическими элементами во взрослом пигментном рисунке (рис. 5) (Dittmann et al., 2012; McCrary, 2015).
Рис. 5.
Пигментный рисунок цихлид из рода Andinoacara (а – A. biseriatus, б – A. blombergi, в – A. sapayensis, г – A. stalsbergi) и рода Amphilophus (д – A. zaliosus, е – A. astorquii).

Проведенный эксперимент продемонстрировал зависимость рисунка взрослых цихлид от сроков и темпов их развития. Полученные данные подтверждают состоятельность онтогенетической гипотезы, выдвинутой Ришаном с соавт. (Říčan et al., 2005, 2016), и указывают на существенный вклад гетерохроний в эволюцию окраски цихлид. Кроме того, показана зависимость развития пигментного рисунка A. rivulatus от ТГ. Ранее схожие результаты были получены для Amatitlania nigrofasciata – одной из цихлид, входящих в состав группы Cichlasomatinae (Prazdnikov, Shkil, 2018), и других костистых рыб (Yoo et al., 2000; Jegstrup et al., 2003; McMenamin et al., 2014; Guillot et al., 2016; Prazdnikov, Shkil, 2016). Схожесть реакций на изменения уровня ТГ указывает на общность механизмов регуляции развития пигментного рисунка у различных таксонов костистых рыб и дает возможность предположить, что изменения активности тиреоидной оси играют важную роль в эволюции окраски Teleostei.
ЗАКЛЮЧЕНИЕ
Развитие пигментного рисунка бирюзовой акары представляет собой сложный процесс с отчетливыми онтогенетическими этапами. Сроки и темпы многих процессов в онтогенезе пигментного рисунка акар регулируются уровнем ТГ. Изменения гормонального статуса вызывают гетерохронии в развитии пигментного рисунка, которые, в свою очередь, приводят к серьезным морфологическим последствиям и росту фенотипической изменчивости. Обнаруженное сходство фенотипов экспериментальных рыб с фенотипами других видов цихлид свидетельствует в пользу участия гетерохроний в эволюции пигментных рисунков Cichlasomatinae. Полученные результаты указывают на потенциальную роль тиреоидного сигнального пути в формировании разнообразия окрасок цихловых рыб в целом и открывают новые перспективы для изучения роли эндокринной системы в эволюции костистых рыб.
Исследование выполнено в рамках Государственного задания ИПЭЭ РАН № 0109-2018-0073 и ИБР РАН № 0108-2018-0007, а также при частичной финансовой поддержке РФФИ (грант 18-34-00685).
Список литературы
Aranda A., Pascual A. Nuclear hormone receptors and gene expression // Physiol. Rev. 2001. V. 81. P. 1269–1304.
Barluenga M., Stölting K.N., Salzburger W., Muschick M., Meyer A. Sympatric speciationin Nicaraguan crater lake cichlid fish // Nature. 2006. V. 439. P. 719–723.
Bassett J.D., Harvey C.B., Williams G.R. Mechanisms of thyroid hormone receptor-specific nuclear and extra nuclear actions // Mol. Cell. Endocrinol. 2003. V. 213. P. 1–11.
Bird N.C., Webb J.F. Heterochrony, modularity, and the functional evolution of the mechanosensory lateral line canal system of fishes // EvoDevo. 2014. V. 5. P. 21.
Blanton M.L., Specker J.L. The hypothalamic-pituitary-thyroid (HPT) axis in fish and its role in fish development and reproduction // Critical Rev. Toxicol. 2007. V. 37. P. 97–115.
Bolotovskiy A.A., Levin B.A. Effects of thyroid hormones on vertebral numbers in two cyprinid fish species: Rutilus rutilus (Linnaeus, 1758) and Abramis brama (Linnaeus, 1758) // J. Appl. Ichthyol. 2018. P. 1–6.
Bolotovskiy A.A., Levina M.A., DeFaveri J., Merilä, J., Levin, B.A. Heterochronic development of lateral plates in the three-spined stickleback induced by thyroid hormone level alterations // PloS One. 2018. V. 13. P. e0194040.
Brawand D., Wagner C.E., Li Y.I., Malinsky M., Keller I., Fan S., Simakov O., Alvin Y., Ng A.Y., Lim Z.W., Bezault E., Turner-Maier J., Johnson J., Alcazar R., Noh H.J., Russell P., Aken B., Alföldi J., Amemiya C., Azzouzi N., Baroiller J., Barloy-Hubler F., Berlin A., Bloomquist R., Carleton K., Conte M.A., D’Cotta H., Eshel O., Gaffney L., Galibert F., Gante H.F., Gnerre S., Greuter L., Guyon R., Haddad N.S., Haerty W., Harris R.M., Hofmann H.A., Hourlier T., Hulata G., Jaffe D.B., Lara M., Lee A.P. MacCallum I., Mwaiko S., Nikaido M., Nishihara H., Ozouf-Costaz C., Penman D.J., Przybylski D., Rakotomanga M., Renn S., Ribeiro F.J., Ron M., Salzburger W., Sanchez-Pulido L., Santos M. E., Searle S., Sharpe T., Swofford R., Tan F.J., Williams L., Young S., Yin S., Okada N., Kocher T.D., Miska E.A., Lander E.S., Venkatesh B., Fernald R.D., Meyer A., Ponting C.P. Streelman J.T., Lindblad-Toh K., Seehausen O., Palma F.D. The genomic substrate for adaptive radiation in African cichlid fish // Nature. 2014. V. 513. P. 375–381.
Brent G.A. Mechanisms of thyroid hormone action // J. Clin. Investig. 2012. V. 122. P. 3035–3043.
Brown D.D. The role of thyroid hormone in zebrafish and axolotl development // Proc. Nat. Acad. 1997. V. 9. P. 13011–13016.
Cheng S.Y., Leonard J.L., Davis P.J. Molecular aspects of thyroid hormone actions // Endocrine Rev. 2010. V. 31. P. 139–170.
de Jesus E.G.T., Toledo J.D., Simpas M.S. Thyroid hormones promote early metamorphosis in grouper (Epinephelus coioides) larvae // General Comp. Endocrinol. 1998. V. 112. P. 10–16.
Dittmann M.T., Roesti M., Indermaur A., Colombo M., Gschwind M., Keller I., Kovac R., Barluenga M., Muschick M., Salzburger W. Depth-dependent abundance of Midas Cichlid fish (Amphilophus spp.) in two Nicaraguan crater lakes // Hydrobiologia. 2012. V. 686. P. 277–285.
Elmer K.R., Fan S., Kusche H., Spreitzer M.L., Kautt A.F., Franchini P., Meyer A. Parallel evolution of Nicaraguan crater lake cichlid fishes via non-parallel routes // Nat. Comm. 2014. V. 5 P. 168.
Guillot R., Muriach B., Rocha A., Rotllant J., Kelsh R.N., Cerdá-Reverter J.M. Thyroid hormones regulate zebrafish melanogenesis in a gender-specific manner // PloS One. 2016. V. 11. P. e0166152.
Hulbert A.J. Thyroid hormones and their effects: a new perspective // Biol. Rev. 2000. V. 75. P. 519–631.
Hulsey C. D., Hollingsworth P. R., Fordyce J. A. Temporal diversification of Central American cichlids // BMC Evol. Biol. 2010. V. 10. P. 279.
Jegstrup I.M., Rosenkilde P. Regulation of post-larval development in the European eel: thyroid hormone level, progress of pigmentation and changes in behavior // J. Fish Biol. 2003. V. 63. P. 168–175.
Koblmüller S., Albertson R. C., Genner M. J. et al. Preface: Advances in cichlid research II: behavior, ecology and evolutionary biology // Hydrobiologia. 2017. V. 791. P. 1–6.
Le Pabic P., Cooper W.J., Schilling T.F. Developmental basis of phenotypic integration in two Lake Malawi cichlids // EvoDevo. 2016. V. 7. P. 3.
Levin B.A. Drastic shift in the number of lateral line scales in the common roach Rutilus rutilus as a result of heterochronies: experimental data // J. Appl. Ichthyol. 2010. V. 26. P. 303–306.
López-Fernández H., Winemiller K.O., Honeycutt R.L. Multilocus phylogeny and rapid radiations in Neotropical cichlid fishes (Perciformes: Cichlidae: Cichlinae) // Mol. Phylogenet. Evol. 2010. V. 55. P. 1070–1086.
Martin C.H., Cutler J.S., Friel J.P. Touokong C.D., Coop G., Wainwright P.C. Complex histories of repeated gene flow in Cameroon crater lake cichlids cast doubt on one of the clearest examples of sympatric speciation // Evolution. 2015. V. 69. P. 1406–1422.
McCrary J. The Arrow Cichlid, Amphilophus zaliosus, of Lake Apoyo, Nicaragua // Cichlid News. 2015. V. 24. № 1.
McMenamin S.K., Parichy D.M. Metamorphosis in teleosts // Curr. Top. Dev. Biol. 2013. V. 103. P. 127–165.
McMenamin S.K., Carter C., Cooper W.J. Thyroid hormone stimulates the onset of adult feeding kinematics in zebrafish // Zebrafish. 2017. V. 14. P. 517–525.
McMenamin S.K., Bain E.J., McCann A. E., Patterson L.B., Eom D.S., Waller Z.P., Hamill J.C., Kuhlman J.A., Eisen J.S., Parichy D.M. Thyroid hormone–dependent adult pigment cell lineage and pattern in zebrafish // Science. 2014. V. 345. P. 1358–1361.
Meyer A. Phenotypic plasticity and heterochrony in Cichlasoma managuense (Pisces, Cichlidae) and their implications for speciation in cichlid fishes // Evolution. 1987. V. 41. P. 1357–1369.
Meyer B. S., Matschiner M., Salzburger W. A tribal level phylogeny of Lake Tanganyika cichlid fishes based on a genomic multi-marker approach // Mol. Phylogenet. Evol. 2015. V. 83. P. 56–71.
Musilová Z., Schindler I., Staec W. Description of Andinoacara stalsbergi sp. n. (Teleostei: Cichlidae: Cichlasomatini) from Pacific coastal rivers in Peru, and annotations on the phylogeny of the genus // Vertebr. Zool. 2009. V. 59. P. 131–141.
Musilová Z., Říčan O., Říčanová Š., Janšta P., Gahura O., Novák J. Phylogeny and historical biogeography of trans-Andean cichlid fishes (Teleostei: Cichlidae) // Vertebr. Zool. 2015. V. 65. P. 333–350.
O’Quin K.E., Smith A.R., Sharma A., Carleton K.L. New evidence for the role of heterochrony in the repeated evolution of cichlid opsin expression // Evol. Devel. 2011. V. 13. P. 193–203.
Parsons K.J., Taylor A.T., Powder K.E., Albertson R.C. Wnt signalling underlies the evolution of new phenotypes and craniofacial variability in Lake Malawi cichlids // Nat. Comm. 2014. V. 5. P. 3629.
Piálek L., Říčan O., Casciotta J., Almirón A., Zrzavý J. Multilocus phylogeny of Crenicichla (Teleostei: Cichlidae), with biogeography of the C. lacustris group: species flocks as a model for sympatric speciation in rivers // Mol. Phylogenet. Evol. 2012. V. 62. P. 46–61.
Powder K.E., Milch K., Asselin G., Albertson R.C. Constraint and diversification of developmental trajectories in cichlid facial morphologies // EvoDevo. 2015. V. 6. P. 25.
Power D.M., Llewellyn L., Faustino M., Björnsson B.T., Einarsdottir I.E., MCanario A.V., Sweeney G.E. Thyroid hormones in growth and development of fish // Comp. Biochem. Physiol. Pt C: Toxicol. Pharmacol. 2001. V. 130. P. 447–459.
Prazdnikov D.V., Shkil F.N. Effects of hyperthyroidism on the Labeobarbus (=Barbus) intermedius (Cyprinidae) early larval melanophores development // J. Ichthyol. 2016. V. 56. P. 321–324.
Prazdnikov D.V., Shkil F.N. Experimental evidence of the role of heterochrony in evolution of the Mesoamerican cichlids pigment patterns // Evolution & Development. 2018. P. 1–13. https://doi.org/10.1111/ede.12272.
Rastorguev S.M., Nedoluzhko A.V., Levina M.A. Prokhorchuk E.B., Skryabin K.G., Levin B.A. Pleiotropic effect of thyroid hormones on gene expression in fish as exemplified from the blue bream Ballerus ballerus (Cyprinidae): Results of transcriptomic analysis // Dokl. Biochem. Biophys. 2016. V. 467. P. 124–127.
Říčan O., Musilová Z., Muška M., Novák J. Development of coloration patterns in Neotropical cichlids (Teleostei: Cichlidae: Cichlosomatinae). Brno: Folia Zoologica, 2005. 46 p.
Říčan O., Piálek L., Dragová K., Novák J. Diversity and evolution of the Middle American cichlid nfishes (Teleostei: Cichlidae) with revised classification // Vertebr. Zool. 2016. V. 66. P. 1–102.
Sabet A., Yen P.M. Thyroid hormone action / Eds Wondisford F.E., Radovick S. Clin. Management Thyroid Disease. Elsevier Inc. Philadelphia. 2009. P. 43–56.
Salzburger W. The interaction of sexually and naturally selected traits in the adaptive radiations of cichlid fishes // Mol. ecol. 2009. V. 18. P. 169–185.
Schwarzer J., Lamboj A., Langen K., Misof B., Schliewen U.K. Phylogeny and age of chromidotilapiine cichlids (Teleostei: Cichlidae) // Hydrobiologia. 2015. V. 748. P. 185–199.
Shkil F.N., Kapitanova D.V., Borisov V. B., Abdissa B., Smirnov S. V. Thyroid hormone in skeletal development of cyprinids: effects and morphological consequences // J. Appl. Ichthyol. 2012. V. 28. P. 398–405.
Viguerie N., Langin D. Effect of thyroid hormone on gene expression // Curr. Opinion Clin. Nutrition Metab. Care. 2003. V. 6. P. 377–381.
Wijkmark N., Kullander S.O., Barriga Salazar R.E. Andinoacara blombergi, a new species from the río Esmeraldas basin in Ecuador and a review of A. rivulatus (Teleostei: Cichlidae) // Ichthyol. Explor. Freshwaters. 2012. V. 23. P. 117–137.
Yoo J.H., Takeuchi T., Tagawa M., Seikai T. Effect of thyroid hormones on the stage-specific pigmentation of the Japanese flounder Paralichthys olivaceus // Zool. Sci. 2000. V. 17. P. 1101–1106.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


